-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNádorové mikroprostředí ovlivňuje biologické vlastnosti nádorové buňky – nádor jako embryologický problém?
Cancer microenvironment affects biological properties of tumor cells – tumor as an embryologic problem?
Mutual epithelial-mesenchymal interaction represents a fundamental control mechanism during the development of organs and tissues. This review article demonstrates the importance of such interaction for tumor formation where it influences the biological properties of cancer stem cell and tumor itself. The teratoma and melanoma are employed as examples to demonstrate the influence of embryonic microenvironment on the biological properties of tumor, mainly on its potential to metastasize. The manipulation of cancer microenvironment represents the perspective therapeutic tool for cancer treatment in future.
Key words:
cancer microenvironment, cancer-associated fibroblast, squamous cell carcinoma, neural crest, melanoma.
Autoři: Karel Smetana ml. 1,2; Barbora Dvořánková 1,2; Lukáš Lacina 1,2,3; Eliška Krejčí 1; Miloš Grim 1,2
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, Anatomický ústav 1; Univerzita Karlova v Praze, 2. lékařská fakulta, Centrum buněčné terapie a tkáňových náhrad 2; Univerzita Karlova v Praze, 1. lékařská fakulta, Klinika dermatovenerologie 3
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 572-575
Kategorie: Přehledový článek
Souhrn
Vzájemná epitelo-mezenchymová interakce je základním řídícím principem při vývoji orgánů a tkání. Tento článek ukazuje na význam této interakce při vzniku a šíření nádorů, kdy tato interakce ovlivňuje biologické vlastnosti nádorové kmenové buňky, a tím i nádoru jako takového. Na příkladu teratomu a melanomu je demonstrován vliv embryonálního mikroprostředí na biologickou povahu nádoru, zejména na jeho potenciál metastazovat. Možnost cíleného ovlivnění nádorového mikroprostředí by mohlo být v budoucnu využito jako doplňková terapeutická metoda.
Klíčová slova:
nádorové mikroprostředí, nádorově asociovaný fibroblast, dlaždicový karcinom, neurální lišta, melanom.Nádorová kmenová buňka
Existence nádorové kmenové buňky a její biologický a terapeutický význam
Dnes je všeobecně známo, že nádorová transformace je vyvolána sérií změn genomu buňky. Tyto změny mohou být vrozené, či získané nejrůznějším způsobem od ionizujícího záření po virovou infekci. Důležité je, že tyto změny musejí zahrnovat několik regulačních kaskád. V této souvislosti jsou většinou zmiňovány regulace buněčného cyklu, programované buněčné smrti a schopnosti vyvázat se z mezibuněčných kontaktů a zvýšit migrační potenciál. Není však jasné, zda tyto zněny zasáhnou jednu buňku (monoklonální původ nádoru) či současně více buněk (původ polyklonální) (1).
Pokusy s přenosem nádorů mezi zvířecím dárcem a příjemcem ukázaly, že pouze velmi omezený počet nádorových buněk je schopen zajistit úspěšný růst nádoru v příjemci. Tyto výsledky spolu s ohromným pokrokem při studiu normálních dospělých tkáňových kmenových buněk naznačily existenci nádorových kmenových buněk (2). Je zarážející, že nádorové kmenové (transplantabilní) buňky se zdravým kmenovým buňkám hodně podobají. Podobně jako ony jsou de facto nesmrtelné ve svém mikroprostředí po dobu života jedince. Normální kmenové buňky se dělí asymetrickou mitózou, kdy jedna dceřiná buňka vstupuje do diferenciační kaskády (tzv. transient amplifying cell) a druhá je opět buňkou kmenovou. Toto dělení je velmi pomalé, což je v případě normální kmenové buňky výhodou. Zmenšuje se tak riziko poškození DNA v období silně zranitelné S-fáze buněčného cyklu. „Transient amplifying“ buňka, která má vlastnosti progenitoru, se naopak dělí velmi rychle, což poskytne dostatek buněčného materiálu například při regeneraci poškozené tkáně. Toto dělení je však časově omezené (do 10 cyklů), čímž je redukováno riziko přenosu mutace na další dělící se buňky. V případě nádorové kmenové buňky jsou výše popsané mechanismy terapeutickým problémem, protože pomalé dělení nádorové kmenové buňky snižuje efektivitu zásahu chemoterapeutikem, které je většinou účinné právě v období S-fáze buněčného cyklu. Po léčbě tak sice dojde k významné redukci objemu nádoru, avšak s rizikem perzistence spících nádorových kmenových buněk (minimální residuální choroba), které mohou být v budoucnu reaktivovány, a být tak příčinou nádorového relapsu. Navíc jsou kmenové buňky vybaveny membránovými proteiny, které jsou schopny odstraňovat xenobiotika z jejich cytoplazmy (tzv. „side population“). Za fyziologických podmínek je tento systém vysoce účinný a snižuje riziko poškození dlouhověkých tkáňových kmenových buněk toxickou látkou. V případě nádoru se však intenzivně podílí na vylučování chemoterapeutika z nádorové buňky a může být příčinou selhání léčby pro mnohotnou lékovou rezistenci. Terapeutickou strategií by tedy mělo být útočit na kmenové buňky nádoru, což však stále není bohužel možné (3) (obr. 1).
Obr. 1. V současné době je možný terapeutický zásah zejména vůči „transient amplifying“ buňkám, které se rychle dělí a mají vlastnosti nádorového progenitoru. Tímto způsobem dojde k redukci masy nádoru. Kmenové buňky však přežívají, a mohou být reaktivovány (A). Pokud by se podařilo zasáhnout nádorové kmenové buňky, zmenšení nádoru by nebylo tak velké, ale postupně by došlo k jeho regresi (B). 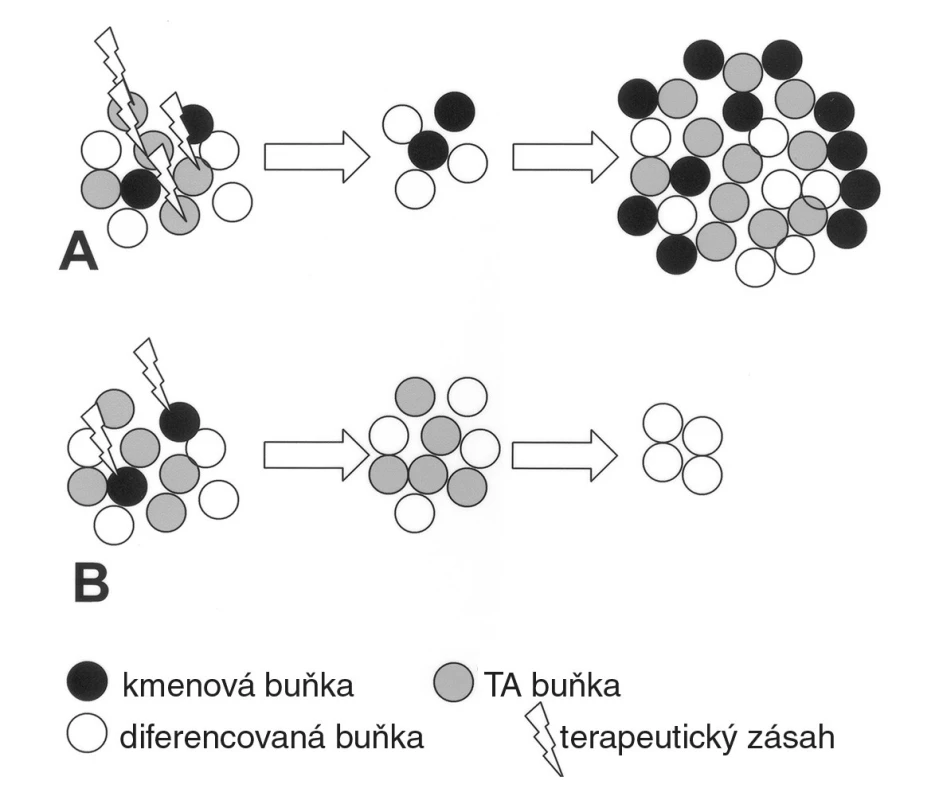
Nádorová kmenová buňka potřebuje specifické mikroprostředí
Normální kmenové buňky potřebují velmi specifické mikroprostředí – niche, které je schopno udržet jejich kmenový charakter. Niche je dosud velmi vágně definováno. Jsou-li z něj kmenové buňky vytrženy, ztrácejí kmenový charakter, tj. přestávají se asymetricky dělit a vstupují do diferenciace (4). Tato skutečnost představuje hlavní překážku dlouhodobé expanze tkáňových kmenových buněk in vitro. Zdá se, že podobné mikroprostředí potřebují i nádorové kmenové buňky. Kromě vlastních nádorových buněk je nádor tvořen také stromatem. Jedná se o heterogenní populaci buněk tvořenou především fibroblasty produkujícími extracelulární matrix, infiltrujícími leukocyty a kapilárami (5). Srovnáme-li vzhled stromatu s okolní pojivovou tkání mimo oblast nádoru, vidíme již v jednoduchém histologickém obarvení zřetelný rozdíl. Je pravděpodobné, že niche nádorové kmenové buňky je právě nádorové stroma, zejména stromální fibroblasty (5). Tyto fibroblasty (někdy též zvané nádorově asociované) se od normálních fibroblastů významně liší. Velmi často jde spíše o myofibroblasty, které se kromě nádorů vyskytují i u fibróz a ve spodině hojící se rány, kde jsou odpovědné za její kontrakci (6). Tyto fibroblasty produkují kromě mezibuněčné hmoty množství specifických růstových faktorů a chemokinů, kterými mohou ovlivnit biologické vlastnosti nádorové buňky a stimulovat její progresivní a promigrační fenotyp (7, 8). Tyto nádorově-asociované fibroblasty mohou ovlivnit i fenotyp zdravých epitelových buněk do podoby buněk nádorových včetně epitelo-mezenchymového přechodu (někdy je též používán termín transformace), který je tak typický pro šíření nádoru a vytváření metastáz (9–11). Není bez zajímavosti, že vzájemná epitelo-mezenchymová interakce se v případu nádorů vycházejících z dlaždicového epitelu podobá epitelo-mezenchymové interakci u vyvíjejícího se základu vlasového folikulu, zubu či mléčné žlázy (12, 13) (obr. 2). Původ nádorově-asociovaných fibroblastů není zcela jasný, zdá se však, že mohou pocházet z více zdrojů, jako jsou lokální fibroblasty, makrofágy, endotelové buňky, pericyty a mezenchymové kmenové buňky (6, 14). Není však vyloučeno, že pocházejí i přímo z nádorové buňky, která prošla epitelo-mezenchymovým přechodem a nemigrovala dále, aby vytvořila metastázu (15, 16).
Kromě nádorově-asociovaných fibroblastů se na tvorbě mikroprostředí podílejí zcela jistě leukocyty, kde je známo, že makrofágy mohou významně stimulovat agresivitu nádoru (17). Funkce stromálních krevních kapilár, které nádor vyživují, je dostatečně známá.
Nádor a embryo
Již patologové v 19. století (von Virchow) si všimli určité podoby mezi anaplastickým nádorem a buněčnými blastémy ve vyvíjejícím se zárodku (18). Tato pozorování byla postupně zpochybňována, i když řada výsledků naznačuje, že embryologický pohled by mohl pomoci pochopit některé zdánlivě paradoxní vlastnosti nádoru.
Teratomy a teratokarcinomy
Teratomy jsou nádory skládající se většinou z buněk všech tří zárodečných listů a jsou tvořeny různě pozměněnými tkáněmi plodu na nejrůznějším vývojovém stupni. Pokud je embryonální kmenová buňka transplantována dospělému jedinci, velmi často vyvolá nádor teratom či teratokarcinom. Opakovaně bylo ukázáno, že teratomové buňky transplantované do raného zárodku se mohou zapojit do vývoje embrya. Narozený jedinec může být nádoru prost a je fertilní (19–21). Tento výsledek naznačil, že embryo může ovlivnit nádorovou buňku a vyladit její regulaci směrem k normálu.
Infekce virem Rousova sarkomu
Pokusy Miny Bissell s virem Rousova sarkomu ukázaly, že zatímco injekce viru do křídla čerstvě vylíhlého kuřete vyvolala růst nádoru, byla kuřecí embrya k tvorbě nádoru rezistentní. Kuřecí embryonální fibroblasty infikované in vitro však byly transformovány podle očekávání (22).
Experimenty s teratomy a virem indukovaným sarkomem naznačily vliv podílu regulačních drah vyvíjející se tkáně na normálním vývoji buňky s prokazatelně maligní genetickou informací.
Melanom a neurální lišta
Asi nejlepším modelem pro studium vlivu embryonálního prostředí na nádorovou buňku je maligní melanom. Podle klasické představy vzniká tento vysoce maligní nádor z maligně transformovaných melanocytů. Tyto buňky pocházejí z neurální lišty, struktury s velmi složitým mechanismem vzniku spojeným s vývojem centrálního nervového systému.
Centrální nervový systém vzniká z neurální trubice. Ta se vytváří invaginací povrchového ektodermu do neurální brázdy. Dorzální konce neurální brázdy se oddělí od povrchového ektodermu a spojí do trubice. Z ektodermu, který spojoval neurální brázdu s povrchovým ektodermem, se vytvoří neurální lišta, která bude umístěna mezi neurální trubicí a povrchovým ektodermem. Neurální lišta představuje materiál, z něhož později vzniká řada buněčných populací včetně melanocytů (23). Buňky neurální lišty také osidlují zevní pochvu vlasového folikulu. Tyto buňky terminálně nediferencují a mají vlastnosti multipotentních kmenových buněk (24, 25). Mohou dát vznik široké škále buněčných typů včetně neuronů. Důležité je, že buňky, které migrují z neurální lišty, procházejí epitelově-mezenchymovým přechodem (podobně jako metastazující buňky) (26). Jsou-li buňky agresivního metastazujícího melanomu transplantovány do raného embrya (ryba, pták), ztrácejí svůj maligní potenciál, a buď ovlivní morfogenezi zárodku, nebo migrují embryem a usidlují se v místech, do nichž za normálních podmínek putují buňky neurální lišty. Nacházíme je potom v sympatických či spinálních gangliích nebo jako normální melanocyty (18, 27). Pokud je studován transkriptom silně agresivní metastazující buňky melanomu a buňky málo agresivní, byly mezi oběma nalezeny významné rozdíly (28). Ty ukázaly, že buňky agresivních nádorů jsou spíše podobné buňkám multipotentním a buňky nádorů méně agresivních normálním melanocytům. Tato plasticita buněk metastazujícího melanomu tak podobná buňkám kmenovým byla zdůrazněna pozorováním vytváření cévám podobných tubulárních kanálů se stěnou tvořenou nádorovými melanoblasty podílejícími se na perfuzi nádoru a dokonce schopnými podílet se na cévním zásobení ischemického svalu (29).
Výše uvedená pozorování ukazují, že nádorové mikroprostředí významně ovlivňuje biologické chování nádoru. Z tohoto hlediska má unikátní vlastnosti mikroprostředí embrya, které je schopno řídit normálním směrem silně maligní geneticky alterované buňky.
Perspektiva
Z uvedeného přehledu vyplývá, že znalost vzájemných buněčných interakcí v normální, vyvíjející se a nádorové tkáni na molekulární úrovni představuje základní podmínku pro pochopení biologických vlastností nádoru a jejich klinické manifestace. Je pravděpodobné, že genetické poškození buňky u zhoubných nádorů vede k aktivaci pevně fylogeneticky a ontogeneticky zafixovaných embryonálních regulačních drah, které umožní patologickému klonu přežít, zdánlivě bez zapojení do regulací makroorganismu. Dokonalá znalost těchto dějů by mohla vést k jejich ovlivněnění buď na úrovni producentů signálních molekul, či na úrovni receptorů permisivních nádorových buněk (5, 30) (viz obr. 2). Tento zásah by následně mohl vést k diferenciaci nádorové kmenové buňky a eliminaci celého nádorového klonu.
Obr. 2. Srovnání vývoje vlasového folikulu (A, B) s s epitelomezenchymovou interakcí u nádoru (C). Při vzniku vlasového folikulu, zubního základu a žláz dochází ke ztluštění epitelu (e) do podoby pupene, který je obklopen kondenzovaným mezenchymem (m). Na základě výměny růstových faktorů a dalších cytokinů/chemokinů (šipky) je závislý další vývoj tohoto základu. U pokročilejší fáze vývoje vlasového folikulu (myš 14,5 dne prenatálního vývoje) je stále patrná kondenzace buněk mezenchymu (m), z něhož se postupně vyvíjí dermální papila (d), která se podílí na regulaci vlasového cyklu (anagen-katagen) v dospělosti. Komunikace (šipky) mezi nádorovým epitelem (e) a okolními fibroblasty (f) podobná situaci za vývoje má nezastupitelnou roli v progresi nádoru. Ovlivnění vzájemného působení nádoru a jeho stromálních fibroblastů může mít významný prodiferenciační efekt a může být v budoucnu využito terapeuticky (31). 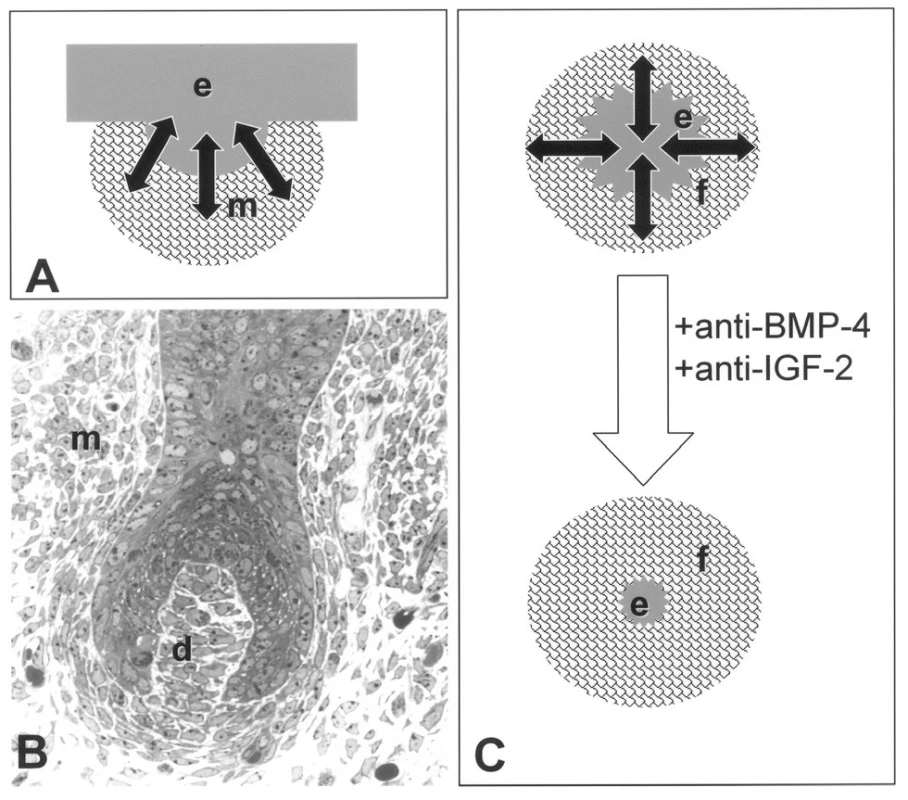
Část výsledků shrnutých v tomto přehledném článku byla získána s podporou Ministerstva školství mládeže a tělovýchovy ČR, projekty č. MSM0021620806, NPVII 2B06106 a 1M0538 a s podporou Karlovy univerzity v Praze, projekt č. 260 510.
Zdroje
1. Weinber RA. The Biology of Cancer. New York: Garland Science, 2007.
2. Sell S. Stem cell origin of cancer and differentiation therapy. Crit Rev Oncol Hematol 2004; 51 : 1–28.
3. Motlík J, et al. Porcine epidermal stem cells as a biomedical model for wound healing and normal/malignant epithelial cell propagation. Theriogenology 2007; 67 : 105–111.
4. Walker MR, et al. The stem cell niche. J Path 2009; 217 : 169–180.
5. Plzák J, et al. Epithelial – stromal interaction in squamous cell epithelium – derived tumors: an important new player in the control of tumor biological properties. Anticancer Res 2010; 30 : 455–462.
6. De Wever O, et al. Stromal myofibroblasts are drivers of invasive cancer growth. Int J Cancer 2008; 123 : 2229–2238.
7. Hwang RF, et al. Cancer-associated stromal fibroblasts promote pancreatic tumor progression. Cancer Res 2008, 68 : 918–926.
8. Strnad H, et al. Head and neck quamous cancer fibroblasts produce growth factors influencing phenotype of normal human keratinocytes. Histochem Cell Biol 2009; 133 : 201–211.
9. Lacina L, et al. Marker profiling of normal keratinocytes identifies the stroma from squamous cell carcinoma of the oral cavity as a modulatory microenvironment in co-culture. Int J Radiation Biol 2007; 83 : 837–848.
10. Lacina L, et al. Stromal fibroblasts from basal cell carcinoma affect phenotype of normal keratinocytes Brit J Dermatol 2007; 156 : 819–829.
11. Kideryová L, et al. Phenotypic characterization of human keratinocytes in coculture reveals differential effects of fibroblasts from benign fibrous histiocytoma (dermatofibroma) as compared to cells from its malignant form and to normal fibroblasts. J Dermatol Sci 2009; 55 : 18–26.
12. Briegel KJ. Embryonic transcription factors in human breast cancer. IUBMB Life 2006; 58 : 123–132.
13. Ohyama M, et al. The mesenchymal component of hair follicle neogenesis: background, methods and molecular characterization. Exp Dermatol 010; 19 : 89–99.
14. Mishra PJ, et al. Carcinoma – associated fibroblast – like differentiation of human mesenchymal stem cells. Cancer Res 2008; 68 : 4331–4339.
15. Petersen OW, et al. Epithelial to mesenchymal transition in human breast cancer can provide a nonmalignant stroma. Am J Pathol 2003; 162 : 391–402.
16. Smetana K Jr, et al. Human hair follicle and interfollicular keratinocyte reactivity to mouse HPV16-transformed cells: an in vitro study. Oncol Rep 2008; 20 : 75–80.
17. Solinas G, et al. Tumor-associated macrophages (TAM) as major players of the cancer-related inflammation. J Leukoc Biol 2009; 86 : 1065–1073.
18. Hendrix MJ, et al. Reprogramming metastatic tumour cells with embryonic microenvironments. Nat Rev Cancer 2007; 7 : 246–255.
19. Lee AS, et al. Effects of cell number on teratoma formation by human embryonic stem cells. Cell Cycle 2009; 8 : 2608–2612.
20. Illmensee K, Mintz B. Totipotency and normal differentiation of single teratocarcinoma cells cloned by injection into blastocysts. Proc Natl Acad Sci USA 1976; 73 : 549–553.
21. Mintz B, Illmensee K. Normal genetically mosaic mice produced from malignant teratocarcinoma cells. Proc Natl Acad Sci USA 1975; 72 : 3585–3589.
22. Dolberg DS, Bissell MJ. Inability of Rous sarcoma virus to cause sarcomas in the avian embryo. Nature 1984; 309 : 552–556.
23. Hall BK. The neural crest and neural crest cells: discovery and significance for theories of embryonic organization. J Biosci 2008; 33 : 781–793.
24. Sieber-Blum M, et al. Pluripotent neural crest stem cells in the adult hair follicle. Dev Dyn 2004; 231 : 258–269.
25. Krejčí E, Grim M. Isolation and characterization of neural crest stem cells from adult human hair follicles. Folia Biol 2010; 56 : 149–157.
26. Karafiát V, et al. Transcription factor c-Myb is involved in the regulation of the epithelial-mesenchymal transition in the avian neural crest. Cell Mol Life Sci 2005; 62 : 2516–2525.
27. Díez-Torre A, et al. Reprogramming of melanoma cells by embryonic microenvironments. Int J Dev Biol 2009; 53 : 1563–1568.
28. Bittner M, et al. Molecular classification of cutaneous malignant melanoma by gene expression profiling. Nature 2000; 406 : 536–540.
29. Seftor EA, et al. Expression of multiple molecular phenotypes by aggressive melanoma tumor cells: role in vasculogenic mimicry. Crit Rev Oncol Hematol 2002; 44 : 17–27.
30. Joyce JA. Therapeutic targeting of the tumor microenvironment. Cancer Cell 2005; 7 : 513–520.
31. Smetana K Jr, et al. Kombinace monoklonálních protilátek nebo jejich Fab fragmentů pro použití jako léčivo a farmaceutický přípravek tyto protilátky nebo jejich Fab fragmenty obsahující. Český patent č. 301597, 2010.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Lékaři primární zdravotní péče v České republice z pohledu demografie – současný stav jako základní kámen budoucího vývoje
- Buňky potní žlázy epidermis jen opravují nebo jsou konstatním zdrojem
- Úloha amfiregulinu
- Nádorové mikroprostředí ovlivňuje biologické vlastnosti nádorové buňky – nádor jako embryologický problém?
-
Vymětal J.
Úvod do psychoterapie. 3. aktualizované a doplněné vydání
Praha: Grada Publishing 2010, 287 s., cena 399 Kč. ISBN 978-80-247-2627-0. - Současný pohled na diagnostiku a léčbu nykturie
- Choroby obličiek a gravidita
- Minulost, současnost a budoucnost neuroprotekce
- Jak ovlivňuje kouření životní styl mladých mužů na počátku 21. století
- Alkohol u dětí a dospívajících – prevence a léčba
- MUDr. Celestýn Opitz
-
von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, Sly PD, Habre W.
Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study
Lancet 2010; 376(9743): 773–783. - Fuchsův večer – Těhotenství a porody za neobvyklých okolností
- Účinnost a riziko medikamentózní léčby otylosti
-
VIII. setkání zájemců o zobrazovací techniky
Český Krumlov, 3. a 4. září 2010 -
60. česko-slovenské Farmakologické dny
Hradec Králové, 15. až 17. září 2010 -
Podzimní konference nukleární medicíny
Praha, 30. září až 1. října 2010 -
3. svatoanenský laboratorní den – celostátní pracovní konference laboratorních oborů
Brno, 9. října 2010 -
XXII. kongres ČLS JEP
Brno, 20. októbra 2010 - VZPOMÍNKA na doc. MUDr. Václava Vlasáka, CSc.
- PLÁNOVANÉ AKCE ODBORNÝCH SLOŽEK ČLS JEP
- SLAVNOSTNÍ PŘEDÁNÍ CEN ZA NEJLEPŠÍ KNIŽNÍ A ČASOPISECKÉ PUBLIKACE za rok 2009
- Paulík K.: Psychologie lidské odolnosti
- Přemáháme bažení, zlepšujeme sebeovládání: informace těm, kteří překonávají návykovou nemoc
- FRANCIS PEYTON ROUS (1879–1970)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Choroby obličiek a gravidita
- Minulost, současnost a budoucnost neuroprotekce
- Lékaři primární zdravotní péče v České republice z pohledu demografie – současný stav jako základní kámen budoucího vývoje
- Alkohol u dětí a dospívajících – prevence a léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



