-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zavedení DNA čipu do molekulární diagnostiky Wilsonovy choroby
Autoři: L. Gojová; E. Jansová; S. Pouchlá; L. Fajkusová
Působiště autorů: Masarykova univerzita Brno, Lékařská fakulta, Interní hematoonkologická klinika FN Brno, Centrum molekulární biologie a genové terapie
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 137-140
Kategorie: Vyšetřovací metody
Souhrn
Východisko.
Wilsonova choroba (WCH) je závažné, autozomálně recesivní onemocnění, jehož podstatou jsou mutace v ATP7B genu, který kóduje měď-specifickou ATPázu. U postižených jedinců dochází k poruše vylučování toxické mědi z organismu a k jejímu hromadění v tělesných orgánech. Molekulární diagnostika Wilsonovy choroby je důležitou součástí stanovení správné diagnózy. Cílem práce bylo navrhnout a zvalidovat genotypovací DNA čip, který umožňuje současně analyzovat 87 mutací a 17 polymorfismů v ATP7B genu.Metody a výsledky.
V první fázi validace bylo testováno 97 WCH pacientů se známým genotypem a 46 vzorků uměle připravených mutagenezí. Všechny analyzované sekvenční varianty byly detekovány se 100% správností. Ve druhé fázi validace byly testovány reálné vzorky WCH suspektních pacientů. Dosud jsme zanalyzovali 58 nepříbuzných pacientů, z nichž u 10 byla čipovou analýzou potvrzena diagnóza WCH, u 13 byla nalezena jedna mutace a u 35 žádná. U pacientů s jednou nebo žádnou detekovanou mutací následovalo přímé sekvenování kódující oblasti genu ATP7B, přičemž nebyla nalezena žádná další kauzální mutace.Závěry.
Wilsonův čip se jeví jako rychlá a spolehlivá vyhledávací metoda mutací v ATP7B genu.Klíčová slova:
ATP7B gen, APEX metoda, DNA čip, molekulární diagnostika, Wilsonova choroba.ÚVOD
Wilsonova choroba (WCH, MIM 277900) je závažná, autozomálně recesivní porucha metabolismu mědi, způsobená deficitem měď-specifické ATPázy (ATP7B). Průměrná incidence WCH se udává 1 na 35 000 živě narozených dětí. Fyziologickou úlohou ATP7B proteinu je transport mědi v organismu – inkorporace mědi do ceruloplazminu a její vylučování žlučí (1). ATP7B protein je exprimován zejména v játrech, v menší míře také v mozku, ledvinách a placentě. V případě nefunkčního proteinu dochází v tělesných orgánech k akumulaci toxické mědi, což může vést až k nevratnému poškození jater, neurologickému selhání a následné smrti, pokud není zahájena správná léčba (2, 3). Choroba se manifestuje nejčastěji ve druhé dekádě života, což znesnadňuje její včasné odhalení. Wilsonovu chorobu lze diagnostikovat na základě kombinace klinických příznaků, biochemických parametrů a molekulárně biologické analýzy ATP7B genu (4–6). Kaiser-Fleischerův prstenec v oku, který vzniká ukládáním mědi v rohovce a je typickým příznakem WCH, však nebývá častokrát zřetelný (7). Biochemická diagnostika WCH je založena na zvýšeném vylučování mědi močí po podání penicillaminu (> 5 μmol/24 hod.), nízké sérové hladině ceruloplazminu (< 0,2 g/L), volné mědi v séru (< 14 μmol/L) a zvýšeném obsahu mědi v jaterní sušině (> 250 μg/g). Nicméně, někteří postižení jedinci mohou být od zdravých heterozygotů – přenašečů biochemicky nerozeznatelní (8). Nejvíce specifickým přístupem ke stanovení diagnózy WCH se jeví molekulárně genetická analýza ATP7B genu. ATP7B gen je lokalizován na dlouhém raménku chromozomu 13 v oblasti 13q14.3 a obsahuje 21 exonů (9, 10). Kóduje protein o 1465 aminokyselinách s celkovou velikostí 157 kDa (11). Do současnosti bylo v tomto genu popsáno více než 400 mutací, z nichž většina je etnicky specifických (12). Převažující mutací v bělošské populaci je p.H1069Q (c.3207C>A), která vede ke ztrátě schopnosti proteinu vázat ATP (13). V současné době se molekulární analýza ATP7B genu opírá o klasickou metodu detekce nejčastějších mutací v jednotlivých populacích restrikčním štěpením a následné přímé sekvenování. Tento přístup je poměrně neefektivní, časově i finančně nákladný. S cílem zefektivnit molekulární diagnostiku WCH jsme navrhli genotypovací DNA čip pro detekci 87 vybraných mutací a 17 polymorfismů v ATP7B genu využívající technologie APEX (Arrayed Primer Extension).
Soubor nemocných a použité metody
Soubor pacientů
Pomocí Wilsonova čipu byla provedena analýza 97 nepříbuzných WCH pacientů, jejichž genotyp byl předem stanoven jinou, molekulárně-biologickou metodou a 58 nepříbuzných pacientů suspektních na WCH. Všichni pacienti pocházeli z České republiky a Slovenské rapubliky a byli zasláni k molekulární analýze WCH z různých klinických pracovišť. Od všech pacientů byl obdržen informovaný souhlas s molekulárně-biologickou analýzou ATP7B genu. DNA byla izolována z periferní krve vysolovací metodou.
DNA čip
Wilsonův čip umožňuje simultánní detekci 87 mutací a 17 polymorfismů v ATP7B genu, které kdy byly detekovány u WCH pacientů v naší laboratoři a které jsou frekventní v blízkých populacích. Na čipu, jehož povrch je speciálně upraven 3-aminopropyl-trimethoxysilanem + 1,4-fenylendiisothiokyanátem, jsou za vzniku kovalentní vazby natištěny specificky navržené krátké oligonukleotidové sondy modifikované amino-skupinou pro detekci všech vybraných sekvenčních variant genu. Každá mutace/polymorfismus je determinována dvěma různými sondami (sense/antisense), kromě nejčastější mutace p.H1069Q, pro jejíž detekci jsou na čip umístěny sondy čtyři. Sondy jsou navrženy dle standardní „wild type“ sekvence ATP7B genu tak, aby se jejich 3‘OH konec nacházel vedle místa sekvenční změny, kterou chceme na čipu analyzovat. Teplota tání, délka a tvorba sekundárních struktur jsou dalšími důležitými parametry sond. Principem analýzy mutací na Wilsonově čipu je APEX (Arrayed Primer Extension) reakce, při níž dochází k prodlužování sond vždy přesně o 1 fluorescenčně značený nukleotidový terminátor (místo mutace/polymorfismu) dle sekvence komplementárně nahybridizovaného úseku analyzovaného DNA vzorku. Touto metodou lze na čipu analyzovat konkrétní substituce, malé inzerce a delece v ATP7B genu.
Výsledky
Validace čipu
Pro možnost využití Wilsonova čipu jako screeningové metody v rutinní diagnostice WCH bylo nutné provést jeho validaci, která spočívala v prvé řadě v otestování funkčnosti jednotlivých sond a schopnosti správně detekovat mutační status. Další podstatnou součástí validace bylo testování neznámých vzorků.
V první fázi validace čipu byla testována schopnost navržených oligonukleotidových sond správně detekovat jednotlivé mutace a polymorfismy ATP7B genu. Byl vybrán soubor 97 WCH pacientů se stanoveným genotypem. Celkem bylo na DNA čipu u vybraného souboru detekováno 43 různých mutací a 15 polymorfismů v homo/heterozygotní formě se 100% správností. Tímto krokem byla otestována funkčnost 118 oligonukleotidových sond (56 %) přítomných na čipu. 13 sond (11 %) vykazovalo slabý nebo žádný signál. Každou testovanou mutaci/polymorfismus bylo ale možné spolehlivě určit alespoň jedním oligonukleotidem (sense nebo antisense) (14). Pro otestování zbylých sond bylo připraveno 46 DNA vzorků s vnesenou mutací či polymorfismem do ATP7B genu. Z celkového počtu 92 oligonukleotidových sond navržených pro detekci frekventních mutací v jiných populacích, 10 sond (11 %) vykazovalo slabý nebo žádný signál. Nicméně, všechny tyto vnesené sekvenční změny byly na čipu detekovány se 100% správností.
Ve druhé fázi validace bylo pomocí Wilsonova čipu otestováno 58 DNA vzorků nepříbuzných, WCH suspektních pacientů. Z celkového počtu 116 analyzovaných alel bylo nalezeno 33 mutantních. Zbytek alel byl sekvenován bez nálezu dalších mutací. Wilsonova choroba byla potvrzena u 10 pacientů, 13 pacientů byli heterozygotní přenašeči jedné mutace a u 35 pacientů nebyla nalezena žádná mutace v ATP7B genu (tab. 1, obr. 1).
Tab. 1. Genotypy nalezené čipovou analýzou u WCH suspektních pacientů 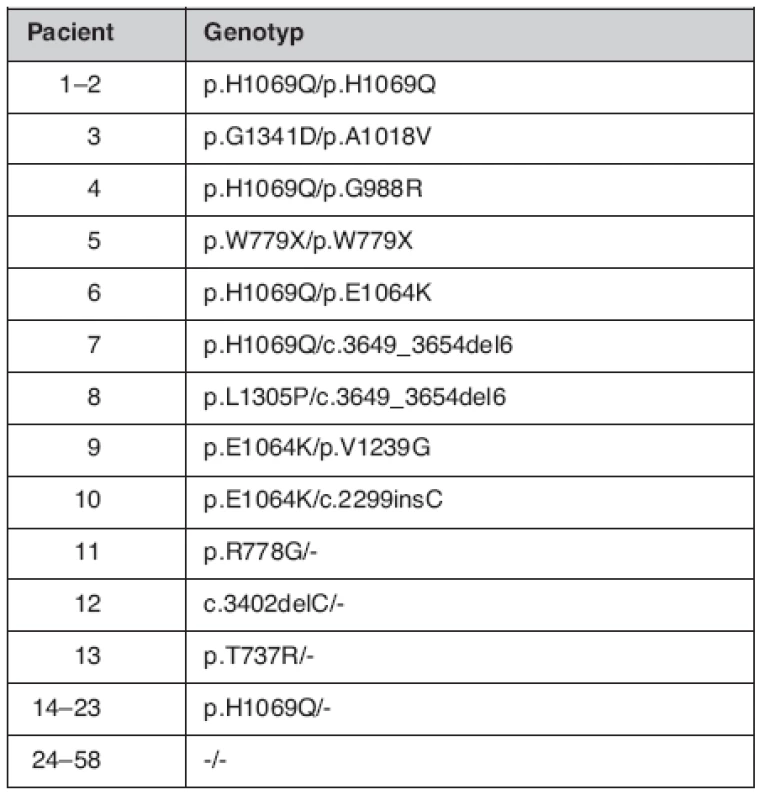
Obr. 1. Výstup z programu Genorama: Výsledek čipové analýzy – pacient 9 s genotypem p.E1064K/p.V1239G 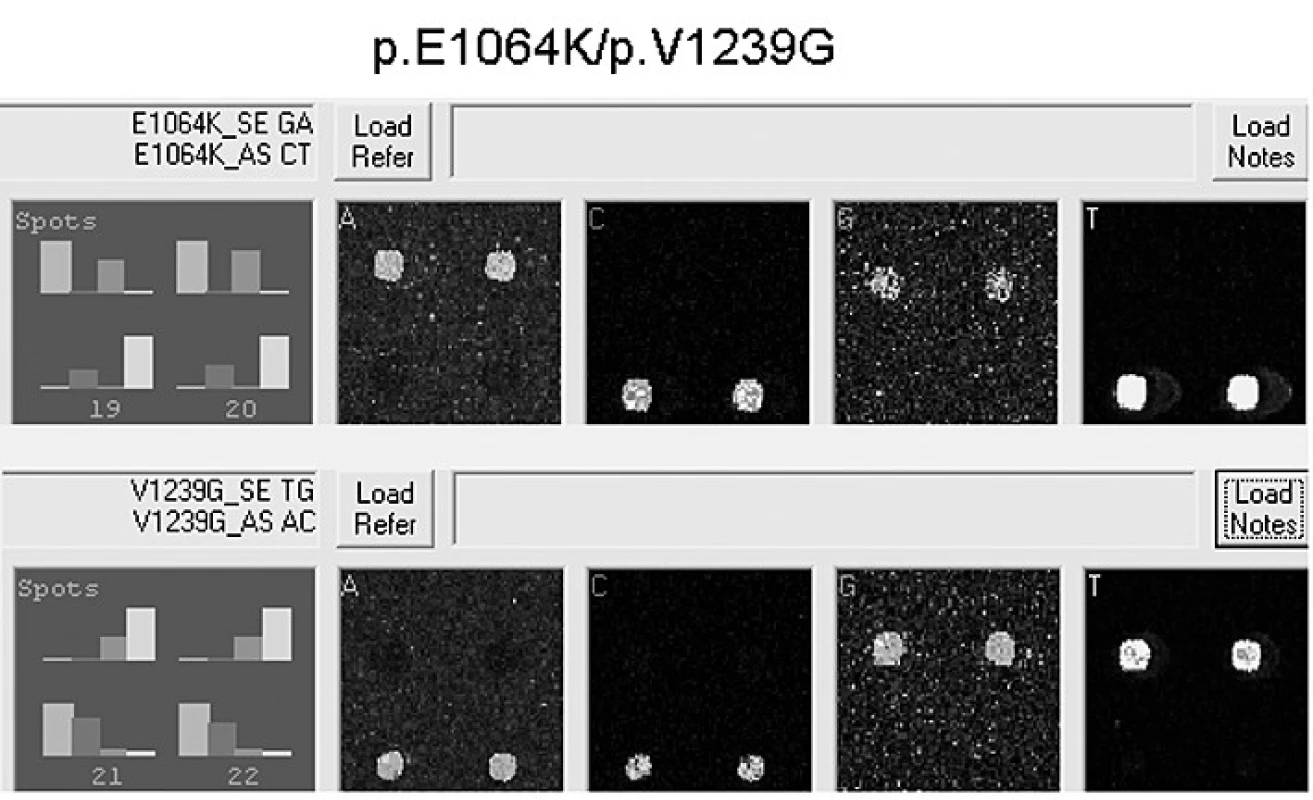
Diskuze
Současným trendem nejen v molekulární diagnostice je miniaturizace analýz a nástup čipové technologie. Genotypovací čipy představují vhodný nástroj pro detekci širokého spektra mutací a polymorfismů v genech v rámci jedné analýzy (15, 16). Cílem naší práce bylo urychlit a zjednodušit molekulární diagnostiku Wilsonovy choroby využitím genotypovacího čipu na bázi APEX pro detekci sekvenčních změn v ATP7B genu. Principem APEX technologie je Sangerovovo dideoxysekvenování. Na čipu dochází k prodlužování imobilizovaných sond vždy právě o jeden fluorescenčně značený terminátor – dideoxynukleotid (ddATP, ddGTP, ddCTP, ddUTP) komplementárně dle hybridizovaného úseku analyzovaného DNA vzorku. Každý ze čtyř terminátorů je označen jinou fluorescenční barvou. Podle toho, který dideoxynukleotid se naváže na danou mutačně-specifickou sondu, lze detekovat sekvenční změny v DNA. APEX technologie umožňuje analyzovat pouze vybrané spektrum známých mutací, nikoliv mutace nové. Nicméně je možné tuto metodu využít pro detekci jak substitucí, tak i delecí a inzercí jednoho či více nukleotidů. Současně je také možné pomocí jedné sondy detekovat více sekvenčních variant. Výhodou APEX metody je její rychlost, jednoduchost a přesnost (17–22). Pro analýzu na Wilsonově čipu bylo vybráno 87 mutací a 17 polymorfismů ATP7B genu. Vybraný mutační panel zahrnoval mutace vyskytující se v české populaci, mutace prevalentní u jiných etnik a polymorfismy pro haplotypovou analýzu (23–29). Na každém čipu byly natištěny kontrolní sondy pro zajištění správného průběhu APEX reakce. Validace Wilsonova čipu, která spočívala v otestování funkčnosti jednotlivých sond, ukázala, že z celkového počtu 210 oligonukleotidových sond natištěných na čipu, 23 sond (11 %) vykazovalo slabý nebo žádný signál. Současně prokázala schopnost správně určit všechny vybrané mutace/polymorfismy. Každá mutace byla spolehlivě detekována alespoň jednou z dvojice specifických sond. Fakt, že některé sondy vykazovaly velmi slabý nebo žádný signál, souvisí s největší pravděpodobností se skutečností, že determinují mutace/polymorfismy nacházející se v sekvenci ATP7B genu s vysokým obsahem GC či AT párů, případně repetitivních oblastí (21). Problém se správnou funkčností může být spojen také s tvorbou sekundárních struktur, délkou a teplotou tání sond. Každou mutaci detekovanou na čipu je nicméně nutné vždy nezávisle ověřit jinou molekulárně biologickou metodou (např. restrikčním štěpením nebo sekvenční analýzou). Zavedením genotypovacího čipu do molekulární diagnostiky Wilsonovy choroby jsme rozšířili prvotní screeningový panel mutací v ATP7B genu z 5 na 87 (14). Příprava vzorku formou multiplexové polymerázové řetězové reakce i samotná APEX reakce na čipu jsou otázkou několika hodin. V případě, že jsou na čipu nalezeny dvě mutace, je diagnóza Wilsonovy choroby potvrzena. Pokud je čipovou analýzou detekována pouze jedna mutace, je nutné v molekulární diagnostice WCH pokračovat přímým sekvenováním genu ATP7B. V případě, že na čipu není prvotním screeningem nalezena žádná mutace, měla by následovat konzultace s ošetřujícím lékařem, zda pokračovat v molekulární analýze. Pokud má pacient klinicky potvrzenou diagnózu WCH, je nutné osekvenovat celý ATP7B gen (obr. 2). Naše výsledky ukazují, že Wilsonův čip je vhodná screeningová metoda jednonukleotidových polymorfismů, malých delecí a inzercí v ATP7B genu.
Obr. 2. Schéma postupu molekulárně-genetického vyšetření Wilsonovy choroby 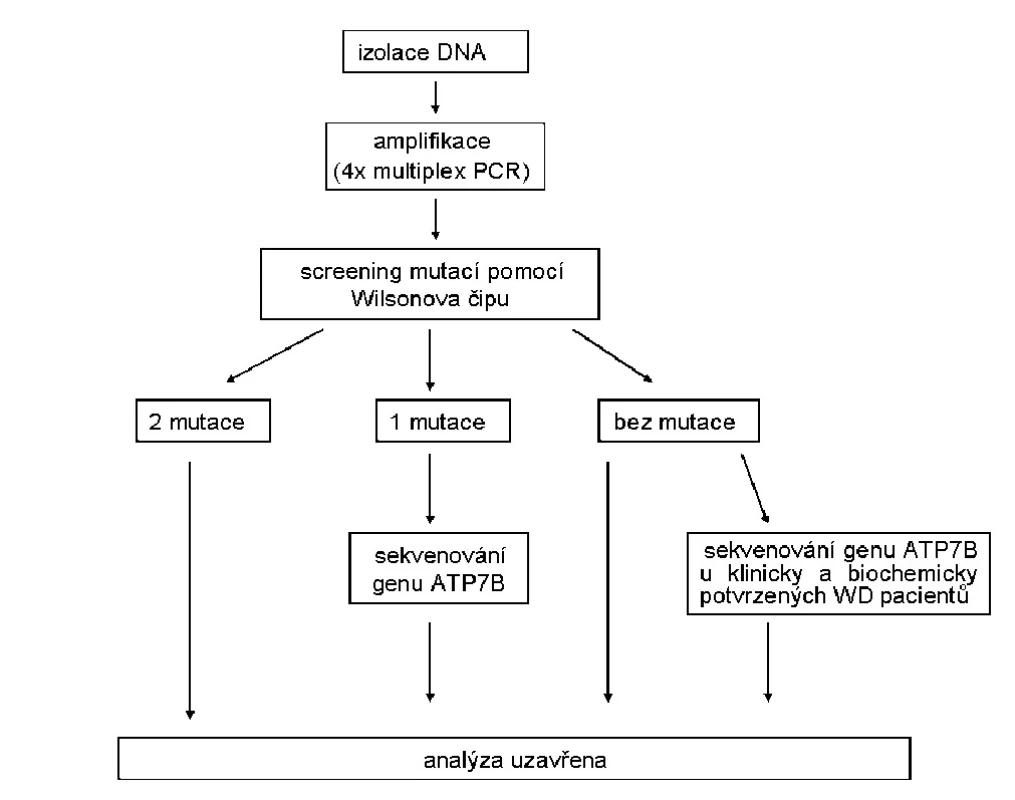
Zkratky
APEX – Arrayed Primer Extension
ddATP – dideoxyadenosintrifosfát
ddGTP – dideoxyguanosintrifosfát
ddCTP – dideoxycytosintrifosfát
ddUTP – dideoxyuridintrifosfát
WCH – Wilsonova choroba
Adresa pro korespondenci:
Mgr. Lucie Gojová
Centrum molekulární biologie a genové terapie FN
Černopolní 9, 613 00 Brno
fax: +420 532 234 623, e-mail: lgojova@fnbrno.cz, luciegojova@seznam.cz
Zdroje
1. Bingham MJ, Ong TJ, Summer KH, et al. Physiologic function of the Wilson disease gene product, ATP7B. Am J Clin Nutr 1998; 67 : 982S–987S.
2. Kodama H. Genetic disorders of copper metabolism. In: Chang LW. (ed.) Toxicology of Metals. New York: CRC Lewis Publishers 1996; 371–386.
3. Harris ED. Cellular copper transport and metabolism. Annu Rev Nutr 2000; 20 : 291–310.
4. Ferenci P. Review article: diagnosis and current therapy of Wilson’s disease. Aliment Pharmacol Ther 2004; 19 : 157–165.
5. Medici V, Rossaro L, Sturniolo GC. Wilson disease-A practical approach to diagnosis, treatment and follow-up. Dig Liver Dis 2007; 39 : 601–609.
6. Medici V, Trevisan CP, D’Inca R et al. Diagnosis and management of Wilson’s disease: results of a single center experience. J Clin Gastroenterol 2006; 40 : 936–941.
7. Liu M, Cohen EJ, Brewer GJ, et al. Kayser-Fleischer ring as the presenting sign of Wilson disease. Am J Ophthalmol 2002; 133 : 832–834.
8. Vrabelova S, Letocha O, Borsky M, et al. Mutation analysis of the ATP7B gene and genotype/phenotype correlation in 227 patients with Wilson disease. Mol Genet Metab 2005; 86 : 277–285.
9. Petrukhin K, Fischer SG, Pirastu M, et al. Mapping, cloning and genetic characterization of the region containing the Wilson disease gene. Nat Genet 1993; 5 : 338–343.
10. Tanzi RE, Petrukhin K, Chernov I, et al. The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene. Nat Genet 1993; 5 : 344–350.
11. Petrukhin K, Lutsenko S, Chernov I, et al. Characterization of the Wilson disease gene encoding a P-type copper transporting ATPase: genomic organization, alternative splicing, and structure/function predictions. Hum Mol Genet 1994; 3 : 1647–1656.
12. Ferenci P. Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing. Hum Genet 2006; 120 : 151–159.
13. Payne AS, Kelly EJ, Gitlin JD. Functional expression of the Wilson disease protein reveals mislocalization and impaired copper-dependent trafficking of the common H1069Q mutation. Proc Natl Acad Sci USA 1998; 95 : 10854–10859.
14. Gojova L, Jansova E, Kulm M, et al. Genotyping microarray as a novel approach for the detection of ATP7B gene mutations in patients with Wilson disease.Clin Gen 2008; 73 : 441–452.
15. Gemignani F, Perra C, Landi S, et al. Reliable detection of beta-thalassemia and G6PD mutations by a DNA microarray. Clin Chem 2002; 48 : 2051–2054.
16. Jaakson K, Zernant J, Kulm M, et al. Genotyping microarray (gene chip) for the ABCR (ABCA4) gene. Hum Mutat 2003; 22 : 395–403.
17. Schrijver I, Oitmaa E, Metspalu A, et al. Genotyping microarray for the detection of more than 200 CFTR mutations in ethnically diverse populations. J Mol Diagn 2005; 7 : 375–387.
18. Kurg A, Tonisson N, Georgiou I, et al. Arrayed primer extension: solid-phase four-color DNA resequencing and mutation detection technology. Genet Test 2000; 4 : 1–7.
19. Zernant J, Kulm M, Dharmaraj S, et al. Genotyping microarray (disease chip) for Leber congenital amaurosis: detection of modifier alleles. Invest Ophthalmol Vis Sci 2005; 46 : 3052–3059.
20. Cremers FP, Kimberling WJ, Kulm M, et al. Development of a genotyping microarray for Usher syndrome. J Med Genet 2007; 44 : 153–160.
21. Tonisson N, Zernant J, Kurg A, et al. Evaluating the arrayed primer extension resequencing assay of TP53 tumor suppressor gene. Proc Natl Acad Sci USA 2002; 99 : 5503–5508.
22. Shadrina M, Nikopensius T, Slominsky P, et al. Association study of sporadic Parkinson’s disease genetic risk factors in patients from Russia by APEX technology. Neurosci Lett 2006; 405 : 212–216.
23. Curtis D, Durkie M, Balac P, et al. A study of Wilson disease mutations in Britain. Hum Mutat 1999; 14 : 304–311.
24. Margarit E, Bach V, Gomez D, et al. Mutation analysis of Wilson disease in the Spanish population — identification of a prevalent substitution and eight novel mutations in the ATP7B gene. Clin Genet 2005; 68 : 61–68.
25. Shah AB, Chernov I, Zhang HT, et al. Identification and analysis of mutations in the Wilson disease gene (ATP7B): population frequencies, genotype-phenotype correlation, and functional analyses. Am J Hum Genet 1997; 61 : 317–328.
26. Gromadzka G, Schmidt HH, Genschel J, et al. Frameshift and nonsense mutations in the gene for ATPase7B are associated with severe impairment of copper metabolism and with an early clinical manifestation of Wilson’s disease. Clin Genet 2005; 68 : 524–532.
27. Loudianos G, Dessi V, Lovicu M, et al. Molecular characterization of wilson disease in the Sardinian population—evidence of a founder effect. Hum Mutat 1999; 14 : 294–303.
28. Firneisz G, Lakatos PL, Szalay F, et al. Common mutations of ATP7B in Wilson disease patients from Hungary. Am J Med Genet 2002; 108 : 23–28.
29. Loudianos G, Dessi V, Lovicu M, et al. Mutation analysis in patients of Mediterranean descent with Wilson disease: identification of 19 novel mutations. J Med Genet 1999; 36 : 833–836.
Štítky
Adiktologie Alergologie a imunologie Anesteziologie a resuscitace Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská dermatologie Dětská gastroenterologie Dětská gynekologie Dětská chirurgie Dětská kardiologie Dětská nefrologie Dětská neurologie Dětská onkologie Dětská otorinolaryngologie Dětská pneumologie Dětská psychiatrie Dětská radiologie Dětská revmatologie Dětská urologie Diabetologie Endokrinologie Farmacie Farmakologie Fyzioterapie Gastroenterologie a hepatologie Genetika Geriatrie a gerontologie Gynekologie a porodnictví Hematologie a transfuzní lékařství Hygiena a epidemiologie Hyperbarická medicína Chirurgie cévní Chirurgie hrudní Chirurgie plastická Chirurgie všeobecná Infekční lékařství Intenzivní medicína Kardiochirurgie Kardiologie Logopedie Mikrobiologie Nefrologie Neonatologie Neurochirurgie Neurologie Nukleární medicína Nutriční terapeut Obezitologie Oftalmologie Onkologie Ortodoncie Ortopedie Otorinolaryngologie Patologie Pediatrie Pneumologie a ftizeologie Popáleninová medicína Posudkové lékařství Praktické lékařství pro děti a dorost Protetika Psychologie Radiodiagnostika Radioterapie Rehabilitační a fyzikální medicína Reprodukční medicína Revmatologie Sestra Sexuologie Soudní lékařství Stomatologie Tělovýchovné lékařství Toxikologie Traumatologie Urgentní medicína Urologie Laboratoř Domácí péče Foniatrie Algeziologie Zdravotnictví Dentální hygienistka Student medicíny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Nepodceňujme důležitost dobré koncepční práce a kompetentního řízení zdravotnictví
- Mastné kyseliny 2. Fyziologický a klinický význam
- Transkripční pochody v jádře
- Šedá eminence v medicíně – štítná žláza: 2. část
- Sedmnáct kroků, jak zvítězit nad internetovou pornografií (svépomocný materiál)
- Přehled chirurgické léčby vitiliga
- mikroRNA regulující stresovou imunitní odpověď
- Alveolární echinokokóza – nově se objevující onemocnění?
- Identifikace genů, které regulují migraci
- T-buňky a jejich polibek smrti
- Zavedení DNA čipu do molekulární diagnostiky Wilsonovy choroby
- Knihy
- Trampoline-related injuries in childhood
- Suicide attempts -possibility of psychoprofilactic
- Food-dependent exercise-induced anaphylaxis
- Konference Sekce infekčních nemocí v gynekologii a porodnictví České gynekologicko-porodnické společnosti České lékařské společnosti J. E. Purkyně
- Kniha
- Založení české společnosti bezkrevní medicíny
- Spolek lékařů českých v Praze
- LAUREÁTI NOBELOVY CENY
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alveolární echinokokóza – nově se objevující onemocnění?
- Mastné kyseliny 2. Fyziologický a klinický význam
- Šedá eminence v medicíně – štítná žláza: 2. část
- Přehled chirurgické léčby vitiliga
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



