-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
Autoři: P. Urbánek 1; P. Husa 2; J. Galský 3; J. Šperl 4
; P. Kümpel 5; V. Němeček 6
; S. Plíšek 7; M. Volfová 8
Působiště autorů: Interní klinika 1. LF UK a ÚVN, Praha 1; Klinika Infekčních chorob FN, Brno 2; Infekční oddělení Nemocnice Mělník 3; Klinika hepatogastroenterologie IKEM, Praha 4; Infekční oddělení Nemocnice Opava 5; NRL pro virové hepatitidy SZÚ, Praha 6; Infekční klinika FN, Hradec Králové 7; Hepato-Gastroenterologie HK, s. r. o. 8
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 1-12
Kategorie: Příloha
Preambule
Níže uvedená doporučení pro diagnostiku a terapii infekce virem hepatitidy C byla vytvořena členy pracovních skupin pro virové hepatitidy České hepatologické společnosti ČLS JEP a Společnosti infekčního lékařství ČLS JEP. Jsou založena především na doporučeních Americké asociace pro studium jaterních chorob z roku 2004 (AASLD) a Asijsko-Pacifické asociace pro studium jater z roku 2007 (APASL). Zapracovány jsou i nejnovější znalosti a pokroky v dané oblasti z období let 2004–2007. Doporučení představují preferovaný přístup k řešení všech níže probíraných aspektů péče o pacienty s virovou hepatitidou C. Nedílnou součástí dokumentu jsou i doporučení racionálních preventivních opatření bránících přenosu viru hepatitidy C.
Maximální možné dodržování odborných doporučení je podmínkou dosažení efektivní péče o nemocné s virovou hepatitidou C v celostátním měřítku. Předkládaný dokument je oporou při jednání obou odborných společností se státními orgány a s plátci zdravotní péče.
Epidemiologie HCV
Celosvětová prevalence infekce HCV se pohybuje v běžné populaci kolem 3 %. V roce 2001 bylo pomocí sérologického přehledu zjištěno, že prevalence protilátek anti-HCV v běžné populaci ČR je 0,2 %. HCV infekce je nejčastější příčinou jaterních onemocnění ve vyspělých zemích světa.
Infekce virem hepatitidy C patří mezi krví přenosné infekce. Hlavními cestami šíření HCV infekce jsou:
- přenos krevními deriváty,
- injekční aplikace drog,
- pravidelné dialyzační léčení (PDL),
- profesionální riziko expozice HCV,
- sexuální kontakt s osobou HCV pozitivní,
- rodinný kontakt s osobou HCV pozitivní,
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos),
- iatrogenní přenos,
- transplantační štěpy.
Recentní studie ukazují na to, že až v 90 % se podaří některý z rizikových faktorů u infikované osoby identifikovat, nicméně je zapotřebí velmi podrobného a aktivního dotazování.
Prevence přenosu HCV
HCV pozitivní osoba musí být poučena jak zabránit přenosu HCV na další osoby, zejména:
- HCV pozitivní osoba nesmí darovat krev, orgány, tkáně či sperma.
- HCV pozitivní osoba by si měla řádně ošetřit každou otevřenou ránu tak, aby nedošlo k jakékoliv expozici jiné osoby infikovanou krví.
- HCV pozitivní toxikomani by měli být zařazeni do programu kontrolované výměny injekčního instrumentaria a všech dalších potřeb, pokud nejsou indikováni k odvykací léčbě.
- HCV pozitivní osoba by měla být poučena, že riziko přenosu HCV sexuální cestou je malé a infekce sama o sobě není indikací k používání bariérové antikoncepce. Metody bezpečného sexu jsou dostatečnou prevencí přenosu.
- HCV pozitivní osoba by měla bránit i náhodnému použití svého zubního kartáčku, holicích potřeb ap. další osobou.
Laboratorní vyšetřovací metody
Sérologické detekční metody
Jedná se sérologickou detekci anti-HCV protilátek. Protilátky jsou markerem expozice – kontaktu dané osoby s virem hepatitidy C. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organismu. Přetrvávají ve značném titru i u pacientů úspěšně vyléčených. Technicky se jedná o detekci protilátek metodou EIA či některých jejích variant. V současné době se používají metody III. generace, které mají senzitivitu 97 % a specificitu až 99 %.
Indikace k vyšetření protilátek anti-HCV
Vyšetření anti-HCV protilátek je možno chápat jako vyšetření skríninkové u všech osob, u kterých je podezření, že byly někdy v průběhu života virem exponovány.
Na základě znalostí o možnostech přenosu je doporučováno testování HCV infekce zejména u těchto skupin osob:
• osoby s anamnézou injekční aplikace drog, a to i v případě jediné aplikace před více lety;
• osoby ve skupinách s vysokou prevalencí HCV infekce
- příjemci krevních derivátů či příjemci orgánových transplantátů před rokem 1992,
- HIV pozitivní osoby,
- hemofilici léčení před rokem 1987,
- osoby s anamnézou hemodialýzy (i akutní a krátkodobou),
- osoby s nevysvětlitelnou elevací aminotransferáz;
• děti narozené HCV pozitivním matkám (testování až po 18. měsíci věku);
• zdravotničtí pracovníci a další osoby s anamnézou poranění injekční jehlou (bez ohledu na sérologický stav event. zdroje) nebo osoby s mukozální expozicí krvi HCV pozitivní osoby;
• sexuální partneři HCV pozitivní osoby.
Molekulárně genetické metody
Molekulárně genetické metody prokazují přítomnost virové nukleové kyseliny (HCV RNA) v séru či tkáních infikovaného jedince. Všechny používané metody jsou dnes dostupné ve variantě kvalitativní i kvantitativní. Největšího rozšíření nalezla metoda amplifikace nukleové kyseliny – polymerázová řetězová reakce (PCR). Molekulárně genetické metody umožňují kromě kvantitativního a kvalitativního stanovení HCV RNA v séru určit i genotyp viru HCV.
Indikace k vyšetření HCV RNA
- osoby anti-HCV pozitivní,
- osoby s nevysvětlitelnou jaterní chorobou, které jsou anti-HCV negativní a lze je považovat za imunokompromitované,
- kvantitativní stanovení virémie – osoby, u kterých je zvažována protivirová léčba. V těchto případech by také měl být určen genotyp HCV. Účelem genotypizace je určení délky terapie a pravděpodobnost vyléčení HCV infekce.
Přirozený průběh HCV infekce
Studie o přirozeném průběhu HCV infekce ukazují, že 55–85 % pacientů, kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat a infekce u nich tudíž přejde do chronického stadia. U 5–20 % osob z tohoto počtu dojde během 20–25 let k rozvoji jaterní cirhózy. Osoby s jaterní cirhózou při chronické HCV infekci mají riziko rozvoje end-stage-liver disease (cca 30 % během 10 let) a riziko vzniku hepatocelulárního karcinomu (HCC, 1–2 % ročně). Faktory asociované s progresí jaterního postižení při chronické HCV infekci jsou:
- přenos infekce ve vyšším věku (riziko narůstá po 40.–45. roce věku),
- konzumace alkoholu ≥ 50 g denně,
- obezita a jaterní steatóza z jakéhokoliv jiného důvodu,
- koinfekce HCV/HBV a HCV/HIV,
- vyšší jaterní staging nežli portální fibróza v iniciální jaterní biopsii (METAVIR ≥ 2 a Ishak ≥ 3).
Chronická HCV infekce je rovněž asociována s celou řadou tzv. extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinémie. Symptomatická smíšená kryoglobulinémie je indikací k protivirové léčbě bez ohledu na staging jaterního postižení.
Používaná terminologie
Chronická HCV infekce
Chronická HCV infekce je definována jako prokazatelná přítomnost viru v organismu po dobu delší nežli 6 měsíců (pozitivní průkaz sérové HCV RNA metodou polymerázové řetězové reakce (PCR) s detekčním limitem 50 IU/ml a méně. Za chronickou infekci je nutno považovat dále každou prokázanou infekci s neznámým okamžikem vzniku.
Akutní HCV infekce
Akutní HCV infekce je diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu HCV infekce. Naše znalosti jsou proto velmi limitovány. Stejně tak neexistuje terminologická jednota. Za akutní HCV infekci někteří považují pouze prokazatelnou sérokonverzi z anti-HCV negativity na anti-HCV pozitivitu a HCV RNA pozitivitu v daném období. Jiní autoři k tomuto kritériu ještě přidávají nutnost prokázané elevace ALT ≥ 10× ULN (horní limit normy) současně s první sérologickou pozitivitou nebo v období 6–12 měsíců před prvním pozitivním sérologickým vyšetřením.
Standardní detekční limit stanovení HCV RNA
Za standardní detekční limit je považována citlivost použité techniky (nejčastěji polymerázové řetězové reakce) 50 IU/ml HCV RNA a méně. Protože řada laboratoří používá metody na stanovení HCV RNA, jejichž citlivost nedosahuje požadovaného standardního detekčního limitu, je třeba, aby lékař zadávající vyšetření v souvislosti s hodnocením terapie dle těchto standardních postupů požadoval na laboratoři informaci, že citlivost jejich stanovení splňuje uvedený limit.
Virologická odpověď v časných fázích léčby
Terminologii pro hodnocení virologické odpovědi v časných fázích léčby (do 12. týdne) uvádí tabulka 1.
Tab. 1. Definice virologické odpovědi v počátcích protivirové terapie 
Virologická odpověď na konci léčby (ETVR, End of Treatment Virological Response)
Negativní sérová HCV RNA metodou PCR se standardním detekčním limitem v okamžiku ukončení protivirové léčby.
Setrvalá virologická odpověď (SVR, Sustained Virological Response)
Negativní sérová HCV RNA metodou PCR se standardním detekčním limitem ve 24. týdnu po skončení terapie. Dosažení SVR je kritériem pro vyléčení HCV infekce. Pětileté riziko relapsu HCV infekce je v těchto případech < 1 %.
Relaps HCV infekce
Znovuobjevení sérové HCV RNA u pacienta s dosažením virologické odpovědi na konci léčby (ETVR), ke kterému dojde po skončení terapie.
Breakthrough (fenomén průlomu)
Během léčby, po dosažení některé z forem virologické odpovědi, dojde k novému vzplanutí infekce, tj. původně negativní sérová HCV RNA se stává opět pozitivní. Současná elevace ALT není nezbytnou podmínkou.
Kritéria pro zahájení terapie chronické infekce virem hepatitidy C
Všichni pacienti s chronickou HCV infekcí jsou potenciálními kandidáty protivirové léčby. Terapie je jednoznačně doporučena pro pacienty se zvýšeným rizikem vzniku jaterní cirhózy. Tito pacienti jsou charakterizováni detekovatelnou sérovou HCV RNA metodou PCR, jaterní biopsií s portální nebo přemosťující fibrózou a s alespoň střední aktivitou zánětu. Většina těchto pacientů má také trvale vyšší aktivitu ALT. Trvale normální aktivita ALT není kontraindikací zahájení protivirové léčby. V některých zvláštních skupinách pacientů nejsou rizika a přínosy terapie přesně definovány. Případná léčba těchto pacientů by měla být zahájena po pečlivém individuálním zvážení konkrétního případu.
Cíle terapie chronické infekce virem hepatitidy C
Cílem terapie je zabránit rozvoji komplikací HCV infekce, což je podmíněno dosažením eradikace infekce. Eradikací infekce je myšleno dosažení SVR ve smyslu výše uvedené definice. Zlepšení jaterní histologie včetně poklesu stagingu jaterní fibrózy bylo dosaženo u pacientů po kombinované terapii pegylovanými interferony a ribavirinem (viz dále), zejména u osob, které dosáhly SVR.
Iniciální terapie HCV infekce
Naivní (dosud neléčený) pacient s chronickou HCV infekcí
Postupem první volby je pro dosud neléčeného pacienta kombinace pegylovaného interferonu alfa (PEG-IFN) a ribavirinu (RBV).
V současné době jsou dostupné a pro terapii HCV infekce schválené dva typy pegylovaných interferonů dvou různých výrobců (tab. 2). Uvedená dávkovací schémata byla schémata užitá ve třech registračních studiích s kombinovanou terapií PEG-IFN + RBV. Oba typy pegylovaných interferonů nebyly dosud zkoumány ve studii používající stejné dávkování ribavirinu, proto nelze srovnat jejich vzájemnou relativní účinnost. Registrační studie s použitím obou typů pegylovaných itnerferonů poskytly dostatek jasných důkazů, které vedly k jednoznačnému doporučení kombinace PEG-IFN + RBV jako postupu první volby pro pacienty s chronickou HCV infekcí.
Tab. 2. Léky užívané v terapii chronické HCV infekce 
Účinnost terapie a předpovědní faktory odpovědi na terapii
Výsledky terapie kombinací PEG-IFN + RBV ze tří registračních studií v závislosti na základních výchozích parametrech a použitém terapeutickém schématu ukazují grafy 1, 2 a 3.
Graf 1. SVR při terapii peginterferonem alfa-2b a ribavirinem po dobu 48 týdnů v závislosti na genotypu a virémii PEG-IFN – pegylovaný interferon, RBV – ribavirin, MU – miliony mezinárodních jednotek, TIW – podání 3× týdně, PEG-IFN alfa-2b 1,5 μg – tj. PEG-IFN alfa-2b 1,5 μg/kg tělesné hmotnosti 
Graf 2. SVR při terapii PEG-IFN alfa-2a + RBV a při terapii IFN alfa2b + RBV v závislosti na genotypu HCV PEG-IFN – pegylovaný itnerferon, RBV – ribavirin, MU – miliony mezinárodních jednotek, TIW – podání 3× týdně 
Graf 3. SVR při terapii peginterferonem alfa-2a (180 μg 1× týdně) a ribavirinem ve dvou různých dávkách po dobu 24 nebo 48 týdnů 
Nejdůležitější faktory asociované s dosažením SVR jsou:
- genotypy HCV 2 a 3,
- nízká virémie (do 800 000 IU/ml),
- nižší histologická aktivita,
- nižší tělesná hmotnost či menší povrch těla.
Shrnutí
Terapie PEG-IFN (PEG-IFN alfa-2a 180 μg s.c. 1× týdně; PEG-IFN alfa-2b 1,5 μg s.c. 1× týdně) + RBV (1000 až 1200 mg p.o. denně dle tělesné hmotnosti) u genotypu HCV 1 by měla trvat 48 týdnů, je-li ve 12. týdnu léčby dosaženo EVR. Není-li dosaženo EVR, terapie má být ukončena. Schematicky tento postup ukazuje obrázek 1.
Obr. 1. Terapeutický algoritmus pro dosud neléčeného pacienta 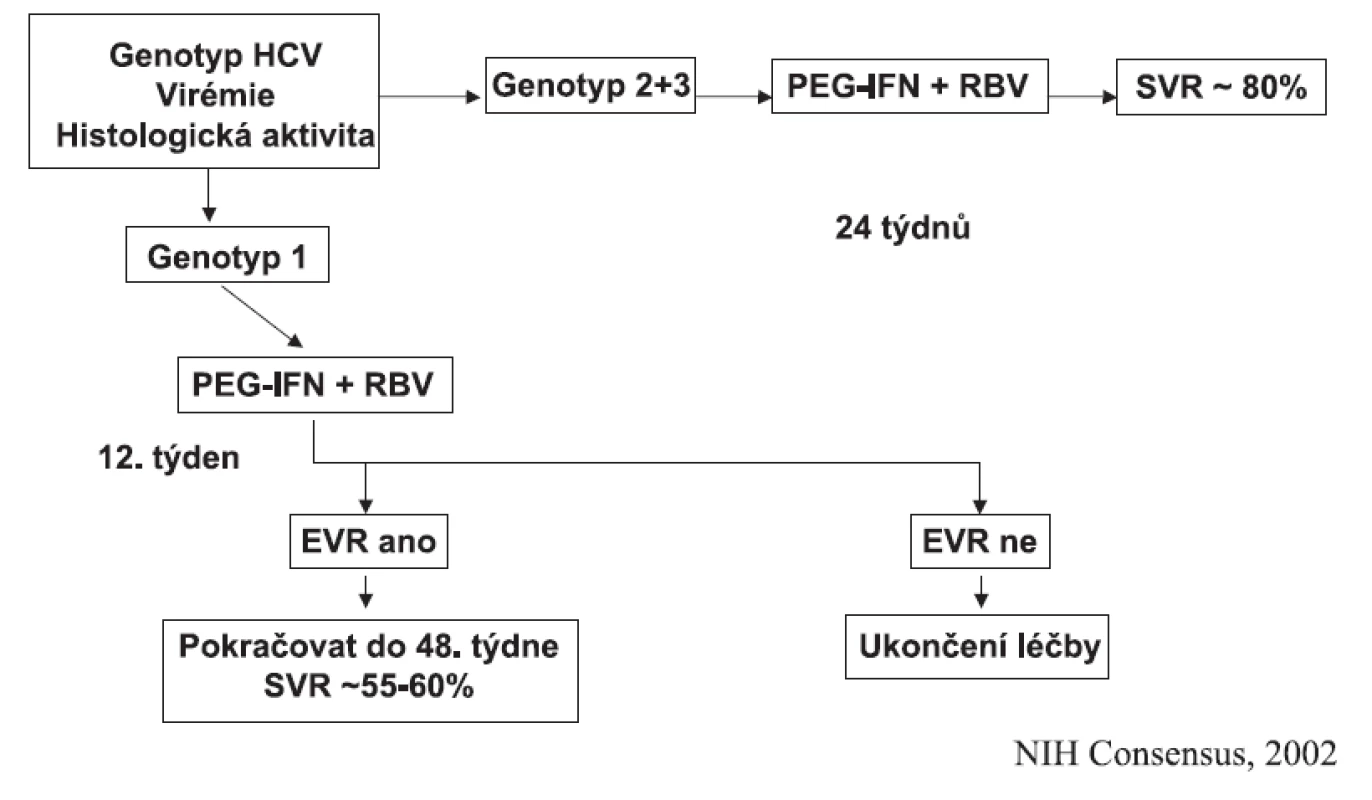
Je-li tato kombinace použita pro genotypy HCV 2 a 3, je dostatečná léčba trvající 24 týdnů a nižší dávka ribavirinu (800 mg p.o. denně).
Vysokou asociaci s dosažením SVR (> 80 %) má dosažení cEVR.
Nové trendy v terapii chronické HCV infekce
Výsledky několika recentních studií svědčí pro to, že v určitých případech lze celkovou délku terapie významným způsobem modifikovat:
Zkrácení terapie
O zkrácení terapie na 24 týdnů je možno uvažovat u pacientů s genotypem HCV 1, kteří mají velmi nízkou výchozí virémii (dle výsledků klinických studií ≤ 600 000 IU/ml) a kteří dosáhnou RVR.
Prodloužení terapie
O prodloužení terapie na 72 týdnů je možno uvažovat u pacientů s genotypem HCV 1, kteří patří do skupiny „slow responders“, tj. u osob, které jsou HCV RNA pozitivní ve 12. týdnu (pEVR) a ve 24. týdnu jsou HCV RNA negativní při standardním detekčním limitu PCR.
Prodloužení terapie není indikováno z pohledu snahy o zabránění progrese fibrózy. Dosavadní výsledky s dlouhodobou protivirovou terapií jsou v tomto smyslu negativní. K významnému zpomalení progrese fibrózy nedošlo.
Terapie při kontraindikaci ribavirinu
Při kontraindikaci ribavirinu je odůvodnitelná monoterapie IFN, např. u pacientů na hemodialýze. Monoterapií IFN lze dosáhnout významně méně SVR nežli kombinovanou terapií. Monoterapie má být přednostně vedena pegylovaným IFN.
Opakovaná léčba
Při indikování opakované léčby pacientů s chronickou HCV infekcí je třeba zvážit následující faktory:
- předchozí léčebný režim a rozdíl v účinnosti mezi současnými léčebnými možnostmi a tímto režimem,
- pravděpodobnou příčinu selhání dosavadní léčby (např. virologická rezistence vs. nízké dávkování),
- závažnost existujícího jaterního postižení (stupeň jaterní dysfunkce),
- spolupráci a motivaci pacienta pro další léčbu,
- epidemiologická rizika,
- genotyp HCV a další prediktivní (pozitivní i negativní) faktory terapie,
- toleranci léčby.
Indikace k opakované terapii s použitím kombinace PEG-IFN + RBV
- pacienti relabující a non-respondeři na předchozí terapii PEG-IFN + RBV Výsledky studií s použitím PEG-IFN alfa a RBV u pacientů relabujících a non-responderů na předchozí terapii PEG-IFN + RBV opravňují k opakovanému užití standardní kombinace i u těchto nemocných. Dosavadní znalosti o průběhu virologické odpovědi v počátcích léčby a o jejím vztahu k dosažení SVR ukazují na to, že reálnou naději na dosažení SVR mají pouze pacienti, kteří jsou ve 12. týdnu opakované léčby HCV RNA negativní (cEVR ve smyslu výše uvedené definice). Pacienti, kteří byli ve 12. týdnu léčby pozitivní, dosáhli SVR pouze v 7 % případů (studie EPIC-3). Podobných výsledků bylo dosaženo ve studii REPEAT s použitím kombinace PEG-IFN alfa-2a a RBV. Jediným preparátem, který má v platném znění SPC výslovně uvedenou indikaci selhání předchozí léčby pegylovaným i nepegylovaným interferonem alfa, je k datu vydání těchto doporučení preparát Pegintron (www.emea.europa. eu/humandocs/Humans/EPAR/pegintron/pegintron.htm). Schválené znění SPC preparátu Pegasys (www.emea.europa.eu/humandocs/Humans/EPAR/pegasys/pegasys.htm) této indikaci výslovně nebrání v případech relapsu po předchozí terapii. Při úvahách o zahájení opakované léčby je třeba pečlivě zvážit, zda stupeň jaterní dysfunkce u daného pacienta není již indikací ke zvážení jaterní transplantace. V těchto případech by protivirová léčba měla být vedena pouze v transplantačních centrech. U non-responderů na předchozí léčbu je nutno počítat s významně nižší pravděpodobností úspěchu léčby nežli u pacientů relabujících. Skupina non-responderů je v ČR tvořena pravděpodobně z větší části pacienty se skutečnou virologickou či imunologickou rezistencí. V dosud publikovaných studiích byly do této skupiny zařazovány i osoby se špatnou spoluprací, s nízkým dávkováním jednotlivých preparátů apod. Výsledky terapie non-responderů proto pravděpodobně nelze aplikovat na populaci ČR zcela přesně. Pacient musí být o této skutečnosti informován před zahájením léčby a musí s ní souhlasit.
- pacient relabující po monoterapii konvenčním IFN
- pacient rezistentní na monoterapii konvenčním IFN
- pacient relabující po kombinaci konvenční IFN + RBV
- pacient rezistentní na kombinaci konvenční IFN + RBV
V těchto případech je možno použít analogický terapeutický postup jako pro pacienta dosud neléčeného. Kvalifikace odpovědí i prediktivní hodnoty jednotlivých typů virologické odpovědi a dalších faktorů jsou velmi podobné jako v případech dosud neléčených pacientů.
SVR lze dosáhnout u 25–40 % pacientů, u kterých selhala monoterapie konvenčním IFN-alfa, a u cca 10 % pacientů, u kterých selhala kombinace konvenční IFN + RBV. Pacienti s genotypy HCV 2 a 3 odpovídají na opakovanou léčbu lépe nežli pacienti s genotypem HCV 1.
Terapie chronické infekce virem hepatitidy C u zvláštních skupin pacientů
Pacienti s trvale normální aktivitou ALT
Definice
Kritéria pro zařazení pacientů s chronickou HCV infekcí (pozitivní sérovou HCV RNA metodou PCR se standardním detekčním limitem) do podskupiny s trvale normální aktivitou ALT (PNALT) nebyla dosud jednoznačně definována. Nebyla jednoznačně stanovena ani frekvence stanovení ALT ani období, během něhož by vyšetřování aktivity ALT mělo být prováděno. Metodika stanovení horního limitu sérové aktivity ALT je v současné době podrobována kritice odborné veřejnosti. Nelze vyloučit, že v dohledné době bude třeba snížit horní hranice normy ALT, ale i jiných biochemických parametrů. Dosavadní výsledky svědčí pro skutečnost, že pouze pacienti, kteří mají opakovaně zcela normální aktivitu ALT během období minimálně 18 měsíců, mají jednak minimální histologickou aktivitu jaterního postižení v okamžiku stanovení diagnózy, jednak mají minimální riziko progrese jaterního postižení z dlouhodobého pohledu. Zdá se proto, že ideální definice pro trvale normální aktivitu zní: opakovaně zcela normální aktivita sérové ALT během období 18 měsíců. V běžné praxi je však pro zařazení pacienta do skupiny s trvale normální aktivitou ALT užíváno kritérium 2× normální ALT během 6 měsíců. Dosud publikované výsledky studií prokazují u pacientů s PNALT přemosťující fibrózu či cirhózu v 1–10 % případů a fibrózu významnější nežli portální (periportální a těžší) pak dokonce ve 14–40 % případů. Progrese jaterního postižení byla opakovaně dokázána i u osob s PNALT.
Pozn.: Při řazení pacientů do této skupiny je považováno za vhodné popisně uvést alespoň sledovací období, na jehož základě je pacient považován za osobu s trvale normální aktivitou ALT. Například 6 měsíců normální ALT, 18 měsíců normální ALT ap.
Terapeutický postup
Dosavadní znalosti o dlouhodobém průběhu onemocnění, rozvoji komplikací jaterních i mimojaterních a výsledky terapie s použitím kombinace PEG-IFN a ribavirinu u osob s PNALT odůvodňují zahájení protivirové terapie v této skupině. Před zahájením léčby bývá doporučováno zvážit i některé další faktory, zejména:
- genotyp HCV,
- přítomnost či nepřítomnost jaterní fibrózy,
- motivace pacienta,
- příznaky onemocnění,
- přidružené nemoci,
- věk pacienta.
Obrázek 2 ukazuje navržený terapeutický algoritmus pro pacienty s PNALT.
Obr. 2. Terapeutický algoritmus pro pacienty s trvale normální ALT 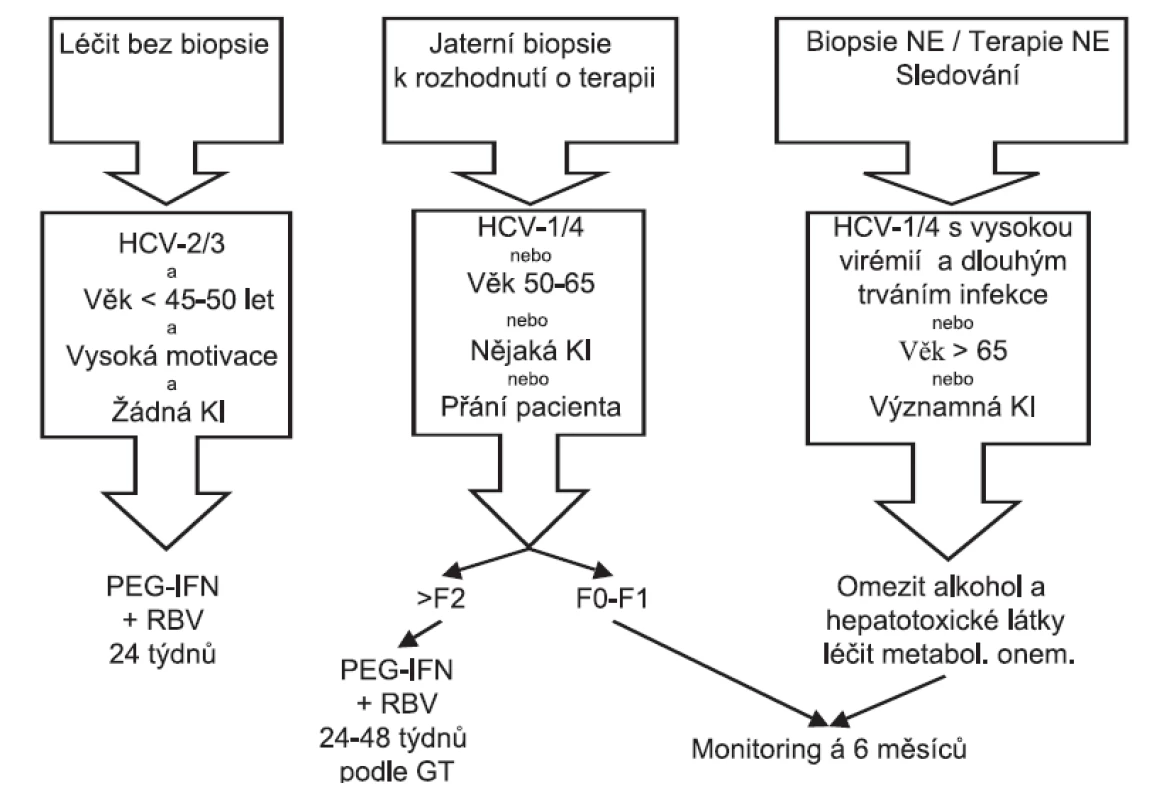
Pokročilé jaterní onemocnění
Znalosti o bezpečnosti a účinnosti interferonu (konvenčního či pegylovaného) s ribavirinem či bez ribavirinu u pacientů s pokročilým jaterním onemocněním jsou odvozeny z analýzy podskupin ve větších klinických studiích. SVR je dosahováno významně méně často nežli u pacientů bez cirhózy. Pro pacienty s dekompenzovanou jaterní cirhózou je terapií volby jaterní transplantace. Studie s protivirovou terapií u pacientů čekajících na jaterní transplantaci v současné době probíhají, u některých pacientů byly však pozorovány potenciálně život ohrožující vedlejší účinky protivirové léčby. Průběh léčby v řadě případů vyžaduje doplnění protivirové léčby o terapii růstovými faktory. Terapie by v této indikaci měla být vedena pouze v rámci klinických studií v transplantačních centrech.
Děti ve věku do 18 let
Doporučení týkající se diagnostiky (včetně jaterní biopsie) u dětí s podezřením na HCV infekci jsou stejná jako pro dospělé osoby. U dětí do 1 roku věku je pozorována vysoká spontánní eradikace viru, proto není doporučováno rutinní testování HCV RNA u novorozenců HCV RNA pozitivních matek. Testování anti-HCV či HCV RNA může být provedeno až po 18. měsíci věku dítěte.
V současné době nejsou dostupné rozsáhlejší studie zabývající se kombinační terapií PEG-IFN + RBV u dětí. Studie s monoterapií IFN dosahovaly poněkud vyšší účinnosti (% SVR) nežli u dospělých, cca 33–45 %, SVR u kombinované terapie konvenčním IFN a ribavirinem 43–60 %. Studie s PEG-IFN či kombinací PEG-IFN + RBV nejsou v současnosti dostupné. Léčba pegylovaným interferonem do 18 let věku dítěte není schválena (očekávají se výsledky studie PEDS-C, pegylovaný IFN alfa-2a 180 μg/1,73 m2 1× týdně, ribavirin denně 15 mg/kg, především z hlediska ovlivnění mentálního vývoje a růstu dítěte, v dalších menších studiích je alternativně aplikován PEG-IFN alfa-2b 1,5 μg/kg 1× týdně a RBV 15 mg/kg denně). Léčba konvenčním IFN a ribavirinem u dětí do 3 let věku je považována za kontraindikovanou. V současné době je doporučena terapie s individuálním přístupem u dětí starších 3 let konvenčním interferonem v kombinaci s ribavirinem. Optimální doba zahájení antivirové terapie u dětí není jednoznačně dána. Při vertikálním přenosu infekce nebo v časném dětství je HCV infekce asociována s minimálním klinickým nálezem a pomalou progresí jaterní fibrózy. Na druhé straně negativním prediktivním faktorem úspěšnosti terapie je doba od přenosu infekce k zahájení terapie a věk při přenosu infekce. Známky progredující fibrózy by měly být indikací k zahájení terapie. Kritický věk pro rozvoj fibrózy, a tedy pro zahájení terapie je 8 let věku dítěte u vertikáního přenosu nebo u přenosu v časném dětství.
U starších dětí a adolescentů je indikována terapie u potvrzené přítomnosti viru po dobu delší než 6 měsíců. V současnosti je doporučována jako standardní kombinovaná léčba dětí kombinace konvenčního rekombinantního interferonu alfa v minimální dávce 1,75 IU/m2 3× týdně s ribavirinem 15 mg/kg/den, což odpovídá u ribavirinu nejvyšší odpovědi na terapii při minimalizaci vzniku vedlejších účinků. Podle genotypu by měla být u genotypu 1 a 4 léčba vedena 48 týdnů, u genotypu 2 a 3 pak 24 až 48 týdnů podle dosažení EVR, respektive RVR.
Léčba dětí a adolescentů v České republice může být upravena odlišně v samostatném dodatku těchto doporučených postupů.
Dialyzovaní nemocní
Pacienti zařazení do pravidelného dialyzačního léčení (PDL) představují velmi speciální skupinu nemocných s chronickou HCV infekcí. Základním kritériem pro zahájení protivirové léčby pacienta v PDL je perspektiva transplantace ledviny. V ostatních případech je třeba zcela individuální přístup, zvážení závažnosti jaterního postižení, celkové prognózy nemocného a především možných rizik vyplývajících z podání protivirové léčby. Léčba pacientů v PDL by měla být vedena na pracovišti mající s touto skupinou nemocných zkušenosti.
Terapie by měla být vedena zpočátku redukovanou dávkou PEG-IFN za současné a trvalé blízké monitorace stavu pacienta. Pro PEG-IFN alfa-2a bylo prokázáno, že dávka 135 g má podobný biologický poločas jako dávka 180 μg. Optimální dávka ribavirinu pro kombinaci není jednoznačně definována. Jako bezpečné se jeví podávání RBV v dávce 200 mg denně. Na základě několika menších pilotních studií lze při dobré toleranci za frekeventní monitorace stavu pacienta uvažovat i o podání dávek vyšších.
Odmítnutí protivirové terapie pacientem není kontraindikací transplantace ledviny. Protivirová léčba podaná po provedení transplantace ledviny je spojena s vysokým rizikem rejekce a selhání štěpu, podání interferonu (konvenčního i pegylovaného) je proto v této situaci kontraindikováno.
Aktivní uživatelé drog
Drogová závislost je uvedena v Mezinárodní statistické klasifikaci nemocí a přidružených zdravotních problémů. Na pacienta drogově závislého je proto nutné pohlížet jako na člověka nemocného. Ani medicínsky ani eticky není tedy odůvodnitelné odmítnutí jakékoliv léčby uživatelům drog. Rozhodující je vždy zvážení přínosu a rizika pro individuálního pacienta.
Aktivní abúzus alkoholu a drog negativně ovlivňuje adherenci k léčbě. Drogově závislí mají častější výskyt poruch mentálního zdraví, častější psychiatrická onemocnění. Obojí dále zhoršuje adherenci k terapii. Studie léčených pacientů s aktivní drogovou závislostí ukazují srovnatelný efekt terapie chronické HCV infekce s jinými skupinami infikovaných osob. Rychlá inhibice replikace viru hepatitidy C (již během 8 hodin po aplikaci interferonu) zabraňuje dalšímu šíření infekce.
Zcela zásadní podmínkou pro zahájení terapie je motivace pacienta a jeho adherence k terapii. Zvýšení adherence lze dosáhnout pravidelnými kontrolami a aplikací pegylovaného interferonu v ordinaci 1× týdně. Předčasné ukončení terapie na základě špatné adherence je častější v prvních 12 týdnech. Kontrolou pomůcek a další intervencí u uživatelů drog lze snížit riziko reinfekce.
K léčbě musí být pacient motivován a musí spolupracovat, aby bylo možno snížit riziko rozvoje závažných nežádoucích účinků terapie. Tyto často souvisejí se současným užívání drog a kombinované protivirové terapie. Léčba drogově závislých je multifaktoriální a multioborová. Předpokládá zajištění psychiatrické intervence, sociálního šetření. Drogově závislý musí být před léčbou vyšetřen psychiatrem nebo lékařem pro léčbu závislostí. Často se jeví jako výhodné zahájení terapie antidepresivy (SSRI) nejméně 14 dní před zahájením terapie PEG-IFN a RBV. K uživatelům drog musí být vždy individuální přístup.
Pacienti na substituční léčbě jsou považováni za pacienty s kontrolovaným psychiatrickým onemocněním. Postup, diagnostika a terapie virové hepatitidy C u spolupracujícího pacienta, u pacienta s aktivní drogovou závislostí (nebo na substituční terapii), je shodný s doporučeným postupem u pacientů bez závislosti.
Obrázek 3 ukazuje terapeutický algoritmus pro aktivní uživatele drog.
Obr. 3. Terapeutický algoritmus pro aktivní uživatele drog 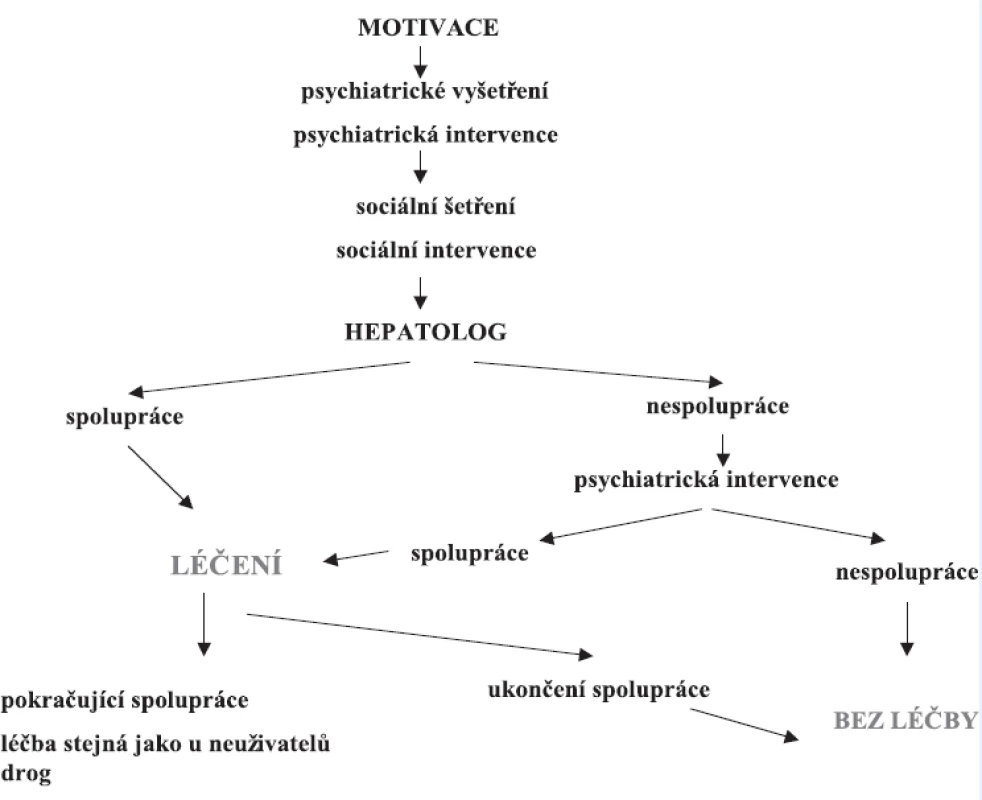
Pacienti s koinfekcí HCV + HIV
Základní fakta
- HIV negativně ovlivňuje průběh akutní i chronické HCV infekce. Pacienti HIV pozitivní s chronickou infekcí HCV mají 3× vyšší riziko rozvoje jaterní cirhózy nežli osoby HIV negativní. Vyšší riziko je i pro rozvoj hepatocelulárního karcinomu.
- Jaterní choroby, zejména vzniklé v souvislosti s chronickou HCV infekcí jsou v současnosti nejčastější příčinou úmrtí mezi HIV pozitivními pacienty.
- HIV/HCV koinfikované osoby mají významně vyšší virémii nežli osoby infikované jenom HCV.
- Hladina CD4 pozitivních T-buněk je nejspolehlivějším prediktorem progrese jaterního postižení u osob HIV/HCV pozitivních. Dalšími predikčními faktory jsou: pohlaví, trvání HCV infekce a konzumace alkoholu.
- Přes možné hepatotoxické vlivy vysoce aktivní antiretrovirové terapie (HAART) se zdá, že její podání výrazně zpomaluje progresi jaterního postižení u HCV/HIV osob. Všem koinfikovaným osobám, by proto některý z režimů HAART měl být podán.
- Data o průběhu HIV infekce u koinfikovaných osob, tj. jak průběh HIV ovlivňuje HCV infekce, nejsou dosud jednoznačná a nelze z nich dělat žádné závěry.
Diagnóza HCV/HIV koinfekce
Všechny osoby HIV pozitivní by měly být vyšetřeny na HCV infekci. Zde je třeba myslet na skutečnost, že část osob s HIV infekcí (a především s nízkým počtem CD4 buněk) je anti-HCV negativní, nebo že titr anti-HCV je minimální, a je proto neprokazatelný. U všech HIV pozitivních osob je tedy správné uvažovat vždy o vyšetření sérové HCV RNA metodou PCR. U všech osob HIV pozitivních, u kterých je sérová HCV RNA negativní (zejména u těch, které jsou přitom anti-HCV pozitivní), je třeba vyšetření několikrát opakovat.
Jaterní biopsie se týkají stejná doporučení jako u HIV negativních osob. Vzhledem k vyššímu riziku závažnějšího jaterního postižení je u koinfikovaných osob jaterní biopsie jednoznačně indikována. Všem osobám HIV pozitivním by měla být doporučena vakcinace proti HBV (pokud jsou HBsAg a anti-HBs negativní) a vakcinace proti viru hepatitidy A (HAV). Samozřejmostí je minimalizace expozice všem ostatním hepatotoxickým vlivům (zejména alkoholu).
Terapie
Standardním terapeutickým postupem je kombinace PEG-IFN a ribavirinu v běžném dávkování jako u osob HIV negativních. Kombinovaná terapie chronické HCV infekce při koinfekci HIV je plně indikována u pacientů s normálním počtem CD4+, i když SVR je dosahováno méně často (ve 20–44 % případů) než u samotné infekce HCV. Častější je výskyt vedlejších účinků terapie.
Ribavirin je inhibitorem IMPDH (inozin monofosfát dehydrogenázy), proto je kontraindikovaná kombinace s purinovým analogem didanosinem. Současná terapie ribavirinem a didanosinem zvyšuje mitochondriální toxicitu, může vést k pankreatitidě, k laktátové acidóze a k dekompenzaci jaterní cirhózy. Terapie stavudinem (d4T) také zvyšuje toxicitu. Současná terapie se zidovudinem zvyšuje riziko dřeňového útlumu (kombinace interferonu, zidovudinu a samotného HIV). Opatrnost musí být i při podání nenukleosidového inhibitoru RT efavirenzu, který zhoršuje neuropsychický efekt interferonu. U koinfekce HIV a HCV by měla být zahájena včasná cAART (kombinovaná aktivní antiretrovirová terapie, nově nahrazující přesněji původní termín HAART, vysoce aktivní antiretrovirová terapie), jež je pozitivním prediktivním faktorem úspěšnosti terapie chronické HCV infekce. Někteří experti doporučují zahájení HAART u sníženého počtu CD4 T-lymfocytů pod 500/μl. Ve stávajícím doporučeném postupu je zahájení HAART při absolutním počtu CD4 T-lymfocytů 350/μl. Zahájení HAART závisí nejen na počtu CD4 T-lymfocytů, ale i na virové náloži HIV RNA a klinické stavu pacienta.
Zhodnocení histologického nálezu z jaterní biopsie je důležité v rozhodovacím procesu terapie. Pokud je chronická virová hepatitida zjištěna v iniciálních stadiích HIV infekce, je zahájena nejdříve terapie chronické virové hepatitidy. Při absolutním počtu CD4 T-lymfocytů 200/μl je nutná nejdříve restaurace pomocí cAART a následné rozhodnutí o terapii HCV infekce. U akutní virové hepatitidy by měla být pro velké riziko rozvoje chronické HCV infekce zahájena terapie HCV vždy, a to buď monoterapií interferonem alfa, nebo kombinací PEG-INF + RBV. Nejpříznivějším predikčním faktorem efektu terapie je genotyp jiný nežli 1, nízká virová nálož a dobrá adherence k terapii. Monoterapie PEG-IFN je účinnou variantou (SVR ve 20 %) pro pacienty s některou kontraindikací či nesnášenlivostí ribavirinu.
Terapie HCV infekce má pozitivní efekt i pro pacienty bez dosažení SVR: > 30 % osob bez dosažení virologické odpovědi během léčby vykázalo významné histologické zlepšení. Zdá se tedy, že u pacientů HCV/HIV koinfikovaných s pokročilou fibrózou, či již rozvinutou jaterní cirhózou představuje udržovací terapie racionální postup. Pokles CD4+ T-buněk, ke kterému obligatorně dochází, je ve většině případů reverzibilní po skončení léčby. Snížení virové nálože HIV během terapie (antiHIV aktivitou interferonu alfa) se po ukončení terapie vrací k původním hodnotám.
U osob, u kterých i přes výše uvedené postupy dojde k progresi jaterní cirhózy, lze uvažovat o provedení jaterní transplantace. V ČR tuto indikaci nelze zatím považovat za standardní.
Pacienti s koinfekcí HCV + HBV
Neexistují zatím žádná obecně platná doporučení pro léčbu pacientů s koinfekcí HBV/HCV. Je nutný individuální přístup a postupné uplatňování nových zkušeností s léčbou těchto problémových pacientů. U naprosté většiny těchto pacientů replikace HCV tlumí replikaci HBV, proto lze zpravidla v séru prokázat HCV RNA, zatímco sérová hladina HBV DNA je pod hranicí detekovatelnosti. Pro současnou infekci potom svědčí pozitivita HBsAg, někdy jen průkaz celkových protilátek anti HBc. Podle výsledků klinických studií je kombinovaná terapie PEG-IFN a RBV u koinfikovaných pacientů stejně účinná vzhledem k infekci HCV jako při samostatné infekci HCV. K trvalému zvládnutí infekce HBV však nedochází a naopak útlum replikace HCV může vést k výraznému nárůstu replikace HBV s následnou akutní exacerbací chronické hepatitidy B s možnými závažnými klinickými následky (rychlá progrese chronické hepatitidy do jaterní cirhózy, dekompenzace cirhózy).
Pacienti se symptomatickou smíšenou kryoglobulinémií
Indikace protivirové léčby se v těchto případech řídí stejnými zásadami jako v typických případech infekce HCV. Ohledně vhodného terapeutického schématu není jednoznačné doporučení. Iniciální terapie by měla spočívat v podání standardní dvojkombinace PEG-IFN + ribavirin po dobu vždy alespoň 48 týdnů (bez ohledu na genotyp viru). Tento režim poskytuje nejvyšší naději na dosažení SVR, která podmiňuje trvalé vymizení produkce kryoglobulinů. Pokud tato léčba selže, dojde k relapsu infekce, nebo je pacient rezistentní, je možno uvažovat o dlouhodobé (v některých případech i o doživotní) monoterapii PEG-IFN, která ve většině případů vede k omezení virové replikace, a tím k omezení (či dokonce k vymizení) produkce kryoglobulinů, v důsledku čehož dochází k udržení klinické remise onemocnění.
Pacienti s chronickou HCV infekcí a s klinickou manifestací porfyria cutanea tarda
Porfyria cutanea tarda (PCT) je považována za jednu z extrahepatálních manifestací chronické HCV infekce. Mechanismus ovlivnění aktivity uroporfyrinogen dekarboxylázy (URO-D) v případě HCV infekce není dosud znám. Zdá se, že při úvahách o podání protivirové léčby se v těchto případech lze rovněž řídit stejnými zásadami jako v typických případech infekce HCV. Dosud není jasné, zda dosažení remise PCT (klinické i laboratorní) je podmínkou pro zahájení protivirové terapie. Podle současných znalostí se zdá vhodnější nejdříve dosáhnout remise PCT terapií antimalariky (např. chlorochinem) a teprve poté zahájit protivirovou terapii. Zdá se, že pouze protivirová léčba sama k navození remise PCT nevede.
Kritéria vyléčení HCV infekce
Kritériem vyléčení HCV infekce je dosažení setrvalé virologické odpovědi.
Pozn.: Z definice setrvalé odpovědi byla vypuštěna normální aktivita ALT. Zvýšená aktivita ALT může v některých případech přetrvávat, a je dána pokročilostí jaterního poškození (významná fibróza, cirhóza jater). Výše zmíněné kritérium vyléčení se proto týká pouze infekce virem hepatitidy C, nikoli vyléčení jaterního onemocnění.
Role a postavení jaterní biopsie
Jaterní biopsie před léčbou
Hlavním přínosem jaterní biopsie provedené před léčbou je poskytnutí informací o stadiu fibrózy a stupni zánětu jaterní tkáně. Oba tyto parametry jsou významnou informací jak pro lékaře, tak i samotného pacienta. Znalost histologického nálezu umožňuje s vysokou pravděpodobností identifikovat pacienty s vysokým rizikem progrese jaterního onemocnění, případně s již rozvinutou jaterní cirhózou, kteří nemusejí mít jedinou laboratorní či klinickou známku takto pokročilého jaterního onemocnění.
Jaterní biopsie je indikována u pacientů s trvale normální aktivitou ALT při chronické HCV infekci. Tito pacienti mají ve 14–40 % případů významnější nežli portální fibrózu. Osoby s takto pokročilou fibrózou jsou ve vysokém riziku progrese fibrózy bez ohledu na trvale normální biochemickou aktivitu. U osob s trvale normální biochemickou aktivitou a pokročilou fibrózou až cirhózou je indikována protivirová terapie zcela jednoznačně a jaterní biopsie je jedinou metodou, která může k tomuto rozhodnutí vést.
Jaterní biopsie je i nadále standardní součástí diagnostického procesu v případech chronické HCV infekce. V současnosti neexistuje alternativní metoda, která by byla schopna poskytnout analogické informace jinou (neinvazivní) cestou. Stanovení různých markerů fibroprodukce umožňuje stanovení pokročilých stupňů fibrózy jater, nikoli však dřívějších stadií onemocnění. Ani jiné metody (aktivita ALT, výpočet diskriminačního skóre ap.) nenahrazují histologické hodnocení aktivity v plném rozsahu.
Samotný fakt neprovedení jaterní biopsie (při kontraindikacích výkonu či při odmítnutí pacientem) nelze považovat za kontraindikaci zahájení protivirové terapie.
Jaterní biopsie po léčbě
Jaterní biopsie po ukončení terapie není standardní součástí terapeutického procesu. U pacientů se SVR lze předpokládat histologické zlepšení.
Opakování jaterní biopsie
U pacientů neléčených pro minimální stupeň jaterní fibrózy v iniciální biopsii může být opakovaná jaterní biopsie vhodným nástrojem ke zhodnocení progrese postižení. V těchto případech je doporučován interval mezi biopsiemi 4–5 let. O opakování jaterní biopsie je možno uvažovat také v případech neúspěšné terapie.
Možnosti histologického hodnocení
Základem histologického hodnocení je podrobný slovní popis se zhodnocením dle současné nomenklatury. Druhá část hodnocení spočívá v použití skórovacích systémů. Největšího rozšíření se dostalo Ishakově modifikaci původního Knodellova hodnocení a systému METAVIR (tab. 3). Použití těchto systémů umožňuje:
Tab. 3. Nejčastěji používané systémy histologického hodnocení 
- kvantitativní zhodnocení aktivity,
- odlišit grade a stage,
- posoudit progresi či naopak regresi změn u každého konkrétního pacienta,
- vzájemné srovnání různých skupin nemocných.
Dispenzarizace pacientů s infekcí virem hepatitidy C
Během léčby
Je doporučováno následující schéma laboratorních a klinických kontrol (v týdnech): 0, 2, 4, 8 a 12. V dalším období lze intervaly individualizovat podle dosaženého účinku a tolerance. Intervaly mezi klinickými a laboratorními kontrolami by však neměly přesáhnout 8 týdnů.
Po ukončení léčby
Není jednoznačné doporučení k dispenzarizaci pacientů po skončení léčby. Během prvních 3 měsíců po skončení terapie je nutné zkontrolovat pacienta z pohledu odeznění nežádoucích účinků terapie (anémie, leukopenie apod.). K posouzení odpovědi na léčbu je indikováno vyšetření sérové HCV RNA 24 týdnů po skončení terapie.
Dosáhne-li pacient setrvalé virologické odpovědi, je v nekomplikovaných případech indikována klinická i laboratorní kontrola v intervalu 1 roku.
Pacienti s trvale normální aktivitou ALT
Tito pacienti, pokud nejsou léčeni, by měli být dispenzarizováni a pravidelně kontrolováni v intervalu 6 měsíců.
Pacienti s jaterní cirhózou při chronické HCV infekci
Dispenzarizace nemocných s jaterní cirhózou se neliší od doporučení pro jiné etiologie jaterní cirhózy.
Vyšetřování sérové HCV RNA
Kvalitativní stanovení
Kvalitativní vyšetření je indikováno:
- v rámci prvotního vyšetření při ověřené pozitivitě anti-HCV,
- v odůvodněných případech i při anti-HCV negativitě (koinfekce HCV/HIV, pacienti v PDL apod.),
- v průběhu léčby ve 24. týdnu terapie a ve 48. týdnu terapie,
- po skončení terapie ve 24. týdnu,
- dále kdykoliv při podezření na breakthrough fenomén.
Ve všech výše zmíněných případech po pozitivním kvalitativním vyšetření může následovat kvantitativní stanovení virémie.
Kvantitativní stanovení
Kvantitativní vyšetření je indikováno:
- před zahájením protivirové léčby,
- ve 4., 8. a 12. týdnu léčby.
Genotypizace HCV
Genotypizace HCV je indikována před zahájením protivirové léčby.
Vakcinace proti ostatním virovým infekcím jater
Všichni pacienti s chronickou HCV infekcí by měli být očkováni proti virové hepatitidě A. Séronegativní pacienti (tj. HBsAg a anti-HBs negativní) by měli být očkováni i proti virové hepatitidě B.
doc. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN
U Vojenské nemocnice 1/1200, 169 02 Praha 6
e-mail: petr. petr.urbanek@uvn.cz
Zdroje
1. Strader, D. B., Wright, T., Thomas, D. L. et al.: Diagnosis, Management, and treatment of hepatitis C. AASLD Practice Guideline, Hepatology, 2004, 39, s. 1147–1171.
2. Manns, M. P., McHutchison, J. G., Gordon, S. C. et al.: PEG-interferon alfa-2b in combination with ribavirin compared to interferon alfa 2b plus ribavirin for initial treatment of chronic hepatitis C. Lancet, 2001, 358, s. 958–965.
3. Fried, M. W., Shiffman, M. L., Reddy, K. R. et al.: Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N. Engl. J. Med., 2002, 347, s. 975–982.
4. Hadziyannis, S. J., Sette, H., Morgan, T. R. et al.: Peginterferon alfa-2a (40kilodaltons) and ribavirin combination therapy in chronic hepatitis C: randomized study of the effect of treatment duration and ribavirin dose. Ann. Intern. Med., 2004, 140, s. 346–355.
5. Zeuzem, S., Buti, M., Ferenci, P. et al.: Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J. Hepatol., 2006, 44, s. 97–103.
6. Zeuzem, S., Pawlotsky, J.-M., Lukasiewicz, E. et al.: International, multicenter, randomized, controlled study comparing dynamically individualized versus standard treatment in patients with chronic hepatitis C. J. Hepatol., 2005, 43, s. 250–257.
7. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control and Prevention. MMWR Recomm. Rep., 1998, 47 (RR-19), s. 1–39.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV)
- Pokles prevalence infekce Helicobacter pylori v České republice
- Lékařská etika a etikoterapie
- Antley-Bixlerův syndrom nebo POR deficience?
- Jednonukleotidová substituce c.645+32C>T v genu APC je nepatogenním polymorfismem s výskytem přibližně u 16 % české populace
- Nahradí nový lék kortikosteroidy?
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC1. Komorbidita
- Alkoholový erytém
- Vliv psychického stresu na zdravotní stav obviněného v průběhu trestního řízení
- Proč Čech Čecha málo cituje? Existuje česká „národní povaha“?
- Deset let nového anatomického názvosloví
- Course of Crohn’s disease prior to establishment of the diagnosis
- CD8+ T lymphocytes and leukotriene B4: novel interactions in the persistence and progression of asthma
- Epithelium dysfunction in asthma
- MUDr. Jan Beránek, CSc.
- Spolek lékařů českých v Praze
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antley-Bixlerův syndrom nebo POR deficience?
- Deset let nového anatomického názvosloví
- Vliv psychického stresu na zdravotní stav obviněného v průběhu trestního řízení
- Lékařská etika a etikoterapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



