-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Srovnání nákladů na doplňovanou anestezii vedenou s oxidem dusným a bez něj ve Fakultní nemocnici Olomouc
Comparison of the cost of balanced anaesthesia maintained with or without nitrous oxide at a university hospital
Objective:
To compare the cost of balanced anaesthesia with or without nitrous oxide.Design:
A prospective, clinical, randomized, non-blinded study.Setting:
Department of anaesthesiology, university hospital.Materials and methods:
Following local ethics committee approval and after obtaining informed consent, patients scheduled for elective surgery under balanced anaesthesia with tracheal intubation were studied. The patients were randomized into two groups with different anaesthetic gases used. In Group AIR, air/oxygen/sevoflurane was administered; in Group N2O, nitrous oxide/oxygen/sevoflurane was used. The cost of the anaesthetic gases and sevoflurane was determined and the Mann-Whitney test was used to compare the expenses in the two groups. The results were expressed as median and quartiles; P value less than 0.05 was considered statistically significant.Results:
In Group AIR (10 males, 28 females) and Group N2O (7 males, 35 females), the demographics and duration of surgery were similar. The inhalational component of anaesthesia was more expensive in Group AIR (p = 0.005), due to higher consumption of sevoflurane (p = 0.001). There was no difference in the cost of oxygen between the groups (p = 0.138). Less sufentanil was used in Group N2O (p = 0.047). The consumption of the remaining anaesthetic agents (midazolam, propofol) and neuromuscular blocking agents (cisatracurium, rocuronium) was equal in Group AIR and Group N2O.Conclusion:
Using nitrous oxide as part of balanced inhalational anaesthesia reduced the cost of anaesthesia.Keywords:
pharmaco-economics – balanced anaesthesia – nitrous oxide – sevoflurane
Autoři: Adamus Milan 1; Koutná Jiřina 1; Hrabálek Lumír 2; Konupčíková Kateřina 1; Fischerová Lucie 1; Frančáková Jana 1
Působiště autorů: Klinika anesteziologie a resuscitace, Lékařská fakulta Univerzity Palackého v Olomouci, Fakultní nemocnice Olomouc 1; Neurochirurgická klinika, Lékařská fakulta Univerzity Palackého v Olomouci, Fakultní nemocnice Olomouc 2
Vyšlo v časopise: Anest. intenziv. Med., 22, 2011, č. 2, s. 90-94
Kategorie: Anesteziologie - Původní práce
Souhrn
Cíl studie:
Srovnání ceny doplňované anestezie s oxidem dusným a bez něj.Typ studie:
Prospektivní, klinická, randomizovaná studie bez zaslepení.Pracoviště:
Klinika anesteziologie a resuscitace fakultní nemocnice.Materiál a metoda:
Po schválení Etickou komisí FN a LF UP v Olomouci a získání informovaného souhlasu jsme vyšetřovali nemocné, kteří byli indikováni k operaci v doplňované anestezii s nutností tracheální intubace a svalové relaxace. Nemocní byli rozděleni do dvou skupin, které se lišily složením podávané čerstvé směsi anestetických plynů (ve skupině AIR byl použit vzduch, kyslík a sevofluran, ve skupině N2O oxid dusný, kyslík a sevofluran). Stanovili jsme cenu spotřebovaných plynů a sevofluranu a skupiny porovnali nepárovým neparametrickým testem (Mannovým-Whitneyovým). Výsledky jsou uvedeny jako medián a kvartily, za statisticky významnou jsme považovali hodnotu p < 0,05.Výsledky:
Skupiny AIR (10 mužů, 38 žen) a N2O (7 mužů, 35 žen) se nelišily ani délkou operace, ani demografickými parametry. Náklady na inhalační složku anestezie byly vyšší ve skupině AIR (p = 0,005), tento rozdíl byl podmíněn především vyšší spotřebou sevofluranu (p = 0,001). Náklady na kyslík byly podobné v obou skupinách (p = 0,138), ve skupině N2O byla nižší spotřeba sufentanilu (p = 0,047). Spotřeba ostatních anestetik (midazolam, propofol) a svalových relaxancií (cisatrakurium, rokuronium) byla obdobná v obou skupinách.Závěr:
Přidání oxidu dusného do nosné směsi plynů redukuje náklady při doplňované anestezii.Klíčová slova:
farmakoekonomika – doplňovaná anestezie – oxid dusný – sevofluranÚvod
Ekonomické souvislosti jsou zřejmé ve všech oblastech života naší společnosti, anesteziologii nevyjímaje. Zavádění nových metod, farmak a sofistikovaného přístrojového vybavení je většinou spojeno s nárůstem ceny anesteziologické péče. Někdy je obtížné určit, zda použitím nákladnějšího moderního postupu skutečně dostáváme natolik vyšší kvalitu, která by zvýšení ceny jednoznačně ospravedlnila [1].
Současná doplňovaná anestezie (balanced anaesthesia) je zavedeným a bezpečným postupem, z kterého pacienti každodenně profitují. Úhrada zdravotními pojišťovnami však v mnoha směrech nezohledňuje, které látky jsme během anestezie podali. Pokud se budeme rozhodovat mezi dvěma postupy doplňované anestezie, které jsou z medicínského hlediska pro daného nemocného vhodné a přijatelné, ale liší se náklady, pak je logické použít levnější z nich.
Cílem práce je porovnání nákladů na doplňovanou anestezii s podáním oxidu dusného a bez něj.
Metodika
Klinická, randomizovaná, prospektivní studie bez zaslepení. Po schválení Etickou komisí FN a LF UP v Olomouci a získání informovaného souhlasu jsme vyšetřovali nemocné, kteří byli indikováni k operaci v celkové anestezii, s nutností tracheální intubace a svalové relaxace. Do studie byli zařazeni nemocní ve věku 18–65 let, ASA klasifikace fyzického stavu 1–3, podstupující operační výkon všeobecné a plastické chirurgie.
Nemocní byli rozděleni (hod kostkou) do dvou skupin, které se lišily složením podávané čerstvé směsi plynů. Ve skupině AIR byl v nosné směsi použit vzduch a kyslík, nemocní skupiny N2O dostali oxid dusný a kyslík. K podání anestezie jsme použili přístroj ADU (Anaesthesia Delivery Unit, GE Medical), kromě odlišného složení směsi plynů byla všem nemocným podána stejná celková anestezie.
Premedikace obsahovala diazepam 10 mg p. o. hodinu před plánovaným začátkem anestezie. Ke sledování a záznamu všech funkcí během anestezie jsme použili přístroj Datex-Ohmeda S/5™ Anaesthesia Monitor s příslušnými moduly (EKG křivka, NIBP [neinvazivní krevní tlak], pulzní oxymetrie, složení dechové směsi v inspiriu a na konci exspiria [O2, CO2, sevofluran, případně N2O], spirometrie).
Před úvodem do anestezie jsme u nemocných zajistili nitrožilní vstup zavedením periferní kanyly velikosti 18 nebo 20 G a zavedli infuzi (Plasmalyte roztok, 1 000 ml, Viaflo, Baxter). Zahájili jsme podávání kyslíku obličejovou maskou (preoxygenace 6 l . min-1 po dobu 3 minut) a intravenózně podali premedikaci – midazolam (Midazolam Torrex, Torrex Chiesi Pharma, 1–5 mg) a sufentanil (Sufentanil Torrex, Torrex Chiesi Pharma, 0,2–0,3 μg . kg-1). Po minutě jsme během 30 s aplikovali propofol (Propofol 1% MCT/LCT „Fresenius”, Fresenius Kabi) v dávce 2 mg . kg-1. Během nástupu anestezie jsme spontánní dýchání prohlubovali manuální ventilací přes obličejovou masku a postupně přešli na ventilaci řízenou. Při nedostatečné hloubce anestezie (přítomnost víčkového reflexu) jsme doplňovali propofol dávkou 0,5 mg . kg-1 (max. do 3 mg . kg-1). K usnadnění tracheální intubace jsme aplikovali nedepolarizující svalové relaxans (rokuronium [Esmeron®, N.V. Organon, 0,5 mg . kg-1] nebo cisatrakurium [Nimbex™, GlaxoSmithKline, 0,15 mg . kg-1]). U žen jsme volili rourku velikosti 7,0 mm, u mužů 8,0 mm, vždy s obturační manžetou. Rourka byla v místě manžety potřena lubrikačním gelem (KY-gel, Johnson and Johnson).
Ve skupině N2O jsme anestezii udržovali směsí kyslíku, oxidu dusného a sevofluranu (Sevorane®, Abbott), ve skupině AIR jsme podávali vzduch s kyslíkem a sevofluranem. Parametry umělé plicní ventilace jsme nastavili k dosažení hodnoty ETCO2 mezi 4,7–5,0 kPa. Přívod inhalačního anestetika (sevofluran, případně s N2O) jsme regulovali k dosažení jednonásobku MAC (minimální alveolární koncentrace). Celkový příkon čerstvé směsi plynů byl nastaven pod 1 l . min-1 s inspirační frakcí kyslíku (FiO2) 0,4.
Analgetickou složku anestezie jsme zajistili podáním doplňujících dávek sufentanilu (0,1–0,2 μg . kg-1) podle klinického stavu nemocného. Pokud to vyžadoval průběh operace, další svalovou relaxaci jsme udržovali doplňujícími dávkami rokuronia (5–10 mg) nebo cisatrakuria (2 mg). Před koncem anestezie a extubací jsme po vysazení sevofluranu (případně oxidu dusného) podali dekurarizaci (neostigmin, Syntostigmin, Hoechst-Biotika, 0,04 mg . kg-1) společně s parasympatolytikem (atropin, Atropin Biotika, Hoechst - -Biotika, 0,015 mg . kg-1).
Zdrojem medicinálních plynů (O2, N2O, vzduch) byl centrální rozvod. Ceny použitých plynů jsme získali z materiálů provozního oddělení FN Olomouc, cenu farmak podaných během anestezie z nemocniční lékárny FN Olomouc. Pomocí přístroje ADU jsme určili množství plynů, které byly použity v průběhu celé anestezie, spotřebu jsme přepočetli na jednu minutu a minutovou cenu vyjádřili v korunách.
Spotřebu sevofluranu jsme stanovili pro každého nemocného vážením odpařovače před zahájením anestezie a po jejím ukončení. K tomu jsme použili digitální váhu (SKS 4000, Sencor®) s přesností na 1 g. Každé vážení jsme provedli třikrát a pro výpočty použili medián zjištěných hodnot.
Z anesteziologického dotazníku jsme zjistili demografická data nemocných – věk, hmotnost, výšku, klasifikaci fyzického stavu podle ASA a vypočítali BMI (body mass index). Z anesteziologického záznamu jsme poznamenali délku anestezie a množství podaných látek (midazolam, propofol, sufentanil a NMBA – neuromuscular blocking agent).
Statistické zpracování
Získané údaje jsme zanesli do tabulkového procesoru Excel (Microsoft® Office Excel® 2007, SP2) a po ukončení sběru dat importovali do programu InStat. Ke statistickému zpracování dat jsme použili počítačový program GraphPad InStat verze 3.10 pro Windows (GraphPad Software, San Diego, California, USA). Získaná data jsme popsali pomocí četností a pro porovnání rozdílů byly podle povahy dat použity Fisherův přesný test nebo chí-kvadrát test, popř. s korekcí podle Yatese. Rozložení numerických dat jsme posoudili Kolmogorovým-Smirnovovým testem. Data, která nerespektovala normální rozložení, jsme popsali pomocí mediánu a horního a dolního kvartilu (25. a 75. percentilu) a skupiny porovnali nepárovým neparametrickým testem (Mannovým-Whitneyovým). Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
Ceny medicinálních plynů ve FN Olomouc: kyslík 0,0145 Kč za litr, oxid dusný 0,226 Kč za litr, vzduch 0,011 Kč za litr. Cena sevofluranu (Sevorane®, Abbott) 14,77 Kč za gram.
Do studie jsme zařadili 80 nemocných (38 ve skupině AIR, 42 ve skupině N2O). Skupiny nemocných se nelišily ani demografickými údaji, ani délkou operace – tabulka 1.
Tab. 1. Demografické údaje nemocných a délka operace 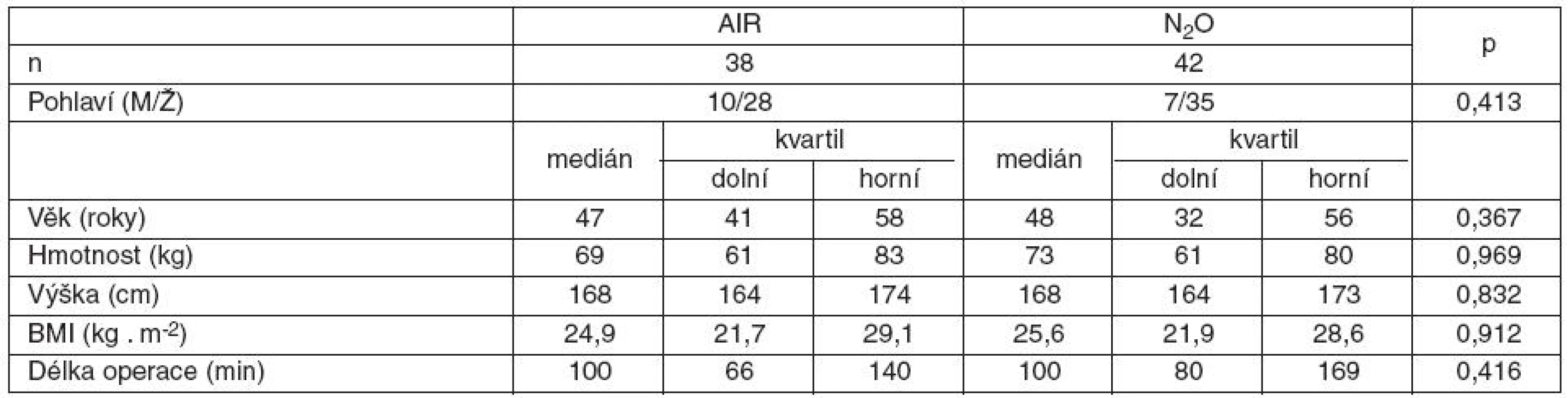
Ceny inhalační složky anestezie (kyslíku, oxidu dusného, vzduchu a sevofluranu) v korunách za minutu udává tabulka 2. Cena spotřebovaného kyslíku byla ve skupinách AIR a N2O podobná (p = 0,138), ve skupině AIR byla minutová spotřeba i cena sevofluranu vyšší než ve skupině N2O (p = 0,001). Rovněž souhrnná minutová cena inhalační složky byla větší ve skupině AIR než ve skupině N2O (p = 0,005), přidáním oxidu dusného (skupina N2O) poklesla cena inhalační složky o 45 % ve srovnání se skupinou AIR.
Tab. 2. Cena plynů a sevofluranu (Kč . min-1) při „low-flow“ anestezii 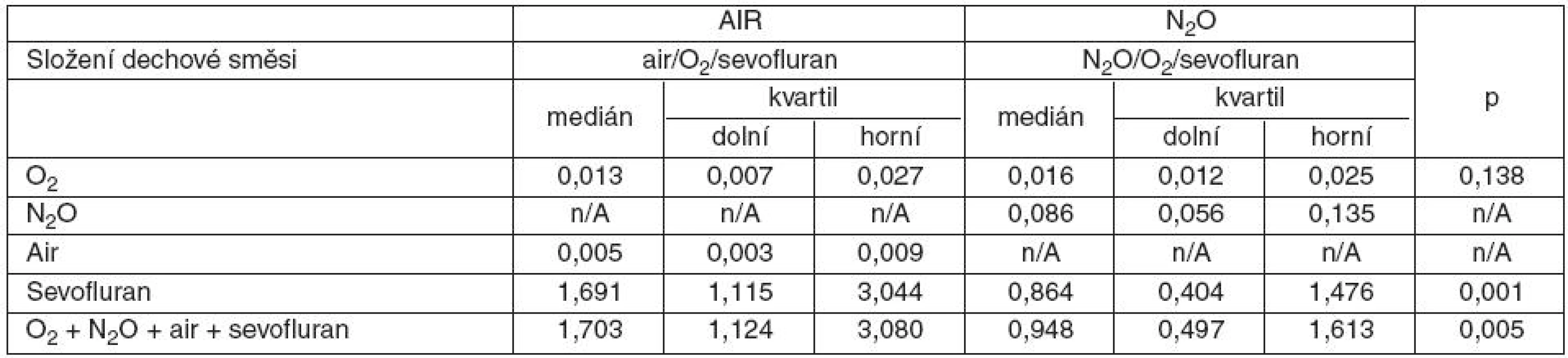
O2 – kyslík, N2O – oxid dusný, air – vzduch Obě skupiny se nelišily četností podaných NMBA (p = 0,488), ve skupině AIR bylo 68 % nemocných podáno cisatrakurium a 32 % rokuronium, ve skupině N2O 60 % cisatrakurium a 40 % rokuronium. Ve skupině AIR byla vyšší spotřeba sufentanilu (p = 0,047). Spotřeba ostatních látek použitých během anestezie (midazolam, propofol, NMBA) byla v obou skupinách podobná – tabulka 3.
Tab. 3. Spotřeba midazolamu, propofolu, sufentanilu a svalových relaxancií ve skupinách AIR a N2O 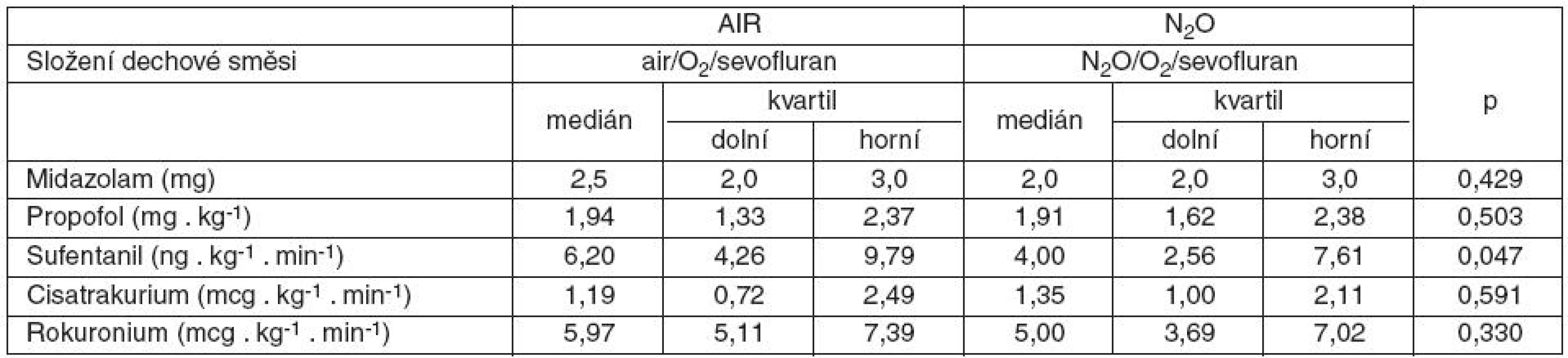
O2 – kyslík, N2O – oxid dusný, air – vzduch Diskuse
Prokázali jsme nižší cenu inhalační složky doplňované anestezie ve skupině N2O (O2 + N2O + sevofluran) ve srovnání se skupinou AIR (O2 + vzduch + sevofluran), v níž byl oxid dusný nahrazen vzduchem (medián 0,948 vs 1,703 Kč za minutu, p = 0,005). Množství podaného sufentanilu bylo větší ve skupině AIR než N2O (6,20 vs 4,0 ng . kg-1 . min-1), rozdíl však byl na hranici statistické významnosti (p = 0,047).
Skupiny AIR a N2O se kromě obsahu vzduchu a oxidu dusného lišily pouze spotřebou sevofluranu a sufentanilu (viz tab. 2 a 3). Rozhodující složkou, která ovlivnila cenu inhalační složky anestezie, byl sevofluran. Oxid dusný byl sice 20krát dražší než vzduch (0,226 vs 0,011 Kč za litr), tento rozdíl však nevyvážil zvýšené náklady na sevofluran ve skupině AIR (1,691 vs 0,864 Kč za minutu ve skupině N2O, p = 0,001).
Oxid dusný byl syntezován v roce 1772 (Joseph Pristley). V roce 1800 si jeho analgetického účinku všiml anglický fyzik a chemik Humphry Davy a popsal i možnost využití N2O při chirurgických výkonech [2]. V lékařské praxi byl oxid dusný poprvé použit v roce 1844, kdy ho dentista Horace Wells podal k tlumení bolesti při extrakci zubu. Od té doby se oxid dusný stal základní látkou pro inhalační analgezii i doplňkem celkové anestezie [3], a byl dokonce považován za látku bez nežádoucích účinků.
Názor o naprosté neškodnosti oxidu dusného podaného při celkové anestezii byl zpochybněn před více než 50 lety [3–5] a v mnoha následujících studiích byly popsány jeho další nežádoucí účinky [5–7]. N2O inhibuje methionin syntetázu a může vyvolat megaloblastickou anémii [8], má vliv na rozvoj myelodegenerativních onemocnění, především u dětí [8, 9] a ovlivňuje imunitní systém [10]. Podání oxidu dusného může zvyšovat hladinu homocysteinu s následným vyšším rizikem myokardiálního poškození [11, 12]. Data o vlivu na reprodukční systém jsou rozporuplná, především pro nemožnost adekvátní randomizace nemocných [13]. Průnik oxidu dusného do vzduchem naplněných uzavřených dutin v organismu může vést k nárůstu tlaku v těchto dutinách (pneumotorax, pneumocefalus, vzduchová embolie, pneumoperitoneum). Oxid dusný difunduje do vzduchem naplněné obturační manžety tracheální rourky. Nárůst tlaku v manžetě s následným zvětšením jejího objemu může ischemizovat sliznici průdušnice a být příčinou pooperačních bolestí v krku [14] nebo později i benigní stenózy trachey. Podání N2O zvyšuje výskyt pooperační nevolnosti a zvracení [15].
Vnitřním mechanismem anesteziologického přístroje ADU lze stanovit spotřebu plynů (O2, N2O, vzduch) v litrech za minutu. U sevofluranu se však měřená spotřeba mění skokově po 5 ml, což je hodnota málo přesná pro účel naší studie. Pro určení spotřeby sevofluranu jsme proto použili vážení odpařovače před zahájením a po ukončení anestezie. Tento postup potenciálně prodlužoval čas mezi navazujícími anesteziemi, reálné prodlení však bylo zanedbatelné a nepochybně daleko významněji ho ovlivňují jiné faktory [16].
Většina farmakoekonomických studií je zatížena četnými metodologickými nedostatky [1], týká se to i naší práce. Studie byla provedena během provozu centrálních operačních sálů ve FN Olomouc a nepoužili jsme zaslepení. Všechny anestezie podávaly dvě spoluautorky této studie (J. F. a J. K.), které byly obeznámeny s její podstatou. Hloubka anestezie byla posuzována pouze podle klinických známek, bez objektivizace např. pomocí bispektrálního indexu nebo relaxometrie. Na druhou stranu tento způsob vedení anestezie odpovídá praxi na našem pracovišti i naprosté většině českých anesteziologických oddělení [17].
Studie má další omezení. Z provozních důvodů jsme nesledovali rozdíly mezi skupinami v pooperační analgezii (spotřebě analgetik nebo době do podání první dávky analgetika po operaci). Tyto parametry mohly být ovlivněny peroperačním podáním oxidu dusného i nižší dávkou sufentanilu ve skupině N2O. Výskyt pooperační nevolnosti a zvracení (PONV) nebyly předmětem studie. Podle našich předchozích výsledků [15] však nelze vyloučit, že četnost PONV byla vyšší ve skupině N2O.
K výpočtu ceny spotřebovaných plynů jsme použili údaje, které poskytlo provozní oddělení naší nemocnice. Kalkulace nezahrnuje fixní náklady (např. náklady na stavbu a udržování rozvodu centrálních plynů). Tyto údaje mohou být (a pravděpodobně i jsou) odlišné na jiných anesteziologických pracovištích. Přenášet naše výsledky na data získaná za jiných podmínek je proto obtížné.
Během každé anestezie jsme sledovali celkovou spotřebu kyslíku. Minutová spotřeba tak byla ovlivněna vysokou spotřebou při preoxygenaci a vyvádění nemocného z anestezie. Tato skutečnost ovlivnila minutovou spotřebu O2 především u kratších anestezií.
Společně s volatilními anestetiky přispívá oxid dusný ke znečištění ovzduší na operačních sálech a působí klimatické změny. V současnosti uváděný vliv anestetik na ovzduší je však v kontextu jiných faktorů velmi malý a neovlivňuje rozhodování anesteziologů, zda inhalační anestezii použít [18–20].
Výhody oxidu dusného jsou prověřeny časem. Jeho analgetické účinky, minimální dráždivost a prokazatelná redukce minimální alveolární koncentrace (MAC) používaných inhalačních anestetik jsou nepominutelné. Studie Czech Anesthesia Day 2010 [17] prokázala v České republice vysoké použití oxidu dusného. Je podáván u 58,3 % všech celkových anestezií a v tuzemské praxi má stále své pevné místo.
Závěr
Oxid dusný se bezpečně a s dobrým efektem používá k analgezii a anestezii déle než 160 let a současný stav poznání (Evidence-based Medicine) neospravedlňuje jeho vyřazení z anesteziologické praxe. Oba způsoby doplňované anestezie, použité v naší studii, jsou postupy lege artis. Pokud respektujeme kontraindikace oxidu dusného a akceptujeme-li jeho potenciální nežádoucí účinky, lze pro celkovou anestezii použít každý z nich. Přidání oxidu dusného do nosné směsi plynů redukuje spotřebu sevofluranu (v menší míře i sufentanilu) a výsledná cena plynné směsi podané během anestezie je nižší než při použití vzduchu.
Došlo dne 4. 1. 2011.
Přijato do tisku dne 3. 2. 2011.Adresa pro korespondenci:
MUDr. Jana Frančáková
Třešňová 23
779 00 Olomouc
e-mail: jfran@centrum.cz
Zdroje
1. Doležal, T., Prokeš, M., Sechser, T., Skoupá, J., Švihovec, J., Tichopád, A. Základy farmakoekonomiky pro lékaře, lékárníky a další pracovníky ve zdravotnictví. 1. vydání. Praha: ČFES, 2007, 99 s. ISBN 978-80-254-0837-7.
2. Nitrous oxide. From Wikipedia, the free encyclopedia [online]. Cit. 20. 12. 2010. Dostupný na www: http://en.wikipedia. org/wiki/Nitrous_oxide
3. Pasternak, J. J., Lanier, W. L. Is nitrous oxide use appropriate in neurosurgical and neurologically at-risk patients? Curr. Opin. Anaesthesiol., 2010, 23, p. 544–550.
4. Lassen, H. C., Henriiksen, E., Neukirch, F., Kristensen, H. S. Treatment of tetanus; severe bone-marrow depression after prolonged nitrous-oxide anaesthesia. Lancet, 1956, 270, p. 527–530.
5. Sanders, R. D., Weimann, J., Maze, M. Biologic effects of nitrous oxide: a mechanistic and toxicologic review. Anesthesiology, 2008, 109, p. 707–722.
6. Leslie, K., Myles, P. S., Chan, M. T., Forbes, A., Paech, M. J., Peyton, P., Silbert, B. S., Williamson, E. Nitrous Oxide and Long-Term Morbidity and Mortality in the ENIGMA Trial. Anesth. Analg., 2010, [Epub ahead of print]. doi:10.1213/ANE.0b013e3181f7e2c4.
7. Myles, P. S., Leslie, K., Peyton, P., Paech, M., Forbes, A., Chan, M. T., Sessler, D., Devereaux, P. J., Silbert, B. S., Jamrozik, K., Beattie, S., Badner, N., Tomlinson, J., Wallace, S.; ANZCA Trials Group. Avoidance of nitrous oxide for patients undergoing major surgery: a randomized controlled trial. Anesthesiology, 2007, 107, p. 221–231.
8. Reynolds, E. Vitamin B12, folic acid, and the nervous system. Lancet Neurol., 2006, 5, p. 949–960.
9. McNeely, J. K., Buczulinski, B., Rosner, D. R. Severe neurological impairment in an infant after nitrous oxide anesthesia. Anesthesiology, 2000, 93, p. 1549–1550.
10. Schneemilch, C. E., Hachenberg, T., Ansorge, S., Ittenson, A., Bank, U. Effects of different anaesthetic agents on immune cell function in vitro. Eur. J. Anaesthesiol., 2005, 22, p. 616–623.
11. Badner, N. H., Beattie, W. S., Freeman, D., Spence, J. D. Nitrous oxide-induced increased homocysteine concentrations are associated with increased postoperative myocardial ischemia in patients undergoing carotid endarterectomy. Anesth. Analg., 2000, 91, p. 1073–1079.
12. Nygard, O., Nordrehaug, J. E., Refsum, H., Ueland, P. M., Farstad, M., Vollset, S. E. Plasma homocysteine levels and mortality in patients with coronary artery disease. N. Engl. J. Med., 1997, 337, p. 230–236.
13. Mazze, R. I., Kallen, B. Reproductive outcome after anesthesia and operation during pregnancy: A registry study of 5405 cases. Am. J. Obstet. Gynecol., 1989, 161, p. 1178–1185.
14. Dostálová, K., Doubravská, L., Fritscherová, Š., Pospíšilová, D., Zapletalová, J., Adamus, M. Pooperační bolesti v krku. Anest. intenziv. med., 2010, 21, p. 172–178.
15. Doubravska, L., Dostalova, K., Fritscherova, S., Zapletalova, J., Adamus, M. Incidence of postoperative nausea and vomitong in patients at a university hospital. Where are we today? Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub., 2010, 154, 1, p. 69–76.
16. Černý, V., Cvachovec, K., Ševčík, P., Vítková, K., Minarčíková, P. Gavulová, E., Dostálová, V., Schreiberová, J., Novotný, T., Machalová, G., Brujevič, J., Silová, X., Stozsková, A., Parnicová, E. Doba úvodu a zotavení z celkové anestezie – prospektivní studie. Anest. intenziv. Med., 2007, 20, p. 236–240.
17. Černý, V., Adamus, M., Cvachovec, K., Ševčík, P., Herold, I. Anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie. Anest. intenziv. Med., 2011, 22, 1, s. 5–12.
18. Shine, K. P. The global warming potential – the need for an interdisciplinary retrial: an editorial comment. Climatic Change, 2009, 96, p. 467–472.
19. Shine, K. P. Climate effect of inhaled anaesthetics. Br. J. Anaesth., 2010, 105, p. 731–733.
20. Sulbaek Andersen, M. P., Sander, S. P., Nielsen, O. J., Wagner, D. S., Sanford, T. J., Wallington, T. J. Inhalation anaesthetics and climate change. Br. J. Anaesth., 2010, 105, p. 760–766.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2011 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Vplyv kyseliny tranexámovej na mortalitu, cievne okluzívne príhody a transfúzie krvi u pacientov s veľkým poúrazovým krvácaním (CRASH-2) – randomizovaná, placebom kontrolovaná štúdia*
- Přehled nejvýznamnějších změn v Doporučených postupech pro neodkladnou resuscitaci
- Aký bude dopad súdnych žalôb na prácu lekárov?
-
Zápis ze schůze výboru ČSIM
Ostrava 25. 1. 2011 - Nový výbor ČSARIM pro období 2011–2014
- Programové prohlášení nového výboru ČSARIM
- Nová Guidelines 2010 pro kardiopulmonální resuscitaci (KPR)
- Svalová relaxace během celkové anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie
- Stanovisko Ústředí VZP ČR pro hodnocení umělé plicní ventilace
- Srovnání nákladů na doplňovanou anestezii vedenou s oxidem dusným a bez něj ve Fakultní nemocnici Olomouc
- Perioperační optimalizace hemodynamiky*
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled nejvýznamnějších změn v Doporučených postupech pro neodkladnou resuscitaci
- Perioperační optimalizace hemodynamiky*
- Svalová relaxace během celkové anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie
- Aký bude dopad súdnych žalôb na prácu lekárov?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



