-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
Treatment of liver cirrhosis – actually possibility of ambulant internist
There are 40 000–60 000 patients with cirrhosis in the Czech Republic. 2 000 die of this disease yearly. This group of patients needs a complex treatment and it is mostly an internist cooperating with other specialists. The most important for an ambulant internist is to diagnose the disease as soon as possible and start with treatment of chronic liver disease that could lead to a cirrhosis. It means especially chronic viral hepatitis, alcoholic or non-alcoholic steatosis/steatohepatitis, auto-immune liver damage and metabolic disease. The next step is to diagnose the cirrhosis in time when it is in no manifest stage. The third step is to diagnose and treat the liver decompensation. It means consequences of the portal hypertension, it is ascit, esophageal or gastric varices, hepatorenal syndrome. Next there are consequences of the metabolic insufficiency, it is icterus, coagulopathy and hepatic encephalopathy. It is necessary to diagnose and cure cholestasis from the very first extrahepatic causes. For a successful treatment of the hepatocellular carcinoma originated almost exclusively in the grounds of the cirrhosis must be early diagnosed. The ambulant internist respective hepatologist must diagnose the stage of the cirrhosis and decide when a hospitalization is necessary. Also a close cooperation with other specialists is urgent if it is about a liver transplantation. The treatment of successive stages of the cirrhosis is a topic of the showed educational article.
Key words:
compensated/decompensated liver cirrhosis – diet/nutrition in liver cirrhosis – etiology and diagnose of liver cirrhosis – treatment of liver insufficiency/failure – treatment of portal hypertension and its complications
Autoři: Jiří Ehrmann; Květa Aiglová; Michal Konečný; Vlastimil Procházka; Drahomíra Vrzalová
Působiště autorů: II. interní klinika – gastro-enterologická a hepatologická LF UP a FN Olomouc
Vyšlo v časopise: Vnitř Lék 2016; 62(7-8): 553-563
Kategorie: Přehledné referáty
V České republice žije 40 000–60 000 pacientů s jaterní cirhózou a ročně jich v jejím důsledku umírá asi 2 000. Jedná se o nepřehlédnutelnou skupinu nemocných vyžadující komplexní léčbu, kterou zajišťuje zejména internista ve spolupráci s dalšími odborníky. Jedním z cílů ambulantního internisty je včasná diagnostika a léčba chronických jaterních onemocnění, která mohou k cirhóze vést.
Souhrn
V České republice žije 40 000–60 000 pacientů s jaterní cirhózou a ročně jich v jejím důsledku umírá asi 2 000. Jedná se o nepřehlédnutelnou skupinu nemocných vyžadující komplexní léčbu, kterou zajišťuje zejména internista ve spolupráci s dalšími odborníky. Jedním z cílů ambulantního internisty je včasná diagnostika a léčba chronických jaterních onemocnění, která mohou k cirhóze vést. Jedná se zejména o chronické virové hepatitidy, alkoholovou nebo nealkoholovou steatózu/steatohepatitidu, autoimunitní jaterní poškození a metabolická onemocnění. Druhým úkolem je včasná diagnostika cirhózy i v jejím nemanifestním stadiu. Třetím úkolem je rozpoznání a léčba jaterní dekompenzace. Jde o důsledky portální hypertenze, tj. ascitu, jícnových nebo žaludečních varixů, hepatorenálního syndromu. Dále o důsledky metabolického selhání, tj. ikteru, koagulopatie a hepatální encefalopatie. Nutná je včasná diagnostika a léčba cholestázy, v první řadě extrahepatální příčiny. Hepatocelulární karcinom vznikající téměř výlučně v terénu jaterní cirhózy musí být časně diagnostikován, aby jeho léčba mohla být úspěšná. Ambulantní internista, resp. hepatolog musí poznat stadia cirhózy, při nichž je již třeba hospitalizace, a dále musí úzce spolupracovat s ostatními odborníky při indikaci jaterní transplantace. Léčba jednotlivých stadií jaterní cirhózy je předmětem předloženého edukačního článku.
Klíčová slova:
diagnostika a příčiny jaterní cirhózy – dietní opatření při jaterní cirhóze – kompenzovaná/dekompenzovaná jaterní cirhóza – léčba cholestázy – léčba jaterní insuficience/selhání – léčba komplikací portální hypertenzeÚvod
Termín jaterní cirhóza zavedl významný představitel francouzské, resp. pařížské lékařské školy, žák J. N. Corvisarta René Théophile Hyacinthe Laennec (1781–1826), profesor interny v Hospice de la Charité v Paříži. Tento skvělý lékař a ušlechtilý člověk proslul zejména zavedením auskultace hrudníku mezi metodiky fyzikálního vyšetření, zkonstruoval dřevěný stetoskop a mimo choroby hrudníku studoval také onemocnění jater. V roce 1819 jako první použil název cirrhosis hepatis, odvozený od řeckého slova „κίρρος“ (žlutohnědý) k označení prominujících žlutohnědých uzlíků nebo uzlů na povrchu jater, a přesto že se později ukázalo, že hlavní podstatou těchto lézí je fibróza (Laennec se zpočátku domníval, že jde o nádorové bujení) termín jaterní cirhóza zůstal univerzálním názvem pro chronické difuzní jaterní onemocnění různé etiologie. Ještě v 60.–70. letech minulého století se pro alkoholovou portální, nutritivní jaterní cirhózu užíval název Laennecova cirhóza [1,2].
Dnes definujeme jaterní cirhózu jako chronické, obvykle progredující jaterní onemocnění charakterizované následujícími morfologickými znaky:
- nekrózy hepatocytů
- větší či menší zánětlivá infiltrace
- proliferace vaziva – fibróza
- nodulární regenerace
- ztráta a transformace lobulární struktury
- porucha intrahepatální a intraacinózní mikrocirkulace
Dříve se užívalo názvů chronická hepatitida a jaterní cirhóza pro označení téměř stejných nemocí. Po histologické stránce mají sice obě zmnožení vaziva a zánětlivou reakci, cirhóza ale má navíc výraznou přestavbu jaterního parenchymu, tj. nodulární regeneraci s transformací lobulární struktury. Klinická symptomatologie a pomocné vyšetřovací metody jsou odrazem kvantitativního a kvalitativního zastoupení uvedených morfologických změn [3,4].
Základní principy léčby jaterní cirhózy
Klinické stadium nemoci
Cirhóza může být ve stadiu latentním nebo manifestním. Manifestní jaterní cirhóza může být kompenzovaná nebo dekompenzovaná. Zatímco průměrné přežívání nemocných s kompenzovanou cirhózou se pohybuje okolo 12 roků, průměrné přežívání nemocných s dekompenzovanou jaterní cirhózou je kolem 3 roků. Kritérií tíže jaterní cirhózy (tedy kompenzace/dekompenzace) je řada, nicméně v ambulantní klinické praxi stále užíváme Childova-Pughova skórovací kritéria (tab. 1). Semikvantitativní varianta Childova-Pughova skóre (tab. 2) je sice přesnější, nicméně v klinické praxi se moc neujala a využívá se spíše v klinických studiích a pro posuzování nemocných v transplantologii. Pro potřeby jaterních transplantací se užívá tzv. MELD skóre (model for end-stage liver disease). Zahrnuje i sérovou koncentraci kreatininu a jeho automatický výpočet lze nalézt na adrese: http://www.unos.org/resources/melPeldCalculator.asp [5]. K posouzení kompenzace/dekompenzace jaterní cirhózy lze užít i neinvazivní zobrazovací metody např. magnetickou rezonanční elastografii [6].
Tab. 1. Funkční hodnocení jaterní cirhózy podle Childa a Pugha 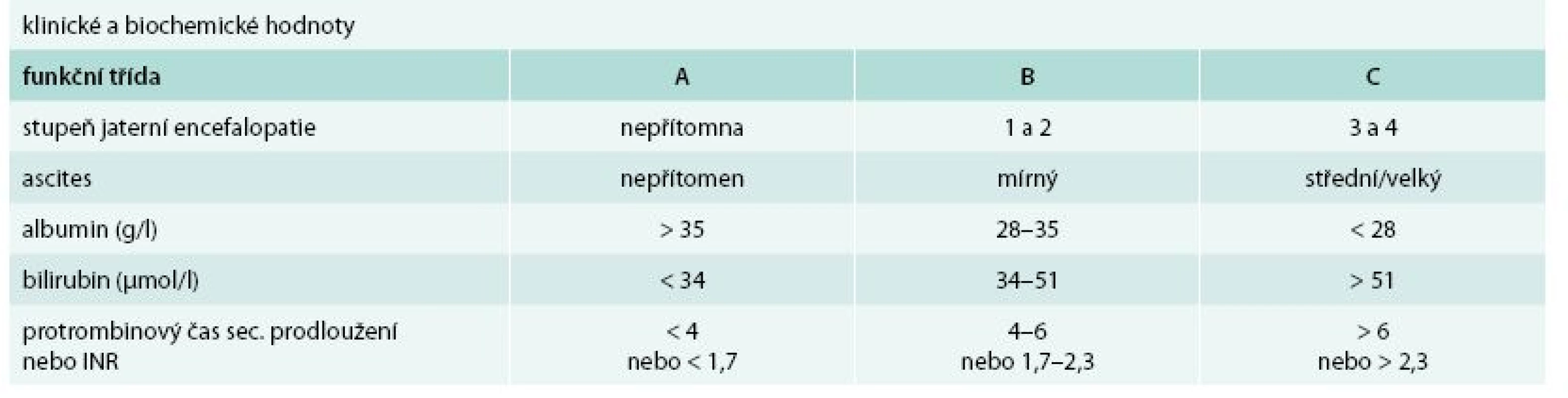
Tab. 2. Semikvantitativní skóre podle Childa a Pugha 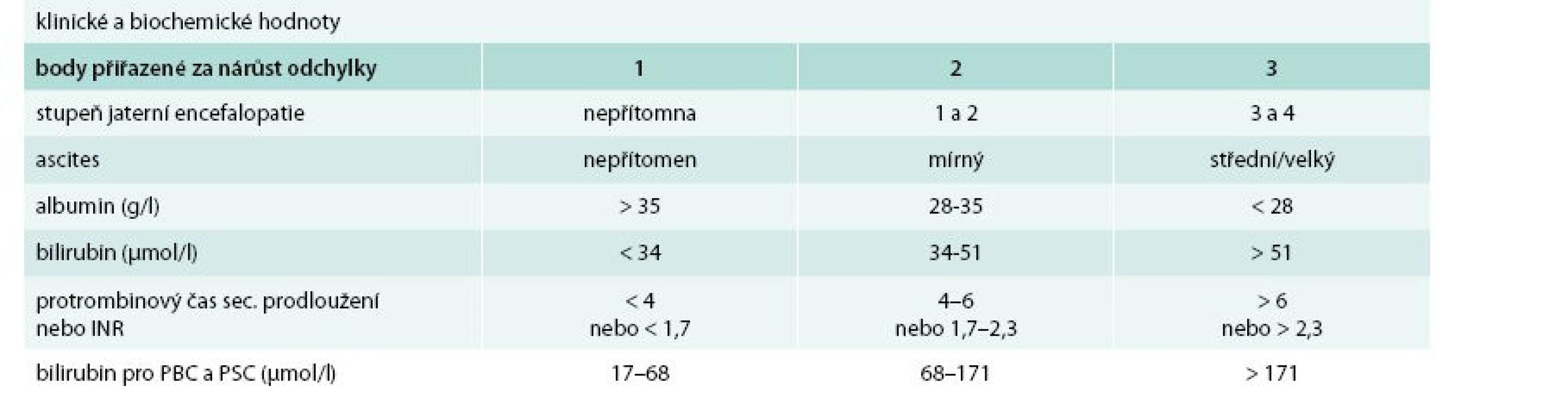
funkční třída A: 5–6 bodů funkční třída B: 7–9 bodů funkční třída C: 10–15 bodů PBC – primární biliární cirhóza PSC – primární sklerotizující cholangitida Příčiny jaterní cirhózy
Příčiny jaterní cirhózy dělíme na zánětlivé, toxonutritivní, cholestatické, cévní a kryptogenní (10 %). Epidemiologické studie vykazují velké geografické rozdíly v závislosti zejména na konzumaci alkoholu a prevalenci chronické infekce virové hepatitidy B (VHB) a virové hepatitidy C (VHC) [7–9]. Dnes se na 3. místo dostává nealkoholová steatóza, resp. její aktivní forma nealkoholová steatohepatitida (non-alcoholic fatty liver disease – NAFLD/nonalcoholic steatohepatitis – NASH) [10–13], a globálně tak 70–80 % jaterních cirhóz vzniká z těchto 3 příčin. Prevalence jaterní cirhózy v ČR je kolem 40 000–60 000 případů a roční mortalita je kolem 2 000.
Jaterní fibróza
Zatímco dříve byl termín jaterní fibróza v podstatě jen termínem morfologickým a klinický lékař ji v léčbě nezohledňoval, poněvadž se mělo za to, že fibróza coby předstupeň cirhózy je stavem ireverzibilním, ve světle nových poznatků je jaterní fibróza potenciálně reverzibilní stav. Její včasná diagnostika a možnost léčebného ovlivnění se staly horkým tématem hepatologie posledních 2 desetiletí [14–17,46].
Příčiny dekompenzace jaterní cirhózy
Latentní jaterní cirhóza může léta probíhat bezpříznakově nebo jen s málo nápadnými subjektivními potížemi a s relativně chudým nálezem při objektivním vyšetření. Když navíc i laboratorní nálezy nebo zobrazovací metody nevykazují v tomto stadiu choroby nápadné patologické změny, je často cirhóza diagnostikovaná pozdě, až ve stadiu manifestním. Hlavním úkolem klinika tedy je odhalit včasná stadia jaterní cirhózy (fibrózy) a zahájit léčbu nebo alespoň doporučit příslušná systémová opatření. Jde o diagnostiku a léčbu chronických virových hepatitid, autoimunitních postižení jater (autoimunitní hepatitida, primární biliární cirhóza, primární sklerozující cholangoitida a IgG4 asociovaná cholangoitida), včasné odhalení alkoholové závislosti, včasnou diagnostiku a léčbu nealkoholové steatózy a steatohepatitidy (NAFLD/NASH), včasnou diagnostiku a léčbu genetické hemochromatózy, Wilsonovy choroby, porfyrie a dalších méně častých hereditárních onemocnění jater či onemocnění jaterních cév [18–22].
Dotazník CAGE
- C = cut down: Měl/a jste někdy pocit, že byste měl/a omezit pití?
- A = annoyed: Naštval vás už někdo tím, že vás kritizoval za vaše pití?
- G = guilty: Cítil/a jste se někdy provinile kvůli pití alkoholu?
- E = eye opener: Napil/a jste se někdy po ránu, abyste se uvolnil/a nebo zahnal/a opici?
Dvě kladně zodpovězené otázky ukazují na možnou alkoholovou závislost.
V latentním stadiu nebo ve stadiu kompenzované jaterní cirhózy je léčba zaměřená zejména na příčiny cirhózy, jde tedy o léčbu kauzální s cílem zastavit progresi onemocnění do fibrózy a cirhózy. Ve stadiu dekompenzace je léčba zaměřena na projevy dekompenzace, jde vlastně o léčbu symptomatickou, která je více méně stejná bez ohledu na příčiny cirhózy.
Příčiny dekompenzace jaterní cirhózy jsou:
Portální hypertenze
Jde o syndrom, který se rozvíjí v souvislosti se zvýšením tlaku v řečišti v. portae. Klinický význam však nemá absolutní hodnota krevního tlaku ve v. portae, ale tlakový gradient mezi v. portae a pravou srdeční síní resp. jaterní žilou. Mluvíme o porto-systémovém gradientu (PSG). Jeho normální hodnoty se pohybují okolo 2–3 torrů (mm Hg). Hlavní příčinou portální hypertenze je ve více než 90 % jaterní cirhóza. Při ní dochází ke zvýšenému odporu v jaterním řečišti jednak z důvodu strukturálních změn jaterního parenchymu, tedy změn pasivních (úbytek sinusoid a jejich kapilarizace), tak z důvodu aktivní složky, která může u jaterní cirhózy představovat až 50% nárůst cévního odporu. Zatímco dříve byla pozornost léčby zaměřena na pasivní složku portální hypertenze, nyní se hledají léčebné možnosti ovlivnění aktivní složky [23,24].
Chronická venostáza při portální hypertenzi vede k poruchám střevní bariéry a střevní motility a k hypersplenizmu. Nicméně, z klinického hlediska nejzávažnějším důsledkem portální hypertenze (když PSG je vyšší než 10 torrů) je remodelace fyziologických portosystémových anastomóz. Nejnebezpečnější jsou kolaterály ve sliznici gastroezofageálního přechodu ohrožující nemocného masivním krvácením. Nejčastěji to jsou jícnové varixy eventuálně varixy žaludečního fundu. Krvácení může ale být i z jiných míst GIT, v nichž dochází k remodelaci anastomóz (varixy v rektu, v chirurgických stomiích a podobně). Specifické je krvácení ze žaludeční sliznice, které je ale spíše na vrub venostatické hyperemie při portální hypertenzi.
Dalšími důsledky portální hypertenze jsou ascites ev. fluidotorax, dále systémové poruchy oběhu, mezi které patří hepatorenální syndrom, hepatopulmonální syndrom, portopulmonální hypertenze a kardiální dysfunkce [25].
Jaterní nedostatečnost a selhání
Jde o soubor příznaků vzniklých v důsledku poruchy jaterní funkce, která vznikne při úbytku funkční kapacity jater o 80–90 %. Jde o hepatocelulární selhání a příčinou takového úbytku jaterní funkce je obvykle nekróza ev. apoptóza jaterních buněk. Rozlišujeme akutní a chronické jaterní selhání. Rozdíl mezi nedostatečností a selháním je v tom, že při selhání jde již o multiorgánové selhání bezprostředně ohrožující nemocného na životě. Akutní jaterní selhání definujeme jako selhání do té doby nepoškozených jater v důsledku fulminantního průběhu akutních virových hepatitid, v důsledku toxických příčin, v důsledku fulminantní formy Wilsonovy choroby, akutní porfyrie, Reyeova syndromu a dalších stavů.
Chronická jaterní nedostatečnost/selhání se rozvíjí na podkladě chronického obvykle mnohaletého jaterního onemocnění, které vede postupně k úbytku funkční jaterní tkáně. Ve většině případů jde o jaterní cirhózu. Mechanizmus chronického selhání je ale v některých ohledech odlišný od selhání akutního. V první řádě jde o důsledky portální hypertenze, resp. portokaválních bypassů, při kterých se sníží perfuze jater ze splanchnického řečiště. To má za následek poruchu syntetických a detoxikačních jaterních funkcí, ale i další poruchy včetně porušené imunity vznikající v důsledku obcházení jaterního imunitního filtru (Kupfferovy buňky) a v důsledku zvýšené translokace střevní flóry slizniční bariérou při venostáze.
Soubor příznaků jaterní insuficience resp. selhání je široký. Z těch nejvýznamnějších to jsou jaterní encefalopatie, ikterus a koagulopatie [26].
Klinické projevy kompenzované jaterní cirhózy
- nechutenství, únava, abdominální diskomfort, poruchy spánku, poruchy menstruačního cyklu, ztráta libida – tyto potíže mohou být i izolovaně jediným projevem cirhózy
- hepatomegalie – běžný nález, ale játra nemusí být vždy zvětšená; konzistence jater je různou měrou zvýšená
- splenomegalie – téměř vždy
- projevy změněného metabolizmu estrogenů – palmární erytém, pavoučkové névy, gynekomastie, ztráta axilárního a pubického ochlupení
- Dupuytrenova kontraktura – u nemocných s jaterní cirhózou bývá častěji, ale nemusí být s ní spojena
Klinické projevy dekompenzované jaterní cirhózy
- ascites, krvácení do trávicího traktu, ikterus, jaterní encefalopatie
- malnutrice, svalová atrofie
- projevy hyperkinetické cirkulace – tachykardie, hypotenze
- hepatorenální syndrom
- krvácivé projevy v důsledku kogulopatie a trombocytopenie
- hepatocelulární karcinom
V poslední době je intenzivně studovaná klinická jednotka charakterizovaná akutním jaterním selháním, ale nasedajícím na játra již poškozená jaterní cirhózou (acute-on-chronic liver failur – ACLF). Alkohol, lékové jaterní poškození, superponovaná virová infekce, trombóza porty, ischemická hepatitida, jaterní trauma, chirurgická intervence, krvácení do GIT, infekce, to jsou okolnosti, které mohou u některých pacientů se zatím kompenzovanou nebo dokonce latentní jaterní cirhózou navodit ACLF. Proč ale jen u některých pacientů dojde k rozvoji náhlého multiorgánového selhání a u jiných ne, je předmětem dalších studií [27,28].
Cholestáza
Definujeme ji jako stav, při němž žluč v přiměřené kvalitě a množství nedosáhne duodena. Dělíme ji na intrahepatální, a tu pak na intrahepatocytární a intrahepatokanalikulární, a na extrahepatální. Nejsou žádné laboratorní znaky k odlišení intrahepatální a extrahepatální cholestázy. Takže při vyslovení diagnózy cholestáza (laboratorně konjugovaná hyperbilirubinemie, zvýšená enzymatická aktivita sérové GGT a ALP) je na prvním místě třeba vyloučit extrahepatální příčinu užitím zobrazovací techniky (dnes USG a MRCP). Prakticky všechny akutní i chronické záněty jater, tedy i cirhóza, mohou probíhat s cholestázou nebo bez ní, přičemž cholestáza zhoršuje jejich průběh a prognózu. Diferenciální diagnostika cholestázy, zejména včasná diagnostika, zůstávají stále žhavým tématem hepatologie [20].
Hepatocelulární karcinom
Hepatocelulární karcinom (HCC) je nejčastějším primárním nádorem jater a setkáváme se s ním výlučně (v 95 %) v cirhotických játrech. Nejčastěji se vyskytuje v oblasti Asie a subsaharské Afriky (aflatoxin ze špatně skladovaných potravin). Celosvětově ale jeho incidence závisí na prevalenci chronické infekce VHB a VHC. Údaje o úmrtí na HCC v cirhóze u alkoholiků lze obtížně vysledovat, vzhledem ke komorbiditě a vysoké úmrtnosti těchto osob v důsledku i jiných orgánových poškození při nadměrné konzumaci alkoholu. Incidence HCC v ČR je 0,8/100 000 obyvatel. Vysoký výskyt HCC je u osob s cirhózou jater na podkladě hemochromatózy, naopak u cirhózy v důsledku autoimunitní hepatitidy a Wilsonovy choroby je nízký.
Časná stadia HCC vhodná k radikální léčbě bývají klinicky němá, klinicky němá mohou být i jeho pozdní stadia. Na druhé straně dekompenzace dosud kompenzované jaterní cirhózy může být prvním projevem HCC [29,30].
Léčba jaterní cirhózy ambulantním internistou
Jak bylo již uvedeno, v České republice žije 40 000–60 000 pacientů s jaterní cirhózou a ročně v jejím důsledku jich umírá asi 2 000. Jde o nepřehlédnutelnou skupinu nemocných vyžadujících komplexní léčbu, kterou zajišťuje zejména internista ve spolupráci s dalšími odborníky. Podstatná je ambulantní péče, jejíž význam vzrostl se snižováním počtu akutních lůžek, ale hlavně nemocní ji preferují, je pro ně komfortnější než dlouhý pobyt v nemocnici. Nemocní jaterní cirhózou představují různorodou skupinu s klinickým obrazem závislým na stavu kompenzace jaterních funkcí často ovlivňovaným dalšími komorbiditami. V ambulantní praxi jsou pacienti roky dispenzarizovaní pro jaterní onemocnění různé etiologie, u kterých progreduje fibróza, až dospěje do jaterní cirhózy. Druhou možností je, že přijde pacient již s rozvinutým obrazem jaterní cirhózy, se závažnými projevy portální hypertenze, nebo jaterního selhání. Tito jsou indikováni k hospitalizaci, na kterou naváže ambulantní léčba. Diagnóza jaterní cirhózy pro nemocného znamená, že bude potřebovat lékařskou péči po celý zbytek života. U stabilizovaných nemocných jde o rutinní kontroly, které jsou zaměřeny především na včasné rozpoznání rozvíjející se dekompenzace, včetně včasného záchytu HCC. Pak jsou nutné frekventnější kontroly s úpravou terapie. Specifickým problémem jsou pacienti po transplantaci jater s doživotní imunosupresivní terapií [31].
Alkoholová jaterní cirhóza
Alkohol je považován celosvětově za příčinu jaterní cirhózy asi v 50 %. V ČR je způsobeno alkoholem asi 30 % cirhóz. Nevratné jaterní poškození vzniká v důsledku letitého abúzu alkoholu. Obecně se uvádí, že jistá cirhóza vznikne při denním pití 180–200 g za 25 let, u žen jsou uváděné hodnoty podle většiny studií menší až o polovinu. Podle studie GDB (Global Burden of Disease) bylo v roce 2010 registrováno více než 1 milion úmrtí v důsledku jaterní cirhózy, což představuje 2,0 % ze všech úmrtí a z toho alkoholová jaterní cirhóza představovala téměř 48 % [9,18,19]. Pokud nemocný při zjišťování anamnestických údajů spolupracuje, pravdivě odpoví na otázky stran konzumace alkoholu, množství a frekvenci konzumovaného alkoholu, je situace pro obě strany – lékaře i pacienta – jednodušší. Nelze se ale spokojit s neurčitou odpovědí o tzv. příležitostném pití, lékař nemůže otázku alkoholu taktně přejít a musí se snažit co možná nejpřesněji spotřebu alkoholu kvantifikovat. Rovněž tak i údaje o abstinenci je nutné upřesňovat, např. zda je stoprocentní a jak dlouho pacient abstinuje. Nemocní velmi často, zvláště při vstupním vyšetření, nejsou konkrétní stran alkoholu, a proto je třeba provést laboratorní vyšetření průkazu abúzu alkoholu a ordinovat je tak, aby bylo možné vyjádřit podíl alkoholu na vzniku jaterní cirhózy. Pokud při objektivním vyšetření máme dojem (např. z dechu), že nemocný konzumoval alkohol, provádíme dechovou zkoušku na alkohol. Nicméně, to není časté. Mezi základní vyšetření pro laboratorní průkaz abúzu alkoholu patří:
- stanovení GGT, odrazem alkoholového abúzu může být i mírné zvýšení, častěji jsou ale hodnoty vysoké, jen pomalu se normalizující při abstinenci
- stanovení poměru AST/ALT, odrazem alkoholového abúzu je hodnota vyšší než 2
- určení středního objemu erytrocytů (mean corpuscular volume – MCV), odrazem alkoholového abúzu je hodnota > 96 fl (fentolitr)
- vhodné je stanovení triacyglycerolů a HDL-cholesterolu, které bývají u alkoholového abúzu vyšší
- z imunologického hlediska je pro abúzus alkoholu typické zvýšení IgA
- karbohydrát-deficientní transferin (CDT); při chronickém abúzu alkoholu se v krvi zvyšuje zastoupení molekulových forem transferinu s menším počtem zbytků sialové kyseliny (deficientní transferin); jde o senzitivní marker abúzu alkoholu s poločasem 12 dní a cut-off 2,5–3 % [18,19]
Cílem těchto vyšetření není nemocného nějak trápit nebo skandalizovat, ale přimět jej, aby byl ke konzumaci alkoholu kritický a dodržoval abstinenci.
Absolutní abstinence je základem léčby alkoholové jaterní cirhózy a prvním předpokladem její úspěšnosti. K dosažení abstinence je nutná spolupráce ošetřujícího internisty s rodinou, s psychiatrem – adiktologem. Od psychiatra očekáváme zejména pomoc v odvykací léčbě a farmakologickou léčbu odvykacích příznaků. Nemocného se snažíme k abstinenci motivovat při každé návštěvě v ordinaci. Posouzení abstinence, stejně tak jako potvrzení nebo vážné podezření na trvající abúzus mají význam pro úvahy o transplantaci jater. Pokračující abúzus je kontraindikací transplantace jater [32,33].
Druhým předpokladem zlepšení kvality a prodloužení života nemocných s alkoholovou jaterní cirhózou je zvládnutí komplikací, tedy jaterního selhání, portální hypertenze a cholestázy a včasná diagnostika hepatocelulárního karcinomu. Léčba těchto stavů je obdobná jako z příčin jiných.
Cirhózy v důsledku virových hepatitid B a C
Jsou v našich podmínkách považovány za příčinu asi 30 % jaterních cirhóz. Již při vstupním laboratorním vyšetření pro hepatopatii vyšetřujeme sérologické markery HBsAg a anti HCV a v případě pozitivního výsledku vyšetřujeme HBV DNA, resp. HCV RNA. Identifikujeme tak chronickou virovou hepatitidu, která progredovala díky pokračující replikaci viru hepatitidy B resp. C do jaterní cirhózy. Léčba infekce HBV a HCV je indikována u nemocných s cirhózou, má však svá specifika vzhledem k možné jaterní insuficienci, změnám krevního obrazu a možné poruše renálních funkcí. V léčbě infekce virem hepatitidy B u cirhotických pacientů je většinou volena dlouhodobá, časově neomezená léčba tenofovirem nebo entekavirem. Cílem léčby je suprese virové replikace a zpomalení progrese jaterní cirhózy [7].
Léčba HCV infekce u pacientů s jaterní cirhózou byla donedávna možná jen u pacientů ve stadiu Child-Pugh A. Vývoj přímo působících antivirotik přinesl možnost bezinterferonové léčby. Terapie bez užití pegylovaného interferonu umožňuje vyléčit infekci virem hepatitidy C i u nemocných s pokročilou cirhózou, se známkami jaterní insuficience, trombocytopenií a leukopenií. Cílem je dosažení trvalé virologické odezvy, zlepšení funkčního stavu jater a oddálení komplikací, zejména vzniku hepatocelulárního karcinomu [8]. Antivirová léčba, včetně pacientů s jaterní cirhózou, je vyhrazena specializovaným centrům [34].
Cirhózy autoimunitní etiologie
Imunosupresivní léčba je na místě i u nemocných s již rozvinutou jaterní cirhózou a dokonce i při její mírné dekompenzaci, zejména při vysoké aktivitě hepatitidy. Základem je podávání glukokortikoidů spolu s azatioprinem k ovlivnění zánětlivých procesů v játrech. Většinou léčbu zahajujeme při hospitalizaci a během následujících ambulantních kontrol snižujeme dávku imunosupresiva až k udržovací dávce. Je však třeba zavčas zachytit komplikace imunosupresivní léčby, zejména změny krevního obrazu, steroidní diabetes mellitus, osteoporózu a jiné [35].
Jaterní cirhóza v důsledku Wilsonovy choroby a hereditární hemochromatózy
Chelační léčba penicilaminem nebo léčba zinkem u Wilsonovy choroby, resp. opakované venepunkce u hereditární hemochromatózy, jsou léčbou dlouhodobou a při jejím správném provádění dochází ve většině případů ke kompletní stabilizaci nemocného. Ambulantně sledujeme účinek léčby, tj. odpad mědi v moči, resp. sérové hodnoty železa, vazebné kapacity železa a feritinu. Nicméně, jaterní cirhóza, pokud vznikne u nemocných s Wilsonovou chorobou nebo hereditární hemochromatózou, probíhá různě dlouhou dobu latentně, či je kompenzovaná. V chelační léčbě pokračujeme [21,22].
Jaterní cirhóza v důsledku NAFLD/NASH
Ještě do nedávné doby se neuvažovalo o možnosti vzniku jaterní cirhózy v důsledku nealkoholové steatózy resp. steatohepatitidy. Dnes se ale ukazuje, že zejména tzv. kryptogenní cirhózy jsou často v důsledku neléčené nebo nedostatečně léčené NAFLD/NASH, která se stává nejčastější chronickou jaterní afekcí západní populace s 30% prevalencí [10]. Nejčastější příčinou NAFLD/NASH je metabolický syndrom a jeho včasná diagnostika a důsledná léčba jsou prevencí vzniku cirhózy resp. HCC [13]. Pokud ale již cirhóza vznikla a přešla do stadia dekompenzace, léčíme ji stejně jako z jiných příčin.
Primární biliární cirhóza
Jde o autoimunitní cholestatické onemocnění, postihující ve více než 90 % případů ženy, převážně mladšího věku. Název onemocnění je v podstatě nesprávný, poněvadž cirhóza představuje až konečné stadium tohoto chronického jaterního onemocnění. Medikamentózní léčba je obecně málo účinná a zatím se nejlépe osvědčilo dlouhodobé podávání kyseliny ursodeoxycholové (UDCA), která vytěsňuje hydrofobní žlučové kyseliny s hepatotoxickým účinkem. Dávky UDCA musí být dostatečně vysoké kolem 15 mg/kg/den. Mimo to je třeba léčit důsledky cholestázy ať již subjektivní, hlavně pruritus, nebo celkové, zejména osteoporózu, malabsorpci a jiné. Jedinou nadějí nemocných ve stadiu nekompenzované jaterní cirhózy je transplantace jater [20].
Ascites
Je jednou ze známek dekompenzace jaterní cirhózy a vzniká hlavně v důsledku portální hypertenze. Zhoršuje kvalitu života a signalizuje další komplikace. Menší množství ascitu způsobuje jen mírné dyspeptické potíže, při progresi ascitu se objeví tlak v břiše a dušnost. Mluvíme o tenzním ascitu. Prokážeme jej při sonografickém vyšetření. Fyzikálním vyšetřením, zejména poklepem, můžeme zjistit ascites až při množství 2 000–3 000 ml. Každý nově vzniklý ascites je nutno došetřit i stran jiné možné etiologie než jaterní cirhózy. Musíme myslet zejména na trombózu v. portae, maligní etiologii, kardiální příčinu, méně často Buddův-Chiariho syndrom, zánětlivou příčinu a další. Pacienti s významným ascitem jsou indikováni k hospitalizaci, během které provedeme punkci břicha z důvodů diagnostických i terapeutických (paracentéza) a zahájíme léčbu především diuretiky. Punktát vyšetřujeme pro rozlišení transsudátu a exsudátu, tj. stanovíme specifickou hmotnost, obsah bílkovin (pro transsudát svědčí < 25 g/l) resp. stanovíme albuminový gradientu sérum/ascites (SAAG). Hodnota vyšší než 11 g/l je u portální hypertenze ev. srdečního selhání. Cytologické vyšetření indikujeme zejména s ohledem na možnou maligní příčinu ascitu. Hodnota leukocytů v ascitu nás informuje o přítomnosti spontánní bakteriální peritonitidy. Materiál ke kultivačnímu vyšetřen í před zahájením antibiotické léčby odebíráme do zkumavek na vyšetření hemokultury.
V terapii ascitu potřebujeme spolupráci nemocného. Je určitě nutná abstinence, celkové šetření většinou s relativním klidem na lůžku, abychom zabránili další aktivaci renin-angiotenzin-aldosteronového systému a aktivaci sympatiku, které vedou ke zvýšené retenci Na+ a vody. Edukujeme nemocného stran omezení příjmu sodíku a vody, aby denní dávka NaCl nepřesáhla 5–7,5 g a příjem tekutin 1 500 ml.
Medikamentózní léčba ascitu spočívá především v podávání diuretik. Spironolakton inhibuje efekt aldosteronu, počáteční dávku většinou 100 mg/den můžeme navýšit až na 400 mg denně. Ve většině případů přidáváme v terapii furosemid k dosažení regrese ascitu. Furosemid inhibuje reabsorpci sodíku a chloridů v ascendentním raménku Henleovy kličky. Dávka diuretik by se měla řídit odpady sodíku v moči, tento postup je možný při hospitalizaci pacienta. Dle guidelines České hepatologické společnosti (ČHS) je maximální doporučená dávka furosemidu 160 mg denně.
Kritériem pro diagnostiku spontánní bakteriální peritonitidy (SBP) je hodnota granulocytů vyšší než 250/mm3 nebo leukocytů nad 500/mm3 v punktátu. Jde o významnou komplikaci jaterní cirhózy, která nemocného ohrožuje na životě a zhoršuje jeho prognózu. Do 1 roku po vzniku spontánní bakteriální peritonitidy umírá 50–70 % nemocných a rekurenci spontánní bakteriální peritonitidy můžeme předpokládat v 40–70 % případů.
Antibiotickou léčbu spontánní bakteriální peritonitidy skoro vždy začínáme u hospitalizovaného pacienta. Ordinujeme cefalosporiny 3. generace, případně ampicilin s kyselinou klavulanovou a klaritromycin nebo chinolony. V ambulantní léčbě potom navážeme dlouhodobým podáváním antibiotik, která mají zabránit rekurenci SBP. V prevenci rekurence je indikováno dlouhodobé podávání norfloxacinu 400 mg denně, další možností je trimetoprim-sulfametoxazol v dávce 480 mg denně. Tato léčba je dlouhodobá a je možné ji ukončit až po vymizení ascitu, je mnohdy nastane až po transplantaci jater.
U nemalého počtu pacientů větší ascites přetrvává dlouho i po propuštění z nemocnice. Při ambulantních kontrolách sledujeme kromě hmotnosti pacienta také obvod břicha, nárůst obou hodnot znamená progresi ascitu. Na zvětšení ascitu reagujeme navýšením dávky diuretik. Pokud objemný ascites činí pacientovi potíže, jsou nutné opakované paracentézy. Ty můžeme provádět i v ambulantním režimu, hospitalizace není vždycky nezbytná. Ambulantní postup volíme u nemocných, kteří jsou oběhově stabilní, nejsou hypotenzní, mají přijatelné hemokoagulační poměry a spolupracují. Objem punktátu je 3 500–4 500 ml. Tzv. velkoobjemové paracentézy vyžadují většinou hospitalizaci a podání albuminu nebo terlipresinu. Hodnoty sérového albuminu musíme vždy respektovat s vědomím, že paracentézou hypalbuminemii ještě prohlubujeme. Podání albuminu indikujeme vždy při paracentézách větších než 5 l, pokud máme obavu z hypovolemie a vzniku hepatorenálního syndromu. Podle doporučeného postupu ČHS k léčbě ascitu ordinujeme 6–8 g albuminu/l punktátu.
Tzv. refrakterní ascites, nereagující na diuretickou léčbu, vyžadující opakované paracentézy, je indikací k zavedení transjugulárního intrahepatického portosystémového shuntu (TIPS). Vidíme-li, že naše terapeutické snahy o ovlivnění ascitu jsou neúspěšné, snažíme se co nejdříve pacienta k TIPS připravit. Musíme došetřit portální systém zobrazovací metodou, aby se intervenční radiolog mohl vyjádřit, zda je TIPS technicky možný. Echokardiografické vyšetření indikujeme k vyloučení plicní hypertenze, která by byla kontraindikací TIPS. Indikace případného TIPS má svá úskalí. Výkon, jeho zdůvodnění i možné komplikace, zejména encefalopatie, musíme vždy podrobně probrat s nemocným a jeho blízkými, kteří o něj pečují [36–38,40].
Jícnové a žaludeční varixy
Při dekompenzaci jaterní cirhózy dochází k rozvoji ascitu, encefalopatie, hepatorenálního syndromu a k selhání metabolických jaterních funkcí. Nejčastější smrtící komplikací je však krvácení do GIT, zejména z jícnových případně žaludeční varixů. U nemocných s kompenzovanou jaterní cirhózou je roční riziko varikózního krvácení menší než 5 %. Výrazně však stoupá u nemocných s již prokázanými velkými varixy, se stupněm pokročilosti jaterního onemocnění a dosahuje až 80 % ročně. Nejlepším prediktivním faktorem rizika varikózního krvácení je invazivně změřená hodnota portosystémového gradientu. Jedná se o tlakový gradient mezi volným a zaklíněným tlakem v jaterní žíle (hepatic vein pressure gradient – HVPG). Významný je tlakový rozdíl vyšší než 16 mm Hg. I když díky rozvoji nových terapeutických možností letalita na varikózní krvácení mírně klesá, stále zůstává vysoká. V souvislosti s první atakou varikózního krvácení stále umírá více než 15 % nemocných [24].
Primární a sekundární prevence
Přirozeně, že podstatou léčby by měla být snaha, aby k varikóznímu krvácení, či nejlépe k tvorbě varixů vůbec nedošlo. Zásadní je dispenzarizace nemocného, terapie základního onemocnění a primární prevence. Svůj význam má farmakologická i endoskopická terapie. Volba způsobu léčby závisí na pokročilosti jaterního onemocnění, výskytu přidružených chorob, endoskopickém nálezu a vzájemné dohodě nemocného s pacientem. Ve farmakologické léčbě mají nezastupitelné místo neselektivní betablokátory, ty snižují HPVG, a to jak redukcí minutového srdečního výdeje, tak přímým působením na splanchnickou oblast. Jako nejúčinnější se v současné době jeví karvediol. Dávkování volíme s ohledem na výskyt nežádoucích účinků, vhodné množství titrujeme v rozmezí 6,25–12,5 mg rozdělené do 2 denních dávek [41].
Nemocní po první epizodě krvácení jsou v dlouhodobém horizontu vystaveni riziku recidivy krvácení, v 2letém horizontu dokonce ve více než 1/2 případů. Proto v takovém případě je již jednoznačně indikována kombinovaná sekundární preventivní léčba spočívající v kombinaci farmakoterapie a endoskopické ligace (sklerotizace není indikována pro vysoké riziko výskytu komplikací). V posledním desetiletí se preferuje u těchto nemocných (zejména s HPVG > 20 mm Hg) časné zavedení TIPS. Data z klinických studií z posledního desetiletí dokumentují význam TPS nejen pro snížení rizika recidivy krvácení, ale i snížení měsíční i roční mortality [42].
Léčba akutního varikózního krvácení
Vzhledem ke skutečnosti, že se jedná o jednu z nejzávažnějších příhod v gastroenterologii vůbec, vyžaduje tento stav multioborový přístup za účasti intenzivisty, endoskopisty, intervenčního radiologa a chirurga. Terapii zahajujeme vždy oběhovou a volumovou stabilizací nemocného, podáním vazoaktivních léků a následně je provedena endoskopie horní části GIT. Po zajištění dostatečného žilního přístupu podáme krystaloidy a provedeme hemosubstituci s cílem udržení hodnot hemoglobinu na dolní hranici 80–100 g/l (u nemocných s přidruženými chorobami). Pro korekci protrombinového času a hladiny krevních destiček nejsou v současné době platná doporučení. Naopak podání širokospektrých antibiotik již v úvodu zvyšuje úspěšnost hemostázy, snižuje riziko recidivy krvácení i mortalitu [39].
Farmakologická léčba
Základem farmakologické terapie je podání léků ovlivňujících perfuzi splanchnického řečiště. Nejlépe prověřeným a nejčastěji užívaným je terlipresin, syntetický analog vazopresinu poprvé vyrobený v Československu v roce 1964. Jedná se o preparát, který způsobuje splanchnickou vazokonstrikci, snižuje portální tlak a průtok portosystémovými kolaterálami. Podává se bolusově v dávce 1–2 mg v intervalu 4–6 hod. Tato dávka vede až u 3/4 nemocných k zástavě krvácení, snižuje mortalitu, riziko recidivy krvácení i rozvoje hepatorenálního syndromu. Léčbu je možno zahájit ještě v přednemocniční fázi péče o nemocného, je třeba ale mít na paměti nežádoucí účinky (ischemie myokardu u starších nemocných). Podobné účinky na léčbu nemocných s krvácením z jícnových varixů mají somatostatin a jeho analog okterotid, taková léčba je však dražší [40–42].
Endoskopická léčba
Endoskopie horní části trávicího traktu má klíčový význam jak v diagnostice, tak v terapii. K endoskopii je ale možno přistoupit až po zajištění a stabilizaci nemocného. Je-li to možné, pak nejpozději do 6 hod od přijetí. U nemocného s rizikem aspirace provádíme výkon v celkové anestezii s endotracheální intubací. Za nejvhodnější metodu endoskopické hemostázy dnes považujeme ligaci jícnových varixů. Ta má v porovnání se sklerotizací vyšší účinnost i bezpečnost. V některých případech však ligaci nelze provést.
Selhání léčby
V případě nezastavitelného krvácení, či recidivy v souvislosti s výše uvedenými metodami léčby, lze použít k transportu nemocného na vyšší pracoviště tamponádu krvácejících jícnových varixů trojcestnou dvoubalónkovou Sengstakenovu-Blakemorovu sondu. Přechodná efektivita při jejím správném použití je až 80%. Nejpozději do 24 hod je ale nutno provést její desuflaci, riziko recidivy krvácení je téměř poloviční. Další metodou k zástavě nekontrolovaného krvácení je použití speciálního stentu (Danis). Ten komprimuje varixy svou silou po expanzi v jícnu. Efektivita hemostázy je vysoká, až 90%, zavedení je ale poměrně obtížné a komplikace (migrace stentu, otlakové ulcerace) poměrně časté. Za zlatý standard záchranné terapie je stále považováno urgentní zavedení transjugulární intrahepatální portosystémové spojky. Následkem výkonu je nejen rychlé snížení portosystémového tlakového gardientu, ale je současně provedeno i endovaskulární ošetření varixů za použití tkáňového lepidla. K okamžité zástavě krvácení dojde téměř ve 100 % případů. Recidivy krvácení v 1. měsíci po zavedení TIPS nepřesahují 20 % a bývají způsobeny především poruchou průchodnosti spojky [40]. Je třeba si uvědomit, že i zavedení TIPS má své limitace a kontraindikace, zejména u nemocných s neprůchodností portální žíly. Chirurgická léčba, ať již vytvoření portosystémové spojky či azygoportální dekonexe varixů, jsou metodami prováděnými jen velmi zřídka v několika specializovaných centrech České republiky.
Žaludeční varixy
Asi u 1/4 nemocných s portální hypertenzí se vytvářejí žaludeční varixy, které jsou až v 1/2 případů zdrojem závažného krvácení. Prognosticky nejzávažnější jsou izolované fundální žaludeční varixy. Terapie akutního krvácení je stejná jako u varixů jícnových, odlišnost je jen v léčbě endoskopické. Metodou volby je použití tkáňového lepidla (Histoacryl). U kombinovaných gastroezofageálních varixů je možné provedení ligace. Jako záchranou jednodenní terapii je vhodné použít jednobalonkovou sondu (Lintonova-Nichlasova). TIPS u nemocných se žaludečními varixy hraje opět klíčovou roli [40].
Hepatorenální syndrom (HRS)
Jedná se o komplikaci, která spočívá ve funkčním selhání ledvin při normálním morfologickém nálezu na ledvinách, u pacientů s jaterní cirhózou a portální hypertenzí, je možný i u akutního jaterního selhání. Vzniká na podkladě vazokonstrikce renálních tepen, která je reakcí na systémovou vazodilataci a hyperkinetickou cirkulaci typickou u jaterní cirhózy. Dochází ke snížení perfuze kůry ledvin, poklesu glomerulární filtrace, retenci Na+ a vody.
Rozlišujeme 2 typy hepatorenálního syndromu: 1. typ je rychle progredující renální selhání, při němž dochází během 2 týdnů k 2násobnému zvýšení koncentrace kreatininu dosahující nejméně 221 µmol/l. HRS 2. typu je většinou spojen s ascitem refrakterním na léčbu a dalšími projevy jaterní nedostatečnosti tj. koagulopatie, ikterus, hypalbuminemie.
Hepatorenální syndrom vyžaduje hospitalizační léčbu, zpravidla na jednotce intenzivní péče. U HRS 1. typu je cílem úprava vnitřního prostření, je podáván terlipresin k dosažení vazokonstrikce ve splanchnickém řečišti a albumin k expanzi plazmatického volumu. Doporučené dávky jsou 0,5–2,0 mg terlipresinu 4–6krát denně i.v. a 100–200 ml 20% albuminu denně. Použití dialýzy se nedoporučuje, nevede ke zlepšení prognózy nemocného. V léčbě HRS 2. typu se soustředíme na ovlivnění refrakterního ascitu, jsou doporučovány velkoobjemové paracentézy s podáním albuminu, diuretik a terlipresinu. Prognóza nemocných s HRS je velmi vážná a jistě bychom měli zvažovat i možnost transplantace jater u těch pacientů, u nichž není k transplantaci kontraindikace. Prevence rozvoje HRS je smyslem ambulantní péče. Musíme se vyhnout potenciálně nefrotoxické medikaci, dále léčit infekce včetně spontánní bakteriální peritonitidy a uvážlivě ordinovat diuretika a paracentézu [23].
Jaterní encefalopatie
Jaterní encefalopatie (JE) je soubor nervových a psychických příznaků obvykle reverzibilních. Vzniká u pokročilé jaterní cirhózy, ale také u akutního jaterního selhání. Jaterní encefalopatie různého stupně se objevuje asi u 75 % cirhotiků. Rozlišujeme 3 typy JE: typ A se objevuje při akutním jaterním selhání; typ B – nemocní mají normální jaterní funkce, vyskytuje se u portosystémových zkratů a typ C u jaterního selhání u chronických jaterních onemocnění.
Kvantitativní klasifikace rozlišuje minimální JE (subklinická nebo latentní) a manifestní JE.
Podstatou JE je ovlivnění CNS neurotoxickými a neuromodulačními látkami. Běžně jsou tyto látky metabolizovány zdravými játry, při jaterní cirhóze se však vzhledem k jaterní insuficienci a portosystémovým zkratům dostávají do systémové cirkulace a CNS. Zjevná JE se manifestuje změnami chování, zmateností, poruchami spánku, kvantitativními i kvalitativními poruchami vědomí. Podle tzv. West-Haven kritérií rozlišujeme stadium 0, které je bez abnormalit a další 4 stadia JE:
- stadium I – snížená pozornost, apatie, euforie, porucha spánku, snížená schopnost počítat
- stadium II – spavost, apatie, desorientace časem
- stadium III – somnolence, nesrozumitelná řeč
- stadium IV – kóma
Diagnóza je stanovena především klinicky, u nemocných zjišťujeme flapping tremor a foetor hepaticus. Z laboratorních vyšetření podporuje diagnózu JE zvýšená hladina amoniaku v arteriální krvi.
Zjevná jaterní encefalopatie by neměla být diagnostickým problémem, musíme však vyloučit i jinou příčinu poruch vědomí, zejména intrakraniální krvácení. Minimální jaterní encefalopatie vyžaduje detailní vyšetření včetně EEG a psychometrických testů. Minimální jaterní encefalopatii můžeme diagnostikovat na základě přítomnosti vlny P300, velmi citlivý test je tzv. critical flicker frequency. Z psychometrických testů je všeobecně známý test spojování čísel (connecting number test), diskrétnější projevy jaterní encefalopatie je možné prokázat vyšetřením MMSE (mini mental status examination), testy na reakční čas na různé podněty, neporušené binokulární vidění, rozlišení barev.
Základem léčby je snížení tvorby a vstřebávání amoniaku ze střeva. Můžeme toho dosáhnout podáváním rifaximinu v dávce 1 200 mg denně. Jde o antibiotikum, které se jen minimálně vstřebává a maximum jeho účinku je v tlustém střevu. Další možností je medikace laktulózy, jde o nestravitelný disacharid, který mění pH v tračníku ve prospěch mikroorganizmů neprodukujících amoniak. Názory na často užívanou kombinaci rifaximinu a laktulózy jsou rozporné, ale v písemnictví je popsán i příznivý efekt této kombinace léků. Samozřejmostí v léčbě je rehydratace pacienta, identifikace možného spouštěcího faktoru encefalopatie.
V ambulantní praxi musíme právě mít na paměti možný vznik jaterní encefalopatie při intenzivnější diuretické léčbě, krvácení, interkurentním onemocnění. Specifickým problémem je minimální jaterní encefalopatie, která může zásadně ovlivnit schopnost nemocných vykonávat svou dosavadní práci, zejména u řidičů z povolání. U pacientů s minimální JE je popsána zhoršená schopnost řídit – pomalejší jízda, více nehod, problém sledovat provoz a dopravní značení.
Právě s dotazem na schopnost řízení motorového vozidla se velmi často obrací na ambulantního internistu praktičtí lékaři, kteří se o pacienty s jaterní cirhózou dlouhodobě starají. Mnohdy konzultujeme stran jaterní encefalopatie neurologa a psychologa [43].
Karcinom jater
Vzniká v 95 % v terénu jaterní cirhózy, nejčastěji kde o cirhózu vzniklou na podkladě abúzu alkoholu, infekce virem hepatitidy C a B, hereditární hemochromatózy. Kromě ovlivnění příčiny jaterního onemocnění nedokážeme vzniku karcinomu jater zabránit. Jsme však schopni při pravidelných kontrolách včetně sonografického vyšetření jater zachytit včas ložiska hepatocelulárního karcinomu, aby byla možná radikální léčba, tj. jaterní transplantace nebo resekční výkon.
Jaterní dieta a nutriční podpora u nemocných s cirhózou jaterní
Nutriční a metabolické poruchy jsou u jaterní cirhózy běžné. Nutriční stav je považován za prognostický faktor morbidity a mortality. Výskyt proteinoenergetické malnutrice se zvyšuje s pokročilostí jaterní cirhózy. Časná diagnostika metabolických a nutričních poruch doprovázená adekvátní nutriční podporou je u jaterní cirhózy nezbytná.
Dietní režim je nedílnou součástí léčebných opatření u nemocných s jaterní cirhózou. Dietní doporučení mají u jaterního postižení podpůrnou funkci, zásadní však je vždy vyloučení alkoholu. Jaterní dieta není jednotný soubor opatření, ale zahrnuje řadu různých omezení a doporučení, týkajících se energetické hodnoty jídla, poměru a obsahu bílkovin, tuků, sacharidů, vitaminů a dalších mikronutrientů. Správně zvolená dieta je šetrná vůči játrům mechanicky, chemicky i tepelně. Výživová doporučení jsou dlouhodobá, je důležité nemocnému pravidla dietního stravování vysvětlit a získat ho ke spolupráci. Úspěšnost dodržování dlouhodobých dietních opatření je vyšší, pokud jsou výživová doporučení individuálně upravena pro pacienta podle jeho stravovacích zvyklostí. K rozhodnutí o složení diety je nutná znalost dalších přidružených nemocí a komplikací.
Prvním krokem je zhodnocení stavu výživy pacienta, ke kterému je možné využít některý ze standardizovaných nutričních dotazníků, nejčastěji Nutritional Risk Screening, zohledňující BMI, úbytek hmotnosti za poslední 3 měsíce, omezení příjmu stravy v posledním týdnu a závažnost nemoci. Stav výživy je kromě anamnestických údajů zjišťován také posouzením konstituce pacienta, výpočtem výškovo-váhového indexu (body mass index – BMI), laboratorními hodnotami, klinickým a antropometrickým vyšetřením. Rozhodnutí o způsobu výživy vychází ze současného stavu a fáze jaterního onemocnění, z možnosti adekvátního příjmu stravy perorálně či nutnosti nutriční podpory formou enterální nebo parenterální výživy. Základním vodítkem k výpočtu stanovení potřeby energie, makronutrientů a mikronutrientů jsou výživová doporučení pro danou věkovou skupinu a pohlaví, která určují bazální energetický výdej, a takto získaný údaj je navýšený o další hodnoty zohledňující typ onemocnění, závažnost choroby, pohybovou aktivitu a změny hmotnosti. K rámcovému stanovení diety může být vodítkem nemocniční dietní systém. Číselně označené diety v možných technologických úpravách jsou definovány množstvím dodané energie a složením stravy v gramech bílkovin, tuků, sacharidů. U pacientů s jaterní cirhózou je podávána dieta 4 s omezením tuků, či 4S s přísným omezením tuků, u nemocných trpících současně diabetem je podávána dieta 9 diabetická či 9S diabetická šetřící. Možný je také individuální rozpis diety či dodávání bílkovinných přídavků. Dieta u nemocných s kompenzovanou jaterní cirhózou se jen málo liší od racionální stravy. Pokud není nemocný podvyživený, je doporučen dostatek kvalitních bílkovin, přísun vitaminů formou zeleniny a ovoce, šetrná technologie přípravy pokrmů. Doporučený přísun energie je 25–30 kcal/kg/den, proteinů 1–1,2 g/kg/den. Parenterální či enterální nutriční podpora je indikována u nemocných s kompenzovanou jaterní cirhózou tehdy, pokud jsou podvyživeni.
Dieta u nemocných s dekompenzovanou jaterní cirhózou se řídí závažností stavu nemocného, přítomností projevů jaterní encefalopatie, ascitu, cholestázy nebo komplikujícího krvácení. Jaterní nedostatečnost vede k alteraci metabolizmu tuků ve smyslu zvýšené lipolýzy, zvýšené tvorby a oxidaci neesterifikovaných mastných kyselin. Ketogeneze může být normální nebo zvýšená. Dochází také ke zvýšenému katabolizmu bílkovin se zvýšením periferní utilizace větvených aminokyselin a ke snížené tvorbě močoviny s nárůstem amoniaku. V metabolizmu cukrů dochází k poklesu a snížení syntézy glykogenu v játrech a kosterním svalstvu, ke zvýšené glukoneogenezi, hyperinzulinemii, často až k těžké hypoglykemii, rozvoji inzulinové rezistence. Základem dietních opatření je zabránit destrukci tělesných bílkovin, zpomalit rozvoj jaterní encefalopatie, upravit metabolizmus vody a minerálů a podpořit regeneraci hepatocytů. Doporučený příjem energie u nemocného jak s mírnou, tak i s těžkou encefalopatií je 25–30 kcal/kg/den. Proteinové energie u mírné encefalopatie je zpočátku 0,5 g/kg/den a později 1–1,5 g/kg/den. Proteinové energie u těžké encefalopatie je 0,5–1,5 g/kg/den. Příjem sodíku při ascitu je omezen na 70–90 mmol/den. Dle bilance tekutin je indikována při hladině sodíku v séru pod 120 mmol/l restrikce příjmu tekutin do 1 000 ml/24 hod. Dekompenzovaná jaterní cirhóza vede k různému stupni malnutrice a je nutné zahájit enterální a parenterální podporu.
Enterální výživa u jaterní cirhózy je indikována tehdy, pokud nemocný nedokáže pokrýt své energetické nároky normálním jídlem i přes dodržení nutričních doporučení. Enterální výživa zlepšuje nutriční stav a jaterní funkce, snižuje komplikace a prodlužuje přežití u nemocných s jaterní cirhózou. Je podávána formou nutričních doplňků nebo jako sondová výživa. Zavádění perkutánní endoskopické gastrostomie je spojeno s vyšším rizikem komplikací a není doporučeno. Podávány jsou přípravky s celými nenaštěpenými proteiny. U nemocných s ascitem je vhodné podávat koncentrovanější vysokoenergetické přípravky. Pokud se během enterální výživy vyvine jaterní encefalopatie, použití přípravků obohacených o větvené aminokyseliny může zlepšit stav nemocného s pokročilou jaterní cirhózou.
Parenterální výživa umožňuje zvýšit nebo zajistit adekvátní přívod živin u nemocných s nedostatečnou nebo nulovou výživou ústy nebo enterální cestou. Parenterální výživu je nutné zahájit u závažně malnutričních pacientů. Pokud nemocný s jaterní cirhózou nejí déle než 12 hod, je nutné dodávat glukózu interavenózně v dávce 2–3 g/kg/den. V případě hladovění delším než 72 hod zahajujeme parenterální výživu dodávkou energie pokrývající 1,3násobek klidové spotřeby energie, z toho 50–60 % energetických nároků je třeba pokrýt glukózou. Je nezbytné opakovaně kontrolovat hladiny glykemií a korigovat hyperglykemie inzulinem s krátkým biologickým poločasem. Jsou indikovány lipidové emulze s menším obsahem ω-6 nenasycených mastných kyselin v dávce 1,2–1,5 g/kg/den. V případě encefalopatie 3.–4. stupně jsou podávány roztoky bohaté na rozvětvené aminokyseliny s nízkým obsahem aromatických aminokyselin metioninu a tryptofanu. Od prvního dne parenterální výživy dodáváme vitaminy rozpustné ve vodě a stopové prvky, sledujeme hladiny fosfátu, draslíku a magnezia [44–46].
Možnosti ovlivnění jaterní fibrózy
Je to velká výzva pro současnou hepatologii, poněvadž jaterní fibróza je dnes považovaná za stav reverzibilní nebo léčbou lze alespoň zpomalit nebo zastavit progresi do jaterní cirhózy. Antifibrotika musí být dlouhodobě dobře tolerovaná, bez vedlejších účinků, cenově dostupná s možností monitorace účinku. Základem je léčba primárního onemocnění, tj. chronických virových hepatitid, alkoholového chronického jaterního poškození, NAFLD/NASH, metabolického jaterního poškození, autoimunitního jaterního poškození.
Fibrogenezi můžeme ovlivnit látkami inhibujícími zánět a imunitní odezvu. Kortikosteroidy nemají přímý účinek na fibrogenezi. Benefit ursodeoxycholové kyseliny byl prokázán jen u primární biliární cirhózy. Nejsou důkazy benefitu anti-TNFα pro progresi jaterní fibrózy, stejně tak i kolchicinu.
Fibrogenezi mohou ovlivnit látky inhibující HSC (hepatic stellate cells – Itovy hvězdicové buňky). Sem patří antioxidanty silymarin, vitamin E, S-adenosylmetionin, propyltiouracil, nicméně jednoznačný efekt prokázán nebyl.
Zkoumají se látky potlačující projevy aktivovaných HSC, např. antagonisté TGFβ, pentoxyfylin, tiazolidin, látky ovlivňující metabolizmus leptinu.
Další skupinou jsou látky stimulující apoptózu HSC, např. interferon γ, sulfasalazin, kurkumin – PPARγ ligand – součást koření kari a další.
Nicméně vše je zatím ve stadiu experimentálního výzkumu [47].
Režimová a preventivní opatření
Častý a logický je dotaz nemocných s chronickým jaterním onemocněním, a tedy i s cirhózou, na schopnost vykonávat zaměstnání. Ta se řídí příslušnými předpisy posudkového lékařství, nicméně obecně platí, že nemocní s kompenzovanou jaterní cirhózou by neměli vykonávat těžkou fyzickou práci, zatímco dekompenzovaná jaterní cirhóza je důvodem pracovní neschopnosti. Dalším častým dotazem je význam podávání tzv. hepatoprotektiv. I když nebyl podán jasný důkaz jejich benefitu v progresi jaterní fibrózy, podáváme je nakonec i z psychologických důvodů. Jiný dotaz bývá na lázeňskou léčbu. Má roborující účinek, nicméně ve stadiu nekompenzované cirhózy je lázeňská léčba kontraindikována. Problematika dietního režimu a nutriční podpory je zmíněna v předešlých kapitolách, stejně tak problematika alkoholu, virových hepatitid a NAFLD, nejčastějších příčin jaterní cirhózy.
S tím, jak se daří zvládat dekompenzaci cirhózy a prodlužovat přežívání nemocných s jaterní cirhózou, se stává aktuálním problémem včasná diagnostika HCC. Doporučuje se pravidelné sonografické vyšetření jater s odstupem 6 měsíců. Monitorace koncentrace α1-fetoproteinu v rámci screeningu se neosvědčila [47].
prof. MUDr. Jiří Ehrmann, CSc.
ehrmanj@fnol.cz
II. interní klinika – gastro-enterologická a hepatologická LF UP a FN Olomouc
www.fnol.cz
Doručeno do redakce 1. 7. 2016
Přijato po recenzi 29. 7. 2016
Zdroje
1. Ehrmann J. Historie fyzikálních vyšetřovacích metod. In: Táborský M (ed) et al. Interní propedeutika. Mladá fronta: Praha 2014 : 18–24. ISBN 978–80–204–3207–0.
2. Lukl P. Cirrhosis hepatis. In: Lukl P (ed). Vnitřní lékařství. 3. ed. Státní zdravotnické nakladatelství: Praha 1965 : 658–667.
3. Gaiani S, Gramantieri L, Venturoli N et al. What is the criterion for differentiating chronic hepatitis from compensated cirrhosis? A prospective study comparing ultrasonography and percutaneous liver biopsy. J Hepatol 1997; 27(6): 979–985.
4. Siegel CA, Silas AM, Suriawinata AA et al. Liver biopsy 2005: When and how? Clev Clin J Med 2005; 72(3); 199 - 201, 206, 208 passim.
5. Horák J. Kvantifikace jaterních funkcí. In: Ehrmann J, Hůlek P (eds). Hepatologie. 2. ed. Grada: Praha 2014 : 56–59. ISBN 978–80–247–5510–6.
6. Asrani SK, Talwalkar JA, Kamath PS et al. Role of magnetic resonance elastography in compensated and decompensated liver disease. J Hepatol 2014; 60(5): 934–939.
7. [European Association for the Study of the Liver]. EASL clinical practical guidelines: Management of chronic hepatitis B. J Hepatol 2012; 57(1): 167–185.
8. Urbánek P, Husa P, Galský J et al. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Gastroent Hepatol 2012; 66(3): 214–229.
9. Ehrmann J. Alkoholická cirhóza. In: Ehrmann J Jr (ed) et al. Alkohol a játra. Grada: Praha 2006 : 69–87. ISBN 80–247–1048-X.
10. Browning JD, Kumar KS, Saboorian MH et al. Ethnic differences in the prevalence of cryptogenic cirrhosis. Am J Gastroenterol 2004; 99(2): 292–298.
11. Hyysalo J., Männistö VT, Zhou Y et al. A population-based study on the prevalence of NASH using scores validated against liver histology. J Hepatol 2014; 60(4): 839–846.
12. Moreau R et al. [From the editor´s desk]. Alarming increase in NAFLD in China. J Hepatol 2014; 60(4): 839–846.
13. EASL-EASD-EASO clinical practice guidelines for management of non-alcoholic fatty liver disease. J Hepatol 2016; 64(6): 1388–1402.
14. Friedman SL. Liver fibrosis – from bench to bedside. J Hepatol 2003; 38(Suppl 1): S38-S53.
15. Castéra L, Foucher J, Bernard PH et al. Prospective comparsion of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128(2): 343–350.
16. Huang Yi, de Boer WB, Adans LA et al. Image analysis of liver biopsy symples measures fibrosis and predicts clinical outcome. J Hepatol 2014; 61(1): 22–27.
17. Leroy V, Sturm N, Faure P et al. Prospective evaluation of FibroTest®, FibroMetr®, and HepaScore® for staging liver fibrosis in chronic hepatitis B: comparsion with hepatitis C. J Hepatol 2014; 61(1): 28–34.
18. [European Association for the Study of alcoholic Liver Disease]. EASL clinical practical guidelines: management of alcoholic liver disease. J Hepatol 2012; 57(2): 399–420.
19. Askgaard G, Gronbaek M, Kjaer M et al. Alcohol drinking pattern and risk of alcoholic liver cirrhosis: A prospective cohort study. J Hepatol 2015; 62(5): 1061–1067.
20. [European Association for the Study of the Liver]. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases. J Hepatol 2009; 51(2): 237–267.
21. Horák J. Terapie genetické hemochromatózy. In: Horák J (ed) et al. Hemochromatóza. Grada: Praha 2010 : 127–130. ISBN 978–80–247–3287–9.
22. Brůha R, Mareček Z, Pospíšilová L et al. Long-term follow-up of Wilson disease: natural history, treatment, mutation analysis and phenotypic correlation. Liver Int 2011; 31(1): 83–91.
23. Sherlock S, Dooley J. Portální žilní systém a portální hypertenze. In: Sherlock S, Doolet J (eds). Nemoci jater a žlučových cest; český překlad. Čermáková O: Hradec Králové 2004 : 147–185. ISBN 80–86703–00–2
24. De Franchis R. [Baveno VI Faculty]. Expanding consensus in portal hypertension: report of the Baveno IV Consensus Workshop: straitifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63(3): 743–752.
25. [European Association for the Study of the Liver]. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53(3): 397–417.
26. Jalan R, Pavesi M, Saliba F et al. [CANONIC Study Investigators; EASL-CLIF Consortium]. The CLIF Consortium Acute Decompensation score (CLIF-C ADs) for prognosis of hospitalised cirrhotic patients without acute-on-chronic liver failure. J Hepatol 2015; 62(4): 831–840. Erratum in J Hepatol 2015; 63(1): 291.
27. Jalan J, Gines P, Olson JC et al. Acute-on-chronic liver failure. J Hepatol 2012; 57(6): 1336–1348.
28. Mookerjee RJ, Pavesi M, Thomsen KL et al. [CANONIC Study Investigators of the EASL-CLIF Consortium]. Treatment with non-selective beta blockers is associated with reduced severity of systemic inflammation and improved survival of patients with acute-on-chronic liver failure. J Hepatol 2016; 64(3): 574–582.
29. Oliverius M, Bělina F, Novotný J et al. Léčba hepatocelulárního karcinomu a současný stav v České republice. Rozhl Chir 2007; 86(12): 635–641.
30. Bruix J, Herman M. [American Association for the Study of Liver Diseases]. Management of hepatocellular carcinoma: an update. Hepatology 2011; 53(3): 1020–1022.
31. Trunečka P, Froněk J, Janoušek L et al. Prvních 1000 transplantací jater v IKEM. Gastroent Hepatol 2013; 67(5): 399–406.
32. Watt KD, McCashland TM. Transplantation in alcoholic patient. Semin Liver Dis 2004; 24(3): 249–255.
33. Hůlková M, Hosák L. Alkoholismus a abúzus alkoholu. In: Ehrmann J, Hůlek P (eds). Hepatologie. 2. ed. Grada: Praha 2014 : 344–355. ISBN 978–80–247–5510–6.
34. Fraňková S, Šperl J. Léčba virových hepatitid u pacientů s cirhózou. In: Ehrmann J, Hůlek P (eds). Hepatologie. 2. ed. Grada: Praha 2014 : 271–273. ISBN 978–80–247–5510–6.
35. Horák J, Vaňásek T. Autoimunitní postižení jater. In: Ehrmann J, Hůlek P (eds). Hepatologie. 2. ed. Grada: Praha 2014 : 297–313. ISBN 978–80–247–5510–6.
36. Runyon BA. AASLD Practice Guideline. Management of adult patients with ascites due to cirrhosis – update 2012. Dostupné z WWW: <https://www.aasld.org/sites/default/files/guideline_documents/adultascitesenhanced.pdf>.
37. Thévenot T, Burelu C, Oberti F et al. Effect of albumin in cirrhotic patients with infection other than spontaneous bacterial peritonitis. A randomized trial. J Hepatol 2015; 62(4): 822–830.
38. Moller S, Hansen EF, Becker U et al. Central and systemic haemodynamic effect of terlipressin in portal in portal hypertensive patients. Liver 2000; 20(1): 51–59.
39. Moreau R, Bataller R, Berg T et al. [From the editor´s desk]. Baveno 6 consensus report: Variceal bleeding deaths reduced by 30 % in 25 years. J Hepatol 2015; 63(3): 537–539. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2015.07.003>.
40. Vaňásek T. TIPS in the management of bleeding due to portal hypertension. In: Hůlek P, Krajina A. Current Practise of TIPS. Olga Štambergová: Hradec Králové 2001 : 120–133. ISBN 80–902883–2-4.
41. Bernard B, Grangé JD, Khac EN et al. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology 1999; 29(6): 1655–1661.
42. Tripathi D, Hayes PC. Beta-blockers in portal hypertension: new developments and controversies. Liv Intern 2014; 34(5): 655–667.
43. Brůha R. Léčba jaterní encefalopatie. In: Brůha J. Jaterní encefalopatie: komplikace jaterní cirhózy. Medprint: Praha 2000 : 58–80. ISBN 80–902036–0-7.
44. Wohl P, Wohl P, Wohl R et al. Metabolické aspekty jaterní cirhózy a nutriční intervence. In: Zazula R et al (ed). Ročenka intenzivní medicíny. Galén: Praha 2003–2004 : 134–141.
45. Plauth M, Cabré E et al. ESPEN guidelines on enteral nutrition: liver disease. Clin Nutr 2006; 25(2): 285–294.
46. Šatrová J. Dietologie u nemocí trávicího traktu. In: Lukáš K, Žák A et al (eds). Gastroenterologie a hepatologie. Grada: Praha 2007 : 325–336. ISBN 978–80–247–1787–6.
47. Zois CD, Baltayiannis GH, Karayiannis P et al. Systematic review: hepatis fibrosis-regression with therapy. Aliment Pharmacol Ther 2008; 28(10): 1175–1187.
48. Ehrmann J. Režimová a preventivní opatření v hepatologii. In: Horák J, Ehrmann J (eds): Hepatologie do kapsy. Mladá fronta: Praha 201 : 209–214. ISBN 978–80–204–3299–5.
Štítky
Diabetologie Endokrinologie Gastroenterologie a hepatologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 7-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Milan Kvapil slaví 60!
- Pozdrav jubilantovi prof. MUDr. Milanovi Kvapilovi, CSc.
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
-
Kateřina Štěchová (ed), Eva Kravarová, Milan Kvapil, Lenka Lhotská, Pavlína Piťhová, Šárka Slabá.
Technologie v diabetologii -
Jozef Kollár.
Aterotrombóza – patofyziológia a epidemiológia -
Vratislav Sedlák, Petr Vaník.
Ultrazvuk hrudníku v klinické praxi
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



