-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Normální lidský imunoglobulin pro subkutánní podání v léčbě primární imunodeficience
27. 6. 2024
Substituční terapie imunoglobulinem G (IgG) se běžně používá k prevenci infekcí spojených s primárním imunodeficitem (PID). Protilátky je možné podat intravenózní infuzí, u některých pacientů je však výhodné subkutánní podání. Přinášíme vám přehledné shrnutí dat o účinnosti a bezpečnosti 20% imunoglobulinového koncentrátu z dárcovské plazmy pro subkutánní podání.
SCIG − na koncentraci záleží
Podkožní podání imunoglobulinové substituční léčby (SCIG) je u některých pacientů výhodnější než dlouho zavedená intravenózní léčba (IVIG). Profitují z něj zejména nemocní se špatným žilním přístupem nebo v riziku systémových nežádoucích účinků. Další výhodou SCIG je možnost podání v domácím prostředí. Pro pacienty je tak terapie pohodlnější, snazší a poskytuje jim větší nezávislost.
V posledních desetiletích proto roste obliba subkutánně podávané substituční léčby. Koncentrace IgG v těchto přípravcích obvykle bývá 10–20 %. Vyšší koncentrace imunoglobulinu snižuje objem infuze a zkracuje čas podání, což přípravky s vyšší koncentrací IgG činí zvláště výhodnými.
Inovativní 20% koncentrát normálního lidského IgG (IGSC-C 20%) se připravuje z plazmy dárců pomocí frakcionace ethanolem za studena, srážení kaprylátem s následnou filtrací a poté se purifikuje pomocí aniontově-výměnné chromatografie. Pro léčbu pacientů s primárním imunodeficitem byl americkým Úřadem pro kontrolu potravin a léčiv (FDA) schválen v roce 2019, schválení Evropskou lékovou agenturou (EMA) následovalo v roce 2022. Přípravek IGSC-C 20% je bioekvivalentní se stejným způsobem připravovaným 10% koncentrátem pro intravenózní podání, a to s podobným bezpečnostním profilem a snášenlivostí.
Jeho účinnost, bezpečnost a farmakokinetický profil byly u pacientů s PID hodnoceny v klinické studii fáze III. V souladu s metodikou navrženou EMA bylo primárním cílem této studie ověřit, zda profylaxe každotýdenním podáním IGSC-C 20% povede k roční míře závažných bakteriálních infekcí (SBIs − serious bacterial infections) ≤ 1 případ na osobu a rok.
Metodika a cíle studie
Multicentrická jednoramenná otevřená studie probíhala ve 22 centrech v celkem 8 zemích (Austrálie, Česko, Francie, Maďarsko, Německo, Polsko, Španělsko, Velká Británie). Všichni účastníci byli po dobu nejméně 3 měsíců před vstupem do studie léčeni IVIG nebo SCIG a v období před zahájením studijní léčby jim byla 2× změřena údolní (trough) koncentrace IgG. V průběhu studie si pacienti po dobu 52 týdnů doma 1× týdně aplikovali IGSC-C 20% v dávce ekvivalentní jejich předchozí léčbě (minimální dávka 100 mg/kg/týden).
Primárním cílem studie byl počet a frekvence SBIs. Mezi sekundární cíle patřila míra výskytu jakýchkoliv infekcí (nezávažných a závažných), nutnost podání antibiotické léčby (profylakticky či terapeuticky), počet hospitalizací z důvodu infekce a související léčby a také průměrná údolní koncentrace IgG v ustáleném stavu. Studie také zahrnovala subpopulaci dospělých pacientů pro hodnocení farmakokinetického profilu – série vzorků byla odebrána v průběhu 7 dnů před a po podání 17. infuze. Bezpečnost byla hodnocena klinicky a laboratorně v měsíčních intervalech.
Výsledky
Studie se zúčastnilo 61 pacientů s protilátkovou primární imunodeficiencí. Nejčastěji se jednalo o běžnou variabilní imunodeficienci (CVID, 63,9 %) nebo Brutonovu agamaglobulinémii (21,3 %). Medián doby od stanovení diagnózy PID činil 5,99 roku. Mezi pacienty bylo 19 dětí ve věku od 2 do 12 let, 10 adolescentů do 16 let a 32 dospělých. Většina pacientů byla před vstupem do studie léčena IVIG (65,6 %), třetině (34,4 %) nemocných byly podávány SCIG.
Účinnost léčby
Celkem bylo v průběhu studie aplikováno 3045 infuzí testovaného přípravku. Rok sledování dokončilo 90,2 % účastníků. Pouze 1 pacient prodělal v průběhu studie závažnou bakteriální infekci, a to pneumonii, která byla úspěšně ambulantně vyléčena perorální antibiotickou léčbou v průběhu 4 dnů. Roční míra SBIs činila 0,017 případu na osobu a rok (98% interval spolehlivosti [CI] 0,006–0,036), primární cíl studie byl tedy naplněn. Míra nutnosti hospitalizace z důvodu infekce byla taktéž nízká (0,017 případu/pacientorok) – došlo pouze k 1 hospitalizaci pro infekci močových cest.
Celkem bylo zaznamenáno 36 infekcí potvrzených radiograficky, kultivačně, pozitivním diagnostickým testem na přítomnost mikroorganismů či přítomností febrilie, což odpovídá roční míře potvrzených infekcí 0,616 případu/pacientorok (95% CI 0,401–0,898). Míra výskytu jakýchkoliv (i nezávažných) infekcí činila 2,397 případu/pacientorok (95% CI 1,824–3,079). Výsledky studie včetně dalších sekundárních cílů přehledně shrnuje obrázek níže.
Obr. Výsledky klinického hodnocení přípravku IGSC-C 20% u pacientů s PID
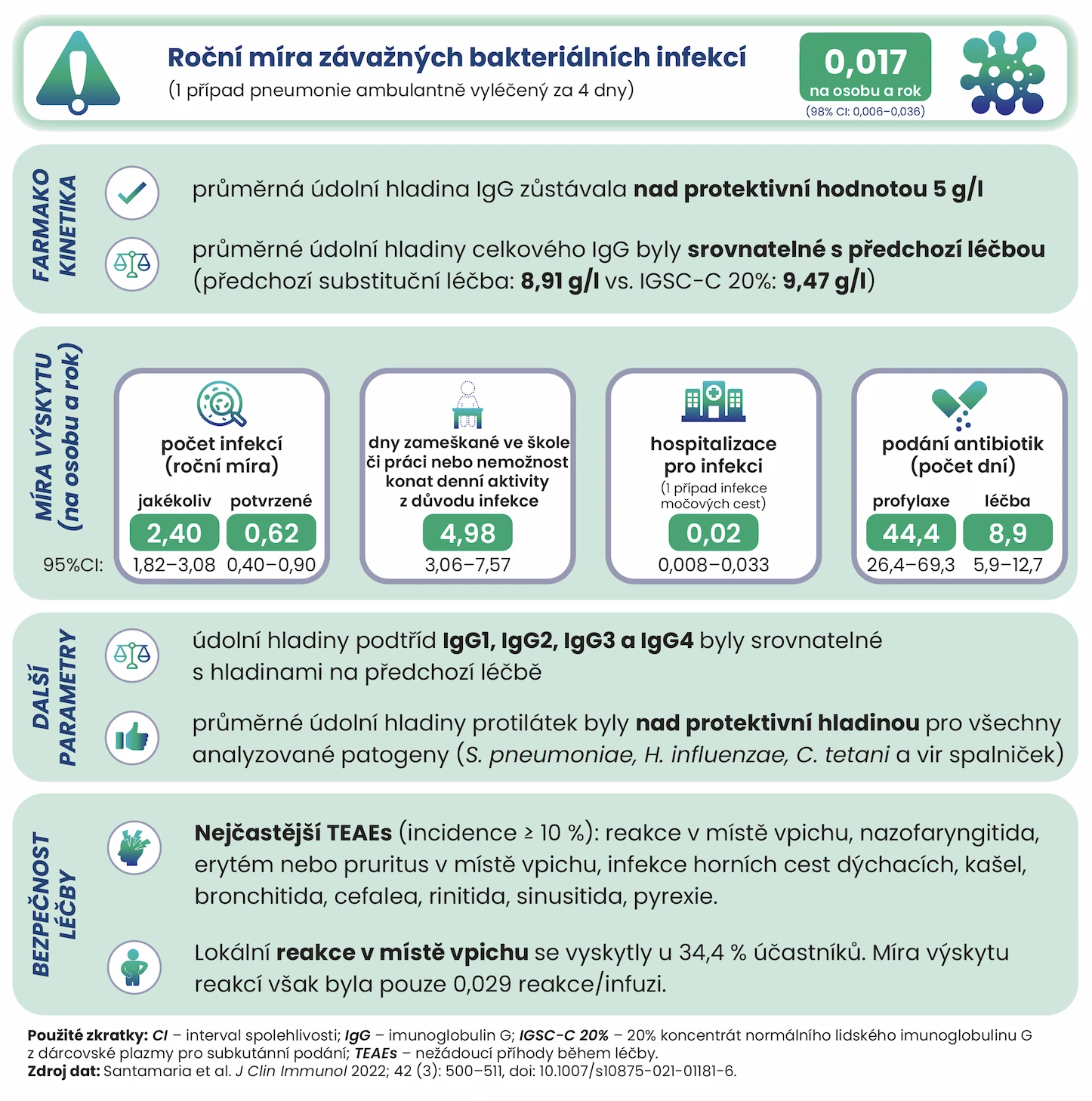
Farmakokinetické vlastnosti
Průměrné údolní (trough) hladiny celkového IgG při použití testovaného přípravku byly srovnatelné s hladinami na předchozí terapii. Ustáleného stavu minimálních hladin podtříd IgG1–4 bylo dosaženo nejpozději ve 13. týdnu podávání a údolní koncentrace jednotlivých podtříd byly srovnatelné s předchozí léčbou a konzistentní napříč věkovými skupinami.
Bezpečnostní profil
Terapie byla předčasně vysazena celkem u 6 pacientů, z toho u 2 z vlastního rozhodnutí účastníka a u 4 pro nežádoucí příhody v průběhu léčby (TEAEs − treatment emergent adverse events). Jednalo se o úzkost nesouvisející s podáváním IGSC-C 20% u 2letého dítěte, nedomykavost aortální chlopně z důvodu vrozené srdeční vady, nefrotický syndrom, který se rozvinul v průběhu léčby, ale nesouvisel s podáváním IGSC-C 20%, a podkožní fibrom.
Většina hlášených TEAEs (97,1 %) byla mírné či střední intenzity, nejčastěji (frekvence ≥ 10 %) se jednalo o nazofaryngitidu, erytém či pruritus v místě vpichu, infekce horních cest dýchacích, kašel, bronchitidu, pyrexii, rinitidu, sinusitidu a bolest hlavy. Lokální reakce v místě podání infuze se vyskytla u 34,4 % účastníků, s mírou výskytu 0,029/infuze.
Závěr
Terapie 20% roztokem normálního lidského IgG z dárcovské plazmy poskytovala dětským i dospělým pacientům s PID efektivní ochranu proti závažným bakteriálním infekcím, a to s dobrým bezpečnostním profilem. Zaznamenány byly protektivní titry protilátek proti S. pneumoniae, H. influenzae, tetanu a spalničkám. Testovaný přípravek pro podkožní podání tak nemocným s PID nabízí další terapeutickou možnost.
(este)
Zdroje:
1. Santamaria M., Neth O., Douglass J. A. et al. A multi‑center, open‑label, single‑arm trial to evaluate the efficacy, pharmacokinetics, and safety and tolerability of IGSC 20% in subjects with primary immunodeficiency. J Clin Immunol 2022; 42 (3): 500–511, doi: 10.1007/s10875-021-01181-6.
2. Sleasman J. W., Lumry W. R., Hussain I. et al. Immune globulin subcutaneous, human - klhw 20% for primary humoral immunodeficiency: an open-label, Phase III study. Immunotherapy 2019; 11 (16): 1371–1386, doi: 10.2217/imt-2019-0159.
3. Grifols’ XEMBIFY receives European approvals, expanding access to innovative therapies. Grifols, 2022 Mar 10. Dostupné na: www.grifols.com/en/view-news/-/news/grifols-xembify-receives-european-approvals-expanding-access-to-innovative-therapies
4. SPC Xembify. Dostupné na: https://prehledy.sukl.cz/prehledy/v1/dokumenty/15153
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Nejčtenější tento týden- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- INFOGRAFIKA: Světový den boje proti rakovině... aneb jaké výzvy stojí před českou onkologií?
- AI pomůže personalizovat léčbu fibrilace síní
- Česká gastroenterologie jde s dobou. Už 80 let
- Původní český test ALBA pro odhalení mírných kognitivních deficitů získal certifikaci MZ ČR
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



