Molekulová patológia endometriálneho karcinómu – prehľad
Molecular pathology of endometrial carcinoma – a review
Endometrial carcinoma (EC) is the most common malignancy of the female genital tract in developed countries. According to its histomorphologic characteristics EC is divided into endometroid and serous carcinoma; among less common subtypes there are clear cell, mucinous, neuroendocrine and undifferentiated carcinoma and carcinosarcoma. Endometroid and serous EC were essential for the so-called dual classification of EC (type I and type II), which considered mainly epidemiological, clinical and endocrine characteristics.
It was shown that part of the high-grade serous carcinomas (type II) can develop from the endometroid EC by a multiplication of genomic changes and there are also EC, in which both basic types are overlapping. Today it is known that clinical and histological presentation of the EC reflects the genetic and epigenetic alterations affecting mainly PTEN, PIK3CA, KRAS, CTNNB1 and TP53 genes, or leading to microsatellite instability. However, these changes are variably present in both types of EC; therefore dual division of EC has appeared very rigid.
The novel classifications should represent an integrated system which also incorporates the results of the gene expression analyses and multiparallel DNA sequencing. Based on these findings EC were divided into four molecular categories: a) POLE/ultra mutated; b) hyper mutated microsatellite instable; c) “copy number low” d) “copy number high” serous-like carcinoma. This division better reflects the biological characteristics of each EC and represents a base for the individual therapy.
Keywords:
endometrium – carcinoma – immunohistochemistry – genetics
Autoři:
Karol Kajo 1; Miroslava Vallová 1; Csaba Biró 1; Gabriel Bognár 1; Katarína Macháleková 1; Katarína Závodná 2; Štefan Galbavý 1,3; Pavol Žúbor 4
Působiště autorů:
Ústav patológie SZU a OÚSA, Bratislava
1; Oddelenie lekárskej genetiky Ústavu laboratórnej medicíny OÚSA, Bratislava
2; Ústav súdneho lekárstva LF UK, Bratislava
3; Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin
4
Vyšlo v časopise:
Čes.-slov. Patol., 51, 2015, No. 2, p. 65-73
Kategorie:
Přehledový článek
Souhrn
Endometriálny karcinóm (EC) je vo vyspelých krajinách sveta najčastejšou malignitou ženského genitálneho traktu. EC sa na základe histomorfologických charakteristík delí na endometroidný a serózny karcinóm, resp. na ďalšie zriedkavejšie podtypy (svetlobunkový, mucinózny, neuroendokrinný, nediferencovaný karcinóm a karcinosarkóm). Endometroidný a serózny EC boli podkladom pre tzv. duálnu klasifikáciu EC (typ I a typ II), ktorá zohľadňovala najmä ich epidemiologické, klinické a endokrinné charakteristiky. Ukázalo sa, že časť high-grade seróznych karcinómov (typ II) môže vznikať z endometroidných EC ďalším hromadením genomických zmien a že existujú aj EC, v ktorých sa prekrývajú oba základné typy. Dnes je známe, že za klinickú a histomorfologickú prezentáciu EC sú zodpovedné genetické a epigenetické alterácie, ktoré najčastejšie postihujú gény PTEN, PIK3CA, KRAS, CTNNB1 a TP53, resp. rezultujú do mikrosatelitnej instability. Tieto zmeny sú variabilne zastúpené v oboch typoch EC, a preto sa duálne delenie EC ukázalo ako veľmi rigidné.
Nové klasifikácie by mali predstavovať integrovaný systém, ktorého súčasťou budú aj výsledky analýz génovej expresie a multiparalelného sekvenovania DNA. Na základe súčasných poznatkov boli EC rozdelené do 4 molekulových skupín: a) POLE/ultramutované; b) hypermutované mikrosatelitne instabilné; c) „copy number low“ a d) „copy number high“ podobné seróznym karcinómom. Toto rozdelenie lepšie vystihuje biologické charakteristiky každého EC a je prípravou na individualizáciu terapie.
Kľúčové slová:
endometrium – karcinóm – imunohistochémia – genetika
Endometriálny karcinóm (EC) je vo vyspelých krajinách sveta najčastejšou malignitou ženského genitálneho traktu (1-4). Ročne je na celom svete diagnostikovaných približne 150 000 nových prípadov EC. Závažným epidemiologickým fenoménom pri EC je neustály nárast jeho incidencie (2,4). Preto je potrebné zintenzívniť štúdium etiopatogenetických a rizikových faktorov a hľadať možnosti adekvátnej individualizovanej liečby založenej na identifikácii prognosticky a prediktívne relevantných molekulových parametrov.
Väčšina prípadov (až 75 %) EC je diagnostikovaná vo včasných štádiách ochorenia, t.j. v štádiách I a II FIGO (International Federation of Gynecology and Obstetrics), v ktorých 5 rokov prežíva 74 - 91 % pacientok. Na druhej strane v pokročilom štádiu ochorenia, t.j. v IV. štádiu podľa FIGO, sa 5 rokov dožíva len jedna štvrtina, resp. jedna pätina pacientok s EC (4).
Predkladaná práca prezentuje prehľad historických, súčasných a perspektívnych pohľadov na taxonómiu EC, zohľadňujúci úroveň súčasného poznania najmä so zameraním sa na molekulovú podstatu tohto ochorenia.
TAXONÓMIA ENDOMETRIÁLNYCH KARCINÓMOV
1. Patologická klasifikácia EC
EC predstavuje heterogénne nádorové ochorenie s viacerými histomorfologickými podtypmi vzniknutými na podklade rozličných rizikových faktorov a prekurzorových lézií a vykazujúcimi rozdielnu prognózu (5). V súčasnosti sa v každodennej klinickej praxi využíva klasifikácia EC založená na histopatologických kritériách bunkového typu, stupňa diferenciácie a štádia ochorenia. Na základe komplexného posúdenia týchto parametrov je pacientka následne liečená (6-8). Najčastejším typom EC je endometroidný endometriálny karcinóm (EEC); menej časté sú serózne a svetlobunkové karcinómy, resp. zriedkavejšie typy, ako sú mucinózny, neuroendokrinný, nediferencovaný karcinóm a karcinosarkóm (8). Pacientky vo včasnom štádiu EEC sú liečené len adjuvantnou rádioterapiou, avšak prípady so seróznym typom EC a EEC v pokročilom štádiu ochorenia sú liečené chemoterapiou. Preto je exaktná typizácia kritická pre výber primeranej adjuvantnej terapie (9).
Na základe poznatkov molekulovej biológie je dnes jasné, že iniciácia, progresia a metastázovanie EC sú asociované s genetickými a epigenetickými alteráciami (10,11). Z toho vyplýva, že rozličné podtypy EC sú spojené s rozdielnymi molekulovými zmenami (5). Ukázalo sa, že približne 25 % nádorov, ktoré boli patológmi klasifikované ako high-grade EEC vykazuje molekulový fenotyp podobný seróznym EC, napr. s častými mutáciami TP53 a extenzívnymi somatickými alteráciami počtu kópií celých génov alebo úsekov DNA (somatic copy number alterations - SCNA) (9). Preto diagnostika EC by nemala vystihovať len izolované histomorfologické charakteristiky, ale mala by zohľadňovať aj molekulové alterácie zodpovedné za fenotypové charakteristiky a biologické správanie jednotlivých EC.
2. Duálna klasifikácia EC
Na základe epidemiologických, klinických, metabolických a endokrinných charakteristík boli pred tridsiatimi rokmi EC rozdelené do dvoch patogenetických podtypov, a to na typ I a typ II (12). Základné klinické a patologické charakteristiky oboch typov sú uvedené v tabuľke 1.
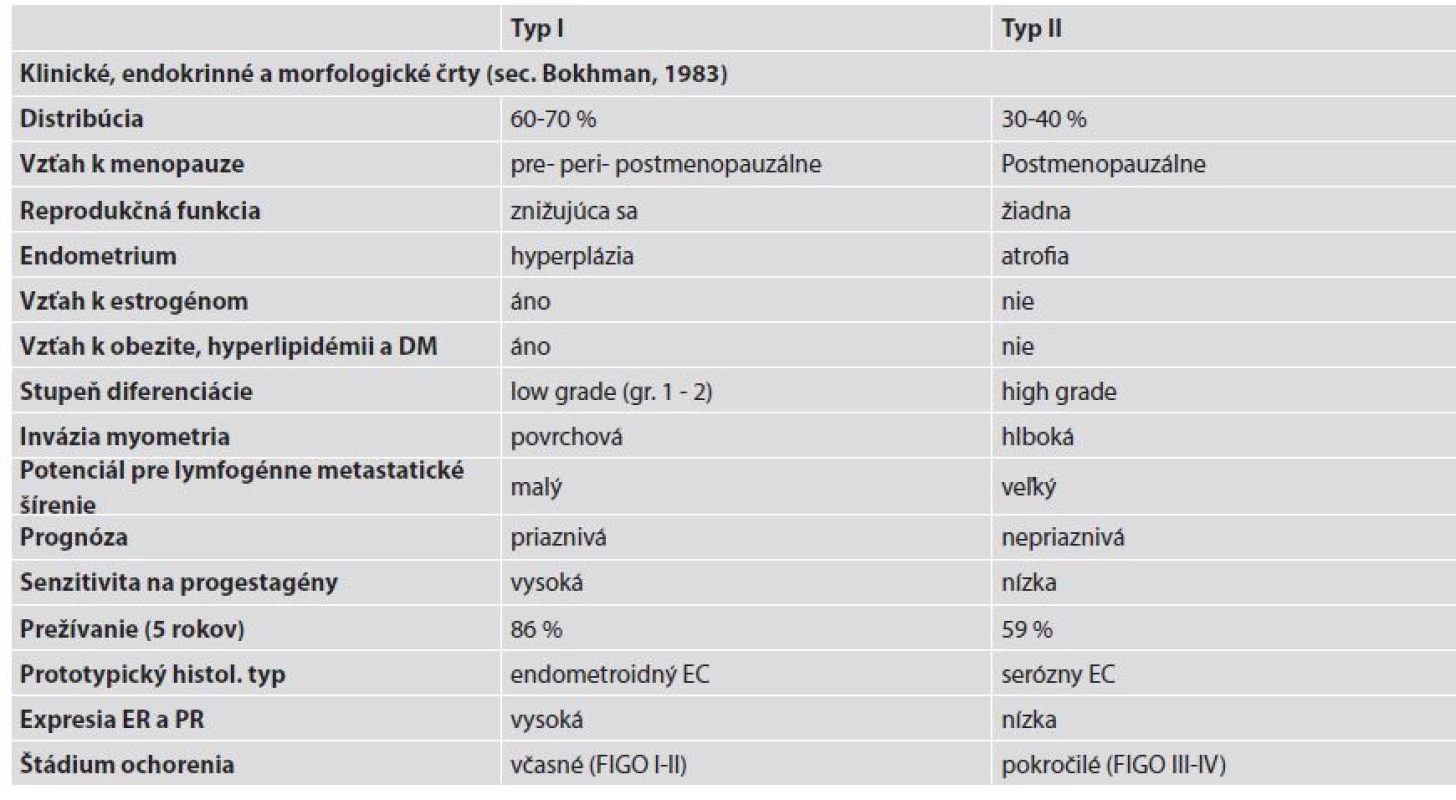
Typ I endometriálnych karcinómov
Typ I EC reprezentuje najčastejšiu formu sporadických EC so 70 - 80 % podielom zo všetkých EC (13). Ide o nádory vzniknuté na podklade excesu estrogénov, nulliparity, obezity, zvýšenej expresie hormónových receptorov a endometriálnej hyperplázie. Z hľadiska histopatológie sú to dobre a stredne diferencované EEC s priaznivou prognózou (13,14).
Molekulová patogenéza EEC
Molekulovo-genetické alterácie, ktoré sú zahrnuté v evolúcii EEC sú sčasti rozdielne oproti tým, ktoré sú zahrnuté pri vývoji typu II EC (ne-endometroidné EC – NEEC) (3) – tab. 2. Potvrdzujú to výsledky komplementárnych DNA analýz, ktoré jasne poukázali na rozdielne génové expresie medzi týmito typmi nádorov. Charakteristickými molekulovými črtami EEC sú najmä mikrosatelitná instabilita (MSI) a mutácie PTEN (Phosphatase and tensin homoloque), PIK3CA (Phosphatidylinositol-4,5-bisphosphonate 3-kinase, catalytic subunit alpha), KRAS (Kirsten rat sarcoma viral oncogene homolog) a CTNNB1 (β-catenin). Podobne ako pri iných orgánoch, napr. prsník a ovárium, približne 90 % EC je sporadických a zostávajúcich 10 % má hereditárny pôvod (14,15).
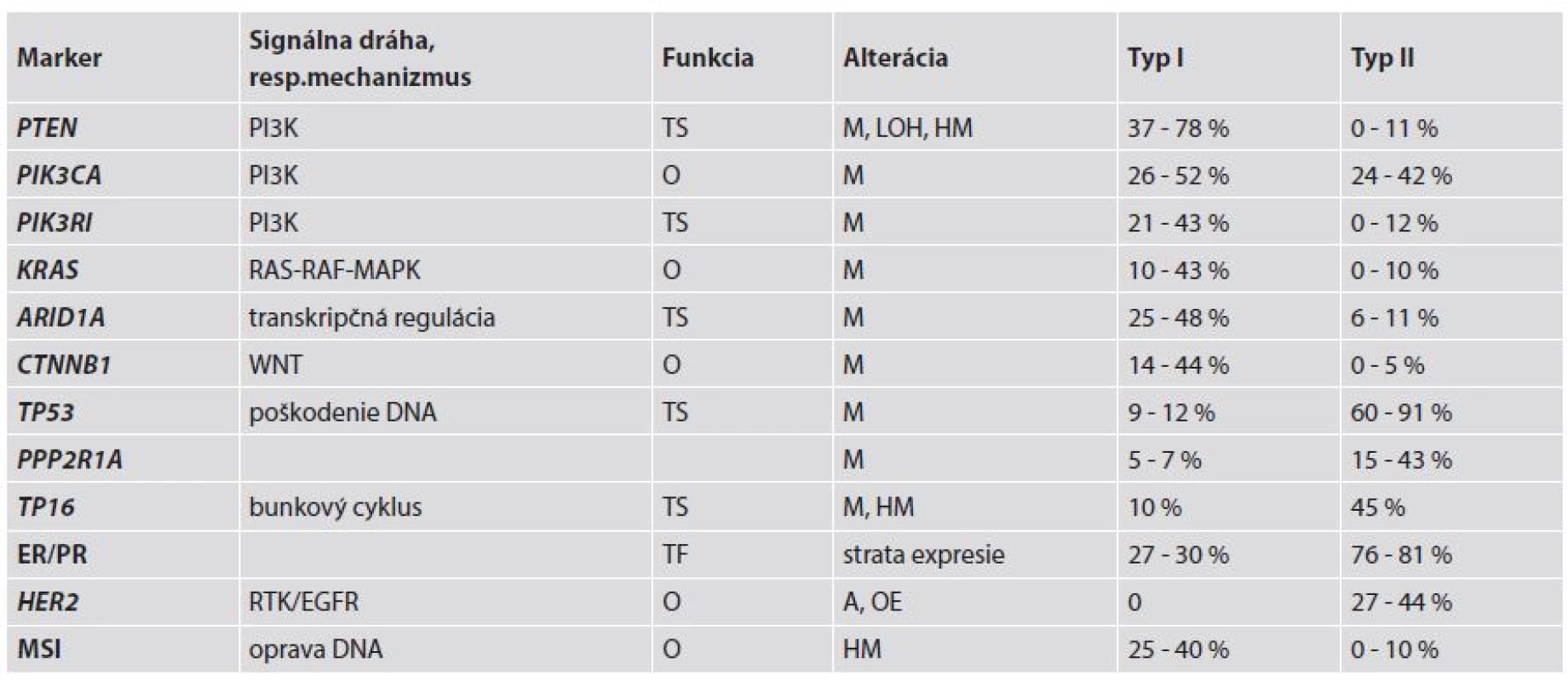
MSI bola pôvodne opísaná u pacientov s hereditárnym ne-polypóznym kolorektálnym karcinómom (HNPCC) a tiež v sporadických kolorektálnych karcinómoch. MSI sa vyskytuje v približne 75 % EC asociovaných s HNPCC a v 25-40 % sporadických EC, ale len v ojedinelých prípadoch NEEC (1,4). U pacientov s HNPCC sú prítomné zárodočné mutácie v „mismatch repair“ (MMR) génoch MLH1 (mutL homolog 1), MSH2 (mutS homolog 2), MSH6 (mutS homolog 6) a PMS2 (postmeiotic segregation increased 2) ako prvý zásah (first hit) a EC sa vyvinie až po delécii alebo mutácii v druhej alele týchto génov (second hit) (16). V etiopatogenéze EC sú v súvislosti s Lynchovým syndrómom (LS) najčastejšie a najvýznamnejšie mutácie v MSH6. Ak sa u pacientky s LS vyvinú viaceré nádory, tak EC obvykle vzniká ako neskoršie nádorové ochorenie. Preto má veľký význam genetická konzultácia aj s následnými genetickými testami za účelom dôkazu alebo vylúčenia zárodočných mutácií v MMR génoch, napríklad u pacientov s prvotným kolorektálnym karcinómom (17). Pri sporadických EC je hlavnou príčinou inaktivácie MHL1 hypermetylácia jeho promotora, čím dochádza k MMR deficiencii, ktorá následne vedie k akumulácii mutácií v kódujúcich aj nekódujúcich sekvenciách DNA (tzv. mikrosatelitoch) v dôležitých génoch, ako sú napr. MSH3, BAX, MSH6, BCL10 a APAF1 (3). Tieto alterované gény by mohli byť potenciálnymi cieľmi v procese nádorovej progresie v EC s MSI (1).
PTEN je tumor supresorový gén lokalizovaný na chromozóme 10q23.3. Proteín PTEN plní dve základné biochemické funkcie, a to jednak cestou aktivity lipidovej a na druhej strane aj proteínovej fosfatázy. Lipidová fosfatáza má úlohu v PI3K signálnej ceste, kde negatívne kontroluje PI3K fosforyláciu. Takto zastavuje bunkový cyklus v G1/S cez nadmernú reguláciu inhibítoru cyklín-dependentných kináz (napr. p27) (18). Aktivita proteínovej fosfatázy je zahrnutá v inhibícii fokálnych adhezívnych formácií a potlačení migrácie a tiež v inhibícii rastovým faktorom stimulovanej MAPK signálnej cesty. Ak dôjde k stratám aktivity lipidovej a proteínovej fosfatázy, tak sa zvýši bunkový rast, bunky unikajú apoptóze a môže dôjsť k ich abnormálnej migrácii (13). Inaktivácia PTEN môže byť navodená rôznymi mechanizmami, ako sú delécie (strata heterozygozity - LOH), bodové mutácie alebo hypermetylácia promotora. LOH sa na chromozóme 10q23 vyskytuje v 40 % EC. Somatické mutácie PTEN sú prítomné v 37 - 78 % EEC (1,3,4,16) a sú častejšie v MSI-pozitívnych prípadoch EEC (60 - 80 %) ako v MSI-negatívnych EEC (24 - 35 %) (1,18). Paradoxne, prípady EC s alterovaným génom PTEN sú spojené s lepšou prognózou (1).
PIK3CA je gén lokalizovaný na 3q26.32, ktorý kóduje 110α katalytickú jednotku PI3K (fosfoinozitol 3-kinázu). Mutácie PIK3CA môžu byť lokalizované na helikázovej (exón 9) alebo kinázovej (exón 20) doméne a menej často na exónoch 1-7. Tieto mutácie boli zaznamenané v 24 - 52 % prípadov EC, pričom často koexistujú s mutáciami PTEN. Zaujímavosťou je, že mutácie v exóne 20 sú asociované s nepriaznivými prognostickými faktormi, ako sú high-grade a hlbšia myometriálna invázia (1,3,4). Mutácie PIK3CA sú súčasťou alterácií PI3K-AKT signálnej dráhy v EC a okrem EEC sa vyskytujú aj v NEEC, resp. zmiešaných EEC-NEEC. Navyše až v 43 % EEC sú prítomné aj mutácie PIK3RI, čo je gén kódujúci P85a, ktorý predstavuje inhibičnú podjednotku PI3K (1).
Mutácie KRAS boli zaznamenané v 10 - 43 % prípadov EEC a spolu so zriedkavými alteráciami BRAF sa podieľajú prostredníctvom RAS-RAF-MEK-ERK signálnej dráhy na tumorigenéze EC (1,3,4). Jedným z efektorov RAS je RASSF1A, ktorý zohráva inhibičnú úlohu. Tento býva inaktivovaný v priebehu karcinogenézy a jednou z významných ciest jeho vyradenia z funkcie je hypermetylácia jeho promotora, ktorá bola dokázaná v 85,4 % EEC. Táto alterácia bola zároveň spojená s nepriaznivými prognostickými znakmi, ako sú vyšší histologický grade, hlbšia myometriálna invázia a metastázy v panvových lymfatických uzlinách (19).
Beta-katenínový gén (CTNNB1) je lokalizovaný na 3p21 a kóduje β-katenín, ktorý je zahrnutý v komplexe s E-kadherínom. Tento komplex zohráva dôležitú úlohu v bunkovej diferenciácii a zachovaní normálnej tkanivovej mikroarchitektoniky (1). Pri mutácii v 3. exóne CTNNB1 dochádza k stabilizácii β-katenínového proteínu a jeho cytoplazmatickej a jadrovej akumulácii, a tým k účasti na transdukcii signálu a transkripčnej aktivácii cestou formovania komplexu s DNA viažúcimi proteínmi. Mutácie v 3. exóne sa vyskytujú v 14 - 44 % EEC a pravdepodobne sú spojené s dobrými prognostickými znakmi (1,4).
Z ostatných génov, u ktorých boli opísané mutácie a súvislosť so vznikom EC je ARID1A. Tento gén predstavuje komponent komplexu remodulujúceho chromatín. Mutácie ARID1A alebo strata expresie jeho proteínového produktu BAF250a boli zaznamenané v 29 % low-grade EEC a v 39 % high-grade EEC, resp. 26 % svetlobunkových EC a v 18 % seróznych EC (4).
Pri korelácii low-grade EEC s high-grade EEC sa ukázalo, že oba podtypy vykazujú často mutácie PTEN, PIK3CA, ARID1A, KRAS and CTNNB1, pričom v low-grade EEC chýbajú mutácie TP53. Na druhej strane high-grade EEC majú síce rovnaké mutácie vyššie uvedených génov ako v low-grade EEC, ale navyše sú u nich časté mutácie TP53. Časté mutácie PTEN v EEC potvrdzujú jeho účasť vo včasných štádiách nádorovej progresie. MSI sa vyskytuje rovnako v low-grade EEC ako v high-grade EEC, čo svedčí o tom, že väčšina high-grade EEC môže vznikať progresiou z low-grade EEC (5).
V súvislosti s hereditárnymi formami EC sú okrem vyššie uvedeného LS spomínané Cowdenov syndróm (CS) a Peutz-Jeghersov syndróm (PJS). Ide o autozomálne dominantné hereditárne ochorenia. Pri CS sa vyskytujú hamartómy vo viacerých lokalitách a pacienti sa vyznačujú zvýšeným rizikom vzniku malígnych nádorov v prsníku, štítnej žľaze a v endometriu. Približne 80 % pacientok s CS má zárodočnú mutáciu v géne PTEN. Pri PJS sú časté početné hamartomatózne polypy v gastrointestinálnom trakte a mukokutánne pigmentácie. Pacienti s PJS majú zvýšené riziko vzniku nádorov práve v gastrointenstiálnom trakte a približne 9 % celoživotné riziko pre rozvinutie EC. Približne 80-94 % pacientov s PJS má mutácie génu LKB1, ktorý kóduje serín/threonínovú kinázu, ktorá priamo fosforyluje centrálny metabolický senzor AMPK, a tým sa podieľa na regulácii metabolizmu glukózy, lipidového metabolizmu, bunkovej proliferácie a bunkovej polarite (17).
Prekurzory EEC
Bezprostredným prekuzorom typu I EC je endometriálna intraepitelová neoplázia (EIN), ktorá vzniká z latentných prekanceróznych zmien v morfologicky normálnych endometriálnych žľazách, ktoré vykazujú somatické mutácie PTEN. Výskyt PTEN deficientných latentných prekanceróznych zmien je častý, vyskytujú sa u 43 % premenopauzálnych žien (20-22). Napriek tejto vysokej prevalencii latentných prekanceróznych zmien je výskyt EC relatívne nízky, o čom svedčí celoživotné riziko EC len okolo 2,6 % (22). Ak sa EIN vyvinie, tak až jedna tretina pacientok má zároveň okultný karcinóm a tie pacientky, u ktorých ešte EC nie je vyvinutý, tak tieto majú až 45-násobné riziko vzniku EC v porovnaní s pacientkami s endometriálnou hyperpláziou bez EIN (23). Evolučnú asociáciu medzi EIN a EC dotvárajú aj poznatky o podobných genetických alteráciách medzi EIN a EC. Okrem alterácií PTEN ide o MSI a mutácie CTNNB1. Včasnou zmenou v patogenéze EEC je tiež hypermetylácia MLH1, ktorá sa zvyčajne vyskytuje už v prekurzorových léziách typu atypickej endometriálnej hyperplázie (16,18). Taktiež mutácie CTNNB1 boli opísané už v atypických hyperpláziách endometria, a to najmä v tých, ktoré boli spojené so známkami skvamóznej metaplázie a s tvorbou morúl (1). Strata vyššie opísaného proteínu BAF250a pri mutáciách ARID1A bola zaznamenaná v 16 % komplexných a atypických endometriálnych hyperplázií (1).
Typ II endometriálnych karcinómov
Typ II EC tvorí približne 10 - 20 % EC. Tento typ vzniká u starších, štíhlych žien, bez hormonálnych alebo metabolických zmien a podkladom jeho vzniku je atrofické endometrium. Ide o NEEC, ktoré sú spojené so zlou prognózou (4,12-14). Tento typ je charakterizovaný seróznym EC a pravdepodobne sem možno zaradiť časť iných zle diferencovaných fenotypov, ako sú svetlobunkový EC, high-grade EEC, nediferencovaný karcinóm a karcinosarkóm (22,24).
Molekulová patogenéza NEEC
Na molekulovej úrovni sú NEEC spojené s mutáciami p53, značne redukovanou expresiou E-kadherínu, amplifikáciou HER2 alebo nadmernou expresiou HER2 proteínu, alteráciami p16 a tiež génmi zúčastňujúcimi sa na regulácii kontrolného bodu pre správnu funkciu deliaceho vretienka (mitotic spindle checkpoint) (1,3). Výraznou molekulovou črtou NEEC je chromozómová instabilita. Tento fenomén je charakterizovaný viacpočetnými získaniami alebo stratami častí chromozómov a je spojený s aneuploidiou (16).
Primárnym genetickým defektom pri NEEC sú teda mutácie p53, ktoré sa vyskytujú v 75 - 100 % NEEC, pričom vo vyššie opísaných EEC sú alterácie p53 zaznamenané len v približne 10-20 % prípadov, a to najmä v high-grade nádoroch (1,3,4,18). Za normálnych okolností po poškodení DNA nastáva akumulácia p53 v jadre, čo vedie k zastaveniu bunkového cyklu inhibíciou cyklín D1 fosforylácie Rb génu a zahájením apoptózy. Pri mutáciách p53 dochádza k akumulácii nefunkčného p53 proteínu, ktorý pôsobí ako dvojito negatívny inhibítor „wild-type“ p53, čím dochádza k propagácii aberantných buniek (18).
HER2/neu je onkogén, ktorý kóduje transmembránový receptor s tyrozín-kinázou funkciou, ktorý je zahrnutý v prenose signálu (18). Amplifikácia HER2 alebo nadmerná expresia jeho proteínu bola zaznamenaná v 27 - 44 % NEEC (1,4,16).
Inaktivácia regulátora bunkového cyklu p16 bola dokázaná v 40-45 % NEEC, v porovnaní s 10 % EEC (16,18). Tumor supresorový gén p16 je lokalizovaný na 9p21 a kóduje regulátorový proteín bunkového cyklu. Pri inaktivácii p16 dochádza k nekontrolovanému bunkovému rastu (18). Hlavnými mechanizmami inaktivácie p16 sú delécie a hypermetylácia (16).
Redukovaná expresia E-kadherínu môže byť spôsobená LOH alebo hypermetyláciou promotora. Strata heterozygozyty 16q22.1 bola zaznamenaná v 60 - 62 % seróznych karcinómov a v 87 % svetlobunkových karcinómov, ale len v 22 % EEC (16,18). E-kadherín je transmembránový proteín, ktorého intracelulárna doména sa viaže pomocou katenínu na cytoskeletálny aktín. Znížená expresia E-kadherínu je spojená so stratou medzibunkových kohezívnych spojení a uľahčuje motilitu nádorových buniek. Nádory s negativitou E-kadherínu sú zle diferencované NEEC asociované so zlou prognózou (18). Medzi gény zodpovedné za reguláciu deliaceho vretienka patria STK15, BUB1 a CCNB2. Z nich STK15 je esenciálny pre segregáciu chromozómov a funkciu centrozómov. Tento gén je často amplifikovaný v NEEC (3,16).
Ďalším génom opísaným najmä v súvislosti s vývojom NEEC je PPP2R1A, ktorý kóduje a-izoformu podjednotky PP2A holoenzýmu, ktorý je považovaný za predpokladanú súčasť tumor supresorového komplexu. Mutácie PPP2R1A boli identifikované v približne 40 % seróznych EC a v 5 % EEC (1,3,4). Hladina hormónových receptorov je v NEEC podstatne nižšia ako v EEC (1,3,4,9). Ako už bolo vyššie spomenuté, menej častými alteráciami v NEEC v porovnaní s EEC sú alterácie typu MSI, mutácie PTEN, KRAS, CTNNB1 a PIK3CA (1).
Prekurzory NEEC
V roku 2004 bol postulovaný nový model karcinogenézy seróznych karcinómov (25-27), podľa ktorého serózne EC vznikajú predovšetkým v atrofickom endometriu. V ňom najprv nastáva akumulácia p53 v morfologicky normálnych endometriálnych bunkách (tzv. p53 signatúra) a neskôr dochádza k vytvoreniu tzv. endometriálnej glandulárnej dysplázie (EGD) s prechodom do serózneho endometriálneho intraepitelového karcinómu (EIC), z ktorého sa v konečnom štádiu vyvinie invazívny serózny karcinóm (7,22,26,27). EGD sa vyskytuje v 53 % prípadov s EIC, resp. seróznym EC (22). EGD vykazuje cytologické zmeny a alterácie medzi normálnym endometriom a seróznym EIC (25), ide o stratu bunkovej polarity, nukleárny hyperchromatizmus a trojnásobne zväčšené jadrá so zreteľnými jadierkami a minimálne formovanie papíl. V EGD boli zaznamenané alterácie p53, HER2, CDKN2A, Nrf2 a IMP3. Účasť EGD v karcinogenéze NEEC bola potvrdená aj na myšacom modeli. V štádiu EIC sa ďalej pridružujú molekulové abnormity PPP2R1A, FBXW7 a PI3K (27). Vzhľadom k tomu, že boli opísané prípady s propagáciou EIC do peritoneálnej dutiny, mal by EIC byť považovaný za bezprostredný prekurzor serózneho EC. EIC sa vyskytuje v približne 90 % prípadov s invazívnym seróznym EC (22) a len zriedka je diagnostikovaný bez vyvinutého serózneho EC. EIC vykazuje obdobné mutácie p53 a bunkové atypie ako okolitý serózny EC (22). Mutácie p53 sú prítomné v 80 % EIC. Bolo postulované, že mutácia p53 v jednej alele sa vyskytuje vo včasnej fáze karcinogenézy serózneho karcinómu a následná alterácia druhej alely sa objavuje neskôr pri progresii do karcinómu (18). Intenzita farbenia p53 proteínu v seróznych léziách je charakteru „všetko alebo nič“, čo svedčí pre bodové alebo „nonsence“ mutácie génu p53. Na porovnanie je expresia p53 v EEC len sporadická, t.j. len v ojedinelých bunkách (27). Niektoré ďalšie alterácie, napr. polymorfizmy exónu 4 BsTUI p53, sú taktiež spojené so vznikom EC alebo s nepriaznivými prognostickými ukazovateľmi (stupeň diferenciácie, typ II, angioinvázia a hĺbka myometriálnej invázie (28,29).
Limity duálnej klasifikácie EC
Duálny model sa ukázal byť užitočnou pomôckou pri zaraďovaní EC podľa daných kritérií, pretože sčasti zohľadňoval molekulové charakteristiky. Oba typy podľa Bokhmana boli na molekulovej úrovni definované ako homogénne entity s charakteristickými genetickými alteráciami, avšak ako sa neskôr ukázalo, takmer všetky známe molekulové zmeny sa môžu nájsť v oboch typoch EC, aj keď v rozdielnej, resp. štatisticky významnej distribúcii (4). Pritom odlíšenie oboch typov EC je dôležité, pretože oba typy vyžadujú odlišný terapeutický prístup a majú rozdielnu prognózu (30). Časom sa ukázali viaceré limity duálneho rozdelenia, a tieto nedostatky si vyžiadali revíziu a najmä inkorporovanie nových poznatkov o genomike do nových klasifikačných systémov. Pôvodná duálna klasifikácia EC bola zostavená Bokhmanom v roku 1983. Jeho model bol založený na klinických a epidemiologických charakteristikách žien s EC v bývalom Sovietskom zväze a rozlíšenie oboch typov bolo realizované na morfologickej báze (12,13). Aj keď išlo nesporne o nadčasovú klasifikáciu, podľa ktorej je možné aj v súčasnosti klasifikovať väčšinu EC, predsa len došlo k viacerým novým poznatkom a faktorom, ktoré v čase jej vzniku neboli známe, resp. došlo k ich zavedeniu v nedávnej dobe, napr. poznatky v oblasti molekulovej genetiky a zavedenie hormónovej substitučnej liečby. V pôvodnom Bokhmanovom modeli taktiež neboli zahrnuté ostatné high-grade EC, ako sú svetlobunkové a nediferencované karcinómy a karcinosarkómy (4) a neboli zohľadnené ani hereditárne syndrómy, ako je LS, CS a PJS.
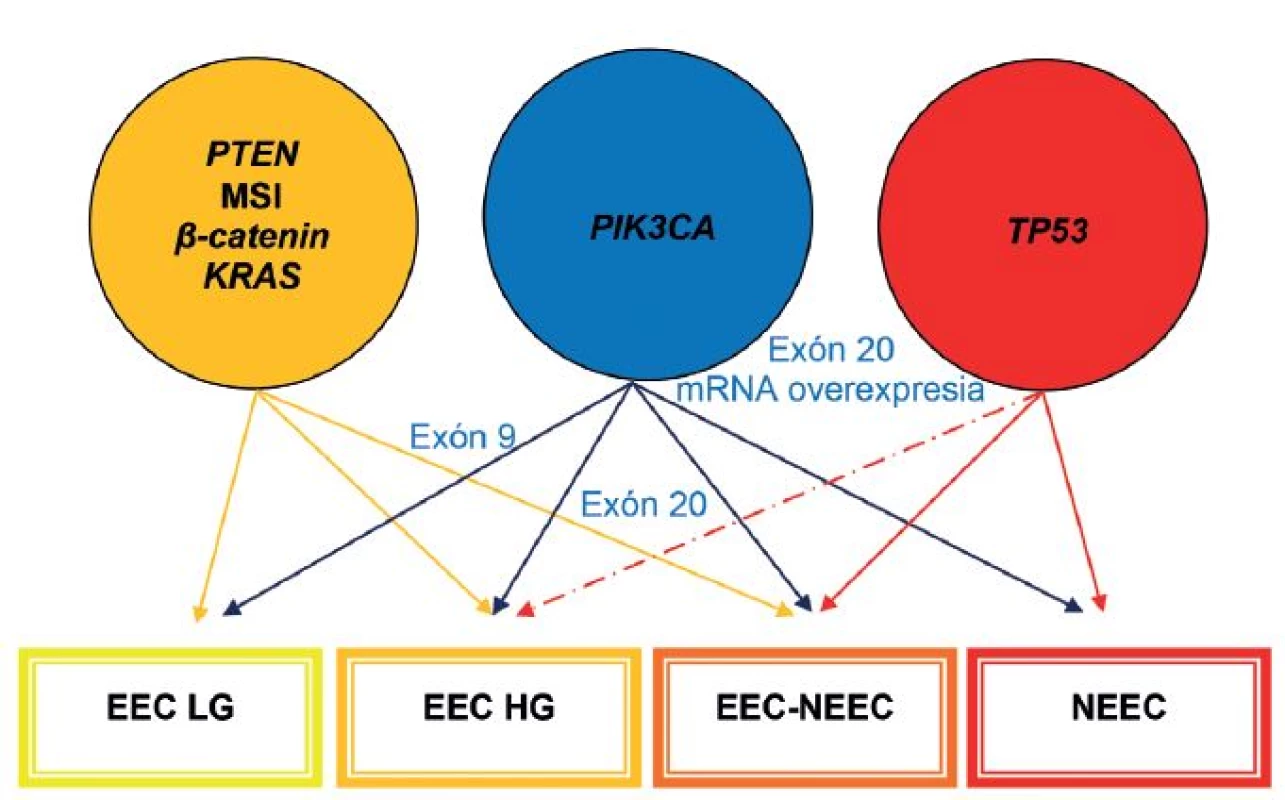
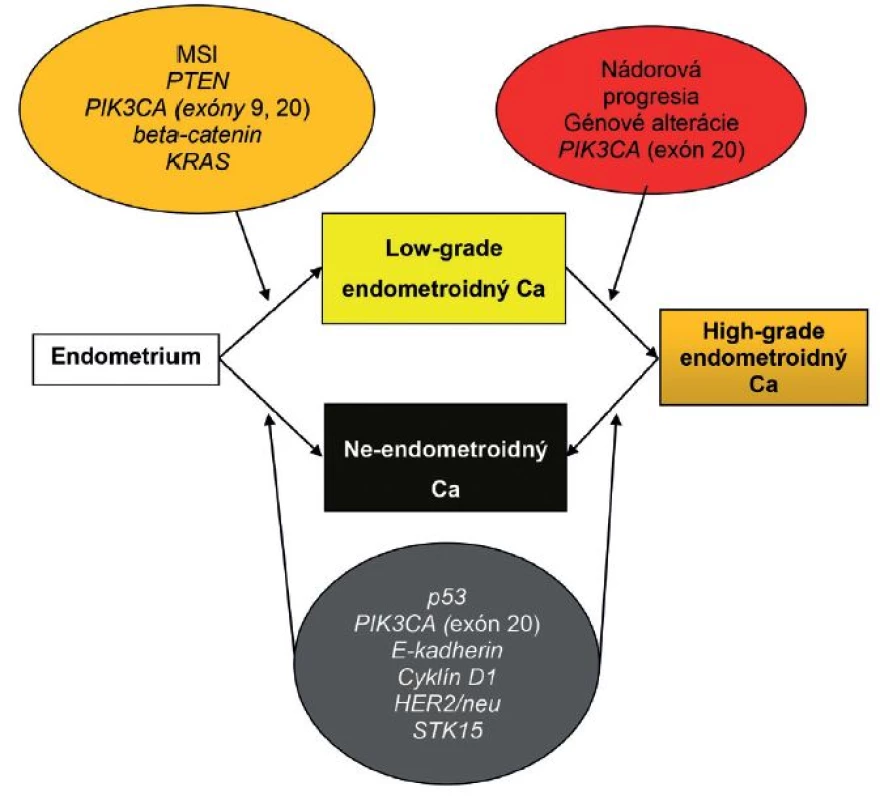
Časom sa ukázalo, že okolo 10 - 19 % EEC je high-grade a majú klinické, histopatologické a molekulové črty prekrývajúce sa s oboma typmi EC. Podobne nie všetky serózne EC sú prototypmi typu II EC, napr. približne 2 % seróznych EC vzniká na podklade endometriálnej hyperplázie a až jedna pätina seróznych EC nie je spojených s hlbokou myometriálnou inváziou (4). Podľa novších poznatkov niektoré z NEEC pravdepodobne vznikajú z EEC formou ďalšej nádorovej progresie, resp. dediferenciácie (3,13,31). Preto nie je prekvapujúce, že niektoré z nádorov vykazujú zmiešané charakteristiky na klinickej, patologickej a molekulovej úrovni (3,31). V súčasnosti sa tieto nádory označujú ako hybridné alebo morfologicky indeterminované karcinómy, keď vykazujú prekrývajúce sa črty najmenej dvoch entít, napr. endometroidný verzus serózny karcinóm, alebo serózny verzus svetlobunkový karcinóm a mali by sa zároveň odlíšiť od zmiešaných epitelových nádorov, v ktorých sú prítomné najmenej dve separátne a odlišné komponenty a každý z komponentov sa prezentuje aspoň 10 %-ným podielom (32). V niektorých nediferencovaných karcinómoch sa nachádzajú okrsky dobre, resp. stredne diferencovaného EEC. Takéto nádory by sa mali označovať ako dediferencované karcinómy. Predominantnou molekulovou črtou vo väčšine z nich je MSI. V ostatných takýchto nádoroch nebola prítomná MSI, ako črta EEC, ale boli dokázané mutácie p53 a amplifikácia alebo nadmerná expresia HER2, ako výsledok neskorých alterácií v priebehu progresie z EEC. Samozrejme, že ak sa tieto alterácie vyskytnú hneď na začiatku nádorového procesu, tak vznikajú de novo zle diferencované EEC alebo ide o serózne karcinómy, ktoré sa vyvinú z EEC (13). Ak sa v zmiešaných EEC-NEEC vyskytuje MSI a alterácie PTEN, KRAS a CTNNB1, tak s veľkou pravdepodobnosťou ide o NEEC, ktoré vznikli z EEC v rámci nádorovej progresie. Na druhej strane je niekedy veľmi ťažké oddiferencovanie high-grade EEC od NEEC, pretože v niektorých high-grade EEC sú prítomné molekulové alterácie charakteristické pre NEEC, ako napr. mutácie p53 (obr. 1, 2) (1). Rozdelenie EC do dvoch typov sa preto ukázalo ako veľmi umelé a príliš rigidné.
Pomerne málo sa vie o molekulových alteráciách karcinosarkómov (malígne zmiešané mülleriánske tumory alebo sarkomatoidné karcinómy), ktoré predstavujú menej ako 5 % EC. Sú to nádory, ktoré vykazujú bifázické črty, t.j. kombináciu malígneho epitelového nádoru so sarkomatoidným komponentom. Na základe súčasných poznatkov by sa mali tieto nádory označovať ako metaplastické karcinómy. Vznikajú na podklade epitelovo-mezenchymálneho prechodu (epithelial to mesenchymal transition - EMT) v EC. EMT predstavuje proces bunkovej transdiferenciácie, pri ktorom epitelové bunky strácajú polaritu a medzibunkový kontakt, reorganizujú svoj cytoskelet, získavajú expresiu mezenchýmových markerov a prejavujú sa migračným fenotypom. Pri EMT bunky získavajú charakteristiky karcinómových kmeňových buniek (CSC) a stávajú sa chemorezistentné (31). Iniciácia EMT môže byť navodená rozličnými signálmi a signálnymi dráhami, ako napr. transformujúcim rastovým faktorom (TGF-beta), tyrozín-kinázovými receptormi a/alebo Wnt. Aktivácia jednej alebo viacerých ciest konverguje v skupine transkripčných faktorov, ako sú Snail1, Slug, ZEB1, ZEB2, E47, E2-2 a Twist, pričom väčšina z nich má schopnosť potláčať E-kadherín, ktorý je zodpovedný za bunkové adhézie a polaritu (1). Fenomén EMT sa prechodne vyskytuje aj v konvenčných EC pri myometriálnej invázii, avšak v karcinosarkómoch je expresia EMT permanentná a vedie k represii niektorých epitelových markerov (napr. E-kadherínu) a k zvýšenej expresii mezenchýmových markerov, čím sa zvýrazňuje sarkomatózny vzhľad v týchto nádoroch. Taktiež dochádza k nadmernej expresii HMGA2 a k mikroRNA signatúre, ktoré sú charakteristické pre karcinosarkómy (3). Štúdie ukázali, že centrálnym mechanizmom kontrolujúcim EMT/CSC predstavuje PI3K/AKT signálna dráha (31). V karcinosarkómoch boli doteraz zaznamenané mutácie TP53 v 44 - 64 %, mutácie PTEN v 11 - 33 %, PIK3CA v 22 - 29 %, PIK3RI v 6 %, ARID1A v 24 %, KRAS v 17 %, PPP2R1A v 21 % a CTNNB1 do 5 % (4). Predpokladá sa, že existujú dve skupiny karcinosarkómov, a to skupina s endometroidným typom mutácií (PTEN a ARID1A) a skupina so seróznym typom mutácií (TP53 a PPP2R1A)(5).
Epigenetické alterácie
V súčasnosti je karcinóm považovaný za dôsledok genetických a epigenetických alterácií. Oba druhy abnormít veľmi často úzko súvisia a dochádza k ich synergickému efektu, napr. mutovaný PTEN pôsobí ako kľúčový mediátor signálnej dráhy, ale navyše funkcia tohto génu môže byť narušená aj histónovou deacetyláciou v promotorovej oblasti. V ostatných génoch, ako sú p16 a Rb boli taktiež zaznamenané genetické alterácie aj epigenetické zmeny. Epigenetické alterácie sú spojené so zmenami génovej expresie bez korešpondujúcich štrukturálnych zmien genómu. Na rozdiel od genetických abnormít sú epigenetické alterácie reverzibilné a vplyvom nových terapeutických modalít je možné obnoviť narušenú funkciu niektorých génov. Základnými epigenetickými alteráciami sú zmeny metylácie DNA (metylácia/demetylácia DNA) a modifikácie histónov (acetylácie/deacetylácie, metylácie/demetylácie, fosforylácie, ubiquitylácie, sumoylácie) (11,33). Aberantná hypermetylácia je obvykle detekovateľná už v prekanceróznych léziách a je signifikantne zvýšená v malígnych léziách v porovnaní s benígnymi nádormi. Okrem spomínaného MLH1, ďalšími génmi alterovanými hypermetyláciou sú estrogénový receptor a (ERa), progesterónový receptor (PR), inhibítor cyklín-dependentnej kinázy 2A/p16 (CDKN2A/P16), SFRP1 (secreted frizzed-related protein1), SFRP2 a SFRP5 (17), ako aj RASSF1A, GSTP1 a CDH1 (19). V iných prácach bola dokázaná signifikantne vyššia metylácia v géne CDH13 v EC v porovnaní s nenádorovým endometriom. Taktiež bola dokázaná vyššia metylácia v génoch WT1 a GATA5 v pokročilejších štádiách EC a v zle diferencovaných EC. Okrem štúdií, ktoré analyzovali epigenetické alterácie jednotlivých génov sa nedávno podarilo zhodnotenie kompletného DNA metylómu v oboch typoch EC aj s komparáciou s normálnym endometriom. V práci bolo zaznamenaných 27009 metylovaných oblastí v EEC a 15676 epigeneticky alterovaných oblastí v NEEC, ktoré boli rozdielne oproti normálnemu endometriu (34).
Štúdium epigenetických mechanizmov má za úlohu sledovanie dvoch základných cieľov, a to identifikáciu nových nádorových biomarkerov (štúdium uplatňovania globálnej hypometylácie a lokálnej hypermetylácie v promotorovej oblasti supresorových génov v procese karcinogenézy) a hľadanie nových terapeutických možností, napr. cestou regulácie týchto epigenetických modifikácií, napr. cez inhibítory DNA metyltransferáz, resp. demetylujúce látky, inhibítory histónovej deacetylázy (11,33-35). Koncept epigenetických regulácií sa preniesol aj do oblasti regulácie nekódujúcej RNA (33).
Nekódujúca RNA
Na vzniku malígneho nádoru sa okrem alterácií kódujúcich génov podieľajú aj tzv. nekódujúce RNA, ktoré môžu byť vo forme mikroRNA alebo v podobe dlhej nekódujúcej RNA.
MikroRNA
MikroRNA (miRNA) sú malé nekódujúce molekuly RNA, ktoré na posttranskripčnej úrovni kontrolujú transláciu a stabilitu mRNA. Sú tvorené 20 - 23 pármi báz (17). Jednotlivé miRNA sa môžu súčasne naviazať na viaceré mRNA a ovplyvňovať ich expresiu. Strata tumor-supresorových miRNA a/alebo získanie onkogenických miRNAs vedie ku tumorigenéze a progresii (1,31). V EC, a hlavne v EEC, môžu byť rôzne miRNA znížene (down-regulated) alebo zvýšene regulované (up-regulated). So zníženou reguláciou sú v literatúre uvedené miR-200a, miR-200b, miR-200c, miR-429, miR-203, miR-205, miR-210 a so zvýšenou reguláciou sú spájané miR-410, miR-15b, miR-17-5p, miR-221, miR-222, miR-424 a ďalšie. Napr. prípady EC s metastázami v lymfatických uzlinách bývajú asociované s expresiou miR-200a, miR-203 a miR-429, a to s 80% senzitivitou a 79% špecificitou (17). Expresia miRNA môže byť spôsobená aberantnou DNA hypermetyláciou, o čom svedčí práca Hirokiho et al. (2012), ktorí dokázali zníženú reguláciu 113 a 54 miRNA v EEC a v NEEC. Jedna z miRNA (miR-34b) bola značne znížene regulovaná, a to práve cestou hypermetylácie (36). V poslednom čase sa ukázalo, že miRNA predstavujú kľúčové regulátory viacerých génov a tiež signálov zahrnutých v získaní EMT/CSC charakteristík, napr. v PI3K/AKT signálnej ceste a ovplyvnení génu HMGA-2 (1,31). Niektoré miRNA môžu tiež slúžiť ako diagnostické biomarkery a pre monitorovanie terapie v EC (17).
Dlhé nekódujúce RNA
Dlhé nekódujúce RNA (lncRNA) sú rozsiahlejšie transkripty (>200 nukleotidov) z intergenických a introgenických oblastí ľudského genómu bez schopnosti kódovať proteíny. Pravdepodobne zohrávajú úlohu pri naväzovaní komplexov modifikujúcich históny na chromatín a pri regulácii transkripcie. Niekoľko lncRNA bolo identifikovaných v súvislosti s vývojom EC, napr. pseudogén PTENP1, ktorý môže regulovať tumor supresorovú úlohu PTEN kompetitívnou väzbou ku niektorým miRNA (1).
3. Genomická klasifikácia
Väčšina doterajších štúdií bola realizovaná na výlučne endometroidných EC a seróznych EC a boli hodnotené len jednotlivé gény alebo signálne dráhy. Až štúdie založené na multiparalelnom sekvenovaní alebo sekvenovaní novej generácie (next-generation sequencing) odhalili široké spektrum genetických alterácií v genóme.
Pri viacúrovňovej evolúcii EC bola zaznamenaná účasť viacerých signálnych dráh, ako sú PI3K/AKT/mTOR, Wnt/β-katenínová signálna transdukčná kaskáda (s APC/β-katenínovou cestou), MAPK/ERK, VEGF/VEGFR ligand-receptorová signálna dráha, Erb signálna cesta, p53/p21 a p16INK4a/pRB (33), z ktorých najvýznamnejšími dráhami s najčastejšími genetickými alteráciami sú PI3K/AKT/mTOR signálna dráha, ktorá reguluje bunkový rast a prežívanie a Wnt/β-katenínová signálna dráha, ktorá reguluje génovú transkripciu a vývoj (4).
Nedávno boli vytvorené viaceré klasifikačné modely na rozlíšenie typu I od typu II EC. Jedným z nich je model založený na analýze rozdielnej expresie 19 génov, pomocou ktorého je možné zaradiť EC do jedného z hlavných typov. V NEEC bola zaznamenaná signifikantná nadmerná expresia v šiestich génoch, a to v L1CAM, CLDN6, RSPO4, PLAG1, FCHO1 a DHCR24 a na druhej strane v EEC bola nadmerná expresia v ostatných 13 génov (PIGR, IHH, TFF3, SPDEF, KIAA1324, C9ORF152, FOXA2, CNGA1, HHAT, UQCR11, MDM2, SORBS2 a PPAP2C). Z týchto génov napr. KIAA1324 je indukovaný estrogénmi, a teda predstavuje dobrý biomarker asociovaný s hyperestrogenickým stavom a s typom I EC. Podobne pri rozlíšení týchto dvoch typov by mohla byť využitá rozdielna expresia klaudínu 1 (CLDN1) a klaudínu 2 (CLDN2) (30).
Najnovšie molekulárne analýzy endometroidných aj seróznych EC založené na erejových technikách (array-based) a multiparalelnom sekvenovaní boli realizované viacerými nezávislými laboratóriami a tiež prostredníctvom projektu The Cancer Genome Atlas (TCGA). Tieto analýzy odhalili niektoré nové štatisticky signifikantne mutované gény v týchto nádoroch (9,37-41). Ide o gény, ktoré sú mutované na štatisticky významnej hladine v porovnaní s normálnym endometriom, a ktoré predstavujú tzv. kandidátne nádorové gény (candidate cancer genes) (42). Na základe výsledkov týchto genomických, transkriptomických a proteomických analýz boli EC rozdelené do štyroch zreteľných molekulových skupín: a/ ultramutované/s mutáciou POLE; b/ hypermutované/s mikrosatelitnou instabilitou (MSI); c/ „copy number low“/mikrosatelitne stabilné (MSS) a d/ „copy number high/serous-like“ (9) – tab. 3.
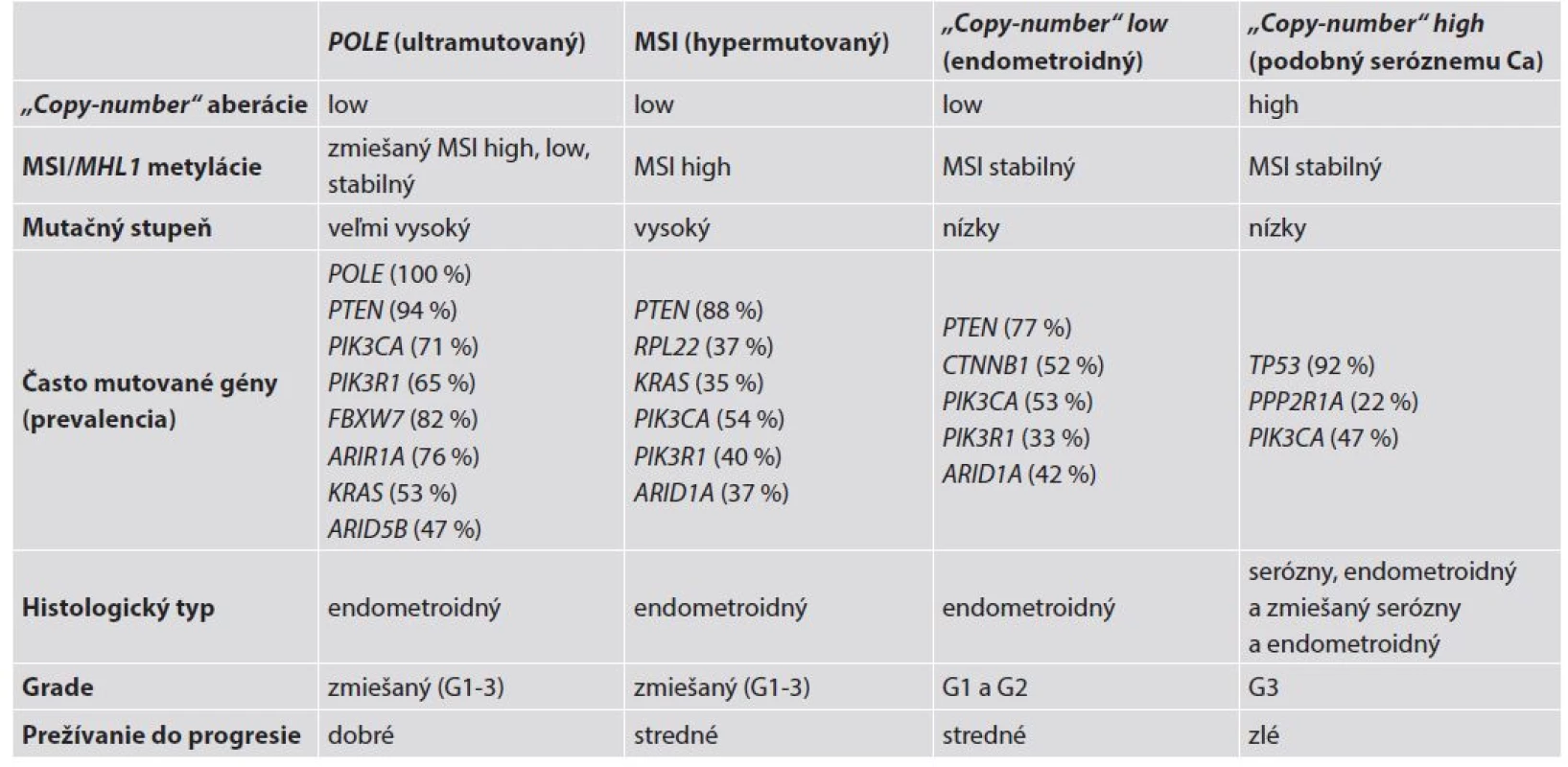
1. POLE mutované/ultramutované tumory sú charakterizované vysokým mutačným pomerom a „hotspot“ mutáciami v exonukleázovej doméne POLE. Ide o podjednotku DNA polymerázy ε, ktorá zohráva úlohu v replikácii DNA. Ďalej sú prítomné aberácie počtu kópií, narastajúca frekvencia C∀A transverzií a mutácie PTEN, PIK3R1, PIK3CA, FBXW7 a KRAS. Táto skupina EC je mikrosatelitne stabilná, má málo SCNA a je spojená s dobrou prognózou;
2. mikrosatelitne instabilná/hypermutovaná skupina EEC je typicky spojená s MSI spôsobenou metyláciou MLH1 promotora, vysokým mutačným pomerom, niekoľkými aberáciami počtu kópií, rekurentnými posunovými mutáciami RPL22 a mutáciami KRAS a PTEN;
3. „copy-number low“ karcinómy sú mikrosatelitne stabilné nádory charakteru grade 1 a 2 EEC, s nízkym mutačným pomerom, vyznačujúce sa častými mutáciami CTNNB1, ale bez mutácií p53;
4. „copy-number high“ tumory (serous-like) sú charakterizované extenzívnymi „copy-number“ aberáciami a nízkym mutačným pomerom, s rekurentnými mutáciami TP53, FBXW7 a PPP2R1A, zriedkavými mutáciami PTEN a KRAS a sú spojené so zlou prognózou. V tejto genomickej kategórii sú všetky serózne a zmiešané EEC-NEEC a štvrtina EEC s grade 3 (4,9).
Výsledky TCGA štúdie priniesli možnosti praktického uplatnenia v patológii. Hodnotenie génov alebo ich produktov môže poskytnúť dôležité informácie potrebné k spresneniu diagnózy. V diferenciálnej diagnostike endometroidných a seróznych EC je možné použiť sekvenovanie (alebo imunohistochémiu) k vyšetreniu stavu génu TP53 (proteínu p53), PTEN (PTEN), PPP2R1A (PPP2R1A) a ARID1A (ARID1A) alebo vyšetrenie DNA MMR génov (alebo ich proteínov) k stanoveniu exaktnej diagnózy. Napríklad, nádory s mutovaným (alterovaným) TP53 (TP53) alebo PPP2R1A (PPP2R1A), pri „wild“- type (nezmenenom) PTEN (PTEN), ARID1A (ARID1A) alebo DNA MMR génov (alebo ich proteínov) môžu byť diagnostikované ako serózne EC, zatiaľ čo opačný genetický profil svedčí pre endometroidné EC (4).
Treba si však uvedomiť, že doterajší katalóg genetických cieľov v EEC aj NEEC bol spracovaný z analýz primárnych nádorov pred liečbou, takže vyvstáva otázka, či sa v budúcnosti neobjavia nové genetické ciele alebo zmeny v rekurentných alebo perzistujúcich nádoroch refraktérnych na liečbu alebo v ich metastázach. Taktiež neboli patrične analyzované iné zriedkavé podtypy EC, ako sú mucinózne, skvamózne a malobunkové karcinómy a pod. U nich sa predpokladá identifikácia ďalších génov alebo nová kombinácia somatických genetických alterácií, ktoré budú špecifické pre tieto nádorové podtypy (4,42). Vyššie spomínané analýzy realizované TCGA poukázali na to, že serózne EC vykazujú určité prekrývajúce črty s ovariálnymi seróznymi karcinómami a s bazaloidnými prsníkovými karcinómami, napr. mutácie p53 sa vyskytujú v 91 % a 96 % endometriálnych a ovariálnych seróznych karcinómov a v 84 % prsníkových bazaloidných karcinómov. Na druhej strane mutácie PTEN sú vo všetkých týchto nádoroch zriedkavé – len v 1 - 2 %. Tieto poznatky by mohli viesť k novým možnostiam pri vytváraní spoločných terapeutických paradigiem (9).
Z hľadiska aplikácie výsledkov nových genomických analýz do duálneho modelu predstavujú typ I (low-grade) EC heterogénnu skupinu nádorov s MSI (hypermutované), POLE (ultramutované) a s „copy-number low“ fenotypmi, zatiaľ čo do typu II (high-grade) EC sú zaradené serózne karcinómy a časť high-grade endometroidných EC (4).
ZÁVER
Primárna diagnostika EC je založená na histomorfogickom vyšetrení, ktoré poskytuje základné informácie o typizácii, stupni diferenciácie a štádiu ochorenia týchto nádorov. Duálna klasifikácia je nesporne užitočným nástrojom v diagnostike EC, avšak nedokáže klasifikovať časť high-grade EC a EC s prekrývajúcimi sa črtami medzi oboma typmi. Štúdium molekulových mechanizmov nám poskytlo cenné informácie pre pochopenie karcinogenézy EC a zaujatie postoja k predikcii prognózy. Nové poznatky v oblasti genomiky EC poukazujú na nevyhnutnosť integrácie molekulových alterácií do klasifikačných schém a využitie molekulových cieľov pri hľadaní nových terapeutických stratégií (4,18), čo však presahuje rámec predkladaného prehľadu
POĎAKOVANIE
Autori ďakujú Lige proti rakovine za podporu Projektu nádorovej biobanky a FISH diagnostiky na Ústave patológie SZU a OÚSA v Bratislave.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka i všetkých spoluautorov.
Adresa pre korešpodenciu:
Doc. MUDr. Karol Kajo, Ph.D.
Ústav patológie SZU a OÚSA
Heydukova 10, 812 50 Bratislava
tel.: +421 2 3224 9536, fax: +421 2 3224 9515
e-mail: karol.kajo@ousa.sk
Zdroje
1. Matias-Guiu X, Prat J. Molecular pathology of endometrial carcinoma. Histopathology 2013; 62(1): 111-123.
2. Safaei-Diba Ch, Pleško I, Hlava P. Incidencia zhubných nádorov v Slovenskej republike 2007. Národný onkologický register SR, NCZI: Bratislava; 2012: 136.
3. Yeramian A, Moreno-Bueno G, Dolcet X, et al. Endometrial carcinoma: molecular alterations involved in tumor development and progression. Oncogene 2013; 32(4): 403-413.
4. Murali R, Soslow RA, Weigelt B. Classification of endometrial carcinoma: more than two types. Lancet Oncol 2014; 15(7): e268-e278.
5. McConechy MK, Ding J, Cheang MC, et al. Use of mutation profiles to refine the classification of endometrial carcinomas. J Pathol 2012; 228(1): 20-30.
6. Prat J, Gallaro A, Coutrecasas M, Catasús L. Endometrial carcinoma: pathology and genetics. Pathology 2007; 39(1): 72-87.
7. Nakayama K, Nakayama N, Ishikawa M, Miyazali K. Endometrial serous carcinoma: its molecular characteristics and histology-specific treatment strategies. Cancers (Basel) 2012; 4(3): 799-807.
8. Zaino R, Carinelli SG, Ellenson LH, et al. Epithelial tumours and precursors. In: Kurman RJ, Carcangiu ML, Herrington CS, Young RH, eds. WHO Classification of tumours of female reproductive organs. Lyon: IARC; 2014: 125-135.
9. Kandoth C, Schultz N, Cherniack AD, et al. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497(7447): 67-73.
10. Ma X, Gao X. Epigenetic modification and carcinogenesis of human endometrial cancer. Austin J Clin Pathol 2014; 1(3): 9.
11. Hatzimichael E, Crook T. Cancer epigenetics: new therapies and new challenges. J Grug Deliv 2013; 2013: 529312.
12. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15(1): 10-17.
13. Abal M, Planaguma J, Gil-Moreno A, et al. Molecular pathology of endometrial carcinoma: transcriptional signature in endometroid tumors. Histol Histopathol 2006; 21(2): 197-204.
14. Doll A, Abal M, Rigau M, et al. Novel molecular profiles of endometrial cancer – new light through old window. J Steroid Biochem Mol Biol 2008: 108(3-5): 221-229.
15. Okuda T, Sekizawa A, Purwosunu Y, et al. Genetics of Endometrial Cancers. Obstet Gynecol Int 2010; 2010: 984013.
16. Llobet D, Pallares J, Yeramian A, et al. Molecular pathology of endometrial carcinoma: practical aspects from the diagnostic and therapeutic viewpoints. J Clin Pathol 2009; 62(9): 777-785.
17. Banno K, Nogami Y, Kisu I, et al. Candidate Biomarkers for Genetic and Clinicopathological Diagnosis of Endometrial Cancer. Int J Mol Sci 2013; 14(6): 12123-12137.
18. Bansal N, Yenduri V, Wenham RM. The molecular biology of endometrial cancers and the implications for pathogenesis, classification, and targeted therapies. Cancer Control 2009; 16(1): 8-13.
19. Fiolka R, Zubor P, Janusicova V, et al. Promoter hypermethylation of the tumor-suppressor genes RASSF1A, GSTP1 and CDH1 in endometrial cancer. Oncol Rep 2013; 30(6): 2868-2871.
20. Mutter GL, Lin MC, Fitzgerald JT, et al. Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers. J Natl Cancer Inst 2000; 92(11): 924-931.
21. Mutter GL. PTEN, a protean tumor suppressor. Am J Pathol 2001; 158(6): 1895–1898.
22. Merritt MA, Cramer DW. Molecular pathogenesis of endometrial and ovarian cancer. Cancer Biomark (2010); 9(1-6): 287–305.
23. Baak JP, Mutter GL, Robboy S, et al. The molecular genetics and morphometry-based endometrial intraepithelial neoplasia classification system predicts disease progression in endometrial hyperplasia more accurately than the 1994 World Health Organization classification system. Cancer 2005; 103(11): 2304–2312.
24. Sherman ME, Bur ME, Kurman RJ. p53 in endometrial cancer and its putative precursors: evidence for diverse pathways of tumorigenesis. Hum Pathol 1995; 26(11): 1268-1274.
25. Zheng W, Liang SX, Yu H, Rutherford T, Chambers SK, Schwartz PE. Endometrial glandular dysplasia: a newly defined precursor lesion of uterine papillary serous carcinoma. Part I: morphologic features. Int J Surg Pathol 2004; 12(3): 207-223.
26. Zheng W, Xiang L, Fadare O, Kong B. A proposed model for endometrial serous carcinogenesis. Am J Surg Pathol 2011; 35(1): e1-e14.
27. Han LM, Wei L, Ferguson DC, Chambers SK, Fadare O, Wang Y, Zheng W. From endometrial glandular dysplasia to endometrial serous carcinoma: insights into underlying biological aspects. Am J Clin Obstet Gynecol 2013; 1(1): 1-16.
28. Zubor P, Stanclova A, Kajo K, et al. The p53 codon 72 exon 4 BstUI polymorphism and endometrial cancer in Caucasian women. Oncology 2009; 76: 173-83.
29. Kafshdooz T, Tabrizi AD, Ardabili SMM, et al. Polymorphism of p53 Gene Codon 72 in Endometrial Cancer: Correlation with Tumor Grade and Histological Type. Asian Pac J Cancer Prev 2014; 15(22): 9603-9606.
30. Sung CO, Sohn I. The expression pattern of 19 genes predicts the histology of endometrial carcinoma. Sci Rep 2014; 4: 5174.
31. Dong P, Konno Y, Watari H, Hosaka M, Noguchi M, Sakuragi N. The impact of microRNA- mediated PI3K/AKT signalling on epithelial-mesenchymal transition and cancer stemness in endometrial cancer. J Transl Med 2014; 12: 231.
32. Soslow RA. High-grade endometrial carcinomas – strategies for typing. Histopathology 2013; 62(1): 89-110.
33. Ma X, Ma CX, Wang J. Endometrial carcinogenesis and molecular signaling pathways. Am J Mol Biol 2014; 4: 134-149.
34. Zhang B, Xing X, Li J, et al. Comparative DNA methylome analysis of endometrial carcinoma reveals complex and distinct deregulation of cancer promoters and enhancers. BMC Genomics 2014; 15: 868.
35. Dvořáková E, Chmelařová M, Laco J, Palička J, Špaček J. Methylation analysis of tumor suppressor genes in endometroid carcinoma of endometrium using MS-MLPA. Biomed Pap Med Fac Univ Palacky Olomouc Czech Republ 2013; 157(4): 298-303.
36. Hiroki E, Suzuki F, Akahira J, et al. MicroRNA-34b function as a potential tumor suppressor in endometrial serous adenocarcinoma. Int J Cancer 2012; 131(4): E395-404.
37. Kuhn E, Wu RC, Guan B, et al. Identification of molecular pathway aberrations in uterine serous carcinoma by genome-wide analyses. J Natl Cancer Inst 2012; 104(19): 1503-1513.
38. Le Gallo M, O’Hara AJ, Rudd ML, et al. Exome sequencing of serous endometrial tumors identifies recurrent somatic mutations in chromatin remodeling and ubiquitin ligase complex genes. Nat Genet 2012; 44(12): 1310-1315.
39. Zhao S, Choi M, Overton JD, et al. Landscape of somatic single-nucleotide and copy-number mutations in uterine serous carcinoma. Proc Natl Acad Sci USA 2013; 110(8): 2916-2921.
40. Liang H, Cheung LW, Li J, et al. Whole-exome sequencing combined with functional genomics reveals novel candidate driver cancer genes in endometrial cancer. Genome Res 2012; 22(11): 2120-2129.
41. Kinde I, Bettegowda C, Wang Y, et al. Evaluation of DNA from the Papanicolaou test to detect ovarian and endometrial cancers. Sci Transl Med 2013; 5(167): 167ra4.
42. Bell DW. Novel genetic targets in endometrial cancer. Exp Opin Ther Targets 2014; 18(7): 725-730.
43. Salvesen HB, Haldorsen IS, Trovik J. Markers for individualized therapy in endometrial carcinoma. Lancet Oncol 2012; 13(8): e353-361.
Štítky
Patologie Soudní lékařství ToxikologieČlánek vyšel v časopise
Česko-slovenská patologie

2015 Číslo 2
Nejčtenější v tomto čísle
- Praktické poznámky k vyšetření placenty ve druhém a třetím trimestru gravidity
- Molekulová patológia endometriálneho karcinómu – prehľad
- Neobvyklý pľúcny nález masívneho vyplnenia alveolov penovitými makrofágmi pri kongenitálnej epidermolysis bullosa po aspirácii súčastí plodovej vody u novorodenca prežívajúceho 15 dní bez akýchkoľvek príznakov poškodenia dýchacích funkcií
- MONITOR aneb nemělo by vám uniknout, že...
