-
Medical journals
- Career
Léčba píštělí orální části gastrointestinálního traktu na chirurgické jednotce intenzivní péče
Authors: J. Kulda; T. Kural; D. Hasman; P. Novák; M. Brabec
Authors‘ workplace: Chirurgická klinika FN Plzeň, přednosta: prof. MUDr. Vladislav Třeška, DrSc.
Published in: Rozhl. Chir., 2010, roč. 89, č. 7, s. 421-426.
Category: Monothematic special - Original
Overview
Retrospektivně jsme sledovali soubor konsekventně léčených nemocných s píštělemi horní části gastrointestinálního traktu, tedy píštělemi s vnitřním ústím v oblasti jícnu, žaludku a orální části tenkého střeva, hospitalizovaných na našem pracovišti (septická jednotka intenzivní péče Chirurgické kliniky, Fakultní nemocnice v Plzni) v době od 1. ledna 2006 do 31. prosince 2008. Statisticky jsme vyhodnotili výsledky naší léčby a pokusili jsme se vysledovat příčinnou souvislost mezi charakteristikou píštělí, případně léčebným postupem a mortalitou resp. morbiditou nemocných.
Klíčová slova:
gastrointestinální píštěl – sepse – SOWATS pravidlaÚVOD
Gastrointestinální píštěl je patologicky vzniklá komunikace mezi gastrointestinálním traktem (GIT) a jiným orgánem nebo tělesnou dutinou, resp. mezi dvěma oddíly GIT. Takovou píštěl označujeme jako vnitřní. Patologickou komunikaci mezi GIT a kožním povrchem nazýváme zevní neboli enterokutánní píštěl.
Gastrointestinální píštěle lze rozdělit podle několika hledisek. Z hlediska etiologie vzniku píštěle se rozlišují píštěle vrozené a získané. Na základě velikosti odvodu rozeznáváme píštěle s nízkým odvodem (do 500 ml/24 hodin) a píštěle s vysokým odvodem (více než 500 ml/24 hod). Anatomické hledisko rozeznává píštěle proximální části GIT (jícen, žaludek, duodenum, resp. duodeno-jejunální přechod) a píštěle distální části GIT (tenké střevo, tračník) [1].
MATERIÁL A METODA
V této retrospektivní analýze tvořili sledovaný soubor nemocní s píštělemi orální části GIT, kteří byli konsekventně hospitalizováni na jednotce intenzivní péče Chirurgické kliniky FN Plzeň od 1. ledna 2006 do 31. prosince 2008. Věk, pohlaví, způsob léčby ani příčina vzniku píštěle nebyly limitujícím faktorem pro zařazení do sledované skupiny. Naopak byli vyloučeni nemocní s biliární, pankreatickou píštělí nebo s píštělí lokalizovanou na aborální části GIT (distální jejunum, ileum, tračník a rektum). Studovali jsme etiologii píštělí, lokalizaci vnitřního ústí, resp. ústí na GIT, přítomnost sepse, potřebu chirurgické intervence, velikost derivace píštěle, mortalitu, potřebu umělé plicní ventilace (jako známku orgánové dysfunkce), sérovou hladinu albuminu v době rekonstrukční operace (u nemocných, u kterých nebyl zapotřebí rekonstrukční chirurgický výkon, jsme stanovili hladinu albuminu v době, kdy jsme se snažili o kontrolu septického ložiska), délku hospitalizace a její vztah k velikosti odvodu píštělí.
V léčbě jsme postupovali podle pravidel SOWATS. V první řadě jsme se snažili o kontrolu sepse odstraněním jejího zdroje, buď chirurgickým zákrokem nebo použitím miniinvazivních postupů (endoskopická stentáž, drenáž pod CT kontrolou) a antibiotickou léčbou. Následně jsme se pokusili vytvořit podmínky pro spontánní uzávěr píštěle (enterální/parenterální výživa, korekce metabolických poruch, místní ošetřování zevního ústí píštěle a jeho okolí, psychologická podpora, ev. antidepresivní terapie). V případě neúspěchu konzervativních postupů následoval pokus o rekonstrukční chirurgický výkon, zpravidla v odstupu 6 týdnů od vzniku píštěle.
Do skupiny nemocných se spontánním uzávěrem píštěle jsme zařadili i případy, kdy byl sice učiněn pokus o chirurgické řešení, ale došlo k recidivě píštěle a ta byla následně zhojena konzervativním přístupem.
VÝSLEDKY
Sledovaný soubor tvořilo 28 nemocných, z toho 20 mužů (71,4 %) a 8 žen (28,6 %). Průměrný věk nemocných byl 62,9 roku s rozptylem od 22 let do 85 let. Průměrná délka hospitalizace (počítali jsme celkovou délku pobytu v nemocnici) byla 43,1 dne (od 7 do 141 dnů). Z celkového počtu nemocných bylo 11 (39 %) s velkým odvodem píštělí a 17 (61 %) s malým odvodem píštělí (Tab. 3), přičemž skupina nemocných s vysokým odvodem píštělí, ve srovnání se skupinou nemocných s nízkým odvodem píštělí, byla starší (65,9 let vs. 58,1 let), byla postižena sepsí ve 100 % proti 76,5 % u píštělí s nízkým odvodem, chirurgická příčina vzniku byla u této skupiny častější (81,8 % vs. 50 %). Nemocní s vysokým odvodem píštělí byli hospitalizováni déle (59,9 dnů vs. 32,3 dnů), spontánní uzávěr píštěle byl u této skupiny méně častý (27,3 % proti 47,1 %) a mortalita vyšší (45,5 % proti 29,4 %). Známky sepse jsme diagnostikovali u 24 nemocných (85,7 %). U všech nemocných se sepsí byla potřebná umělá plicní ventilace (UPV). Průměrná délka hospitalizace nemocných, kteří prodělali sepsi, byla 47 dní, zatímco u pacientů bez známek sepse pouze 19,8 dní. Mortalita v souvislosti s gastrointestinální píštělí byla poměrně vysoká; z 28 nemocných zemřelo 10 (35,7 %), nebyl podstatný rozdíl mezi ženami (37,5 %) a muži (35 %). Průměrný věk zemřelých byl 73,1 roku, kromě jednoho případu byli všichni zemřelí starší 65 let (výše jmenovaný zemřel v 57 letech a patologicko-anatomická pitva prokázala terminální stadium malignity, kromě lokální recidivy původního nádoru tračníku i karcinózu parietálního peritonea a těžké metastatické postižení plic a pohrudnice), u většiny zemřelých byla příčinou smrti sepse.
Všichni zemřelí prodělali sepsi v průběhu léčení. Naopak přežití nemocných, u kterých nedošlo k rozvoji sepse, bylo 100%.
Z hlediska lokalizace vnitřního ústí se tvořily píštěle nejčastěji na duodenu, případně na duodeno-jejunálním přechodu (18), na jícnu (8) a nejméně na žaludku (2). Graf 1 znázorňuje zastoupení jednotlivých lokalizací vnitřního ústí píštěle. V největším počtu jsme léčili píštěle vzniklé jako komplikace chirurgického výkonu. Graf 2, který znázorňuje etiologii vzniku píštěle, tvoří výchozí počet 29 nemocných, jelikož u jedné nemocné došlo k rozvoji jejuno-kutánní píštěle v těsné časové závislosti na chirurgickém výkonu, nicméně u této nemocné byla prokazatelně diagnostikována aktivní forma Crohnovy nemoci. Protože je pravděpodobné, že etiologie vzniku píštěle byla v tomto případě kombinovaná, zařadili jsme zmíněnou nemocnou jak do skupiny komplikací chirurgického výkonu, tak do skupiny komplikací základního onemocnění. V případě poranění (6) se jednalo o tři iatrogenní poranění po ezofagogastroduodenofibroskopii (EGDF) vesměs o postižení jícnu, 2 poranění distálního jícnu při úporném zvracení (Boerhaveův syndrom) a jedno bodné poranění duodenopankreatického okna. Skupinu komplikací základního onemocnění (5) tvořil různorodý soubor klinických jednotek: dvě komplikace Crohnovy choroby, jedna komplikace malignity, jeden penetrující vřed a jedna komplikace hemoragicko-nekrotizující pankreatitidy.
Graph 1. Lokalizace gastrointestiální píštěle Graph 1. Location of the gastrointestinal fistule 
Graph 2. Etiologie vzniku píštěle Graph 2. Etiology of fistules 
DISKUSE
Největší klinický význam má asi rozdělení na základě patogeneze píštěle. Až 90 % píštělí GIT vzniká v souvislosti s chirurgickým výkonem jako pooperační komplikace (dehiscence anastomóz, dehiscence enterotomií, dekubitální nekróza GIT způsobená drénem, arteficielní poranění střevní stěny během operace). U píštěle, která vznikla do 1 měsíce od primárního chirurgického zákroku, lze předpokládat příčinnou souvislost s operací. Existují skupiny predisponovaných nemocných, u kterých je zvýšené riziko vzniku píštěle GIT po chirurgickém výkonu. Jsou to především nemocní operovaní urgentně, v malnutrici, v katabolickém stavu, s malignitou, po aktinoterapii a nemocní v pokročilém věku se závažnými interními komorbiditami (chronická ledvinná nedostatečnost, diabetes mellitus, srdeční selhávání, dlouhodobá léčba kortikosteroidy atd.) [1, 2, 3, 4, 5, 6].
V dalších případech vznikají píštěle jako komplikace základního onemocnění – malignity, postiradiačního postižení, zánětlivých onemocnění GIT (morbus Crohn, colitis ulcerosa, diverticulitis, komplikace vředové choroby gastroduodenální, akutní pankreatitis) nebo po traumatech, nejčastěji po penetrujících poraněních břicha s postižením střeva, resp. žaludku. Může se jednat o monotraumata, často následky kriminálních činů nebo o součást polytraumatu (dopravní nehody, pády z výšky, pracovní úrazy, sportovní úrazy). Zvláštní skupinou jsou iatrogenní poranění v souvislosti s diagnostickými nebo terapeutickými zákroky – ezofagoduodenofibroskopie (EGDF), koloskopie, endoskopická retrográdní cholangiopankreatikografie (ERCP), apod. [2].
Gastrointestinální píštěle mohou mít závažný dopad na morbiditu i mortalitu nemocných. Při větších únicích střevního resp. žaludečního obsahu může docházet k významným ztrátám iontů a elektrolytů (H+, HCO3-, Cl-, K, Na...), a na základě nedostatku určitých elektrolytů dochází k rozvoji poruchy acidobazické rovnováhy (metabolická acidóza/alkalóza) [7]. Píštěl může zapříčinit poruchu příjmu potravy, resp. poruchu vstřebávání důležitých nutrientů, což může vyústit v protein-energickou malnutrici [7, 8, 9, 10]. Různá stadia vývoje gastrointestinálních píštělí mohou být spojena s rozvojem sepse, nejčastěji v období vzniku píštěle. Sepse je nejčastější příčinou mortality nemocných s gastrointestinálními píštělemi. U píštělí, které vznikly jako komplikace chirurgického výkonu, bývají často vyvolávajícím infekčním agens multirezistentní nemocniční kmeny (vancomycin rezistentní enterokok, polyrezistentní klebsiely, pseudomonády, acinetobacter nebo kandidy), což samozřejmě limituje úspěšnost ATB léčby [8, 11].
Gastrointestinální píštěle bývají často spojené s fyzickým strádáním, mohou mít celou škálu negativních dopadů na nemocného: bolesti, nechutenství, omezení perorálního příjmu, defekty kůže v okolí zevního ústí píštěle, technické problémy s aplikací stomických pomůcek, snížení kvality života, imobilizace (u některých speciálních technik drenáže – aktivní sání), vyloučení určitých činností z běžného života, společenská diskriminace, atd. V důsledku mnohdy dlouhodobého léčení nemocných s gastrointestinální píštělí jsou pacienti konfrontováni s různými psychickými potížemi, setkáváme se často s reaktivními depresemi, ztrátou důvěry k lékaři i zdravotnickému personálu, pochybnostmi o léčbě. Z ekonomického pohledu je léčba gastrointestinálních píštělí spojena s vysokými náklady (délka hospitalizace, opakované chirurgické výkony, dlouhodobá parenterální nutrice, ATB...) [12].
Mortalita v souvislosti s gastrointestinálními píštělemi je i v dnešní době poměrně vysoká, jak demonstruje tabulka 2 na výsledcích několika studií, které byly provedeny v minulých letech [1, 6, 8, 11, 13, 14].
Table 1. Srovnání výstupů několika prací zabývajících se nemocnými s GIT píštělemi Tab. 2. Comparison of outcomes of several studies with GIT fistules patients 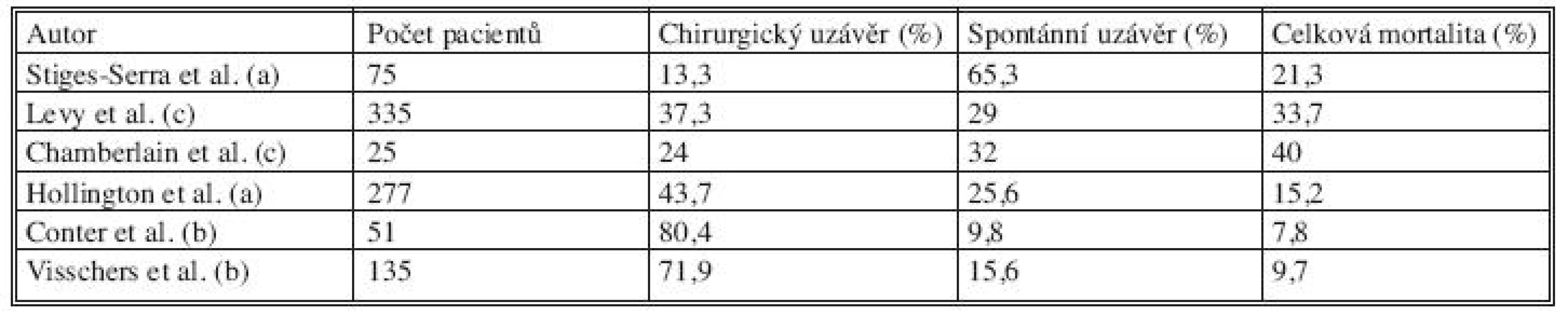
(a) Gastrointestinální píštěle /obecně/ (b) Enterokutánní píštěle (c) Píštěle na tenkém střevě R.G.J. Visschers et al., Treatment Strategies in 135 consecutive Patients with Enterocutaneus Fistulas, World J Surg (2008) 32:445–453 Diagnostika píštělí je poměrně jednoduchá. Bezesporu důležitá je anamnéza; kromě subjektivních potíží, které se odlišují v závislosti na etáži GIT, kde se potenciální píštěl nachází, jsou signalizujícími údaji chronická zánětlivá onemocnění střeva, malignity, instrumentální zákrok v předchorobí, aktinoterapie apod. U nemocných po chirurgických zákrocích na GIT dochází často k vytvoření píštěle ještě v průběhu hospitalizace. Pro vznik píštěle je rozhodující technika a taktika operování: rozsah mobilizace úseků střeva, porušení cévního zásobení, ponechání slepých vaků vyřazených z pasáže, deserozace úseků střeva, volba šicího materiálu [15].
V klinickém obraze dominují septické projevy, patologická příměs v tělních sekretech a především patologická sekrece (ranou, incizemi po drénech, pochvou...), jejíž původ v gastrointestinálním traktu lze potvrdit perorálním podáním metylénové modři. V laboratorním vyšetření se nachází elevace zánětlivých markerů, hypalbuminémie, změny v iontogramu nebo poruchy acidobazické rovnováhy. Přítomnost píštěle je možné definitivně ověřit zobrazovacími metodami (RTG fistulografie, RTG pasáž GIT vodnou kontrastní látkou, CT enteroklýza) [3, 7].
Léčba gastrointestinálních píštělí bývá většinou svízelná a dlouhodobá. Byla vytvořena doporučení, jejichž jednotlivé léčebné cíle shrnuje zkratka SOWATS (Sepse, Optimalizace stavu výživy nemocného, „Wound care“, Anatomie píštěle, „Timing of surgery“, „Surgical strategy“). Primárním úkolem je eliminovat sepsi, která může probíhat pod různým obrazem od izolovaných septických febrilií po těžký septický šok se syndromem multiorgánové dysfunkce (MODS). Nemocného v sepsi v souvislosti s enterokutánní píštělí léčíme podle obecných zásad (zajištění volných dýchacích cest, ev. ventilační podpora, resuscitace oběhu – především objemovými náhradami, podpora selhávajících orgánových systémů/katecholaminy, extrakorporální eliminační metody.../, včasná ATB terapie). Pokud to stav nemocného dovolí, před nasazením ATB terapie odebereme dostupný materiál pro mikrobiologické vyšetření. Hlavním úkolem je kontrola septického ložiska – derivace patologické kolekce/sekrece zevně. V této době volíme co nejméně zatěžující výkon – lokální drenáž, drenáž pod CT kontrolou, založení odlehčující stomie. Pokud je nutný chirurgický výkon, a je-li funkční aborální část GIT, je vhodné u píštělí vycházejících z horní části GIT zavést v průběhu zákroku nasojejunální sondu, případně založit katétrovou jejunostomii pro časnou enterální výživu.
Neméně důležitá je úprava proteinenergické malnutrice, v první řadě rehydratace nemocného a korekce elektrolytových dysbalancí / poruch acidobazické rovnováhy. Během prvních 24–48 hodin od vzniku píštěle zahájíme plnou parenterální výživu podle obecných zásad, efekt tzv. imunonutrice je sporný a nemá vliv na mortalitu nemocných [1, 6, 8, 9, 16]. U nemocných s funkčním gastrointestinálním traktem, kde nepředpokládáme spontánní uzávěr píštěle, u píštělí tračníku a tam, kde zvýšená sekrece nekomplikuje ošetřování rány či zevního ústí píštěle, můžeme zvážit podání enterální nutrice. Mortalita nemocných s gastrointestinální píštělí koreluje s hladinou sérového albuminu před rekonstrukčním chirurgickým zákrokem. U nemocných se sérovou hladinou albuminu pod 25 g/l před definitivním chirurgickým zákrokem vzrostla mortalita z 9,7% na 32 % [1, 4, 16].
Místní ošetřování rány resp. zevního ústí je nezbytnou součástí péče o nemocné s gastrointestinální píštělí. Principem je zabránění kontaktu agresivní střevní sekrece s kůží a předcházení vzniku bolestivých defektů kůže a dermatitid, které ještě více komplikují další lokální ošetřování chirurgické rány a významným způsobem nemocného obtěžují a mutilují. K tomuto účelu využíváme celou škálu drenážních a stomických pomůcek (sáčky, pasty, krycí fólie a systém aktivního sání – srkavá drenáž, V.A.C. systém) [15, 17, 18]. V.A.C. systém (Vacuum-Assisted Closure) je moderní fyzikální metoda hojení ran, jež využívá kontinuálního nebo intermitentního působení podtlaku na ránu a tím odsává nežádoucí sekreci a podporuje tvorbu granulací, což v našem případě vede k uzavírání píštěle. V.A.C. systém se skládá z přístroje, který je umístěn u lůžka nemocného (existují „minisystémy“, které jsou přenosné), a který vytváří podtlak, jenž je vyvíjen na komplikovanou ránu cestou sběrné nádoby, hadičky, podložky T.R.A.C. Pad a pěnové hmoty V.A.C. GranuFoam. Celá soustava je utěsněna proti atmosférickému vzduchu prostřednictvím nalepovací fólie, kterou překryjeme pěnovou hmotu uloženou do rány. V případě použití V.A.C. systému při léčbě enterokutánních píštělí musíme mezi obnažené orgány či cévní/nervové struktury a pěnovou hmotu vložit neadhezivní krytí (např. polyvinyl-alkoholovou pěnu V.A.C. VersFoam). Podtlak nastavujeme tak, že postupně zvyšujeme jeho hodnotu o 25 mm Hg do doby, kdy dojde k snižování produkce sekretu (max. 200 mm Hg) [17, 18]. Na obrázku (viz. obr. 1.) je demonstrována aplikace srkavého drénu do operační rány s píštělí; jako drén využíváme upravený permanentní močový katétr o velkém průměru (20 Ch a více).
Image 1. Příklad aplikace srkavé drenáže k zevnímu ústí enterokutánní píštěle, které je v tomto případě v průběhu operační rány Fig. 1. A sucking drainage is applied to the external orifice of the enterocutaneous fistule, which is, in this case, located within the surgical wound 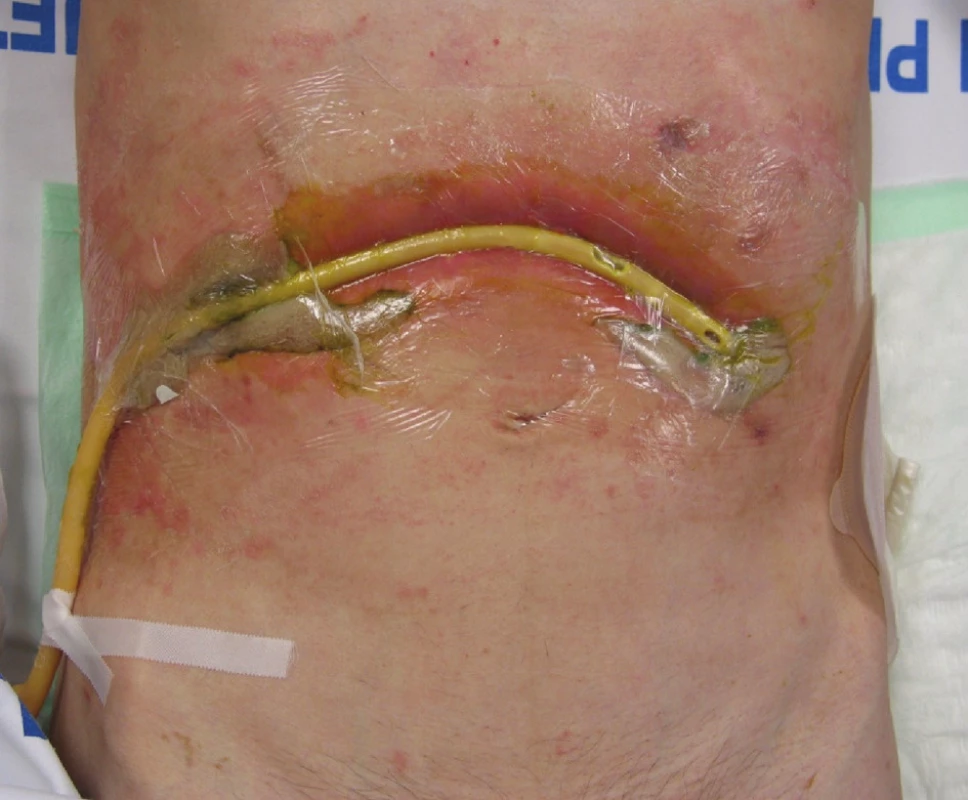
Table 2. Charakteristika skupiny nemocných Tab. 1. The patient group characteristics 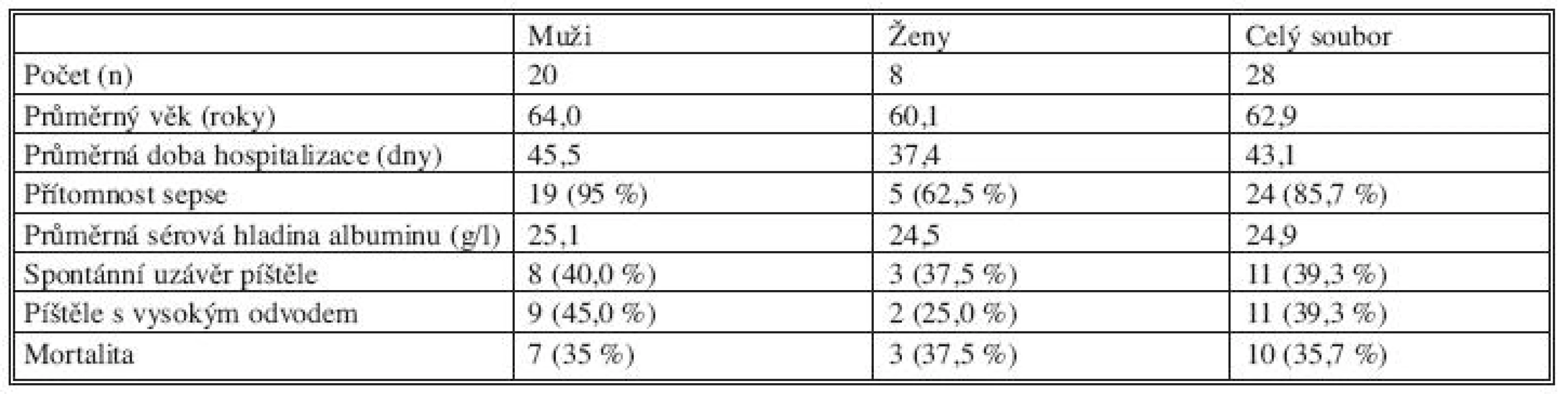
Z hlediska anatomie píštěle je pro úspěšnost léčby důležitá znalost průběhu a délky kanálu píštěle a samozřejmě lokalizace vnitřního ústí. Vznik píštěle může být podporován obstrukcí či stenózou střeva aborálně od vnitřního ústí. V tomto případě může být zásadní v léčbě píštěle obnovení průchodnosti střeva, zpravidla chirurgickým zákrokem.
Kritériem pro načasování chirurgického rekonstrukčního výkonu je splnění všech výše uvedených podmínek. Absence známek sepse je definována narůstající hladinou sérového albuminu a hemoglobinu, normalizace počtu leukocytů a trombocytů v periferní krvi a regresí zánětlivých laboratorních ukazatelů – C reaktivní protein (CRP), prokalcitonin (PCT), rychlost sedimentace červených krvinek (FW). Důležitá je dobrá nutriční kondice. Usilujeme o to, aby před chirurgickým zákrokem byla sérová hladina albuminu alespoň 25 g/l [1, 16]. Subjektivními kritérii pro uspokojivý klinický stav je schopnost alespoň částečné mobilizace nemocného, absence negativních pocitů, zájem ev. naléhání na rekonstrukční operaci. Minimální časový úsek mezi vznikem píštěle a rekonstrukčním chirurgickým výkonem je šest týdnů [1].
Ve strategii chirurgické rekonstrukce je třeba dodržet několik zásad. Především je nutná resekce postižené části gastrointestinálního traktu, nikoli prostá sutura vnitřního ústí píštěle. Pokud je to možné, vyvarujeme se použití neabsorbovatelných šicích materiálů. U enterokutánních píštělí se s výhodou uplatňují protektivní stomie orálně od původního vnitřního ústí píštěle. U píštělí na jícnu (tracheoezofageálních, ezofagopleurálních, ezofagokutánních) se úspěšně používá endoskopické zavedení stentu do oblasti, kde se nachází vnitřní ústí píštěle, jako alternativa rekonstrukčního chirurgického výkonu nebo v kombinaci s operací [1, 11, 16].
Z našich závěrů (Tab. 1) vyplývá, že významnější rozdíly mezi skupinou mužů a žen jsou pouze v délce hospitalizace, přítomnosti sepse a píštělí s vysokým odvodem. Ve všech třech kategoriích vycházejí vyšší hodnoty u mužů, tzn. u mužů byla prokazatelně delší průměrná doba hospitalizace, prakticky u všech mužů došlo k rozvoji sepse a rovněž byl v této skupině častější výskyt píštělí s vysokým odvodem, přesto je ve skupině mužů nepatrně nižší mortalita ve srovnání se ženami. Významná se zdá být i závislost mortality nemocných na velikosti odvodu píštělí: u nemocných postižených píštělí s vysokým odvodem byla shledána vyšší úmrtnost (45,5 %) v porovnání se skupinou nemocných s píštělí s nízkým odvodem (29,4 %). Úspěšnost léčby byla vyšší u chirurgicky léčených nemocných (zemřelo 8 z 24, tj. 33,3 %); u nemocných léčených konzervativně zemřeli 2 ze 4, tj. 50 %, nicméně jsme si vědomi, že se jedná o malá, statisticky nevýznamná čísla.
Z dalších vztahů nás zajímal vliv velikosti odvodu píštělí na jednotlivé sledované modality, tedy vlastně dopad na průběh onemocnění a úspěšnost léčby (Tab. 3). Podle našeho sledování má velikost odvodu prokazatelný vliv na průběh onemocnění a úspěšnost léčby; veškeré sledované parametry vykazovaly ve skupině nemocných s vysokým odvodem píštělí horší výsledky proti skupině nemocných s nízkým odvodem píštělí. Sepse byla u nemocných s vysokým odvodem píštělí přítomna v 100 %, zatímco v druhé skupině pouze v necelých 77 %. Rovněž etiologie vzniku píštěle byla v první skupině převážně chirurgická (81,8 %) ve srovnání s druhou skupinou nemocných s nízkým odvodem píštělí, kde byla komplikace chirurgického výkonu příčinou vzniku píštěle pouze v polovině případů. Dramatické rozdíly mezi skupinami byly v délce hospitalizace, v případech spontánního uzávěru píštěle a v mortalitě. Průměrná délka hospitalizace byla u nemocných s píštělemi s vysokým odvodem téměř dvojnásobná (59,9 dní) vůči druhé skupině (32,3 dní). Ke spontánnímu uzávěru v případě píštělí s nízkým odvodem došlo téměř u poloviny nemocných, zatímco ve skupině nemocných s vysokým odvodem došlo k spontánnímu uzavření píštěle jen v 27 % případů. Zjevný je i vliv velikosti odvodu píštělí na mortalitu nemocných; ve skupině nemocných s vysokým odvodem píštělí zemřelo skoro 46 %, zatímco v souboru nemocných postižených píštělí s nízkým odvodem zemřelo necelých 30 %. Zajímavé je porovnání průměrných sérových hladin albuminu u sledovaných skupin: u skupiny s vysokým odvodem píštělí, která vykazovala rozhodně horší výsledky léčby, nepřekročila průměrná sérová hladina albuminu 25 g/l (22,8 g/l), na rozdíl od skupiny nemocných s nízkým odvodem (26,3 g/l).
Table 3. Srovnání patofyziologie píštělí s vysokým a nízkým odvodem Tab. 3. Comparison of pathophysiology of fistules with high and low secretion 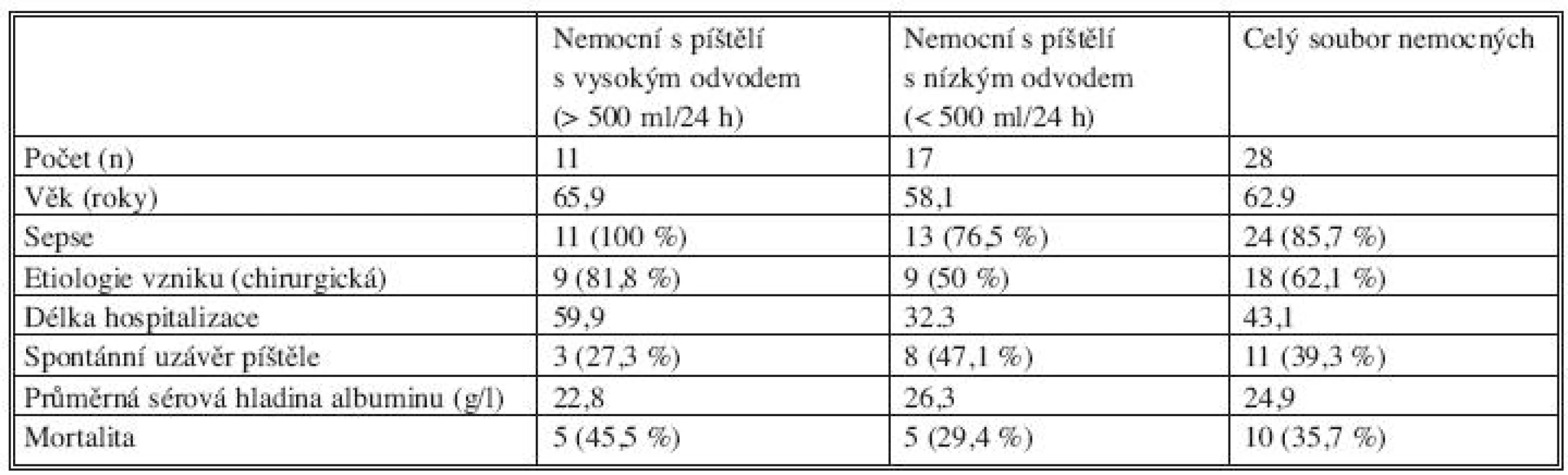
ZÁVĚR
Cílem našeho průzkumu bylo získání zpětné vazby v léčení nemocných s gastrointestinálními píštělemi orální části GIT. Soubor nemocných byl malý, statisticky nereprezentativní, nicméně naše sledování může mít význam jako výchozí bod pro novou analýzu – prospektivní, s předem stanoveným protokolem. V diskusi jsme vyslovili několik hypotetických závěrů, které mohou mít význam pro terapeutické postupy u nemocných s gastrointestinálními píštělemi, ale které je nutné ověřit větší, nejlépe prospektivní, randomizovanou analýzou.
S jistou mírou pravděpodobnosti lze konstatovat, že u mužů v porovnání se ženami došlo k častějšímu výskytu sepse, byl větší podíl píštělí s vysokým odvodem a delší doba hospitalizace, přesto mortalita v této skupině byla spíše nižší. Je tedy ženské pohlaví rizikovým faktorem úmrtí v souvislosti s gastrointestinální píštělí? I když jsou ženy zřejmě rizikovější skupinou z hlediska mortality, je u nich patrně menší riziko samotného vzniku píštěle, nižší riziko rozvoje sepse a menší předpoklad pro vznik píštěle s vysokým odvodem.
Zcela jistě je nepříznivým faktorem věk nemocných – téměř všichni nemocní, kteří zemřeli v souvislosti s píštělí, byli starší 65 let. Úmrtnost nemocných s enterokutánními píštělemi má vztah k přítomnosti sepse, pohlaví, věku a velikosti odvodu píštělí [1].
Mortalita u nemocných po chirurgickém uzávěru píštěle významně koreluje s předoperační sérovou hladinou albuminu, která by měla být vyšší než 25 g/l [1, 16].
Základní podmínkou pro úspěšnou léčbu gastrointestinálních píštělí je zvládnutí sepse, která je stále nejčastější příčinou smrti v souvislosti s gastrointestinální píštělí [1]. Sepse se ve sledovaném souboru vyskytovala u všech nemocných, kteří zemřeli, naopak pacienti, u nichž nedošlo k rozvoji sepse, přežili v 100 %; sepse byla i v našem souboru nejčastější příčinou smrti (v 9 z deseti případů úmrtí).
Vysoký odvod gastrointestinální píštělí je rizikový faktor rozvoje sepse a mortality a nepříznivě ovlivňuje léčbu nemocných, čímž se významně prodlužuje délka hospitalizace včetně navýšení ekonomických nákladů na léčbu, a snižuje se pravděpodobnost spontánního uzávěru píštěle.
Seznam zkratek:
- ATB – antibiotika/-cká
- CRP – C reaktivní protein
- EGDF – ezofagogastroduodenofibroskopie
- ERCP – endoskopická retrográdní cholangiopankreatikografie
- FW – sedimentace červených krvinek
- GIT – gastrointestinální trakt
- JIP – jednotka intenzivní péče
- MODS – multiorgan dysfunction syndrome (syndrom multiorgánové dysfunkce)
- PCT – prokalcitonin
- UPV – umělá plicní ventilace
- VAC – vacuum assisted closure
MUDr. Jan Kulda
Lidická 28
323 00 Plzeň
e-mail: kuldaj@fnplzen.cz
Sources
1. Visschers, R. G. J., Olde Damink, S. W. M., Winkens, B., Soeters P. B., van Gemert, W. G. Treatment strategies in 135 consecutive patients with enterocutaneous fistulas. World J. Surg., 2008; 32 : 445–453.
2. Černý, J., et al. Špeciálna chirurgia. 2. rozšířené vydání, I. sv. Chirurgia tráviacej rúry. Osveta, 1996 : 134–168; 257–267.
3. Hájek, M., et al. Kritická onemocnění průdušnice a jejich léčení, GRADA Publishing, spol.s.r.o., 2000.
4. Campos A. C., Andrade, D. F., Campos, G. M., et al. A multivariate model to determine prognostic factors in gastrointestinal fistulas. J. Am. Coll. Surg., 1999; 188 : 483–831.
5. Lynch, A. C., Delaney, C. P., Senagore, A. J., et al. Clinical outcome and factors predictive of recurrence after enterocutaneous fistula surgery. Ann. Surg., 2004; 240 : 825–831.
6. Sitges-Serra, A., Jaurrieta, E., Sitges-Creus A Management of postoperative enterocutaneous fistulas: the roles of parenteral nutrition and surgery. Br. J. Surg., 1982; 69 : 147–150.
7. Lloyd, D. A., Gabe, S. M., Windsor, A. C. Nutrition and management of enterocutaneous fistula. Br. J. Surg., 2003; 93 : 1045–1055.
8. Levy, E., Frileux, P., Cugnenc, P. H., et al. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br. J. Surg., 1989; 76 : 676–679.
9. Makhdoom, Z. A., Komar, M. J., Still, C. D. Nutrition and enterocutaneous fistulas. J. Clin. Gastroenterol., 2000; 31 : 195–204.
10. Rosenthal, R. A. Nutritional concerns in the older surgical patient. J. Am. Coll. Surg., 2004; 199 : 785–791.
11. Hollington, P., Mawdsley, J., Lim, W., et al. An 11-year experience of enterocutaneous fistula. Br. J. Surg., 2004; 91 : 1646–1651.
12. Evenson, A. R., Fisher, J. E. Current managment of enterocutaneous fistula. J. Gastroinest. Surg., 2006; 10 : 455–464.
13. Conter, R. L., Roof, L., Roslyn, J. J. Delayed reconstructive surgery for complex enterocutaneous fistulae. Am. Surg., 1988; 54 : 589–593.
14. Chamberlain, R. S., Kaufman, H. L., Danforth, D. N. Enterocutaneous fistula in cancer patients: etiology, management, outcome, end impact on futher treatment. Am. Surg., 1998; 64 : 1204–1211.
15. Barclay, L., et al. Vacuum-assisted fascial closure of abdomen may be beneficia. Ann. Surg., 2004; 239 : 608–610.
16. Gibbs, J., Cull, W., Henderson, W., et al. Preoperative serum albumin level as a predictor of operative mortality and morbidity: results from the national VA Surgical Risk Study. Arch. Surg., 1999; 134 : 36–42.
17. Weidenhagen, R., et al. Endoscopic Vacuum-assisted closure of anastomotic leakage following anterior resection of the rectum: A new method. Surg. Endosc., 2008; 22 : 1818–1825.
18. Giovannini, U. M., Demaria, R. G., Teot, L. Interest of negative pressure therapy in the treatment of postoperative sepsis in cardiovascular Sumery. Wounds, 2001; 13(2).
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 7-
All articles in this issue
- Miesto laparoskopie v liečbe invaginácie u detí
- Transplantace jater u dětí redukovaným štěpem
- Invaginace tenkého střeva v dospělosti
- Léčba píštělí orální části gastrointestinálního traktu na chirurgické jednotce intenzivní péče
- Výsledky a komplikace laparoskopické adjustabilní bandáže žaludku – 12 let zkušeností
- Přínos PET/CT v předoperačním stagingu karcinomu pankreatu
- Nezvyčajné metastazovanie adenokarcinómu rekta
- Zriedkavá komplikácia po šití anastomózy biofragmentilným prstencom Valtrac© – kazuistika a prehľad literatúry
- Chirurgické riešenie failed back surgery syndrómu FBSS pomocou zadnej lumbálnej medzitelovej fúzie PLIF so zadnou transpedikulárnou stabilizáciou
- Submukózní lipom jako příčina invaginace v dospělém věku
- Význam biopsie sentinelovej uzliny pri včasnom karcinóme prsníka
- Ovariálny hyperstimulačný syndróm v diferenciálnej diagnostike náhlej brušnej príhody
- Akútne poranenia laterálneho väzivového aparátu členkového kĺbu
- Hallux flexus – dôsledok poúrazového zakliesnenia šľachy flexor hallucis longus v mieste zlomeniny tíbie
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Invaginace tenkého střeva v dospělosti
- Ovariálny hyperstimulačný syndróm v diferenciálnej diagnostike náhlej brušnej príhody
- Nezvyčajné metastazovanie adenokarcinómu rekta
- Význam biopsie sentinelovej uzliny pri včasnom karcinóme prsníka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

