-
Medical journals
- Career
Nezvyčajné metastazovanie adenokarcinómu rekta
: J. Radoňak; L. Lakyová; T. Toporcer
: I. chirurgická klinika, Lekárska fakulta Univerzity Pavla Jozefa Šafárika, Košice, Fakultná nemocnica L. Pasteura, Košice, Slovenská republika, prednosta kliniky: prof. MUDr. Jozef Radoňak, CSc.
: Rozhl. Chir., 2010, roč. 89, č. 7, s. 441-445.
: Monothematic special - Original
Liečba rektálneho nádoru je multimodálna a výsledky liečby sú odrazom pokroku v zobrazovacej diagnostike, v chirurgických metódach resekcie a v neo a adjuvantnej liečbe. Cieľom práce bolo prezentovať prípad úspešne liečeného adenokarcinómu rekta a adenokarcinómu hepatálnej flexúry s recidivujúcimi metastázami a extrémne zriedkavým prerastením metastázy do venózneho systému pacienta.
61-ročný pacient podstúpil nízku resekciu rekta sec. Dixon pre stredne diferencovaný adenokarcinóm s klasifikáciou T3N0M0. Po absolvovaní chemoterapie (FUL -5-fluorouracyl) a ožiarení v dávke 50,4 Gy bol revidovaný pre metastázu adenokarcinómu do brušnej steny o veľkosti 16x15x20 cm. Po opätovnej adjuvantnej terapii FUL+Leukovorin bola exstirpovaná mestastáza opäť z brušnej steny. O 26 mesiacov od resekcie rekta sa objavil prisadlý nový polyp v hepatálnej flexúre s histologickým popisom dobre diferencovaného adenokarcinómu, ktorý bol odstránený pravostrannou hemikolektómiou. Vyšetrené lymfatické uzliny boli bez metastáz, pacient nebol indikovaný na adjuvantnú terapiu. O dva mesiace bol prijatý s flebotrombózou ľavej femorálnej vény a v priebehu nasledujúcich deviatich mesiacov bol trikrát reoperovaný a bolo aplikovaných 6 cyklov Xelody. Trikrát sa vykonala totálna exstirpácia metastázy do ľavého stehna, pričom sa histologicky potvrdilo prerastanie nádoru do vena saphena magna.
Autori sa nestretli s prípadom prerastania metastázy adenokarcinómu do venózneho systému v literatúre, pri ktorom by bolo 5-ročné prežívanie pacienta. Pacient šesť rokov po prvej operácii nemá lokálnu recidívu ani metastázy.Kľúčové slová:
adenokarcinóm – nádor rekta – metastáza do venózneho systému – chirurgická liečbaÚVOD
Recidívy karcinómu rekta vznikajú najčastejšie lokálne: 75 % vzniká do 2 rokov a 88–92 % do 4 rokov. Radikálne chirurgicky je možné riešiť menej ako 10 % recidív. Na výskyt recidív má vplyv aj neoadjuvantná alebo adjuvantná terapia. Jednoznačne to dokázala štúdia, kde na súbore 1861 pacientov predoperačná RAT znížila výskyt lokoregionálnych recidív z 8,2 % na 2,4 %. Prežívanie 2 roky bolo 82 % po kombinovanom postupe a 81,8 % iba po resekcii. Štúdie dokázali lepší vplyv neoadjuvantnej RAT a CHT ako adjuvantnej [1]. Racionálnym vysvetlením je to, že pred operáciou je ešte neporušeného terénu, ktorý je dobre oxygenovaný, čo dovoľuje hlbší prienik chemoterapeutika do tkanív v porovnaní s CHT aplikovanom v pooperačnom období [2]. Ďalšou výhodou predoperačnej RAT je nižšia toxicita na tenké črevo a neprítomnosť novo konštruovanej anastomózy v ožarovanom poli [3].
Napriek dnešným moderným diagnostickým a terapeutickým postupom je rekurencia ochorenia po operácii pomerne vysoká. Mortalita pacienta sa výrazne zvyšuje s recidívou nádoru, ktorá vzniká najčastejšie do dvoch rokov po prvej „kuratívnej” operácii.
Práca prezentuje kazuistiku opakovane recidivujúceho karcinómu rekta úspešne liečenú pomocou chirurgickej a adjuvantnej terapie a extrémne vzácnu nádorovú trombózu vena saphena magna.
KAZUISTIKA
Pacient, 61 rokov, s predchádzajúcou anamnézou liečenej artériovej hypertenzie a po cholecystektómii pre cholecystolitiázu bol prijatý na II. chirurgickú kliniku FNLP v Košiciach. Pacient posledné tri mesiace pozoroval prímes krvi v stolici. Pri ambulantnej rektoskopii bol nájdený 14 cm od anu exulcerovaný tumor s histologicky potvrdeným adenokarcinómom. Pacient následne podstúpil resekciu rekta sec. Dixon. Výsledok definitívnej histológie potvrdil stredne diferencovaný adenokarcinóm infiltrujúci stenu čreva v celej hrúbke. Zachytené lymfatické uzliny boli bez nádorových zmien s klasifikáciou T3N0M0. Pacient podstúpil následnú adjuvantnú chemoterapiu FUL (5-fluorouracyl) a rádioterapiu v dávke 50,4 Gy. O rok neskôr pacient bol hospitalizovaný pre nádor brušnej steny o veľkosti detskej hlavy, pričom pri revízii nebola nájdená lokorecidíva (Obr. 1). Pacient absolvoval exstirpáciu tumoru o veľkosti 15x16x20 cm a polychemoterapiu s dvomi cyklami FUL+Leukovorin. Histologicky išlo o metastázu adenokarcinómu s rozsiahlymi areálmi nekrózy. O deväť mesiacov vznikla v mieste exstirpácie tumoru z brušnej steny recidíva adenokarcinómu metastatického pôvodu, ktorá bola riešená exstirpáciou a plastikou steny brušnej pomocou prolénovej sieťky (Obr. 2). Kolonoskopické vyšetrenie do céka bolo negatívne, pacient nedostal adjuvantnú terapiu. O päť mesiacov pri kontrolnej kolonoskopii bola odobratá biopsia z laločnatého prisadlého dvojcentimetrového polypu v oblasti hepatálnej flexúry. Histologické vyšetrenie potvrdilo exofyticky dobre diferencovaný adenokarcinóm, ktorý podľa definitívnej histologie po pravostrannej hemikolektómii prerastal do submukózy. Lymfatické uzliny neboli postihnuté, preto nebola odporučená ani adjuvantná onkologická liečba. O dva mesiace bol pacient opäť prijatý do nemocnice pre flebotrombózu ľavej dolnej končatiny s uzáverom arteria femoralis siahajúcim proximálne až do vena iliaca. Pacientovi bol nasadený nízkomolekulárny heparín v antikoagulačnej dávke a následne prechod na perorálne antikoagulanciá. O tri mesiace pacient pozoroval hrčku v oblasti jazvy po predchádzajúcich operáciách. V mieste prolénovej sieťky bola exstirpovaná metastáza adenokarcinómu o veľkosti 13x12x15 cm, pričom pacient absolvoval následne 6 cyklov kapecitabínom (Obr. 3). O štyri mesiace neskôr bol pacient prijatý do nemocnice pre tumor pravého stehna o veľkosti 20x15x18 cm. Pacient podstúpil radikálnu exstirpáciu tumoru aj s odstránením vena saphena magna po jej vústenie do veny femoralis. Vzniknutý rozsiahly kožný defekt bol riešený posuvnou plastikou kože. Operačná rana sa hojila per secundam. V náleze patológa boli popísané mnohopočetné metastázy adenokarcinómu, pričom v exstirpovanej časti vena saphena magna nad tumorom bola nájdená nádorová trombóza. O tri mesiace bol pacient nútený podstúpiť reoperáciu pre opätovnú recidívu tumoru v inguine a brušnej stene v pôvodných jazvách po operácii. Odvtedy pri kontrolných vyšetreniach nebola zaznamenaná ani jedna recidíva tohto tumoru, pacient zomrel po šiestich rokoch na kardiovaskulárne ochorenie. Pre prehľadné zhrnutie operačných výkonov je uvedená Tab. 1.
1. Chronologický zoznam operácií, ktoré podstúpil pacient počas rokov 2000–2003. Tab. 1 Chronological list of operations, which underwent the patient during the year 2000–2004 
1. CT obraz metastázy adenokarcinómu do brušnej steny Fig. 1. CT imaging of metastasis of adenocarcinoma into abdominal wall 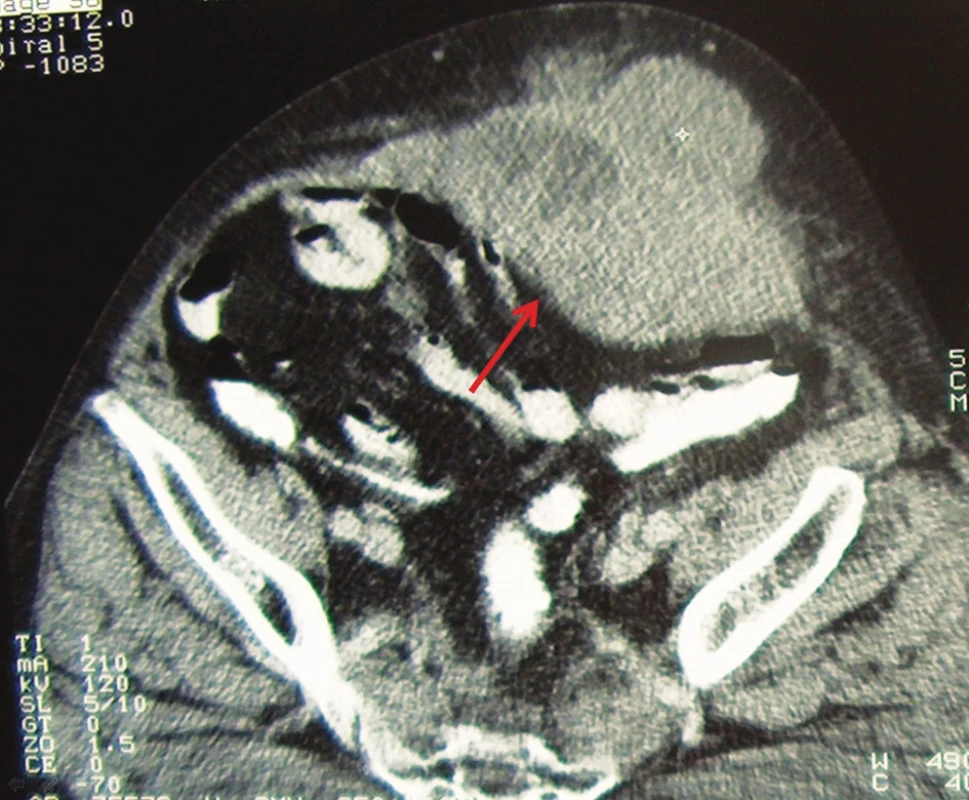
2. Exstirpovaná metastáza adenokarcinómu do brušnej steny Fig. 2. Exstirpated metastasis of adenocarcinoma into abdominal wall 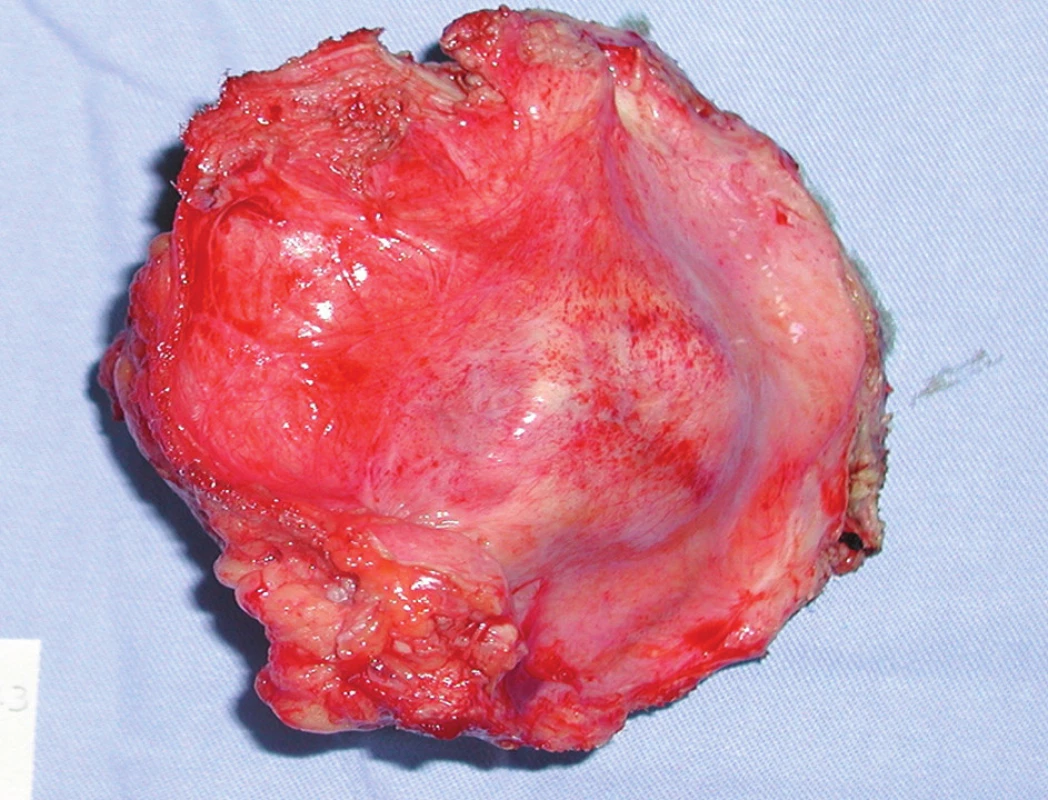
3. USG znázornenie metastázy adenokarcinómu prerastajúca prolénovú sieťku Fig. 3. Ultrasonography of metastasis of adenocarcina overgrowing the Prolene net 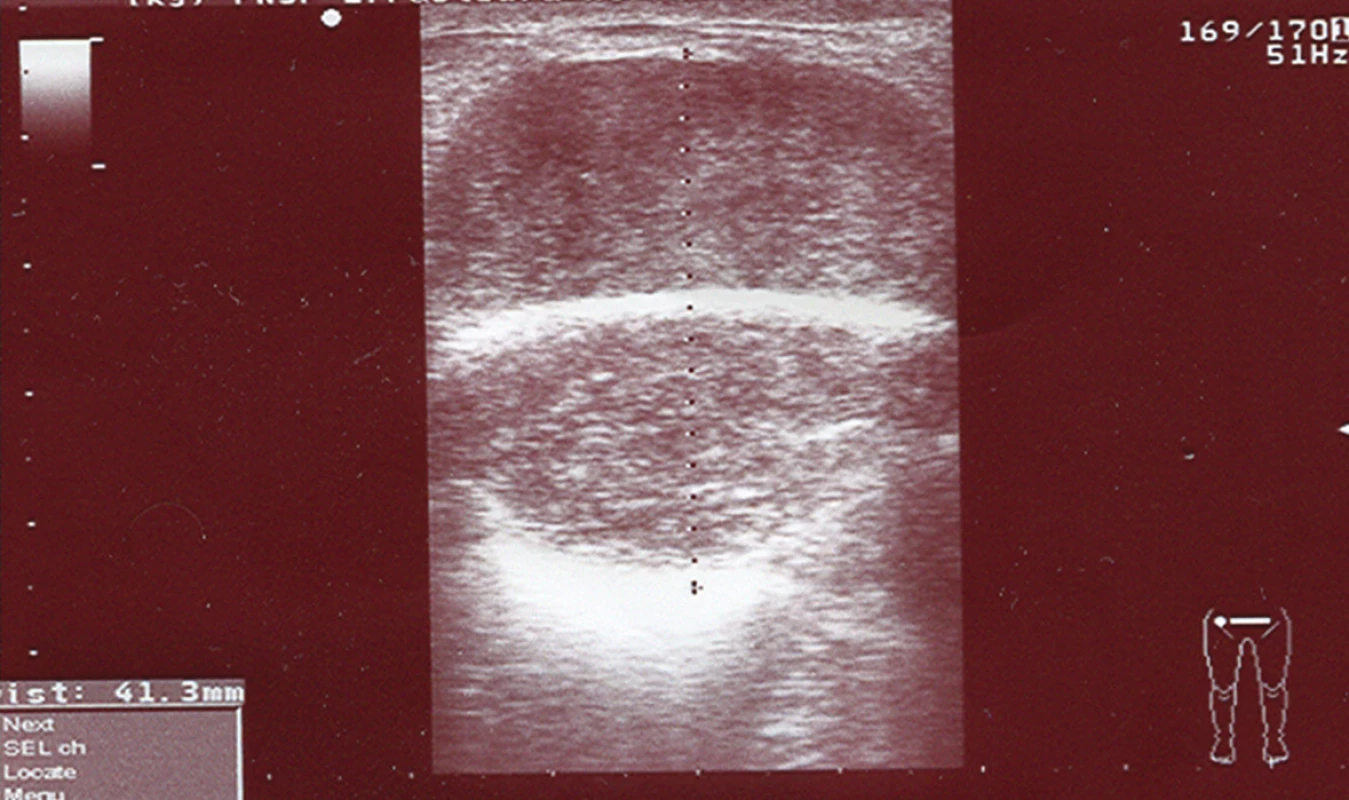
DISKUSIA
Kolorektálne karcinómy sa šíria lymfogénnou a hematogénnou cestou. Invázia tumoru do extramurálnej časti a zhrubnuté vény sú asociované so zlou prognózou nezáväzne so stupňom diferenciácie adenokarcinómu. Zvýšená permeabilita kapilár, neprítomnosť zhlukov nádorových buniek a priamy kontakt buniek s venóznou krvou naopak zhoršujú prežívanie Až v 51,9 % podľa výsledkov histopatologického vyšetrenia primárny nádor sa šíri angioinváziou. Aneuryzmatická distenzia a zápalové poškodenie steny invadovaných vén, prítomnosť trombu alebo plášť endoteliálnych buniek pokrývajúcich nádorový trombus má naopak pozitívny vplyv na pacientove prežívanie [4]. Incidencia rekurencie, či už lokálna alebo vznik vzdialených metastáz je výrazne signifikantná [5]. Päťročné prežívanie u pacientov s lokoregionálnou rekurenciou je iba 10–20 % [6]. V našom prípade pacient napriek opakovaným recidívam prežil šesť rokov. K rizikovým faktorom rekurencie po kuratívnej resekcii rekta patrí pozitívna rodinná anamnéza, perforácia čreva v mieste karcinómu, stupeň diferenciácie tumoru, embolizácia tumoróznych hmôt do ciev a prítomnosť mezorektálnych metastáz [6]. Podľa štúdie autorov Benevent et al. tumor lokalizovaný na mezenteriálnej strane vykazuje 42,5 % incidenciu postihnutia lymfatických uzlín (L.U.) v porovnaní s 13,5 % incidenciou metastáz do L.U. pri tumoroch na antimezenteriálnej strane. Vyplýva to z anatomickej polohy, ktorá pri mezenteriálnych tumoroch je bližšia k lymfatickým spádovým uzlinám, ako aj lymfatickým a krvným cievam [7]. Prognóza tohto ochorenia sa môže zlepšiť ak pacient absolvuje po resekcii chemoterapiu, rádioterapiu alebo ich kombináciu. Adjuvantná terapia je podávaná v klinickej praxi pacientom iba s dokázanými metastázami do L.U. Avšak v práci Oberg et al. bolo zistené, že až u 26 % pacientov bez infiltrácie lymfatických uzlín nádorom vyšetrených rutinným histologickým vyšetrením s farbením hematoxilín a eozín, sú prítomné skryté mikrometastázy. Preto signifikancia okultných mikrometastáz je stále v centre pozornosti [8].
Vzdialené metastázy sa objavujú najčastejšie v pečeni a pľúcach, hoci sú popísané aj metastázy do kostí, lymfatických uzlín inguiny s mediánom prežívania 8 mesiacov [9], nadobličiek, mozgu, či kože [10]. Metastázy do kože u adenokarcinómu hrubého čreva a rekta sa popisujú v menej ako piatich percentách [11]. U týchto pacientov s metastázami do kože sa popisuje doba prežívania iba 18 mesiacov [11]. Ešte zriedkavejšími metastázami sú hematogénne metastázy do priečnej pruhovaných svalov. Opakované metastázy do brušnej steny popísané v našej kazuistike tiež nie sú časté. Vyššia incidencia sa udáva po laparoskopických prístupoch v mieste portov pri resekcii rektosigmy [12].
Prvýkrát sa o asociácii malignity a následnej trombózy zmienil Trouseau [13]. Síce zriedkavé, no dokumentované sú aj prípady hyperkoagulačných stavov u nádorových intravaskulárnych ochorení ako sú lipóm femorálnej vény [14], sarkóm vena cava [15], či diseminovaný intravaskulárny metastatický karcinóm [16]. Trombóza u pacientov bez hyperkoagulačného stavu je viac podozrivá zo sekundárnej trombózy v mieste intravaskulárneho fokusu nádorových buniek. Mechanizmus adherencie nádorových buniek doteraz nebol presne vysvetlený. V literatúre boli popísané mikroskopické tumorózne embolizácie zachytávajúce sa na bazálnej membráne poškodených ciev [17]. Ďalšou z teórií je strata bunkových adhezívnych molekúl malígnych buniek, čo by umožňovala tumoróznym bunkám preniknúť cez steny ciev [18]. To je zrejme mechanizmus, ktorý sa uplatnil aj v našom prezentovanom prípade, kde bola v zachytená metastáza prerastajúca do vena saphena magna, ktorá podľa histologického nálezu obturovala jej lúmen spolu s nasadajúcim trombom. V klinickej praxi sú metastatické tromby v cievach extrémnou vzácnosťou. Autori v literatúre našli iba niekoľko kazuistík. Levi a kol. publikoval prípad recidívnych trombóz artérií a vén, kedy sa prišlo na pravú príčinu trombózy metastatického procesu v cievach až pri autopsii u pacientky s kolorektálnym adenokarcinómom [16]. Vyššiu incidenciu trombóz vykazuje hepatocelulárny karcinóm s portálnou trombózou [19–21]. Trombotický uzáver vena iliaca vznikol aj pri renal cell carcinoma [22, 23]. Portálna trombóza tumorom bola diagnostikovaná taktiež pri metastázach kolorektálneho adenokarcinómu rekta do pečene [24]. Dokonca sa objavil jeden prípad embolizácie tumoróznych hmôt stredne diferencovaného adenokarcinómu do portálnej vény bez prítomnosti metastáz v pečeni a s embolizáciou do vena mesenterica inferior. Pacientka zomrela o šesť mesiacov na hepatálne zlyhanie napriek úspešnému chirurgickému odstráneniu tumoróznych hmôt [25]. Autor Mendoza vo svojej kazuistike publikoval ako prvý prípad venóznej makroskopickej metastázy rektálneho adenokarcinómu do periférnej žily. U pacienta sa na liečbu použila trombolýza na rozpustenie venóznej trombózy a následne bol aplikovaný vaskulárny stent skrz celý nádor vo véne, ktorý slúžil ako terč pre 4300 cGY cestou megavoltážového externého radiačného lúča. Liečba pokračovala v dávke dvakrát týždenne aplikáciou 192Ir s 400 cGy. Počas nasledovných 43 mesiacov nebola zaznamenaná po tejto unikátnej liečbe recidíva. Prerastenie veny sapheny magny bol v našom prípade riešené exstirpáciou tumoru aj so zavzatou vénou do tumoru. Pacient podstúpil ešte dvakrát reoperáciu pre recidívu, a nasledujúcich 36 mesiacov bol bez známok rekurencie ochorenia [26].
Výsledkom metaanalýz zahrňujúcích randomizované štúdie porovnávajúce rozdielne dispenzarizačné programy po kurativných resekciách pre kolorektálny karcinóm je štatisticky signifikantne vyššie prežívanie intenzívne sledovaných chorých [27]. Riziko rekurencie je najvyššie v prvých dvoch rokoch od operácie, preto aj dispenzarizácia chorých v tomto období by mala prebiehať každé tri až šesť mesiacov [28]. Intenzívne sledovanie pacienta objavilo v našom prípade až päťnásobnú recidívu vrátane zvrhnutia sa iného polypu v hrubom čreve nezávisle na predchádzajúcom postihnutí rekta adenokarcinómom.
ZÁVER
Prezentovaný prípad poukázal aj na možnosť opakovanej recidívy tumoru, ktorý mohol byť implantačnou mts. Ani opakované radikálne exstirpácie spolu s adjuvantnou RAT a PCHT nezabránili výskytu recidív. Pacient tri roky po poslednej operácii nemal lokálnu recidívu na rekte ani metastázy v pečeni, alebo v pľúcach. V priebehu liečby došlo k zvrhnutiu polypu v inej časti hrubého čreva.
Dôkaz uzáveru vena saphena magna nádorovými hmotami, môže svedčiť o hematogénnom šírení nádoru venóznym systémom. Tejto etiológie je zrejme aj trombotický uzáver vena saphena magna do vena femoralis vľavo.
Prof. MUDr. Jozef Radoňak, CSc.
I. chirurgická klinika LF UPJŠ, FNLP
Tr. SNP 1
041 90 Košice
Slovenská republika
e-mail: radonak@gmail.com
Sources
1. Sauer, R., Becker, H., Hohenberger, W., et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N. Engl. J. Med., 2004; 351 : 1731–1740.
2. Taflampas, P., Christodoulakis, M., de Bree, E., Melissas, J., Tsiftsis, D. D. A. Preoperative decision making for rectal cancer. The American Journal of Surgery, Vol xx, 2010, in press.
3. Swedish Rectal Cancer Trial. Improved survival with preoperative radiotherapy in resectable rectal cancer. N. Engl. J. Med., 1997; 336 : 980–987.
4. Talbot, C., Ritchie, S., Leighton, M., Hughes, A. O., Bussey, H. J. R., Morson, B. C. Invasion of veins by carcinoma of rectum: method of detection, histological features and significance. The American Journal of Surgery, 1981; 141 : 15–17.
5. Ünsal, D. C., Üner, A., Üzum, N., Akmansu, M. Metastatic rectal adenocarcinoma to forearm muscle: An unusual site of Metastasis. Turkish Journal of Cancer, 2005; 35 : 181–185.
6. Ze-Yu Wu, Jin Wan, Gang Zhao, Lin Peng, Jia-Lin Du, Yuan Yao, Quan-Fang Liu, Hua-Huan Lin Risk factors for local recurrence of middle and lower rectal carcinoma after curative resection. World J. Gastroenterol., 2008; 14 : 4805–4809.
7. Benevent, A., Boni, L., Dionigi, G., Carcano, G., Capella, C., Capriata, G., et al. The mesenteric and antimesenteric location of colorectal cancer: The relationship with lymph nodes metastases. Surg. J. R. Coll. Surg. Edinb. Irel., 2004; 2 : 214–220.
8. Oberg, A., Stenling, R., Tavelin, B., Lindmark, G. Are lymph node micrometastasis of any clinical significance in Dukes stages A and B colorectal cancer? Dis. Colon Rectum, 1998; 41 : 1244–1249.
9. Luna-Perez, P., Corral, P., Labastida, S., Rodriguez-Coria, D., Delgado, S. Inguinal lymph node metastases from rectal adenocarcinoma. Journal of surgical oncology, 1999; 70 : 177–180.
10. Hasegawa, S., Sakurai, Y., Imazu, H., et al. Metastasis to the forearm skeletal muscle from an adenocarcinoma of thecolon: Report of a case. Surg. Today, 2000; 30 : 1118–1123.
11. Lookingbill, D. P., Spangler, N., Helm, K. F. Cutaneous metastases in patients with metastatic carcinoma: a retrospective study of 4020 patients. J. Am. Acad. Dermatol., 1993; 29 : 228–236.
12. Gutt, C. N., Kim, Z. G., Hollander, D., Bruttel, T., Lorenz, M. CO2 environment influences the growth of cultured human cancer cells dependent on insufflation pressure. Surgical Endoscopy, 2001; 15 : 314–318.
13. Phlegmasia alba dolens. In: Trousseau, A. Lectures on Clinical medicine delivered at the Hotel-Dieu, Paris. London: The New Sydenham Society. 1872; 281–295.
14. McClure, M. J., Sarrazin, J., Kapusta, L., et al. Intravascular femoral vein lipoma: An unusual cause of lower limb venous obstruction. Am. J. Roentgenol., 2001; 176 : 463–464.
15. Abratt, R. P., Williams, M., Raff, M., et al. Angiosarcoma of the superior vena cava. Cancer, 1983; 52 : 740–743.
16. Bronkhorst, M., Levi, C., Noorduyn, L. A., Vrecken, J. Recurrent thrombotic occlusions of arteries and veins caused by intravascular metastatic adenocarcinoma. Clin. Pathol., 1994; 47 : 858–859.
17. Warren, B. A., Vales, O. The adhesion of thromboplastic tumor emboli to vessel walls in vivo. Brit. J. Exp. Pathol., 1972; 53 : 301–313.
18. Cowley, G. P., Smith, M. F. Modulation of E-cadherin expression and morphological phenotype in the intravascular component of adenocarcinomas. Int. J. Cancer, 1995; 60 : 325–329.
19. Novi, M., Lauritano, E. C., Piscaglia, A. C., Barbaro, B., Zocco, M. A., Pompili, M., Gasbarrini, A. Portal vein tumor thrombosis revascularization during sorafenib treatment for hepatocellular carcinoma. Am. J. Gastroenterol., 2009; 104 : 1852–1854.
20. Schuldes, M., Weickert, U. 55-year-old woman with upper abdominal pain with chronic hepatitis C. Tumor thrombus of the portal vein in hepatocellular carcinoma (HCC), Dtsch. Med. Wochenschr., 2010; 135 : 129–130.
21. Tomimaru, Y., Kobayashi, S., Nagano, H., Murakami, M., Wada, H., Marubashi, S. et al. A long-term survival case of hepatocellular carcinoma with lymph node metastasis on the posterior surface of the pancreas head and portal vein tumor thrombus successfully treated with hepatopancreatoduodenectomy and adjuvant interferon-alpha and 5-fluorouracil combination therapy. Gan To Kagaku Ryoho, 2009; 36 : 2389–2391.
22. Guo, H. F., Song, Y., Na, Y. Q. Value of abdominal ultrasound scan, CT and MRI for diagnosing inferior vena cava tumour thrombus in renal cell carcinoma. Chin. Med. J., 2009; 122 : 2299–2302.
23. Alonzo, V., de Prados, V., Olmo, C., Geler, P., Herrera R., Morcillo, M., Maldonado, E., BuĖuel, T. Renal cell carcinoma with vena cava involvement: update and review of our series. Actas Urol. Esp., 2009; 33 : 569–574.
24. Lee, K. F., Chu,W., San Lai, P. B. Portal vein tumor thrombus in colorectal liver metastasis. , 2007; 106 : 589–591.
25. Ryota, H., Yuushi, I., Reiki, E., Masakazu, Y., Takafumi, S., Takehito, O., Tooru, T., Ken, T. A case of metastatic potal vein tumor thrombs of colorectal carcinoma, no metastasis in liver parenchyma. Surgical Therapy, 2002; 86 : 237–239.
26. Mendoza, A. S., Shaves, M. E. High-dose-rate brachytherapy of recurrent rectal adenocarcinoma presenting as a solitary intravascular metastasis of the iliac vein: A case report. , 2003; 2 : 249–252.
27. Prochotsky, A., Okolicany, R., Sekac, J., Skultety, J. Diagnosis and management of local and locoregional recurrence of colorectal carcinoma. Bratislavske lekarske listy, 2009; 110 : 569–573.
28. Skalický, P., Vysloužil, K. Dispenzarice nemocných po radikální resekci kolorektálneho karcinomu. Onkologie, 2008; 2 : 24–27.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 7-
All articles in this issue
- Laparoscopy in the Management of Invagination in Pediatric Patients
- Liver Transplantations in Children Using Reduced Grafts
- Small Intestine Invagination in an Adult
- Treatment of Upper Gastrointestinal Tract Fistules in the Surgical Intensive Care Unit
- Results and Complications of Laparoscopic Adjustable Gastric Banding – 12 Years Experience
- Benefit of PET/CT in the Preoperative Staging in Pancreatic Carcinomas
- Uncommon Rectal Adenocarcinoma Metastases
- A Rare Complication Following Anastomosis Suturing Using a Biofragmentable Valtrac© Anastomosis Ring – A Case Review and Literature Overview
- Surgical Management of the Failed Back Surgery Syndrome (FBSS) Using Posterior Lumbar Interbody Fusion (PLIF) with Posterior Transpedicular Stabilization
- Submucous Lipoma as a Cause of Invagination in Adulthood
- Significance of the Sentinel Lymph Node Biopsy in Early Breast Carcinomas
- Ovarial Hyperstimulation Syndrome in the Differential Diagnostics of Acute Abdomen
- Acute Injuries of Lateral Ankle Joint Ligaments
- Hallux Flexus – The Result of Posttraumatic Entrapment of the Flexor Hallucis Longus Tendon in the Tibial Fracture Site
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Small Intestine Invagination in an Adult
- Ovarial Hyperstimulation Syndrome in the Differential Diagnostics of Acute Abdomen
- Uncommon Rectal Adenocarcinoma Metastases
- Significance of the Sentinel Lymph Node Biopsy in Early Breast Carcinomas
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

