-
Medical journals
- Career
Význam biopsie sentinelovej uzliny pri včasnom karcinóme prsníka
: P. Chválny; V. Straka 1; R. Donát 1; J. Malina 1; D. Dyttert 1; M. Sabol 1; B. Duchaj 2; J. Veselý 2; V. Lehotská 3; K. Rauová 3; Š. Galbavý 4; D. Macák 4; V. Ďurčány 4; C. Bíró 4
: Klinika onkologickej chirurgie LF UKo a OÚSA, Bratislava, Slovenská republika prednosta: doc. MUDr. Štefan Durdík, Ph. D. ; Klinika onkologickej chirurgie LF UKo a OÚSA, Bratislava, Slovenská republika primár: doc. MUDr. Vladimír Straka, CSc. 1; Klinika nukleárnej medicíny LF UKo a OÚSA, Bratislava, Slovenská republika prednostka: doc. MUDr. Izabela Makaiová, CSc. 2; II. rádiologická klinika LF UKo a OÚSA, Bratislava, Slovenská republika prednosta: doc. MUDr. Viera Lehotská, Ph. D. 3; Ústav laboratórnych a vyšetrovacích metód LF UKo a OÚSA, Bratislava, Slovenská republika prednosta: prof. MUDr. Štefan Galbavý, CSc. 4
: Rozhl. Chir., 2010, roč. 89, č. 7, s. 395-401.
: Monothematic special - Original
V tejto práci sú prezentované skúsenosti s biopsiou sentinelovej uzliny (SLNB) v Onkologickom ústave sv. Alžbety za obdobie 48 mesiacov. Celkovo sme v časovom horizonte od 1. 1. 2006–31. 12. 2009 vykonali SLNB u 269 pacientok. Veľkosť primárneho tumoru bola od 0,3 do 3,5 cm, vrátane neinvazívnych foriem karcinómov, t.j. Tis, T1, T2 – TNM klasifikácie. Invazívnych karcinómov bolo 255 (94,8 %) a neinvazívnych foriem 14 (5,2 %). Z celkového počtu 269 pacientok sme v 157 (72,7 %) prípadoch postupovali validačnou metódou. U 255 pacientok s invazívnym karcinómom sme sentinelovú uzlinu (SU) neidentifikovali v 4 (1,6 %) prípadoch. V jednom prípade u T1 invazívneho karcinómu a v troch prípadoch pri T2 tumoroch. Falošná negativita sentinelovej uzliny u T1 nádorov bola 4,3 %. Výskyt makrometastáz v SU bol verifikovaný štandardným histopatologickým spracovaním a farbením hematoxylínom a eozinom. V prípade negativity nálezu bolo vyšetrenie doplnené o sériové rezy a imunohistochémiu s použitím cytoskeletálnych protilátok na dôkaz mikrometastáz. V 6 prípadoch (2,4 %) sme takýmto vyšetrením zistili mikrometastázu v pôvodne negatívnej SU. Následná axilárna disekcia metastatické postihnutie nesentinelových uzlín nepreukázala.
Kľúčové slová:
biopsia sentinelovej uzliny – karcinóm prsníka – validačná metóda – mikrometastázyÚVOD
Biopsia sentinelovej uzliny predstavuje novú metódu v oblasti diagnostiky a liečby zhubných nádorov, aj keď prvé poznatky v rámci klinického využitia siahajú do minulého storočia. Takmer polovica exenterácií axily pre karcinóm prsníka vo včasnom štádiu bola vykonávaná ako súčasť radikálnej operácie karcinómu prsníka z diagnostických dôvodov, nakoľko neboli v lymfatických uzlinách zistené metastázy. Biopsia sentinelovej uzliny z tohto pohľadu predstavuje spoľahlivú alternatívu axilárnej disekcie, ktorá pri dodržaní presne stanovených indikačných kritérií umožňuje určiť štádium ochorenia bez toho, aby boli pacientky vystavené negatívnemu dopadu exenterácie axily.
MATERIÁL A METÓDA
Na chirurgickej klinike LF UKo a OÚSA sme vykonali od 1. 1. 2006 do 31. 12. 2009 biopsiu sentinelovej uzliny u 269 pacientov. V roku 2006 sme používali metódu farbením pomocou patentnej modrej. Neskôr sme realizovali detekciu sentinelovej uzliny kombinovanou metódou aj s využitím rádiofarmaka (Senti-Scint, Technéciom 99 značkovaný koloid). Od roku 2007 vykonávame biopsiu sentinelovej uzliny (SLNB) štandardne v priebehu jedného dňa. Aplikácia farbiva a rádiofarmaka bola spočiatku vykonávaná peritumoróznou a subdermálnou instiláciou Patent Blue a rádiokoloidu z jedného až troch samostatných vpichov. SENTI-SCINT (Medi-Radiopharma Ltd., Érd, Maďarsko) sme podávali ráno, v deň operácie na pracovisku Kliniky nukleárnej medicíny v celkovej dávke od 1–2 mCi, v objeme cca 1–4 ml. V súčasnosti podávame 2 mCi (75 MBq) z jedného subdermálneho vpichu do oblasti subareolárneho lymfatického plexu. Po cca 120–180 minútach nasleduje snímkovanie na gamakamere v dvoch na seba kolmých projekciách. Operácia nasleduje v intervale 2–7 hodín od aplikácie rádiofarmaka. Bezprostredne, asi 10 min. pred operáciou, podávame obdobným spôsobom 4,0 ml riedenej Patent Blue (1 : 1 s fyziologickým roztokom) a po krátkej masáži prsníka nasleduje samotná operácia, pri ktorej odstraňujeme primárny tumor, identifikujeme a disekujeme sentinelové uzliny. Výkon realizujeme prevažne z diskontinuálneho axilárneho prístupu, zväčša v mieste najväčšej aktivity, ktorú nameriame pomocou prenosnej gamasondy a detektora. V prípade viacpočetného výskytu radiačne aktívnych, resp. modro sfarbených uzlín tieto odstraňujeme a následne odosielame k histopatologickému vyšetreniu. Operácia na prsníku sa riadi podľa výsledku peroperačnej histológie a indikačných kritérií k prsník zachovávajúcim výkonom. Iba v prípade nemožnosti dodržať princíp onkologickej radikality limitovaným výkonom, je indikovaná mastektómia. Nakoľko metódu biopsie sentinelovej uzliny sme vykonávali do konca mája r. 2009 validačnou metódou, tak záverečnou fázou operácie bola kompletná disekcia axilárnych lymfatických uzlín a ich histologické vyšetrenie. Štandardnou indikáciou boli unifokálne, malé karcinómy prsníka vo včasnej fáze ochorenia, bez klinického a paraklinického postihnutia axilárnych lymfatických uzlín. Axilárny status sme predoperačne zisťovali klinicky a USG vyšetrením axily. V prípadoch invazívneho lobulárneho karcinómu bol stav axilárnych LU hodnotený v rámci MR vyšetrenia prsníkov. Pacientky s jednoznačne hmatnou axilárnou lymfadenopatiou, pozitívnym USG nálezom, alebo s biopticky verifikovaným metastatickým postihnutím axily sme k biopsii SU neindikovali (Tab. 1).
1. Indikácie k biopsii sentinelovej uzliny Tab. 1. Indications for the sentinel lymph node biopsy 
VÝSLEDKY
Súbor pacientov
Chirurgická liečba karcinómu prsníka sa na našom pracovisku realizuje už vyše 50 rokov a má stúpajúcu tendenciu. Kým v roku 1999 sme vykonali operácie u 873 pacientov, z čoho sa jednalo v 332 (38 %) prípadoch o operáciu prsníkov, tak v roku 2009 sme operovali celkovo 1 800 pacientov, kde operáciu pre ochorenie prsníka podstúpilo 724 (40,2 %) pacientov (Graf 1). Celkový počet pacientov, u ktorých bola vykonaná operácia od 1. 1. 1999 do 31. 12. 2009 pre malígnu a benígnu prsníkovú léziu bol 3 753. Z tohto počtu sa jednalo o benígnu léziu v 1555 prípadoch a o malígnu léziu v 2198 prípadoch (Graf 2). U malígnych tumoroch bola v 686 (31,2 %) prípadoch realizovaná modifikovaná radikálna mastektómia a v 1512 (68,8 %) prípadoch konzervatívny chirurgický výkon (Graf 3).
1. Operácie TU prsníka metódou biopsie sentinelovej uzliny (SNB) r. 2006–2009. Operácie r. 1999–2009 Graph 1. Breast tumor surgical procedures associated with the sentinel node biopsy (SNB) 2006–2009. Procedures from 1999 to 2009 
2. Operácie TU prsníka r. 1999–2009. Malígne + benígne tumory (n = 3753) Graph 2. Breast tumor surgical procedures, from1999 to 2009. Malignant+ benign tumors (n = 3753) 
3. Operácie malígnych TU prsníka r. 1999–2009. Invazívne karcinómy (n = 2198) Graph 3. Surgeries for malignant breast tumors, from 1999 to 2009. Invasive carcinomas (n = 2198) 
Na chirurgickej klinike LFUK a OÚSA sme vykonali od 1. 1. 2006 do 31. 12. 2009 biopsiu sentinelovej uzliny u 269 pacientov. Vo všetkých prípadoch sa jednalo o ženy s predoperačne biopticky verifikovanou malígnou léziou prsníka. Karcinóm prsnej žľazy u mužov sme v sledovanom časovom horizonte nezaznamenali. Mali sme 2 prípady lokálne pokročilého sarkómu, kde biopsia SU nebola indikovaná. Veľkosť primárneho tumoru bola od 0,3 do 3,5 cm, vrátane neinvazívnych foriem karcinómov, t.j. Tis, T1, T2 – TNM klasifikácie. Invazívnych karcinómov bolo 255 (94,8 %) a neinvazívnych foriem 14 (5,2 %). Z celkového počtu 269 pacientok, u ktorých sme vykonali biopsiu sentinelovej uzliny, sme v 157 (72,7 %) prípadoch postupovali validačnou metódou. V 4 (1,9 %) prípadoch sme sentinelovú uzlinu peroperačne neidentifikovali.
Z invazívnych foriem karcinómov sa vo väčšine prípadov jednalo o invazívny duktálny karcinóm (IDC), ktorý bol nájdený 208x (81,6 %) z celkového počtu 255 všetkých invazívnych karcinómov. Invazívny lobulárny karcinóm (ILC) sme diagnostikovali v 21 (8,3 %) prípadoch. Ostatné formy invazívnych karcinómov, podľa histopatologickej klasifikácie WHO, sme našli iba v ojedinelých prípadoch. T1 tumory tvorili prevažnú časť nášho súboru 187 (73,3 %). T2 karcinómov (do veľkosti 3,5 cm) sme mali 68 (26,7 %). Najčastejšie sme vykonali biopsiu sentinelovej uzliny u pacientok s T1c a T1b tumorom.
Priemerný vek pacientok bol 57 rokov, medián 55 rokov – najmladšia pacientka mala 32 rokov, najstaršia 81 rokov. V 248 (97,3 %) prípadoch bol vykonaný limitovaný, prsník zachovávajúci operačný výkon, t.j. lumpektomia, kvadrantektómia, resp. centrálna resekcia. V 7 (2,7 %) prípadoch sme vykonali modifikovanú radikálnu mastektómiu.
Výsledky
Identifikáciu sentinelovej uzliny sme vykonávali v prvých mesiacoch samostatnou aplikáciou patentnej modrej, resp. v 2 prípadoch sme použili iba rádiofarmakum (z technických príčin). V ďalšom období bola identifikácia SU realizovaná iba kombinovanou metódou pomocou Senti-Scintu a modrého fabiva. Z celkového počtu 255 pacientok s invazívnym karcinómom prsníka sa SU peroperačne nezobrazila sfarbením, ani s využitím detektora v 4 (1,6 %) prípadoch. V jednom prípade u T1 invazívneho karcinómu a v troch prípadoch pri T2 tumoroch. Najvyššiu identifikačnú presnosť sme dosiahli pri kombinovanej metóde, kedy v súbore 235 pacientok sa SU nezobrazila iba v 3 (1,3 %) prípadoch. U 232 (98,7 %) pacientok sme sentinelovú uzlinu identifikovali (Tab. 2). Horšie výsledky sme dosiahli podľa očakávania vtedy, ak sme identifikáciu vykonávali bez aplikácie Senti-Scintu a patentnej modrej súčasne, kedy táto metóda vykazuje nižšiu senzitivitu a špecificitu [5, 12, 19]. Jedná sa však o malý, štatisticky nevýznamný súbor 20 pacientok (7,8 %), ktorý vznikol na začiatku r. 2006, keď sme s biopsiou SU začínali a nemali sme v tom čase k dispozícii rádiofarmakum.
2. Identifikácia sentinelovej uzliny u T1 a T2 invazívneho karcinómu (vlastný súbor) Tab. 2. Identification of the sentinel lymph node in T1 and T2 invasive carcinoma (the author’s patient group) 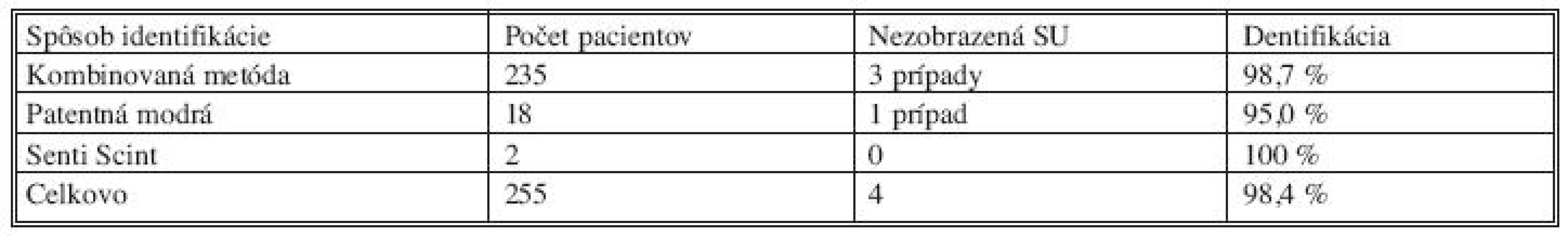
V súbore pacientok s veľkosťou primárneho tumoru T1 sme u 106 pacientok vykonali SLNB validačnou metódou. V 105 prípadoch sme sentinelovú uzlinu peroperačne identifikovali, odstránili a odoslali na histopatologické vyšetrenie. V 1 prípade (0,5 %) sme SU počas operácie neidentifikovali a preto bola vykonaná kompletná ALND. Falošne negatívnu SU sme zistili v jednom prípade (0,9 %) zo súboru 106 pacientok. Falošná negativita sentinelovej uzliny tzv. „False Negative Rate“ bola 4,3 % [6, 27]. V skupine pacientok T2 bola vykonaná biopsia SU validačnou metódou v 51 (32,5 %) prípadoch z celkového počtu 157. V 48 prípadoch sme sentinelovú uzlinu peroperačne identifikovali, odstránili a odoslali k histopatologickému vyšetreniu. V 3 prípadoch (4,4 %) sme sentinelovú uzlinu peroperačne neidentifikovali, preto sme operáciu dokončili ALND. Falošne negatívnu SU sme zaznamenali v 4 prípadoch (7,8 %). Falošná negativita SU bola 16,0 %. Celkový počet pacientok, u ktorých bola vykonaná biopsia sentinelovej uzliny v T2 štádiu, bol 68. V 14 (20,6 %) prípadoch z 68 sme pri negatívnej SU v axilárnej disekcii nepokračovali. Podmienkou však bolo identifikovanie a histopatologické vyšetrenie minimálne troch sentinelových uzlín s negatívnym výsledkom.
Celkový počet vyšetrených axilárnych lymfatických uzlín pri T1 a T2 invazívnych karcinómoch bol 2 638. Z toho tvorilo sentinelových LU 626, priemer 2,49. Non-sentinelových LU bolo vyšetrených 2012, priemer 12,8. Metastatické postihnutie SU sme zaznamenali v 74 (29,5 %) prípadoch z 251. Z toho sa v 38 prípadoch (51,3 %) vyskytli metastázy v ďalších, non-sentinelových axilárnych LU. Negatívna SU bola prítomná v 177 (70,5 %) prípadoch z 251. Z toho v 88 (94,6 %) prípadoch z celkového počtu 93 pacientov, ktoré boli vyšetrované validačnou metódou, neboli nájdené metastázy v non-sentinelových axilárnych lymfatických uzlinách. V 5 prípadoch (5,4 %) z celkového počtu 93 pacientov boli prítomné MTS v non-sentinelových LU, keď bola sentinelová uzlina negatívna. V 84 prípadoch zo súboru 177 pacientov sme pri negatívnej sentinelovej uzline nevykonávali ALND. Na základe našich výsledkov môžeme potvrdiť všeobecný poznatok, že výpovedná hodnota negatívnej sentinelovej uzliny je signifikantne vyššia, ako výpovedná hodnota pozitívnej SU. Kým pozitívna SU predpovedala správne stav ďalších non-sentinelových axilárnych LU v 55,0 %, tak negatívna SU predpovedala korektne axilárny status v 95,5 % (Tab. 3). Pri T1 tumoroch sme zaznamenali metastázy v non-sentinelových lymfatických uzlinách v 22 prípadoch (20,7 %) zo 106. U T2 tumorov ( v našom súbore veľkosť do 3,5cm) sa vyskytli MTS v non-sentinelových LU v 21 prípadoch (41,1 %) z celkového súboru 51 pacientov. Tieto výsledky potvrdzujú skutočnosť, že s veľkosťou primárneho nádoru vzrastá pravdepodobnosť metastatického postihnutia axilárnych lymfatických uzlín (Graf 4).Výskyt makrometastáz v SU bol verifikovaný štandardným histopatologickým spracovaním a farbením hematoxylínom a eozinom. V prípade negativity nálezu bolo vyšetrenie doplnené o sériové rezy a imunohistochémiu s použitím cytoskeletálnych protilátok na dôkaz mikrometastáz. V 6 prípadoch (2,4 %) sme takýmto vyšetrením zistili mikrometastázu v pôvodne negatívnej SU. Následná axilárna disekcia metastatické postihnutie nesentinelových uzlín nepreukázala.
3. Validačná metóda u T1 karcinómov (vlastný súbor) Tab. 3.Validation method in T1 carcinomas (the author’s patient group) 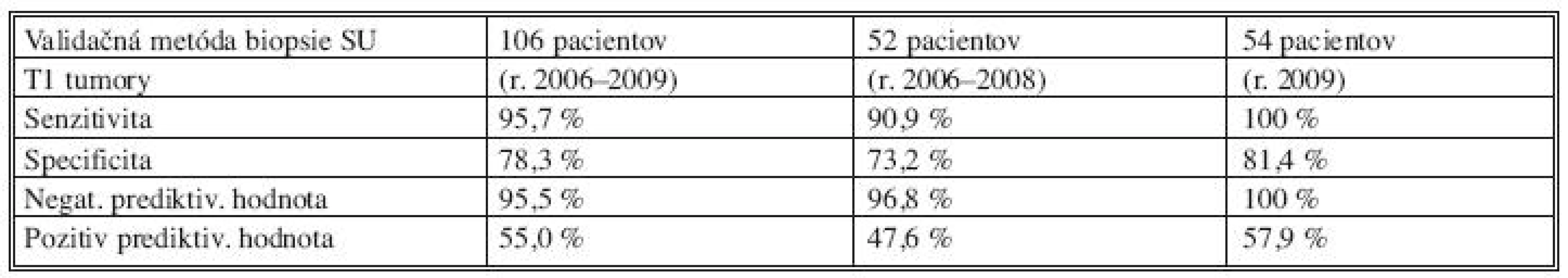
4. Axilárna rekurencia u žien po chirurgickej liečbe a SLNB (Tjan-Heijnen a spol., 2009) Tab. 4. Axillary relapse rates in female patients following surgery and SLNB (Tjan-Heijnen et al., 2009) 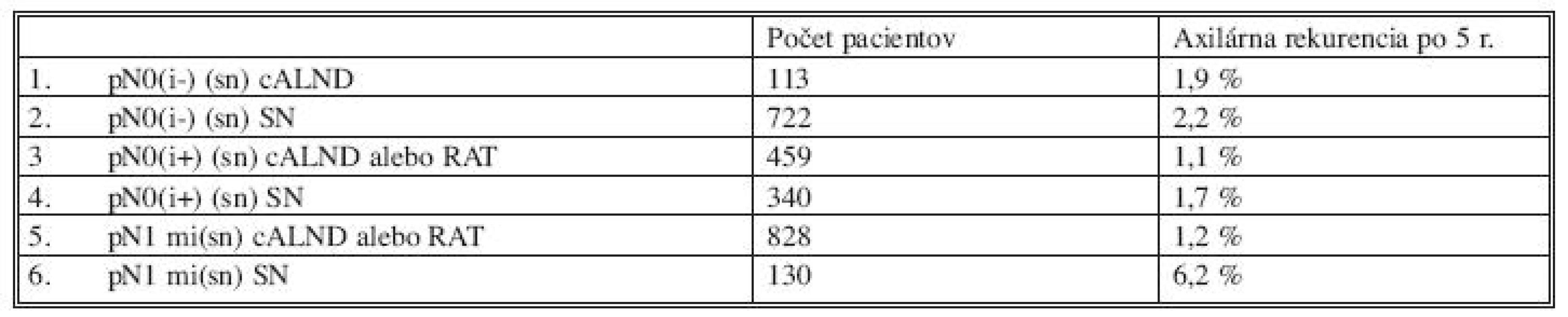
p – patologické spracovanie; N – uzliny; i – izolované nádorové bunky; cALND – kompletná axilárna disekcia; SN – sentinelová uzlina p – pathological examination; N – lymph nodes; i – isolated tumor cells; cALND – complete axillary dissection; SN – sentinel lymph node DISKUSIA
Prítomnosť metastáz v axilárnych uzlinách predstavuje aj v súčasnosti významný prognostický faktor v iniciálnych štádiách karcinómu prsníka. Napriek radikálnej chirurgickej liečbe dochádza k relapsu ochorenia v pôvodne negatívnych lymfatických uzlinách. Jedno z možných vysvetlení je prítomnosť synchrónnych metastáz počas operácie, ktoré neboli v minulosti diagnostikované štandardným patologickým vyšetrením. V poslednom decéniu sme preto svedkami rozširujúceho sa mikrostagingu sentinelovej uzliny na prítomnosť okultných metastáz. V tejto súvislosti vzniká požiadavka na detailnejšie histopatologické spracovanie sentinelovej uzliny sériovými rezmi a imunocytochemickým vyšetrením monoklonálnymi protilátkami, ev. molekulárno biologickými metódami. Výsledkom je zvýšená detekcia mikro a nanometastáz a zmeny v stagingovaní pacientov [9, 11, 25] V tejto súvislosti môže byť ťažké určiť prognostickú hodnotu rozdielnych stupňov mikrometastatického ochorenia.
Snahou dnešných onkologických centier je zistiť, či iné metastázy ako makrometastázy ovplyvňujú dlhodobé prežívanie pacientov. Hoci SLNB zlepšila staging pacientov s včasným ochorením, je prognostický význam mikro a nanometastáz (submikrometastáz) námetom na diskusiu. V prípade pozitívnej biopsie SU sa hľadá najvhodnejší a najúčinnejší spôsob ďalšej liečby. Do úvahy prichádzajú – kompletná axilárna disekcia, radioterapia na axilárne lymfatické uzliny, adjuvantná chemoterapia, adjuvantná hormonálna terapia (v prípade pozitivity hormonálnych receptorov). Výsledky zverejnené na decembrovom sympóziu SABCS (San Antonio Breast Cancer Symposium) r. 2008 ukazujú, že pacienti, ktorí nedostali adjuvantnú systémovú terapiu v prípade izolovaných nádorových buniek a mikrometastáz, mali významne horšiu prognózu prežívania [14]. Rovnako štúdie prezentované v júni r. 2009 na Annual Meetingu ASCO (American Society of Clinical Oncology) v Orlande potvrdili, že v prípade výskytu mikrometastáz v sentinelovej uzline je jednoznačne potrebná ďalšia terapia za účelom zníženia rizika relapsu ochorenia [2].
4. Axilárna rekurencia u žien po chirurgickej liečbe a SLNB (Tjan-Heijnen a spol., 2009) Tab. 4. Axillary relapse rates in female patients following surgery and SLNB (Tjan-Heijnen et al., 2009) 
p – patologické spracovanie; N – uzliny; i – izolované nádorové bunky; cALND – kompletná axilárna disekcia; SN – sentinelová uzlina p – pathological examination; N – lymph nodes; i – isolated tumor cells; cALND – complete axillary dissection; SN – sentinel lymph node Pacienti s mikrometastázami v sentinelových uzlinách pN1(mi+) by mali podstúpiť axilárnu disekciu, alebo radioterapiu. Neliečené nodálne metastázy o veľkosti 0,2–2,0 mm u žien s včasným karcinómom prsníka signifikantne zvyšujú 5-ročné riziko axilárnej rekurencie [31]. Multicentrická holandská štúdia hodnotí záznamy 2 700 žien, ktoré podstúpili biopsiu sentinelovej uzliny pri včasnom karcinóme prsníka a mali negatívnu sentinelovú uzlinu, mikrometastázu, alebo prítomnosť izolovaných nádorových buniek. Niektoré ženy podstúpili adjuvantnú axilárnu liečbu s chirurgickým odstránením uzlín, alebo radioterapiu. Výsledky sú v tabuľke 1. Vzhľadom na tieto výsledky autori odporúčajú kompletnú axilárnu lymfadenektómiu, alebo radioterapiu pre ženy s mikrometastázami za účelom redukcie rizika rekurencie ochorenia. Z viacerých centier USA prichádzajú referencie, že ženy s lokalizovaným ochorením a pozitívnou sentinelovou uzlinou, ktoré dostali adjuvantnú chemoterapiu a alebo adjuvantnú hormonálnu liečbu neprofitujú signifikantne z axilárnej lymfadenektómie. V štúdii z National Cancer Date Base sú vyhodnotené dáta za roky 1998–2005 u 403 167 žien, ktoré podstúpili SLNB pre klinicky uzlinovo-negatívne, lokalizované ochorenie [26]. Analýza sa zamerala na 97 314 žien (24 %) s mikrometastázami. Autori nenašli významný rozdiel v prežívaní medzi ženami liečenými len samotnou biopsiou sentinelovej uzliny, alebo aj axilárnou disekciou. Päťročné prežívanie bolo 82,1 % u skupiny so sentinelovou biopsiou a 81,8 % v skupine, kde bola vykonaná axilárna disekcia. Pre 5 596 žien so sentinelovou biopsiou bola axilárna rekurencia 1 % oproti 22 591 ženám s disekciou axily a rekurenciou v axile 1,1 %. Tieto dáta boli overené aj po korekcii vzhľadom na spolupôsobiace faktory ako klinicko-patologické charakteristiky, adjuvantná liečba a histologický typ. Autori uvádzajú, že táto štúdia poskytuje dôkaz o tom, že axilárna rekurencia a prežívanie sa nelíšia medzi samotnou sentinelovou biopsiou oproti SLNB a axilárnej disekcii pri mikroskopickom postihnutí sentinelovej uzliny, ani u selektívnej skupiny pacientov s makroskopickým postihnutím sentinelovej uzliny, ktorí dostali adekvátnu adjuvantnú terapiu. Iní autori však poukazujú na fakt, že potreba liečiť pacientov s mikrometastázami v sentinelovej uzline systémovou adjuvantnou chemoterapiou je otázna vzhľadom ku známej toxicite chemoterapie. Je potrebné, aby výhody systémovej liečby prevyšovali riziko nežiadúcich účinkov. V prípade výskytu nanometastáz v sentinelovej uzline je adjuvantná liečba indikovaná v závislosti od charakteristiky nádorového ochorenia akými sú – veľkosť tumoru, grading tumoru a status hormonálnych receptorov. Vynára sa tiež otázka prediktívnej hodnoty menopauzálneho statusu pri systémovej adjuvantnej terapii nano a mikro metastáz [30]. Súčasné štúdie pokračujú v demonštrovaní kontroverzií nano a mikro metastáz ochorenia. Niektoré uzatvárajú, že nemajú prognostický význam, iné, že pN1(mi) sú významné, ale pN0(i+) nie. Iné štúdie hovoria o prognostickom význame pre obe skupiny [8, 10, 13, 18, 21]. V súčasných systémoch určovania štádií karcinómu prsníka sa lymfatické uzliny ktoré obsahujú mikrometastázy klasifikujú ako uzlinovo-pozitívne pN1(mi), zatiaľ čo uzliny obsahujúce izolované rakovinové bunky sú klasifikované ako uzlinovo-negatívne pN0(i+). Z hľadiska novších výsledkov bude zrejme potrebné aj prehodnotenie súčasnej AJCC klasifikácie [1]. V súčasnosti sú pacientky s výskytom makro a mikrometastáz v sentinelovej uzline indikované k axilárnej disekcii, nakoľko predstavujú signifikantný prognostický faktor, ktorý vedie k častejšiemu relapsu ochorenia a kratšiemu prežívaniu pacientok [13,17, 22].
ZÁVER
Prechod od rutinnej axilárnej lymfadenektómie k biopsii sentinelovej uzliny predstavuje jeden z najvýznamnejších medicínskych úspechov u žien s rakovinou prsníka za posledných 40 rokov. V terapeutickom algoritme tohto ochorenia je porovnateľný s prechodom od radikálnych mastektómií k prsník záchovnym výkonom. Tak, ako sme boli za uplynulých 20 rokov svedkami meniacich sa indikačných kritérií k prsník záchovnym operáciám, tak sme v súčasnosti konfrontovaní s najnovšími poznatkami pri zdokonaľovaní a aplikovaní tejto metódy do každodennej klinickej praxe. Dnes už nestojí otázka, či biopsiu sentinelovej uzliny robiť, ale ako ju realizovať a kde. Na jednej strane by mala predstavovať „zlatý štandard“ na pracoviskách, ktoré sa zaoberajú chirurgiou prsníka. Na druhej strane, vzhľadom k vysokým požiadavkám na interdisciplinárnu spoluprácu, erudíciu chirurga a náročné materiálovo technické vybavenie, je táto metóda predurčená k tomu, aby sa vykonávala v špecializovaných, diagnosticko-terapeutických a onkologických centrách.
V poslednom decéniu sme svedkami rozširujúcich sa indikačných kritérií. V literárnych zdrojoch nachádzame časté referencie o využití tejto metódy u niektorých foriem duktálného karcinómu in situ [3, 23, 29] a multifokálnych, resp. multicentrických invazívnych tumorov [7, 16, 20].Využitie tejto metódy u pokročilých karcinómoch a tumoroch liečených primárne chemoterapiou je však zatiaľ v rovine klinických štúdií [4, 15, 24].
Kontroverznou naďalej zostáva problematika klinického významu mikrometastáz a izolovaných nádorových buniek.
MUDr. Peter Chvalný
Bukova 5
811 02 Bratislava
Slovenská republika
e-mail: pchvalny@ousa.sk
Sources
1. American Joint Committee for Cancer Staging and End Results, Clinical Highlights from the National Cancer Data Base. CA Cancer J. Clin., 49, 1999, s. 145–158.
2. ASCO 2009: Sentinel Node Micrometastases Need Additional Treatment in Breast Cancer American Society of Clinical Oncology, June 4, 2009 (Orlando, Florida) http://www.medscape.com/viewarticle/703954
3. Ansari, B., Ogston, S. A., Purdie, C. A., Adamson, D. J., Brown, D. C., Thompson, A. M. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. British Journal of Surgery, 2008, 95, 547–554.
4. Barclay, L., Vega, Ch. Lymphatic Mapping, Sentinel Lymphadenectomy Before Neoadjuvant Chemotherapy May Be Accurate in Large Breast Cancers. Am. J. Surg., 2005; 190 : 371–375.
5. Bauer, T. W., Spitz, F. R., Callans, L. S., et al. Subareolar and peritumoral injection identify similar sentinel nodes for breast cancer. Ann. Surg. Oncol., 2002, 9 : 169–176.
6. Bland, K., Copeland, E. The Breast. London, Saunders 3rd edition. 2003, 1049 pp.
7. Cipolla, C., Vieni, S., Fricano, S., Cabibi, D., Graceffa, G., Costa, R., Latteri, S. The accuracy of sentinel lymph node biopsy in the treatment of multicentric invasive breast cancer using a subareolar injection of tracer. World J. Surg., 2008, Nov; 32(11): 2483–2487.
8. Colleoni, M., Rotmensz, N., Peruzzotti, G., et al. Size of breast cancer metastases in axillary lymph nodes: Clinical relevance of minimal lymph node involvement. J. Clin. Oncol., 2005, 23 : 1379–1389.
9. Cote, R. J., Peterson, H. F., Chaiwun, B., et al. Role of immunohistochemical detection of lymph-node metastases in management of breast cancer: International Breast Cancer Study Group. Lancet, 1999, 354 : 896–900.
10. Cox, C. E., Kiluk, J. V., Riker, A. I., et al. Significance of sentinel node micrometastases in human breast cancer. J. Am. Coll. Surg., 2008, 206 : 261–268.
11. Cserni, G., Gregori, D., Merletii, F., et al. Meta-analysis of non-sentinel node metastases associated with micrometastastis sentinel node in breast cancer. Br. J. Surg. 2004; 91.
12. Červinka, V., Šťastný, K., Šiller, J., a kol. Sentinelová uzlina v praxi. Onkológia (Bratisl.), 2006, roč. 1 (4): 259–261.
13. Červinka, V., Šťastný, K., Nechvátal, L., Pellant, A., Ryška, A. Význam imunohistochemického vyšetření při detekci metastáz v sentinelových uzlinách karcinomu prsu. Onkologia (Bratisl.), 2008, roč. 3 (4): 268–269.
14. de Boer, M., et al. Micrometastases and isolated tumor cells: relevant and robust or rubbish? (MIRROR) Preliminary results of the MIRROR study from the Dutch breast cancer trialists group. SABCS 2008 Abstracts. 70 s. Abstract 23.
15. Fait, V., Chrenko, V., Gaťek, J. Sentinelová biopsie u karcinomu prsu a neoadjuvantní chemoterapie. Klinická onkologie, 2005, č. 3, 77–79.
16. Ferrari, A., Dionigi, P., Rovera, F. Multifocality and multicentricity are not contraindications for sentinel lymph node biopsy in breast cancer surgery. World Journal of Surgical Oncology, 2006, 4 : 79.
17. Gipponi, M., Canavese, G., Lionetto, R. The role of axillary lymph node dissection in breast cancer patients wit sentinel lymph node micrometastases. Eur. J. Surg. Oncol., 2006; 32 : 143–147.
18. Gobardhan, P. D., Elias, S. G., Madsen, E. V. E., et al. Prognostic value of micrometastases in sentinel lymph nodes of patients with breast carcinoma: A cohort study. Ann. Oncol., 2009, 20 : 41–48.
19. Hohenberger, P., Reuhl, Th., Markwardt, P. et al. Sentinel node detection beim Mammacarcinom, Chirurg, 1998, 69 : 708–716.
20. Holwitt, D. M., Gillanders, W. E., Aft, R. L., Eberlein, T. J., Margenthaler, J. A. Sentinel lymph node biopsy in patients with multicentric/multifocal breast cancer: low false-negative rate and lack of axillary recurrence. Am. J. Surg., 2008, Oct; 196(4): 562–565.
21. Chen, S. L., Hoehne, F. M., Giuliano, A. E. The prognostic signficiance of micrometastases in breast cancer: A SEER population-based analysis. Ann. Surg. Oncol., 2007, 14, 3378–3384.
22. Julínek, S. Mikrometastázy karcinomu prsu v sentinelové uzlině: současné kontroverze. Prakt. Gyn. 2006; 10(1).
23. Meijnen, P., Rutgers, E. J. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. Br. J. Surg., 2008; 95 : 547–554.
24. Menard, J. P., Extra, J. M., Jacquemier, J., Buttarelli, M., Lambaudie, E., Bannier, M., Brenot Rossi, I., Houvenaeghel, G. Sentinel lymphadenectomy for the staging of clinical axillary node-negative breast cancer before neoadjuvant chemotherapy. Eur. J. Surg. Oncol., 2009, Jan 19.
25. Nasser, I. A., Lee, A. K., Bosari, S., et al. Occult axillary lymph node metastases in „node-negative” breast carcinoma. Hum. Pathol., 1993, 24 : 950–957.
26. National Cancer Date Base 2009, http://www.facs.org/cancer/
27. Rimarčík, M. Štatistika pre prax. Enigma, 2007, 81–82, kapitola 3. 2. 10.
28. San Antonio Breast Cancer Symposium (SABCS) 32nd Annual meeting, December 9 - 13, 2009; San Antonio, Texas, Nodal Micrometastases Raise Breast Cancer Recurrence Risk,
http://www.medpagetoday.com/MeetingCoverage/SABCS/12195
29. Schauer, A. J., Becker, W., Reiser, M., Possinger, K. The Sentinel Lymph Node Concept, Springer-Verlag Berlin Heidelberg 2005, ISBN 3-540-41041-4.
30. Thoma, B. J. If Sentinel Node Micrometastases Are the Question, Are Clinical Trials the Answer? Allegheny General Hospital, Pittsburg, PA. Journal Of Clinical Oncology, Vol. 27, 2009.
31. Tjan-Heijnen, V. C., Pepels, M. J., de Boer, M., et al. Impact of omission of completion axillary lymph node dissection (cALND) or axillary radiotherapy (axRT) in breast cancer patients with micrometastases (pN1mi) or isolated tumor cells (pN0(i+) in the sentinel lymph node (SN): Results from the MIRROR study. Presented at the 2009 annual meeting of the American Society of Clinical Oncology, May 29–June 2, 2009.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 7-
All articles in this issue
- Laparoscopy in the Management of Invagination in Pediatric Patients
- Liver Transplantations in Children Using Reduced Grafts
- Small Intestine Invagination in an Adult
- Treatment of Upper Gastrointestinal Tract Fistules in the Surgical Intensive Care Unit
- Results and Complications of Laparoscopic Adjustable Gastric Banding – 12 Years Experience
- Benefit of PET/CT in the Preoperative Staging in Pancreatic Carcinomas
- Uncommon Rectal Adenocarcinoma Metastases
- A Rare Complication Following Anastomosis Suturing Using a Biofragmentable Valtrac© Anastomosis Ring – A Case Review and Literature Overview
- Surgical Management of the Failed Back Surgery Syndrome (FBSS) Using Posterior Lumbar Interbody Fusion (PLIF) with Posterior Transpedicular Stabilization
- Submucous Lipoma as a Cause of Invagination in Adulthood
- Significance of the Sentinel Lymph Node Biopsy in Early Breast Carcinomas
- Ovarial Hyperstimulation Syndrome in the Differential Diagnostics of Acute Abdomen
- Acute Injuries of Lateral Ankle Joint Ligaments
- Hallux Flexus – The Result of Posttraumatic Entrapment of the Flexor Hallucis Longus Tendon in the Tibial Fracture Site
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Small Intestine Invagination in an Adult
- Ovarial Hyperstimulation Syndrome in the Differential Diagnostics of Acute Abdomen
- Uncommon Rectal Adenocarcinoma Metastases
- Significance of the Sentinel Lymph Node Biopsy in Early Breast Carcinomas
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

