-
Medical journals
- Career
Trombocytopenie u myelodysplastického syndromu
Authors: J. Čermák
Authors‘ workplace: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Published in: Vnitř Lék 2010; 56(Supplementum 1): 39-42
Category: 16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Trombocytopenie se vyskytuje v době diagnózy u 30 % nemocných s myelodysplastickým syndromem (MDS) a může být příčinou závažných komplikaci jak v časné, tak v pokročilé fázi onemocnění. Cytopenie přítomná ve více krevních řadách je sama o sobě nepříznivým prognostickým faktorem u MDS. Nejčastější příčinou trombocytopenie u MDS je porucha regulace trombopoézy, která je inefektivní a podléhá ve zvýšené míře apoptóze, méně často je přítomna absolutně snížená produkce trombocytů. V léčbě trombocytopenie se u MDS krom podávání destičkových koncentrátů uplatňuje imunosupresivní léčba, u vybraných nemocných transplantace krvetvorných buněk a probíhají klinické studie s využitím agonistů trombopoetinu. Efektivní a relativně bezpečné podávání těchto látek by mohlo u nemocných s časnou formou MDS nahradit některé náročnější a rizikovější léčebné postupy (transplantace krvetvorných buněk, podávání antithymocytárního globulinu).
Klíčová slova:
myelodysplazie – trombocytopenie – patogeneze – léčba – imunosuprese – romiplostimÚvod
Myelodysplastický syndrom (MDS) představuje soubor klonálních poruch krvetvorby charakterizovaný v časné fázi mutací kmenové krvetvorné buňky, jež vede jednak k akcentaci proliferace mladších forem krvetvorby, jednak vyvolává jako antigenní podnět imunitní reakci s indukcí tvorby proapoptotických cytokinů cytotoxickými T-lymfocyty, což vede k vystupňovanému zániku zralejších elementů krvetvorby. Vznikající nestabilita genomu se projevuje tendencí k akumulaci dalších mutací vedoucích ke ztrátě fyziologické regulace proliferace a diferenciace a nekontrolovanému nárůstu mladých CD34+ prekurzorů o nízkém stupni apoptózy. Výsledkem je rozvoj akutní myeloidní leukemie (AML).
Incidence trombocytopenie u MDS
Analýza nálezů u rozsáhlé skupiny neléčených nemocných s MDS, která byla podkladem pro vytvoření Mezinárodního prognostického skórovacího systému (IPSS), prokázala přítomnost trombocytopenie (počty trombocytů < 100 × 109/ l) u 30 % nemocných v době diagnózy choroby. Medián délky přežití činil u nemocných s < 100 × 109/ l trombocytů 27 měsíců oproti 60 měsícům u nemocných s > 100 × 109/ l trombocytů v době diagnózy [1]. Při analýze největšího evropského registru nemocných s MDS v Düsseldorfu došlo během pěti let od diagnózy k přechodu do AML u 32 % nemocných s > 100 × 109/ l trombocytů v době diagnózy na rozdíl od 38 % nemocných s < 100 × 109/ l trombocytů [2]. I když izolovaná trombocytopenie bez přítomnosti cytopenie v dalších řadách nebyla vyhodnocena u nemocných s MDS jako statisticky významný nepříznivý prognostický faktor [1], může být příčinou závažných krvácivých komplikací jak u nemocných s časnými formami choroby bez tendence k leukemizaci, tak u nemocných s pokročilými formami choroby léčených chemoterapií.
Etiologie a patogeneze
Ke snížení počtu trombocytů může dojít obecně buď v důsledku jejich snížené produkce v kostní dřeni, či při jejich zvýšeném zániku (obr. 1). Absolutně snížená produkce trombocytů bývá přítomna zejména u tzv. hypoplastické formy MDS charakterizované povšechně sníženou buněčností kostní dřeně [3], méně často bývá trombopoéza redukována u pokročilých forem MDS díky proliferaci patologického klonu. Zdaleka nejčastější příčinou trombocytopenie u MDS je však porucha regulace trombopoézy. Jak již bylo zmíněno výše, mutace vedoucí ke vzniku abnormálního klonu působí současně jako antigenní podnět vedoucí k abnormální aktivaci cytotoxických lymfocytů indukujících apoptózu zralejších elementů krvetvorby. Důsledkem je různý stupeň cytopenie v jednotlivých krevních řadách. Krvetvorba je inefektivní a část krevních elementů zaniká ještě před vyplavením do periferní krve. Zvýšený zánik trombocytů v důsledku přítomnosti protilátek je u MDS poměrně vzácný a většinou je doprovázen jinými autoimunitními fenomény [4]. Zejména u pokročilých forem choroby může k trombocytopenii přispívat i zvýšená konzumpce destiček při aktivaci koagulačního systému.
Image 1. Schéma obratu krevních destiček v organizmu s vyznačením jednotlivých mechanizmů, jež se mohou podílet na vzniku trombocytopenie. 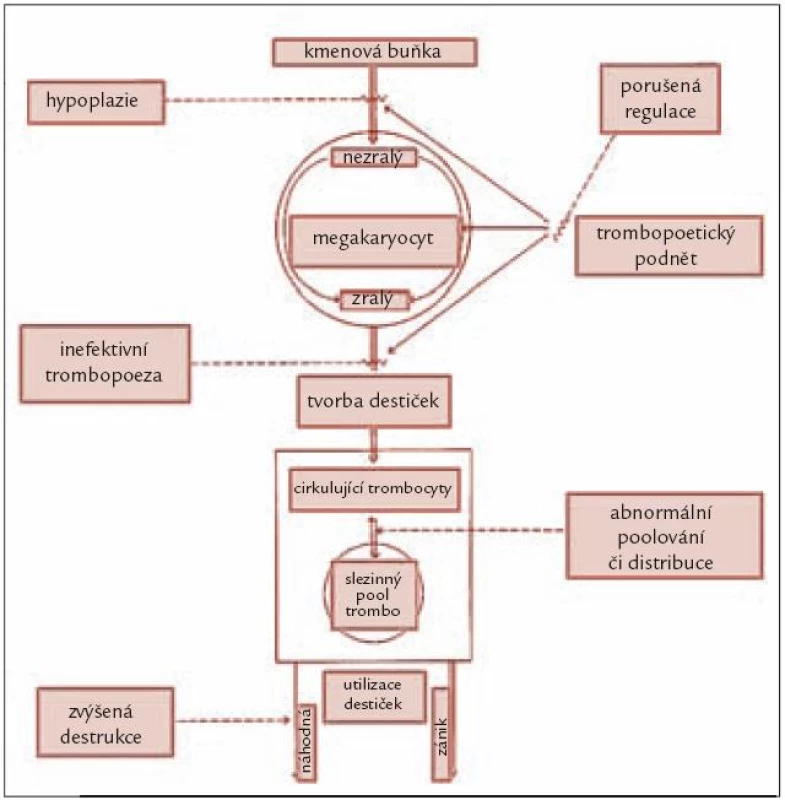
U nemocných s MDS s počty trombocytů < 10 × 109/ l je přítomno vysoké riziko závažných krvácivých komplikací, nicméně krvácet mohou i nemocní s vyššími počty krevních destiček. Cortes et al prokázali u nemocných s MDS vysokou incidenci funkčních poruch destiček, zejména poruchy agregace trombocytů [5]. Recentní nálezy ukazují, že porucha agregace destiček může u MDS vznikat v důsledku snížené exprese některých proteinů sloužících k přenosu signálů z nitra trombocytu na jeho povrch extracelulárně (Talin-1 a Vinculin), což může vést k defektní funkci glykoproteinu GPIIb/ IIIa [6].
Diagnostika
Diagnostika trombocytopenie se u MDSopírá o běžný diagnostický panel zahrnující vyšetření periferního krevního obrazu, aspirátu a trepanobioptického vzorku kostní dřeně. Dysplastické změny v megakaryopoéze odrážejí poruchy proliferace a diferenciace a projevují se v kostní dřeni nejčastěji přítomností mikromegakaryocytů, poruchami lobulizace jader (velké mononukleární jádro, mnohotná malá jádra) či nesouběhem zrání jádra a cytoplazmy (obr. 2). V periferní krvi nacházíme makrotrombocyty a hypogranulární trombocyty [7]. Přítomnost protilátek vázaných na trombocyty můžeme prokázat pomocí průtokové cytometrie.
Image 2. Obraz hrubých dysplastických změn megakaryocytu u nemocné s MDS. 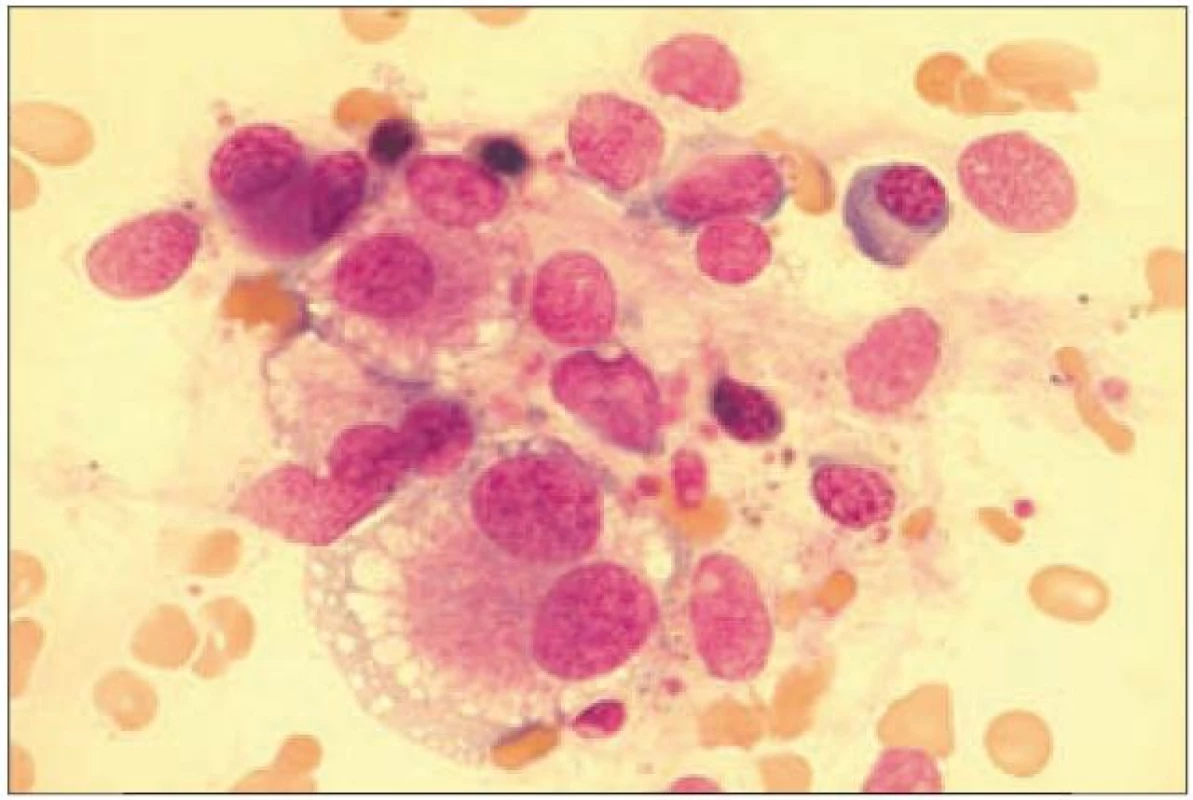
Léčba
Základní léčebné postupy u trombocytopenických nemocných s MDS jsou uvedeny v tab. 1.
Table 1. Možnosti léčby trombocytopenie u nemocných s myelodysplastickým syndromem. 
Podpůrná léčba spočívá v podávání destičkových koncentrátů. Vzhledem k riziku vzniku aloprotilátek při opakovaném podávání trombokoncentrátů je doporučováno přípravky před podáním deleukotizovat. Terapeutická indikace je dána přítomností krvácivých projevů v důsledku trombocytopenie, na profylaktické podávání destičkových koncentrátů není u MDS jednotný názor, hodnoty počtu trombocytů, při kterých je indikováno podání trombocytů, se pohybují mezi 10 a 15 × 109/ l, hodnoty se však mohou individuálně výrazně lišit vzhledem k možné přítomnosti funkčních poruch trombocytů či současné aktivace koagulačního systému.
Indikace imunosupresivní léčby u MDS vychází z předpokladu přítomnosti abnormální reakce imunitního systému namířené proti krvetvorným buňkám a vedoucí k jejich zániku – apoptóze. Imunosuprese je používánahlavně u hypoplastické formy MDS (imunitně podmíněného selhání kostní dřeně) či při přítomnosti dalších autoimunitních fenoménů. Nejčastěji užívanými léčivy bývají kortikosteroidy v kombinaci s cyklosporinem A (CS - A), nebo antithymocytární globulin (ATG) v kombinaci s kortikosteroidy a CS - A. Experimentálně byla podávána řada léků, nejnověji alemtuzumab [8]. V naší práci z roku 1997 bylo léčeno CS - A většinou v kombinací s prednisonem 17 nemocných s časným MDS a cytopenií ve 2 či 3 řadách [9]. U 23 % nemocných bylo dosaženo kompletní remise, ze skupiny 12 nemocných, kteří měli trombocytopenii, byl efekt hodnocený vzestupem počtu trombocytů nad 50 × 109/ l přítomen u 66 % nemocných. Rozšířená studie publikovaná v roce 2005 prokázala efekt kombinace prednisonu v dávce 0,4 – 0,5 mg/ kg/ den s CS - A (3 mg/ kg/ den a úprava dle hladiny CS - A v séru) u 45 % nemocných s iniciální trombocytopenií (opět hodnocen vzestup počtu trombocytů nad 50 × 109/ l) [10]. ATG je většinou podáván v dávce 3,75 mg/ kg/ den po dobu pěti dní společně s kortikosteroidy a následnou dlouhodobou léčbou CS - A, odpověď v destičkové řadě byla pozorována u 40 – 50 % nemocných, přičemž nebyl pozorován rozdíl mezi koňským a králičím ATG [11]. Krom práce Molldrema et al nebyl pozorován prognostický význam počtu trombocytů v době léčby na efekt podávání ATG [12].
Určitý efekt na vzestup počtu trombocytů mělo podávání syntetického androgenu Danazolu, zejména u nemocných s přítomností protilátek proti trombocytům díky tlumivému účinku Danazolu na expresi receptoru pro Fc fragment imunoglobulinů na povrchu makrofágů [13].
Stimulační efekt na produkci trombocytů byl prokázán i u některých interleukinů (IL-3, IL-6), zejména v kombinaci s nízkodávkovanou chemoterapií [14].
Přítomnost trombocytopenie může hrát roli při indikaci nemocných s časnými formami MDS k transplantaci krvetvorných buněk (SCT). Nález cytopenie ve více řadách spolu s nepříznivými změnami karyotypu (dle IPSS) zařazuje nemocné do skupiny se středním – II. rizikem, u kterých by měla být zvážena indikace SCT jako prvé léčebné metody [15]. Relativní indikaci k SCT představuje přítomnost těžké trombocytopenie s opakovanými závažnými krvácivými komplikacemi u nemocných s nízkým či středním – I. rizikem. Dnes přežívá po SCT pět a více let 60 – 75 % nemocných s časnými stadii choroby bez nadbytku blastů [16]. Nicméně je stále přítomna signifikantní peritransplantační mortalita (15 – 30 %), předběžné výsledky neukazují významnější rozdíl mezi užitím myeloablativního a redukovaného přípravného režimu [17], ale je nutné zhodnocení v prospektivní studii.
Nález relativního deficitu trombopoetinu, kdy vzestup jeho hladiny nekoreloval se stupněm trombocytopenie u nemocných s MDS [18], vedl obdobně jako u imunitní trombocytopenické purpury k indikaci podávání agonistů trombopoetinu i u MDS. Romiplostim představuje fúzní protein složený z Fc domény IgG, k jejímž oběma větvím na C konci je kovalentně vázán peptidový řetězec obsahujcí dvě domény pro vazbu na trombopoetinový receptor. Studie fáze I. a II. [19,20] ukázaly dobrou toleranci léku a optimální efektivní dávku 750 µg s. c. jedenkrát týdně, účinek hodnocený vzestupem počtu trombocytů nad 50 × 109/ l byl přítomen u 82 % nemocných. Kombinace podávání romiplostimu a hypometylačních látek rovněž významně snížila incidenci těžké trombocytopenie po podávání azacytidinu a decitabinu [21]. V současné době probíhá randomizovaná studie fáze III podávání romiplostinu u nemocných s MDS oproti placebu. Příznivý efekt romiplostinu u MDS lze spatřovat zejména v možnosti jeho podání nemocným s těžkou trombocytopenií a krvácivými projevy v časných stadiích choroby, kteří jsou v současnosti díky přítomnosti trombocytopenie indikováni k významně rizikovějším léčebným postupům (podávání ATG, transplantace).
doc. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 6. 5. 2010
Sources
1. Greenberg P, Cox C, Le Beau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079 – 2088.
2. Germing U, Strupp C, Kuengden A et al. Prospective validation of the WHO proposals for the classification of myelodysplastic syndromes. Haematologica 2006; 91 : 1596 – 1604.
3. Greenberg PL, Young NS, Gattermann N.Myelodysplastic syndromes. Hematology Am Soc Hematol Educ Program 2002; 136 – 161.
4. Enright H, Jacob HS, Vercellotti G et al. Paraneoplastic autoimmune phenomena in patients with myelodysplastic syndromes: response to immunosuppressive therapy. Br J Haematol 1995; 91 : 403 – 408.
5. Cortes JE, List A, Kantarjian H. Myelodysplastic syndromes. In: Pazdu R et al. (eds.) Cancer Management. A Multidisciplinary Approach 9th edition. New York: CMP Health Care Media 2005 : 825 – 842.
6. Czibere AG, Fröbel J, Hartwig S et al. Platelets derived from patients with myelodysplastic syndromes (MDS) show defective platelet aggregation and integrin aIIbb3 receptor (GPIIb/ IIIa) signaling caused by a reduced expression of proteins required inside - out signaling. (Abstr) Blood 2009; 114 : 248.
7. Brunning RD, Orazi A, Germing U et al. Myelodysplastic syndromes/ neoplasms, overview. In: Swerdlow SH, Campo E, Harris NL et al (eds.) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: International Agency for Research on Cancer (IARC) 2008 : 87 – 108.
8. Sloand EM, Olnes MJ, Weinstein B et al. Alemtuzumab treatment of intermediate - 1 (INT - 1) myelodysplasia patients is associated with sustained improvement in blood counts and cytogenetic remission. (Abstr) Blood 2009; 114 : 53.
9. Jonášová A, Neuwirtová R, Čermák J et al. Cyclosporin A therapy in hypoplastic MDS patients and certain refractory anaemias without hypoplastic bone marrow. Br J Haematol 1998; 100 : 314 – 309.
10. Čermák J, Beličková M, Michalová K.Combined immunosuppressive therapy in patients with early MDS (Abstr.) Haematologica 2005; 90 (Suppl 2): 367.
11. Stadler M, Germing U, Klich KO et al. A prospective, randomised, phase II study of horse antithymocyte globulin vs rabbit antithymocyte globulin as immune - modulating therapy in patients with low - risk myelodysplastic syndromes. Leukemia 2004; 18 : 460 – 465.
12. Molldrem JJ, Leifer E, Bahceci E et al. Antithymocyte globulin for treatment of the bone marrow failure associated with myelodysplastic syndromes. Ann Intern Med 2002; 137 : 156 – 163.
13. Buzaid AC, Garewal HS, Lippman SM et al. Danazol in the treatment of myelodysplastic syndromes. Eur J Haematol 1987; 39 : 346 – 348.
14. Zwierzina H, Suciu S, Loeffler - Ragg Jet al. Low-dose cytosine arabinoside (LD - AraC) vs LD - AraC plus granulocyte/ macrophage colony stimulating factor vs LD - AraC plus Interleukin-3 for myelodysplastic syndrome patiens with a high risk of developing acute leukemia: final results of a randomized phas II study (06903) of the EORTC Leukemia Cooperative Group. Leukemia 2005; 19 : 1929 – 1933.
15. Cutler CS, Lee SJ, Greenberg P et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low - risk myelodysplasia is associated with improved outcome. Blood 2004, 104 : 579 – 585.
16. Deeg HJ. Reducing the frequency of relapse after hematopoietic cell transplantation for MDS. (Abstr). Leukemia Res 2009; 33 (Suppl 1): 28 – 29.
17. Martino R, Iacobelli S, Brand R et al. Retrospective comparison of reduced - intensity conditioning and conventional high-dose conditioning for allogeneic hematopoietic stem cell transplantation using HLA-identical sibling donors in myelodysplastic syndromes. Blood 2006; 108 : 836 – 846.
18. Hellström - Lindberg E, Kanter - Lewensohn L, Nichol J et al. Spontaneous and cytosine-induced thrombocytopenia in myelodysplastic syndromes: serum thrombopoietin levels and bone marrow morfology. Br J Haematol 1999; 105 : 966 – 973.
19. Kantarjian H, Fenaux P, Sekeres MA et al. Phase 1/ 2 study of AMG 531 in thrombocytopenic patients (pts) with low - risk myelodysplastic syndrome (MDS): update including extended tratment (Abstr.). Blood 2007; 110 : 250.
20. Fenaux P, Lyons R, Kantarjian H. An open - label extension study evaluating the long-term safety and efficacy of romiplostin in thrombocytopenic patients (pts) with myelodysplastic syndrome (MDS) (Abstr). Blood 2009; 114 : 2765.
21. Kantarjian H, Giles F, Greenberg P et al. Effect of romiplostim in patients (pts) with low or intermediate risk myelodysplastic syndrome (MDS) receiving azacytidine (Abstr). Blood 2008; 112 : 224.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

