-
Medical journals
- Career
Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
Authors: R. Hrstka; T. Kolářová; E. Michalová; B. Vojtěšek
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2014; 27(Supplementum): 69-74
Overview
PCR metoda se velmi krátce od svého objevení stala rutinní metodou molekulárně biologických výzkumných laboratoří a nepostradatelným nástrojem diagnostické medicíny. Za dobu svého využívání byla rozvinuta do řady variant, které specificky reagují na potřeby výzkumu a diagnostiky co do použitého vstupního materiálu a jeho množství, podmínek reakce a nově vyvinutých technologií. Předložená práce stručně shrnuje jednotlivé PCR přístupy s důrazem na jejich využití v onkologickém výzkumu a praxi.
Klíčová slova:
polymerázová řetězová reakce (PCR) – PCR v reálném čase – digitální PCR – klinická onkologieÚvod
Prvním zásadním krokem vedoucím k objevu a následnému zavedení polymerázové řetězové reakce (polymerase chain reaction – PCR) byla práce publikovaná na konci 60. let minulého století popisující nový druh termofilní bakterie tehdy nazvané Thermus aquaticus. Krátce na to byla z tohoto mikroorganizmu izolována termostabilní polymeráza nazvaná „Taq polymeráza“ a v polovině 80. let minulého století pak americký chemik K. Mullis objevil PCR, za což byl v roce 1993 oceněn Nobelovou cenou za chemii. Význam a originalitu tohoto objevu podtrhuje článek otištěný v amerických novinách The New York Times, který na základě tohoto objevu rozděluje biologii do dvou epoch – „před PCR“ a „po PCR“. Zavedení PCR do praxe tak odstartovalo obrovský rozmach molekulární biologie a významně rozšířilo do té doby relativně omezené portfolio molekulárně-biologických metod.
Polymerázová řetězová reakce je metoda umožňující amplifikaci (tj. zmnožení) specifického úseku nukleové kyseliny, přičemž využívá obecných rysů replikace DNA. Podstatou metody je mnohonásobná syntéza komplementárního řetězce pomocí příslušné DNA polymerázy, a to v rámci sekvence vymezené krátkými syntetickými oligonukleotidy (ssDNA,15 – 30 b), tzv. primery, které jsou odvozeny od dané sekvence. Teoreticky lze z jedné molekuly templátu získat 2n kopií dané sekvence při n cyklech. Toto zmnožení následně umožňuje vizualizaci amplifikovaného produktu, jenž nejčastěji probíhá s využitím agarózové gelové elektroforézy (obr. 1A). PCR reakce byla za dobu jejího využívání rozvinuta do řady variant, které specificky reagují na potřeby výzkumu a diagnostiky co do použitého vstupního materiálu a jeho množství, podmínek reakce a nově vyvinutých technologií.
Image 1. Přehled stěžejních PCR technologií. A. Tradiční PCR; B. PCR v reálném čase; C. digitální PCR – schematická ukázka frakcionace vzorku a následné vyhodnocení; D. konkrétní ukázka výsledků získaných pomocí digitální PCR (ddPCR), pro zajímavost tytéž vzorky byly paralelně analyzovány pomocí PCR v reálném čase viz část B. 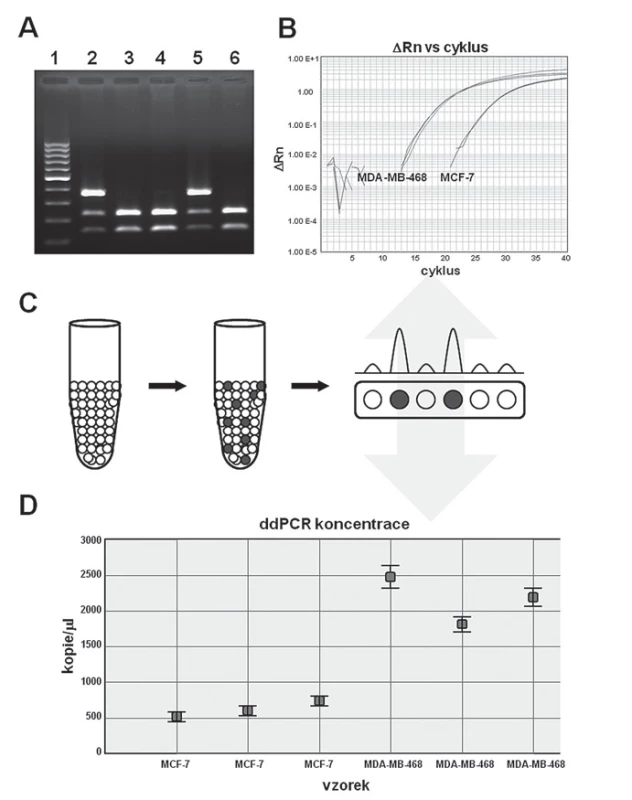
Využití PCR v onkologii
PCR je stejně jako mnoho dalších molekulárně-biologických analýz díky svým přednostem, jako je časová a materiálová úspora, možnost automatizace a dobrá reprodukovatelnost, využívána ve stále širším měřítku v rámci preventivních programů zaměřených na stanovení rizika vzniku onemocnění, při diagnostice patologických stavů i určení prognózy onemocnění. PCR se rovněž uplatňuje v rámci tzv. farmakogenetických vyšetření, při nichž je sledována genetická predispozice pro lékovou odpověď, tj. predikována bezpečnost či toxicita a účinnost terapeutické látky pro konkrétního pacienta.
PCR, obvykle ve spojení s dalšími molekulárně-biologickými technikami (elektroforéza, RFLP, sekvencování), umožňuje detekovat různé typy mutací spojené s vyšším rizikem vzniku nádoru a pomáhá tak zlepšit preventivní screeningové programy nádorových onemocnění či podrobněji charakterizovat typ nádoru pro následnou volbu účinnější terapie. Příkladem vyšetření prováděných v Masarykově onkologickém ústavu mohou být detekce mutací specifických genů spojených s genetickou predispozicí ke vzniku nádoru, kdy příslušná sekvence genu je nejprve amplifikována pomocí PCR a získané amplikony následně sekvencovány. Jedná se např. o geny BRCA1, BRCA2 u hereditárního syndromu nádoru prsu a/ nebo vaječníku; geny MLH1, MSH2, MSH6 u hereditárního nepolypózního karcinomu tlustého střeva – tzv. Lynchova syndromu; transkripční varianty p16/ INK4a a p14/ ARF genu CDKN2A u familiárního maligního melanomu; gen TP53 u Li ‑ Fraumeniho syndromu; nebo gen CDH1 u hereditární formy difúzního karcinomu žaludku. Dalším příkladem je vývoj metod detekce volných nádorových buněk v krevním řečišti či lymfatických uzlinách na principu PCR, který má zásadní význam pro hodnocení metastatického potenciálu buněk a vývoje onemocnění a tím i volby příslušné terapie. Analogicky se PCR případně RT‑PCR (reverse transcription PCR) využívá při sledování minimální reziduální nemoci zejména u hematologických malignit, při níž se hodnotí počet přítomných nádorových buněk, např. detekcí transkriptu fúzního genu bcl ‑ abl v případě chronické myeloidní leukemie (chronic myeloid leukaemia – CML). Kromě identifikace vlastních nádorových markerů je PCR, zejména pak kvantitativní PCR (viz dále), významným nástrojem při stanovení přítomnosti patogenních organizmů u onkologických pacientů při septických stavech. Základem testu je amplifikace specifické sekvence patogenu v odebraném biologickém vzorku a oproti klasické mikrobiologické kultivaci představuje značnou časovou úsporu a pro pacienta tedy rychlejší nasazení účinné léčby.
V rámci experimentální onkologie se PCR využívá především při technikách klonování, tj. vnášení cizorodé DNA do vektorových systémů, kdy současně představuje i základní nástroj pro ověřování přítomnosti specifických sekvencí ve sledovaném genomu. PCR je využívána i v případě čipových technologií, při nichž je analyzována úroveň transkripce několika až stovek genů současně a sledovány reakce buněk na specifické podmínky indukcí vybraných signálních drah, expresí specifických genů a syntézou specifických proteinů.
PCR v reálném čase (kvantitativní)
Dalším revolučním krokem bylo zavedení kvantitativní PCR (quantitative PCR – qPCR) neboli PCR v reálném čase (real ‑ time PCR). Oproti tradiční PCR, kdy konečný produkt (amplikon) je detekován až po ukončení reakce, PCR v reálném čase umožňuje stanovit tvorbu produktu v průběhu reakce, a to i v raných fázích, kdy přírůstek intenzity fluorescence je úměrný množství stanovovaného templátu (obr. 1B). Právě měření kinetiky v brzkých fázích reakce představuje zásadní výhodu v porovnání s tradiční PCR. Postup tradiční PCR včetně jejího vyhodnocení je v porovnání s kvantitativní PCR časově náročnější a vyznačuje se nižší citlivostí detekce, amplifikované produkty jsou rozlišovány především na základě velikosti, a poskytují tak výsledky především kvalitativního charakteru. V případě qPCR je však potřeba počítat s podstatně vyšší pořizovací hodnotou přístrojového vybavení a vyššími náklady na analýzu vzorku.
Obecně lze průběh qPCR reakci rozdělit do tří fází. V první, tzv. exponenciální fázi, je reakce vysoce specifická, v případě 100% efektivity dochází k přesnému zdvojnásobení množství očekávaného produktu, data jsou tudíž maximálně přesná. Druhou fázi označujeme jako lineární. Tato fáze může být poměrně variabilní, dochází při ní ke zpomalování reakce, spotřebě jednotlivých komponent reakce, může začít docházet i k degradaci vzniklých produktů. Ve třetí, tzv. plateau fázi, je reakce zastavena, nedochází k syntéze dalšího produktu, naopak může nastat jeho degradace. K přesné kvantifikaci jsou využívány sondy obvykle značené fluorescenčním barvivem. Rozlišujeme dva hlavní typy sond: 1. nespecifické – typickým příkladem jsou fluorescenční kyaninová barviva SYBR Green, která fluoreskují při vazbě do menšího žlábku dsDNA, a 2. specifické, fluorescenčně značené sondy. Specifické sondy jsou navrženy tak, aby hybridizovaly s templátovou DNA za stejných podmínek jako primery v místě vymezeném protisměrně orientovanými primery. Existuje řada variant specifických sond, nejčastěji se používají tzv. hydrolyzační (TaqMan) sondy, které nesou na svém 5’ konci fluorescenční značku a na 3‘ konci tzv. zhášeč. Při hydrolýze sondy DNA ‑ polymerázou dochází k oddělení fluorescenční značky od zhášeče a následné emisi fluorescence (obr. 2).
Image 2. Princip využití nespecifických a specifických sond při PCR v reálném čase. A. Nespecifi cká próba (nejčastěji SYBR Green) se váže na dsDNA, čímž dochází k emisi fluorescence. B. Působením exonukleázové aktivity polymerázy dochází k rozštěpení próby navázané k cílové sekvenci a následnému uvolnění fluorescenčního signálu. 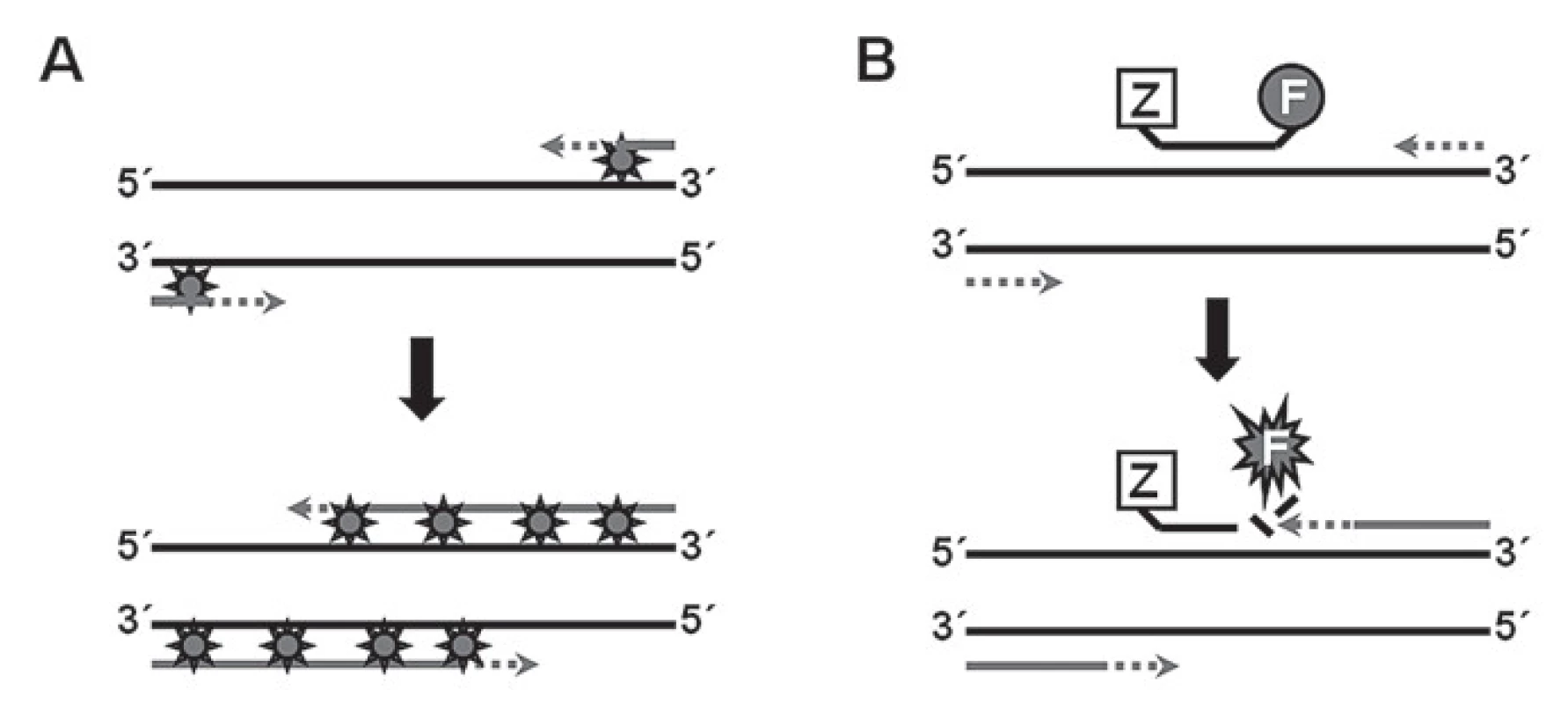
V praxi se nejčastěji využívají dvě základní vyhodnocovací metody. První varianta je absolutní kvantifikace, tzv. metoda absolutní standardní křivky, která umožňuje zjištění přesného množství kopií templátu ve vzorku. Získáváme tak výsledek v kopiích vzhledem k celkovému množství standardu (např. plazmidové DNA). Druhá varianta je relativní kvantifikace využívající buď relativní standardní křivku, nebo se provádí tzv. komparativní CT metoda. Přístup založený na konstrukci relativní standardní křivky umožňuje zjištění změn množství templátu mezi vzorky vzhledem k interní kontrole (tzv. kalibrátoru). Komparativní CT metoda využívá aritmetický vzorec (2 – ∆∆CT) definující množství cílového templátu normalizovaný na základě množství endogenních referenčních sekvencí a kvantifikovaný relativně, tedy vzhledem ke kalibrátoru (jinému vzorku – obvykle kontrole).
Využití PCR v reálném čase v onkologii
PCR v reálném čase patří mezi důležité diagnostické nástroje umožňující nejen kvantitativní analýzu zaměřenou na stanovení exprese vybraných genů, ale i kvalitativní, běžně používanou při stanovení mutací či polymorfizmů. V případě kvalitativních analýz (genotypizace) se velmi často používá vysokorozlišovací analýza křivek tání tzv. HRM (high resolution melting) analýza. V principu je tato metoda založena na heteroduplexní analýze, v rámci které jsou detekovány rozdíly v teplotách tání PCR disociačních křivek. Kromě stanovení rozdílů v analyzovaných sekvencích, především přítomnosti specifických mutací, lze HRM použít i k detekci metylací. Typickým příkladem využití HRM v onkologii je diagnostika hereditárních nádorových syndromů. Patří sem např. přímé vyšetření přítomnosti mutace v genech BRCA1, BRCA2 (hereditární syndrom nádoru prsu a/nebo vaječníků); MLH1, MSH2, MSH6 (hereditární nepolypózní kolorektální karcinom, Lynchův syndrom); TP53 (Li ‑ Fraumeniho syndrom) a řada dalších. Dále se PCR v reálném čase používá i k detekci mutací vzhledem k indikaci vhodné léčby. Klasickým příkladem je vyšetření na přítomnost bodové záměny v kodonech 12 a 13 genu KRAS, kdy se opět používá HRM analýza nebo se využívá technologie ARMS (amplification refractory mutation system), jenž spočívá v použití alelicky, v tomto případě mutant specifických primerů specificky rozpoznávajících jednotlivé mutanty. Není‑li mutace genu KRAS prokázána, je vhodné nasadit biologickou léčbu založenou na aplikaci rekombinantních protilátek inhibujících EGFR (epidermal growth factor receptor). Vychází se z předpokladu, že v nádorech s wild type KRAS je exprese KRAS proteinu aktivována pouze přechodně signalizací prostřednictvím EGFR, zatímco v případech mutovaného genu KRAS dochází k jeho konstitutivní aktivaci a takové nádory vykazují výrazně sníženou odpověď na EGFR inhibici.
Jedním z nejvýznamnějších farmakogenetických vyšetření v případě hematologických malignit je stanovení polymorfizmu a aktivity enzymu thiopurin S ‑ metyltransferázy (TPMT), enzymu zásadního při odbourávání thiopurinových léčiv využívaných v onkologické terapii a jako imunosupresiv. Snížená aktivita enzymu je důsledkem řady polymorfizmů v kódující oblasti genu TPMT a vede k nežádoucím účinkům při léčbě thiopuriny, jako jsou neurotoxicita, hepatotoxicita atd. Stanovení nejčastějších typů polymorfizmů je prováděno pomocí kvantitativní PCR a je doprovázeno stanovením aktivity TPMT v erytrocytech pomocí HPLC.
Hlavní výhoda PCR v reálném čase v porovnání s klasickou (end‑point PCR) však spočívá v možnosti kvantifikovat množství výchozího templátu podle dynamiky amplifikační reakce, především tedy stanovení exprese vybraných genů. Této skutečnosti lze využít i v experimentální onkologii při sledování hladin exprese vybraných genů na úrovni mRNA za definovaných podmínek. Jedním z možných příkladů praktického využití je predikce vhodnosti nasazení fluorovaných pirimidinů při léčbě nádorů gastrointestinálního traktu, a to v rámci paliativní i adjuvantní terapie. V těchto případech je vhodné stanovit hladinu mRNA pro thymidylát syntázu (TS), thymidin fosforylázu (TP) a dihydropyrimidin dehydrogenázu (DPD), tedy enzymů účastnících se v metabolizmu 5 - fluorouracilu (5 - FU). mRNA může být izolována z biopsií primárního nádoru i metastázy pacienta. V případě zvýšené hladiny exprese genů lze předpokládat rezistenci nádoru k fluoropyrimidinovým cytostatikům.
Digitální PCR
Digitální PCR je někdy též označována jako tzv. třetí generace PCR (obr. 1C). Hlavní výhodou tohoto přístupu je absolutní kvantifikace, aniž musí být sestrojena kalibrační křivka. V podstatě se jedná o „upgrade“ tradiční PCR umožňující klonální amplifikaci a přímou kvantifikaci nukleových kyselin. Je třeba si však uvědomit, že se nejedná o metodu zcela nahrazující stávající PCR přístupy, ale spíše o komplementární metodu zaměřenou především na detekci vzácněji se vyskytujících cílových molekul.
Podstata digitální PCR spočívá v rozdělení analyzovaného vzorku, tedy i vlastních cílových sekvencí, do velkého množství dílčích vzorků. To se provádí buď pomocí miniaturních čipů, kdy je vzorek pomocí mikrokapilár rozdělen do řady malých segmentů (komůrek), nebo je ze vzorku vytvořena emulze olejových mikrokapek. Následně probíhá v každé mikrokapce či komůrce čipu standardní PCR, takže v závislosti na počtu mikrokapek/ kapacitě čipu získáváme tisíce až několik desítek tisíc parciálních kvalitativních výsledků na bázi fluorescence (pozitivní/ negativní) pro analyzovaný vzorek. Vzhledem k možné přítomnosti dvou a více cílových molekul současně (v jedné mikrokapce/ segmentu čipu) je v rámci celkového vyhodnocování tato skutečnost brána v potaz a výsledky jsou korigovány na základě Poissonova rozdělení. Na rozdíl od tradiční PCR, kdy množství amplifikovaného produktu pouze přibližně odpovídá množství templátu a je značně ovlivněno počtem PCR cyklů, kvantifikace cílové sekvence v případě digitální PCR prakticky nezávisí na počtu amplifikačních cyklů, což významně eliminuje závislost na exponenciálním nárůstu množství výsledného PCR produktu, jako je tomu u konvenční PCR či PCR v reálném čase, a umožňuje tak zcela absolutní kvantifikaci (obr. 1D).
Mezi nejvýznamnější aplikace digitální PCR patří:
- Detekce amplifikací genů spojených s maligní transformací. Genomové amplifikace jsou běžnou součástí genomu nádorových buněk. Tyto amplifikace často vedou ke zvýšené expresi specifických onkogenů a zásadním způsobem ovlivňují biologii nádoru. Přesná a citlivá detekce amplifikací je proto žádoucí v rámci diagnostiky nádorů a může mít prognostický a/ nebo prediktivní význam. Tento přístup by mohl v budoucnu sloužit i jako alternativa k v současnosti prováděným FISH analýzám. Hlavní výhoda digitální PCR je robustnost, senzitivita a finanční nenáročnost v porovnání se standardně prováděnými FISH stanoveními.
- Detekce alterací nukleových kyselin přítomných ve vzorku s nízkou četností, tedy minoritně zastoupených v analyzovaném vzorku. Stanovení přítomnosti mutací v homogenních vzorcích je obecně snadno proveditelné a velmi dobře realizovatelné běžnými metodami, neboť se pracuje s velkým množstvím genetického materiálu a mutace je obvykle přítomna v 50 % všech cílových sekvencí (1 mutovaná alela ze 2). Situace se však komplikuje v případě zpracování heterogenního vzorku, v němž je přítomnost mutovaných sekvencí významně snížená. V onkologii jsou typickým příkladem punkční biopsie obecně obsahující velké množství normální/ zdravé tkáně nebo krevní vzorky, kde jsou aberantní buňky značně naředěny.
- Stanovení hladiny miRNA. Tento přístup umožňuje absolutní kvantifikaci miRNA a prokazuje vynikající reprodukovatelnost i v případě nízkých hladin miRNA. Digitální PCR je tedy ideální pro detekci cirkulujících miRNA jako potenciálních diagnostických biomakerů poukazujících na přítomnost onkologického onemocnění.
- Mezi další aplikace, pro něž je vhodné uvažovat o použití digitální PCR, patří absolutní kvantifikace patogenů, detekce onkogenních alel ve vzorcích uchovávaných ve formě parafinových bloků, absolutní kvantifikace standardů pro další aplikace, kvantifikace vzorků v rámci jejich přípravy pro NGS (nová generace sekvencování; pro více informací viz článek Koubková et al v rámci tohoto Supplementa, str. 61–68) či validace výsledků NGS díky absolutní kvantifikaci.
Závěr
Polymerázová řetězová reakce se řadí mezi základní metody molekulární biologie a v dnešní době představuje nepostradatelný nástroj pro manipulaci s genetickou informací v mnoha oblastech biomedicínského výzkumu. S objevem PCR také došlo k obrovskému rozvoji molekulární diagnostiky, který byl ještě umocněn možností kvantifikace cílových molekul díky PCR v reálném čase a následně pak vývojem digitální PCR. Přehled jednotlivých PCR přístupů, jejich porovnání včetně výhod a nedostatků je pro větší přehlednost a srozumitelnost shrnut do tab. 1.
Table 1. Přehled PCR přístupů. 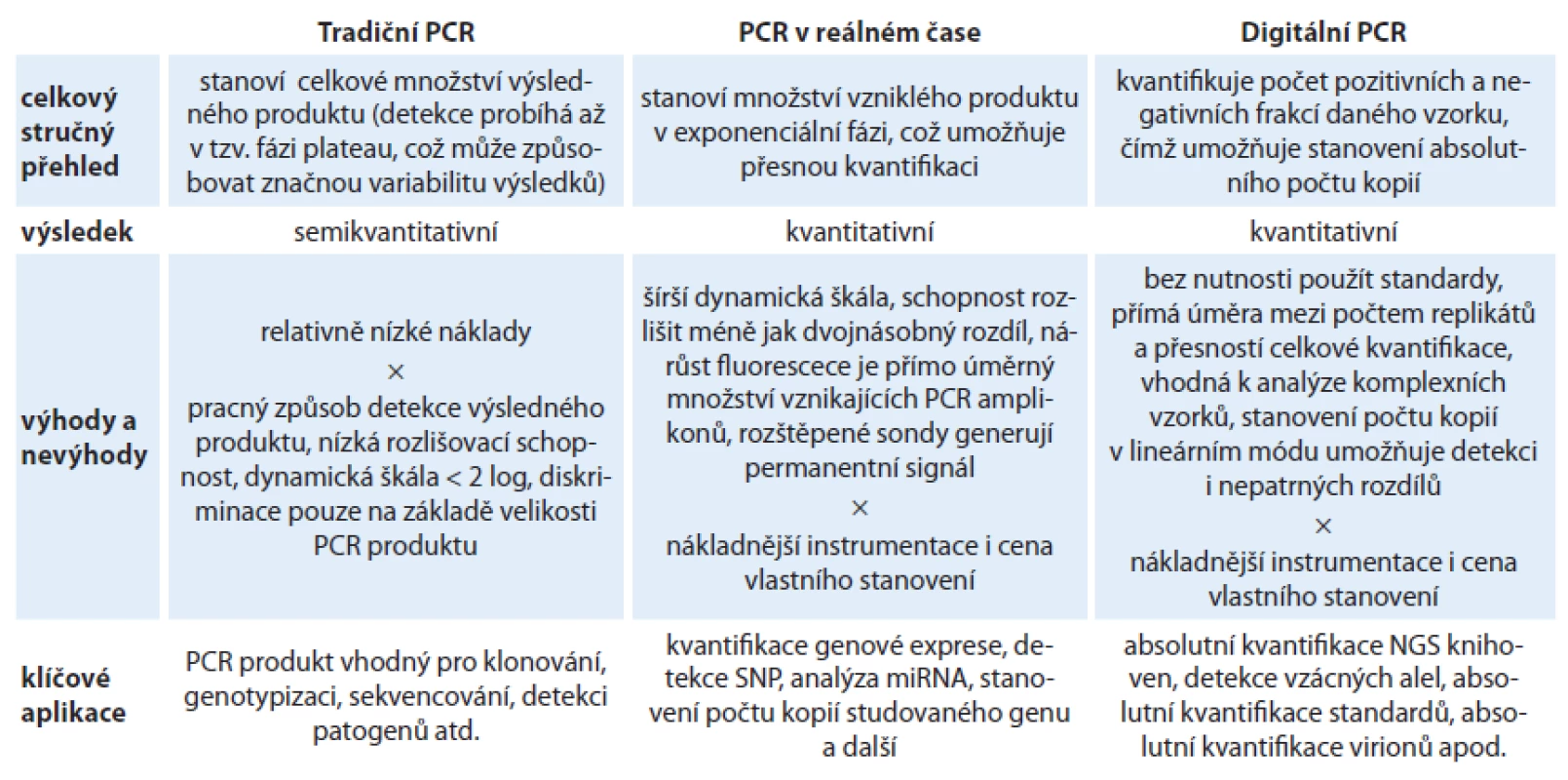
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101), BBMRI_CZ (LM2010004), GAČR 13-00956S a MZ ČR –RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Roman Hrstka, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: hrstka@mou.cz
Obdrženo: 10. 2. 2014
Přijato: 1. 4. 2014
Sources
1. Brock TD, Freeze H. Thermus aquaticus gen. n. and sp. n.,a nonsporulating extreme thermophile. J Bacteriol 1969; 98(1): 289 – 297.
2. Bartlett JM, Stirling D. A short history of the polymerase chain reaction. Methods Mol Biol 2003; 226 : 3 – 6.
3. Wade N. Researchers claim embryonic cell mix of human and cow. N Y Times Web 1998; A1, A26.
4. Foretova L, Petrakova K, Palacova M et al. Genetic testing and prevention of hereditary cancer at the MMCI – over 10 years of experience. Klin Onkol 2010; 23(6): 388 – 400.
5. Goydos JS, Reintgen DS. A molecular technique useful in the detection of occult metastases in patients with melanoma: rt‑PCR analysis of sentinel lymph nodes and peripheral blood. Methods Mol Med 2001; 61 : 301 – 320. doi: 10.1385/ 1 - 59259 - 145 - 0 : 301.
6. Haferlach T, Bacher U, Kern W et al. The diagnosis of BCR/ ABL ‑ negative chronic myeloproliferative diseases (CMPD): a comprehensive approach based on morphology, cytogenetics, and molecular markers. Ann Hematol 2008; 87(1): 1 – 10.
7. Jabbour E, Cortes JE, Kantarjian HM. Molecular monitoring in chronic myeloid leukemia: response to tyrosine kinase inhibitors and prognostic implications. Cancer 2008; 112(10): 2112 – 2118. doi: 10.1002/ cncr.23427.
8. Klouche M, Schroder U. Rapid methods for diagnosis of bloodstream infections. Clin Chem Lab Med 2008; 46(7): 888 – 908. doi: 10.1515/ CCLM.2008.157.
9. Tsalik EL, Jones D, Nicholson B et al. Multiplex PCR to diagnose bloodstream infections in patients admitted from the emergency department with sepsis. J Clin Microbiol 2010; 48(1): 26 – 33. doi: 10.1128/ JCM.01447 - 09.
10. Dubska L, Vyskocilova M, Minarikova D et al. LightCycler SeptiFast technology in patients with solid malignancies: clinical utility for rapid etiologic diagnosis of sepsis. Crit Care 2012; 16(1): 404. doi: 10.1186/ cc10595.
11. Heid CA, Stevens J, Livak KJ et al. Real time quantitative PCR. Genome Res 1996; 6(10): 986 – 994.
12. Zipper H, Brunner H, Bernhagen J et al. Investigations on DNA intercalation and surface binding by SYBR Green I,its structure determination and methodological implications. Nucleic Acids Res 2004; 32(12): e103.
13. Holland PM, Abramson RD, Watson R et al. Detection of specific polymerase chain reaction product by utilizing the 5‘ – 3‘ exonuclease activity of Thermus aquaticus DNA polymerase. Proc Natl Acad Sci USA 1991; 88(16): 7276 – 7280.
14. Wilke K, Duman B, Horst J. Diagnosis of haploidy and triploidy based on measurement of gene copy number by real ‑ time PCR. Hum Mutat 2000; 16(5): 431 – 436.
15. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real ‑ time quantitative PCR and the 2( - Delta Delta C(T)) method. Methods 2001; 25(4): 402 – 408.
16. Krypuy M, Ahmed AA, Etemadmoghadam D et al.High resolution melting for mutation scanning of TP53 exons 5 – 8. BMC Cancer 2007; 7 : 168.
17. Rouleau E, Lefol C, Bourdon V et al. Quantitative PCR high‑resolution melting (qPCR ‑ HRM) curve analysis, a new approach to simultaneously screen point mutations and large rearrangements: application to MLH1 germline mutations in Lynch syndrome. Hum Mutat 2009; 30(6): 867 – 875.
18. Takano EA, Mitchell G, Fox SB et al. Rapid detection of carriers with BRCA1 and BRCA2 mutations using high resolution melting analysis. BMC Cancer 2008; 8 : 59. doi: 10.1186/ 1471 - 2407 - 8 - 59.
19. Bando H, Yoshino T, Tsuchihara K et al. KRAS mutations detected by the amplification refractory mutation system ‑ scorpion assays strongly correlate with therapeutic effect of cetuximab. Br J Cancer 2011; 105(3): 403 – 406.
20. Franklin WA, Haney J, Sugita M et al. KRAS mutation: comparison of testing methods and tissue sampling techniques in colon cancer. J Mol Diagn 2010; 12(1): 43 – 50. doi: 10.2353/ jmoldx.2010.080131.
21. Demlova R, Mrkvicova M, Sterba J et al. Augmenting clinical interpretability of thiopurine methyltransferase laboratory evaluation. Oncology 2014; 86(3): 152 – 158.
22. Aschele C, Lonardi S, Monfardini S. Thymidylate Synthase expression as a predictor of clinical response to fluoropyrimidine‑based chemotherapy in advanced colorectal cancer. Cancer Treat Rev 2002; 28(1): 27 – 47.
23. Mader RM, Muller M, Steger GG. Resistance to 5 - fluorouracil. Gen Pharmacol 1998; 31(5): 661 – 666.
24. Zimmermann BG, Grill S, Holzgreve W et al. Digital PCR: a powerful new tool for noninvasive prenatal diagnosis? Prenat Diagn 2008; 28(12): 1087 – 1093. doi: 10.1002/ pd.2150.
25. Hindson CM, Chevillet JR, Briggs HA et al. Absolute quantification by droplet digital PCR versus analog real ‑ time PCR. Nat Methods 2013; 10(10): 1003 – 1005. doi: 10.1038/ nmeth.2633.
26. Williams Z, Ben ‑ Dov IZ, Elias R et al. Comprehensive profiling of circulating microRNA via small RNA sequencing of cDNA libraries reveals biomarker potential and limitations. Proc Natl Acad Sci USA 2013; 110(11): 4255 – 4260.
27. Henrich TJ, Gallien S, Li JZ et al. Low ‑ level detection and quantitation of cellular HIV ‑ 1 DNA and 2 - LTR circles using droplet digital PCR. J Virol Methods 2012; 186(1 – 2): 68 – 72. doi: 10.1016/ j.jviromet.2012.08.019.
28. Nadauld L, Regan JF, Miotke L et al. Quantitative and sensitive detection of cancer genome amplifications from formalin fixed paraffin embedded tumors with droplet digital PCR. Transl Med (Sunnyvale) 2012; 2(2): pii: 1000107.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue Supplementum-
All articles in this issue
- Programovaná buněčná smrt v nádorových buňkách
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

