-
Medical journals
- Career
Metody studia buněčné migrace a invazivity nádorových buněk
: P. Kovaříková 1; E. Michalová 2; L. Knopfová 3; P. Bouchal 1,2
: Ústav biochemie, Přírodovědecká fakulta MU, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2; Ústav experimentální biologie, Přírodovědecká fakulta MU, Brno 3
: Klin Onkol 2014; 27(Supplementum): 22-27
Migrace a invazivita jsou fenotypovými vlastnostmi buněk, které významně přispívají k průběhu žádoucích fyziologických dějů, jako je hojení ran či embryogeneze, i k velmi závažným patologickým procesům, především pak k metastazování nádorů. Dostupnost vhodných metod studia migračních a invazivních vlastností buněk je tedy zásadní pro pochopení molekulární podstaty těchto dějů a v případě nádorových onemocnění je migrační, invazivní a metastatický potenciál nádorových buněk klíčovým faktorem určujícím klinickou prognózu pacienta. Tento článek podává přehled základních metod in vitro a in vivo, které se využívají při studiu buněčné migrace, invazivity a mechanizmů metastazování nádorů. In vitro metody studia buněčné migrace zahrnují jednoduché dvourozměrné testy (scratch ‑ wound assay a test založený na účinku hepatocytárního růstového faktoru) a dále metody využívající účinku chemotaxe (Dunnova komůrka, videomikroskopie buněk a použití nosičů s chemoatraktanty). Metody pro studium buněčné migrace a invazivity in vitro zahrnují složitější systémy založené na principu Boydenovy komůrky (Transwell migrační/ invazivní test, analýza buněčné migrace a invazivity pomocí systému xCELLigence, a analýzy prováděné s využitím konfokální mikroskopie) a rovněž pak metodu studia buněčné migrace v mikrokanálcích. Přehled in vivo metod shrnuje základní organizmy a metody užívané ke studiu buněčné migrace a invazivity s hlavním důrazem na studium metastazování in vivo v myších modelech. Popsané metody se uplatňují především ve výzkumných projektech zaměřených na vývoj nových diagnostických a terapeutických přístupů v onkologii.
Klíčová slova:
migrace – invazivita – in vitro assaye – in vivo modely – metastazování – nádorové buňkyÚvod
Buněčná migrace a invazivita hrají podstatnou úlohu v řadě biologických procesů, jako je např. embryogeneze, imunitní odpověď, hojení ran, morfogeneze či zánět [1]. V onkologii mají zásadní význam v metastazování nádorových buněk, což je nejčastější příčina vedoucí k terminálnímu stadiu nádorového onemocnění. Tvorba metastáz probíhá během multifaktoriálního a vícestupňového procesu zvaného metastatická kaskáda [2,3]. Její první krok je oddělení nádorové buňky od primárního nádoru [3]. Díky zvýšené expresi proteáz, které zásadně přispívají k invazivní schopnosti buněk štěpením extracelulární matrix (ECM), tyto buňky následně pronikají bazální membránou a mohou prostupovat do stromatu [2]. Stromální buňky přitom mohou zvyšovat jejich agresivní potenciál a podílet se na procesu epiteliálně‑mezenchymální tranzice (EMT) [4,5], vedoucím ke ztrátě buněčné adheze, epiteliální polarity a zvýšené migrační a invazivní schopnosti nádorových buněk. Buňky s mezenchymálním fenotypem pak pronikají do cévního systému procesem označovaným jako intravazace, krevním řečištěm putují do oblasti vzdáleného orgánu, kde mohou po extravazaci vytvořit sekundární nádor neboli metastázu.
Buněčná migrace je proces velmi komplikovaný a při jejím studiu je třeba brát v úvahu řadu biologických aspektů [6]. Pro studium migrace jsou nejčastěji užívány in vitro modelové systémy na bázi buněčných linií, nicméně podmínky, ve kterých buňky migrují, jsou zde značně zjednodušeny, a výsledky proto nemusí plně reflektovat skutečné chování v organizmu. Studium buněčné invazivity se obvykle realizuje v prostředí substrátu, jenž se složením podobá přirozené ECM, jako je kolagen či Matrigel® (obchodní název pro želatinovou proteinovou směs, odvozenou z myších nádorových buněk [7]). Experimentálně podstatně náročnější, avšak reálným podmínkám bližší jsou metody studia in vivo ve zvířecích modelech [6]. Za účelem porozumění procesům migrace, invazivity a s nimi spojené adheze jsou nadále vyvíjeny nové metody studia, díky nimž je možné studovat mechanizmy migrace buněk a buněčných souborů ve vztahu k regulačním mechanizmům. V kombinaci se studiem buněčné migrace a invazivity jsou pak využívány techniky molekulární biologie, biochemie (zejména genomiky a proteomiky) i pokročilé zobrazovací techniky. Kombinace uvedených přístupů je vhodný nástroj při studiu komplexních patologických procesů, jako je právě tvorba metastáz. Tyto metody (obr. 1) umožňují nejen studovat migraci různých typů buněk, ale také analyzovat úlohu jednotlivých prometastatických genů a proteinů i jejich funkčních partnerů, uplatňují se při jejich funkční charakterizaci a validaci směrem k vývoji nových diagnostických a terapeutických přístupů. Cílem výzkumu je využít získané poznatky ke zvyšování efektivity diagnostiky, léčby a prevence nádorových onemocnění.
1. Schéma metod studia buněčné migrace a invazivity. Celkové schéma všech metod popisovaných v článku, doplněné o vystihující obrázky. 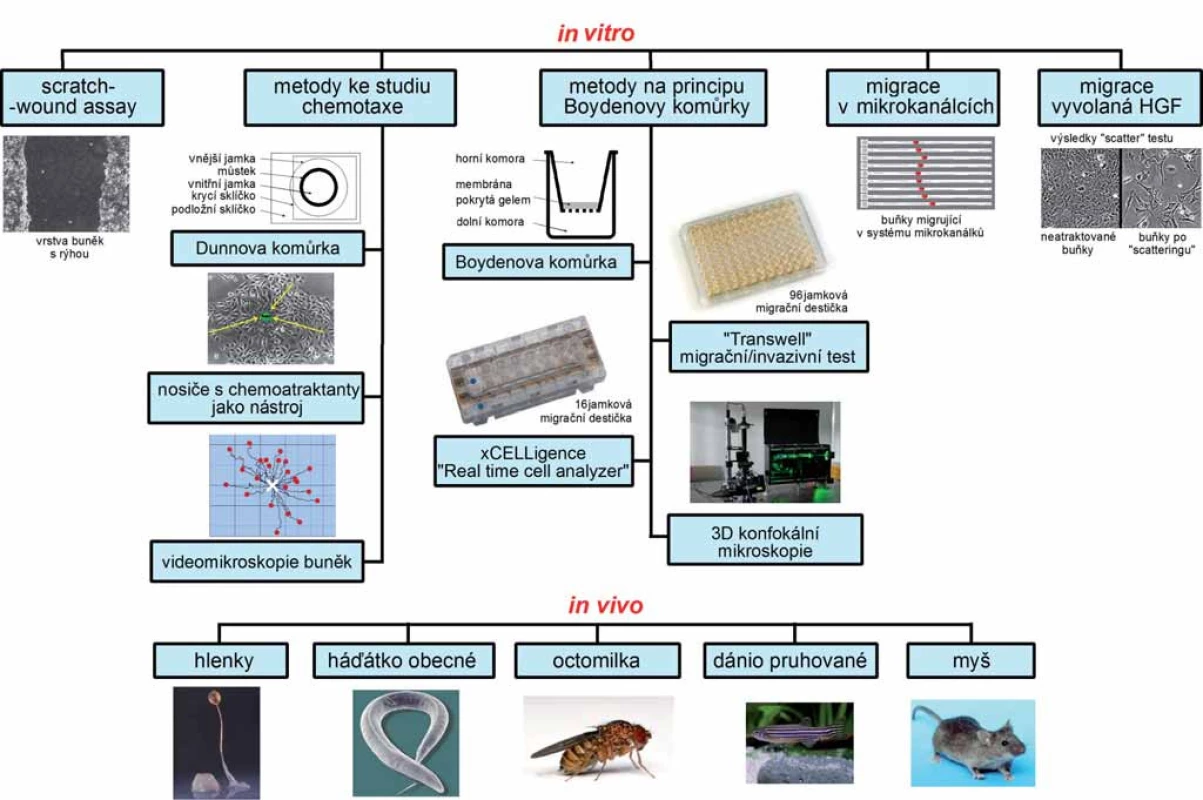
Jednoduché metody ke studiu buněčné migrace in vitro
Scratch ‑ wound assay
Scratch ‑ wound assay (zacelování rýhy) je běžně užívaná jednoduchá metoda pro měření základních parametrů buněčné migrace, jako jsou především rychlost migrace a polarita buněk [8]. Buňky jsou kultivovány v běžném kultivačním médiu, dokud nevytvoří souvislou vrstvu. Následně je do této vrstvy špičkou pipety o definované velikosti vytvořena rýha [9,10]. Buňky na okraji rýhy polarizují a začínají samovolně migrovat směrem ke středu rýhy ve snaze ji zacelit (obr. 2) [11]. Obvyklým způsobem monitorování pohybu buněk je intervalové snímání mikroskopem [8]. Motilitu je možno kvantifikovat pomocí času nezbytného pro kompletní zacelení rýhy, k čemuž lze využít softwarové hodnocení pokrytí snímané oblasti buňkami. Důležité je však vzít v úvahu příspěvek proliferace buněk na samotné zacelování během experimentu. K její inhibici je nezbytné přidání inhibitorů proliferace do média (běžně je používán např. mitomycin C). Metoda je vhodná ke studiu procesu hojení mechanických poranění. Ve vztahu k metastazování nádorových buněk lze tuto metodu např. využít k základnímu studiu prometastatických genů a proteinů i jejich vlivu na migrační schopnost buněk.
2. Scratch- wound assay – zacelování rýhy. Čtyři stadia průběhu experimentu prováděného na buňkách linie MCF- 7. A. Do monovrstvy buněk je špičkou pipety vytvořena rýha o předem definované velikosti. B. Stejné místo na misce focené po 24 hod. Buňky na okraji rýhy polarizují a migrují směrem k jejímu středu ve snaze ji zacelit. C. Stav po 72 hod. D. Stav po 120 hod. Rýha je zcela zacelena migrujícími buňkami. 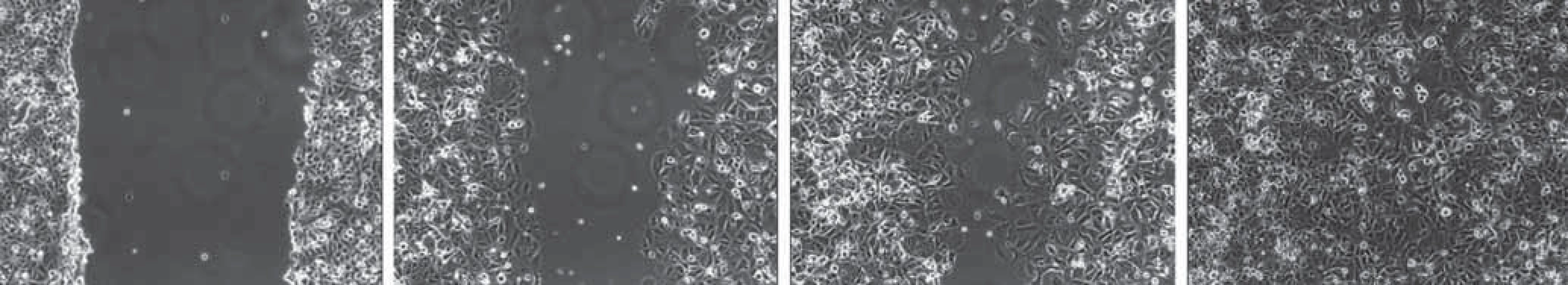
Scatter test
Metoda je založena na monitorování odpovědi určitých buněčných linií na stimulaci prostřednictvím hepatocytárního růstového faktoru (hepatocyte growth factor – HGF) [12,13]. Po ní dochází u těchto buněk k tzv. buněčnému scatteringu, tedy rozptýlení z buněčné kolonie, který je důsledkem reorganizace aktinového cytoskeletu, narušení mezibuněčných spojů a následné zvýšené schopnosti migrace. Jde o morfologickou změnu obdobnou procesu EMT. Průběh scatter testu je monitorován mikroskopem s intervalovým snímáním. Je hodnoceno procentuální zastoupení nesoudržných/ uvolněných buněk, u kterých došlo k buněčnému scatteringu, k celkovému počtu buněk. Tak lze testovat vliv exprese jednotlivých genů na změny migrace. Původně byla tato metoda vyvinuta pro buněčnou linii MDCK (buňky odvozené z normálních psích ledvin), později byla použita i pro linii lidských prostatických nádorových buněk DU145 ke studiu úlohy vybraných proteinů (Cdc42, p21 aktivovaných kináz, p210ctn) v procesu EMT [12].
In vitro metody ke studiu buněčné migrace na principu chemotaxe
Chemotaxe migrujících buněk má obrovský význam v mnoha biologických procesech včetně tvorby metastáz [14].
Dunnova komůrka
Jedná se o metodu, která umožňuje mikroskopické pozorování migrace buněk v reálném čase v odpovědi na přítomnost chemoatraktantu [15]. Využívá usměrněného pohybu buněk z vnější jamky Dunnovy komůrky po můstku vedoucím do vnitřní jamky s chemoatraktantem (obr. 1), přičemž tento pohyb po můstku je snímán mikroskopem a zaznamenáván v pravidelných intervalech. Metodika je užitečný nástroj ke studiu chemotaxe [16], jako jednoho z migračních mechanizmů buněk, způsobených gradientem difúzních signálních faktorů, které přispívají rovněž k metastatickým procesům.
Videomikroskopie buněk
Videomikroskopie umožňuje vizualizaci a kvantifikaci chemotaxe, a to zejména u adherentních savčích buněk, jako jsou buňky nádorové či endoteliální [17]. Tato metoda využívá videomikroskopický záznam pohybu buněk, na jehož základě se odvozuje trajektorie (obr. 1) každé jednotlivé buňky, která migruje v chemotaktickém gradientu obvykle po dobu 12 – 24 hod. Ten se vytváří díky soustavě kanálků a komůrek pod speciálním mikrosklíčkem (µ ‑ Slide Chemotaxis), pod nímž se pohybují buňky. Touto metodou lze vyhodnocovat např. vliv inhibitorů na chemotaxi. Inhibitory chemotaxe jsou přitom zvažovány jako terapeutika zamezující metastazování [17].
Nosiče s chemoatraktanty jako nástroj pro studium chemotaxe
Schopnost buněk reagovat na vnější podněty hraje významnou roli v řízení usměrněné migrace buněk, tedy při cílení buněčného pohybu vedoucímu k zakládání metastáz [18,19]. Pro studium migrace buněčných souborů i pro buněčné explantáty (živá tkáň pro tkáňovou kulturu) byla vytvořena metoda využívající nosičů s chemoatraktanty. Na malé misce pokryté proteiny reprezentující ECM (např. fibronektin) a zalité živným médiem jsou umístěny kulaté nosiče s chemoatraktivními molekulami, do jejichž blízkosti jsou následně vloženy buňky nebo buněčné explantáty. V okolí chemoatraktantu se ihned tvoří chemotaktický gradient, který může vyvolat migraci buněk (obr. 1). Ta je snímána mikroskopem v pravidelných intervalech. Metoda umožňuje nejen pozorovat populace stejných typů buněk, ale i srovnávat odlišné chemotaktické chování dvou nebo více buněčných typů zároveň.
In vitro metody ke studiu buněčné migrace a invazivity založené na principu Boydenovy komůrky
Boydenova komůrka
Metoda původně vyvinutá pro studium chemotaxe leukocytů se stala vhodným nástrojem pro pozorování motility a invazivity nádorových buněk [16]. Klasická Boydenova komůrka (obr. 3) sestává ze dvou prostorů oddělených membránou [20]. V horní části jsou buňky v živném médiu a v části spodní v médiu s obsahem chemoatraktantu. Membrána mezi nimi představuje fyzikální bariéru, kterou mohou buňky překonat pouze aktivním pohybem. Toto uspořádání se využívá ke studiu migračních vlastností buněk. Komora může být však modifikována pro studium invazivních vlastností nádorových buněk pokrytím mikroporézní membrány vrstvou, jejíž složení je blízké ECM. V tom případě hovoříme o trojrozměrném (3D) prostředí. Pro pokrytí membrány se využívají matrice jako kolagen nebo Matrigel®, kdy během procesu simulujícího buněčnou invazi dochází k interakci nádorových buněk s komponentami ECM a buněčné adhezi a proteolytické degradaci ECM substrátu. Další výhoda je, že v tomto 3D prostředí jsou buňky přirozeněji polární, a jejich chování je proto bližší podmínkám in vivo.
3. Boydenova komůrka. Schéma základní Boydenovy komůrky (vlevo) a komůrky s membránou pokrytou gelem z ECM (extracelulární matrix) pro studium invazivity buněk (vpravo). Buňky jsou nanášeny do horní komory a migrují skrz porézní membránu do dolní komory s chemoatraktantem. Je-li membrána pokryta vrstvou gelu, buňky mají ztížené podmínky a musí invadovat skrze něj. 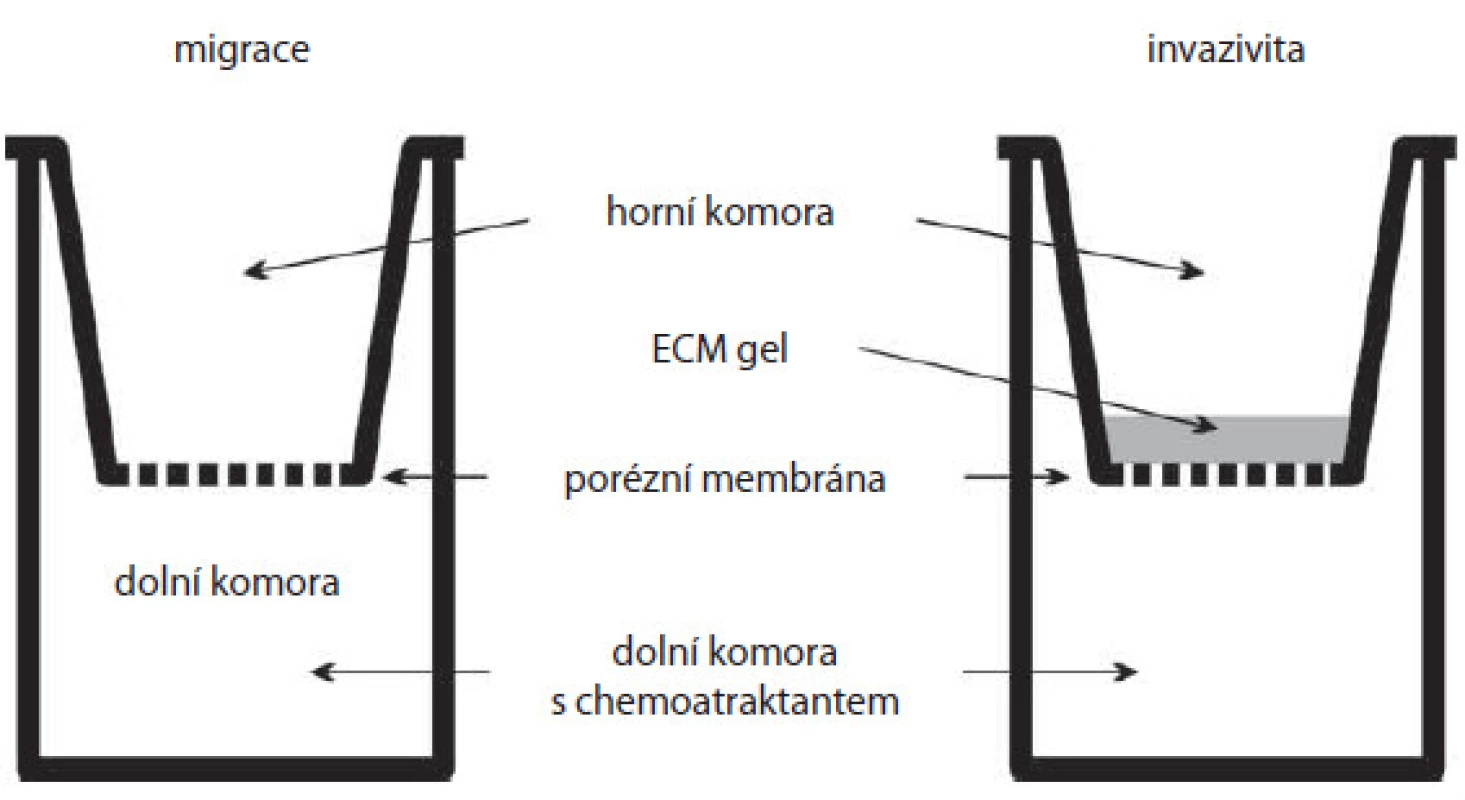
Transwell migrační/ invazivní test
Běžně užívané komerční kvantitativní in vitro testy migrace a invazivity jsou převážně založeny na originálním systému Boydenovy komůrky [21]. Transwell® Invasion Assay představuje komerční variantu založenou na jednorázových plastových vícejamkových destičkách s mikroporézní membránou (obr. 1) [22], do níž jsou buňky umístěny na jednu stranu membrány a chemoatraktanty na druhou. Po určitém čase průběhu experimentu jsou buňky vizualizovány fluorescenčním (nebo jiným) barvením a buněčná migrace hodnocena na základě podílu buněk, které prošly skrze membránu směrem k oblasti vyšší koncentrace chemoatraktantu. Experimentální sestava ke studiu buněčné invazivity může být vytvořena zablokováním pórů v membráně gelem o složení blízkém ECM (kolagen, Matrigel®), invazivita je tak podmíněna proteolytickou degradací ECM složek.
xCELLigence systém – analýza migrace a invazivity v reálném čase
xCELLigence systém (RTCA DP – Real ‑ time cell analyzer double plate, Roche/ Acea Biosciences) je nová technologie rovněž založená na principu Boydenovy komůrky, umožňující sledování buněčné migrace, invazivity, ale i proliferace, adheze buněk a vlivu chemotaxe a cytotoxicity na ně v reálném čase [23,24]. Na rozdíl od Transwell migračního testu jsou tedy buňky sledovány nepřetržitě (nikoliv pouze v jednom zvoleném časovém okamžiku) bez nutnosti fluorescenčního barvení při ukončení experimentu. Přístroj se skládá ze dvou základních částí: 1. RTCA DP analytické a 2. kontrolní jednotky. Do analytické jednotky se vkládají destičky s různým počtem jamek, v nichž probíhají jednotlivé experimenty.
K měření migrace a invazivity je využíváno destiček CIM ‑ plate 16 (cell invasion and migration, obr. 1). Každá jamka v destičce představuje migrační komůrku, která se skládá ze dvou částí oddělených mikroporézní polyetylentereftalátovou (PET) membránou, do jejíž spodní části jsou integrovány mikroelektronické senzory [25]. Horní komora obsahuje médium se sledovanými buňkami. K měření invazivity se podobně jako u Transwell assay přidává vrstva gelu o složení blízkém složení ECM (např. Matrigel®). Spodní komora obsahuje médium s chemoatraktantem [11,25]. Jak buňky během experimentu migrují z horní komory přes membránu směrem k chemoatraktantu, přicházejí do kontaktu s elektrickými senzory a jejich počet je přímo úměrný měřené impedanci (komplexní veličina popisující zdánlivý odpor součástky při průchodu střídavého elektrického proudu).
Ke zjišťování míry buněčné adheze a proliferace se využívá destiček E ‑ plate 16. Jamky v nich jsou jednoduché, bez rozdělení membránou na dvě komory. Dno jamky je pokryto elektrodami, které umožňují měření změny impedance v odpovědi na přisednutí buněk na dno jamky [11]. Nejdříve se změří signál kultivačního média bez přídavku buněk a následně jsou zaznamenávány změny impedance v důsledku zvýšené adheze či proliferace přidaných buněk [11,23,24].
Výstupem experimentu prováděného v systému xCELLigence je tzv. buněčný index (cell index – CI). Jde o bezrozměrnou veličinu, k jejímuž výpočtu se využívá vztahu: CI = (Zi – Z0)/ 15 W, kde Zi je impedance v daném okamžiku experimentu a Z0 pak impedance pozadí (média před přidáním buněk) [26]. Hodnoty CI pro různé paralelní experimenty jsou poté dávány do vztahu s konkrétní studovanou vlastností buněk.
In vitro studium migrace a invazivity pomocí trojrozměrné konfokální mikroskopie
Využití konfokálního mikroskopu umožňuje zaznamenávat pohyb buněk v prostoru a čase [27]. Pro studium buněčné migrace a invazivity se v tomto případě kombinuje Boydenova komůrka ve výše popsaném uspořádání se záznamem obrazu získaného konfokálním mikroskopem. Test je pak prováděn tak, že nejdříve sestavíme migrační experiment v Boydenově komůrce s membránou pokrytou 3D ECM gelem. Po nanesení studovaných nádorových buněk je gel vyříznut. Míra migrace, resp. invazivity je poté monitorována ve 3D projekci konfokálním mikroskopem a zaznamenávána v reálném čase. Lze přitom využít jak mikroskopie v procházejícím světle, tak fluorescenčního značení buněk, buněčných struktur a molekul.
Studium buněčné migrace v mikrokanálcích
Jedná se o univerzální, jednoduchou metodu studia buněčné migrace v mikrokanálcích o přesně definovaném tvaru [28,29]. Tento test je považován za 3D metodu studia buněčné migrace. Sestavy paralelních kanálků (obr. 1) se vyrábějí na míru pro konkrétní experimenty, materiálem jsou většinou transparentní silikonové pryže. Konstrukce kanálku určuje míru omezení pohybu buněk, což je dáno adhezivitou materiálu, lokálními zúženími a ohyby mikrokanálků. Buňky procházejí paralelními mikrokanálky, přičemž pomocí světelného mikroskopu jsou sledovány vzdálenosti, které buňky v paralelních experimentech urazí za daný čas. Tímto způsobem je možné srovnávat migraci různých buněčných linií, anebo izogenních buněčných linií exprimujících studované proteiny s potenciální promigrační úlohou. Obecně je tedy možno porovnávat a hodnotit různé parametry ovlivňující migraci v paralelních mikrokanálcích v závislosti na designu experimentu.
Metody studia metastazování in vivo
In vivo testování je nezbytnou součástí výzkumu v oblasti nádorové biologie, tj. zkoumání molekulární podstaty onemocnění, rozvoje diagnostických přístupů a vývoje efektivnější léčby včetně nových terapeutik. Savčí in vivo modely umožňují oproti výše popsaným in vitro experimentům lépe přiblížit experimentální podmínky komplexnímu stavu organizmu, tedy podmínkám, v nichž dochází k patologickým procesům, které není možno dostatečně v podmínkách in vitro simulovat. In vivo experimenty tudíž poskytují relativně věrohodnější výsledky, jsou však experimentálně a ekonomicky značně náročné. Vlastní vývoj geneticky modifikovaných modelových organizmů se tak sám o osobě stal nepostradatelným podpůrným odvětvím výzkumu, bez něhož by nebylo možno studovat fyziologické a patologické děje v tak komplexním systému, jako je živý organizmus. Ke studiu buněčné migrace a invazivity in vivo se využívá celá řada organizmů (obr. 1). Hlenky Dictyostelium discoideum zásadně přispěly porozumění chemotaxe a identifikaci jejích potenciálních regulátorů [30]. Háďátko obecné (Caenorhabditis elegans) díky svému průhlednému tělu a možnosti vizualizace buněk pomocí proteinu GFP (green fluorescence protein) umožňuje analýzu přirozených a patologických migratorních cest [31], stejně tak průsvitná embrya a kukly octomilky (Drosophila) dovolují pozorování migrace určitých typů buněk [32,33]. Fluorescenčně značené neutrofily ryby dánia pruhovaného (Danio rerio) pak byly využity např. pro studium buněčných procesů během zánětu [34,35].
Myš – nejpoužívanější in vivo model v nádorové biologii
Nejpoužívanější organizmus ke studiu mechanizmů vzniku nádorů, nádorového růstu a procesů metastatické kaskády in vivo je však myš domácí (Mus musculus) [36 – 38]. V laboratorní praxi se nejčastěji používají dva jednoduché experimentální testy pro vznik plicních a jaterních metastáz a dva spontánní testy pro prsní a prostatické karcinomy. Využívá se myších nádorových buněčných linií v syngenních imunokompetentních (schopných imunologické odpovědi na antigen) myších, nebo lidských nádorových štěpů implantovaných do imunodeprivovaných (neschopných imunologické odpovědi na antigen) myší. Při studiu molekulární podstaty metastazování jsou využívány třeba tyto modelové systémy: 1. buněčná linie prsního myšího karcinomu aplikovaná do prsní tkáně imunokompetentní myši, přičemž je hodnoceno vytváření metastáz (např. v játrech, lymfatických uzlinách a plicích) [39]; 2. buněčná linie lidského prsního karcinomu aplikovaná do prsní tkáně imunodeficientní myši, přičemž je hodnoceno vytváření metastáz [40]; 3. lidská buněčná linie karcinomu prostaty aplikovaná do prostaty imunodeficientní myši s následným hodnocením tvorby metastáz [41]. K makroskopickému hodnocení vzniku a rozvoje vzniklých metastáz se využívají různé metody in vivo zobrazování, např. magnetická rezonance, pozitronová emisní tomografie, počítačová tomografie, chemiluminiscenční a fluorescenční zobrazovaní i další.
Závěr
Ke studiu buněčné migrace a invazivity je využívána řada in vitro a in vivo metod. Tyto techniky jsou vhodný nástroj pro výzkum široké škály biologických procesů, a zejména pak pro studium molekulární podstaty rozvoje nádorových onemocnění. Lze tedy očekávat, že aplikace a další rozvoj těchto technik přinese nové významné poznatky vedoucí k novým terapeutickým a diagnostickým přístupům zlepšujícím léčbu nádorových onemocnění.
Práce byla podpořena projektem Grantové agentury České republiky č. 14-19250S, Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Pavel Bouchal, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: bouchal@mou.cz
Obdrženo: 27. 1. 2014
Přijato: 31. 3. 2014
Sources
1. Vincente ‑ Manzanares M, Horwitz AR. Cell migration: an overview. Methods Mol Biol 2011; 769 : 1−24. doi: 10.1007/ 978-1-61779 - 207 - 6_1.
2. Valastyan S, Weinberg RA. Tumor metastasis: molecular insights and evolving paradigms. Cell 2011; 147(2): 275 – 292. doi: 10.1016/ j.cell.2011.09.024.
3. Patel LR, Camacho DF, Shiozawa Y et al. Mechanisms of cancer cell metastasis to the bone: a multistep process. Future Oncol 2011; 7(11): 1285 – 1297. doi: 10.2217/ fon.11.112.
4. Penet MF, Chen Z, Bhujwalla ZM. MRI of metastasis permissive microenvironments. Future Oncol 2011; 7(11): 1269 – 1284. doi: 10.2217/ fon.11.114.
5. Maryáš J, Faktor J, Dvořáková M et al. Proteomics in investigation of cancer metastasis: Functional and clinical consequences and methodological challenges. Proteomics 2014; 14(4−5): 426−440. doi: 10.1002/ pmic.201300264.
6. Faktor J, Dvorakova M, Maryas J et al. Identification and characterization of pro‑metastatic targets, pathways and molecular complexes using a toolbox of proteomic technology. Klin Onkol 2012; 25 (Suppl 2): 2S70−2S77.
7. Hughes CS, Postovit LM, Lajoie GA. Matrigel: a complex protein mixture required for optimal growth of cell culture. Proteomics 2010; 10(9): 1886−1890. doi: 10.1002/ pmic.200900758.
8. Cory G. Scratch ‑ wound assay. Methods Mol Biol 2011; 769 : 25−30. doi: 10.1007/ 978-1 - 61779 - 207 - 6_2.
9. Magdalena J, Millard TH, Etienne ‑ Manneville S et al. Involvement of the Arp2/ 3 Complex and Scar2 in Golgi Polarity in scratch wound models. Mol Biol Cell 2003; 14(2): 670−684.
10. Eccles SA, Box C, Court W. Cell migration/ invasion assays and their application in cancer drug discovery. Biotechnol Annu Rev 2005; 11 : 391 – 421.
11. Knopfová L. Funkce proteinu c ‑ Myb ve vybraných aspektech kancerogeneze. Informační listy GSGM 2013; 41 : 37−50.
12. Fram TS, Wells CM, Jones GE. HGF‑induced DU145 cell scatter assay. Methods Mol Biol 2011; 769 : 31−40. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_3.
13. Thiery JP. Epithelial ‑ mesenchymal transitions in tumour progression. Nat Rev Cancer 2002; 2(6): 442−454.
14. Cooper CR, Pienta KJ. Cell adhesion and chemotaxis in prostate cancer metastasis to bone: a minireview. Prostate Cancer Prostatic Dis 2000; 3(1): 6−12.
15. Zicha D, Dunn GA, Brown AS. A new direct ‑ viewing chemotaxis chamber. J Cell Sci 1991; 9(Pt 4): 769−775.
16. Kassis J, Lauffenburger DA, Turner T et al. Tumor invasion as dysregulated cell motility. Semin Cancer Biol 2001; 11(2): 105−117.
17. Zantl R, Horn E. Chemotaxis of slow migrating mammalian cells analysed by video microscopy. Methods Mol Biol 2011; 769 : 191−203. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_13.
18. Le Y, Zhou Y, Iribarren P et al. Chemokines and chemokine receptors: their manifold roles in homeostasis and disease. Cell Mol Immunol 2004; 1(2): 95−104.
19. Theveneau E, Mayor R. Beads on the run: beads as alternative tools for chemotaxis assays. Methods Mol Biol 2011; 769 : 449−460. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_30.
20. Falasca M, Raimondi C, Maffucci T. Boyden chamber. Methods Mol Biol 2011; 769 : 87−95. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_7.
21. Boyden S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leukocytes. J Exp Med 1962; 115 : 453−466.
22. Marshall J. Transwell® invasion assays. Methods Mol Biol 2011; 769 : 97−110. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_8.
23. Limame R, Wouters A, Pauwels B et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real ‑ time technology and classic endpoint assays. PLoS One 2012; 7(10): e46536. doi: 10.1371/ journal.pone.0046536.
24. Aceabio.com [homepage on the Internet]. CA: Acea Biosciences, Inc.; c2014 [cited 2014 January 25]. Available from: http:/ / www.aceabio.com/ product_info.aspx?id=184.
25. Bird C, Kirstein S. Real ‑ time, label‑free monitoring of cellular invasion and migration with the xCELLigence system. Nature Methods 2009; 6: v ‑ vi.
26. RTCA DP Instrument Operator’s Manual. Germany: Roche Diagnostics 2009.
27. Cain RJ, Borda d’Água B, Ridley AJ. Quantification of transendothelial migration using three ‑ dimensional confocal microscopy. Methods Mol Biol 2011; 769 : 167−190. doi: 10.1007/ 978 - 1 - 61779 - 207-6_12.
28. Friedl P, Wolf K. Plasticity of cell migration: a multiscale tunning model. J Cell Biol 2010; 188(1): 11−19.
29. Heuzé ML, Collin O, Terriac E et al. Cell migration in confinement: a micro‑channel‑based assay. Methods Mol Biol 2011; 769 : 415−434. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_28.
30. Artemenko Y, Swaney KF, Devreotes PN. Assessment of development and chemotaxis in Dictyostelium discodeum mutants. Methods Mol Biol 2011; 769 : 287−309. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_20.
31. Wong M, Martynovsky M, Schwarzbauer JE. Analysis of cell migration using Ceanorhabditis elegans as a model system. Methods Mol Biol 2011; 769 : 233−248. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_16.
32. Stramer B, Wood W. Inflammation and wound healing in Drosophila. Methods Mol Biol 2009; 571 : 137−149. doi: 10.1007/ 978 - 1 - 60761 - 198 - 1_9.
33. Xu T, Rubin TM. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development 1993; 117(4): 1223−1237.
34. Lieschke GJ, Currie PD. Animal models of human disease: zebrafish swim into view. Nat Rev Genet 2007; 8(5): 353−367.
35. Elks PM, Loynes CA, Renshaw SA. Measuring inflammatory cell migration in the zebrafis. Methods Mol Biol 2011; 769 : 261−275. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_18.
36. Box GM, Eccles SA. Simple experimental and spontaneous metastatic assays in mice. Methods Mol Biol 2011; 769 : 311−329. doi: 10.1007/ 978 - 1 - 61779-207 - 6_21.
37. Lu J, Steeg PS, Price JE et al. Breast cancer metastasis: challenges an opportunities. Cancer Res 2009; 69(12): 4951−4953. doi: 10.1158/ 0008 - 5472.CAN ‑ 09 - 0099.
38. Talmadge JE. Models of metastasis in drug discovery. Methods Mol Biol 2010; 602 : 215−233. doi: 10.1007/ 978 - 1 - 60761 - 058 - 8_13.
39. Aslakson CJ, Miller FR. Selective events in the metastatic proces defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Res 1992; 52(6): 1399−1405.
40. Price JE, Polyzos A, Zhang RD et al. Tumorigenicity and metastasis of human breast carcinoma cell lines in nude mice. Cancer Res 1990; 50(3): 717−721.
41. Havens AM, Pedersen EA, Shiozawa Y et al. An in vivo mouse model for human prostate cancer metastasis. Neoplasia 2008; 10(4): 371−380.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue Supplementum-
All articles in this issue
- Programmed Cell Death in Cancer Cells
- The Use of Flow Cytometry for Analysis of the Mitochondrial Cell Death
- Methods for Studying Tumor Cell Migration and Invasiveness
- Techniques to Study Transendothelial Migration In Vitro
- Mechanisms of Drug Resistance and Cancer Stem Cells
- Functional Assays for Detection of Cancer Stem Cells
- Tumor Microenvironment – Possibilities of the Research Under In Vitro Conditions
- Electrochemical Analysis of Nucleic Acids, Proteins and Polysaccharides in Biomedicine
- Next Generation Sequencing – Application in Clinical Practice
- Development of PCR Methods and Their Applications in Oncological Research and Practice
- Methods for Analysis of Protein‑protein and Protein‑ligand Interactions
- Analysis of Protein Using Mass Spectrometry
- p‑ SRM, SWATH and HRM – Targeted Proteomics Approaches on TripleTOF 5600+ Mass Spectrometer and Their Applications in Oncology Research
- Ananlysis of Phosphoproteins and Signalling Pathwaysby Quantitative Proteomics
- New Trends in the Study of Protein Glycosylation in Oncological Diseases
- Current Trends in Using PET Radiopharmaceuticals for Diagnostics in Oncology
- „Technetium Crisis“ – Causes, Possible Solutions and Consequences for Planar Scintigraphy and SPECT Diagnostics
- Vitamin D as an Important Steroid Hormone in Breast Cancer
- Detection of Protein‑protein Interactions by FRET and BRET Methods
- In Situ Proximity Ligation Assay for Detection of Proteins, Their Interactions and Modifications
- Protein Expression and Purification
- Quantitative Mass Spectrometry and Its Utilization in Oncology
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Protein Expression and Purification
- Methods for Studying Tumor Cell Migration and Invasiveness
- Next Generation Sequencing – Application in Clinical Practice
- Analysis of Protein Using Mass Spectrometry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

