-
Medical journals
- Career
Prevence náhlé srdeční smrti u pacientů do 40 let věku
Authors: J. Plášek
Authors‘ workplace: Kardiovaskulární oddělení, FN Ostrava Lékařská fakulta OU, Ostrava
Published in: Kardiol Rev Int Med 2018, 20(2): 96-103
Overview
Náhlá srdeční smrt (NSS) odpovídá za 50 % kardiovaskulární mortality a v Evropě umírá na NSS přibližně 2 500 osob denně. V neselektované populaci je velmi obtížné predikovat riziko NSS, v selektovaných skupinách onemocnění již je riziková stratifikace možná. U mladých pacientů do 40 let přicházejí v úvahu jako rizika NSS především tato onemocnění: hypertrofická kardiomyopatie, arytmogenní kardiomyopatie a syndrom dlouhého QT. Kolem 30 % NSS zůstává neobjasněných. Specifickou subpopulací jsou v této věkové skupině aktivní sportovci/atleti, kde je k odhadu rizika velmi užitečné „Seattle skóre“ hodnotící EKG abnormity. Velkým rizikem, které ohrožuje i mladé pacienty, je léky indukované prodloužení QT intervalu. Je nutné znát nejrizikovější skupiny léků z řad psychofarmak, azolových antimykotik, makrolidových antibiotik a QT interval správně měřit. Screening na rizikové faktory NSS je možný jen u subpopulací, jako jsou sportovci nebo rizikové profese. U pacientů ve vyšším riziku NSS máme k dispozici farmakologické a nefarmakologické postupy prevence dle úrovní rizika. Nejsilněji redukují riziko NSS betablokátory, z nefarmakologických postupů pak implantace transvenózního, subkutánního kardioverter-defibrilátoru, u vybraných pacientů/chorob katetrizační ablace.
Klíčová slova:
náhlá srdeční smrt – hypertrofická kardiomyopatie – arytmogenní kardiomyopatie – syndrom dlouhého QT – subkutánní implantabilní kardioverter-defibrilátorÚvod
Náhlou srdeční smrt (NSS) definujeme jako náhlé neočekávané úmrtí ze srdeční příčiny do ≤ 1 hod od začátku symptomů. Způsob tohoto úmrtí je hodnocen jako neočekávaný v neočekávané chvíli u osoby se známým onemocněním srdce nebo bez něj [1]. NSS odpovídá za 50 % kardiovaskulární (KV) mortality (450 000 úmrtí/ rok v USA [2], 70 000 úmrtí/ rok ve Velké Británii [3]), počet náhlých srdečních úmrtí převyšuje součet úmrtí na karcinom plic, prsu, AIDS a cévní mozkové příhody (CMP) dohromady.
Ve věkové skupině do 40 let je incidence NSS méně častá, ale nastane-li, má devastující dopad na rodinu zemřelého i komunitu. Populační studie u obyvatel amerického státu Minnesota ve věku 20 – 40 let prokázala incidenci NSS 6,2 na 100 000 obyvatel/ rok [4]. Retrospektivní demografická a autoptická studie více než 6 milionů sledovaných amerických vojáků ve věku 18 – 35 let prokázala incidenci NSS 13 na 100 000 osoboroků [5]. Na druhé straně studie u atletů jak z Itálie [6], tak z USA vykazovaly nepoměrně nižší incidenci NSS: 2,1, resp. 0,5 na 100 000 osoboroků (tab. 1) [7]. Při zkoumání incidence vycházíme vždy z retrospektivních analýz nebo prospektivních screeningů zaměřených na předdefinované kohorty, protože riziko NSS v obecné populaci se odhaduje velmi špatně. Bohužel právě v obecné populaci je největší absolutní počet NSS, na rozdíl od pacientů s jasně definovanými KV riziky (dysfunkce levé komory, stav po infarktu myokardu apod.), kde je sice vysoká incidence, ale vztaženo k obecné neselektované populaci nízký absolutní počet případů. Tomuto fenoménu říkáme Myerburgův paradox (graf 1).
Table 1. Souhrn studií zkoumajících incidenci náhlé srdeční smrti na předdefinovaných kohortách nebo populacích/n odpovídá počtu mrtvých, počet celé populace v tabulce není uveden. Upraveno dle [4,5,28,29]. ![Souhrn studií zkoumajících incidenci náhlé srdeční smrti na předdefinovaných kohortách nebo populacích/n odpovídá počtu mrtvých, počet celé populace v tabulce není uveden. Upraveno dle [4,5,28,29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ed489d26c176112533c7a31f1252f562.jpeg)
Graph 1. Incidence náhlé srdeční smrti vztažené na různé populační skupiny, data ze Spojených států amerických. Převzato z [46]. ![Incidence náhlé srdeční smrti vztažené na různé populační skupiny, data ze Spojených států amerických. Převzato z [46].](https://pl-master.mdcdn.cz/media/image/9620e867c334c201ee79cff02be8c170.jpeg?version=1533280450)
ICHS – ischemická choroba srdeční, EF LK – ejekční frakce levé komory, KPCR – kardiopulmonální resuscitace, IM – infarkt myokardu Celá řada onemocnění, přechodných vlivů a rizikových faktorů může vést k NSS, nejčastější etiologií jsou akutní i chronické formy ischemické choroby srdeční (ICHS), které odpovídají až za 80 % NSS [8]. Příčiny NSS můžeme racionálně rozdělit do několika celků, NSS s prokázaným KV onemocněním (KVO), NSS u specifických skupin (atleti), NSS vlivem podané medikace. Přes veškerou snahu zůstává kolem 20 – 30 % NSS neobjasněných (tab. 1).
Náhlá srdeční smrt s prokázaným KVO
Následující KVO mohou být příčinou NSS:
- strukturální srdeční onemocnění – ze získaných nejčastěji ICHS, resp. přímo ischemická kardiomyopatie, kongenitální strukturální srdeční onemocnění a heterogenní skupina neischemických kardiomyopatií;
- hereditární arytmické syndromy – syndrom dlouhého QT – LQTS, syndrom krátkého QT, Brugada syndrom (BrS), katecholaminergní polymorfní komorová tachykardie;
- myokarditidy a zánětlivé kardiomyopatie;
- abnormality koronárního řečiště.
Problémem je většinou především presymptomatické, resp. oligosymptomatické období onemocnění a otázka, u kterých populačních skupin dělat screening a jaký.
Vrozené a získané kardiomyopatie
Mezi vrozené kardiomyopatie s vysokým rizikem NSS náleží: hypertrofická kardiomyopatie (HKMP), nonkompaktní kardiomyopatie, arytmogenní kardiomyopatie, dilatační kardiomyopatie (2/ 3 zánětlivé kardiomyopatie s průkazem virového genomu z endomyokardiální biopsie) a sarkoidóza. Jakmile jsou tato onemocnění již diagnostikována, mají poměrně jasnou rizikovou stratifikaci primární prevence NSS. O varovných symptomech onemocnění bude ještě řeč dále. V případě hypertrofické kardiomyopatie se jedná o specifický skórovací systém (tab. 2) použitelný výhradně pro toto onemocnění, konkrétně počítá 5leté riziko NSS [9]. Tento skórovací systém by neměl být užíván pro:
- děti pod 16 let věku;
- kompetitivní atlety;
- pacienty se střádavým onemocněním (M. Fabry, Noonan syndrom);
- pacienty s anamnézou odvrácené NSS a/ nebo setrvalou komorovou tachykardií, kteří již jsou kandidáti ICD ze sekundární prevence [9,10].
Table 2. Stratifikace rizika NSS u HKMP. Převzato z [9,10]. ![Stratifikace rizika NSS u HKMP. Převzato z [9,10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ca20bbae40a5353b3034b23dfc30cb06.jpeg)
NSS – náhlá srdeční smrt, KMP – kardiomyopatie, LK – levá komora V případě takto vypočteného 5letého rizika NSS ≥ 6 % a zároveň pravděpodobnosti přežití nad 1 rok by měla být zvážena implantace kardioverter-defibrilátoru (ICD) [10]. U pacientů s nonkompaktní a dilatovanou kardiomyopatií postupujeme v primární prevenci NSS jako u neischemických kardiomyopatií, tj. pacienti se srdečním selháním ve funkční třídě NYHA II – III, EF LK ≤ 35 % na min. 3měsíční optimální medikamentózní léčbě [11]. Arytmogenní kardiomyopatie (ARVC) je vrozené desmozomální onemocnění související s poškozením interkalárních disků. Diagnóza spočívá ve splnění kombinace:
- a) morfologických kritérií (globální/ regionální akineze, dysfunkce pravé komory dle echokardiografie či magnetické rezonance);
- b) abnormalit depolarizace/ kondukce (epsilon vlna – nízkoamplitudový signál od konce QRS komplexu do začátku T vlny, terminální aktivace QRS nad 55 ms, pozdní potenciály);
- c) arytmie – setrvalé nebo nesetrvalé komorové tachykardie s tvarem blokády levého Tawarova raménka a inferiorní osou;
- d) rodinná anamnéza ARVC [12,13].
Poměrně typickým EKG projevem ARVC je inkompletní blokáda pravého Tawarova raménka s negativními vlnami T v prekordiálních svodech. Diagnostika onemocnění může být svízelná, pokud ještě nejsou patrné morfologické/ funkční změny ani na magnetické rezonanci, přesto tito pacienti mohou mít komorové arytmie a být již ve zvýšeném riziku NSS. V této fázi může být užitečné genetické testování asociovaných genů pro desmozomální proteiny (aktuálně 13), genetické testování ale nehraje zásadní roli v rizikové stratifikaci NSS u ARVC [13]. Riziková stratifikace je založena na klinických a paraklinických nálezech: přítomnost (ne)setrvalých komorových arytmií, synkopa, dysfunkce pravé komory. Dle rozsahu a charakteru splněných kritérií stratifikujeme riziko jako vysoké, intermediární a nízké. U pacientů s vysokým a intermediárním rizikem je racionální implantovat ICD, protože ARVC nese primárně riziko arytmické NSS, až později riziko selhání pravé komory.
Hereditární arytmické syndromy
K hereditárním arytmickým syndromům nesoucím zvýšené riziko náleží LQTS, syndrom krátkého QT, BrS a katecholaminergní polymorfní komorová tachykardie. V případě LQTS se jedná buď o vrozený, nebo získaný stav prodloužení QT intervalu na povrchovém EKG vedoucí ke zvýšenému riziku NSS v důsledku komorových arytmií typu torsade de pointes. Za 65 % geneticky determinovaných LQTS odpovídají 3 geny: 2 kódují jednotky draslíkového kanálu Iks a Ikr (KCNQ1, KCNH2), třetí natriový kanál Nav1.5(SCN5A) [15]. Mutace v 13 identifikovaných genech vedou ke kanalopatiím ovlivňujícím myokardiální repolarizaci, event. disperzi repolarizace. Nejčastější vrozené formy LQTS mají specifické EKG projevy a spouštěcí mechanizmy (tab. 3). Genetické testování na uvedené kandidátní geny je doporučováno v případě QTc nad 500 ms a u členů rodiny pacienta s prokázanou kauzální mutací LQTS [16]. Bohužel jsou popsány i případy, kdy má pacient potvrzenou kauzální genovou mutaci pro LQTS, ale má normální QTc interval. Kumulativní pravděpodobnost NSS je u těchto jedinců o něco menší než u jedinců s korigovaným prodlouženým QT intervalem (4 vs. 15 %) [17]. Diagnostická kritéria pro LQTS jsou založena na rodinné anamnéze a EKG nálezu (tab. 4) [18]. Základními specifickými opatřeními jsou: u LQTS1 zákaz namáhavější/ kompetitivní sportovní aktivity (obzvláště plavání a vodní sporty), vyvarovat se náhlým hlasitým zvukům (zvonění budíku) u LQTS2 a všem lékům prodlužujícím QT interval, což platí univerzálně pro všechny LQTS. Z léků jsou velmi efektivní betablokátory v případě LQTS1, méně již u LQTS2 a LQTS3 [19]. U vysoce rizikových pacientů je s výhodou levostranná denervace srdečního sympatiku (left cardiac sympathetic denervation – LCSD); největší studie (n = 147 pacientů) u extrémně rizikových pacientů (QTc 543±65 ms) prokázala 91% redukci srdečních příhod [20]. Doporučené postupy HRS/ EHRA/ APHRS z roku 2013 nedoporučují implantaci ICD u asymptomatických pacientů s LQTS, u kterých nebyl vyzkoušen betablokátor krom zvláštních případů:
- QTc > 550 ms krom LQTS1;
- ženy s LQTS2 a QTc > 500 ms;
- Jervell Lange-Nielsen syndrom;
- rozsáhlá rodinná anamnéza LQTS [21].
Table 4. Schwartzova kritéria pro diagnózu syndromu dlouhého QT. 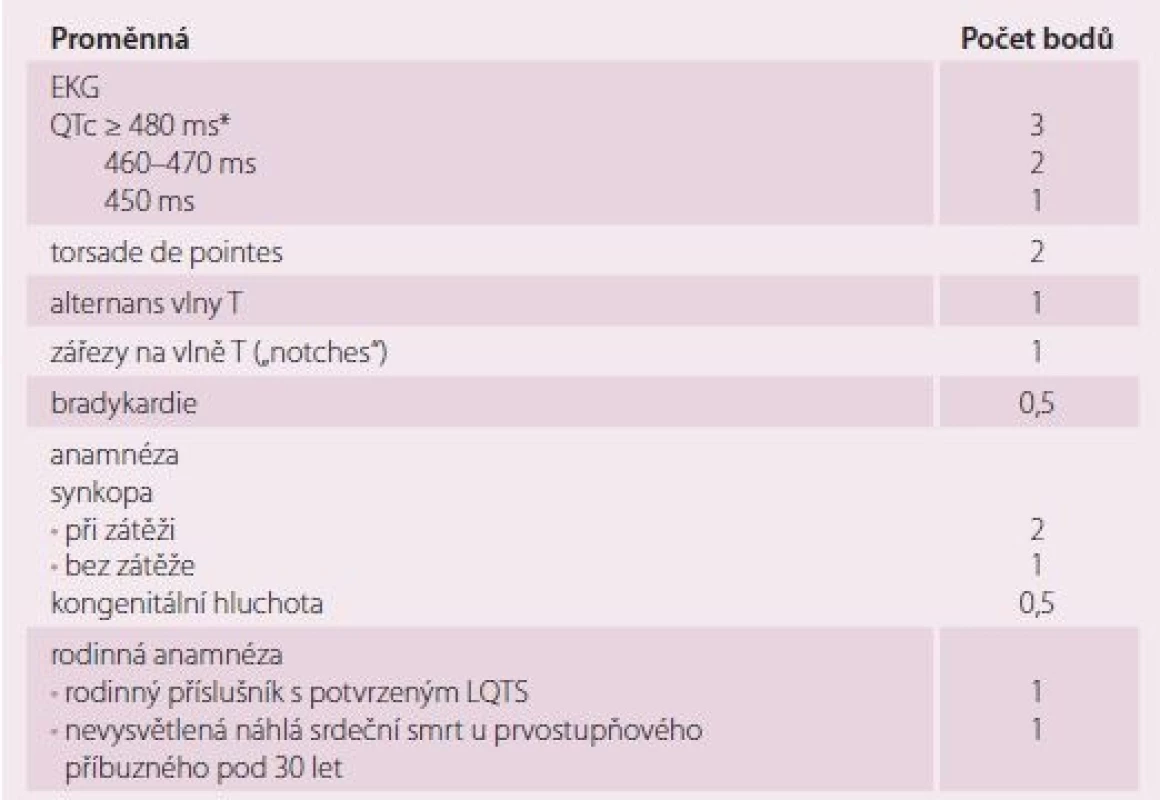
< 1 – nízkápravděpodobnost; 2–3 – střední pravděpodobnost; ≥ 4 – vysoká pravděpodobnost LQTS (syndrom dlouhého QT)
*QTc dle Bazzetova vzorce (QTc = QT/RR interval)Brugada syndrom je vzácné vrozené onemocnění původně popsané jako autozomálně dominantní primárně elektrická porucha bez strukturálního srdečního onemocnění projevující se ST elevacemi, negativními T v prekordiálních svodech; postupně byly popsány tři typy dle povrchového EKG (obr. 1). Onemocnění se vyznačuje zvýšeným rizikem NSS na fibrilaci komor, obzvláště při teplotách nebo ve spánku [22]. EKG obraz se u jednotlivého pacienta může měnit, demaskovat typický EKG projev (typ I) lze pomocí ajmalinového testu, který ale není zcela bez rizika indukce maligní arytmie. Později byly u BrS popsány i strukturální změny, hlavně pravé komory. Tímto se otevřela diskuze o patofyziologii, rizikové stratifikaci, typu možné léčby, ale i úloze nejčastěji zmiňované „kauzální“ mutace (je známo již přes 100 mutací) genu SCN5A, který kóduje α-podjednotku natriového kanálu [23]. Genetické testování je doporučeno u rodinných příslušníků pacienta s prokázanou kauzální mutací v genu SCN5A [16]. Léčebné možnosti BrS tkví v implantaci ICD – ze sekundární prevence u pacientů, kteří prodělali fibrilaci komor; z primární prevence u pacientů se spontánním BrS typem 1 na povrchovém EKG a synkopou. Z léků se používá chinidin, a to i v případě elektrické bouře [22]. Jako viabilní léčebná varianta u vybraných nemocných se prosazuje katetrizační ablace – modifikace epikardiálního substrátu ve výtokovém traktu pravé komory [24,25]. Jsou-li pacienti s LQTS nebo BrS indikování k ICD, můžeme s výhodou využít podkožní variantu, tzv. subkutánní ICD (S-ICD), jelikož tito pacienti většinou nemají bradykardickou indikaci (rozuměj, nepotřebují stimulační funkce) ani indikaci k srdeční resynchronizační léčbě. S-ICD je výhodné hned z několika důvodů:
- je-li infekční komplikace, nemá riziko infekční endokarditidy jako transvenózní systém;
- nemůže dojít k tzv. sublavian „crush“ syndrom – což je mechanické porušení integrity elektrody v podklíčkové oblasti;
- není závislost na průchodnosti centrálního žilního systému a anulujeme také případné trombózy či žilní uzávěry;
- pacient nemůže mít periprocedurální komplikace jako pneumothorax, dislokace elektrody (pokud dojde k dislokaci, nemá tak závažné konsekvence) nebo v nejhorším případě hemoperikard při perforaci pravé komory [26].
Image 1. EKG projevy Brugada syndromu, jediný „diagnostický“ je typ 1, tj. ST elevace ≥ 2 mm následovaná negativní vlnou bez izoelektrické nebo s minimální izoelektrickou linií, zvaný také „Coved type“; další dva typy nazýváme „Saddle back“ – typ 2 má mít výše J bod než T vlnu, typ 3 naopak. Upraveno dle [21,22]. ![EKG projevy Brugada syndromu, jediný „diagnostický“ je typ 1, tj. ST elevace ≥ 2 mm následovaná negativní vlnou bez izoelektrické nebo s minimální izoelektrickou linií, zvaný také „Coved type“; další dva typy nazýváme „Saddle back“ – typ 2 má mít výše J bod než T vlnu, typ 3 naopak. Upraveno dle [21,22].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/7fad8bd4a22cce4d2f6238ef02ff5fdf.jpeg)
Katecholaminergní polymorfní komorová tachykardie je vzácné arytmogenní onemocnění, které se projevuje adrenergně indukovanou bidirekční nebo polymorfní komorovou tachykardií při nepřítomnosti strukturálního srdečního onemocnění. Mortalita do 30 let je až 31 %, pokud je pacient zcela bez léčby, čím dřív se onemocnění projeví synkopou, tím horší je prognóza. Kauzální spojení s mutací genu pro ryanodinový receptor (RYR2) nebo srdeční calsequestrin (CASQ2) je nalezeno jen u 50 – 60 % probandů, zřejmě se na tomto maligním onemocnění budou podílet ještě jiné geny [27]. Na klidovém EKG většinou nejsou zásadní změny, při zátěži nebo infuzi izoproterenolu se objevuje komorová ektopie tvaru blokády pravého Tawarova raménka s alternující deviací osy. Ve farmakoterapii se uplatňují zejména betablokátory a flecainid, implantace ICD je indikována v případě setrvalé komorové tachykardie a/ nebo synkopy na medikaci betablokátorem [21]. Mimo hereditární syndromy pak stojí idiopatická fibrilace komor, jejíž nositelé mají výrazně zvýšené riziko NSS. Tato arytmie je většinou spouštěna komorovými extrasystolami vycházejícími z Purkyňových vláken [24], katetrizační ablace výrazně snižuje riziko rekurencí, ačkoli většina pacientů z kardiocenter odchází s implantovaným ICD.
Náhlá srdeční smrt atletů
Úmrtí atletů většinou přitahují velkou mediální pozornost, jelikož se jednak často jedná o globální celebrity, jednak jsou to mladí lidé, kteří v očích veřejnosti nemají umírat. Incidence NSS je u atletů velmi variabilní v závislosti na studované populaci od 1 : 3 000 do 1 : 917 000 [28].
Etiologie NSS je u atletů nejčastěji neobjasněná, a to až ve 30 % případů; v tom se shodují jak data z Anglie a Walesu [29], tak z Národní asociace univerzitních atletů v USA (NCAA – National Collegiate Athletic Assciation) [30].V kontradikci jsou pak:
- italské registry z oblasti Benátek [6], které vykazují u atletů do 2 % neobjasněných NSS;
- celoamerické registry neatletů [31], kde autopticky neobjasněnou NSS nalezneme jen u 10 %;
- pouhé 3 % v registru amerických kompetitivních atletů [32].
Z hereditárních kardiomyopatií jsou nejčastější příčinou NSS atletů hypertrofická a arytmogenní kardiomyopatie, ačkoli jejich distribuce se v různých souborech odlišuje (graf 2) [6,28 – 32]. Není také zcela jasné, je-li profesionální sportovní aktivita modifikovatelný faktor NSS. Adrenergní stimulace se jeví jako logický rizikový faktor u HKMP, ARVC, LQTS a anomálních odstupů koronárních tepen, případně myokardiálních můstků [28]. Preparticipační screening zacílený na tato onemocnění by měl potenciál redukovat riziko NSS u atletů. Navíc úmrtí u pacientů s ARVC nastávala u atletické populace v dřívějším věku než u neatletů [6], což odpovídá urychlení progrese choroby při fyzické zátěži, tj. objemově-tlakovém přetěžování pravé i levé komory. Mezi nejrizikovější sporty v sestupném pořadí náleží fotbal, basketbal a plavání [6].
Graph 2. Etiologie náhlé srdeční smrti u atletů ve srovnání s neatlety. Upraveno dle [28–32]. ![Etiologie náhlé srdeční smrti u atletů ve srovnání s neatlety. Upraveno dle [28–32].](https://pl-master.mdcdn.cz/media/image/83672f395466c9c4f8311b053f85932b.jpeg?version=1533280461)
AMT – aneuryzma mozkové tepny, ARVC – arytmogenní kardiomyopatie, EAP – akutní embolizace do plicnice, LQTS – syndrom dlouhého QT, HKMP – hypertrofi cká kardiomyopatie, DKMP – dilatační kardiomyopatie, ICMP – ischemická cévní mozková příhoda, ICHS – ischemická choroba srdeční, LK – levá komora, WPW – Wolff -Parkonson-White syndrom Identifikace rizikových faktorů i patologických paraklinických nálezů je komplikovaná, protože mnoho atletů má EKG nálezy, které by v obecné populaci byly hodnoceny jako patologické. Existuje konsenzus autorů nazývající se „Seattle kritéria“, který vymezuje fyziologické a abnormální EKG nálezy u atletů [33].
Náhlá srdeční smrt a farmakoterapie
Principiálně můžeme léky rozdělit dichotomicky na ty, které mají potenciál NSS preventovat, a ty, které ji mohou „způsobit“ nebo spíše facilitovat. Psychofarmaka patří k nejčastěji zmiňované lékové skupině v kontextu zvýšeného rizika NSS. Z velkých populačních studií vyplývá, že riziko NSS je u pacientů užívajících psychofarmaka oproti neselektované populaci 2 – 3× vyšší. Souvisí to se schopností některých antipsychotik (pipamperon, haloperidol), ale i antidepresiv (jak skupina tricyklických/ tetracyklických antidepresiv, tak selektivní blokátory zpětného vstřebávání serotoninu – mezi nimi i oblíbený citalopram) prodlužovat QT interval. Na molekulární úrovni je pravděpodobně zodpovědný za léky-indukovanou prolongaci QT intervalu inhibice Ikr kanálu, který je částečně zodpovědný za repolarizaci komorových myocytů [34]. Nová atypická antipsychotika jako risperidon a olanzapin se jeví bezpečnější stran rizika NSS [35]. Mezi známé rizikové faktory prolongace QT u psychofarmak patří ženské pohlaví, bradykardie a hypokalemie. K další skupině léků s potenciálně vysokým rizikem prodloužení QT intervalu náleží azolová antimykotika, makrolidy, ketolidy, fluorochinolony a antimalarika. Seznam léků dle rizik prolongace QT naleznete na https:/ / crediblemeds.org/ , nikoli na www.qtdrugs.com, což je stránka firmy zabývající se analýzou EKG u pacientů s LQTS. Na druhé straně spektra jsou léky snižující riziko NSS; opět je možné je rozdělit na skupinu antiarytmik, u kterých se tento efekt očekává, a léky bez primárního antiarytmického efektu. Nejefektivnější skupinou antiarytmik v prevenci arytmické NSS jsou betablokátory, což je známo již ze studie CIBIS II, kde došlo k redukci relativního rizika NSS o 44 % [36]. Ze skupiny neurohormonálních modulátorů (primárně nearytmik) dosáhl překvapivých výsledků sakubitril/ valsartan, který redukoval riziko NSS dokonce nezávisle na přítomnosti ICD, snížení relativního rizika NSS dosáhlo 20 % oproti větvi s enalaprilem [37,38]. Blokátory mineralokortikoidního receptoru ve studii RALES dosáhly signifikantní redukce relativního rizika (RRR) NSS o 29 % oproti placebu [39]. Tyto výsledky byly potvrzeny, jak ve studii EPHESUS [40], kde došlo k RRR NSS o 21 %, tak ve studii EMPHASIS-HF [41], kde došlo k RRR NSS o 24 %. V subanalýze studie DEFINITE prokázaly statiny RRR NSS o neuvěřitelných 78 %, jednalo se ale o post-hoc analýzu [42]. Metaanalýza 29 studií, které porovnávaly vždy statin proti kontrole, prokázala redukci relativního rizika NSS o 10 % [43].
Jak identifikovat mladé pacienty v riziku NSS?
Nejspolehlivějším „symptomem“ je odvrácená NSS, rekurence srdeční zástavy/ fibrilace komor je u těchto pacientů velmi pravděpodobná [28]. U těchto pacientů často nezjistíme příčinu a odcházejí s vágní diagnózou „idiopatická fibrilace komor“, v drtivé většině s implantovaným ICD. Typickými symptomy souvisejícími se zvýšeným rizikem NSS jsou: synkopy, vertigo, palpitace, přechodné výkyvy tlaku a pulzu a bolest na hrudi. Tyto symptomy ale bohužel mívají i zdravé děti/ adolescenti [44]. Výjimku tvoří námahová synkopa, která má ve většině případů nějakou vážnější příčinu (aortální stenóza, HKMP atd.) [45]. Screenin-gové testy v celé populaci jsou neproveditelné, proto je nutné provést screening u vybraných podskupin, jako jsou sportovci, pacienti s pozitivní rodinnou anamnézou, případně lidé vykonávající rizikové profese – piloti, vojáci, profesionální řidiči. Mimo screening je kritické věnovat pozornost QT intervalu, obzvláště pokud pacient užívá medikaci se zvýšeným rizikem prolongace QT intervalu.
Závěr
Prevence NSS u pacientů do 40 let věku v celé populaci je obtížná, stále nás stíhá Myerburgův paradox. Vybrané skupiny rizikových pacientů s vysokou incidencí NSS umíme identifikovat i relativně účinně léčit, ale v obecné populaci, kde je absolutní počet vysoký, ale nízká incidence NSS, zatím není jak vyhledat ty rizikovější. U zdravých jedinců je třeba se zaměřit na varovné symptomy. Přibližně kolem 30 % NSS zůstává neobjasněných a můžeme jen spekulovat, jedná-li se o čisté elektrické poruchy související s mutacemi iontových kanálů. Nejčastější příčiny NSS jsou akutní a chronické formy ICHS, v mladší populaci a populaci aktivních sportovců ale naopak převažují HKMP a ARVC, v menší míře pak anomální odstupy koronárních tepen a myokardiální můstky. Logickým opatřením by mělo být v případě sportovců, pacientů v rizikových profesích a pacientů s varovnými příznaky pátrání po těchto nejčastějších chorobách. V případě potvrzení diagnóz ARVC, HKMP pak riziková stratifikace. U profesionálních sportovců by měl jednoznačně proběhnout preparticipační screening, kdy nejjednodušší metodou je EKG screening dle „Seattle kritérií“ (tab. 5). K metodám prevence NSS patří:
- farmakoterapie – a) léky s přímým antiarytmickým účinkem – nejčastěji betablokátor, který je u většiny diagnóz nejefektivnější; b) léky neurohormonálně modulační (sakubitril-valsartan, blokátory mineralokortikoidního receptoru, statiny);
- implantace ICD – buď klasického transvenózního, nebo v indikovaných případech S-ICD;
- katetrizační ablace, která má potenciál snížit riziko NSS u pacientů s idiopatickou fibrilací komor a BrS
Doručeno do redakce: 17. 5. 2018
Přijato po recenzi: 29. 5. 2018
MU Dr. Jiří Plášek, Ph.D., FESC
Sources
1. Engelstein ED, Zipes DP. Sudden cardiac death. In: Alexander RW, Schlant RC, Fuster V. (eds.) The Heart, Arteries and Veins. New York, NY: McGraw-Hill; 1998 : 1081 – 1112.
2. Zheng ZJ, Croft JB, Giles WH et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation 2001; 104(18): 2158 – 2163.
3. Implantable cardioverter defibrillators and cardiac resynchronisation therapy for arrhytmias and herat failure. National Institute for Health and Clinical Excellence (NICE). Available at: https:/ / www.nice.org.uk/ guidance/ ta314/ resources/ implantable-cardioverter-defibrillators-and-cardiac-resynchronisation-therapy-for-arrhythmias-and-heart-failure-pdf-82602426443461.
4. Shen WK, Edwards WD, Hammill SC et al. Sudden unexpected nontraumatic death in 54 young adults: a 30-year population-based study. Am J Cardiol 1995; 76(3): 148 – 152.
5. Eckart RE, Scoville SL, Campbell CL et al. Sudden death in young adults: a 25-year review of autopsies in military recruits. Ann Intern Med 2004; 141(11): 829 – 834.
6. Corrado D, Basso C, Rizzoli G et al. Does sport activity enhance the risk of sudden death in adolescents and young adults? J Am Coll Cardiol 2003; 42(11): 1959 – 1963.
7. Maron BJ, Gohman TE, Aeppli D. Prevalence of sudden cardiac death during competitive sports activities in Minnesota high school athletes. J Am Coll Cardiol 1998; 32(7): 1881 – 1884.
8. Kozák M. Náhlá srdeční smrt. Interní Med 2009; 11(5): 211 – 214.
9. O'Mahony C, Jichi F, Pavlou M et al. Hypertrophic Cardiomyopathy Outcomes Investigators. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J 2014; 35(30): 2010 – 2020. doi: 10.1093/ eurheartj/ eht439.
10. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the Diagnosis and Management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733 – 2779. doi: 10.1093/ eurheartj/ ehu284.
11. Špinar J, Hradec J, Špinarová L et al. Souhrn doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Cor Vasa 2016; 58(5): e530 – e568.
12. Marcus FI, McKenna WJ, Sherrill D et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/ dysplasia: proposed modification of the task force criteria. Circulation 2010; 121(13): 1533 – 1541. doi: 10.1161/ CIRCULATIONAHA.108.840827.
13. Wang W, James CA, Calkins H. Diagnostic and therapeutic strategies for arrhythmogenic right ventricular dysplasia/ cardiomyopathy patient. Europace 2018. Ahead of print. doi: 10.1093/ europace/ euy063.
14. Corrado D, Wichter T, Link MS et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/ dysplasia: an international task force consensus statement. Eur Heart J 2015; 36(46): 3227 – 3237. doi: 10.1093/ eurheartj/ ehv162.
15. Medeiros-Domingo A, Iturralde-Torres P, Ackerman MJ. Clinical and genetic characteristics of long QT syndrome. Rev Esp Cardiol 2007; 60(7): 739 – 752.
16. Ackerman MJ, Priori SG, Willems S et al. HRS/ EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm 2011; 8(8): 1308 – 1339. doi: 10.1016/ j.hrthm.2011.05.020.
17. Goldenberg I, Horr S, Moss AJ et al. Risk for life--threatening cardiac events in patients with genotype-confirmed long-QT syndrome and normal-range corrected QT intervals. J Am Coll Cardiol 2011; 57(1): 51 – 59. doi: 10.1016/ j.jacc.2010.07.038.
18. Schwartz PJ, Moss AJ, Vincent GM et al. Diagnostic criteria for the long QT syndrome. An update. Circulation 1993; 88(2): 782 – 784.
19. Schwartz PJ, Priori SG, Spazzolini C et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001; 103(1): 89 – 95.
20. Schwartz PJ, Priori SG, Cerrone M et al. Left cardiac sympathetic denervation in the management of high-risk patients affected by the long-QT syndrome. Circulation 2004; 109(15): 1826 – 1833. doi: 10.1161/ 01.CIR.0000125523.14403.1E.
21. Priori SG, Wilde AA, Horie M et al. HRS/ EHRA/ APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes. Heart Rhythm 2013; 10(12): 1932 – 1963. doi: 10.1016/ j.hrthm.2013.05.014.
22. Mizusawa Y, Wilde AA. Brugada syndrome. Circ Arrhythm Electrophysiol 2012; 5(3): 606 – 616. doi: 10.1161/ CIRCEP.111.964577.
23. Priori SG, Napolitano C, Giordano U et al. Brugada syndrome and sudden cardiac death in children. Lancet 2000; 355(9206): 808 – 809. doi: 10.1016/ S0140-6736(99)05277-0.
24. Kautzner J, Peichl P. Catheter ablation to prevent sudden cardiac death. Int J Cardiol 2017; 237 : 29 – 33. doi: 10.1016/ j.ijcard.2017.03.135.
25. Nademanee K, Hocini M, Haïssaguerre M. Epicardial substrate ablation for Brugada syndrome. Heart Rhythm 2017; 14(3): 457 – 461. doi: 10.1016/ j.hrthm.2016.12.001.
26. Sponder M, Khazen C, Dichtl W et al. Specific indications and clinical outcome in patients with subcutaneous implantable cardioverter-defibrillator (ICD). A nationwide multicentre registry. Eur J Intern Med 2018; 48 : 64 – 68. doi: 10.1016/ j.ejim.2017.09.038.
27. Leenhardt A, Denjoy I, Guicheney P. Catecholaminergic polymorphic ventricular tachycardia. Circ Arrhythm Electrophysiol 2012; 5(5): 1044 – 1052. doi: 10.1161/ CIRCEP.111.962027.
28. Ackerman M, Atkins DL, Triedman JK. Sudden cardiac death in the young. Circulation 2016; 133(10): 1006 – 1026. doi: 10.1161/ CIRCULATION AHA.115.020254.
29. Papadakis M, Sharma S, Cox S et al. The magnitude of sudden cardiac death in the young: a death certificate-based review in England and Wales. Europace 2009; 11(10): 1353 – 1358. doi: 10.1093/ europace/ eup229.
30. Harmon KG, Drezner JA, Maleszewski JJ et al. Pathogeneses of sudden cardiac death in National Collegiate Athletic Association athletes. Circ Arrhythm Electrophysiol 2014; 7(2): 198 – 204. doi: 10.1161/ CIRCEP.113.001376.
31. Meyer L, Stubbs B, Fahrenbruch C et al. Incidence, causes, and survival trends from cardiovascular-related sudden cardiac arrest in child-ren and young adults 0 to 35 years of age: a 30-year review. Circulation 2012; 126(1): 1363 – 1372. doi: 10.1161/ CIRCULATIONAHA.111.076810.
32. Maron BJ, Doerer JJ, Haas TS et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980 – 2006. Circulation 2009; 119(8): 1085 – 1092. doi: 10.1161/ CIRCULATIONAHA.108.804617.
33. Drezner JA, Ackerman MJ, Anderson J et al. Electrocardiographic interpretation in athletes: the 'Seattle criteria'. Br J Sports Med 2013; 47(3): 122 – 124. doi: 10.1136/ bjsports-2012-092067.
34. Kallergis EM, Goudis CA, Simantirakis EN et al. Mechanisms, risk factors, and management of acquired long QT syndrome: a comprehensive review. ScientificWorldJournal 2012; 2012 : 212178. doi: 10.1100/ 2012/ 212178.
35. Liperoti R, Gambassi G, Lapane KL et al. Conventional and atypical antipsychotics and the risk of hospitalization for ventricular arrhythmias or cardiac arrest. Arch Intern Med 2005; 165(6): 696 – 701.
36. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999; 353(9146): 9 – 13.
37. Desai AS, McMurray JJ, Packer M et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J 2015; 36(30): 1990 – 1997. doi: 10.1093/ eurheartj/ ehv186.
38. Erath JW, Hohnloser SH. Drugs to prevent sudden cardiac death. Int J Cardiol 2017; 237 : 22 – 24. doi: 10.1016/ j.ijcard.2017.03.066.
39. Pitt B, Zannad F, Remme WJ et al. The randomized aldactone evaluation study investigators. The effect of spironolactone on morbidityand mortality in patients with severe heart silure. N Engl J Med 1999; 341(10): 709 – 717. doi: 10.1056/ NEJM199909023411001.
40. Pitt B, Remme WJ, Zannad F et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348(14): 1309 – 1321.
41. Zannad F, McMurray JJ, Krum H et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364(1): 11 – 21. doi: 10.1056/ NEJMoa1009492.
42. Goldberger JJ, Subacius H, Schaechter A et al. DEFINITE Investigators. Effects of statin therapy on arrhythmic events and survival in patients with nonischemic dilated cardiomyopathy. J Am Coll Cardiol 2006; 48(6): 1228 – 1233. doi: 10.1016/ j.jacc.2006.05.053.
43. Rahimi K, Majoni W, Merhi A et al. Effect of statins on ventricular tachyarrhythmia, cardiac arrest, and sudden cardiac death: a meta-analysis of published and unpublished evidence from randomized trials. Eur Heart J 2012; 33(13): 1571 – 1581. doi: 10.1093/ eurheartj/ ehs005.
44. Friedman KG, Alexander ME. Chest pain and syncope in children: a practical approach to the diagnosis of cardiac disease. J Pediatr 2013; 163(3): 896 – 901. doi: 10.1016/ j.jpeds.2013.05.001.
45. Tretter JT, Kavey RE. Distinguishing cardiac syncope from vasovagal syncope in a referral population. J Pediatr 2013; 163(3): 1618 – 1623.e1. doi: 10.1016/ j.jpeds.2013.07.023.
46. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death. Structure, function, and time-dependence of risk. Circulation. 1992; 85 (1 Suppl): I2 – I10.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 2-
All articles in this issue
- Arytmie u mladých dospělých
- Prevence náhlé srdeční smrti u pacientů do 40 let věku
- Juvenilní hypertenze
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
- Význam a léčba dyslipidemie u mladých dospělých
- Diabetes mellitus a kardiovaskulární onemocnění
- Možnosti ovlivnění inzulinové rezistence u jedinců s diabetem 1. typu
- Klinická štúdia ODYSSEY OUTCOMES
- Kyslíková terapie při podezření na akutní infarkt myokardu – studie DETO2X-AMI
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Manažment hypertenzikov s končatinovocievnou artériovou chorobou
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Arytmie u mladých dospělých
- Juvenilní hypertenze
- Fixní kombinace rosuvastatinu s ezetimibem – lékový profil
- Chronická žilní insuficience a varixy dolních končetin u mladých osob
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


![Nejčastější typy syndromu dlouhého QT a jejich EKG manifestace. Upraveno dle [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/97709a27d42eb46fa3950ab75a19e880.jpeg)
![Seattle kritéria – abnormální EKG nálezy u atletů [32].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e60355fef42933b0e70b21d27f8ccd48.jpeg)