-
Medical journals
- Career
Arytmie u mladých dospělých
: M. Vícha; T. Skála; M. Táborský
: I. interní klinika – kardiologická LF UP a FN Olomouc
: Kardiol Rev Int Med 2018, 20(2): 87-95
Poruchy srdečního rytmu jsou heterogenní skupinou onemocnění vyskytující se v každém věku. Klinická závažnost je dána konkrétním typem arytmie – od jednotek spíše benigních (velká část supraventrikulárních tachykardií) po arytmie komorové s různě vysokým rizikem náhlé srdeční smrti. Lepší než dlouhodobá antiarytmická profylaxe je moderní a často i kauzální terapií elektrofyziologické vyšetření srdce s možností endo - a/ nebo epikardiální katetrové ablace. U indikovaných pacientů přistupujeme k implantaci kardiostimulátoru či kardioverter-defibrilátoru z primární nebo sekundární prevence.
Klíčová slova
arytmie – tachykardie – bradykardie – supraventrikulární tachykardie – komorové arytmie – fibrilace komor – náhlá srdeční smrt – kardioverter-defibrilátor – katetrové ablace – farmakoterapie – doporučené postupy
Úvod
Arytmie lze definovat jako poruchy srdečního rytmu v důsledku změny tvorby a/ nebo vedení vzruchu. Jedná se o velmi heterogenní skupinu onemocnění napříč širokým spektrem populace. Velká část z nich má pouze benigní charakter (např. síňové extrasystoly), jiné tvoří život ohrožující stavy či přímo vedou k náhlé srdeční smrti (NSS) [1]. Některé se typicky vyskytují u mladších osob (např. paroxysmální supraventrikulární tachykardie), naopak jiné se v této věkové skupině nachází velmi sporadicky (průměrný věk u sick sinus syndromu je 68 let) [1,2]. Nejčastější významnou arytmií u dospělých pacientů je fibrilace síní (FS) s prevalencí asi 2 – 3 % populace, přičemž s věkem počet nemocných signifikantně stoupá [2,3]. Nutno říci, že v mladším věku je poměrně vzácná a důležitou roli zde tvoří genetická složka [3].
V klinické praxi lze poruchy rytmu rozdělit z několika pohledů. Podle frekvence na tachykardie a bradykardie, dle místa vzniku na síňové a komorové, délkou trvání na paroxysmální a neparoxysmální atd. Z prognostického hlediska rozlišujeme arytmie benigní a maligní, současně je důležité, zda má jedinec strukturální onemocnění srdce. Může jít o stavy vrozené, kam řadíme např. kompletní kongenitální atrioventrikulární blokádu (CCAVB), nebo získané, jako je tomu u atrioventrikulární blokády III. stupně (AVB III) po proběhlé myokarditidě [1,2].
Termín bradykardie je u dospělých osobcharakterizován počtem komorových stahů< 60/ min, tachykardie pak > 100/ min [4]. Pojem supraventrikulární arytmie (brady - či tachyarytmie) je definována jako onemocnění srdečního rytmu, kdy podkladem vzniku a udržení jsou anatomické struktury nad Hisovým svazkem, naopak komorové arytmie mají svůj původ ve svalovině komor, resp. v tkáni převodního systému distálně od Hisova svazku [3].
Klinický obraz
Arytmie se mohou manifestovat velmi odlišně, od absence příznaků přes subjektivně výrazné obtíže až po náhlé úmrtí [5]. V anamnéze pátráme po palpitacích (nepříjemné bušení srdce), dotazujeme se cíleně na jejich frekvenci, pravidelnost, okolnosti vzniku, délku trvání. Palpitace nemusí být jenom projevem tachykardie, obdobně nepříjemně mohou být vnímány i prosté komorové nebo síňové extrasystoly. Mezi další příznačné symptomy patří dušnost, nevýkonnost, únava a slabost při tzv. syndromu nízkého minutového výdeje, kdy hypoperfuze orgánů mnohdy vede k vertigu, presynkopě nebo přímo k poruše vědomí. Vzácněji pacienti popisují tinitus, abdominální dyskomfort, poruchy zraku, zvýšenou frekvenci močení. Sekundárně může dojít k rozvoji srdečního selhání, ischemii myokardu nebo trombembolizmu [5,6].
Vyšetřovací metody v arytmologii
Tvoří základní část diagnostického algoritmu a umožní zvolit strategii léčby. Z neinvazivních metod má (i nadále) své nezastupitelné místo standardní povrchové 12svodové EKG, poprvé uvedené do klinické praxe Einthovenem, za které získal v roce 1924 Nobelovu cenu [7]. Nutno říci, že ne vždy se podaří úspěšně zachytit obraz arytmie, typicky tomu je u paroxysmálních forem s krátkou dobou trvání (např. atrioventrikulární nodální reentry tachykardie – AVNRT), proto je vhodné využívat i dlouhodobé monitorovací systémy. S výhodou je lze indikovat u nemocných s palpitacemi či po prodělané synkopě. Velmi cenná je souvislost detekce arytmie v době obtíží stiskem tlačítka přístroje, ale stejně tak je důležitý i negativní nález, tedy fyziologický EKG záznam v okamžiku obtíží [1]. V naší klinické praxi využíváme Holterovu monitoraci v délce od 24 hod do 7 dnů. Délku záznamu volíme s ohledem na četnost a šanci detekce arytmie. Pro delší záznam volíme epizodní EKG záznamníky (trvání v řádů dnů až týdnů). U některých pacientů přistupujeme k implantaci EKG záznamníků. Ty umožňují dlouhodobou monitoraci po dobu měsíců až let. Nezbytnou součástí vyšetřovacího algoritmu jsou zobrazovací metody. Nejdostupnější je echokardiografické vyšetření k vyloučení strukturálního onemocnění srdce. V případě podrobnějšího došetření pak magnetická rezonance (MR) pro svou vysokou senzitivitu a specificitu. Na výše uvedené navazuje invazivní elektrofyziologické vyšetření srdce s možností katetrové ablace, a tedy kauzálním řešením arytmií.
Nejčastější poruchy srdečního rytmu v mladé populaci
- supraventrikulární tachykardie (SVT),
- komorové arytmie (KA),
- bradykardie u dětí a mladších dospělých.
Supraventrikulární tachykardie
SVT je porucha rytmu, kdy k jejímu vzniku a udržení jsou nutné struktury nad Hisovým svazkem. Do této skupiny patří i FS, ta však bývá obvykle uváděna samostatně [2]. Mechanizmus arytmií je pak v principu dvojí. Některé jsou na podkladě ložiska (tzv. fokální), jiné využívají reentry okruhu [8]. Pojem paroxysmální supraventrikulární tachykardie (PSVT) označuje takové arytmie, které začínají i končí skokem. Patří zde atrioventrikulární reentry tachykardie (AVRT), AVNRT, případně síňová tachykardie (AT) a sinusová reentry tachykardie (SANRT). Základní rozdělení shrnuje tab. 1. Přesná epidemiologická data o SVT nejsou k dispozici, předpokládá se, že incidence činí asi 36 na 100 000 osob/ rok, prevalence 2,25 na 1 000 osob [9]. Průměrný věk pacientů bez strukturálního postižení srdce je 37 let a mívají tachykardii rychlejší než starší lidé (průměrně 186/ min vs. 155/ min) [9]. AVRT se zpravidla projeví dříve (23 ± 14 let) než AVNRT (32 ± 18 let) [8]. Relativní riziko u žen je 2× vyšší než u mužů [2].
1. Základní rozdělení supraventrikulárních tachykardií. Převzato z [2]. ![Základní rozdělení supraventrikulárních tachykardií. Převzato z [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2c8b30fc234dc70106425921b3238809.jpeg)
Diagnostika SVT je založena na anamnéze (palpitace, začátek i konec tachykardie skokem), fyzikálním vyšetření (obvykle věku přiměřený nález) a EKG záznamu. Na něm je zpravidla obraz úzkokomplexové pravidelné tachykardie (QRS < 120 ms), vzácněji pak širokokomplexové při antidromní AVRT či blokádě Tawarova raménka. Většina SVT má síňovou frekvenci < 200/ min (flutter a FS pak obvykle > 250/ min). Někdy může být identifikace P vlny obtížná (ukryta v QRS nebo vlně T), pak je s výhodou SVT zpomalit či přímo ukončit za kontinuálního EKG záznamu [2].
Terapeutický postup u akutní SVT zahrnuje provedení vagových manévrů a/ nebo podání adenozinu (v dávce 6 – 12 mg i.v.) [9]. Při neúspěchu u jinak hemodynamicky stabilních pacientů můžeme ke zpomalení/ terminaci arytmie užít např. metoprolol (2,5 – 5,0 mg i.v.), verapamil (1,0 – 5,0 mg i.v.), digoxin (0,5 mg i.v.) či amiodaron (150 mg i.v.) [10]. Hemodynamicky nestabilní pacient (šok, hypotenze, srdeční selhání) vyžaduje urgentní elektrickou kardioverzi. U všech pacientů se snažíme určit typ a příčinu arytmie (např. minerálová dysbalance) [10].
Vybrané arytmie
Atrioventrikulární reentry tachykardie
Reentry tachykardie na podkladě vrozené přídatné (akcesorní) dráhy spojují anatomicky síně a komory mimo definované fyziologické vedení atrioventrikulárním (AV) uzlem. Histologicky jde zpravidla o snopce pracovního myokardu, které jsou pozůstatkem nedokonalého oddělení svaloviny síní od komor v embryonálním období [1,2,8]. Jako manifestní nazýváme takové akcesorní dráhy, jež umožňují vedení vzruchu antegrádně (ze síní do komor). Ve většině případů vedou i retrográdně (z komor na síně). Tyto dráhy se projevují na povrchovém EKG tzv. preexcitací (obr. 1, 2) [8]. Ta je dána tím, že akcesorní dráha převede vzruch rychleji než fyziologicky AV uzel, načež dochází k předčasné a abnormální aktivaci komorového myokardu. Na EKG se projeví jako obraz delta vlny [8].
1. Obraz preexcitace u pacienta s WPW syndromem – akcesorní dráha vlevo anterolaterálně. 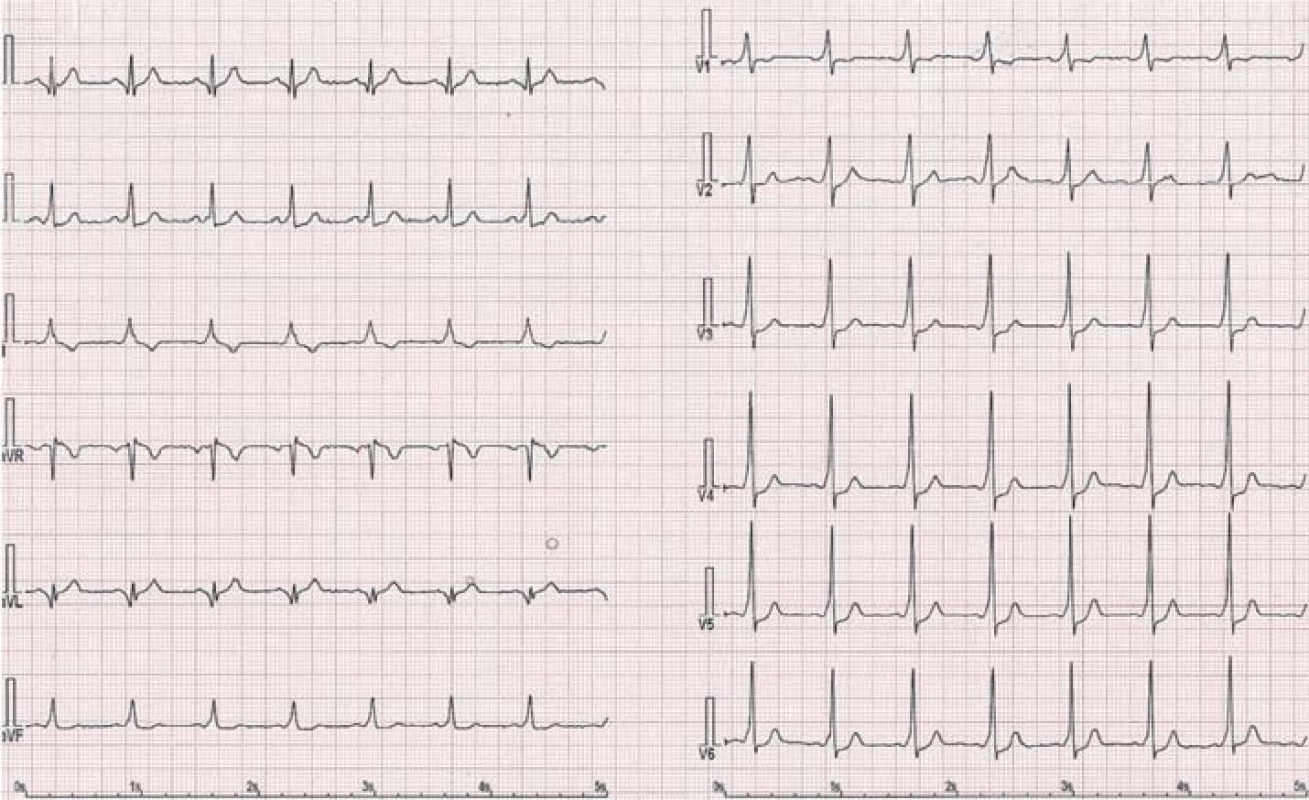
2. 12svodové EKG u téhož pacienta po úspěšné radiofrekvenční ablaci přídatné dráhy s vymizením známek preexcitace. 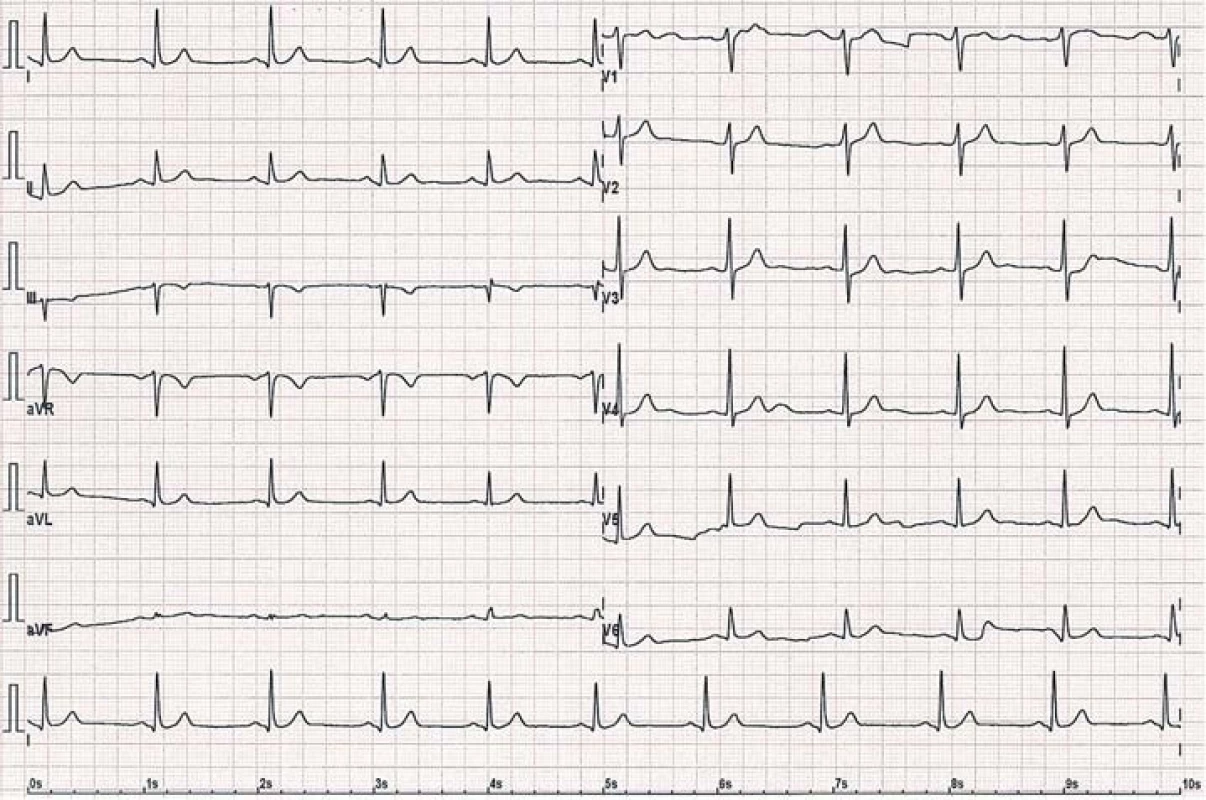
Tzv. skryté dráhy (concealed AV bypass tracts) vedou vzruch pouze retrográdně, proto je nelze na povrchovém EKG zaznamenat (30 – 40 % případů přídatných drah). Skryté dráhy lze verifikovat pouze elektrofyziologickým vyšetřením [1,8].
Akcesorní spojky, které vedou výlučně antegrádně, jsou vzácné (např. Mahaimovy spojky) [2].
Termín Wolf-Parkinson-Whiteův syndrom (WPW syndrom) užíváme u pacientů, kteří mají na povrchovém EKG obraz preexcitace a s akcesorní spojkou související tachykardii typu AVRT [2,8]. Je známo, že asi 10 – 15 % pacientů s WPW má vrozenou srdeční vadu (kardiomyopatie – KMP, Ebsteinova anomálie aj.), tito jedinci mívají současně větší počet akcesorních spojek [8]. V závislosti na tvaru delta vlny, její lokalizaci a orientaci QRS komplexu můžeme odhadnout anatomickou lokalizaci spojky, to však nemá zpravidla klinický přínos. Na místě je provedení elektrofyziologického vyšetření s možností ablačního řešení přídatné dráhy [1].
Při ortodromní AVRT se šíří elektrický potenciál antegrádně, tedy přirozeně ze síní na komory cestou AV uzlu a zpět z komor na síně přes akcesorní spojku [9]. Logicky je proto absence delta vlny a QRS komplex je štíhlý. Ortodromní AVRT tvoří 95 % SVT u pacientů s WPW [2]. Mnohem vzácnější je tzv. antidromní AVRT (5 % pacientů), kdy se vzruch propaguje prográdně přes přídatnou dráhu a retrográdně přes AV uzel. Antidromní AVRT je typická pro tzv. Mahaimovou spojku [8]. Při antidromní AVRT na povrchovém EKG vidíme obraz širokokomplexové tachykardie.
Roční riziko náhlého úmrtí u WPW syndromu je zhruba 0,1 % (u asymptomatických osob), ale až 2,2 % u pacientů se symptomy (především palpitace) [2]. Hlavním ukazatelem zvýšeného rizika náhlého úmrtí je nejkratší preexcitovaný R-R interval při FS menší než 250 ms, kterou má současně až 30 % pacientů s WPW syndromem. FS tak představuje potenciálně život ohrožující situaci, kdy rychlý převod signálu ze síní na komory (cestou spojky) vede k vysoké frekvenci komor a ta může následně zdegenerovat do fibrilace komor (FK) [2,8]. Zajímavostí je, že ablační řešení přídatné dráhy vede i k odstranění FS [8].
Terapie
Akutní léčba se řídí obecným terapeutickým postupem SVT (viz výše). Na tomto místě je nutno upozornit, že podání adenozinu může vyvolat FS s rychlou odpovědí komor, proto se doporučuje mít k dispozici externí defibrilátor [2]. Alternativou je podání propafenonu, který zpomaluje vedení akcesorní spojkou [2,8]. V případě život ohrožujícího stavu, jakým je FS u WPW syndromu, je urgentní volbou elektrická kardioverze, současně jsou přísně kontraindikovány uzlové blokátory [2]. Optimálním a dlouhodobým řešením je katetrová ablace s dlouhodobou úspěšností dosahující cca 93 %. Komplikace se vyskytují u zhruba 2,8 % pacientů [9]. Ti, kteří z nějakého důvodu striktně odmítají ablaci, mohou profylakticky užívat antiarytmika I. a III. třídy, avšak data o jejich účinku a bezpečnosti nejsou podložena závěry velkých randomizovaných studií [8].
Atrioventrikulární nodální reentry tachykardie
Jde o nejčastější PSVT v populaci (obr. 3). Ženy postihuje až 2× častěji než muže a jako taková se manifestuje kdykoli v průběhu života, nicméně první symptomy se obvykle projeví u žen v mladším věku, mezi 15. a 50. rokem (60 % případů) [9]. Frekvence tachykardie je mezi 140 a 250/ min [8]. Mechanizmem vzniku a udržením arytmie je malý reentry okruh bezprostředně související s AV uzlem, tzv. dualita („rychlá a pomalá dráha“) [1]. Pravdou je, že dualita vedení může být při elektrofyziologickém vyšetření prokázána i u osob, které reálně nikdy manifestní AVNRT neprodělají [1]. Pomalou dráhou označujeme svazek probíhající v Kochově trojúhelníku u ústí koronárního sinu. Rychlou (přední) dráhu anatomicky lokalizujeme vpředu nahoře výše nad ústím koronárního sinu. V samotném vrcholu pomyslného trojúhelníku je AV uzel [1].
3. Holterova EKG monitorace se záchytem paroxysmu typické AVNRT. 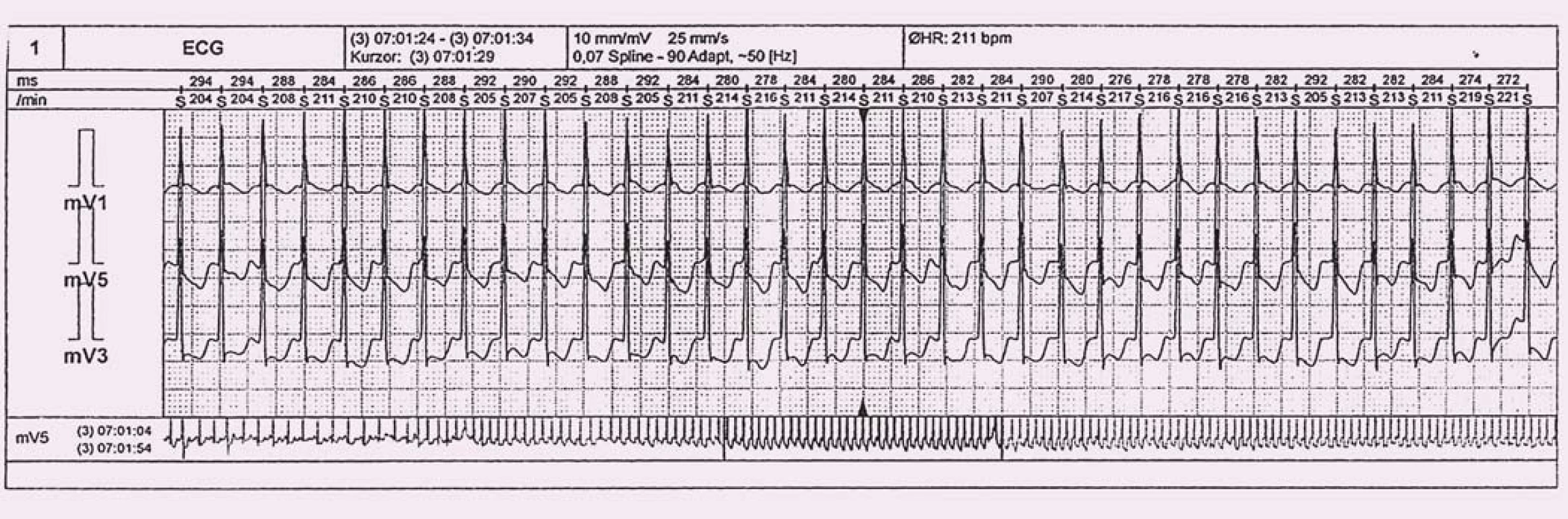
Při tzv. typické slow-fast AVNRT (95 % pacientů) je impuls šířen nejprve pomalou drahou směrem do kompaktního AV uzlu a následně rychlou drahou zpět – retrográdní aktivace síní [1,8]. Na 12svodovém EKG pozorujeme P vlnu často ukrytou v terminální části QRS komplexu, popř. těsně za ním. Pokud lze P vlnu identifikovat, pak mnohdy mění terminální konec QRS komplexu a vytváří tzv. pseudo r’ kmit ve svodu V1 a pseudo s’ kmit na spodní stěně (II, III, aVF) [2]. U vzácné atypické formy fast-slow (5 % pacientů) je propagace vzruchu opačná, tedy nejprve rychlou drahou a zpět pomalou. Na EKG vidíme aktivaci síní opožděně za QRS, a P vlna tak může být snadněji identifikovatelná, nicméně někdy připomíná síňovou tachykardii [1,2,8]. Častým nálezem při AVNRT jsou deprese ST úseku, které mohou připomínat ischemické změny (obr. 3), pravděpodobně se jedná o fúzi ST-segmentu a retrográdní P vlny (nemusí nutně záviset na rychlosti tachykardie) [11]. V praxi se lze setkat i s laboratorní pozitivitou troponinu po proběhlé AVNRT, a to i při absenci strukturálního onemocnění srdce či koronární nemoci [12].
Terapie
Principem je zpomalení, optimálně pak přechodná blokáda AV uzlu, a tím terminace arytmie. Při neúspěchu vagových manévrů a/ nebo adenozinu podáváme i.v. betablokátory (metoprolol) nebo nondihydropyridinové blokátory kalciových kanálů (verapamil) [1,2]. V chronické medikaci se uplatňují uzlové blokátory, ve zvláštních případech můžeme volit antiarytmika I. a III. třídy. Metodou volby a současně kauzální terapií je ablační řešení. Ve srovnání s profylaktickou antiarytmickou terapií, která je účinná asi ve 30 – 40 % případů, dosahuje katetrová ablace efektu v 97 % případů [8]. Principem je modifikace pomalé síňové dráhy [1]. Recidiva po ablaci se pohybuje do 5 %, přičemž riziko iatrogenní AV blokády je pod 1 % [9].
Fokální síňová tachykardie
Fokální (ložiskovou) síňovou tachykardii (FAT) ve většině případů charakterizujeme jako benigní pravidelnou síňovou tachykardii, setrvalou či nesetrvalou, vznikající v relativně malém ložisku ektopie asi 0,5 × 0,5 cm (mimo tkáň sinoatriálního (SA) a AV uzlu), odkud se elektrický vzruch šíří centrifugálně síněmi o frekvenci 100 – 250/ min, přičemž odpověď komor závisí na funkci AV uzlu [1,8,9]. Představuje asi 3 – 17 % pacientů odeslaných k radiofrekvenční ablaci SVT [9]. Predilekčním místem ložiska ektopické aktivity jsou plicní žíly, ouško levé síně, koronární sinus, Marshallovo ligamentum, oblast síňové přepážky kolem foramen ovale, crista terminalis, Eustachova hrana, trikuspidální a mitrální anulus aj. [8]. Diagnostika je založena na EKG obrazu síňové tachykardie s původem mimo SA uzel, kdy podrobným hodnocením morfologie P vlny v různých svodech lze odlišit patologickou vlnu P od P vlny při sinusovém rytmu, nicméně přesnou lokalizaci ektopické aktivity lze potvrdit až při podrobném elektrofyziologickém vyšetření [1,2]. Nápomocná v diagnostice může být Holterovská monitorace, kdy FAT, na rozdíl od sinusové tachykardie, má poměrně rychlý začátek a konec, kdežto zrychlení a zpomalení běžné sinusové tachykardie trvá obyčejně až desítky vteřin (obr. 4 – 6) [2].
4. Fokální síňová tachykardie z oblasti pravé dolní plicní žíly. 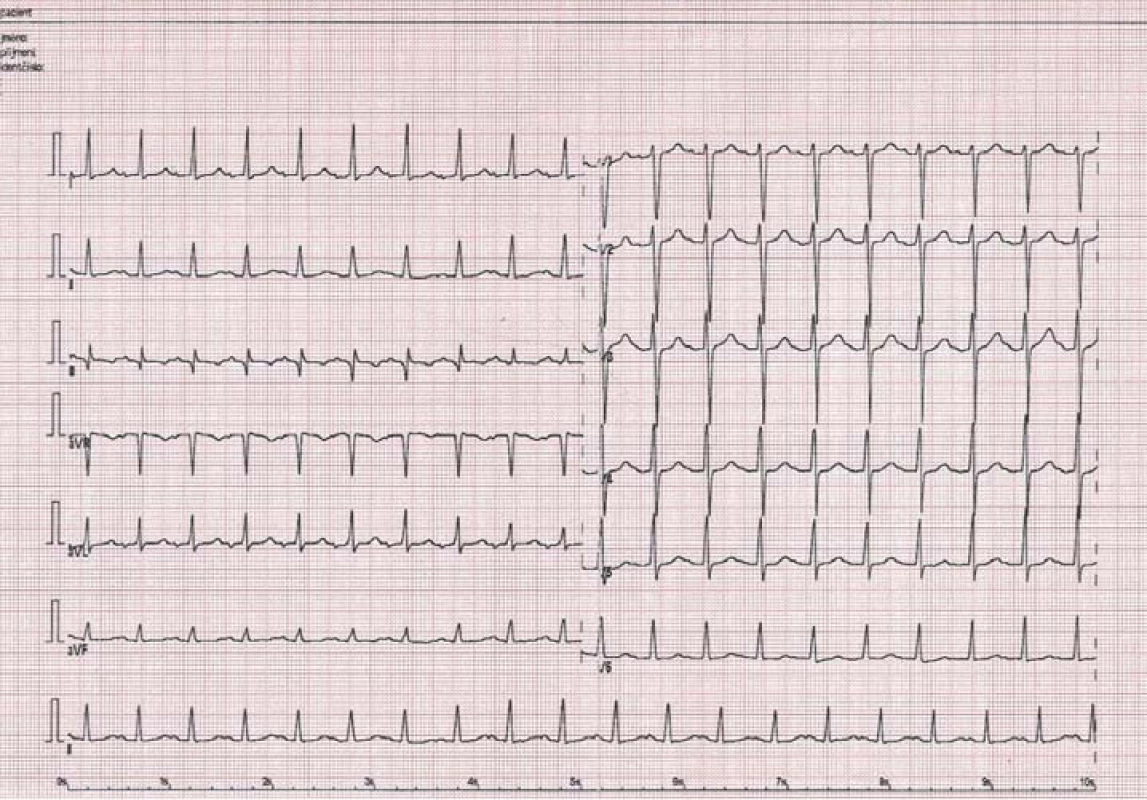
5. CARTO 3 mapa levé a pravé síně u téhož pacienta s fokální síňovou tachykardií z pravé dolní plicní žíly a paroxysmy fi brilace síní. 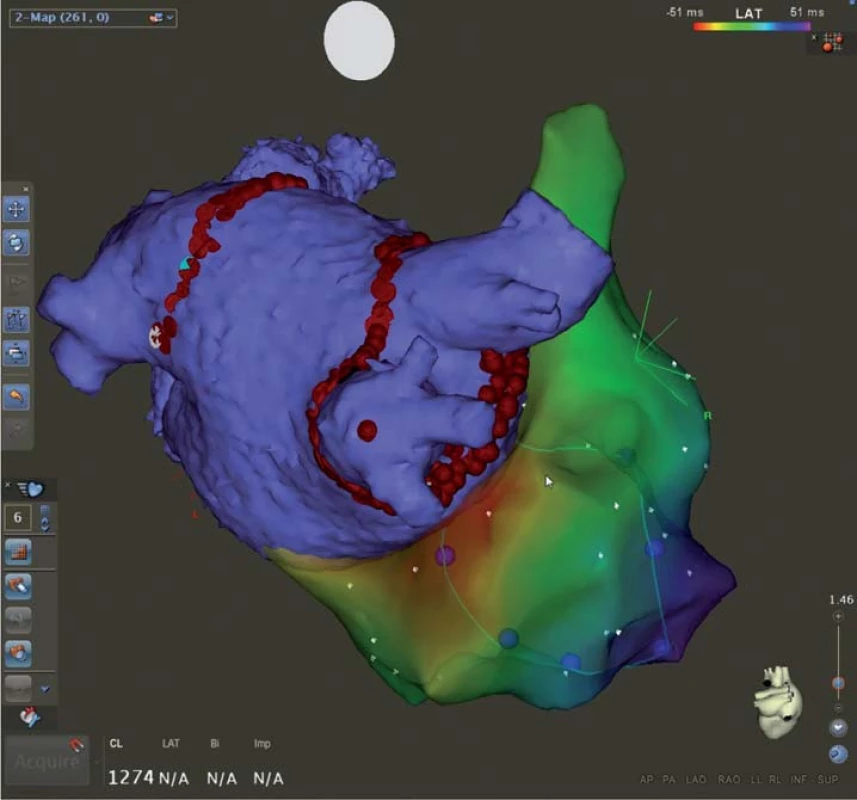
6. 12svodové EKG po úspěšně provedené ablaci FAT u stejného pacienta. 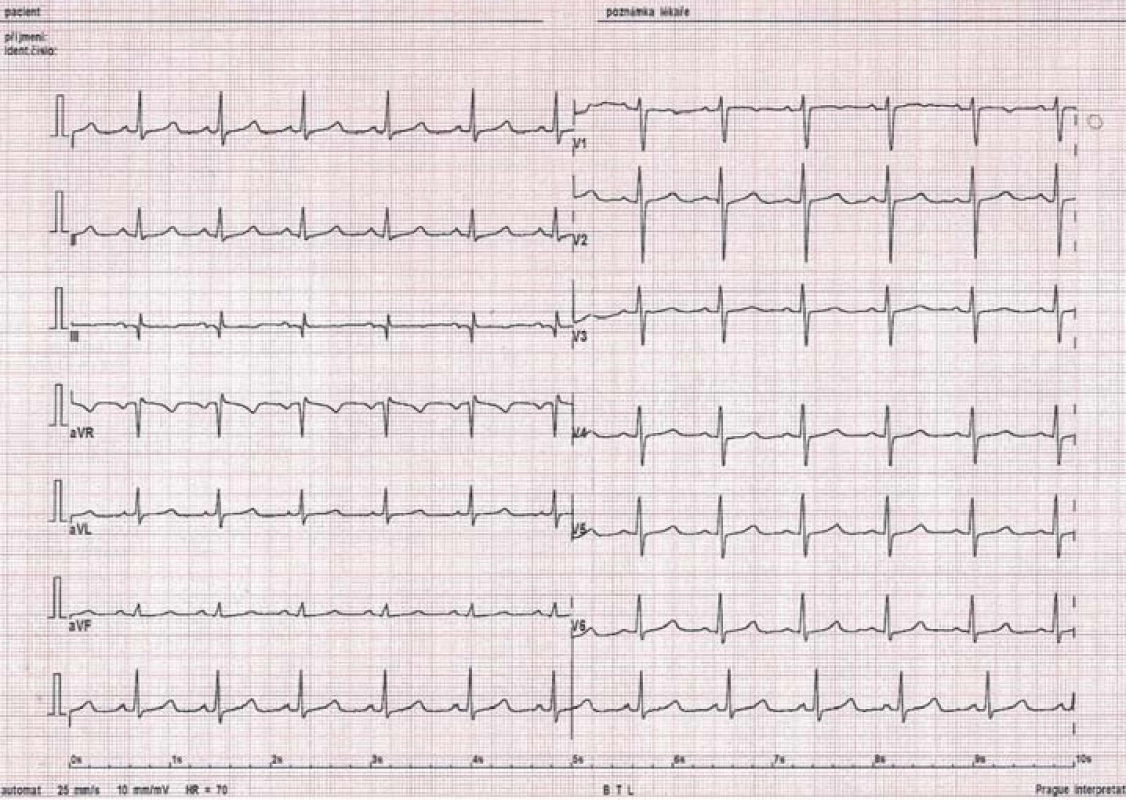
Arytmie má většinou benigní charakter, proto nesetrvalé a mnohdy asymptomatické FAT nevyžadují obvykle terapii. Katetrová ablace je doporučena u pacientů se symptomatickou FAT jako alternativa k farmakoterapii (betablokátory, nondihydropyridinové blokátory kalciových kanálů, propafenon, flekainid, amiodaron, sotalol) [9]. Její úspěšnost se pohybuje kolem 90 – 95 % [9]. Rizikem incesantní formy je vznik tachykardií indukované KMP. Po úspěšné ablaci dochází k normalizaci ejekční frakce téměř u téměř 97 % pacientů [9].
Nepřiměřená sinusová tachykardie
Za fyziologických podmínek je klidová frekvence SA uzlu mezi 50 a 90/ min v závislosti na tonu vagu [9]. Sinusová tachykardie (≥ 100/ min) může být zcela adekvátní a přiměřená fyzické a/ nebo emoční aktivitě, případně jiným vyvolávajícím faktorům, typicky při dehydrataci, infekci a horečce, anémii, u srdečního selhání, hypertyreóze, případně navozená příjmem kofeinu, abúzem drog (kokain, amfetaminy), popř. léčivy (např. beta agonisté – salmeterol apod.) [9]. Ve všech výše uvedených případech dochází k normalizaci tepové frekvence po odeznění vyvolávající příčiny [9].
U tzv. nepřiměřené sinusové tachykardie (inappropriate sinus tachycardia – IST) dochází k perzistující zvýšené srdeční frekvenci (původem z SA uzlu), která je však nepřiměřená úrovni fyzické či emoční zátěže, patologickým stavům, farmakologickým vlivům, a nelze ji tedy racionálně vysvětlit bezprostřední příčinou [8]. Etiologie není zcela známa, hypotézy předpokládají jak poruchy a dysregulaci sympatiku a parasympatiku, tak vlastní vnitřní hyperaktivitu sinusového uzlu [8,9]. Jedná se o diagnózu per exclusionem [9].
Prevalence je asi 1 % dospělé populace, častěji postihuje ženy (90 %), pracovníky ve zdravotnictví [1,8]. Průměrný věk pacientů je 38 let [8]. Klinicky dominují palpitace, dušnost, někdy až závratě a presynkopy [8].
Diagnostika se po vyloučení ostatních příčin sinusové tachykardie opírá o záchyt nevysvětlitelné paroxysmální nebo perzistentní sinusové tachykardie na 12svodovém EKG/ při Holterově monitoraci (průměrná tepová frekvence za 24hod > 90/ min) [2,9].
Diferenciální diagnostika zahrnuje SA reentry tachykardii, syndrom posturální ortostatické tachykardie, FAT z oblasti crista terminalis a jiné SVT [9].
Léčba asymptomatických pacientů není všeobecně doporučována, jelikož riziko rozvoje tachykardií indukované KMP je vzácné [2]. Terapie symptomatických pacientů je složitá v tom, že snížení tepové frekvence nemusí zákonitě zcela vést k vymizení symptomů [9]. Lékem volby jsou betablokátory a nondihydropyridinové blokátory kalciových kanálů, ale lze zvážit i ivabradin (inhibitor If kanálu) [9]. Další možností je katetrizační ablace SA uzlu. Principem je modifikace rychlejších center v horní části SA uzlu při současném zachování rytmu vycházejícího z nižších center, nicméně rizika spojená s výkonem nejsou zanedbatelná [8]. Poslední možností je ablace SA uzlu s implantací trvalého kardiostimulátoru [2].
Téměř všechny tachykardie se štíhlým QRS komplexem mají supraventrikulární původ. Přestože velká část z nich je pro svého nositele prakticky benigní, může stav za určitých okolností při déletrvající vyšší frekvenci komor vést k srdečnímu selhání – tzv. tachykardií indukované KMP (TIC). V případě odstranění vyvolávající příčiny, tedy při úspěšné terapii, je TIC potenciálně reverzibilní [13].
Komorové arytmie
Původ KA je v tkáni distálně od Hisova svazku nebo ve svalovině komor [14]. KA zahrnují širokou škálu nálezů od předčasných komorových extrasystol (KES) po FK (tab. 2) [17]. Zvláštní skupinu tvoří geneticky podmíněné primární elektrické syndromy (hereditární arytmické syndromy), u kterých je pacient ohrožen NSS (tab. 3). Nejčastější etiologií KA u starších dospělých je ischemická choroba srdeční, u pacientů do 35 let KMP [2].
2. Dělení komorových tachykardií dle EKG kritérií [2]. ![Dělení komorových tachykardií dle EKG kritérií [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3ff33d5c1d974d7e47b0e65253ba19a3.jpeg)
3. Termín náhlá srdeční smrt lze užít v následujících případech. Převzato z [14]. ![Termín náhlá srdeční smrt lze užít v následujících případech. Převzato z [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/8b8dd7d19cdf22163ea2085f88f6200b.jpeg)
Bezprostřední příčinou NSS bývá zpravidla komorová tachykardie (KT) a FK. Výskyt NSS je u mladších osob odhadován na 0,46 – 3,7 případů na 100 000 obyvatel ročně. U mladších pacientů dominují KMP, kanálopatie, zánětlivé postižení myokardu (myokarditidy) a užívání drog [14]. Statisticky u dětí do 13 let představuje NSS asi 20 % náhlých úmrtí, mezi 14. a 21. rokem až 30 % [2].
Komorové tachykardie
KT lze charakterizovat jako ≥ 3 po sobě následující komorové komplexy o frekvenci nad 100/ min [17]. Pro svůj původ distálně od Hisova svazku patří typicky mezi širokokomplexové tachykardie (wide complex tachycardia – WCT) s QRS ≥ 0,12 s [1,2]. Pouze výjimečně má hraniční šíři QRS připomínající SVT (např. idiopatická KT typu intrafascikulárního reentry) [2]. Nutno podotknout, že ne všechny WCT jsou automaticky KT. Samotné KT tvoří asi 80 % všech WCT, ostatní příčiny zahrnují např. SVT s aberantním převodem na komory (typicky u funkční raménkové blokády), u nemocných s preexcitací (antidromní AVRT), stimulovaný rytmus aj. (obr. 7) [1]. Rozdělení KT dle EKG záznamu shrnuje tab. 4.
7. Fibrilace komor terminována elektrickým výbojem ICD. 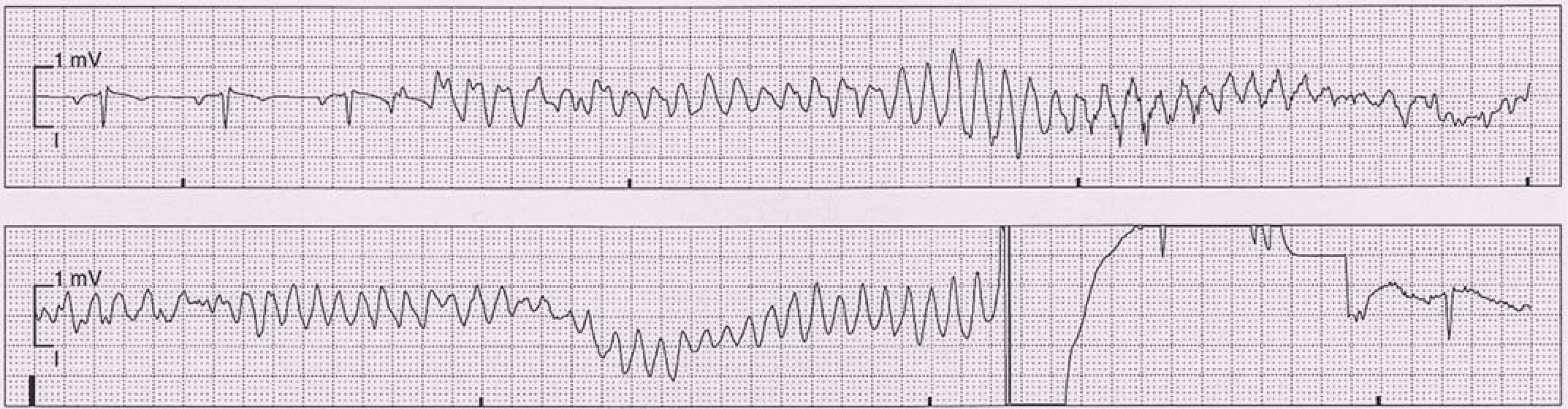
4. Rozdělení KT dle EKG záznamu. Převzato z [17]. ![Rozdělení KT dle EKG záznamu. Převzato z [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/17dcc3c0b7ad5d06b35bc9dfff54b718.jpeg)
Z prognostického hlediska je důležité, zda je přítomno strukturální onemocnění srdce či nikoli. Idiopatické monomorfní KT jsou zpravidla benigní, naopak polymorfní idiopatické KT jsou i při absenci strukturálního onemocnění srdce prognosticky závažnější [2].
Idiopatické monomorfní KT
U pacientů bez strukturálního onemocnění srdce. Tvoří asi 10 % KT v populaci. Mají zpravidla fokální charakter a benigní prognózu [2]. Níže uvedené KT.
Fokální idiopatické KT z výtokového traktu
KT z výtokového traktu (outflow tract ventricular tachycardias – OTVT) zahrnují podskupinu idiopatických KT. Jsou dominantně lokalizovány ve výtokovém traktu pravé komory srdeční (RVOT), a to až v 90 % případů [18]. Manifestují se v mladším věku (mezi 30. a 50. rokem), častěji u žen [2,18]. U většiny postižených dominují palpitace, vzácně dochází k synkopě [18]. V některých případech mohou být zcela asymptomatické [2]. Echokardiografie neprokazuje strukturální onemocnění srdce, na MR srdce však může být přítomen obraz abnormit pravé komory (až v 70 %), např. fokální ztenčení a abnormální pohyb stěn [18].
Charakteristická je frekventní komorová ektopie, kuplety extrasystol z pravé komory, salvy nesetrvalé monomorfní KT s morfologií blokády levého Tawarova raménka a deviací osy vpravo (při původu v RVOT) [20]. Extrasystoly se častěji vyskytují ve dne než v noci, v klidu, po fyzické námaze. Bývají potlačeny sinusovou tachykardií (mohou vymizet při cvičení nebo zátěžovém testu) [18]. U velmi četné ektopie může stav vést až k rozvoji KMP, raritně spouští FK [2].
Terapie
U stabilních pacientů můžeme vyzkoušet efekt betablokátorů, u hemodynamicky kompromitovaných přistupujeme k provedení elektrické kardioverze [20].
U zcela asymptomatických osob nevyžaduje RVOT KT léčbu, u symptomatických pacientů volíme mezi farmakoterapií (betablokátory, verapamil, popř. antiarytmika třídy IA, IC a III) nebo ideálně katetrovou ablací, která má úspěšnost až v 90 % případů (recidiva v 5 %, typicky v 1. roce). Ablace substrátu by měla být zvážena vždy, když je v anamnéze synkopa, rychlá KT a/ nebo četné KES s krátkým vazebným intervalem, tedy potenciálně maligní formy [2,18].
Diferenciálně diagnosticky musíme vyloučit arytmogenní KMP pravé komory (ARVC), která má svůj charakteristický EKG obraz a neterminuje po podání adenozinu (viz dále) [18].
Polymorfní KT u hereditárních arytmických syndromů (kanálopatie)
Primárně poruchy iontových kanálů, kdy nelze prokázat strukturální onemocnění srdce. Syndromy predisponují k NSS [2].
Syndrom dlouhého QT intervalu (kongenitální forma)
Vrozené onemocnění v důsledku mutace genů pro iontové kanály (draslíkové nebo sodíkové), následkem čehož dochází k patofyziologické prolongaci srdeční repolarizace. Ta se projeví na povrchovém EKG prodloužením korigovaného QT intervalu (QTc) – muži > 440 ms, ženy > 460 ms a popř. morfologickými abnormitami vlny T [19]. Syndrom je nejčastěji diagnostikován během prvních tří dekád života, v klinickém obraze dominují synkopy a oběhová zástava [20]. Rozlišujeme 13 základních podtypů (LQT 1–13 dle mutace genů). LQT 1, 2 a 3 je odpovědno za více než 95 % případů [19]. Nositelé jsou ohroženi synkopou, polymorfní KT charakteru torsades de pointes a NSS. Diagnózu může potvrdit genetické vyšetření (vč. stratifikace rizika dle subtypu a vyšetření rodinných příslušníků), to avšak dosahuje pouze asi 70% senzitivity, vyžaduje interpretaci zkušeným odborníkem a je velmi nákladné. Není proto doporučeno asymptomatickým osobám s negativní rodinnou anamnézou a hraničním QTc, naopak je indikováno při vysoké pravděpodobnosti a/ nebo QTc > 500 ms při absenci reverzibilní příčiny [19].
Terapie
Primární léčbu tvoří betablokátory (redukce mortality na hranici 2 %) a v indikovaných případech implantace kardioverter-defibrilátoru (ICD), stejně jako striktní zákaz léků prodlužující QT interval a vyhýbání se kompetitivním sportům [2,19].
Syndrom krátkého QT intervalu
Geneticky podmíněné heterogenní onemocnění charakterizováné zkrácením srdeční repolarizace – QT intervalu (QTc < 330 ms) při současném vyloučení sekundárních příčin (hyperkalcemie, hyperkalemie aj.) [2,21]. Pacienti se syndromem krátkého QT intervalu (SQTS) vykazují prakticky konstantní hodnotu QT intervalu, který se příliš nemění v závislosti na tepové frekvenci [21]. SQTS představuje riziko pro vznik FS a život ohrožujících KA [2,15]. Medián primozáchytu je 30 let, nejčastějším klinickým projevem je srdeční zástava (asi 30 % pacientů), proto je syndrom spjatý s vysokou letalitou [21]. S onemocněním je asociováno pět genů, nicméně výtěžnost genetického screeningu je nízká (asi 20 %) [15]. Pro poměrně vysoké riziko náhlé smrti jsou pacienti většinou indikováni k implantaci ICD [2].
Brugadův syndrom
Hereditární onemocnění s autozomálně-dominantní dědičností s variabilní expresí. Průměrný věk v době manifestace bývá 41 ± 15 let, ale onemocnění se může projevit prakticky kdykoli během života [22]. Postihuje mladé muže (až 6× častěji) [22]. EKG nález zahrnuje (dle podtypu) obraz ST elevací ve svodech V1 – V3 s charakterem bloku pravého Tawarova raménka (obr. 8) [2]. Pacienti s historií KT/ VF a/ nebo synkopy jsou indikováni k implantaci ICD jako metody volby v prevenci NSS [22].
8. EKG obraz Brugadova syndromu – typ I („coved type“) s nahoru vyklenutou ST elevací. 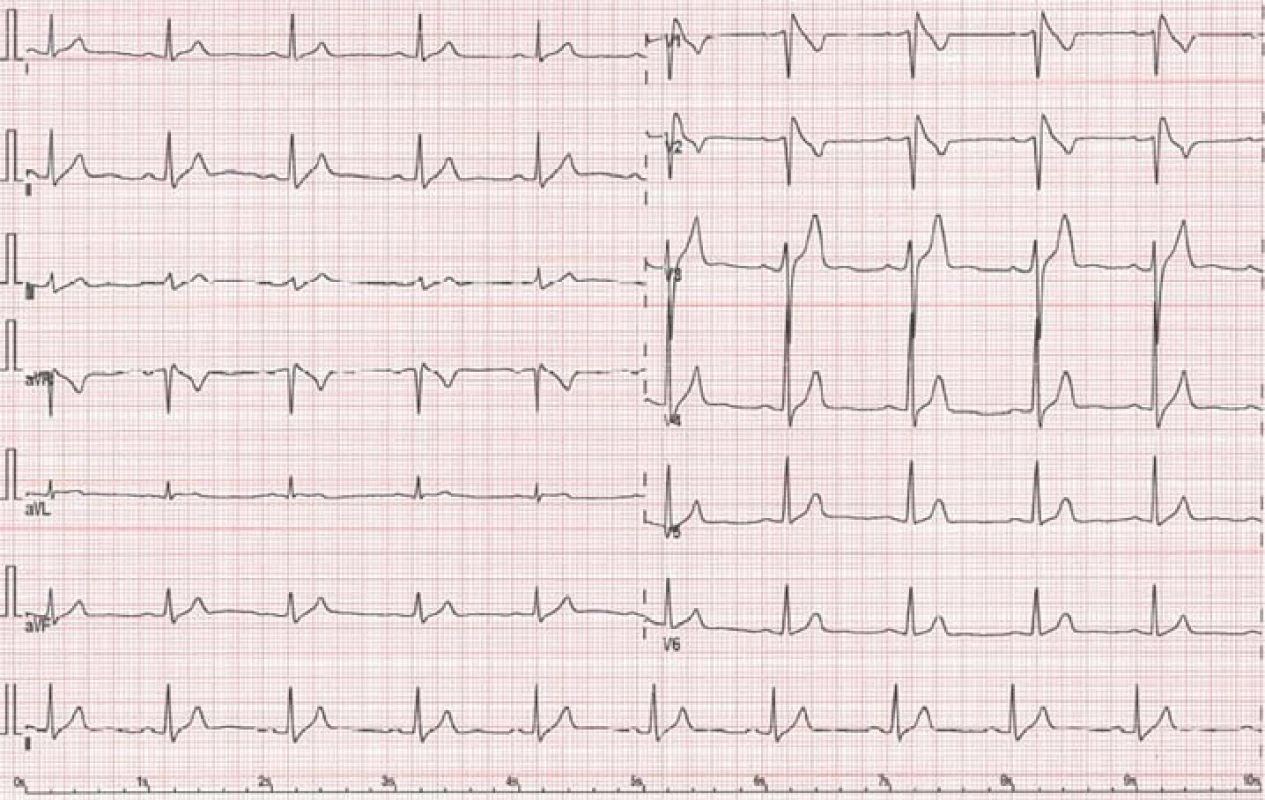
Katecholamin dependentní polymorfní KT
Vzácné vrozené onemocnění manifestující se u dětí polymorfní KT s rizikem přechodu do FK. Katecholamin dependentní polymorfní KT (CPVT) je typicky vázána na zátěž. Až u 30 % může být prvním projevem NSS. Lékem volby jsou betablokátory, v případě synkopy či setrvalé KT implantace ICD [2].
Komorové tachykardie při strukturálním onemocnění srdce
U mladších osob se převážně jedná o arytmie spojené s KMP, ve vyšším věku pak poruchy rytmu v důsledku ischemické choroby srdeční. KT mohou být monomorfní i polymorfní [2]. Vznikají na podkladě všech tří hlavních mechanizmů, tedy abnormální automacií, spouštěnou aktivitou při časné či opožděné následné depolarizaci a na podkladě reentry [16].
Hypertrofická kardiomyopatie
Hypertrofická kardiomyopatie (HKMP) je definována patologickým zesílením stěny levé komory, které není možno vysvětlit abnormálním tlakovým nebo objemovým přetížením. Až v 60 % jde o hereditární onemocnění s autozomálně-dominantní dědičností, způsobené mutací genů pro sarkomery [23]. Fenotypicky bývá vyjádřena u většiny nemocných v období puberty a časné adolescence, to však nemusí být doprovázeno vznikem symptomů [2]. Roční mortalita činní asi 1–2 %, příčinou bývá NSS, srdeční selhání a tromboembolizmus [23]. NSS je mnohdy první manifestací. HKMP je vůbec nejčastější příčinou náhlé smrti osob do 30 let, zvláště závodních sportovců [2]. Substrátem KT jsou neorganizovaně uspořádaná svalová vlákna a intersticiální fibróza [2]. Nejvíce vyjádřenou arytmií pacientů s HKMP je FS (asi u 23 %). Příčinou je zvýšený tlak a velikost levé síně při diastolické dysfunkci levé komory, mitrální regurgitaci a popř. obstrukci LVOT (left ventricular outflow tract) [23]. Léčba pacientů je komplexní a složitá, přesahující rámec této kapitoly. Při rozhodování o implantaci ICD užíváme doporučený skórovací systém Evropské kardiologické společnosti ke stratifikaci 5letého rizika NSS – HCM-Risk-SCD Calculator (volně dostupný z http:/ / www.doc2do.com/ hcm/ webHCM.html). Nelze ho užít u osob mladších 16 let, vrcholových sportovců či osob s metabolickým/ infiltrativním onemocněním myokardu (obr. 9) [23].
9. Indikace k implantaci kardioverter-defi brilátoru dle stratifi kace rizika náhlé srdeční smrti. Upraveno dle [23]. KT – komorová tachykardie, FK – fi brilace komor, ICD – implantabilní kardioverter-defi brilátor, HKMP – hypertrofi cká kardiomyopatie ![Indikace k implantaci kardioverter-defi brilátoru dle stratifi kace rizika náhlé srdeční smrti. Upraveno dle [23]. KT – komorová tachykardie, FK – fi brilace komor, ICD – implantabilní kardioverter-defi brilátor, HKMP – hypertrofi cká kardiomyopatie](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ade539c3aca4014c8f6fe4c761460f76.jpeg)
Arytmogenní kardiomyopatie pravé komory
ARVC je chronická progresivní autozomálně-dědičná KMP s prevalencí 1 : 1 000 až 1 : 5 000 a současně jedna z nejčastějších příčin NSS u jinak zdravých mladých osob (3× častěji muži). Příčinou jsou mutace genů pro desmozomy [24]. Klinicky se manifestuje palpitacemi (75 %), synkopou (30 %), ale také srdeční zástavou v důsledku KA [2,24]. V pozdější fázi může vést k rozvoji srdečního selhání. ARVC charakteristicky postihuje myokard pravé komory, ale nacházíme i biventrikulární nebo dominantně levokomorové postižení myokardu [24]. Podkladem je náhrada myokardu fibro-lipomatózní tkání, to vede k tvorbě zón pomalého vedení vzruchu a anatomických bloků [2]. Ve velké míře postihuje hrot, RVOT a spodní diafragmatickou část pravé komory [1]. Příznačným EKG obrazem je nález vlny epsilon (nízkoamplitudová pozitivní výchylka na konci QRS komplexu ve svodech V1 – V3), nesetrvalé/ setrvalé KT s morfologií bloku levého Tawarova raménka a invertované vlny T v pravých prekordiálních svodech [24]. Pro stanovení diagnózy jsou užívána tzv. malá a velká kritéria. Léčba pacientů je komplexní, zahrnuje farmakologické i nefarmakologické intervence (katetrové ablace, transplantace srdce aj.), u rizikových jedinců přistupujeme k implantaci ICD, event. resynchronizační terapii (CRT-D) [24].
Bradykardie u dětí a mladších dospělých
Bradykardie jsou poruchy srdečního rytmu s poklesem tepové frekvence za základě snížené automacie SA uzlu a/ nebo následkem sinoatriální či atrioventrikulární blokády (AVB) [2,25]. Zajímavou jednotku tvoří kompletní kongenitální atrioventrikulární blokáda (CCAVB) u novorozenců. Příčinou je porucha vývoje převodního systému, popř. systémové onemocnění pojiva matky (průchodem protilátek třídy IgG poškozujících vývoj AV uzlu) [2,25]. Získaná AVB III. stupně (AVB III) mladých osob bývá způsobena myokarditidou (typicky boreliová), nádory nebo poškozením převodního systému při operaci [2]. V případě suspekce na AVB II (typu Mobitz II) nebo AVB III je doporučena EKG Holterovská monitorace.
Indikace ke kardiostimulační terapii jsou v mnohém podobné u mladých i dospělých osob, nicméně je nutné akceptovat fakt, že kardiostimulace u dětí je celoživotní, důsledkem čehož jsou vystaveny vyššímu výskytu dlouhodobých nežádoucích účinků vč. stimulace z neoptimálního místa [26]. Kompletní indikační kritéria k implantaci kardiostimulátorů a resynchronizační terapie u kongenitálních vad, dětí a dospělých lze nalézt v doporučených postupech Evropské kardiologické společnosti [26].
Závěr
Poruchy srdečního rytmu mají u mladších pacientů svá specifika. Z velké části se jedná o arytmie s benigní prognózou – zvláště pak PSVT, nicméně právě v tomto věku se manifestují kardiomyopatie a kanálopatie, jejichž prvním projevem může být maligní KA a NSS. S rozvojem endokardiální biopsie, molekulárně-genetických a zobrazovacích metod dochází postupně k pochopení velmi složité problematiky arytmií. Velkou roli má elektrofyziologické vyšetření srdce, mapování substrátu a možnost kauzálního řešení poruch srdečního rytmu. U indikovaných pacientů přistupujeme dle typu arytmie k implantaci kardiostimulátoru nebo ICD, který snižuje riziko NSS.
Doručeno do redakce: 21. 5. 2018
Přijato po recenzi: 5. 6. 2018
MU Dr. Marek Vícha
www.fnol.cz
marekvicha@gmail.com
Sources
1. Kvasnička J, Havlíček A. Arytmologie pro praxi. Praha: Galén 2010.
2. Táborský M, Kautzner J, Linhart A et al. Kardiologie. Praha: Mladá fronta 2017.
3. Čihák R, Haman L, Táborský M et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Summary of the document prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58: e636 – e683.
4. 2005 American Heart Association Guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Management of symptomatic bradycardia and tachycardia. Circulation 2005; 112: IV67 – IV77. doi: 10.1161/ CIRCULATIONAHA.105.166558.
5. Češka R et al. Interna. 1. vyd. Praha: Triton 2010.
6. Lévy S, Olshansky B. Arrhythmia management for the primary care clinician. Available at: https:/ / www.uptodate.com/ contents/ arrhythmia-management-for-the-primary-care-clinician.
7. The electrocardiogram, ECG. Nobel Media AB 2014. Available at: https:/ / www.nobelprize.org/ educational/ medicine/ ecg/ .
8. Fiala M. Doporučené postupy pro diagnostiku a léčbu supraventrikulárních tachyarytmií. Česká kardiologická společnost. Cor Vasa 2005; 47 (9 Suppl): 18 – 39.
9. Page RL, Joglar JA, Caldwell MA et al. 2015 ACC/ AHA/ HRS Guideline for the management of adult patients with supraventricular tachycardia: executive summary: a report of the American College of Cardiology/ American Heart Association task force on clinical practice guidelines and the Heart Rhythm Society. Circulation 2016; 133(14): e471 – e505. doi: 10.1161/ CIR.0000000000000310.
10. Kettner J, Kautzner J et al. Akutní kardiologie. 2. vyd. Praha: Mladá fronta 2017.
11. Rivera S, De La Paz Ricapito M, Conde D et al. The retrograde P-wave theory: explaining ST segment depression in supraventricular tachycardia by retrograde AV node conduction. Pacing Clin Electrophysiol 2014; 37(9): 1100 – 1105. doi: 10.1111/ pace.12394.
12. Schueler M, Vafaie M, Becker R et al. Prevalence, kinetic changes and possible reasons of elevated cardiac troponin T in patients with AV nodal re-entrant tachycardia. Acute Card Care 2012; 14(4): 131 – 137. doi: 10.3109/ 17482941.2012.741246.
13. Ellis ER, Josephson ME. What about tachycardia-induced Cardiomyopathy? Arrhythm Electrophysiol Rev 2013; 2(2): 82 – 90. doi: 10.15420/ aer.2013.2.2.82.
14. Priori SG, Blomström-Lundqvist C, Mazzanti Aet al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36(41): 2793 – 2867. doi: 10.1093/ eurheartj/ ehv316.
15. Kautzner J, Osmančík P. Summary of the 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Prepared by the Czech Society of Cardiology. Cor Vasa 2016 : 58: e29 – e80.
16. Bytešník J, Pařízek P, Wichterle D et al. Komorové arytmie. Doporučený diagnostický a léčebný postup České kardiologické společnosti. Cor Vasa 2011; 53 (Suppl 1): 53 – 77.
17. Al-Khatib SM, Stevenson WG, Ackerman MJ et al. 2017 AHA/ ACC/ HRS Guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: executive summary: a report of the American College of Cardiology/ American Heart Association task force on clinical practice guidelines and the Heart Rhythm Society. Circulation 2017; pii: CIR.0000000000000548. doi: 10.1161/ CIR.0000000000000548.
18. Brugada J, Diez DP. How to recognise and manage idiopathic ventricular tachycardia. An article from the e-journal of the ESC Council for Cardiology Practice 2010; 8(26). Available at: https:/ / www.escardio.org/ Journals/ E-Journal-of-Cardiology-Practice/ Volume-8/ How-to-recognise-and-manage-idiopathic-ventricular-tachycardia.
19. Aktas M, Daubert P. Long QT syndrome. BMJ Best Practice. Available at: https:/ / bestpractice.bmj.com.
20. Schwartz PJ, Ackerman MJ. Congenital long QT syndrome: Epidemiology and clinical manifestations. Available at: https:/ / www.uptodate.com/ contents/ congenital-long-qt-syndrome-epidemiology-and-clinical-manifestations.
21. Reviriego SM, Merino JL. Short QT Syndrome. An article from the E-Journal of the ESC Council for Cardiology Practice 2010; 9(2). Available at: https:/ / www.escardio.org/ Journals/ E-Journal-of-Cardiology-Practice/ Volume-9/ Short-QT-Syndrome.
22. Mizusawa Y, Wilde A. Brugada syndrome. Circ Arrhythm Electrophysiol 2012; 5(3): 606 – 616. doi: 10.1161/ CIRCEP.111.964577.
23. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733 – 2779. doi: 10.1093/ eurheartj/ ehu284.
24. Haugaa KH, Haland TF, Leren IS et al. Arrhythmogenic right ventricular cardiomyopathy, clinical manifestations, and diagnosis. Europace 2016; 18(7): 965 – 972. doi: 10.1093/ europace/ euv340.
25. Lebl J, Janda J, Pohunek P et al. Klinická pediatrie. 2. vyd. Praha: Galén 2014.
26. Brignole M, Auricchio A, Baron-Esquivias G et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34(29): 2281 – 2329. doi: 10.1093/ eurheartj/ eht150
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 2-
All articles in this issue
- Arrhythmias in young adults
- Prevention of sudden cardiac death in patients up to 40 years of age
- Juvenile hypertension
- Chronic venous insufficiency and varicose veins in young people
- The significance and treatment of dyslipidaemia in young adults
- Diabetes mellitus and cardiovascular disease
- Možnosti ovlivnění inzulinové rezistence u jedinců s diabetem 1. typu
- Clinical study ODYSSEY OUTCOMES
- Oxygen therapy for suspected acute myocardial infarction – DETO2X-AMI
- Fixed dose combination of rosuvastatin and ezetimibe – drug profile
- Management of hypertensive patients with lower extremity peripheral arterial disease
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Arrhythmias in young adults
- Juvenile hypertension
- Fixed dose combination of rosuvastatin and ezetimibe – drug profile
- Chronic venous insufficiency and varicose veins in young people
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

