-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
JAK inhibice v léčbě zánětlivých revmatických onemocnění
JAK inhibition in the treatment of inflammatory rheumatic diseases
The most common immune-mediated inflammatory rheumatic diseases, rheumatoid arthritis, psoriatic arthritis and axial spondyloarthritis and have reached significant advances in recent years with the introduction of biological therapies against cytokines and immune cells, but also against intracellular enzymes, specifically Janus kinases (JAKs). Intracellular JAK signalling is activated by binding of various cytokines or growth factors to the respective cellular receptors, allowing the activation of STAT (Signal Transducers and Activators of Transcription) transcription factors and ultimately the transcription of genes with important roles during the innate and adaptive immune response. Four Janus kinases have been described: JAK1, JAK2, JAK3 and tyrosine kinase-2 (TYK2). Four JAK inhibitors (tofacitinib, baricitinib, upadacitinib and filgotinib) are currently approved for the treatment of rheumatoid arthritis, and some for the treatment of psoriatic arthritis and axial spondyloarthritis. JAK inhibitors have varying selectivity against individual kinases. Some JAK inhibitors are being tested in other rarer systemic connective tissue diseases. The general advantages of JAK inhibitors are oral administration, rapid onset of action, and efficacy in monotherapy. The safety profile of JAK inhibitors compared with biologic therapy appears to be comparable, with a higher incidence of herpes zoster, and an increased incidence of major cardiovascular disease, thromboembolic complications, and cancer in at-risk patients is discussed. The aim of this paper will be to summarize the latest findings on JAK inhibitors in approved indications for the most common rheumatic diseases.
Keywords:
JAK inhibitors – safety profile – immune‑mediated inflammatory rheumatic diseases – intracellular signalling
Autoři: Ladislav Šenolt
Působiště autorů: Revmatologický ústav 1. LF UK, Praha
Vyšlo v časopise: Vnitř Lék 2023; 69(3): 181-188
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2023.031Souhrn
Nejčastější imunitně podmíněná zánětlivá revmatická onemocnění – revmatoidní artritida, psoriatická artritida a axiální spondyloartritida – zaznamenala v posledních letech významný pokrok se zavedením biologické léčby proti cytokinům a imunitním buňkám, ale také proti nitrobuněčným enzymům, konkrétně Janusovým kinázám (JAK). Nitrobuněčná signalizace JAK se aktivuje navázáním různých cytokinů nebo růstových faktorů na příslušné buněčné receptory, umožní se aktivace transkripčních faktorů STAT (Signal Transducers and Activators of Transcription) a finálně transkripce genů s důležitým postavením v průběhu vrozené a získané imunitní odpovědi. Popsány jsou čtyři Janusovy kinázy: JAK1, JAK2, JAK3 a tyrosin kináza-2 (TYK2). V současnosti jsou schválené čtyři JAK inhibitory (tofacitinib, baricitinib, upadacitinib a filgotinib) pro léčbu revmatoidní artritidy, některé pro léčbu psoriatické artritidy a axiální spondyloartritidy. JAK inhibitory mají různou selektivitu proti jednotlivým kinázám. Některé JAK inhibitory jsou zkoušeny u dalších vzácnějších systémových onemocnění pojiva. Obecnou výhodou JAK inhibitorů je perorální podávání, rychlý nástup účinku a účinnost v monoterapii. Bezpečnostní profil JAK inhibitorů v porovnání s biologickou léčbou se zdá být srovnatelný, častěji se vyskytuje herpes zoster, diskutuje se zvýšený výskyt závažných kardiovaskulárních onemocnění, tromboembolických komplikací a nádorů u rizikových pacientů. Cílem této práce bude shrnout nejnovější poznatky o JAK inhibitorech ve schválených indikacích nejčastějších revmatických onemocnění.
Klíčová slova:
JAK inhibitory – bezpečnostní profil – imunitně podmíněná zánětlivá revmatická onemocnění – intracelulární signalizace
Úvod
Léčba imunitně podmíněných zánětlivých revmatických onemocnění, konkrétně revmatoidní artritidy (RA), axiální spondyloartritidy (axSpA) a psoriatické artritidy (PsA), zaznamenala v posledních více než 20 letech nebývalý pokrok (1–3). Hlavními strůjci těchto změn jsou technologický pokrok a nové poznatky v oblasti imunopatogeneze. Klíčovou roli v patogenezi imunitně podmíněných zánětlivých onemocnění hrají imunitní buňky a jimi produkované cytokiny, které se již v řadě případů staly léčebným cílem (4). Mezi nejčastěji využívané biologické léky patří monoklonální protilátky namířené proti tumor nekrotizujícímu faktoru (TNF), k dispozici jsou i protilátky nebo rekombinantní proteiny proti interleukinu (IL)-1, IL-6, IL-12/23, IL-17 nebo IL-23; včetně biologických léků zasahujících na úrovni B‑lymfocytů a T‑lymfocytů. Velká pozornost se v posledních letech věnuje inhibitorům Janusových kináz (JAK), inovativním léčivým přípravkům, které budou v kontextu imunitně podmíněných zánětlivých revmatických onemocnění blíže popsány v tomto přehledovém článku.
Co jsou a jak fungují Janusovy kinázy?
JAK kináza byla poprvé popsána na počátku 90. let minulého století jako jedna z mnoha objevených kináz a zkratka JAK sloužila jako akronym pro „Just Another Kinase“ (5). Její název byl ale původně určen na podkladě podobnosti dvou homologických kinázových domén pojmenovaných podle římského boha dvou tváří Januse (6). Zpočátku nebyla úloha JAK známa a jejich role jako souboru nitrobuněčných enzymů byla odhalena později. Popsány byly čtyři JAK kinázy – JAK1, JAK2, JAK3 a tyrosin kináza 2 (TYK2), které tvoří homodimery nebo heterodimery, jejichž fosforylace umožňuje aktivaci transkripčních faktorů STAT (Signal Transducers and Activators of Transcription). Nitrobuněčná signalizační kaskáda JAK/STAT se aktivuje navázáním cytokinů nebo růstových faktorů na příslušné buněčné receptory, výsledkem je dimerizace a fosforylace JAK, což umožní navázání transkripčního faktoru STAT k cytoplazmatickému konci receptorového komplexu. Transkripčních faktorů STAT je popsáno sedm, což se podílí na rozličnosti imunitních reakcí. Vazbou na receptorový komplex se STAT aktivuje a následně uvolňuje z komplexu s JAK kinázou, vytváří STAT dimer a přesouvá se do jádra, kde spouští transkripci genů s důležitým postavením v průběhu vrozené a získané imunitní odpovědi (Obr. 1) (7).
Obr. 1. Schematická znázornění mechanismu účinku nitrobuněčné signalizace pomocí Janusovy kinázy (upraveno podle 7) 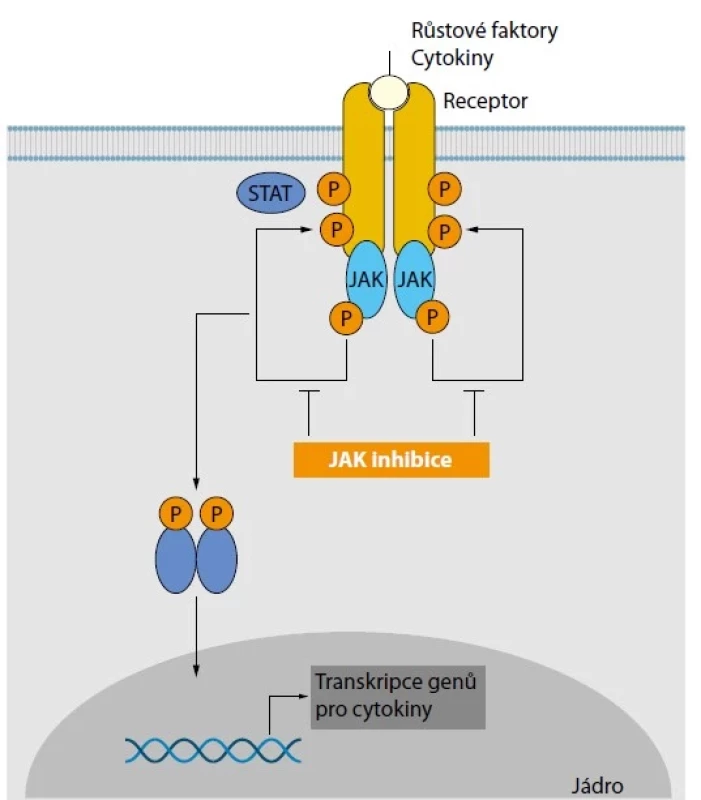
JAK – Janusova kináza; STAT – Signal Transducer and Activator of Transcription Úloha JAK v aktivaci imunitních pochodů
V závislosti na přítomnosti cytokinů jsou aktivovány různé JAK kinázy a spouští odlišné kaskády nitrobuněčných reakcí imunitních buněk (Obr. 2) (8).
Obr. 2. Janusovy kinázy a jejich inhibitory v regulaci zánětu a imunitní odpovědi (upraveno podle 8) 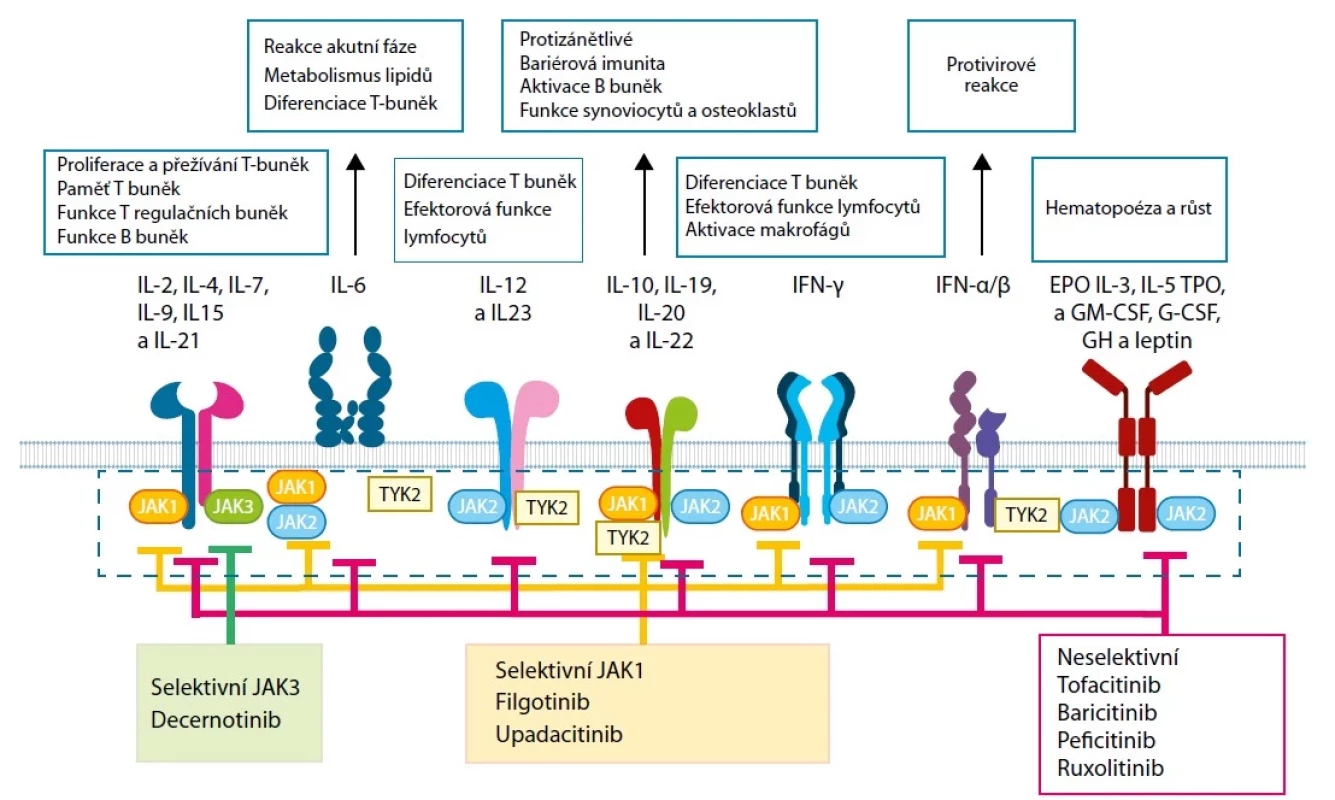
Vysvětlivky: EPO – erytropoetin; GH – růstový hormon; G-CSF – faktor stimulující kolonie granulocytů; GM-CSF – faktor stimulující kolonie granulocytů a makrofágů; IL – interleukin; IFN – interferon; TPO – trombopoetin; TYK – tyrozinkináza. JAK1 je tvořena převážně lymfoidními buňkami. Po navázání cytokinu na receptor se váže na β podjednotku cytokinového receptoru a přispívá k dimerizaci JAK1 s jednotlivými členy JAK rodiny v závislosti na typu imunitní reakce a přítomnosti jednotlivých cytokinů. Dimerizace JAK1 s JAK2 zprostředkovává signalizaci IL-6 a interferonu‑γ (IFN‑γ), JAK1 s TYK2 zprostředkovává přenos signálu IFN‑α/ β. JAK2 homodimer je odpovědný za signalizaci hematopoetických růstových faktorů, zejména erytropoetinu a trombopoetinu, nebo faktoru stimulujícího granulocytární a makrofágové kolonie (GM‑CSF). JAK3 je tvořen lymfocyty, ale i buňkami myeloidní řady, a aktivuje se cytokiny využívajícími společný γ‑řetězec (IL-2, IL-4, IL-7, IL-9, IL-15 a IL-21). JAK3 obvykle vytváří heterodimer s JAK1 a hraje klíčovou roli při aktivaci lymfocytů. Tyk2 může dimerizovat s ostatními JAK a je mimo jiné odpovědná za signalizaci IL-12, IL-23, IL-6, IL-10 nebo IFN‑α/ β. JAK kinázy tak mají klíčové postavení při vývoji a fungování buněk imunitního systému a jejich ovlivnění si získává důležité postavení v léčbě imunitně podmíněných zánětlivých onemocnění (9).
JAK inhibitory u zánětlivých revmatických onemocnění
U zánětlivých revmatických onemocnění nastal zlom v terapii objevem biologické léčby. Biologické léky mají velkou molekulovou hmotnost a jsou aplikovány subkutánně, některé přípravky intravenózně, kdežto JAK inhibitory jsou cíleně působící malé syntetické molekuly, které mají výhodu perorálního podávání. JAK inhibitory, někdy nazývané jakiniby, jednoduše přestupují do nitra buňky a mají schopnost specificky tlumit konkrétní nitrobuněčný enzym, a tím zamezit přenosu signálu od cytokinových receptorů až po regulaci genové exprese ovlivňující prozánětlivou buněčnou aktivitu (10). JAK inhibitory našly své využití kromě některých revmatických onemocnění např. u myeloproliferativních neoplazií, psoriázy, atopické dermatitidy, alopecie areata nebo u idiopatických střevních zánětů.
Revmatologové mají k dispozici čtyři JAK inhibitory, které jsou schváleny pro léčbu RA, některé jsou schváleny i pro léčbu PsA a axSpA, a několik dalších JAK inhibitorů je testováno v různých fázích klinického hodnocení i pro jiné diagnózy (Tabulka 1). Tofacitinib byl jako první neselektivní JAK inhibitor schválen pro léčbu RA americkým Úřadem pro kontrolu potravin a léčiv (FDA) již v roce 2012, o pět let později i Evropskou lékovou agenturou (EMA) a později byl schválen i pro léčbu PsA a axSpA. Směr dalšího vývoje se ubíral k přípravkům s větší selektivitou vůči jednotlivým podjednotkám JAK ve snaze vyvinout přípravky s lepším poměrem účinnosti a bezpečnosti (11). Druhým schváleným přípravkem pro léčbu RA je baricitinib, selektivní inhibitor JAK1/2, který je schválen pro léčbu RA. Tyto přípravky se někdy označují jako JAK inhibitory první generace (12). Mezi inhibitory s větší selektivitou proti JAK-1, které ale také vykazují minimální aktivitu vůči ostatním kinázám JAK rodiny, patří upadacitinib a filgotinib (13).
Tab. 1. Přehled vybraných inhibitorů Janusových kináz schválených nebo ve vývoji pro léčbu imunitně podmíněných zánětlivých revmatických onemocnění 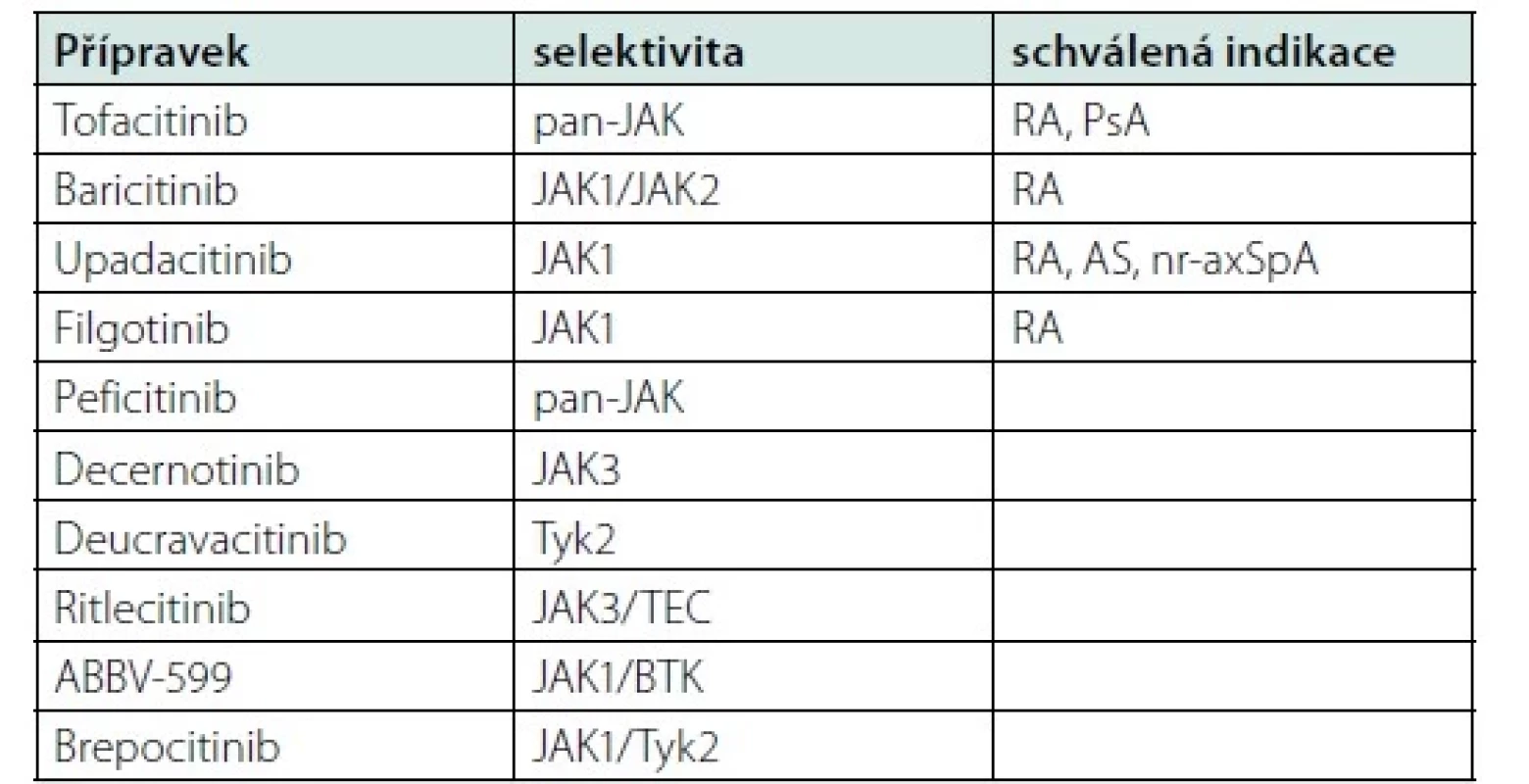
RA – revmatoidní artritida; PsA – psoriatická artritida; AS – ankylozující spondylitida; nr-axSpA – neradiografická axiální spondyloartritida JAK inhibitory v léčbě revmatoidní artritidy
Revmatoidní artritida (RA) je chronické autoimunitní onemocnění pohybového aparátu postihující destruktivní synovitidou periferní klouby, které bývají ztuhlé, bolestivé a nateklé, mohou vznikat kloubní deformity, ale také řada extra‑artikulárních projevů. Základem léčby je většinou methotrexát, glukokortikoidy se doporučuje podávat krátkodobě nebo intraartikulárně. V případě středně vysoké a vysoké aktivity onemocnění je v případě selhání základní léčby doporučována biologická terapie nebo JAK inhibitory (14).
JAK inhibitory prošly rozsáhlým klinickým programem u širokého spektra pacientů s RA, zkoušeny byly v časné fázi onemocnění ještě neléčeného methotrexátem, až po pacienty s nedostatečným účinkem nebo intolerancí základních syntetických chorobu modifikujících přípravků (methotrexát, leflunomid nebo sulfasalazin), i biologické léčby včetně TNF inhibitorů (15). Výhodou JAK inhibitorů je poměrně rychlý nástup účinku, účinnost v monoterapii a slušná účinnost v případě obtížně léčitelného onemocnění.
Nástup účinku lze pozorovat obvykle kolem 1–2 týdnů s maximem dosaženého účinku do 3 měsíců od zahájení léčby. Klinický účinek je většinou setrvalý, lepší než po methotrexátu, a je buď srovnatelný (non‑inferiorní), nebo lepší (superiorní) v porovnání s TNF inhibitory. Kromě klinické aktivity nemoci působí JAK inhibitory pozitivně na pacientem udávané potíže, jakými jsou např. funkční schopnost, bolest, ranní ztuhlost, únava nebo spánek (16, 17). JAK inhibitory v porovnání s methotrexátem významně tlumí rentgenovou progresi, podobně jako TNF inhibitory.
Pro celou skupinu JAK inhibitorů lze pozorovat dobrou účinnost v monoterapii. Podle doporučených léčebných postupů České revmatologické společnosti je možné JAK inhibitory nasadit v případě středně vysoké až vysoké aktivity při selhání základní léčby, nejčastěji methotrexátu (14). Při jejich nasazení se doporučuje přidání k základní léčbě, ale při její nevhodnosti nebo intoleranci lze považovat monoterapii JAK inhibitory za výhodnou alternativu, podobně jako inhibitory receptoru IL-6. V České republice se však liší úhrada od doporučených postupů – pro nasazení JAK inhibitorů je vyžadována vysoká aktivita onemocnění a kromě baricitinibu je k úhradě nezbytné selhání alespoň jednoho biologického léku.
Nedávno bylo zjištěno, že při nasazení jakinibu (upadacitinib) ve druhé linii, tedy u RA pacientů s předchozím selháním biologické léčby, dosáhl větší podíl pacientů remise na upadacitinibu v porovnání s abataceptem, biologickým lékem ovlivňujícím kostimulaci T‑lymfocytů (18). Počet předchozích biologických léků je většinou spjat s poklesem účinnosti následného biologického přípravku, ale ve studiích byl prokázán podobný účinek JAK inhibitorů i při selhání většího počtu předchozích biologických přípravků, což je pravděpodobně důvodem k jejich častějšímu nasazení u jedinců s obtížně léčitelnou formou onemocnění (19). Při selhání biologického léku, konkrétně TNF nebo IL-6 inhibitoru, je doporučeno změnit na lék s jiným mechanismem účinku nebo na přípravek ze stejné skupiny (20). Současná data z evropských registrů ukazují, že i po selhání prvního JAK inhibitoru je změna na další JAK inhibitor (tzv. cycling) podobně účinná jako přechod na biologický lék (tzv. swapping) (21).
JAK inhibitory v léčbě psoriatické artritidy
Psoriatická artritida může mít podobné klinické projevy jako RA, postižení je polyartikulární, ale v některých případech mohou být na rozdíl od RA zasaženy i distální interfalangeální klouby, někdy je průběh oligoartikulární, vzácně až mutilující. Bolestivé otoky kloubů jsou zpravidla provázeny přítomností kožních nebo nehtových psoriatických lézí. U mírné formy onemocnění se podávají nesteroidní antirevmatika (NSA), lokálně aplikované glukokortikoidy a v případě zasažení více kloubů pak methotrexát. V případě selhání tohoto postupu jsou k dispozici biologické léky. Protože v patogenezi psoriatické artritidy hraje zásadní roli kromě TNF i cytokinová osa IL-23/IL-17, která je spjata s aktivací signalizační dráhy JAK/STAT (22), jsou v léčbě kromě TNF inhibitorů využívány i přípravky zasahující na úrovni IL-17, IL-12/IL-23 nebo IL-23, ale také JAK.
Pro léčbu psoriatické artritidy jsou v současnosti schváleny dva přípravky ze skupiny JAK inhibitorů – tofacitinib a upadacitinib. Výhodou JAK inhibitorů je podobně jako u RA poměrně rychlý nástup účinku, účinnost v monoterapii a poměrně slušný účinek na periferní projevy onemocnění (artritida, entezitida, daktylitida), ovlivnění psoriázy je v porovnání s dostupnými biologickými léky méně účinné.
Oba přípravky byly ve dvou studiích třetí fáze klinického hodnocení zkoušeny u pacientů s aktivní psoriatickou artritidou, kteří neměli dostatečnou odpověď buď na alespoň jeden základní lék, nejčastěji methotrexát, nebo na biologickou léčbu (23–28). Tofacitinib i upadacitinib vykazovaly lepší účinek než placebo na projevy periferní artritidy, entezitidy, daktylitidy i psoriázy, a byly podobně účinné jako TNF inhibitor adalimumab. Tofacitinib měl numericky nižší účinnost na psoriázu (23) a upadacitinib byl více účinný při užití vyšší dávky a vykazoval častěji zhojení entezitidy, menší intenzitu bolesti a funkčního postižení než léčba adalimumabem (24). Pozitivní výsledky studie s JAK inhibitory byly popsány i u pacientů po selhání biologické léčby (25, 26). Po roce léčby nemělo strukturální progresi nemoci více než 90 % pacientů (27, 28). Podle evropských doporučených postupů jsou tofacitinib a upadacitinib schváleny pro léčbu pacientů s psoriatickou artritidou a nedostatečnou odpovědí na alespoň jeden základní a jeden biologický lék nebo v případech, pokud je podávání biologické léčby nevhodné (29). Pracovní skupina pro výzkum a hodnocení lupénky a psoriatické artritidy (GRAPPA) vydala v současnosti doporučené léčebné postupy, které navrhují léčbu podle aktivity konkrétních domén psoriatického onemocnění v kontextu sdíleného rozhodování s přihlédnutím k mimokloubním projevům a relevantním komorbiditám (30).
JAK inhibitory v léčbě axiální spondyloartritidy
Axiální spondyloartritida ve své rozvinuté formě (ankylozující spondylitida) postihuje častěji muže a projevuje se bolestmi dolních zad s maximem v nočních a ranních hodinách. Nezřídka jsou kromě postižení sakroiliakálních (SI) kloubů a páteře postiženy velké klouby, přítomna může být koxitida nebo hydrops kolenního kloubu, častá je také entezitida Achillovy šlachy. Velká část pacientů může mít uveitidu nebo psoriázu, méně často idiopatický střevní zánět. V případě čistě axiálního postižení jsou lékem první volby NSA, pokud je onemocnění aktivní, jsou doporučeny anticytokinové léky proti TNF nebo IL-17, případně JAK inhibitory, se kterými je v léčbě axSpA zatím méně zkušeností.
Časná fáze klinického zkoušení s tofacitinibem u pacientů s radiografickou axSpA (ankylozující spondylitidou) prokázala dobrý klinický účinek, a to zejména u pacientů se zvýšenými reaktanty zánětu nebo aktivní sakroiliitidou na magnetické rezonanci (31). Ve třetí fázi klinického hodnocení měl tofacitinib u pacientů s radiografickou axSpA, u kterých selhala alespoň dvě NSA, lepší účinek ve všech sledovaných klinických parametrech než placebo (32). Klinicky významný účinek byl popsán i v kontextu bolesti, únavy, funkčního postižení a práceschopnosti (33). Stejně tak byla míra odpovědi lepší na upadacitinibu než na placebu, a bylo pozorováno významné zlepšení klinické odpovědi, včetně bolesti zad, funkčních parametrů, pokles systémového zánětu a zmírnění projevů lokálního zánětu na magnetické rezonanci páteře a SI kloubů (34).
Nástup účinku odlišující JAK inhibitory od placeba byl rychlý a byl také pozorován již po 2 týdnech. Prokázána byla setrvalá účinnost upadacitinibu a významné zpomalení strukturální progrese na páteři během 2letého sledování (35). Pozitivní účinek upadacitinibu byl prokázán i u pacientů s neradiografickou axSpA, tedy relativně časnou fází onemocnění, což posloužilo k registraci přípravku v této indikaci (36). Podle nejnovějších evropských doporučených postupů jsou JAK inhibitory schváleny pro léčbu pacientů s radiografickou axSpA na stejné úrovni jako TNF inhibitory a IL-17 inhibitory, ačkoliv jsou na podkladě větší zkušenosti preferovány anticytokinové léky (37). Pro neradiografickou formu onemocnění je v současnosti schválen z JAK inhibitorů pouze upadacitinib.
Nežádoucí účinky JAK inhibitorů
Bezpečnost JAK inhibitorů je obecně srovnatelná s biologickými přípravky, ale určité rozdíly lze pozorovat např. v četnějším výskytu herpes zoster, kardiovaskulárních onemocnění, tromboembolických komplikací a některých laboratorních abnormalit po léčbě JAK inhibitory.
Při léčbě JAK inhibitory, podobně jako při biologické léčbě, jsou častější běžné infekce, většinou respiračního a močového traktu. Protože JAK signalizační kaskádu využívá interferonová aktivita, jsou v porovnání s TNF inhibitory při léčbě jakiniby častější virové infekce (38). Herpes zoster se vyskytuje na JAK inhibitorech přibližně dvakrát častěji, a to zejména u starších pacientů, při souběžném užívání glukokortikoidů a methotrexátu. Před léčbou JAK inhibitory je proto vhodné rizikovým pacientům doporučit očkování proti herpes zoster, ideálně vakcínou Shingrix, která však není hrazena z veřejného zdravotního pojištění. Vážné a oportunní infekce jsou častější, podobně jako při biologické léčbě, ale jejich výskyt je celkově velmi nízký, méně než 0,5 případu na 100 pacientoroků (39). Tuberkulóza je velmi vzácná, vyskytuje se méně často než při léčbě TNF inhibitory.
V důsledku systémového zánětu a zvýšené přítomnosti tradičních rizikových faktorů mají revmatičtí pacienti zvýšené riziko tromboembolických příhod a kardiovaskulárních onemocnění (40, 41). Výskyt hluboké žilní trombózy a plicní embolie se objevil v průběhu klinického zkoušení JAK inhibitorů první generace jako varovný signál a v postmarketingové studii ORAL Surveillance se u pacientů s aktivní RA starších 50 let a s přítomností alespoň jednoho kardiovaskulárního rizikového faktoru prokázal častější výskyt závažných kardiovaskulárních, infekčních i nádorových onemocnění při léčbě tofacitinibem ve srovnání s adalimumabem (42). Naopak rozsáhlá 5letá observační studie z amerického registru poukazovala u pacientů s RA na srovnatelné riziko hluboké žilní trombózy při léčbě JAK inhibitory a TNF inhibitory (43), ale švédská recentní komparativní studie častější výskyt tromboembolických komplikací potvrdila (44). Přestože dosud není jasné, zda se jedná o skupinový efekt všech JAK inhibitorů, není v současné době doporučováno podávat JAK inhibitory lidem nad 65 let, kuřákům a pacientům s přítomností kardiovaskulárních nebo nádorových rizikových faktorů.
U pacientů léčených JAK inhibitory nebylo popsáno zvýšené riziko gastrointestinální perforace, ale protože ovlivnění signalizace IL-6 toto riziko zvyšuje, je třeba zvýšené opatrnosti u rizikových pacientů s divertikulitidou, u jedinců vyššího věku a při užívání glukokortikoidů (38).
Léčba JAK inhibitory bývá provázena změnami některých laboratorních parametrů, nejčastěji můžeme pozorovat klinicky nevýznamný pokles hemoglobinu, trombocytů a leukocytů. Klinicky významné anémie jsou vzácné a pokles lymfocytů a neutrofilních leukocytů nemá vztah k vyššímu riziku infekce. Podobně jako biologické léky zaměřené proti IL-6 přispívají JAK inhibitory ke zvýšení sérových hladin LDL‑cholesterolu, HDL‑cholesterolu, nebo triglyceridů, poměr LDL : HDL však narušen nebývá. Zvýšené hladiny transamináz a kreatinkinázy většinou nebývají klinicky významné.
Závěr
JAK inhibitory představují novou generaci léčivých přípravků pro několik zánětlivých imunitně podmíněných, a nejenom revmatických, onemocnění. V léčbě revmatoidní artritidy mají JAK inhibitory účinnost srovnatelnou nebo i lepší než některé biologické léky. U psoriatické artritidy a axiální spondyloartritidy jsou zkušenosti menší a při selhání základní léčby je v první linii většinou dávána přednost biologickým lékům. Mezi nesporné výhody JAK inhibitorů patří možnost perorálního podávání, rychlý nástup účinku a dobrá účinnost v monoterapii.
V revmatologii jsou schváleny čtyři přípravky pro léčbu revmatoidní artritidy, některé také pro léčbu psoriatické artritidy a axiální spondyloartritidy, tedy pro nejčastější zánětlivá revmatická onemocnění. Některé jsou zkoušeny v různých fázích klinických hodnocení pro další vzácnější zánětlivá revmatická onemocnění, např. systémový lupus erythematodes, Sjögrenův syndrom, vaskulitidy, systémovou sklerodermii nebo idiopatické zánětlivé myopatie (45). V pokročilé fázi výzkumu je např. deucravacitinib, vysoce selektivní inhibitor Tyk2, u psoriázy a psoriatické artritidy (46). Ve snaze zesílit účinnost jsou zkoušeny kombinované kinázové inhibitory, např. Jak1 s Tyk2, TEC kinázou nebo Bruton tyrosinkinázou (BTK).
Bezpečnostní profil, včetně kardiovaskulárních příhod, se u JAK inhibitorů v porovnání s biologickou léčbou zdá být srovnatelný, má však svá specifika (47). Častěji se např. vyskytuje herpes zoster a u starších jedinců s ischemickou chorobu srdeční a kuřáků není tato léčba vhodná. Budoucí výzkum a data z registrů by měly objasnit, zda JAK inhibitory, včetně selektivnějších přípravků, mají v kontextu závažných kardiovaskulárních onemocnění, tromboembolických komplikací a nádorů lepší bezpečnostní profil.
Poděkování: tato práce byla podpořena projektem Ministerstva zdravotnictví ČR pro koncepční rozvoj výzkumné organizace 023728
Článek přijat redakcí: 22. 2. 2023
Článek přijat po recenzích: 13. 3. 2023
prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav, 1. LF UK Praha
Zdroje
1. Smolen JS, Aletaha D, Barton A, et al. Rheumatoid arthritis. Nat Rev Dis Primers. 2018;4 : 18001.
2. Coates LC, Soriano ER, Corp N, et al. GRAPPA Treatment Recommendations domain subcommittees. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol. 2022;18(8):465-479.
3. Danve A, Deodhar A. Treatment of axial spondyloarthritis: an update. Nat Rev Rheumatol. 2022;18(4):205-216.
4. Senolt L. Emerging therapies in rheumatoid arthritis: focus on monoclonal antibodies. F1000Res. 2019 Aug 30;8:F1000.
5. Briscoe J, Guschin D, Müller M. Signal transduction. Just another signalling pathway. Curr Biol. 1994;4 : 1033-5.
6. Shuai K, Ziemiecki A, Wilks AF, et al. Polypeptide signalling to the nucleus through tyrosine phosphorylation of Jak and Stat proteins. Nature. 1993;366 : 580-3.
7. Yamaoka K, Saharinen P, Pesu M, et al. The Janus kinases (Jaks). Genome Biol. 2004;5 : 253.
8. Schwartz DM, Kanno Y, Villarino A, et al. JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nat Rev Drug Discov. 2017;16(12):843-862.
9. McLornan DP, Pope JE, Gotlib J, Harrison CN. Current and future status of JAK inhibitors. Lancet. 2021;398(10302):803-816.
10. Tanaka Y, Luo Y, O‘Shea JJ, Nakayamada S. Janus kinase‑targeting therapies in rheumatology: a mechanisms‑based approach. Nat Rev Rheumatol. 2022 Mar;18(3):133-145.
11. Westhovens R. Clinical efficacy of new JAK inhibitors under development. Just more of the same? Rheumatology (Oxford). 2019;58(Suppl 1):i27-i33.
12. Taylor PC. Clinical efficacy of launched JAK inhibitors in rheumatoid arthritis. Rheumatology (Oxford). 2019;58(Suppl 1):i17-i26.
13. Biggioggero M, Becciolini A, Crotti C, Agape E, Favalli EG. Upadacitinib and filgotinib: the role of JAK1 selective inhibition in the treatment of rheumatoid arthritis. Drugs Context. 2019;8 : 212595.
14. Šenolt L, Mann H, Závada J, Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017. Česká revmatologie. 2017;25(1):3-18.
15. Taylor PC. Clinical efficacy of launched JAK inhibitors in rheumatoid arthritis. Rheumatology (Oxford). 2019;58(Suppl 1):i17-i26.
16. Strand V, Lee EB, Fleischmann R, et al. Tofacitinib versus methotrexate in rheumatoid arthritis: patient‑reported outcomes from the randomised phase III ORAL Start trial. RMD Open 2016;2:e000308.
17. Keystone EC, Taylor PC, Tanaka Y, et al. Patient‑reported outcomes from a phase 3 study of baricitinib versus placebo or adalimumab in rheumatoid arthritis: secondary analyses from the RA‑BEAM study. Ann Rheum Dis 2017;76 : 1853_61.
18. Rubbert‑Roth A, Enejosa J, Pangan AL, et al. Trial of Upadacitinib or Abatacept in Rheumatoid Arthritis. N Engl J Med. 2020 Oct 15;383(16):1511-1521.
19. Ochi S, Sonomoto K, Nakayamada S, Tanaka Y. Preferable outcome of Janus kinase inhibitors for a group of difficult‑to‑treat rheumatoid arthritis patients: from the FIRST Registry. Arthritis Res Ther. 2022;24(1):61.
20. Smolen JS, Landewé RBM, Bergstra SA, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2022 update. Ann Rheum, DiS. 2023;82(1):3-18.
21. Pombo‑Suarez M, Sanchez‑Piedra C, Gómez‑Reino J, et al. After JAK inhibitor failure: to cycle or to switch, that is the question – data from the JAK‑pot collaboration of registries. Ann Rheum, DiS. 2023 Feb;82(2):175-181.
22. Raychaudhuri SK, Abria C, Raychaudhuri SP. Regulatory role of the JAK STAT kinase signalling system on the IL-23/IL-17 cytokine axis in psoriatic arthritis. Ann Rheum, DiS. 2017;76(10):e36.
23. Mease P, Hall S, FitzGerald O, et al. Tofacitinib or Adalimumab versus Placebo for Psoriatic Arthritis. N Engl J Med. 2017;377(16):1537-1550.
24. McInnes IB, Anderson JK, Magrey M, et al. Trial of Upadacitinib and Adalimumab for Psoriatic Arthritis. N Engl J Med. 2021;384(13):1227-1239.
25. Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. N Engl J Med. 2017;377(16):1525-1536.
26. Mease PJ, Lertratanakul A, Anderson JK, et al. Upadacitinib for psoriatic arthritis refractory to biologics: SELECT‑PsA 2. Ann Rheum, DiS. 2020;80(3):312-20.
27. van der Heijde D, Gladman DD, FitzGerald O, et al. Radiographic Progression According to Baseline C‑reactive Protein Levels and Other Risk Factors in Psoriatic Arthritis Treated with Tofacitinib or Adalimumab. J Rheumatol. 2019;46(9):1089-1096.
28. McInnes IB, Kato K, Magrey M, et al. Upadacitinib in patients with psoriatic arthritis and an inadequate response to non‑biological therapy: 56-week data from the phase 3 SELECT‑PsA 1 study. RMD Open. 2021;7(3):e001838.
29. Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum, DiS. 2020;79(6):700-712.
30. Coates LC, Soriano ER, Corp N, et al. GRAPPA Treatment Recommendations domain subcommittees. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol. 2022;18(8):465-479
31. Maksymowych WP, van der Heijde D, Baraliakos X, et al. Tofacitinib is associated with attainment of the minimally important reduction in axial magnetic resonance imaging inflammation in ankylosing spondylitis patients. Rheumatology (Oxford). 2018;57(8):1390 - 1399.
32. Deodhar A, Sliwinska‑Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double‑blind, placebo‑controlled study. Ann Rheum, DiS. 2021;80(8):1004-1013.
33. Navarro‑Compán V, Wei JC, Van den Bosch F, et al. Effect of tofacitinib on pain, fatigue, health‑related quality of life and work productivity in patients with active ankylosing spondylitis: results from a phase III, randomised, double‑blind, placebo‑controlled trial. RMD Open. 2022;8(2):e002253.
34. van der Heijde D, Song IH, Pangan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT‑AXIS 1): a multicentre, randomised, double‑blind, placebo‑controlled, phase 2/3 trial. Lancet. 2019 Dec 7;394(10214):2108-2117.
35. van der Heijde D, Deodhar A, Maksymowych WP, et al. Upadacitinib in active ankylosing spondylitis: results of the 2-year, double‑blind, placebo‑controlled SELECT‑AXIS 1 study and open‑label extension. RMD Open. 2022;8(2):e002280.
36. Deodhar A, Van den Bosch F, Poddubnyy D, et al. Upadacitinib for the treatment of active non‑radiographic axial spondyloarthritis (SELECT‑AXIS 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet. 2022;400(10349):369-379.
37. Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS‑EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum, DiS. 2023;82(1):19-34.
38. Harigai M. Growing evidence of the safety of JAK inhibitors in patients with rheumatoid arthritis. Rheumatology (Oxford). 2019;58(Suppl 1):i34-i42.
39. Riley TR, George MD. Risk for infections with glucocorticoids and DMARDs in patients with rheumatoid arthritis. RMD Open. 2021;7(1):e001235.
40. Blum A, Adawi M. Rheumatoid arthritis (RA) and cardiovascular disease. Autoimmun Rev 2019;18(7):679–90.
41. Molander V, Bower H, Frisell T, Askling J. Risk of venous thromboembolism in rheumatoid arthritis, and its association with disease activity: a nationwide cohort study from Sweden. Ann Rheum, DiS. 2021 Feb;80(2):169-175.
42. Ytterberg SR, Bhatt DL, Mikuls TR, et al; ORAL Surveillance Investigators. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med. 2022;386(4):316-326.
43. Desai RJ, Pawar A, Weinblatt ME, Kim SC. Comparative Risk of Venous Thromboembolism in Rheumatoid Arthritis Patients Receiving Tofacitinib Versus Those Receiving Tumor Necrosis Factor Inhibitors: An Observational Cohort Study. Arthritis Rheumatol. 2019;71(6):892-900.
44. Molander V, Bower H, Frisell T, Delcoigne B, Di Giuseppe D, Askling J; ARTIS study group. Venous thromboembolism with JAK inhibitors and other immune‑modulatory drugs: a Swedish comparative safety study among patients with rheumatoid arthritis. Ann Rheum, DiS. 2023;82(2):189-197.
45. Benucci M, Bernardini P, Coccia C, et al. JAK inhibitors and autoimmune rheumatic diseases. Autoimmun Rev. 2023 Jan 14;22(4):103276.
46. Mease PJ, Deodhar AA, van der Heijde D, et al. Efficacy and safety of selective TYK2 inhibitor, deucravacitinib, in a phase II trial in psoriatic arthritis. Ann Rheum, DiS. 2022;81(6):815-822.
47. Frisell T, Bower H, Morin M, et al. ARTIS Study group. Safety of biological and targeted synthetic disease‑modifying antirheumatic drugs for rheumatoid arthritis as used in clinical practice: results from the ARTIS programme. Ann Rheum, DiS. 2023:ard-2022-223762. doi: 10.1136/ard-2022-223762. Epub ahead of print.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperační péče o pacienta s multimorbiditou
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
- Specifika diagnostiky a léčby multimorbidních pacientů
- JAK inhibice v léčbě zánětlivých revmatických onemocnění
- Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
- Diferenciální diagnostika intersticiálních plicních procesů
- Novinky v gastroenterologii, hepatologii a digestivní endoskopii
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika intersticiálních plicních procesů
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



