-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Primární synoviální sarkom srdce klinicky napodobující SARS‑CoV- 2 asociovanou perikarditidu
Primary cardiac synovial sarcoma mimicking SARS-CoV-2 associated pericarditis
Primary cardiac synovial sarcoma is an extremely rare tumor with a higher incidence in young men. The mean age of occurrence is 32 years. Synovial sarcomas are tumors with high aggressiveness, proliferate rapidly and metastasize to regional and distant lymph nodes or surrounding organs. The typical location of synovial sarcoma of the heart is the atrial and ventricular septum. Its size, the degree of infiltration of the surrounding tissues and the presence of metastases influence clinical symptoms, which are very non-specific. The low specificity of the symptoms complicates the clinical diagnosis and in most cases the tumor is detected during its progression or incidentally. The final diagnosis is based on histological examination. The primary and only method of treatment is a surgical solution with an effort to completely resect the tumor, followed by aggressive palliative chemotherapy.
In the following paper, we present a case report of a 32-year-old man who was diagnosed with synovial cardiac sarcoma only on the basis of exacerbation of non-specific subjective complaints due to the complication in the form of of aneurysmal bleeding of the tumor mass.
Keywords:
Chemotherapy – sarcoma – SARS‑CoV- 2 – heart tumors
Autoři: Eva Cinková; Ondrej Ondič
; Alexander Malán
Působiště autorů: Šiklův ústav patologie lékařské fakulty UK v Plzni a Fakultní nemocnice Plzeň ; Klinika zobrazovacích metod Fakultní nemocnice Plzeň ; II. interní klinika Fakultní nemocnice Plzeň
Vyšlo v časopise: Vnitř Lék 2022; 68(E-7): 23-27
Kategorie: Kazuistiky
doi: https://doi.org/10.36290/vnl.2022.102Souhrn
Primární synoviální sarkom srdce je mimořádně vzácným nádorem s vyšším výskytem u mladých mužů. Průměrný věk výskytu je 32 let. Synoviální sarkomy jsou nádory s vysokou agresivitou, rychle proliferují a metastazují do regionálních i vzdálených mízních uzlin či okolních orgánů. Typická lokalizace synoviálního sarkomu srdce je síňové a komorové septum. Jeho velikost, stupeň infiltrace okolních tkání a přítomnost metastáz mají vliv na klinické příznaky, které jsou velmi nespecifické. Nízká specifita příznaků ztěžuje klinickou diagnózu a ve většině případech k jeho odhalení dojde při jeho progresi nebo v rámci jiného vyšetření. Stanovení konečné diagnózy je na podkladě histologického vyšetření. Prvotní a jedinou metodou léčby je operační řešení se snahou o kompletní resekci nádoru, poté navazující agresivní paliativní chemoterapie. V následujícím sdělení předkládáme kazuistiku 32letého muže, u kterého bylo zjištěno onemocnění synoviálním sarkomem srdce až na základě zhoršení nespecifických subjektivních obtíží při komplikaci v podobě aneuryzmatického krvácení nádorové hmoty.
Klíčová slova:
chemoterapie – sarkom – SARS‑CoV- 2 – nádory srdce
Úvod
Sarkomy jsou vzácnou heterogenní skupinou maligních nádorů mezenchymálního původu, které tvoří méně než 1 % všech malignit u dospělých a přibližně 10 % dětských nádorů (1–4). Přibližně 80 procent nových případů sarkomu pochází z měkkých tkání (1).
I primárně srdce postihující nádory jsou velmi vzácnou skupinou, prevalence je 0,00–0,3 % běžně prováděných pitev. Více než tři čtvrtiny z nich jsou benigní (myxomy) (5, 6). Z primárně maligních nádorů jsou nejčastějšími angiosarkom, rhabdomyosarkom, osteosarkom, fibrosarkom, primární srdeční lymfom a synoviální sarkom (0,1 % všech sarkomů) (7).
Primární srdeční synoviální sarkom je mimořádně vzácným nádorem s vyšším výskytem u mužů. Průměrný věk výskytu je 32 let. Nádor je velmi agresivní, rychle proliferující, metastazující do uzlin, recidivující a způsobující smrt prostřednictvím rozsáhlé infiltrace myokardu nebo okolních struktur. Přežití je 3 měsíce až rok, nad rok je vzácné a bylo pozorováno pouze u osob, které podstoupily transplantaci srdce s agresivní chemoterapií k zamezení tvorby vzdálených metastáz (8–9).
Klinické příznaky
Lokalizace synoviálního sarkomu, jeho velikost, stupeň infiltrace okolních tkání a přítomnost metastáz mají vliv na klinické příznaky, které jsou velmi nespecifické. Nízká specifita příznaků velmi ztěžuje klinickou diagnózu a ve většině případech k jeho odhalení dojde v rámci jiného vyšetření (transthorakální event. transezofageální echokardiografie). Nejčastější lokalizací synoviálního sarkomu je síňové a komorové septum (10).
Hlavními příznaky synoviálního sarkomu jsou dušnost (38 %) nebo embolické příhody plic či CNS (24 %) (8). Dalšími příznaky jsou bolest na hrudi, hypotenze, tachykardie, únava, známky kardiální nedostatečnosti, synkopa, poruchy funkce chlopenního aparátu, arytmie, poruchy převodu vzruchu, perikardiální výpotek s možnou tamponádou nebo i bez ní (11–12).
Histologie
Synoviální sarkomy se skládají ze dvou odlišných typů buněk, vřetenovitých a buněk s epiteliální diferenciací. Podle WHO 2020 rozlišujeme 3 podtypy: vřetenobuněčný, bifazický a nízce diferencovaný (9).
Bifazický typ je snadno rozpoznatelný pro přítomnost dvou buněčných typů, k diagnóze zbylých tří typů je zlatým standardem imunohistochemické barvení na mezenchymální a epiteliální markery a molekulární testování na specifickou mutaci. Molekulární diagnostika se doplňuje pouze v některých případech vřetenobuněčného nádoru neobvyklé lokalizace (10).
K diagnostické kompletizaci synoviálního sarkomu kromě histologického obrazu slouží pozitronová emisní tomografie, počítačová tomografie (PET/CT) a magnetická rezonance.
Léčba
Prvotní a jedinou metodou léčby je operační řešení se snahou o kompletní resekci nádoru s následnou neoadjuvantní nebo paliativní chemoterapií. Literatura uvádí i několik kazuistik s úspěšnou transplantací srdce bez recidivy nádorového onemocnění při agresivní chemoterapii (13–14). Radioterapie je vzhledem k nepřesnosti koncentrace dávky záření při pohybu srdce a k vysoké toxicitě záření na okolní životně důležité zdravé tkáně spíše riziková (15, 16).
Pro svůj účinek na sarkomy různého původu jsou používány zejména látky jako doxorubicin, cyklofosfamid, ifosfamid, docetaxel, paklitaxel, cisplatina a etoposid, bevacuzimab (17–18).
Většina publikovaných zkušeností s léčbou a přežitím v případě diagnózy synoviálního sarkomu tvoří neoficiální kazuistiky nebo retrospektivní přehledy. Závěry jsou takové, že průměrná doba přežívání nemocných po transplantaci srdce se výrazněji neliší od přežívání při konzervativním postupu. Některé práce poukazují na prodloužení doby přežití bez transplantace i po transplantaci při adjuvantní chemoterapii doxorubicinem.
Kazuistika
36letý nekuřák (175 cm/75 kg), doposud interně nestonající, s negativní rodinnou anamnézou stran interních onemocnění, byl vyšetřen na interní ambulanci a následně hospitalizován pro námahové bolesti na hrudi a dušnost. Plicní embolizace jako příčina námahové dušnosti vyloučena CT angiografií plicnice, plicní parenchym a měkké tkáně byly bez patologie. Na EKG registrovány vyšší odstupy ST do 2 mm. Byla odebrána kardiospecifická laboratoř, včetně NT-BNP, tato, stejně jako ostatní laboratorní výsledky, byla bez pozoruhodností. Dle EKG křivky bylo tedy vysloveno podezření na perikarditidu, akutně bylo provedeno ECHO srdce s nálezem hemodynamicky nevýznamného perikardiálního výpotku, jinak bez patologie. Nemocný byl hospitalizován, byly provedeny odběry k vyloučení revmatické choroby či respiračních virů jako příčiny perikarditidy a výpotku, všechny s negativním výsledkem. Za hospitalizace byl nemocný léčen zvyklou terapií; Colchicin 0,5 mg 2 × d, nesteroidní antiflogistikum (Ibalgin 400 mg) 3 × d, inhibitor protonové pumpy a penicilinové antibiotikum Amoksiklav 1 g 3 × d. Hospitalizace byla komplikována pozitivním testem na onemocnění SARS‑CoV - 2 s bezpříznakovým průběhem a nemocný na vlastní žádost dimitován do ambulantní péče. Dušnost a bolesti na hrudi byly uzavírány jako počínající virová perikarditida s perikardiálním výpotkem bez rizika tamponády srdeční, infekční agens SARS‑CoV - 2 (nemocný neočkován). Pacient byl dimitován s nově zavedenou terapií kolchicinem a inhibitorem protonové pumpy. Na kontrolním ECHO vyšetření byla zjištěna regrese perikardiálního výpotku.
Po 3 týdnech byl nemocný znovu přivezen na interní ambulanci pro recidivu námahové dušnosti a bolestí na hrudi s propagací do levé horní končetiny v návaznosti na defekaci. Na příjmové interní ambulanci byla provedena EKG registrace s nálezem AV bloku 1. stupně, jinak normální nález, ST úsek oproti minulé hospitalizaci normalizován. Laboratorně byla zjištěna mírná normocytární anémie, leukocytóza, CRP 258 a pozitivní prokalcitonin. Ostatní biochemický nález byl normální. Za hospitalizace bylo pokračováno v dosavadní terapii kolchicinem a zahájena terapie cefalosporiny 3. generace. Pro podezření na komplikace po prodělaném onemocnění SARS‑CoV - 2 a recidivu perikarditidy bylo znovu provedeno ECHO srdce s dobrou kinetikou myokardu a systolickou funkcí levé komory srdeční, viděn hemodynamicky nevýznamný perikardiální výpotek a nově patrný 30 mm kulovitý útvar mezi levou síní a aortou, dopplerometricky bez patrné perfuze. Nový nález byl korelován s tři týdny starou CT angioagrafií plicnice, kde nyní echokardiograficky popisované ložisko nediferencováno.
K objasnění nálezu na srdci byla provedena CT angiografie koronárního řečiště, s popisem hematomu v horním mediastinu s významnou kompresí horní duté žíly s dislokací okolních struktur, suspektní intramurální hematom v mezisíňovém septu (Obr. 1).
Obr. 1. CT angiografie hrudní aorty a koronárních tepen 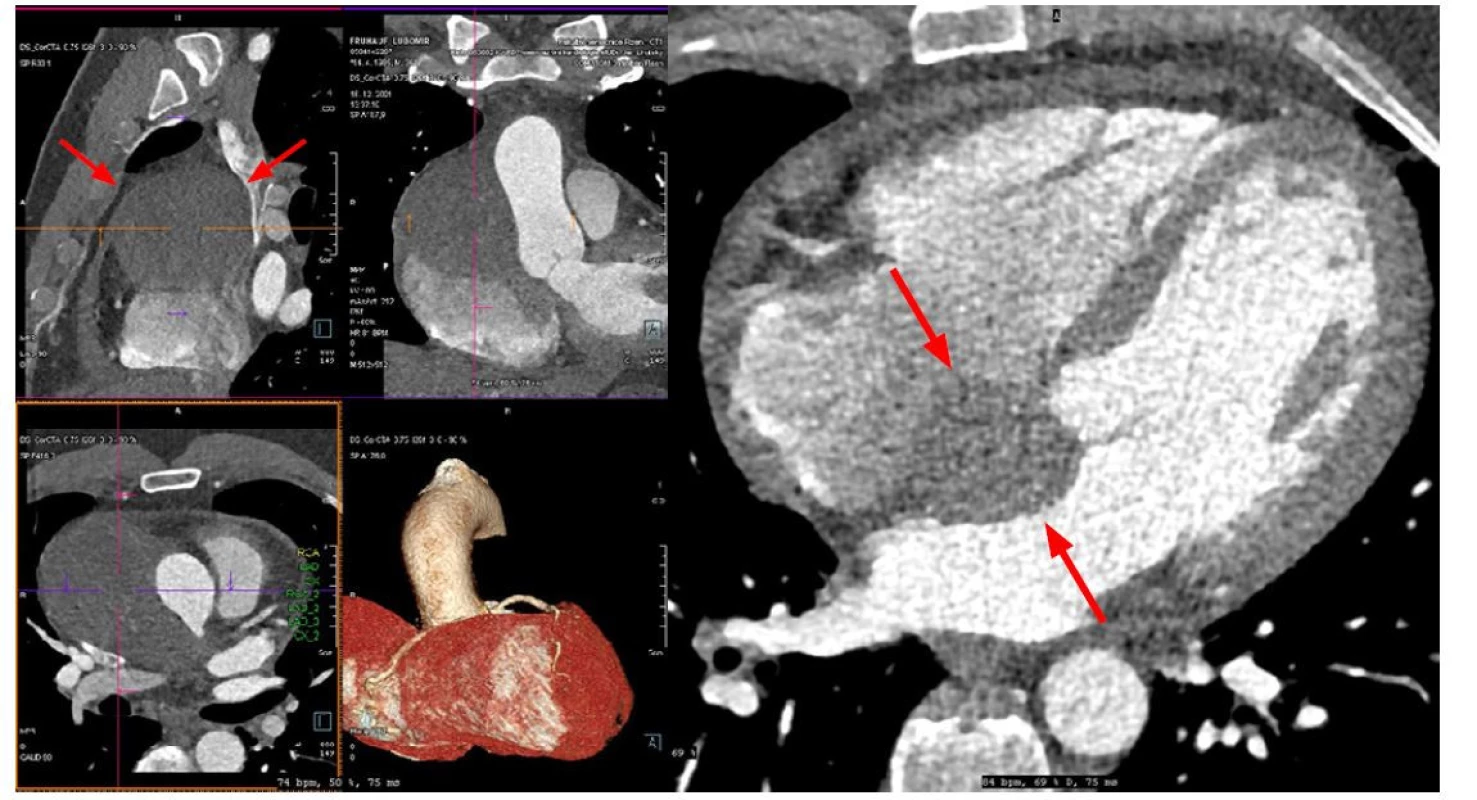
Objemný hematom v prostoru mezi vzestupnou aortou a horní dutou žílou, který se vyklenuje ventrálně a také do mezisíňového septa. Nemocný byl akutně operován na Kardiochirurgické klinice, perioperačně mezi ouškem pravé síně a ascendentní aortou viděn přirostlý křehký kulovitý vakovitý útvar 100 × 60 mm, po jehož incizi se z vaku uvolnily tromby, stará krev a tumorózní hmota myxomatózního charakteru. Dále viděn široce rozvlákněný tumor infiltrující zadní část mezisíňového septa a horní stěnu levé síně. Levá síň byla tumorem perforována a tumor prominoval do vaku pseudoaneuryzmatu s defektem v levé síni 10 × 10 mm. Chirurgem byla provedena maximální možná resekce tumoru a pseudoaneuryzmatu mediastina, levá síň záplatována, septum suturováno. Odeslány vzorky na histologické vyšetření.
Pooperační průběh byl nadále u nemocného bez komplikací, kontrolní echokardiografie byla s nálezem hemodynamicky nevýznamného perikardiálního výpotku, se zesíleným mezisíňovým septem a s malým levo‑pravým zkratem při defektu síňového septa v místě záplaty. Nemocný dimitován do ambulantní péče s malou dávkou betablokátoru v chronické medikaci.
Konečná diagnóza synoviálního sarkomu srdce byla stanovena histologicky. V histologickém obraze byl popsán částečně nekrotický hypercelulární vřetenobuněčný novotvar, který dosahoval do chirurgických okrajů s minimálními pleomorfiemi, s vysokou mitotickou aktivitou (více než 50 mitóz na 10 polí velkého zvětšení), zcela fokálně tvořící epitelové struktury imunohistochemicky s difuzně silně pozitivními protilátkami SS18-SSX a SSX. V ojedinělých epitelových strukturách byla pozitivní exprese EMA širokospektrálních citokeratinů AE1/3 (Obr. 2–5).
Morfologie i imunoprofil svědčily pro diagnózu bifázického synoviálního sarkomu s převahou vřetenobuněčné složky, grade III dle klasifikace FNCLCC (French Federation of Cancer Centers Sarcoma Group system, nejužívanější systém pro stanovení gradingu sarkomu) (Obr. 2–5). Molekulárně genetické vyšetření nebylo provedeno z důvodu přítomné silné nukleární pozitivity s protilátkami SSX a SS18-SSX, která, po konzultaci s patology, je více specifická nežli potvrzení fúzního genu SS18-SSX pomocí polymerázové řetězové reakce.
Obr. 2–5. Morfologie i imunoprofil svědčící pro diagnózu bifázického synoviálního sarkomu s převahou vřetenobuněčné složky, grade III dle klasifikace FNCLCC 
Vzhledem k histologicky ověřenému sarkomu srdce byla k posouzení stagingu nádorového onemocnění provedena pozitronová emisní tomografie v kombinaci s magnetickou rezonancí, se zjištěnou diseminací nádoru do paratracheálních uzlin vpravo a do uzlin coeliacké oblasti pod úrovní bránice. Dále bylo popsáno suspektní reziduum nádorové tkáně, které nešlo s jistotou odlišit od reaktivních pooperačních změn (Obr. 6–8).
Obr. 6. Pozitronová emisní tomografie/magnetická rezonance (PET/MR) 
V perikaridálním vaku zbytky výpotku hemorhagického charakteru, v oblasti před pravou komorou a kolem pravé síně a dále pod levou komorou se zobrazuje tkáň s vysokým obratem FDG. SUV max do 7,89, dále sytící se tkáň s restrikcí difuze v oblasti interatriálního septa velikosti 15 × 10 mm, SUV max. 6,80. Obr. 7. PET/MR 
Pod bránicí je přítomna kolem tr. coeliacus trojice uzlin velikosti do 12 × 15 mm. Jedna z uzlin akumuluje FDG velice vysoce (SUVmax 11,67), další dvě vykazují akumulaci jen mírně zvýšenou SUVmax 6 a 4,5. Obr. 8. PET/MR 
Dvě uzliny s vysokou akumulací FDG paratracheálně vpravo velikosti do 12 × 10 mm, SUVmax 5,0. Nemocný byl předán do péče onkologů, kteří vzhledem ke generalizaci nádorového onemocnění indikovali paliativní systémovou léčbu.
Šest týdnů po kardiochirurgické operaci a 10 týdnů od prvních nespecifických příznaků synoviálního sarkomu srdce byl zahájen první cyklus chemoterapie, a to kombinace ifosfamid/antracyklin (užito schéma na léčbu ostatních sarkomů). Chemoterapii nemocný zvládal bez komplikací. Bylo provedeno kontrolní CT s odstupem 3 měsíců od začátku chemoterapie, bez nálezu recidivy nádoru na srdci a v perikardu, bylo popsáno mírné zmenšení mediastinálních uzlin. Nemocný byl v dobrém klinickém stavu, běžnou činnost zvládal bez omezení.
Závěr
Případ tohoto mladého nemocného ukazuje na možnou souvislost příznaků (dušnost, bolesti na hrudi), které jsou u mladých lidí typické spíše pro virové či bakteriální infekty, revmatologická systémová onemocnění, plicní embolii či jiné postižení plic, s velmi raritním výskytem srdečního nádoru typického pro mladé nemocné, především muže. V tomto případě se vyskytl srdeční maligní nádor, který dokud nebyl komplikován krvácením, nebyl možný rozlišit klasickými vyšetřeními (transthorakální echokardiografie, CT plicnice a plicního parenchymu), a způsoboval velmi nespecifické příznaky, které spolu se SARS‑CoV - 19 infekcí vedly k mylné diagnóze srdečního postižení při virovém infektu. Synoviální sarkom srdce se neprojevoval typickými známkami srdečního selhání, poruchami vedení vzruchu či plicní embolizace, ale nespecifickým příznakem dušnosti a bolesti na hrudi, přítomností perikardiálního výpotku.
Obecně lze říci, že v případě nespecifických respiračních a kardiálních obtíží u mladého člověka, především muže, bychom primárně měli také pátrat po neoplazii, ačkoli se nám nabízí infekční či systémová etiologie. Časnou diagnostikou, chirurgickou resekcí a chemoterapií se prodlužuje medián přežití u mladých nemocných s vyšší šancí pro transplantaci srdce.
KORESPONDENČNÍ ADRESA AUTORKY:
MUDr. Eva Cinková, MBA
II. interní klinika Fakultní nemocnice Plzeň-Bory
E. Beneše 13, 305 99 Plzeň
Cit. zkr: Vnitř Lék. 2022;68(7):E23-E27
Článek přijat redakcí: 13. 6. 2022
Článek přijat po recenzích: 17. 8. 2022
Zdroje
1. World Health Organization Classification of Tumours Editorial Board. Soft Tissue and Bone Tumours, 5th ed, International Agency for Research on Cancer, 2020. Vol 3.
2. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72 : 7.
3. Ward E, DeSantis C, Robbins A, et al. Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin. 2014;64 : 83.
4. Miller KD, Fidler‑Benaoudia M, Keegan TH et al. Cancer statistics for adolescents and young adults, 2020. CA Cancer J Clin. 2020;70 : 443.
5. Burke A, Virmani R. Primary cardiac sarcomas. Atlas of tumor pa_thology. Tumors of the heart and great vessels. 1990;16 : 127-70.
6. Patel J, Sheppard MN. Pathological study of primary cardiac and pericardial tumours in a specialist UK centre: surgical and autop_sy series. Cardiovasc Pathol. 2010;19 : 343-52.
7. Hamidi M, Moody JS, Weigel TL, Kozak KR. Primary cardiac sarco_ma. Ann Thorac Surg. 2010;90 : 176-81.
8. Piazza N, Chughtai T, Toledano K et al. Primary cardiac tumors: Eighteen years of surgical experience on 21 patients. Can J Cardiol. 2004;20 : 1443-1448.
9. Birdsall S, Osin P, Lu YJ et al. Synovial sarcoma specific translocation associated with both epithelial and spindle cell components. Int J Cancer. 1999;82 : 605 - 608.
10. Debourdeau P, Gligorov J, Teixeira L et al. Maligant cardiac tumors. Bull Cancer. 2004;91 : 136-146.
11. Sheu CC, Lin SF, Chiu CC et al. Left atrial sarcoma mimicking obstructive pulmonary disease. J Clin Oncol. 2007;25 : 1277.
12. Lee VH, Connolly HM, Brown RD Jr. Central nervous system manifestations of cardiac myxoma. Arch Neurol. 2007;64 : 1115.
13. Grande AM, Ragni T, Viganò M. Primary cardiac tumors. A clinical experience of 12 years. Tex Heart Inst J. 1993;20 : 223-30.
14. Gowdamarajan A, Michler RE. Therapy for primary cardiac tumors: is there a role for heart transplantation? Curr Opin Cardiol. 2000;15 : 121-5.
15. Butany J, Nair V, Naseemuddin A, Nair GM, Catton C, Yau T. Car_diac tumors: diagnosis and management. Lancet Oncol. 2005;6 : 219-28.
16. Prosnitz RG, Chen YH, Marks LB. Cardiac toxicity following thoracic radiation. Semin Oncol. 2005;32 : 71-80.
17. Llombart‑Cussac A, Pivot X, Contesso G, Rhor‑Alvarado A, Delord JP, Spielmann M, Türsz T, Le Cesne A. Adjuvant chemotherapy for primary cardiac sarcoma: the IGR experience. Br J Cancer. 1998;78 : 1624-8.
18. Simpson L, Kumar SK, Okuno SH, Schaff HV, Porrata LF, Buckner JC, Moynihan TJ. Malignant primary cardiac tumors: review of a single institution experience. Cancer. 2008;112 : 2440-6.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo E-7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Zápalové markery v klinickej praxi
- Pegvisomant v liečbe akromegálie
- Primární synoviální sarkom srdce klinicky napodobující SARS‑CoV- 2 asociovanou perikarditidu
- Diferenciální diagnostika leukocytózy a leukopenie
- Podiatrická péče z pohledu ambulantních specialistů – diabetologů
- Telemedicine, Innovative Technologies and Digital Health Working Group
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika leukocytózy a leukopenie
- Zápalové markery v klinickej praxi
- Pegvisomant v liečbe akromegálie
- Podiatrická péče z pohledu ambulantních specialistů – diabetologů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



