-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Časný karcinom žaludku
Early gastric cancer
Early gastric cancer is defined histopathologically as a tumour with limited local progression to the mucosa and submucosa. The concept of early cancer was developed in the 1960s in Japan and is now widely accepted. The term of early gastric cancer included cases with/without metastatic lymph node involvement. However, a common characteristic is a favourable prognosis of the disease. The task of the endoscopist is primarily to diagnose (identify) the tumour (precancerous lesions) and to verify it by biopsy. Successful identification must be followed by its correct classification, leading to the choice of an adequate approach, which includes surveillance, endoscopic treatment (resection) or surgical treatment (with or without chemotherapy). The method of treatment is determined primarily by the nature or risk of lymph node involvement.
Keywords:
Gastric cancer – gastroscopy – early cancer – endoscopic resection
Autoři: Ladislav Douda; Jiří Cyrany; Ilja Tachecí
Působiště autorů: 2. interní gastroenterologická klinika Fakultní nemocnice Hradec Králové, Lékařská fakulta UK v Hradci Králové
Vyšlo v časopise: Vnitř Lék 2022; 68(6): 371-375
Kategorie: Hlavní téma
doi: https://doi.org/10.36290/vnl.2022.077Souhrn
Časný karcinom žaludku je definován histopatologicky jako nádor, jehož lokální růst je omezen na sliznici a submukózu. Koncepce časného karcinomu byla rozpracována již v 60. letech v Japonsku a v současnosti je široce akceptována. Je potřeba si uvědomit, že termín časný karcinom zahrnuje léze bez i s metastatickým postižením spádových lymfatických uzlin. Společnou charakteristikou je příznivější prognóza ve srovnání s pokročilým onemocněním. Úkolem endoskopisty je v první řadě nádor (prekancerózy) diagnostikovat (identifikovat) a biopticky ověřit. Po úspěšné identifikaci musí následovat jejich klasifikace vedoucí k volbě adekvátního přístupu, který zahrnuje dispenzarizaci prekanceróz, v případě nádoru pak endoskopickou léčbu (resekci) nebo léčbu chirurgickou (s nebo bez chemoterapie). Způsob léčby je určován především charakterem léze dle rizika či průkazu postižení lymfatických uzlin.
Klíčová slova:
karcinom žaludku – gastroskopie – časný karcinom – endoskopická resekce
Časný karcinom žaludku je definován jako nádor omezený na sliznici a submukózu, bez postižení svaloviny orgánu. Je potřeba si uvědomit, že termín časný karcinom zahrnuje léze bez i s metastatickým postižením spádových lymfatických uzlin. Společnou charakteristikou je významně příznivější prognóza onemocnění při správné identifikaci a adekvátní léčbě ve srovnání s pokročilým onemocněním.
Úvod a epidemiologie
Karcinom žaludku je celosvětově čtvrtou nejčastější příčinou úmrtí na nádorové onemocnění (po nádorech plic, kolorekta a jater). Ročně onemocní přes 1 000 000 lidí, především v Asii a východní Evropě (75 %) (1) a přes 700 000 nemocných ve stejném období na nádor zemře. Známé jsou také etnické rozdíly v prevalenci, vysoká je například u Maorů a Inuitů. Onemocnění je častější u mužů, rozdíl vymizí u postmenopauzálních žen.
Česká republika patří mezi země se střední (nižší) incidencí onemocnění, karcinom žaludku zde zaujímá 12. místo, což odpovídá cca 2 % všech nově diagnostikovaných novotvarů (2). Od konce 2. světové války zde dochází k prakticky soustavnému poklesu incidence a mortality (incidence byla v roce 2018 12,8 na 100 000 osob, mortalita 9,5 úmrtí na 100 000 osob) (2). Přesto zůstává toto nádorové onemocnění důležitým problémem tuzemské gastrointestinální onkologie. Příčinou jsou stále neuspokojivé výsledky léčby (5leté přežití dosahuje pouze 32 %!). Je to především důsledek diagnostiky onemocnění v pokročilejších stadiích (více než polovina karcinomů žaludku je diagnostikována v III. nebo IV. stadiu). Japonské zkušenosti prokazují možnosti významného zlepšení prognózy při zjištění nádoru v časných fázích, ideálně ještě jako časného karcinomu nebo prekancerozní léze. V těchto případech je endoskopická, event. chirurgická léčba spojena s 5letým přežitím u více než 97 % nemocných. Zvýšení podílu zjištěných onemocnění v I. stadiu na 59 % vedlo v Japonsku (díky screeningovým programům) ke zvýšení 5letého přežití až na 71 % (3). Problémem západních endoskopistů zůstává poměrně vysoké riziko přehlédnutí karcinomu v průběhu gastroskopie (4).
Etiopatogeneze karcinomu žaludku
Adenokarcinom žaludku je možné klasicky rozdělit na typ intestinální a difuzní (Laurénova klasifikace). Každý z nich má odlišné morfologické a genetické charakteristiky, epidemiologii a etiopatogenezi. V onkogenezi karcinomu intestinálního typu se projevuje především chromozomální nestabilita, poruchy v systému regulátorů buněčného cyklu (cyclin E a cyclin‑dependentní kinázy p15, p16, p2), zvýšená exprese a amplifikace genu HER2. Pro difuzní typ karcinomu žaludku jsou typické poruchy genů regulujících interakce mezi buňkami a mezibuněčnou matrix. Primárně se objevují mutace alely tumor supresorového genu CDH1 (gen pro E‑cadherin) s následnou epigenetickou inaktivací druhé alely prostřednictvím hypermetylace DNA. Určitý význam mají pravděpodobně také polymorfismy genu pro interleukin 1-beta, metylen‑tetrahydrofolát‑reduktázu a genu IFNGR1 (kódujícího řetězec 1 receptoru interferonu gama). Nádory asociované s infekcí EBV mají typický molekulárně genetický profil (vyšší exprese PD‑L1, PIK3CA mutace a hypermetylace DNA).
Rizikové faktory a prekancerózy
Rizikovými faktory (především pro intestinální typ karcinomu) jsou infekce H. pylori (určitou roli hraje kmen bakterie: cagA a vacA pozitivní, délka trvání infekce a přítomnost dalších rizikových faktorů), perniciozní anémie, kouření cigaret a šňupání tabáku, vysoký příjem kuchyňské soli a stavy po částečné resekci žaludku (Billroth II). Obezita a refluxní choroba jícnu jsou rizikovými faktory karcinomu žaludeční kardie. Vzácnou prekancerózou je Menetrierova choroba, která je spojena s cca 15% rizikem vzniku nádoru. Vysoké riziko představuje také rodinná anamnéza karcinomu žaludku u příbuzného 1. stupně a hereditární formy karcinomu (difuzní hereditární karcinom žaludku, gastrický adenokarcinom a proximální polypóza žaludku (GAPPS), Lynchův syndrom, Peutzův‑Jeghersův syndrom, syndrom Li‑Fraumeni, syndrom hereditárního karcinomu prsu a ovaria apod.).
Chronická atrofická gastritida (způsobená infekcí H. pylori, nebo méně často autoimunitně s protilátkami proti parietálním buňkám a vnitřnímu faktoru) indukuje u části pacientů vznik intestinální metaplazie, dysplazie a dále intestinálního typu karcinomu žaludku (riziko u H. pylori indukované gastritidy je okolo 1 %). Významná je z tohoto pohledu především multifokální atrofická gastritida s nižší produkcí kyseliny. Nekompletní intestinální metaplazie (typ II a III s přítomností pohárkových buněk a neabsorpčních, kolocytům podobných buněk) zvyšuje riziko vzniku intestinálního typu karcinomu žaludku zhruba 20krát. Nejvyšší riziko vzniku karcinomu žaludku představuje ložisko dysplazie / intraepiteliální neoplazie (podíl progrese dysplazie vysokého stupně do karcinomu se pohybuje okolo 6 %/rok). Také v karcinogenezi difuzního typu karcinomu žaludku může hrát chronický zánět určitou roli, genetické odchylky modifikují zánětlivou reakci na infekci H. pylori, častěji však nádor vzniká v zánětem nepostižené sliznici, je agresivnější a má horší prognózu.
Klinický obraz
Vzhledem k charakteru prekancerozních změn sliznice a časného karcinomu žaludku je většina nemocných zcela asymptomatická či trpí pouze nespecifickými dyspeptickými obtížemi (pocity plnosti žaludku, předčasná sytost, říhání, tlaky v nadbřišku, nauzea, nechutenství). V zemích s vysokou prevalencí onemocnění a funkčním screeningovým programem (Východní Asie) je většina karcinomů diagnostikována u asymptomatických jedinců v rámci screeningu. V Evropě se jedná o diagnózu více či méně náhodnou, prevalence nádorů žaludku u nemocných s dyspepsií je relativně nízká a chybí spolehlivý klinický či laboratorní marker rizika vzniku či přítomnosti karcinomu, použitelný v běžné klinické praxi. Výskyt takzvaných varovných symptomů (anémie, významný váhový úbytek) většinou znamenají již pokročilejší formy nádoru.
Endoskopická diagnostika
Z endoskopického pohledu lze identifikovat již prekancerózy (atrofickou gastritidu, intestinální metaplazii a dysplazii), definitivní diagnostika je ale stále histopatologická (po odběru vzorků bioptickými kleštěmi). Ideální pro diagnostiku časných premaligních změn je použití endoskopů s vysokým rozlišením. Při standardním zobrazení v bílém světle je pro atrofickou gastritidu typické výraznější prosvítání podslizniční cévní kresby (Obr. 1), pro intestinální metaplazii jsou charakteristické okrsky (až mapovitě uspořádané) bělavé, mírně vyvýšené sliznice (Obr. 2) a pro dysplazii drobné slizniční nepravidelnosti (nodularity, vkleslé, ploché či vyvýšené léze) či zarudnutí (Obr. 3). K rozlišení zánětlivých a neoplastických změn je výhodou využití klasické či virtuální chromoendoskopie: zvýraznění povrchové struktury sliznice pomocí aplikace barviv (metylenová modř, indigokarmín), ev. speciálních režimů endoskopů (např. NBI – narrow band imaging (Obr. 4), BLI – blue light imaging, LCI – linked color imaging). Zjednodušeně lze zánětlivou lézi rozlišit pomocí pravidelné struktury povrchu i cév, na rozdíl od léze neoplastické, kde lze očekávat nepravidelnosti, smazanou strukturu či neovaskularizace. Dysplastické léze či časný karcinom žaludku klasifikujeme v průběhu endoskopie pomocí takzvané Pařížské klasifikace povrchových neoplastických lézí na léze polypoidní (typ I) a nepolypoidní (ploché), prominující nad okolní sliznici maximálně do 2,5 mm (typ II se subtypy mírně vyvýšený IIa, plochý IIb a mírně vkleslý IIc), a dále typ III – vyhloubený (Obr. 5) (5). Existují také kombinované typy (např. IIa+c nebo IIc+a). Makroskopická morfologie léze koreluje s hloubkou invaze karcinomu a tím i s rizikem přítomnosti lymfatických metastáz – nejrizikovější je z tohoto pohledu typ IIc.
Obr. 1. Chronická atrofická gastritida. Charakteristické je výraznější prosvítání podslizniční cévní kresby 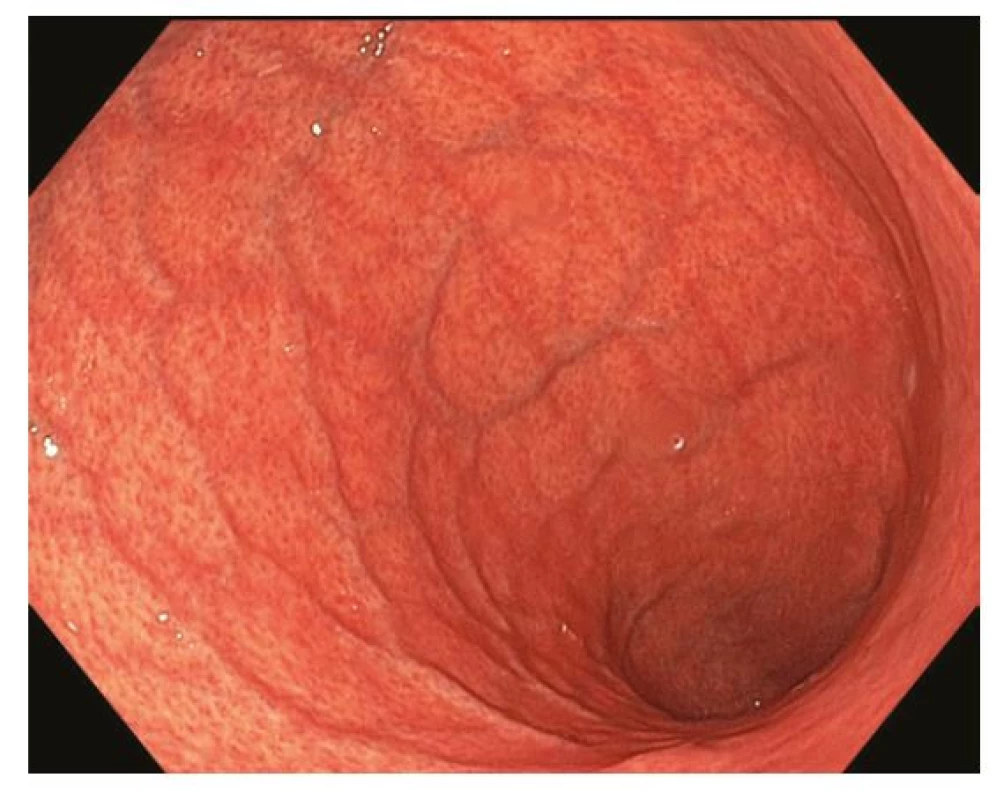
Obr. 2. Intestinální metaplazie mapovitými okrsky bělavé, mírně vyvýšené sliznice 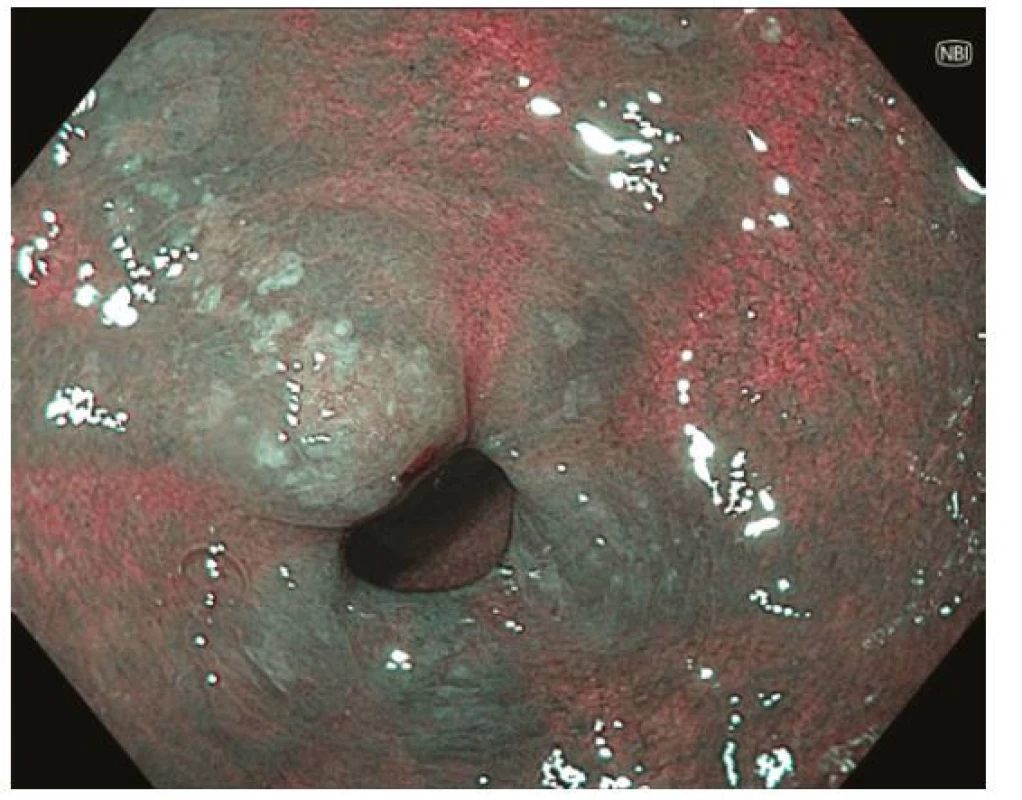
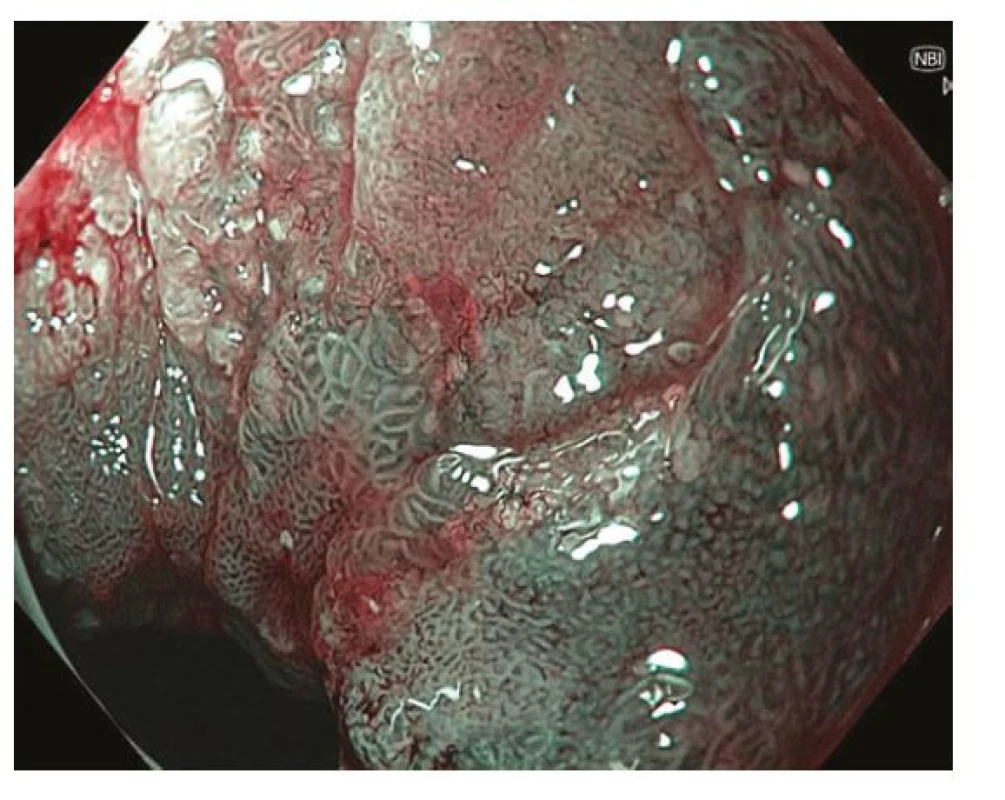
Obr. 3. Ložisko časného karcinomu v oblasti antra žaludku. Endoskopicky patrná léze typu 0-IIc dle Pařížské klasifikace se smazanou povrchovou strukturou a neovaskularizacemi v centrální, vkleslé části léze 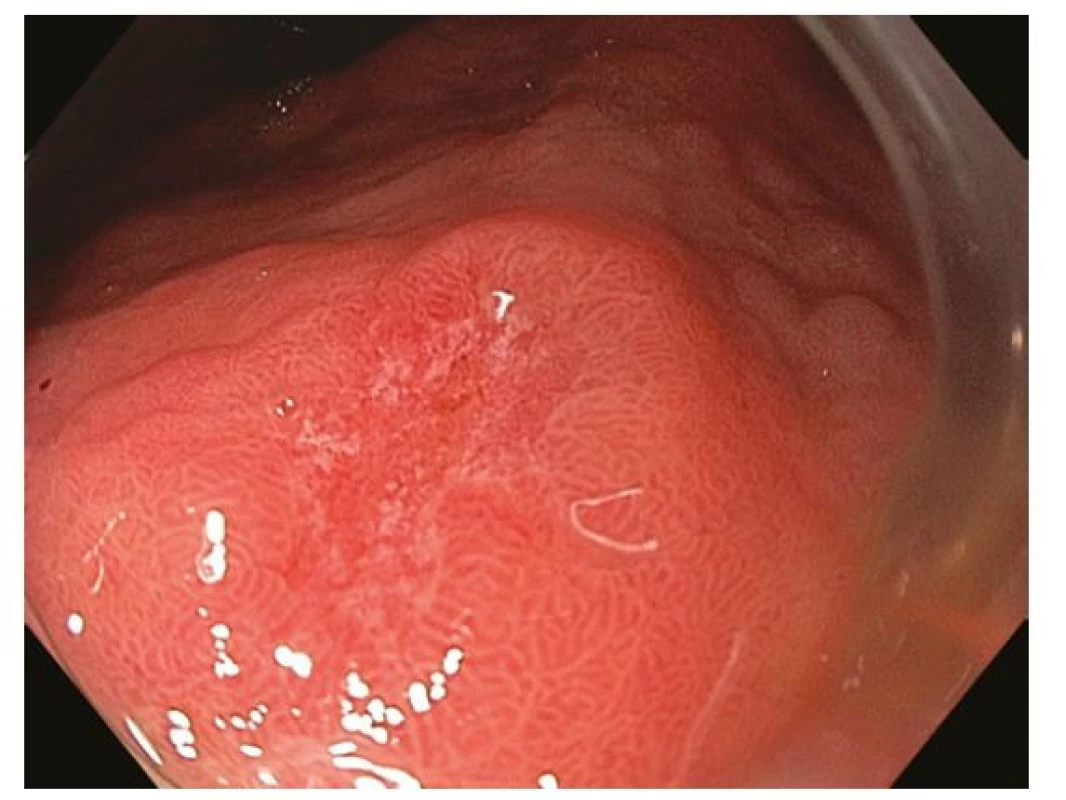
Obr. 4. Ložisko časného karcinomu v oblasti antra žaludku – zobrazení pomocí techniky virtuální chromoendoskopie – NBI (narrow band imaging). Endoskopicky patrná léze typu 0-IIc dle Pařížské klasifikace se smazanou povrchovou strukturou a neovaskularizacemi v centrální, vkleslé části léze 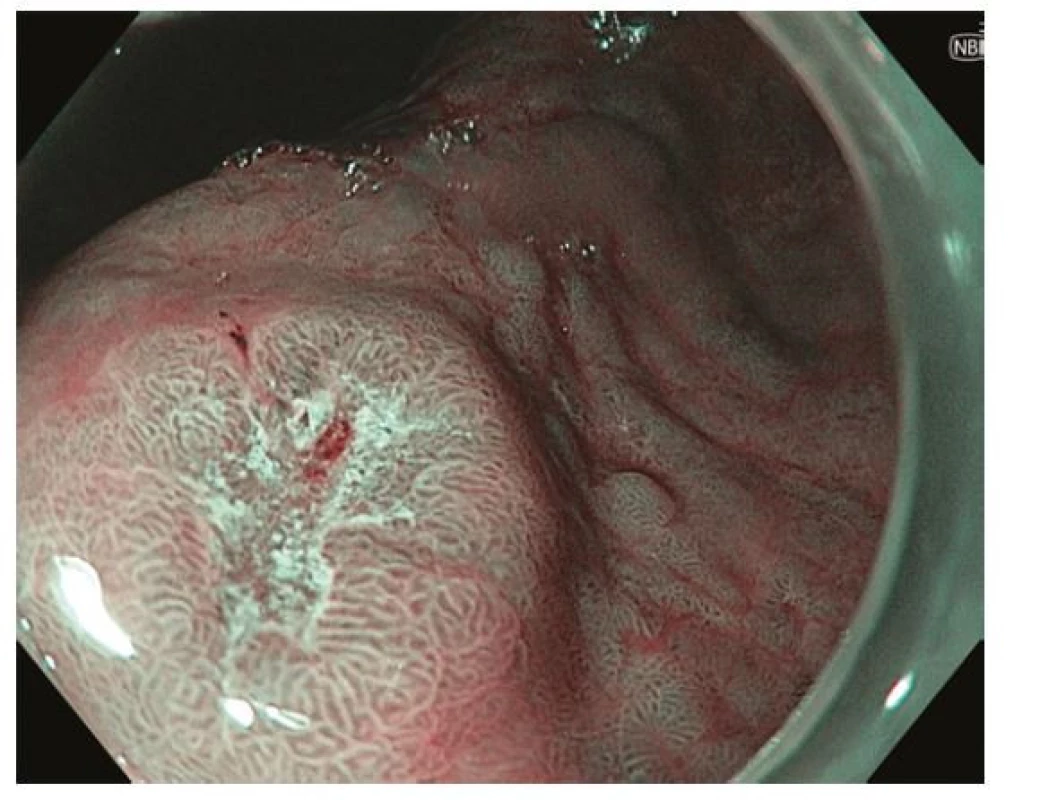
Obr. 6. Pařížská klasifikace povrchových neoplastických lézí, upraveno podle (5) 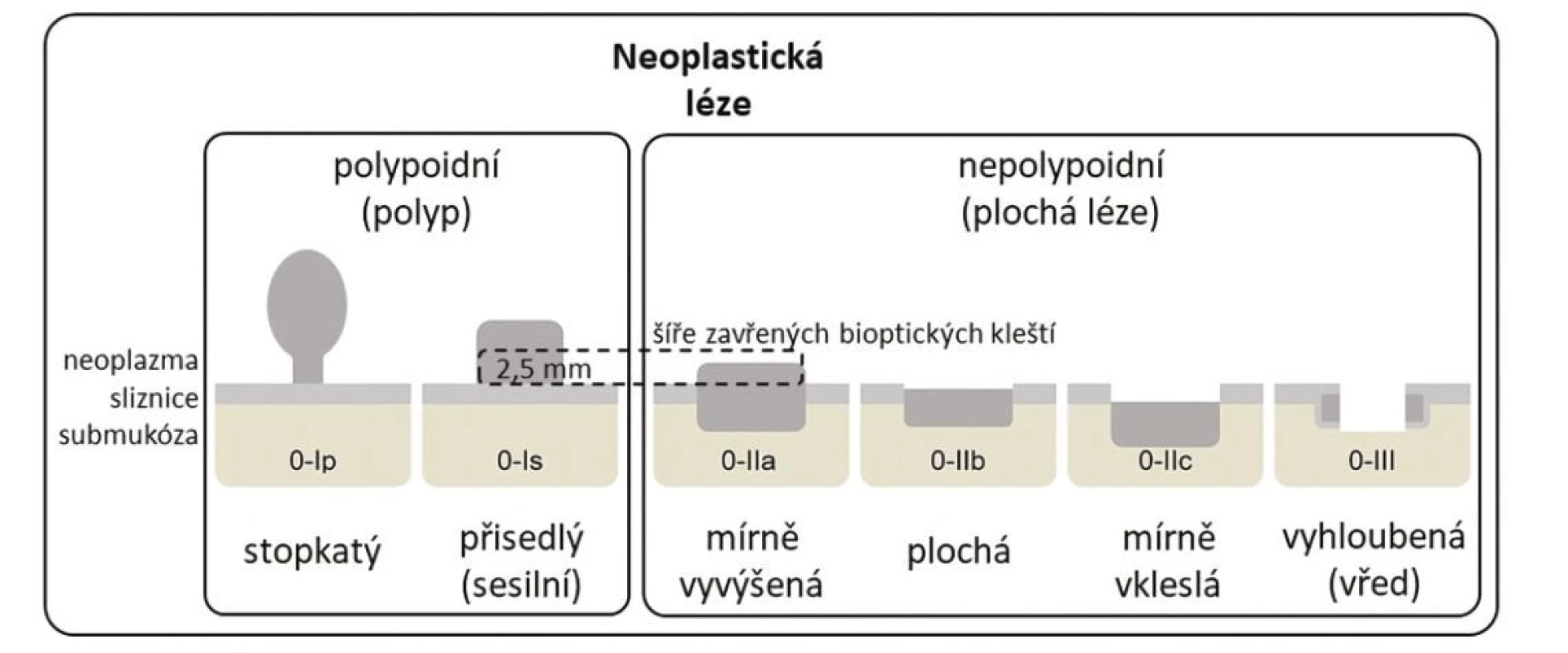
V regionech bez vysoké incidence karcinomu žaludku je diagnostika časných stadií nemoci silně závislá na kvalitě rutinního gastroskopického vyšetření, a to jak v detekci prekancerózních stavů (a jejich správné dispenzarizaci), tak v detekci karcinomu samotného. Vyšší důraz je v současné době kladen na parametry kvality vyšetření, které se týkají především zobrazení (adekvátní analgosedace, insuflace, oplach, fotodokumentace) a délku vyšetření (6). Měřítkem selhání gastroskopie v diagnostice časného karcinomu je procento nádorů, jejichž diagnóze předcházela v intervalu ne delším než 3 roky nediagnostická gastroskopie – podíl těchto „missed gastric cancers“ dosahuje téměř 10 % (7).
Biopsie a histopatologická klasifikace
V běžné endoskopické praxi je vhodný odběr histologie bioptickými kleštěmi v případě podezření na prekancerózy či neoplastické léze žaludku. Odebíráme vzorky ze všech lézí makroskopicky suspektních z neoplazie a doplňujeme necíleným odběrem sliznice z antra, těla žaludku (z malé i velké kurvatury) a angulární řasy (8). V případě průkazu chronické atrofické gastritidy či intestinální metaplazie jsou k posouzení míry rizika vzniku adenokarcinomu žaludku využitelné histologické klasifikační systémy stupně atrofie sliznice (Operative Link on Gastritis Assessment: OLGA) a především intestinální metaplazie (Operative Link on Gastric Intestinal Metaplasia Assessment: OLGIM). Endoskopická dispenzarizace každé 3 roky je poté doporučována u pacientů s průkazem inkompletní intestinální metaplazie, při intestinální metaplazii přítomné současně v těle i antru žaludku nebo pokročilého stupně atrofie sliznice (OLGA/OLGIM III a IV) a u nemocných s autoimunitní atrofickou gastritidou. Intenzivnější sledování je doporučeno u nemocných s pokročilou atrofií a/nebo intestinální metaplazií v těle i antru žaludku a současně s pozitivní rodinnou anamnézou karcinomu žaludku (u příbuzného prvního stupně), nebo v případě výskytu dysplazie (8). Zvážení endoskopické léčby je nutné u endoskopicky viditelných lézí s dysplazií. Odběr části neoplastické léze bioptickými kleštěmi relativně často neodpovídá definitivnímu histopatologickému vyšetření resekátu (riziko falešně příznivějšího nálezu), lézi je tedy nutné odstranit kompletně celou. Při histopatologické klasifikaci slizničních neoplazií trávicí trubice je využívána takzvaná Vídeňská klasifikace (revidovaná verze) (9). Slizniční neoplazie rozlišuje jako low grade, high grade (sem řadíme kromě high grade dysplazie, neinvazivního karcinomu také intramukozní karcinom) a karcinom s invazí do submukózy. Smyslem klasifikace je sdružovat neoplastické nálezy do skupin podle rizika přítomnosti lymfatických metastáz a tedy i podle způsobu vhodné léčby. Riziko přítomnosti lymfatických metastáz je v případě slizničního karcinomu nízké, kolem 0–6 % (v závislosti na dalších rizikových faktorech), při postižení povrchových vrstev submukózy se ale podstatně zvyšuje až na 11 % (10, 11).
Součástí vyšetření žaludku je u těchto nemocných také vyšetření přítomnosti infekce Helicobacter pylori (lokálními testy: rychlým ureázovým testem, barvením v histologických vzorcích a kultivačním průkazem; nebo globálními testy: stanovením antigenu ve stolici nebo dechovým testem) a jeho eradikace. V Asii jsou využívány neendoskopické techniky screeningu těžkých atrofických změn sliznice žaludku u nemocných ve vysokém riziku karcinomu pomocí průkazu snížení sérového pepsinogenu I (změna poměru pepsinogenu I produkovaného v buňkách sliznice fundu a pepsinogenu II v buňkách sliznice pyloru a duodena), v kombinaci s nízkými protilátkami proti Helicobacter pylori, hladinami sérového ghrelinu (nízká hodnota je spojena se zvýšeným rizikem karcinomu), gastrinu 17 (atrofie žaludeční sliznice zvyšuje jeho hodnoty) nebo autoprotilátek proti parietálním buňkám. V Evropě nejsou tyto metody rutinně používány. Onkomarkery nejsou k diagnostice časných karcinomů žaludku využitelné.
Endoskopická léčba
Volba endoskopické léčby je v případě časného karcinomu žaludku (nálezu, který odpovídá časnému karcinomu žaludku – definitivní klasifikaci přinese až histopatologické zhodnocení resekátu) založena především na hodnocení rizika přítomnosti lymfatických metastáz. V případě vysokého rizika volíme primárně chirurgické řešení (s/bez chemoterapie). Riziko je hodnoceno pomocí několika endoskopických ukazatelů, je to především velikost léze, přítomnost/absence ulcerace, a histopatologických ukazatelů (definitivně vyhodnocených po vyšetření resekátu): diferenciace nádoru a hloubka invaze (Tab. 1). Souhrnně lze říci, že k endoskopické terapii jsou vhodné především dobře diferencované karcinomy intestinálního typu omezené na sliznici (high grade slizniční neoplazie dle Vídeňské klasifikace zahrnující high grade dysplazii i intramukosní karcinom), do 2 cm velikosti, bez ulcerace, bez lymfangioinvaze. Riziko lymfatických metastáz se v tomto případě blíží nule. U některých dalších lézí (splňujících takzvaná rozšířená kritéria) lze endoskopickou léčbu zvažovat, riziko lymfatických metastáz je však v těchto případech již nenulové (Tab. 1). U nádorů zasahujících hlubší vrstvy submukózy není endoskopická léčba vhodná. Při volbě léčebné metody je potřeba vždy zvažovat i rizika daného výkonu (především riziko související s celkovou anestezií a operačním řešením).
Tab. 1. Incidence metastáz do lymfatických uzlin u časných karcinomů žaludku: upraveno podle (8) 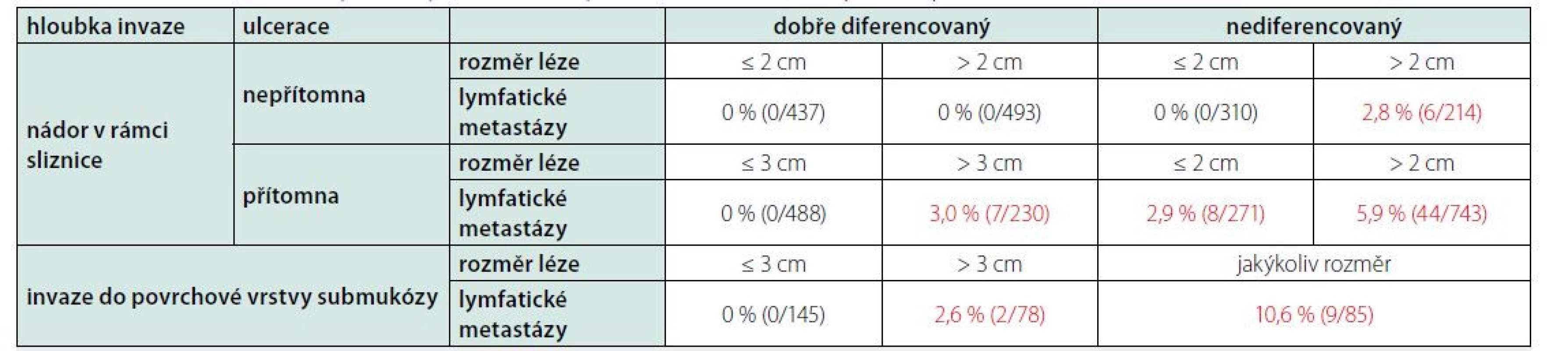
Léze indikované k endoskopické resekci označeny zeleně, žlutě (rozšířené indikace). Chirurgie je indikována – označení červeně. Základní endoskopickou technikou léčby časných karcinomů žaludku je endoskopická submukozní disekce (ESD) umožňující odstranění léze v celku, a tedy také její adekvátní histopatologické vyšetření. Technika je založena na podpichu léze viskózním roztokem (obarveným většinou metylenovou modří či indigokarmínem) do submukózy. Podpichem dojde k rozšíření této vrstvy, ve které je potom pomocí dedikovaných endoskopických nožů léze oddělena od svaloviny, bez jejího poškození. Odstranění karcinomu endoskopickou kličkou (také po podpichu léze do submukózy technikou endoskopické slizniční resekce – EMR) je možné zvažovat pouze u lézí menších než 1 cm. Endoskopické techniky resekce jsou obecně ve srovnání s chirurgickými postupy méně invazivní, s nižší morbiditou i letalitou a spojené se zachováním orgánu s vyšší kvalitou života. Přesto nejsou endoskopické metody zcela bez rizika komplikací. ESD je výkon relativně náročný, expert‑dependentní, riziko perforace dosahuje až 6 % i v expertních, terciálních centrech (12, 13). Dalšími riziky výkonu jsou krvácení a u endoskopické mukózní resekce je přítomno i riziko inkompletní resekce.
Závěr
Léčba časného karcinomu žaludku má relativně dobrou prognózu, v současné době je ale stále většina nádorů žaludku diagnostikována v pokročilém stadiu. Současné technologie gastrointestinální endoskopie diagnostiku i účinnou léčbu karcinomu žaludku umožňují, zásadní je trénink a vzdělávání endoskopistů v diagnostických a terapeutických endoskopických výkonech a dosažení vysoké kvality vyšetření.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Ilja Tachecí, Ph.D.
2. interní gastroenterologická klinika FN UK v Hradci Králové
Sokolská 581, 500 05 Hradec Králové
Cit. zkr: Vnitř Lék. 2022;68(6):371-375
Článek přijat redakcí: 17. 6. 2022
Článek přijat po recenzích: 11. 7. 2022
Zdroje
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
2. Krejčí D, Pehalová L, Talábová A, Pokorová K, Katinová I, Mužík J, Dušek L. (2018). Současné epidemiologické trendy novotvarů v České republice [online]. Ústav zdravotnických informací a statistiky České republiky. Dostupné z: http://www.uzis.cz [cit. 30. 5. 2022].
3. Katai H, Ishikawa T, Akazawa K, Isobe Y, Miyashiro I, Oda I, Tsujitani S, Ono H, Tanabe S, Fukagawa T, Nunobe S, Kakeji Y, Nashimoto A. Registration Committee of the Japanese Gastric Cancer Association. Five‑year survival analysis of surgically resected gastric cancer cases in Japan: a retrospective analysis of more than 100,000 patients from the nationwide registry of the Japanese Gastric Cancer Association (2001-2007). Gastric Cancer. 2018 Jan;21(1):144-154.
4. Menon S, Trudgill N. How commonly is upper gastrointestinal cancer missed at endoscopy? A meta‑analysis. Endosc Int Open. 2014 Jun;2(2):E46-50.
5. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. November 30 to December 1, 2002. Gastrointest Endosc. 2003 Dec;58(6 Suppl):S3-43.
6. Gastroent Hepatol 2022; 76(3):1-22.
7. Pimenta‑Melo AR, Monteiro‑Soares M, Libânio D, Dinis‑Ribeiro M. Missing rate for gastric cancer during upper gastrointestinal endoscopy: a systematic review and meta‑analysis. Eur J Gastroenterol Hepatol. 2016 Sep;28(9):1041-9.
8. Pimentel‑Nunes P, Libânio D, Marcos‑Pinto R, Areia M, Leja M, Esposito G, Garrido M, Kikuste I, Megraud F, Matysiak‑Budnik T, Annibale B, Dumonceau JM, Barros R, Fléjou JF, Carneiro F, van Hooft JE, Kuipers EJ, Dinis‑Ribeiro M. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019 Apr;51(4):365-388.
9. Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut. 2002 Jul;51(1):130-1.
10. Association Japanese Gastric Cancer. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer. 2011;14 : 113-23.
11. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer. 2021 Jan;24(1):1-21.
12. Abe Y, Inamori M, Iida H, et al. Clinical characteristics of patients with gastric perforation
13. following endoscopic submucosal resection for gastric cancer. Hepatogastroenterology 2009; 56 : 921-924.
14. Imagawa A, Okada H, Kawahara Y, et al. Endoscopic submucosal dissection for early
15. Gastric cancer: results and degrees of technical difficulty as well as success. Endoscopy 2006; 38 : 987-990.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hlavní téma – Digestivní endoskopie
- Endoskopická léčba časného kolorektálního karcinomu
- Současné trendy v diagnostice karcinomu pankreatu
- Časný karcinom žaludku
- Komplexní přístup k pacientovi s arteriální hypertenzí a dyslipidemií
- Aká srdcová frekvencia je riziková v rôznych štádiách kardiovaskulárneho kontinua?
- SGLT-2 inhibice užitečným nástrojem v léčbě srdečního selhání se sníženou i zachovalou ejekční frakcí
- Chronická plicní onemocnění a spánek
- Spontánní koronární disekce, kazuistiky dvou případů u mužů
- Jaký je cílový krevní tlak pro pacienty po transplantaci ledviny?
- Opustil nás MUDr. Tomáš Klíma
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Časný karcinom žaludku
- Endoskopická léčba časného kolorektálního karcinomu
- Komplexní přístup k pacientovi s arteriální hypertenzí a dyslipidemií
- Současné trendy v diagnostice karcinomu pankreatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání