-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
What’s new in 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST ‑ segment elevation?
The article sumarizes the 2020 ESC Guidelines for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation. The diagnostics of ACS consists in assessment of chest pain, EKG and cardiac troponin. Troponin should be evaluated by high sensitivity assay. 0h/1h algorithms should be used to rule-in or rule-out ACS. Patients with a positive troponin have higher risk of cardivascular events and mortality and the early invasive treatment should be applied in these patients. In the guidelines several antithrombotic stretegies for different clinical conditions are mentioned, where the cornerstone for the length and intensity of antithrombotic treatment is the evaluation of bleeding risk. Further on the revascularization aspects and strategies are debated in the guidelines. Finally there are mentioned two specific conditions of ACS – Myocardioal infarction with non-obstructive coronary arteries and Spontaneous coronary artery dissection.
Keywords:
Troponin – "rule‑in" and "rule‑out" algorithms – antiplateled treatment – early invasive treatment – MINOCA – Myocardioal infarction with non‑obstructive coronary arteries and Spontaneous coronary artery dissection
Autoři: Jan Mrózek 1,2; Jan Václavík 1,2
Působiště autorů: Interní a kardiologická klinika, Fakultní nemocnice Ostrava 1; Katedra interních oborů, Lékařská fakulta Ostravské Univerzity 2
Vyšlo v časopise: Vnitř Lék 2022; 68(5): 324-331
Kategorie: Přehledové články
doi: https://doi.org/10.36290/vnl.2022.067Souhrn
Článek shrnuje poslední Doporučené postupy evropské kardiologické společnosti pro léčbu akutních koronárních syndromů (AKS) bez ST elevací z roku 2020. Diagnostika AKS spočívá ve zhodnocení kliniky, EKG a posouzení srdečního troponinu. Troponin by měl být stanoven vysoce senzitivní analýzou, k vyloučení nebo potvrzení AKS jsou používány nejlépe 0/1hodinové protokoly. Pacienti s pozitivním troponinem mají výrazně vyšší riziko následných kardiovaskulárních příhod a mortality a měli by být časně – do 24 hodin – invazivně léčeni. V doporučených postupech jsou zmiňovány různé strategie antitrombotické léčby v různých klinických situacích, kdy základem pro intenzitu a délku antitrombotické léčby je zhodnocení rizika krvácení. Dále jsou v doporučených postupech diskutovány strategie revaskularizace a jsou věnovány odstavce dvěma specifickým jednotkám akutního koronárního syndromu – infarktu myokardu bez obstrukce koronárních tepen a spontánní koronární disekci.
Klíčová slova:
Troponin – protidestičková léčba – „rule‑in“ a „rule‑out“ algoritmy – časná invazivní léčba – infarkt myokardu bez koronární obstrukce – spontánní koronární disekce
Úvod
V roce 2020 vydala evropská kardiologická společnost nové doporučené postupy diagnostiky a léčby akutních koronárních syndromů bez elevací ST segmentu, kterými aktualizovala stávající doporučené postupy z roku 2015. Doporučené postupy jsou rozsahem na 52 stranách textu, 17 tabulkách a 13 schématech, s 563 odkazy na zdroje. V tomto článku shrnujeme zásadní poselství a novinky těchto doporučení.
Diagnostika AKS
Klidové EKG je základní diagnostickou metodou u pacientů s náhle vzniklým hrudním dyskomfortem. EKG by mělo být natočeno a interpretováno kvalifikovaným lékařem do 10 minut od prvního kontaktu pacienta se zdravotnickým personálem. Pacienti s perzitujícími ST elevacemi splňující diagnostická kritéria (> 1 mm elevace ve 2 a více konkomitantních svodech nebo nově vzniklý LBBB) mají stanovenu diagnózu akutního koronárního syndromu s ST elevacemi a jsou indikováni k okamžité koronarografii a následné perkutánní koronární intervenci (PCI). Pacienti s akutním koronárním syndromem bez elevací ST segmentu mohou mít na EKG přechodné nebo nediagnostické ST elevace, ST deprese, inverzi ST vlny, nebo až ve 30 % případů normální EKG.
Jako další vyšetření by měl být pacientům s bolestmi na hrudi proveden odběr kardiomarkerů, v první řadě srdečního troponinu. Elevace troponinu je biochemickým korelátem nekrózy myokardu a nejvyšší hodnota změřeného troponinu velmi dobře koreluje s velikostí infarktového ložiska a prognózou AKS. Pacienti s akutním koronárním syndromem a negativním troponinem (tedy s nestabilní anginou pectoris) mají podstatně lepší prognózu než pacienti s troponinem pozitivním a méně profitují z invazivního přístupu. Maximální hodnota naměřeného troponinu je však ovlivněna i dalšími parametry, jako jsou glomerulární filtrace, věk (rozdíl až 300 % u infarktu stejného rozsahu), pohlaví a načasování odběru ve vztahu k začátku obtíží.
Vysoce senzitivní analýzy troponinu
Evropská doporučení jednoznačně preferují vysoce senzitivní analýzy troponinu, protože díky vyšší citlivosti umožňují včasnější diagnostiku myokardiální nekrózy než konvenční analýzy (Obr. 1).
Obr. 1. Rozdíly mezi konvenční analýzou (vlevo – hodnoceno v μg/l) a vysoce senzitivní analýzou srdečního troponinu (vpravo – hodnoceno v ng/l), pouze vysoce senzitivní analýza umožňuje rozlišení mezi normálními a patologickými hodnotami (podle 1) 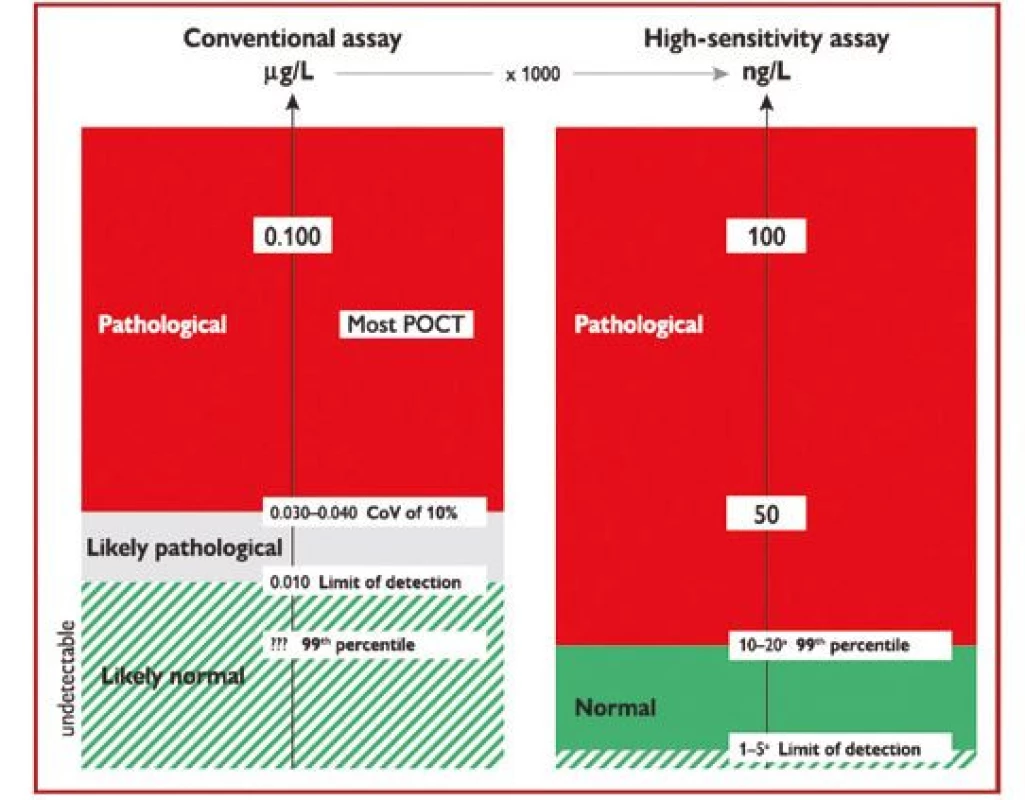
CoV – variační koeficient; POCT – point-of-care test (test v místě péče o pacienta) V současné době prakticky všechny analýzy prováděné v laboratořích na automatických analyzátorech využívají vysoce senzitivní analýzy srdečních troponinů, na rozdíl od většiny testů troponinu prováděných lokálně v ambulancích (Point of care test – POCT). Proto jsou v současné době preferovány laboratorní analýzy troponinu před POCT testy, i když jsou již na trhu dostupné i POCT vysoce senzitivní analýzy troponinu.
Při hodnocení srdečního troponinu, zvláště hodnoceného vysoce senzitivní analýzou, je třeba si uvědomit, že zvýšené hodnoty bývají přítomny kromě akutního infarktu myokardu 1 typu u celé řady srdečních i nekardiálních onemocnění (Tab. 1).
Tab. 1. Jiná onemocnění než akutní infarkt myokardu 1. typu spojená s elevací troponinu (podle 1) 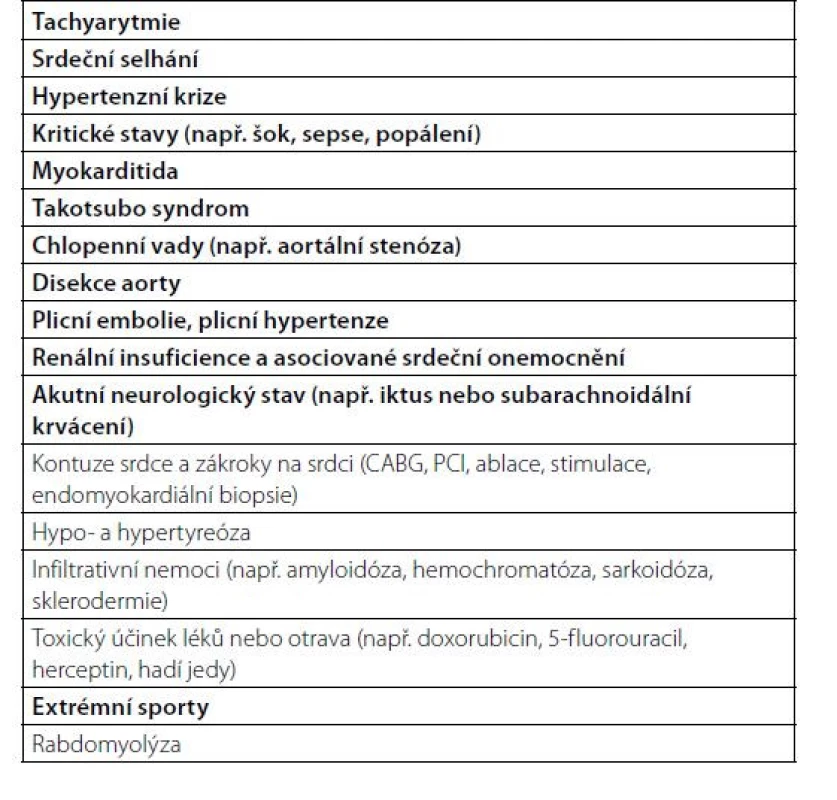
Rychlé „rule ‑ in“ a „rule ‑ out“ algoritmy hodnocení troponinu
Díky vysoké citlivosti analýzy troponinu je rovněž zkrácena časová prodleva mezi začátkem infarktu myokardu a schopností jeho laboratorní detekce, což umožňuje rychleji zahájit léčbu akutního koronárního syndromu nebo naopak vyloučit akutní infarkt myokardu u pacientů, u nichž jsou hodnoty troponinu negativní. Je doporučen sekvenční odběr krve na troponin při příjmu a za hodinu (0h/1h algoritmus), resp. za 2 hodiny (0h/2h algoritmus). Použití 0h/3h algoritmu je rovněž možné a bezpečné, nicméně oproti předchozím algoritmům tento algoritmus je méně výhodný vzhledem k časovému zdržení.
Pro vyloučení akutního koronárního syndromu „rule‑out“ musí být hodnoty troponinu vstupně i po 1 nebo 2 hodinách velmi nízké, nebo musí být obě hodnoty nízké a zároveň nesmí být druhá hodnota výrazně vyšší než první (tzv. delta – Δ). V tomto případě je akutní infarkt myokardu s 99% pravděpodobností vyloučen a pacient může být bezpečně dimitován a došetřen ambulantně. Část těchto pacientů s vyšší klinickou pravděpodobností AKS – tedy se suspektní nestabilní anginou pectoris – by však měla být dále elektivně vyšetřena včetně provedení invazivní koronarografie.
Pro potvrzení akutního infarktu myokardu „rule‑in“ je naopak již vstupní hodnota troponinu na horní nebo nad horní hranicí normy a při druhém odběru hodnota dále stoupne. Pozitivní predikční hodnota „rule‑in“ algoritmu pro potvrzení AKS je sice jen 70–75 %, přesto by měli být všichni tito pacienti agresivně léčeni jako AKS včetně časné koronarografie. Pacienti, kteří nesplňují kritéria „rule‑in“ ani „rule‑out“, by měli být dále observováni včetně dalších sekvenčních odběrů troponinu, EKG, event. dalšího neinvazivního a invazivního došetření (Obr. 2). Pro analytické systémy jednotlivých firem se číselné hodnoty troponinu, resp. Δ troponinu pro „rule‑out“ a „rule‑in“ algoritmy liší, je třeba se tedy informovat v lokální laboratoři ohledně těchto hodnot. Nejčastejší analýzy srdečních troponinů dostupné na českém trhu jsou uvedeny v tabulce 2.
Obr. 2. 0h/1h „rule-out“ a „rule-in“ algoritmus využívající vysoce senzitivní analýzy srdečního troponinu na odděleních urgentního příjmu u hemodynamicky stabilních pacientů s příznaky podezřelými z infarktu myokardu bez ST elevací (podle 1) 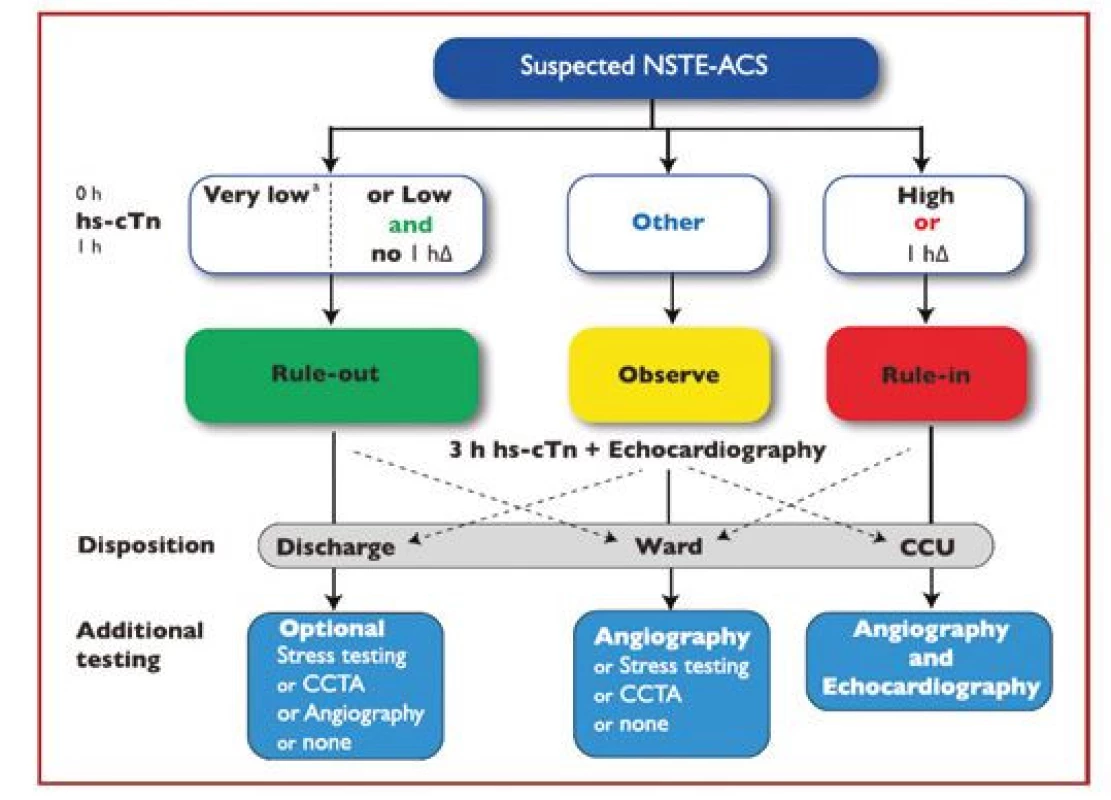
0 h – vstupní odběr troponinu; 1 h – odběr troponinu za 1 hodinu od příjmu; 3 h – odběr troponinu za 3 hodiny od příjmu; CCU – koronární jednotka; CTCA – koronarografie pomocí výpočetní tomografie; hs‑ cTn – vysoce senzitivní analýza srdečního troponinu; hΔ – rozdíl hodnot troponinu mezi vstupním odběrem a odběrem za hodinu 0 h – vstupní odběr troponinu; 1 h – odběr troponinu za 1 hodinu od příjmu; 3 h – odběr troponinu za 3 hodiny od příjmu; CCU – koronární jednotka; CTCA – koronarografie pomocí výpočetní tomografie; hs‑ cTn – vysoce senzitivní analýza srdečního troponinu; hΔ – rozdíl hodnot troponinu mezi vstupním odběrem a odběrem za hodinu Tab. 2. Specifické cut-off hodnoty „rule in“ a „rule out“ algoritmy pro nejčastější analýzy troponinu dostupné na českém trhu (v ng/l) (podle 1) 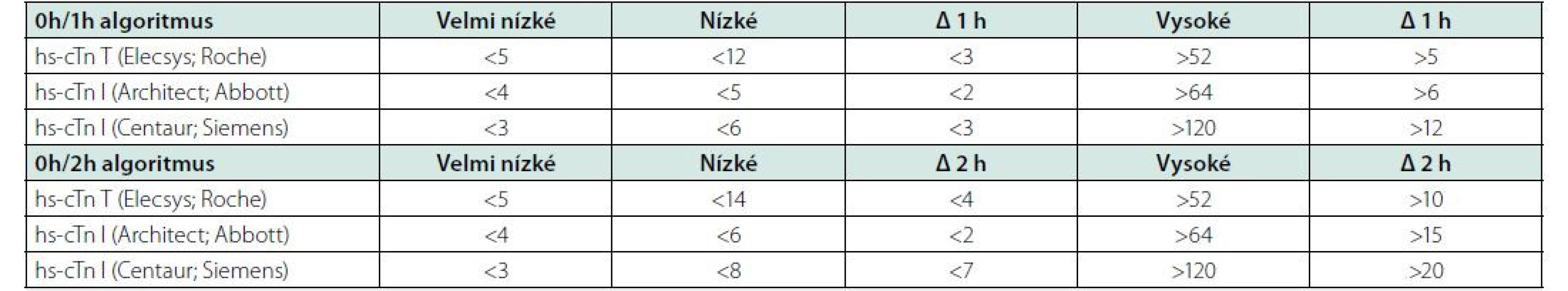
Tyto hodnoty jsou uvedeny bez ohledu na renální funkce a věk. Hodnoty pro pacienty nad 75 let a pacienty s renální insuficiencí se mohou lišit od uvedených hodnot.
hs-cTn – vysoce senzitivní srdeční troponin.Ostatní biomarkery a zhodnocení rizika a prognózy akutního infarktu myokardu
Srdeční troponin je zdaleka nejvíce používaný a nejužitečnější marker nekrózy srdečního svalu, a tedy akutního infarktu myokardu. Za specifických okolností je možno použít při diagnostice akutního koronárního syndromu i jiné kardiomarkery. Myokardiální frakce kreatinkinázy (CK‑MB) po akutním infarktu klesá rychleji (již za cca 48 hodin) k normálním hodnotám, proto je možné ji použít k diagnostice časného reinfarktu. Další kardiomarkery, které je možné použít jako alternativu nebo ke zpřesnění laboratorní diagnostiky akutního infarktu myokardu, jsou Myosin binding protein, copeptin a C‑terminální část vazopresinového prohormonu, jejich použití se však rutinně nedoporučuje. K biomarkerům, které mají přídatnou prognostickou hodnotu u akutního infarktu, jsou kromě již zmiňovaného troponinu například B natriuretický peptid (BNP), respektive N terminální fragment prohormonu BNP (NT‑proBNP), glomerulární filtrace (GFR) nebo hladina glukózy. Na základě klinických a laboratorních ukazatelů je možno vypočítat tzv. GRACE skóre, které dokáže přesněji zhodnotit riziko 6měsíčního úmrtí u pacientů s akutním infarktem myokardu.
Neinvazivní vyšetřovací metody u pacientů s podezřením na akutní infarkt myokardu
U všech pacientů s bolestí na hrudi by měl být proveden předozadní skiagram hrudníku k vyloučení pneumothoraxu, pneumonie nebo patologie skeletu a posouzení dilatace srdečního stínu a známek městnání. Rovněž echokardiografické vyšetření by mělo být rutinně dostupné na odděleních akutního příjmu k posouzení možných známek ischemie (jako ložiskových poruch kinetiky) a zároveň k posouzení i jiných patologií (aortální disekce, aortální stenóza, perikardiální výpotek, plicní embolie).
U pacientů s bolestmi na hrudi a nízkým rizikem – tedy hemodynamicky stabilních, s normálním EKG, negativním troponinem a s nízkým GRACE skóre může být elektivně proveden zátěžový test, preferenčně se zobrazovacími metodami – zátěžové echo nebo SPECT. Rovněž magnetická rezonance srdce dokáže posoudit perfuzi myokardem, poruchu kinetiky a zároveň přítomnosti jizvy, proto normální nález na MR srdce u pacientů s bolestmi na hrudi dobře koreluje s příznivou prognózou. Navíc může MRI srdce diagnostikovat jiné příčiny bolestí na hrudi, jako např. myokarditidu nebo Takotsubo KMP. Alternativou zátěžových testů může být i CT koronarografie, která dokáže vyloučit koronární chorobu. Použití CT koronarografie však není vhodné u pacientů s již známou ICHS, zvláště po koronární revaskularizaci. Všechny výše uvedené neinvazivní testy mají dobrou negativně prediktivní hodnotu k vyloučení AKS a jejich negativní výsledek dobře koreluje s dobrou krátkodobou i střednědobou prognózou, a tak mohou snížit potřebu invazivní koronarografie.
Zhodnocení rizika krvácení
Vzhledem k tomu, že základní léčbou akutního koronárního syndromu je podání antitrombotické (protidestičkové a případně antikoagulační) léčby, je posouzení rizika krvácení velmi důležité. Navíc je prokázáno, že krvácení je spojeno s vyšším rizikem mortality a paradoxně i vyšším rizikem ischemických příhod. Faktory vysokého rizika krvácení u pacientů léčených PCI dle Akademického výzkumu konsorcia pro vysoké riziko krvácení (ARC‑HBR) jsou zmíněny v tabulce 3. Rovněž byla vytvořena celá řada predikčních skóre k posouzení rizika akutního krvácení při AKS, jako jsou např. CRUSADE nebo ACUITY. Naopak skóre PRECISE‑DAPT určuje dlouhodobé riziko krvácení, u pacientů s vysokým skóre PRECISE‑DAPT ≥ 25 byl prokázán přínos zkrácení duální antiagregace na 3–6 měsíců oproti standardní délce.
Tab. 3. Velká a malá kritéria vysokého rizika krvácení během perkutánní koronární intervence podle Akademického výzkumného konsorcia pro vysoké riziko krvácení (Academic Research Consortium for High Bleeding Risk – ARC-HBR). Vysoké riziko krvácení je v přítomnosti alespoň jednoho velkého a dvou malých kritérií 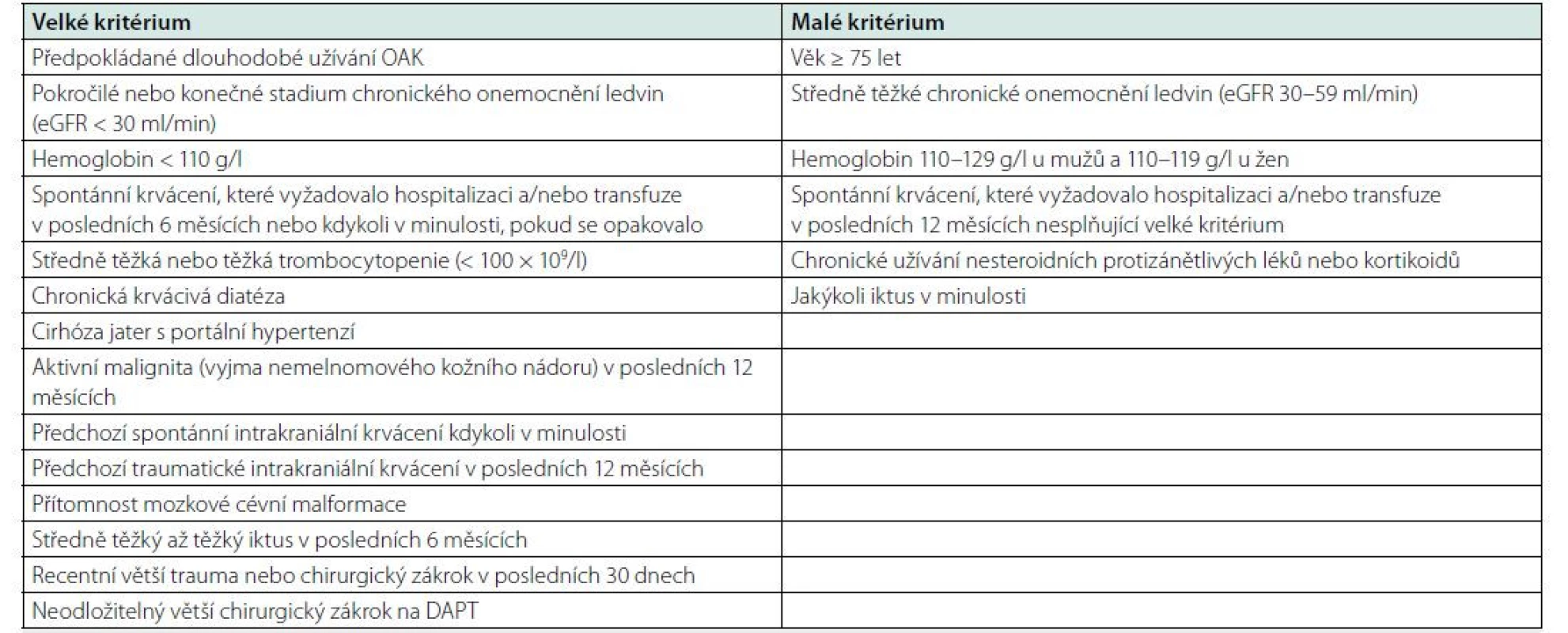
DAPT – duální protidestičková léčba; eGFR – odhadovaná glomerulární filtrace; OAK – orální antikoagulace; PCI – perkutánní koronární intervence. Antitrombotická léčba akutních koronárních syndromů
Aktivace destiček a koagulační kaskády hraje klíčovou roli při uzávěru koronární tepny. Proto jsou protidestičkové léky a přechodně i parenterální antikoagulancia základním kamenem léčby koronárních syndromů.
Parenterální antikoagulancia a protidestičkové léky
Parenterální antikoagulancia by měla být podána ihned po stanovaní diagnózy a v jejich používání by mělo být pokračováno až do koronární intervence. Standardním a nejčastěji užívaným antikoagulanciem je nefrakcionovaný heparin v úvodní dávce 70–100 j/kg s následnou kontinuální infuzí. Z nízkomolekulárních heparinů má nejlepší data enoxaparin, který oproti heparinu snižuje jak krvácivé, tak ischemické riziko. Bivalirudin ve studii MATRIX neprokázal výhodu oproti nefrakcionovanému heparinu a byl spojen s vyšším rizikem trombózy stentu. Rovněž fondaparinux není v případě časného invazivního přístupu doporučován pro vyšší riziko periprocedurální trombózy.
Intravenózní protidestičkové léky mají své místo pouze nouzově v případě trombotických komplikací během PCI, kdy je možno použít inhibitory IIb/IIIa receptorů (abciximab, eptifibatid nebo tirofiban). Cangrelor – intravenózní blokátor P2Y12 – nemá dosud ujasněné místo použití s ohledem na ne zcela uspokojivá data (studie CHAMPION PLATFORM a PCI).
Perorální protidestičkové léky
Acetylsalicylová kyselina (ASA) zůstává primárním protidestičkovým lékem. Úvodní dávka je doporučována 100–300 mg p. o., jen v případě nemožnosti perorálního příjmu je možné použít intravenózní formu v úvodní dávce 75–250 mg. Standardně je při akutním koronárním syndromu acetylsalicylová kyselina kombinována s některým z inhibitorů receptoru P2Y12 – prasugrelem, ticagrelorem nebo clopidogrelem, hovoříme pak o duální protidestičkové léčbě (DAPT). Z těchto tří protidestičkových léků se ukázal být nejúčinnějším prasugrel, který při srovnání s ticagrelorem ve studii ISAR‑REACT 5 snížil riziko kombinovaného ischemického endpointu (úmrtí, infarktu a CMP) o 27 %, a to při srovnatelném riziku krvácení. Při jeho použití je ovšem třeba brát v úvahu vyšší riziko krvácení oproti clopidogrelu (o 32 % ve studii TRITON–TIMI 38) a při jeho užití je proto nutno respektovat kontraindikace (včetně ischemické cévní mozkové příhody v anamnéze) a zvážit jeho užívání u pacientů starších 75 let. Druhým z P2Y12 blokátorů je ticagrelor, který ve studii PLATO prokázal vyšší účinnost oproti clopidogrelu. Jeho nevýhodou je nutnost užívání 2× denně a častá dušnost jako nežádoucí účinek, což může vést k horší adherenci. Z těchto důvodů zůstává clopidogrel stále možnou alternativou k ticagreloru i prasugrelu.
Předléčení P2Y12 inhibitory
Jako předléčení P2Y12 inhibitory bývá označována strategie, kdy je zahájeno podávání těchto léků ihned po stanovení diagnózy AKS, ještě před provedením diagnostické koronarografie a PCI – podobně jako podávání ASA a heparinu. Ačkoli se předléčení P2Y12 jeví jako logické a je široce rozšířeno, je pro jeho použití jen málo kvalitních dat z randomizovaných studií.
Ve studii PCI‑CURE vedlo sice předléčení clopidogrelem k nižšímu riziku ischemických příhod, avšak medián času mezi zahájením podávání clopidogrelu a PCI byl 6 dní, což neodpovídá doporučené časné invazivní strategii. Ticagrelor má data pouze u STEMI pacientů ze studie ATLANTIC, kde předléčení ticagrelorem vedlo k nižší incidenci časné trombózy ve stentu, avšak do klinických ukazatelů se to nepromítlo. Předléčení prasugrelem ve studii ACCOAST nepřineslo žádný prospěch při redukci ischemie a naopak vedlo k vyššímu riziku krvácení. Stejně tak i ve studii ISAR REACT 5 pacienti v prasugrelové větvi bez předléčení měli lepší výsledky než ve větvi s ticagrelorem s předléčením jak z hlediska ischemie, tak krvácení.
Data o neprospěšnosti předléčení v randomizovaných studiích byla navíc potvrzena i v observačních registrech, jako např. ve švédském registru SCAAR. Proto není předléčení P2Y12 doporučováno při předpokládané časné invazivní strategii, u odložené invazivní strategie je možno předléčení individuálně zvážit.
Udržovací protidestičková léčba
Standardní léčbou po prodělaném akutním koronárním syndromu je duální protidestičková léčba po dobu 12 měsíců následovaná monoterapií ASA. Prodloužení nebo naopak zkrácení DAPT se řídí zejména rizikem krvácení.
U pacientů s vysokým rizikem krvácení (např. PRECISE DAPT skóre ≥ 25) je doporučena duální protidestičková léčba ASA s clopidogrelem s následným dřívějším vysazením jednoho z těchto léků po 3 měsících. Byla provedena celá řada studií jednotlivých strategií zkrácení duální protidestičkové léčby, které spočívaly v časném vysazení P2Y12 blokátoru (studie PRECISE DAPT), vysazení ASA (studie SMART CHOICE, SMART DATE, GLOBAL LEADERS). Většina těchto studií vyšla pozitivně pro zkrácení léčby ve smyslu snížení rizika krvácení při nezvýšeném riziku ischemických příhod.
U pacientů s nízkým rizikem krvácení a zároveň nízkým rizikem ischemie je možno provést tzv. deeskalci léčby – tedy záměnu prasugrelu nebo ticagreloru za clopidogrel (studie TRANSLATE ACS, TROPICAL ACS) nebo pacienta převést po 3 měsících DAPT na monoterapii ticagrelorem (studie TWILIGHT).
U pacientů s vysokým rizikem ischemie a zároveň nízkým rizikem krvácení je možno prodloužit duální léčbu na více než 12 měsíců po IM, a to kombinací ASA s redukovanou dávkou ticagreloru 2 × 60 mg denně nebo kombinací ASA s nízkou dávkou rivaroxabanu 2 × 2,5 mg denně. Jednotlivé strategie prodloužení nebo zkrácení DAPT jsou shrnuty v obrázku 3.
Obr. 3. Algoritmus antitrombotické léčby u pacientů s akutním koronárním syndromem bez ST elevací bez fibrilace síní léčených perkutánní koronární intervencí. Barevné označení je podle třídy doporučení ESC (zelené = třída I, žluté = třída IIa, oranžové = třída IIb). Vysoké riziko krvácení znamená zvýšené riziko spontánního krvácení během DAPT (například PRECISE‑DAPT skóre > 25 nebo ARC‑HBR). Velmi vysoké riziko krvácení je definováno jako krvácení v posledním měsíci nebo neodložitelná operace (podle 1) 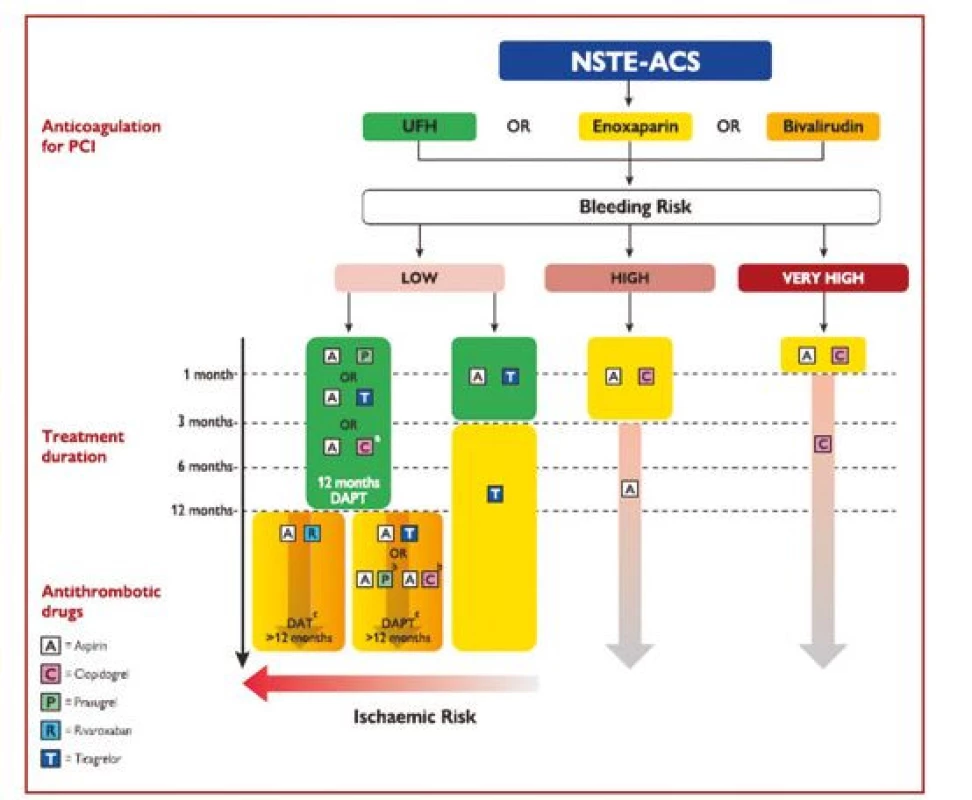
A – aspirin; ARC-HBR – Academic Research Consortium – High Bleeding Risk; C – clopidogrel; DAPT – duální protidestičková léčba; DAT – duální antitrombotická léčba (zde : aspirin + rivaroxaban); eGFR – odhadovaná glomerulární filtrace; ESC – Evropská kardiologická společnost; NSTE-ACS – akutní koronární syndrom bez ST elevací; P – prasugrel; PCI – perkutánní koronární intervence; PRECISE-DAPT – PREdicting bleeding Complications In patients undergoing Stent implantation and subsEquent Dual Anti Platelet Therapy; R – rivaroxaban; T – ticagrelor; UFH – nefrakcionovaný heparin Protidestičkové léky u pacientů vyžadujících dlouhodobou orální antikoagulaci
Asi 6–8 % pacientů po PCI užívá perorální antikoagulaci, nejčastěji z důvodu fibrilace síní. Pacienti s kombinací duální protidestičkové a antikoagulační léčby (tzv. tripple terapie) mají vysoké riziko krvácení. Přesto by užívání orální antikoagulace nemělo být důvodem odložení PCI. U warfarinizovaných pacientů se doporučuje koronarografie provést radiálním přístupem bez vysazení warfarinu. U pacientů s INR > 2,5 se během PCI již nepřidává heparin.
Po PCI je rutinně doporučeno užívat tripple terapii pouze po krátkou dobu – max. 1 týden, následně se po dobu 1 roku doporučuje kombinace orální antikoagulace s inhibitorem P2Y12, obvykle s clopidogrelem. U pacientů s vyšším rizikem ischemie se doporučuje prodloužení tripple terapie až na 1 měsíc, případně kombinovat antikoagulancia s prasugrelem nebo ticagrelorem. Z nových antikoagulancií má jediný apixaban studii, kde je srovnáván oproti warfarinu v kombinaci s 1 protidestičkovým lékem. V této studii (AUGUSTUS) vedlo užívání apixabanu k nižšímu riziku krvácení i celkové mortality. Jednotlivé strategie kombinace orální antikoagulace a prodidestičkových léků jsou uvedeny na obrázku 4.
Obr. 4. Algoritmus antitrombotické léčby u pacientů s akutním koronárním syndromem bez ST elevací s fibrilací síní léčených perkutánní koronární intervencí. Barevné označení je podle třídy doporučení ESC (zelené = třída I, žluté = třída IIa, oranžové = třída IIb). Preference NOAC oproti VKA je obvyklá strategie, pokud není jejich kontraindikace (podle 1) 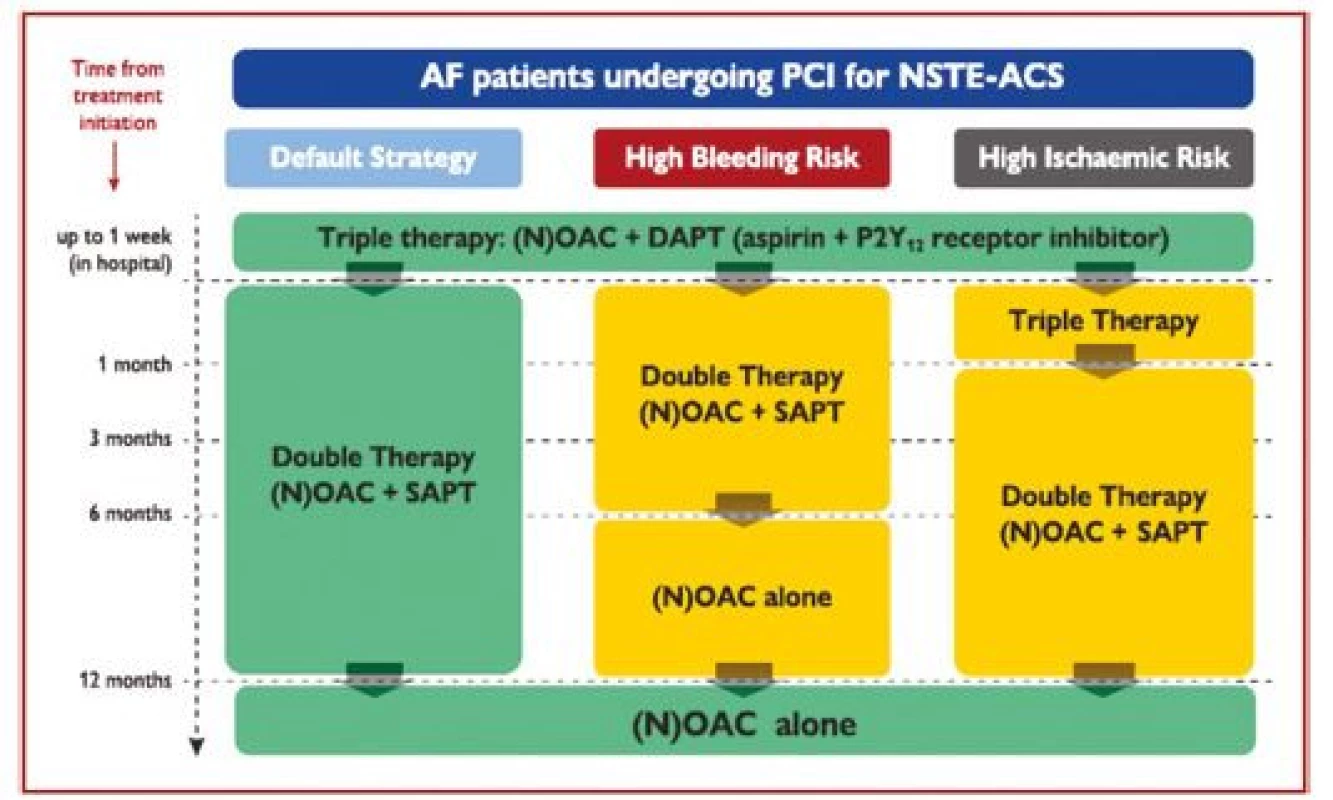
AF – fibrilace síní; DAPT – duální protidestičková léčba; DAT – duální antitrombotická léčba; NOAC – nová (neantagonisté vitaminu K) orální antikoagulancia; NSTE-ACS – akutní koronární syndrom bez ST elevací; OAC – orální antikoagulancia; PCI – perkutánní koronární intervence; SAPT – protidestičková léčba jedním lékem; TAT – trojitá antitrombotická léčba; VKA – antagonista vitaminu K. Stratifkace rizika a načasování invazivní léčby
U akutního koronárního syndromu bez ST elevací by měla být indikována a načasována invazivní koronarografie na základě stratifikace rizika – viz obrázek 5. Pacienti s nejvyšším rizikem by měli být indikováni k okamžité koronarografii, viz podobně jako STEMI. Jedná se o pacienty s projevy hemodynamické nestability, akutním srdečním selháním při AKS, trvajícími nebo rekurentními stenokardiemi i přes úvodní medikamentózní léčbu a dále pacienty s ST depresemi v 6 svodech + ST elevacemi v aVR. Ostatní pacienti s pozitivním troponinem, tedy s NSTEMI, by měli být koronarografováni do 24 hodin, stejně jako pacienti po oběhové zástavě v nepřítomnosti STEMI, s dynamickými nebo novými ST depresemi a GRACE skóre > 140. Naopak pacienti v nízkém riziku by měli být vyšetřování invazivně pouze selektivně a měly by být u nich provedeny primárně neinvazivní diagnostické testy dle doporučených postupů pro léčbu chronických koronárních syndromů. K invazivní koronarografii by rovněž neměli být indikováni pacienti, u nichž je kontraindikace antikoagulační nebo protidestičkové léčby například z důvodu aktivního krvácení.
Obr. 5. Strategie léčby akutních koronárních syndromů a načasování invazivní léčby podle stratifikace iniciálního rizika (podle 1) 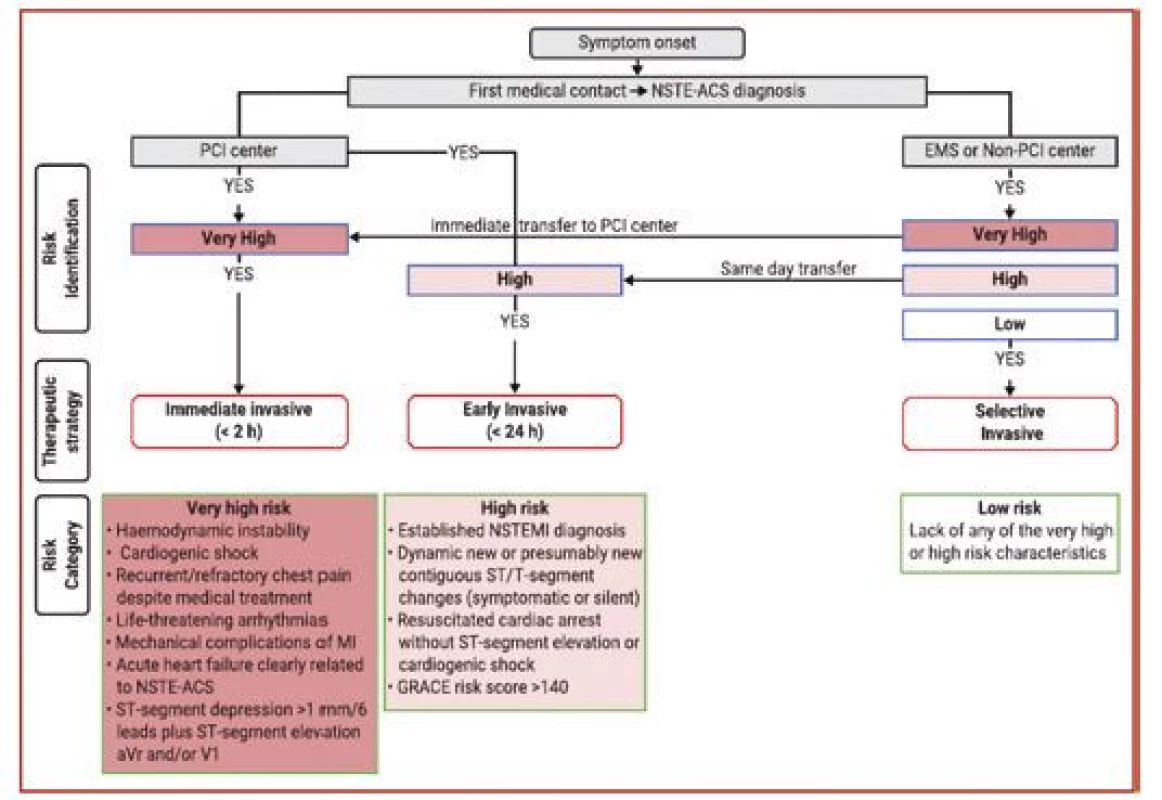
EMS – rychlá zdravotnická služba; GRACE – globální registr akutních koronárních syndromů; MI – infarkt myokardu; NSTE-ACS – akutní koronární syndrom bez ST elevací; NSTEMI – akutní infarkt myokardu bez ST elevací; PCI – perkutánní koronární intervence. Strategie revaskularizace a technické aspekty PCI
Ke koronarografii by měl být rutinně používán radiální přístup, neboť oproti femorálnímu výrazně snižuje riziko krvácivých komplikací. Pacienti s renální insuficiencí by měli být před koronarografií adekvátně hydratováni a měla by u nich být použita isoosmolární kontrastní látka. Volba druhu revaskularizace (PCI vs. CABG) se u pacientů s AKS neliší od pacientů s chronickými koronárními syndromy. Pacienti s komplexním koronárním postižením (vyjádřeným např. pomocí Syntax skóre), zejména diabetici, pacienti s renální insuficiencí a pacienti se systolickou dysfunkcí LK profitují z dlouhodobého hlediska více z chirurgické revaskularizace, proto by volba druhu revaskularizace u komplexních případů měla být ponechána na rozhodnutí indikační komise – „Heart teamu“. U pacientů s vícečetným postižením koronárních tepen, u nichž bylo rozhodnuto o perkutánní revaskularizaci, prokázaly některé studie benefit časné PCI všech stenóz v jedné době (SMILE, CvLPRIT, PRAMI). Při zvažování kompletnosti a načasování revaskularizace je však třeba přihlédnout k celkovému stavu pacienta, renálním funkcím a dalším komorbiditám. U pacientů s kardiogenním šokem se doporučuje iniciálně revaskularizovat pouze culprit léze (studie CULPRIT SHOCK). Použití intrakoronárních zobrazovacích metod (IVUS a OCT) zlepšuje dlouhodobé výsledky PCI, naopak role funkčního hodnocení lézí pomocí FFR není u AKS dosud zcela jasná.
MINOCA syndrom – infarkt myokardu bez obstruktivní koronární choroby
Myocardial infarction with non‑obstructive coronary arteries (MINOCA) je definován jako akutní infarkt myokardu dle WHO 3 univerzální definice, nepřítomnosti významné (> 50%) koronární stenózy a nepřítomnosti jiné zjevné alternativní diagnózy. Jedná se spíše o pracovní diagnózu zahrnující celou řadu různých poškození myokardu ischemické (např. anemie, arytmie, embolizace do koronárních tepen) i neischemické (sepse, plicní embolie) etiologie, našim cílem by mělo být tyto stavy rozpoznat a dále léčit. Základní diagnostickou modalitou u MINOCA syndromu je magnetická rezonance srdce, která dokáže rozlišit ischemické postižení myokardu od neischemického a diagnostikovat např. akutní myokarditidu nebo Tako‑tsubo kardiomyopatii. Při nejasném koronárním nálezu mohou pomoci k objasnění příčiny MINOCA syndromu intrakoronární zobrazovací metody nebo vazokonstrikční provokační test s acytylcholinem nebo ergonovinem.
SCAD – spontánní koronární disekce
Spontaneous coronary artery dissection (SCAD) jsou příčinou akutního koronárního syndromu asi ve 4 procentech, daleko častěji se vyskytují u mladších žen (< 60 let), pacientů s neuropsychickými obtížemi (deprese nebo úzkost), často je vyvolávajícím faktorem emergentní hypertenzní stav. Na koronarogramu se manifestují nejčastěji jako dlouhé stenózy hladkých okrajů, lokalizované převážně v distálnějších segmentech tepen, způsobené kompresí lumina tepny intramurálním hematomem. Diagnózu pomohou stanovit intrakoronární zobrazovací metody (IVUS a OCT). Léčba SCAD spočívá v agresivní antihypertenzní léčbě, kdy lékem volby jsou betablokátory. Strategie antiagregační léčby není zcela určena. Intervenční léčba by měla být vyhrazena pouze pacientům s poruchou koronárního průtoku a pacientům s recidivujícími projevy ischemie, u většiny ostatních se doporučuje konzervativní vyčkávání, neboť většina koronárních disekcí se spontánně zhojí.
Dlouhodobá léčba a sekundární prevence po akutním koronárním syndromu
Antitrombotická léčba po prodělaném infarktu je diskutována v předchozích odstavcích. Dále by měl být každý pacient po prodělaném akutním koronárním syndromu léčen časně agresivní hypolipidemickou léčbou. Lékem volby jsou statiny ve vysoké dávce s cílovou hodnotou LDL < 1,4 mmol/l a současně snížení LDL alespoň o 50 % oproti výchozí hodnotě. U pacientů, kteří po 4–6 týdnech nedosáhnou cílových hodnot, by měl být k léčbě přidán ezetimib. V případě, že ani maximální dávka statinu s ezetimibem nedosáhne hodnot < 1,4 mmol, mají být do léčby zařazeny PCSK9 inhibitory.
Pacient po prodělaném IM s absencí kontraindikací by měl být léčen betablokátorem, zejména pokud je přítomna systolická dysfunkce LK nebo srdeční selhání. Pacient s hypertenzí, srdečním selháním, dysfunkcí LK < 40%, diabetem nebo renálním selháním by měl být léčen ACEI. Inhibitory protonové pumpy by měly být podávány pouze pacientům s vyšším rizikem gastrointestinálního krvácení, jako jsou pacienti se známou vředovou chorobou nebo refluxní ezofagitidou, dyspepsiemi, věkem > 65 let a současným užíváním kortikoidů nebo nesteroidních antiflogistik. U diabetiků po prodělaném infarktu myokardu jsou preferovanou skupinou antidiabetik analoga glukagon‑like peptidu 1 (GLP1A) a inhibitory kontransporteru 2 pro glukózu a sodík (SGLT2i). Rovněž by se nemělo zapomínat u pacientů po prodělaném IM na pravidelné roční očkování proti chřipce.
Důležitá jsou v sekundární prevenci nefarmakologická a režimová opatření – doporučována má být změna životního stylu, zdravá dieta, pacienti mají být povzbuzováni k zanechání kouření, vhodné jsou rehabilitační programy k řízené kardiální rehabilitaci. Pacientům by rovněž měla být poskytnuta psychická podpora a měli by být zainteresováni na léčbě a prevenci.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Mrózek
Interní a kardiologická klinika, Fakultní nemocnice Ostrava
17. listopadu 1790/5, 708 00 Ostrava-Poruba
Cit. zkr: Vnitř Lék. 2022;68(5):324-331
Článek přijat redakcí: 23. 5. 2022
Článek přijat po recenzích: 8. 6. 2022
Zdroje
1. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST‑segment elevation. European Heart Journal. 2021;42 : 1289-1367.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



