-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metabolický syndrom u pacientů po prodělané protinádorové terapii
Anti-cancer therapy-induced metabolic syndrome
The increasing number of long-term survivors that underwent the anti-cancer therapy faces the late treatment-related adverse effects and the increased risk of developing metabolic syndrome. This article defines the pathophysiology that underlies development of anti-cancer therapy-related metabolic syndrome and outlines the possibility of optimisation of comprehensive care focusing on prevention. Considering the preventability of metabolic syndrome, effective screening and follow-up appropriate for patients at increased risk of related adverse events should be established. Subsequently, early initiation of therapy targeting the hallmarks of metabolic syndrome may ease its manifestation in long-term perspective.
Keywords:
metabolic syndrome – oncology – anti-cancer therapy
Autoři: Eva Řiháčková 1; Lubomír Elbl 1; Michal Řiháček 2; Mária Holická 1; Petr Kala 1
Působiště autorů: Interní kardiologická klinika, LF MU a FN Brno 1; Biochemický ústav, LF MU, Brno 2
Vyšlo v časopise: Vnitř Lék 2021; 67(6): 334-338
Kategorie: Přehledové články
Souhrn
Zvyšující se počet dlouhodobě přeživších po onkologické terapii čelí pozdním následkům léčby včetně zvýšeného rizika rozvoje metabolického syndromu. V tomto článku se zabýváme patofyziologií rozvoje metabolického syndromu po prodělané protinádorové terapii a nastiňujeme možnosti prevence v rámci komplexní péče o pacienta. S ohledem na možnost prevence metabolického syndromu je vhodné pro pacienty ve zvýšeném riziku zajistit screening, efektivní sledování a časné zahájení terapie jednotlivých složek metabolického syndromu.
Klíčová slova:
metabolický syndrom – onkologie – protinádorová terapie
Úvod
Díky efektivnější kombinované protinádorové léčbě a aplikaci moderních postupů se prodlužuje doba přežívání onkologických pacientů. Cílem toho článku je upozornit na rostoucí počet osob ve zvýšeném riziku rozvoje metabolického syndromu, kdy jejich identifikace, stratifikace dle režimu protinádorové terapie a cílené sledování by měly vést k redukci morbidity a mortality z kardiovaskulárních příčin.
Patofyziologie metabolického syndromu
Základ k současné klinické definici metabolického syndromu položil G. M. Raeven v roce 1998, když si v souvislosti s inzulinorezistencí všiml kombinace faktorů, které jej často doprovází: vyšší krevní tlak a typická dyslipidemie, tedy vyšší hladina triglyceridů a nižší hladina HDL cholesterolu (1).
Problematickou se v současné době jeví nomenklaturní nejednotnost definic metabolického syndromu od definic zažitých, jako jsou definice NCEP ATP III nebo WHO definice, až po novější, jako je „Lipid accumulation product“, která je dle některých studií dobrým prediktorem rozvoje metabolického syndromu (2, 3).
Řada definic se liší v tom, který z faktorů je podmíněně obsažen, aby byla naplněna požadovaná kritéria pro jednotlivé definice. Nejčastěji používanou definicí v České republice je Harmonizovaná definice metabolického syndromu z roku 2009, kde není ani jeden z faktorů podmíněný a k naplnění definice je postačující, aby byly splněny libovolné tři z pěti kritérií, viz tabulka 1.
Tab. 1. Harmonizovaná definice metabolického syndromu z roku 2009 (4) 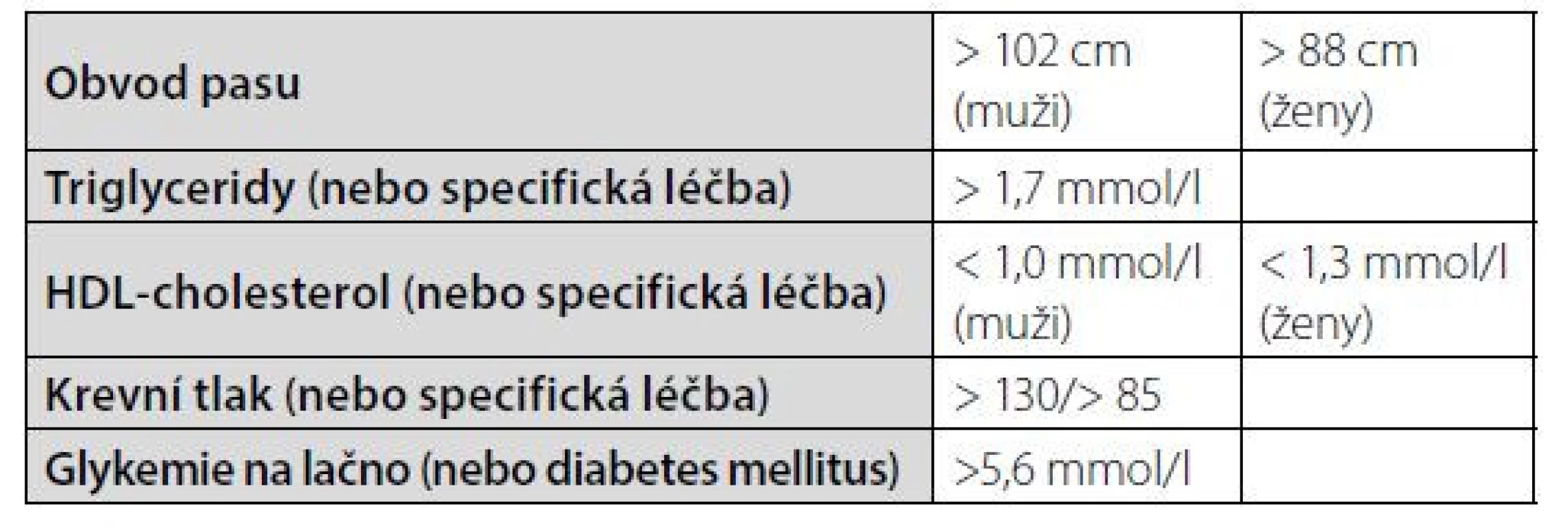
Metabolický syndrom představuje protrombogenní, prozánětlivý stav a tuková tkáň je považována za biologicky velmi aktivní endokrinní orgán (5). V závislosti na hodnotě nutričního příjmu pak tuková tkáň podléhá hypertrofii, čímž se její cévní zásobení stává nedostatečným, dochází k hypoxii a atrakci makrofágů s produkcí prozánětlivých mediátorů, jako tumor nekrosis faktoru α, interleukinu 6 či inhibitoru aktivátoru tkáňového plazminogenu-1, jehož elevované hodnoty jsou asociovány s protrombogenním stavem (6, 7). Vysoké hladiny interleukinu 6 jsou asociovány s akcelerovanou aterosklerózou (8) a tumor nekrosis faktor α hraje roli v řadě kardiovaskulárních onemocnění včetně srdečního selhání (9).
U pacientů s metabolickým syndromem je naopak pozorována nižší hladina exprese protizánětlivě působícího adiponektinu, jehož hladiny negativně korelují s objemem pasu, množstvím viscerálního tuku a hladinou inzulinu (10). Adiponektin inhibuje proaterogenní molekulární cesty zahrnující adhezi monocytů k endoteliálním buňkám, vychytávání oxidovaných LDL částic prostřednictvím scavengerových receptorů a inhibici proliferace hladkosvalových buněk (11), zároveň inhibuje glukoneogenezi v játrech (12). Některé studie uvádějí asociace nízkých hladin adiponektinu s infarktem myokardu a progresí kalcifikací koronárních arterií (13, 14).
Epidemiologie metabolického syndromu u pacientů po prodělané protinádorové terapii
Metabolický syndrom je na jedné straně spjat s vyšší pravděpodobností výskytu určitých druhů onkologických onemocnění, jako je kolorektální karcinom či karcinom prsu. Na druhou stranu po protinádorové terapii existuje vyšší pravděpodobnost rozvoje metabolického syndromu, což se s ohledem na délku přežívání pacientů po prodělané protinádorové terapii stává významným tématem (15, 16). Přežívání onkologických pacientů se liší v závislosti na druhu onemocnění, stadia v době diagnózy či pohlaví pacienta. Z analýzy dat českých registrů z let 2005–2008 vyplývá, že pravděpodobnost pětiletého přežití se u řady diagnóz zvyšuje a obecně dosahuje přes 50 % (až na výjimky, jako je karcinom pankreatu, plic apod.). Mezi onkologické diagnózy s nejvyšší pravděpodobností pětiletého přežití patří Hodgkinova choroba (87 %), karcinom prostaty (82 %), karcinom prsu (80 %) a testikulární karcinom (94 %). U dětí pak v průměru pětileté přežití, bereme-li v úvahu jakoukoliv z onkologických diagnóz, přesahuje 80 % (17–19).
Epidemiologická data stran výskytu metabolického syndromu po protinádorové terapii u dětských onkologických pacientů se různí v závislosti na typu onkologického onemocnění a druhu zvolené protinádorové terapie. Nicméně pro ilustraci zjištěná prevalence metabolického syndromu u pacientů po prodělané transplantaci hematopoetických buněk byla 32 %, což je signifikantně více než u běžné pediatrické populace (v závislosti na typu definice a vybrané věkové kategorie se prevalence metabolického syndromu pohybuje mezi 2–5 %) (20).
Velká analýza k epidemiologii metabolického syndromu po prodělané protinádorové terapii v dospělosti byla provedena v Asii v roce 2016, kde celková prevalence rozvoje metabolického syndromu u pacientů po absolvované protinádorové terapii byla 1,56x vyšší vůči kontrolám. Tato prevalence byla vyšší zejména u pacientů po prodělané terapii kolorektálního karcinomu, karcinomu prsu, plic, prostaty, močového měchýře a štítné žlázy (21). U pacientek, které byly léčeny pro karcinom prsu je sledován nárůst hmotnosti a také je v této skupině vyšší procento pacientek s diagnostikovaným metabolickým syndromem (50 % vs. 36 % v kontrolní skupině), která protinádorovou terapii neabsolvovala (22, 23).
Specifika patofyziologie metabolického syndromu u pacientů po prodělané protinádorové terapii v dětství
Jedny z prvních studií, které si všimly souvislosti rozvoje metabolického syndromu po protinádorové terapii, se týkaly zejména pacientů v dětském věku, poté se objevily i studie popisující podobné dopady protinádorové terapie u dospělých. Například pacienti po prodělané leukemii v dětském věku se častěji potýkali s obezitou a v roce 1996 Talvensaari a kol. popsali u těchto pacientů vyšší pravděpodobnost manifestace metabolického syndromu (24, 25).
U dětí se dominantně na rozvoji metabolického syndromu podílí narušení endokrinních systémů působením chemoterapie či radioterapie a tím zasažení drah metabolických a růstových. Dětští pacienti po absolvování ozáření hlavy pro ALL či tumor mozku mají vyšší riziko rozvoje obezity, např. po ozáření více než 20 Gy byl poměr šancí ve srovnání se sourozenci 2,5x vyšší (26, 27).
Radioterapie, a to zejména na oblast hlavy, je v korelaci se vzestupem BMI a předpokládá se, že tento efekt je způsoben poklesem hladin růstového hormonu, a to pravděpodobně přímým poškozením osy hypotalamus – hypofýza aplikovanou dávkou záření. Nedostatek růstového hormonu byl prokázán i v souvislosti s intrathékálně podaným metotrexátem, případně i po samostatně podané chemoterapii (28, 29). Jednou z funkcí růstového hormonu je stimulace proteosyntézy, vychytávání glukózy periferními tkáněmi a mimo jiné přispívá k lipolýze. Jeho nedostatek pak může přispívat k rozvoji atypické distribuce tuku, sarkopenii a tyto diskrepance pak mohou mít dopad na narušení metabolismu glukózy a ve finále vést k rozvoji metabolického syndromu (30–33). Prozatím existují jen velmi malé studie, kde u dětských pacientů po ukončené onkologické terapii podávali substituci růstovým hormonem. Jedná se například o malou studii s osmnácti pacienty po prodělané akutní lymfoblastické leukemii s prokázaným nedostatkem růstového hormonu, kdy po dvou letech substituce poukázali zlepšení ejekční frakce levé komory a sníženou incidenci metabolického syndromu (34).
Dále i přímý vliv radioterapie na oblast pankreatu se spolupodílí na rozvoji metabolického syndromu u dětských pacientů. Pacienti, kteří v dětství absolvovali celotělové ozáření, mají 12,6x vyšší riziko rozvoje diabetu mellitu oproti sourozencům a v případě radiace na oblast abdominální je to 3,4x vyšší riziko (35). I v dalších studiích byla prokázána na dávce závislá souvislost mezi radiací na oblast pankreatu a rizikem rozvoje diabetu – pravděpodobně tedy přímým působením radiačního záření. Obdobně souvislost prokázali i v případě abdominálního ozařování pro Hodgkinův lymfom (36). V malé analýze pacientů po prodělané RT na abdominální oblast v dětství neměl ani jeden z pacientů více než jeden typ protilátek proti beta buňkám pankreatu, zřejmě tedy etiologie rozvíjejícího se diabetu mellitu po RT nebude na autoimunitním podkladu (37).
A ačkoliv řada pacientů, zejména s hematoonkologickými malignitami, je léčena kortikosteroidy, původní teze stran jejich možného vlivu na nárůst tělesné hmotnosti však recentní studií ze Swiss Childhood Cancer nebyla prokázána (38).
Společné patofyziologické mechanismy rozvoje metabolického syndromu u pacientů po prodělané protinádorové terapii v dětství a v dospělosti
Přesný způsob, kterým chemoterapie přispívá k rozvoji metabolického syndromu, stále není zcela objasněn. Použití alkylačních činidel (např. antracyklinů), chemoterapeutik narušují DNA replikaci (např. platinové deriváty), vede k narušení transkripci a syntézy proteinů, což vede v konečném důsledku k narušení buněčného růstu a regenerace. Chemoterapeutiky indukovaná anémie, apoptóza, hypoxie a zvýšení produkce volných radikálů vede k tvorbě prozánětlivého působení a aktivaci monocyto-makrofágového systému – obdobně jako v patofyziologii metabolického syndromu i u pacientů bez absolvované protinádorové terapie, jak je popsáno výše. Některá chemoterapeutika mohou indukovat inzulinorezistenci přímým působením (39, 40).
Moderní protinádorová terapie včetně checkpoint inhibitorů může taktéž vést k nežádoucím metabolickým dopadům, například skrze indukci autoimunitního DM I typu v kontextu generalizované imunitní odpovědi (41). Dále jsou popsány vlivy narušení cesty programované buněčné smrti a jsou asociovány s prozánětlivým působením a rozvojem aterosklerózy (42).
Mezi další možné mechanismy řadíme vznik deficitu hormonů štítné žlázy a hormonů pohlavních, přičemž narušení každého z těchto endokrinních systémů je asociováno s rozvojem metabolického syndromu včetně často podávané hormonální terapie u pacientek s karcinomem prsu a pacientů s karcinomem prostaty. Hormony štítné žlázy významně ovlivňují energetický metabolismus a narušení rovnováhy tohoto systému může vést k vychýlení energetické bilance. Thyreopatie jsou často diagnostikované u pacientů po absolvované radioterapii na oblast hlavy a krku, zejména u pacientů s diagnózou Hodgkinova lymfomu. Pravděpodobnost rozvoje hypothyreoidismu vzrůstá s věkem, podanou dávkou radiace a ženským pohlavím. Popisované riziko rozvoje hypothyreoidismu 20 let od terapie po podané dávce 45Gy a více bylo okolo 50 % (43, 44).
V rozvoji metabolického syndromu po prodělané protinádorové terapii mají vliv i snížené hladiny pohlavních hormonů. Ve studii od C. Bogeforse z roku 2017 sledovali autoři 92 pacientů po prodělané protinádorové terapii a analyzovali lipidogram, hladiny testosteronu, luteinizačního hormonu, glukózy a inzulinu. U pacientů s hypogonadismem po terapii ve srovnání s pacienty eugonandálními hodnotami prokázali vyšší hladiny inzulinu a zvýšené riziko rozvoje metabolického syndromu (45). Suprese androgrenů u pacientů s karcinomem prostaty je asociovaná s dyslipidemií a zvýšeným rizikem kardiovaskulárních chorob a inzulinorezistencí. Antiestrogenová terapie u pacientek s kacinomem prsu taktéž ovlivňuje lipidogram, funkci jater a může zvyšovat kardiovaskulární riziko (46).
Dalším společným mechanismem může být nižší fyzická aktivita z důvodu sníženého performance statutu např. z důvodu handicapu po operaci pro Ewingův sarkom, osteosarkom apod.
Integrovaně se zde budou spolupodílet i další efekty onkologické terapie včetně endoteliálního poškození řadou chemoterapeutik. Například bleomycin a jeho endoteliální poškození působící rozvoj plicní fibrózy, vaskulární poškození cisplatinou, poškození autonomního nervového systému působením neurotoxickým, akcelerací aterosklerózy a kardiotoxicitou (39, 47).
Doporučení k prevenci rozvoje metabolického syndromu u pacientů po prodělané protinádorové terapii
U pacientů po prodělané protinádorové terapii, jak bylo shrnuto výše, dochází k rozvoji řady metabolických změn, přičemž jejich množství narůstá v čase a tito pacienti tak vyžadují dlouholeté sledování, jak ilustruje Obr. 1.
Obr. 1. Ilustrace nutnosti dlouhodobé dispenzarizace pacientů po prodělané protinádorové terapii pro rostoucí riziko rozvoje složek metabolického syndromu, inspirováno podle (48) 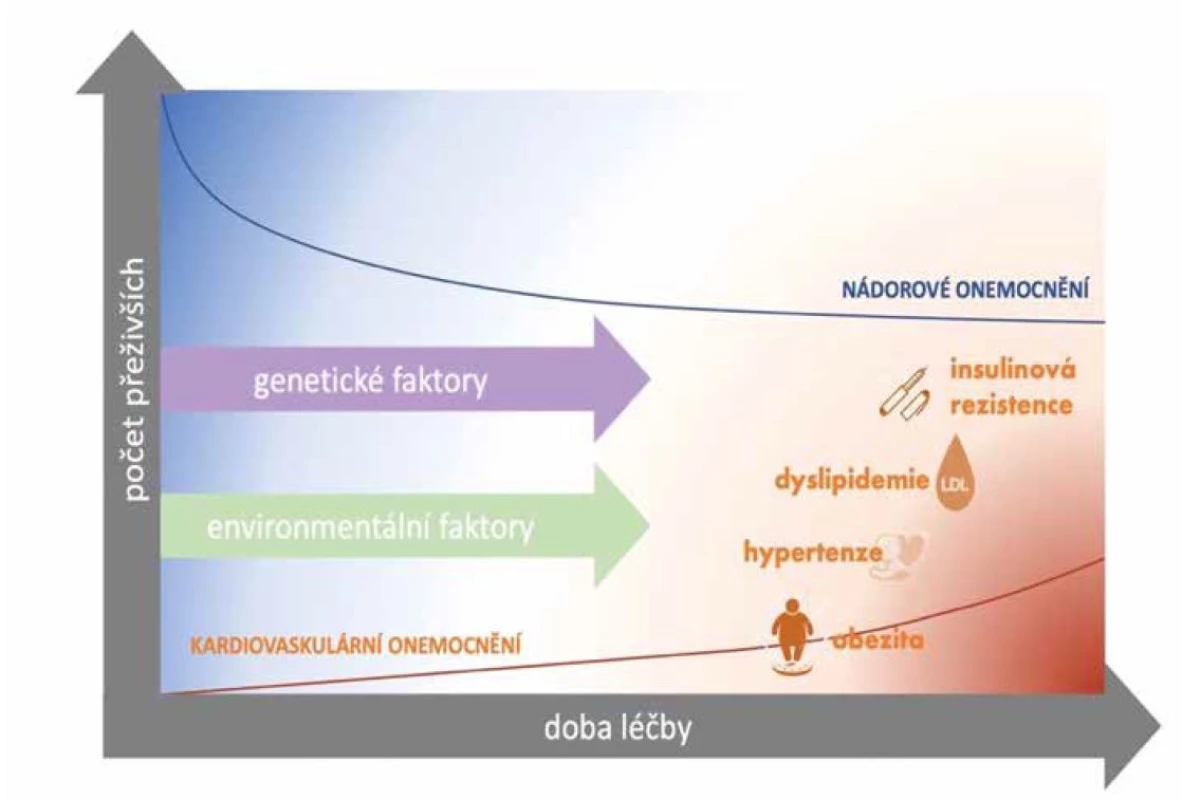
Mezi nejrizikovější pacienty stran rozvoje metabolického syndromu patří: dětští onkologičtí pacienti, pacienti po terapii testikulárního karcinomu, karcinomu prsu, prostaty a pacienti s hematoonkologickými malignitami. Přičemž ve velmi vysokém riziku jsou zejména pacienti po absolvované radioterapii na oblast hlavy, pankreatu či celotělovém ozáření v dětství a pacienti dlouhodobě užívající antiestrogenovou terapii či antiandrogeny.
Podrobná guidelines k dlouhodobému sledování stran prevence vzniku metabolického syndromu chybí. Dispenzarizace těchto pacientů a jejich pravidelné kontroly výživového statutu by měly dominantně být prací jejich sledujících praktických lékařů či internistů. Za vhodné považujeme u těchto pacientů každoročně kontrolovat lačnou glykemii, glykovaný hemoglobin, lipidogram, krevní tlak a včas zahájit terapii. Existují malé studie s preventivně podávaným metforminem u pacientů po androgenní deprivaci a porušenou glukózovou tolerancí, kteří ještě nesplňují kritéria diabetu, ač někteří autoři o jeho efektu spekulují (35, 49).
Obecně přijímaným faktem je prevence pomocí bezpečných a konzervativních metod, jako je změna životního stylu, aerobní aktivita třikrát týdně, vyrovnaná energetická bilance, které mohou zmírnit rozvoj metabolického syndromu a přispět tak k optimální komplexní péči této specifické skupiny pacientů (39, 50, 51).
Závěr
Pacienti po absolvované protinádorové terapii, zejména pacienti po prodělaném hematoonkologickém onemocnění, pacienti s karcinomem testikulárním, karcinomem prsu a prostaty představují kohortu pacientů ve vyšším riziku rozvoje metabolického syndromu. Metabolický syndrom i u této skupiny pacientů však představuje stav, kterému lze předcházet, a ke kterému je nutno prostřednictvím mezioborové spolupráce onkologů, pediatrů, praktických lékařů a internistů nastavit efektivní program k redukci rozvoje kardiovaskulárních příhod díky včasnému záchytu a terapii v době klinicky němých period.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Ing. Eva Řiháčková
Interní kardiologická klinika, LF MU a FN Brno
Cit. zkr: Vnitř Lék 2021; 67(6): 334–338
Článek přijat redakcí: 11. 4. 2021
Článek přijat po recenzích: 16. 7. 2021
Zdroje
1. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes. 1988; 37(12): 1595–607.
2. Parikh RM, Mohan V. Changing definitions of metabolic syndrome. Indian J Endocrinol Metab. 2012; 16(1): 7–12.
3. Tellechea ML, Aranguren F, Martínez-Larrad MT et al. Ability of lipid accumulation product to identify metabolic syndrome in healthy men from Buenos Aires. Diabetes Care. 2009; 32(7): e85.
4. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009; 120(16): 1640–5.
5. Grundy SM, Cleeman JI, Daniels SR et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005; 112(17): 2735–52.
6. Lau DC, Dhillon B, Yan H et al. Adipokines: molecular links between obesity and atheroslcerosis. Am J Physiol Heart Circ Physiol. 2005; 288(5): H2031–41.
7. Cinti S, Mitchell G, Barbatelli G et al. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans. J Lipid Res. 2005; 46(11): 2347–55.
8. Bernberg E, Ulleryd MA, Johansson ME et al. Social disruption stress increases IL-6 levels and accelerates atherosclerosis in ApoE-/ – mice. Atherosclerosis. 2012; 221(2): 359–65.
9. Azzawi M, Hasleton P. Tumour necrosis factor alpha and the cardiovascular system: its role in cardiac allograft rejection and heart disease. Cardiovasc Res. 1999; 43(4): 850–9.
10. Ryo M, Nakamura T, Kihara S et al. Adiponectin as a biomarker of the metabolic syndrome. Circ J. 2004; 68(11): 975–81.
11. Matsuzawa Y, Funahashi T, Kihara S, et al. Adiponectin and metabolic syndrome. Arterioscler Thromb Vasc Biol. 2004; 24(1): 29–33.
12. Combs TP, Berg AH, Obici S et al. Endogenous glucose production is inhibited by the adipose-derived protein Acrp30. J Clin Invest. 2001; 108(12): 1875–81.
13. Maahs DM, Ogden LG, Kinney GL et al. Low plasma adiponectin levels predict progression of coronary artery calcification. Circulation. 2005; 111(6): 747–53.
14. Pischon T, Girman CJ, Hotamisligil GS et al. Plasma adiponectin levels and risk of myocardial infarction in men. JAMA. 2004; 291(14): 1730–7.
15. Stocks T, Lukanova A, Johansson M et al. Components of the metabolic syndrome and colorectal cancer risk; a prospective study. Int J Obes (Lond). 2008; 32(2): 304–14.
16. Kabat GC, Kim M, Chlebowski RT et al. A longitudinal study of the metabolic syndrome and risk of postmenopausal breast cancer. Cancer Epidemiol Biomarkers Prev. 2009; 18(7): 2046–53.
17. Verdecchia A, Francisci S, Brenner H et al. Recent cancer survival in Europe: a 2000–02 period analysis of EUROCARE-4 data. Lancet Oncol. 2007; 8(9): 784–96.
18. Phillips SM, Padgett LS, Leisenring WM et al. Survivors of childhood cancer in the United States: prevalence and burden of morbidity. Cancer Epidemiol Biomarkers Prev. 2015; 24(4): 653–63.
19. Pavlík T, Májek O, Büchler T et al. Trends in stage-specific population-based survival of cancer patients in the Czech Republic in the period 2000–2008. Cancer Epidemiol. 2014; 38(1): 28–34.
20. Paris C, Yates L, Lama P et al. Evaluation of metabolic syndrome after hematopoietic stem cell transplantation in children and adolescents. Pediatr Blood Cancer. 2012; 59(2): 306–10.
21. Kim M, Kim IH, Lim MK et al. Increased prevalence of metabolic syndrome in adult cancer survivors: Asian first report in community setting. Cancer Epidemiol. 2019; 58 : 130–6.
22. Buttros DeA, Nahas EA, Vespoli HeL et al. Risk of metabolic syndrome in postmenopausal breast cancer survivors. Menopause. 2013; 20(4): 448–54.
23. Kim SH, Cho YU, Kim SJ. Weight Gain and its Correlates among Breast Cancer Survivors. Asian Nurs Res (Korean Soc Nurs Sci). 2013; 7(4): 161–7.
24. Zee P, Chen CH. Prevalence of obesity in children after therapy for acute lymphoblastic leukemia. Am J Pediatr Hematol Oncol. 1986; 8(4): 294–9.
25. Talvensaari KK, Lanning M, Tapanainen P et al. Long-term survivors of childhood cancer have an increased risk of manifesting the metabolic syndrome. J Clin Endocrinol Metab. 1996; 81(8): 3051–5.
26. Gurney JG, Ness KK, Stovall M et al. Final height and body mass index among adult survivors of childhood brain cancer: childhood cancer survivor study. J Clin Endocrinol Metab. 2003; 88(10): 4731–9.
27. Oeffinger KC, Mertens AC, Sklar CA et al. Obesity in adult survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study. J Clin Oncol. 2003; 21(7): 1359–65.
28. Hoffman KE, Derdak J, Bernstein D et al. Metabolic syndrome traits in long-term survivors of pediatric sarcoma. Pediatr Blood Cancer. 2008; 50(2): 341–6.
29. Haddy TB, Mosher RB, Nunez SB et al. Growth hormone deficiency after chemotherapy for acute lymphoblastic leukemia in children who have not received cranial radiation. Pediatr Blood Cancer. 2006; 46(2): 258–61.
30. Sklar CA, Mertens AC, Walter A et al. Changes in body mass index and prevalence of overweight in survivors of childhood acute lymphoblastic leukemia: role of cranial irradiation. Med Pediatr Oncol. 2000; 35(2): 91–5.
31. Gurney JG, Ness KK, Sibley SD et al. Metabolic syndrome and growth hormone deficiency in adult survivors of childhood acute lymphoblastic leukemia. Cancer. 2006; 107(6): 1303–1312.
32. Pietilä S, Mäkipernaa A, Sievänen H et al. Obesity and metabolic changes are common in young childhood brain tumor survivors. Pediatr Blood Cancer. 2009; 52(7): 853–9.
33. Link K, Moëll C, Garwicz S, et al. Growth hormone deficiency predicts cardiovascular risk in young adults treated for acute lymphoblastic leukemia in childhood. J Clin Endocrinol Metab. 2004; 89(10): 5003–12.
34. Follin C, Thilén U, Ahrén B et al. Improvement in cardiac systolic function and reduced prevalence of metabolic syndrome after two years of growth hormone (GH) treatment in GH-deficient adult survivors of childhood-onset acute lymphoblastic leukemia. J Clin Endocrinol Metab. 2006; 91(5) 1872–5.
35. Meacham LR, Sklar CA, Li S et al. Diabetes mellitus in long-term survivors of childhood cancer. Increased risk associated with radiation therapy: a report for the childhood cancer survivor study. Arch Intern Med. 2009; 169(15): 1381–8.
36. van Nimwegen FA, Schaapveld M, Janus CP et al. Risk of diabetes mellitus in long-term survivors of Hodgkin lymphoma. J Clin Oncol. 2014;32(29):3257–63.
37. Friedman DN, Hilden P, Moskowitz CS et al. Insulin and glucose homeostasis in childhood cancer survivors treated with abdominal radiation: A pilot study. Pediatr Blood Cancer. 2018; 65(11): e27304.
38. Belle FN, Kasteler R, Schindera C et al. No evidence of overweight in long-term survivors of childhood cancer after glucocorticoid treatment. Cancer. 2018; 124(17): 3576–85.
39. Westerink NL, Nuver J, Lefrandt JD et al. Cancer treatment induced metabolic syndrome: Improving outcome with lifestyle. Crit Rev Oncol Hematol. 2016; 108 : 128–36.
40. Casco S, Soto-Vega E. Development of Metabolic Syndrome Associated to Cancer Therapy: Review. Horm Cancer. 2016; 7(5–6): 289–95.
41. Ryder M, Callahan M, Postow MA et al. Endocrine-related adverse events following ipilimumab in patients with advanced melanoma: a comprehensive retrospective review from a single institution. Endocr Relat Cancer. 2014; 21(2): 371–81.
42. Bu DX, Tarrio M, Maganto-Garcia E et al. Impairment of the programmed cell death-1 pathway increases atherosclerotic lesion development and inflammation. Arterioscler Thromb Vasc Biol. 2011; 31(5): 1100–7.
43. Sklar C, Whitton J, Mertens A et al. Abnormalities of the thyroid in survivors of Hodgkin's disease: data from the Childhood Cancer Survivor Study. J Clin Endocrinol Metab. 2000; 85(9): 3227–32.
44. Sanders JE, Hoffmeister PA, Woolfrey AE et al. Thyroid function following hematopoietic cell transplantation in children: 30 years' experience. Blood. 2009; 113(2): 306–8.
45. Bogefors C, Isaksson S, Bobjer J, et al. Hypogonadism in testicular cancer patients is associated with risk factors of cardiovascular disease and the metabolic syndrome. Andrology. 2017; 5(4): 711–7.
46. Redig AJ, Munshi HG. Care of the cancer survivor: metabolic syndrome after hormone - modifying therapy. Am J Med. 2010; 123(1): 87.e1–6.
47. Sleijfer S. Bleomycin-induced pneumonitis. Chest. 2001;120(2):617–24.
48. de Haas EC, Oosting SF, Lefrandt JD et al. The metabolic syndrome in cancer survivors. Lancet Oncol. 2010; 11(2): 193–203.
49. Cohen P. Metformin for the prevention of androgen deprivation induced metabolic syndrome, obesity and type 2 diabetes. Med Hypotheses. 2009; 72(2): 227–8.
50. Tonorezos ES, Robien K, Eshelman-Kent D et al. Contribution of diet and physical activity to metabolic parameters among survivors of childhood leukemia. Cancer Causes Control. 2013; 24(2): 313–21.
51. Mostoufi-Moab S, Seidel K, Leisenring WM et al. Endocrine Abnormalities in Aging Survivors of Childhood Cancer: A Report From the Childhood Cancer Survivor Study. J Clin Oncol. 2016; 34(27): 3240–3247.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- HLAVNÍ TÉMA – PNEUMOLOGIE
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Inhalační glukokortikoidy v terapii covidu-19
- Nintedanib v terapii intersticiálních plicních procesů u systémových onemocnění pojiva
- Metabolický syndrom u pacientů po prodělané protinádorové terapii
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Špičkové technologie v medicíně – vliv nastavení hodnot alarmů u systémů pro kontinuální monitoraci glykemie na metabolickou kompenzaci u diabetiků 1. typu: systematické review
- FDG-PET/CT dokumentované vymizení nekrobiotického xantogranulomu při potlačení tvorby monoklonálního imunoglobulinu bortezomibem, lenalidomidem a dexametazonem Popis případu a přehled literatury o léčbě nekrobiotického xantogranulomu
- Lokalizované formy plicní amyloidózy
- Screening gestačního diabetes mellitus
- Proč stále nedosahujeme cílových hodnot krevního tlaku
- Aktuální témata kardiovaskulární prevence
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Lokalizované formy plicní amyloidózy
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Screening gestačního diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



