-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Glukagon v léčbě hypoglykemie – novinky
Glucagon in treatment of hypoglycemia – novelties
Glucagon is actually used in the treatment of severe hypoglycemia. Due to technological difficulties with stability in solution, glucagon in currently available preparations was contained in a form of powder, which needs to be first dissolved in the water before application. This particular administration of glucagon was associated with a certain delay and several mistakes that decreased real amount of glucagon injected in the body. Currently two new formulas of glucagon appeared on the market – first as a stable liquid solution, second as a powder for nasal administration. This article summarizes currently available information about these preparations.
Keywords:
glucagon – hypoglycemia – therapy – diabetes
Autoři: Jan Brož 1; Jana Malinovská 1; Ludmila Brunerová 2; Jana Urbanová 2
Působiště autorů: Interní klinika 2. LF UK a FN Motol, Praha 1; Centrum pro výzkum diabetu, metabolismu a výživy, II. interní klinika 3. LF UK a FNKV, Praha 2
Vyšlo v časopise: Vnitř Lék 2021; 67(2): 103-108
Kategorie: Přehledové články
Souhrn
Glukagon je v diabetologii užíván především v léčbě těžké hypoglykemie. Vzhledem k dosavadním technologickým obtížím se zajištěním stability glukagonu v roztoku byla účinná látka obsažená v aktuálně dostupných preparátech ve formě prášku, který se před aplikací nejprve rozpouštěl ve vodném roztoku. S tímto způsobem podání glukagonu byla spojena určitá časová latence a také řada chyb, které často snižovaly skutečné do těla dodané množství glukagonu. Aktuálně se na trhu objevily dvě nové formule glukagonu – jedna v již továrně připraveném stabilním roztoku a druhá určená k nazálnímu podání. Článek shrnuje aktuálně dostupné informace o uvedených preparátech.
Klíčová slova:
glukagon – hypoglykemie – terapie – diabetes
Úvod
Tématu hypoglykemie bylo v časopise Vnitřní lékařství v posledních třech letech věnováno několik článků (1–6), proto úvodem jen krátké shrnutí: Hypoglykemie je u diabetes mellitus definována jako koncentrace glukózy v krvi ≤ 3,9 mmol/l. Je spojena především s léčbou inzulinem. U pacientů s diabetes mellitus 2. typu (DM2T) je její frekvence přibližně třetinová v porovnání s pacienty s diabetes mellitus 1. typu (DM1T). Dochází k ní však i u pacientů s DM2T léčenými některými typy perorálních antidiabetik, ovšem s podstatně nižší frekvencí než u inzulinové léčby. Hypoglykemie je provázena typickými příznaky (adrenergními a neuroglykopenickými), podle kterých ji pacient rozpozná a následně zaléčí sacharidy. Přibližně u 10–15 % pacientů s DM1T a také u menšího počtu pacientů s DM2T léčených inzulinem je však přítomen syndrom zhoršeného rozpoznávání hypoglykemie, kdy jsou příznaky hypoglykemie vyjádřeny omezeně nebo zcela chybí. Z klinického hlediska rozlišujeme především: a) hypoglykemii klinicky významnou (glykemie < 3 mmol/l), která již bývá spojena s neuroglykopenickými příznaky; b) hypoglykemii mírnou, kterou pacient dobře rozpozná a sám zaléčí perorálním podáním sacharidů; c) hypoglykemii těžkou, spojenou s významným postižením kognitivních funkcí (různým stupněm poruchy vědomí) a nutností pomoci druhou osobou (7, 8). Těžká hypoglykemie je v případě profesionálního zdravotnického zásahu většinou léčena intravenózním podáním koncentrovaného roztoku glukózy, v rámci laické pomoci injekčním podáním glukagonu (3).
Glukagon – rámcový pohled na historii a fyziologii
Glukagon byl objeven jako součást pankreatického extraktu v roce 1922 J. R. Murlinem a C. P. Kimballem, kteří popsali jeho hyperglykemizující efekt. Od nich dostal i své současné jméno (glucagon – glucose agonist) (9), avšak až do 50. let byl častěji nazýván „hyperglykemickým pankreatickým faktorem“. Ve 40. letech byla jeho produkce v těle spojena s Langerhansovými ostrůvky a posléze přisouzena konkrétně jejich α‑buňkám. V 50. letech byl glukagon poprvé izolován a bylo popsáno jeho chemické složení (10).
Glukagon je peptidový hormon, který má jako hormon mobilizující glukózu ze zásob jednu z klíčových rolí v udržení glukózové homeostázy. V době omezeného energetického příjmu však stimulací lipidového a proteinového katabolismu, snížením chuti k jídlu (i příjmu potravy) a zvýšením energetického výdeje ovlivňuje také celkovou energetickou homeostázu. (11) Metabolismus ovlivňuje prostřednictvím: a) stimulace produkce glukózy v játrech – navozuje glykogenolýzu a glukoneogenezi z glukoplastických aminokyselin, inhibuje syntézu glykogenu a triacylglycerolů a zvyšuje tvorbu ketolátek; b) snížení vychytávání glukózy ve svalech a v tukové tkáni zvýšením aktivity hormon‑senzitivní lipázy, čímž zvyšuje hladinu volných mastných kyselin; c) snížením produkce inzulinu z pankreatických β‑buněk. Podnětem pro sekreci a tvorbu glukagonu je především hypoglykemie, delší hladovění, cvičení a zvýšená přítomnost glukoplastických aminokyselin (alanin a arginin), např. po jídlech bohatých na bílkoviny. Zvýšení tvorby a sekrece glukagonu též navozuje stres (adrenalin) či sympatikus prostřednictvím β‑adrenergních receptorů (12). Stimulační účinek na uvolnění glukagonu má také glukózo‑dependentní insulinotropní polypeptid (GIP) (13). Naopak hyperglykemie, GLP-1 (glucagon‑like peptide-1), inzulin a somatostatin jej tlumí (12).
Léčebné využití glukagonu
Glukagon je využíván především v léčbě hypoglykemických stavů spojených s nadměrnou hladinou cirkulujícího inzulinu. Jedná se především o léčbu těžké inzulinem‑indukované hypoglykemie spojené se ztrátou vědomí u pacientů s diabetes mellitus, kdy je parenterální podání glukagonu v současné době jedinou schválenou metodou laické léčby těžké hypoglykemie (14). Dále je užíván v léčbě perzistentní hypoglykemie při kongenitálním hyperinzulinismu (15) a testuje se jeho kontinuální podání v tzv. uzavřeném okruhu u pacientů s postbariatrickými alimentárními hypoglykemiemi (16). V současnosti je glukagon v terapii diabetu též používán společně s inzulinem v tzv. duálních inzulinových pumpách (systémech automaticky dávkujících spolu s inzulinem mikrobolusy glukagonu v reakci na data ze senzoru ukazující bezprostřední hypoglykemii) v rámci tzv. uzavřeného okruhu (17).
Pro své účinky na snížení sekrece pankreatických šťáv, bikarbonátu a pankreatických enzymů byl v 70. letech testován také v léčbě akutní pankreatitidy. Provedené studie však efekt v této léčbě neprokázaly (18). V gastroenterologii je využíván při vyšetřeních i terapeutických zákrocích jako relaxans motility trávicího traktu (19).
Glukagon v léčbě hypoglykemie
První publikovaná studie týkající se využití glukagonu v léčbě hypoglykemie uveřejněná v roce 1957, se překvapivě netýkala inzulinem‑podmíněných hypoglykemií u diabetiků, ale vyvedení pacientů se schizofrenií z hypoglykemického kómatu při léčbě inzulinovými šoky (20). Studie poskytuje i zajímavý pohled do historie medicínského využití inzulinu: pacientům byl intramuskulárně aplikován inzulin v průměrné dávce 593 j. (min 60 j., max 2000 j.) v cca 7.00 ráno, hypoglykemické kóma se pak dostavilo obvykle kolem 9.00 a bylo ukončeno kolem 10.30. Krátce na to byl publikován článek o použití glukagonu v léčbě hypoglykemie u diabetických dětí (21) a vzápětí vyšla první práce týkající se téhož u dospělých diabetiků léčených inzulinem (22).
Glukagon je, vzhledem k omezené stabilitě v roztoku, od počátku svého farmakologického využívání používán ve stále stejné práškové (lyofilizované) formě, určené k injekční subkutánní (s.c.) či intramuskulární (i.m.) a intravenózní (i.v.) aplikaci. Dávka 1 mg glukagonu podaná s.c. nebo i.m. zvyšuje glykemii v průměru o 8,5 mmol/l během 60 min (23). Metaanalýza studií srovnávajících úspěšnost podání glukagonu s.c./i.m a glukózy i.v. v léčbě hypoglykemie (publikovaných do května 2014) neprokázala rozdíl ve vzestupu koncentrace glukózy mezi oběma přístupy (24). Po jeho podání by měl pacient reagovat do 10 minut. V opačném případě je nutné podat intravenózně glukózu (25). Glukagon může mít omezenou účinnost v případě současné deplece jaterního glykogenu – např. v souvislosti s extrémním sportovním výkonem či dlouhodobě sníženým příjmem sacharidů, jaterní insuficiencí či selháním a také u pacientů, u kterých hypoglykemie vznikla v souvislosti s intoxikací alkoholem (26–28).
Glukagon je možné využít v léčbě těžké hypoglykemie i u těhotných diabetiček, jelikož neprostupuje placentární bariérou a při jeho užívání u gravidních pacientek nebyly popsány škodlivé účinky na průběh těhotenství a zdraví plodu či novorozence. Stejně tak i u kojících matek s diabetem. Množství glukagonu přestupujícího do mateřského mléka je velmi malé, navíc se štěpí v trávicím ústrojí a nemůže tak mít u dítěte žádný metabolický účinek (25).
Mezi nejtypičtější nežádoucí účinky, plynoucí z ovlivnění motility gastrointestinálního traktu, patří nauzea, event. zvracení, jejich výskyt ale není příliš častý (25).
Mnoho let byl jedinou komerčně dostupnou lékovou formou glukagonu v České republice přípravek GlucaGen 1 mg HypoKit (Novo Nordisk), mimo ČR (v USA) bylo možné využít též „The Glucagon Emergency Kit“ 1 mg (Eli Lilly and Co). V obou těchto současně dostupných přípravcích je lyofilizovaný glukagon obsažen ve formě bílého prášku, který je před použitím nejprve nutno rozpustit ve sterilní vodě, předplněné v injekci, jež je součástí kitu (25, 29). Studie věnovaná řešení těžkých hypoglykemií ukázala, že někteří laici, kteří v takové situaci většinou pacientovi injekci podávají, mohou mít z tohoto způsobu administrace obavy, a proto raději injekci nepodají (30). Obdobně další starší studie věnovaná použití GlucaGen 1 mg HypoKitu ukázala, že 67 % pacientů (102 účastníků studie) by dalo přednost jiné formě glukagonu než injekční a podobné výsledky (82 %) ukázal průzkum mezi lidmi, kteří by takový zásah potenciálně prováděli (příbuzní, učitelé, kolegové) (31). Způsob podání sestávající z několika přípravných kroků trvá delší dobu a ve stresové situaci může být zatížen chybami. Provedená simulační studie doložila, že glukagon takto nedokázalo správně injikovat 80 % laiků, a dokonce též 50 % účastníků zkušených v péči o pacienty s DM1T (dále: poskytovatelé péče). Plnou dávku glukagonu dokázalo podat pouze 13 % zdravotníků, avšak nikdo z laiků. Ani jeden z kroků, potřebných ke správné aplikaci, nebyl zdravotníky ani laiky správně dokončen (32). Je však vhodné uvést, že tato studie, jež je ještě jednou zmíněna v dalším textu, byla vedena pouze s 31 účastníky a většina jejích autorů deklarovala potenciální konflikt zájmů s ohledem na to, že byli nebo jsou zaměstnanci či spolupracovníci firem, jež vyvíjeli konkurenční nazální formu glukagonu. Z výše uvedených důvodů jsou hledány další možnosti, jak podání glukagonu usnadnit.
Novinky v léčbě hypoglykemie glukagonem
Překážku v hledání nových (jednodušších) způsobů podání glukagonu představuje tendence nativního glukagonu fibrilovat a tvořit gel ve vodném roztoku. Existují dvě možnosti, jak vytvořit stabilní roztok glukagonu – připravit nativní glukagon se speciálním nosným roztokem nebo analoga glukagonu stabilní v roztoku. Několik nových glukagonových formulí je již testováno v klinických studiích (Tab. 1). FDA (U.S. Food & Drug Administration) jsou pro léčbu hypoglykemie schváleny intranazální (práškový) glukagon a stabilní kapalný glukagon (tzv. Non‑aqueous Soluble Glucagon), ve fázi klinických studií jsou biochaperon glukagon a dasiglukagon. Všechny tyto nové formule prokázaly při podání během hypoglykemie v porovnání se standardní formou glukagonu (GlucaGen 1 mg HypoKit) podobnou glykemickou odpověď (14).
Tab. 1. Nové formy glukagonu (upraveno podle (39)) 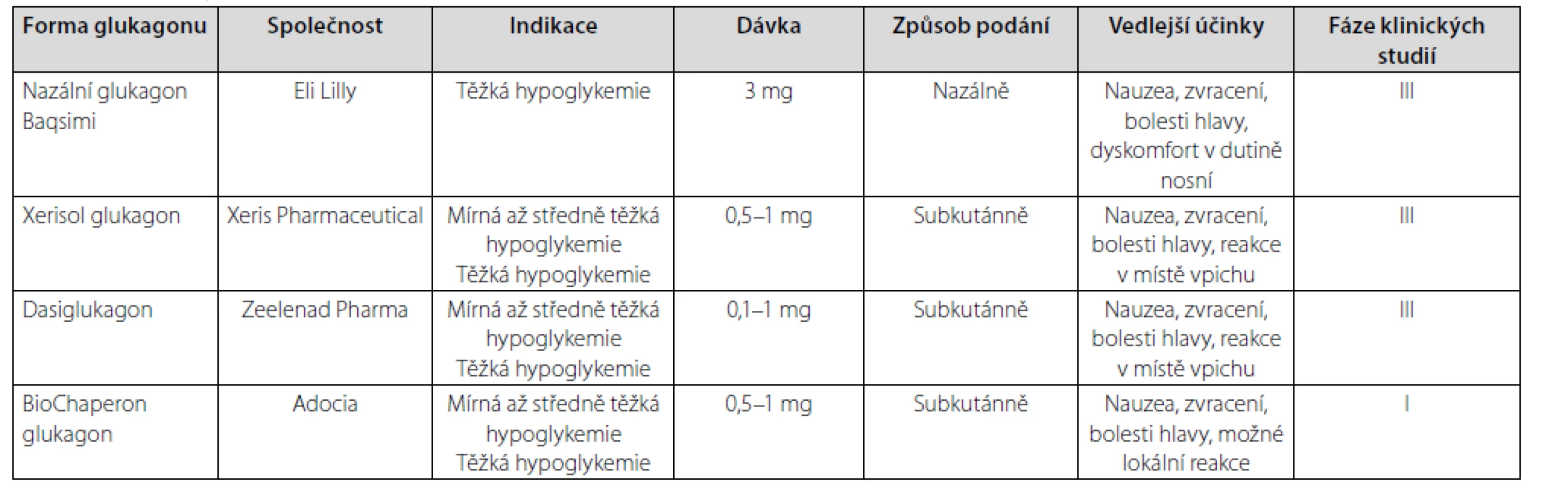
Syntetický práškový glukagon pro nosní aplikaci v léčbě těžké hypoglykemie
Jedná se o nový typ glukagonového preparátu, určeného k léčbě těžké hypoglykemie u všech pacientů s diabetem od 4 let věku – Baqsimi 3mg nosní zásyp. Jde o prášek, který je jednoduše (během jediného kroku) s pomocí specifického dávkovače rozprášen do nosní dírky v množství 3 mg na 1 aplikaci. Zde je pasivně absorbován do krve přes nazální sliznici bez nutnosti aktivní inhalace (tzn., dojde k jeho absorpci i u pacienta v bezvědomí). Ukázalo se, že nosní kongesce („ucpaný nos“), nachlazení ani současné podání nosních dekongestiv účinnost nazálního podání glukagonu nesnižují, jeho farmakokinetika ani farmakodynamika jimi nebyla signifikantně ovlivněna (33). Incidence nežádoucích účinků byla vyšší u pacientů s běžnou rýmou a nebyla ovlivněna podáním dekongescent (34).
Ve výše již zmíněné srovnávací simulační studii dokázalo podat plnou dávku nazálního glukagonu více než 90 % netrénovaných účastníků, zatímco plnou dávku původního injekčního práškového produktu nedokázal i.m. podat žádný z nich. Podání nazálního glukagonu (v plné dávce) trvalo v průměru méně než 30 s (0,27–0,44 min), injekční podání glukagonu (v plné dávce pouze v 13 % případů) naopak déle než 1 min (1,89–2,40 min). V podání nazálního glukagonu byli stejně úspěšní netrénovaní účastníci jako zkušení poskytovatelé péče. Mezi pacienty s diabetem by dalo přednost nazální formě glukagonu 69 % z nich, 19 % preferovalo injekční podání, 13 % preferenci neudalo. Mezi zdravotníky by 81 % preferovalo podání nazální (32).
Dvě studie testující efektivitu a bezpečnost používání nazální formy prokázaly jeho non‑inferioritu oproti i.m. podání 1 mg glukagonu u pacientů s DM1T. Úspěšnost podání byla definována jako vzestup glykemie ≥ 3,9 mmol/l nebo vzestup glykemie o 1,1 mmol/l, kterých bylo dosaženo průměrně za 16 min a 11,4 min u nazální formy a 13 min a 9,8 min u i.m. podání. Mezi nejčastější nežádoucí účinky u nazální formy patřily nauzea, zvracení a bolest hlavy (≥ 10 %). Iritace horních cest dýchacích (nazální kongesce, rhinorhea, nazální dyskomfort) byly též častými nežádoucími účinky (35, 36).
V real‑world studii u dospělých pacientů s DM1T nazální glukagon úspěšně vyřešil 96 % všech hypoglykemií během 30 min, těžké hypoglykemie (12 ze 157 případů) byly vyřešeny do 15 min. U 70 % případů proběhla aplikace do 30 s. Nejčastěji hlášenými nežádoucími účinky byly nazální iritace (u 59 % aplikací), bolest hlavy (u 32 % aplikací), nauzea (13 %) a zvracení (7 %) (37).
Stabilní kapalný glukagon pro přímé subkutánní podání k léčbě těžké hypoglykemie
Další novou lékovou formu představuje humánní glukagon rozpuštěný v aprotickém rozpouštědle dimethylsulfoxidu (DMSO), vytvářející nevodný roztok, ve kterém nedochází k jeho fibrilaci (XeriSol glukagon) (12). Vznik stabilního kapalného glukagonu umožnilo snadnější injekční aplikaci glukagonu bez mezikroků spojených s rozpouštěním prášku. U pacientů s DM1T prokázal stabilní kapalný glukagon podobnou glykemickou odpověď jako lyofilizovaný glukagon (GlukaGen), ale byl častěji spojen s lokálním erytémem, otokem a dyskomfortem, související zřejmě s DMSO (38).
Stabilní kapalný glukagon k léčbě těžké hypoglykemie lze podat jednorázovým dvoustupňovým autoinjektorem (Gvoke HypoPenTM) (14, 39). Toto pero je vyráběno ve dvou dávkováních – 0,5 mg (G‑Pen Jr.) pro použití u dětí vážících méně než 45 kg (preparát lze použít u dětí ve věku 2 let a starších) a 1,0 mg pro dospělé (G‑Pen) (39). Další studie prokázala, že tento způsob podání kapalného glukagonu je jednodušší v porovnání s předchozí verzí lyofilizovaného glukagonu. 88 % účastníků studie (celkem 16 testovaných osob v této části studie) podalo úspěšně glukagon pomocí autoinjektoru v porovnání s 31 % podávající standardní formu glukagonu z pohotovostního kitu. Průměrný čas, za který uživatelé tento glukagon podali, byl 48 sekund oproti 109 sekundám potřebným k podání glukagonu v prášku. Ve va - lidační studii (75 testovaných osob) glukagon autoinjektorem správně podalo 98,7 % účastníků. (40). Opět je vhodné zmínit omezený počet subjektů ve studii, většina autorů jsou zaměstnanci či spolupracovníci firmy vyrábějící nový preparát a studie byla touto firmou sponzorována. Uživatelé v této studii podali nový glukagon v průměru za 27,3 vteřin oproti 97,2 vteřinám u práškové verze (41). Srovnání obou typů glukagonu podaných subkutánně v kontrolované cross‑over studii s inzulinem indukovaou těžkou hypoglykemií ukázalo, že průměrný čas odeznění symptomů po podání preparátů (tekutý vs. práškový) se mezi oběma typy významně nelišil (autonomní symptomy odezněly v průměru za 9,9 ± 6,45 min a 9,8 ± 6,86 min, neuroglykopenické za 10,3 ± 8,92 a 9,9 ± 7,22 min), průměrný čas odeznění pocitu hypoglykemie byl 11,6 ± 6,51 min a 13,1 ± 7,93 min). Frekvence nežádoucích účinků (nejčastější byly nauzea a zvracení) byla u obou preparátů srovnatelná (42).
Preparát byl schválen pro klinické použití a je v některých zemích zatím mimo Českou republiku využíván.
Stabilní kapalný glukagon pro přímé subkutánní podání k léčbě mírné (až středně těžké) hypoglykemie
Vznik stabilního kapalného glukagonu umožnil také vytvoření nové strategie léčby mírných hypoglykemií, jako alternativu k perorálnímu podání sacharidů. Ta může mít svůj význam pro (v řadě případů se vyskytující) „zbytečný“ příjem energie s každou zaléčenou epizodou hypoglykemie, znamenající riziko nežádoucího přírůstku na váze, stejně tak jako časté přejídání při korekci hypoglykemie s následnou reaktivní hyperglykemii (43). Podání malých dávek glukagonu s.c. (tzv. mini‑dose glucagon) bylo již v minulých letech využíváno ke kontrole glykemií u dětí s DM1T při zvládání nemocí provázené nauzeou, zvracením a nechutenstvím (např. při gastroenteritidách) (44).
Stabilní kapalný glukagon je v minidávkách (určených pro léčbu mírné hypoglykemie) možné podat jednak automatickým předplněným perem (G‑PenTM) anebo pumpou (G‑PumpTM – infuze glukagonu přes OmniPod®) (14, 39). Podání malých dávek glukagonu s.c. (100, 200, 300 μg) při mírné inzulinem indukované hypoglykemii (3,4 mmol/l) prokázalo u dospělých diabetiků 1. typu léčených inzulinovou pumpou účinný vzestup glykemie (průměrně o 2,3, 4,2 a 5,0 mmol/l na 6,1, 7,9 a 8,7 mmol/l) (45). Aplikace stabilního kapalného glukagonu v dávce 150 μg pomocí pera G‑pen Mini (Xeris) prokázalo u 20 dospělých pacientů s DM1T léčených inzulinovou pumpou dobrou efektivitu v prevenci či léčbě nejen mírných, ale i středně těžkých hypoglykemií (46) a při zvládání hypoglykemií souvisejících s fyzickou aktivitou se jevila účinnější než redukce dávek inzulinu a také snižovala riziko hyperglykemie po cvičení v porovnání s p.o. příjmem sacharidů (47). Strategie minidávek glukagonu v léčbě a prevenci hypoglykemií zatím není v klinické praxi běžně využívána, k jejímu zavedení bude třeba ověření v dalších klinických studiích.
Glukagonové preparáty v testovací fázi
Dasiglukagon
Dasiglukagon je analog humánního glukagonu, který se vyznačuje lepší stabilitou a nižší tendencí vytvářet fibrily ve vodném roztoku. U pacientů s DM1T s plazmatickou glykemií ~ 3 mmol/l se vzestup glykemie po jeho podání odvíjel od výše podané dávky a dosahoval maxima za 35 minut (s poločasem dasiglukagonu přibližně 30 minut), v porovnání s lyofilizovaným glukagonem, který dosahuje maximální koncentraci glukózy za 20 minut (a kratším poločasem). Po podání 0,3 mg a 0,6 mg dasiglukagonu došlo ke zvýšení koncentrace glukózy v krvi ≥ 3,9 mmol/l za 6–10 minut, což je srovnatelné s použitím lyofilizovaného glukagonu v GlukaGenu v dávce 0,5 mg a 1 mg (48).
Ve 3. fázi klinických studií došlo (u 168 pacientů s DM1T po indukované hypoglykemii) k úpravě glykemie do 10 minut po podání 0,6 mg dasiglukaginu u 65 % z nich (v porovnání s 49 % po podání GlukaGenu) a do 15 minut u 99 % (vs. 95 %). Incidence nežádoucích účinků (nauzea, zvracení) byla srovnatelná (49).
V randomizované dvojitě zaslepené studii u 17 dospělých pacientů s diabetem vedlo s.c. podání dasiglukagonu v minidávkách od 0,03 mg do plné 0,6 mg dávky k rychlému vzestupu glykemie v závislosti na dávce jak při hypoglykemii, tak v době euglykemie. K obnově glykemie (≥ 3,9 mmol/l) došlo po podání 0,03 a 0,08 mg dasiglukagonu za 14 a 10 minut. S ohledem na lepší farmakodynamický profil (dřívější a větší glykemická odpověď i v nízkých dávkách) a možnost titrace jej bude možné využít i v duálních hormonálních pumpách (50).
Biochaperone Glucagon
Biochaperony jsou polymery, oligomery a organické sloučeniny, které mohou s glukagonem tvořit komplexy, které jej chrání před degradací a tvorbou fibril, a zlepšují tak jeho stabilitu ve vodném roztoku. Mohou však také měnit jeho farmakokinetické vlastnosti a ovlivnit farmakodynamiku (14).
První studie s těmito formulemi se stabilním kapalným glukagonem prokázaly u pacientů s DM1T a inzulinem indukovanou hypoglykemií dobrou efektivitu, i když s o něco pomalejším účinkem při porovnání s lyofilizovaným glukagonem (GlucaGen). K vzestupu koncentrace glukózy v krvi ≥ 3,9 mmol/l došlo při použití biochaperonů glukagonu za 11,5 ± 5 min a 10 ± 3,5 min vs. 7,3 ± 1,8 min při použití GlukaGenu (p < 0,001) (51, 52).
Závěr
Na světovém trhu se aktuálně objevují dva nové glukagonové preparáty. Jeden v injekční podobě (Gvoke HypoPen) ve formě již továrně připraveného stabilního roztoku, u kterého odpadají kroky spojené s rozpouštěním prášku a jehož farmakodynamické a farmakokinetické vlastnosti jsou obdobné, jako u nám známého Glucagen Hypo Kitu. Druhý preparát (Baqsimi) je určen pro nazální aplikaci a jeho podání je jednoduché a rychlejší než obě injekční formule, tento preparát je již dostupný i v ČR. Ve studiích byla prokázána jeho farmakodynamická a farmakokinetická noninferiorita vůči injekční formě. K obvyklým nežádoucím účinkům podání glukagonu (nauzea a zvracení) u inhalační formy přibyla bolest hlavy a lokální dráždění nosní sliznice, u stabilního kapalného glukagonu lokální kožní projevy. Aktuálně se testují další dvě nové formule glukagonu v kapalné podobě, u kterých se lokální iritační příznaky neobjevují. Stabilní kapalný glukagon v malých dávkách je testován i v léčbě mírné hypoglykemie, event. jejich prevenci a dále pro nižší riziko ucpání katétru v duálních hormonálních pumpách.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Brož
Interní klinika 2. LF UK a FN v Motole
V Úvalu 84
150 00 Praha 5
Cit. zkr: Vnitř Lék 2021; 67(2): 103–108
Článek přijat redakcí: 31. 8. 2020
Článek přijat po recenzích: 28. 1. 2021
Zdroje
1. Schovánek J, Cibíčková L, Čtvrtlík F et al. Diferenciální diagnostika hypoglykemie. Vnitr Lek 2020; 66(2): 129–133.
2. Brož J, Urbanová J.Rámcový pohled na epidemiologii hypoglykemie u diabetes mellitus 1. a 2. typu. Vnitr Lek 2019; 65(4): 55–60.
3. Brož J, Urbanová J, Nunes MA. Současný pohled na léčbu hypoglykemie. Vnitr Lek 2019; 65(4): 61–65.
4. Brož J, Halciaková K, Janíčková Žďárská D et al. Zdravotní způsobilost k řízení motorových vozidel a diabetes mellitus – legislativní změny v r. 2018 a souhrn zdravotních aspektů, Vnitr Lek 2019; 65(4): 82–86.
5. Brunerová L, Urbanová J, Brož J, Hypoglykemie jako symptom adrenální dysfunkce u pacientů s diabetes mellitus – vzácná, ale reálná situace. Vnitr Lek 2019; 65(4): 69–71.
6. Tuháčková M, Urbanová J, Brunerová J et al. Alkohol a riziko hypoglykemie. Vnitr Lek 2019; 65(4): 72–75.
7. [International Hypoglycaemia Study Group]. Glucose Concentrations of Less Than 3.0 mmol/L (54 mg/dL) Should Be Reported in Clinical Trials: A Joint Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2017; 40(1): 155–157. Dostupné z DOI: .
8. Seaquist ER, Anderson J, Childs B et al. Hypoglycemia and Diabetes: A Report of a Workgroup of the American Diabetes Association and The Endocrine Society. Diabetes Care 2013; 36(5): 1384–1395.
9. Ahrén B. Glucagon-Early breakthroughs and recent discoveries. Peptides. 2015;67 : 74 - 81. doi:10.1016/j.peptides.2015. 03. 011
10. Scott RV, Bloom SR. Problem or solution: The strange story of glucagon. Peptides. 2018;100 : 36-41. doi:10.1016/j.peptides.2017. 11. 013
11. Rix I, Nexøe‑Larsen C, Bergmann NC, et al. Glucagon Physiology. [Updated 2019 Jul 16]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK279127/
12. Langerhansovy ostrůvky 526-530 in Kittnar O a kol. Lékařská fyziologie Praha, Grada Publishing, a. s. 2020, ISBN 978-80-247-9528-7.
13. Christensen M, Vedtofte L, Holst JJ, Vilsboll T, Knop FK. Glucose‑dependent insulinotropic polypeptide: a bifunctional glucose‑dependent regulator of glucagon and insulin secretion in humans. Diabetes 2011; 60 : 3103–3109.
14. Hawkes CP, De Leon DD, Rickels MR. Novel Preparations of Glucagon for the Prevention and Treatment of Hypoglycemia. Curr Diab Rep. 2019;19(10):97. Published 2019 Sep 6. doi:10.1007/s11892-019-1216-4
15. Demirbilek H, Hussain K. Congenital Hyperinsulinism: Diagnosis and Treatment Update. J Clin Res Pediatr Endocrinol. 2017; 9(Suppl 2): 69–87. doi:10.4274/jcrpe.2017.S007.
16. Mulla CM, Zavitsanou S, Laguna Sanz AJ, et al. A Randomized, Placebo‑Controlled Double‑Blind Trial of a Closed‑Loop Glucagon System for Postbariatric Hypoglycemia. J Clin Endocrinol Metab. 2020; 105(4): e1260–e1271. doi:10.1210/clinem/dgz197.
17. Peters TM, Haidar A. Dual‑hormone artificial pancreas: benefits and limitations compared with single‑hormone systems. Diabet Med. 2018; 35(4): 450–459. doi:10.1111/ dme.13581.
18. Bi, Y., Atwal, T. & Vege, S.S. Drug Therapy for Acute Pancreatitis. Curr Treat Options Gastro 13, 354–368 (2015). https://doi‑org. ezproxy.is.cuni.cz/10.1007/s11938-015-0058-7.
19. Vindal A, Chander J, Lal P, Mahendra B. Comparison between intraoperative cholangiography and choledochoscopy for ductal clearance in laparoscopic CBD exploration: a prospective randomized study. Surg Endosc. 2015; 29(5): 1030–1038. doi:10.1007/s00464-014-3766-5.
20. Greben SE, Schulman JL. The effect of glucagon on the blood glucose level and the clinical state in the presence of marked insulin hypoglycemia. J Clin Invest. 1957; 36(1 Part 1): 74 – 80. doi:10.1172/JCI103412.
21. Ebers DW, Meckel BR. Use of glucagon to terminate insulin reactions in diabetic children. Nebr State Med J. 1958; 43(2): 56–57.
22. Elrick H, Witten TA, Arai Y. (1958). Glucagon Treatment of Insulin Reactions. New England Journal of Medicine, 258(10), 476–480. doi:10.1056/nejm195803062581005.
23. Wiethop BV, Cryer PE. Alanine and Terbutaline in Treatment of Hypoglycemia in IDDM. Diabetes Care 1993; 16(8): 1131–1136.
24. Boido A, Ceriani V, Pontiroli AE. (2014). Glucagon for hypoglycemic episodes in insulin‑treated diabetic patients: a systematic review and meta‑analysis with a comparison of glucagon with dextrose and of different glucagon formulations. Acta Diabetologica, 52(2), 405–412. doi:10.1007/s00592-014-0665-0
25. http://cmp‑manual. wbs.cz/-_leky_-/glucagen-1-mg‑hypokit‑spc. pdf.
26. Hall‑Boyer K, Zaloga GP, Chernow B. Glucagon: hormone or therapeutic agent? Crit Care Med 1974; 12(7): 584–589.
27. 23. Lee H, Hosein EA. Chronic alcohol feeding and its withdrawal on the structure and function of the rat liver plasma membrane: a study with 125I ‑ labelled glucagon binding as a metabolic probe. Can J Physiol Pharmacol 1982; 60(9): 1171–1176.
28. American Medical Association. Division of Drugs and Toxicology. Drug evaluations annual 1994. American Medical Association: Chicago 1993. ISBN 0899706029 9780899706023.
29. Eli Lilly and Company. http://cmp‑manual. wbs.cz/-_leky_-/glucagen-1-mg‑hypokit‑spc. pdfGlucagon Emergency Kit. http://www.lillyglucagon.com. Accessed October 29, 2018.
30. Yanai O, Phillip M, Harman I et al. IDDM patients‘ opinions on the use of glucagon emergency kit in severe episodes of hypoglycaemia. Pract Diab Int 1997; 14 : 40–42. doi:10.1002/ pdi.1960140204.
31. Mühlhauser I, Berger M, Sonnenberg G, Koch J, Jörgens V, Schernthaner G, Scholz V, Pädagogin D. Incidence and management of severe hypoglycemia in 434 adults with insulin‑dependent diabetes mellitus. Diabetes Care. 1985; 8(3): 268–273. doi: 10.2337/diacare.8. 3. 268.
32. Yale JF, Dulude H, Egeth M et al. Faster use and fewer failures with needle‑free nasal gucagon versus injectable glucagon in severe hypoglycemia rescue: a simulation study. Diabetes Technol Ther 2017; 19(7): 423–432. Dostupné z DOI: http://dx.doi.org/10.1089/dia.2016.0460.
33. Guzman CB, Dulude H, Piché C, Rufiange M, Sadoune AA, Rampakakis E, Carballo D, Triest M, Zhang MX, Zhang S, Tafreshi M, Sicard E. Effects of common cold and concomitant administration of nasal decongestant on the pharmacokinetics and pharmacodynamics of nasal glucagon in otherwise healthy participants: A randomized clinical trial. Diabetes Obes Metab. 2018; 20(3): 646–653.
34. Guzman CB, Dulude H, Piche C et al. Effects of common cold and concomitant administration of nasal decongestant on the pharmacokinetics and pharmacodynamics of nasal glucagon in otherwise healthy participants: A randomized clinical trial. Diabetes Obes Metab.2018; 20 : 646–653.
35. Rickels MR, Ruedy KJ, Foster NC et al. Intranasal glucagon for treatment of insulin‑induced hypoglycemia in adults with type 1 diabetes:a randomized crossover noninferiority study. Diabetes Care. 2016; 39 : 264–270.
36. Suico J, Hövelmann U, Zhang S et al. Nasal glucagon: a viable alternative to treat insulin‑induced hypoglycaemia in adults with type 1 diabetes. Diabetologia. 2018; 61(Suppl 1): 77–78.
37. Seaquist ER, Dulude H, Zhang XM et al. Prospective study evaluating the use of nasal glucagon for the treatment of moderate to severe hypoglycaemia in adults with type 1 diabetes in a real‑world setting. Diabetes Obes Metab. 2018; 20 : 1316–1320.
38. Castle JR, Youssef JE, Branigan D, Newswanger B, Strange P, Cummins M, Shi L, Prestrelski S. Comparative Pharmacokinetic/Pharmacodynamic Study of Liquid Stable Glucagon Versus Lyophilized Glucagon in Type 1 Diabetes Subjects.J Diabetes Sci Technol. 2016 Sep; 10(5): 1101–1107.
39. Xeris Pharmaceuticals. GVOKE US Prescribing Information. 2019. https://www.accessdata. fda.gov/drugsatfda_docs/label/2019/ 212097s000lbl.pdf.
40. Valentine V, Newswanger B, Prestrelski S, Andre AD, Garibaldi M. Human factors usability and validation studies of a glucagon autoinjector in a simulated severe hypoglycemia rescue situation. Diabetes Technol Ther. 2019; 21(9): 522–530.
41. Cummins M, Andre A, Christiansen MP, Newswanger B, Prestrelski S, Junaidi MK. An assessment of usability and drug preparation time for a ready‑to‑use liquid glucagon pen. J Diabetes Sci Technol. 2019; 13 : 293–409.
42. Christiansen MP, Cummins M, Prestrelski S, Junaidi MK. A phase 3 comparison of a ready‑to‑use liquid glucagon rescue pen to glucagon emergency kit for the symptomatic relief of severe hypoglycemia. J Diabetes Sci Technol. 2019; 13 : 293–409.
43. Beato‑Víbora PI, Arroyo‑Díez FJ. New uses and formulations of glucagon for hypoglycaemia. Drugs Context. 2019; 8 : 212599. Published 2019 Jul 30. doi:10.7573/dic.212599.
44. Laffel LM, Limbert C, Phelan H, Virmani A, Wood J, Hofer SE. ISPAD Clinical Practice Consensus Guidelines 2018: Sick day management in children and adolescents with diabetes. Pediatr Diabetes. 2018; 19 Suppl 27(): 193–204.
45. Ranjan A, Schmidt S, Madsbad S, Holst JJ, Nørgaard K. Effects of subcutaneous, low‑dose glucagon on insulin ‑ induced mild hypoglycaemia in patients with insulin pump treated type 1 diabetes. Diabetes, Obes Metab. 2016; 18(4): 410–418. doi: 10.1111/dom.12627.
46. Haymond MW, Redondo MJ, McKay S et al. Nonaqueous, Mini‑Dose Glucagon for Treatment of Mild Hypoglycemia in Adults With Type 1 Diabetes: A Dose‑Seeking Study. Diabetes Care. 2016; 39(3): 465–468. doi:10.2337/dc15-2124.
47. Rickels MR, DuBose SN, Toschi E, Beck RW, Verdejo AS, Wolpert H, Cummins MJ, Newswanger B, Riddell MC, T1D Exchange Mini‑Dose Glucagon Exercise Study Group. Mini‑Dose Glucagon as a Novel Approach to Prevent Exercise ‑ Induced Hypoglycemia in Type 1 Diabetes. Diabetes Care. 2018; 41(9): 1909–1916.
48. Hövelmann U, Bysted BV, Mouritzen U, Macchi F, Lamers D, Kronshage B, Møller DV, Heise T. Pharmacokinetic and Pharmacodynamic Characteristics of Dasiglucagon, a Novel Soluble and Stable Glucagon Analog.Diabetes Care. 2018; 41(3): 531–537.
49. Pieber TR, Hoevelmann U, Willard J et al. Phase 3 results for dasiglucagon as a fast and effective treatment for severe hypoglycemia. Presented at: American Diabetes Association 79th Scientific Sessions; June 7–11, 2019; San Francisco, CA. Oral Presentation 286-OR.
50. Hövelmann U, Olsen MB, Mouritzen U, Lamers D, Kronshage B, Heise T. Low doses of dasiglucagon consistently increase plasma glucose levels from hypoglycaemia and euglycaemia in people with type 1 diabetes mellitus. Diabetes Obes Metab. 2019; 21(3): 601–610. doi:10.1111/dom.13562.
51. Ranson A, Hövelmann U, Seroussi C, Lamers D, Correia J, Zijlstra E et al. Biochaperone glucagon, a stable ready‑to‑use liquid glucagon formulation enabled by biochaperone technology, is well tolerated and quickly restores euglycemia after insulin‑induced hypoglycemia Advanced Technologies & Treatment for Diabetes; 20–23bruary 2019; Berlin, Germany: 2019.
52. Glezer S, Hovelmann U, Teng S, Lamers D, Odoul M, Correia J et al. BioChaperone glucagon (BCG), a stable ready‑to‑use liquid glucagon formulation, is well tolerated and quickly restores euglycemia after insulin‑induced hypoglycemia. Diabetes. 2018; 67(Supplement 1): 305–OR. 10.2337/db18-305-OR.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Glukagon v léčbě hypoglykemie – novinky
- Hemodynamicky významný perikardiální výpotek jako možný vzácný mimostřevní projev Crohnovy choroby
- Masivní plicní embolie s rozsáhlým trombem ve foramen ovale patens – hrozící paradoxní embolie
- Perindopril – dlouholetá jistota v léčbě hypertenze
-
Jak prodloužit životy našich pacientů ve zdraví?
A lze to? - Hlavní téma: gastroenterologie
- Imonoglobulin G4 asociované onemocnění v gastroenterologii
- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Mimostřevní komplikace idiopatických střevních zánětů
- Aktuální pohled na možnosti diagnostiky a léčby diabetu typu LADA
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Glukagon v léčbě hypoglykemie – novinky
- Perindopril – dlouholetá jistota v léčbě hypertenze
- Mimostřevní komplikace idiopatických střevních zánětů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



