-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
Diagnostics and therapy of chronic pancreatitis according to UEG guidelines
Chronic pancreatitis is one of the diseases whose incidence is slightly increasing long-term. Apparently this is related to our current dietary habits and to the way of life in industrialized societies in general.
In recent years, chronic pancreatitis has experienced greater diagnostic accuracy and reliability, although we are still unable to diagnose the early stages of the disease. In diagnostics, sophisticated imaging methods are in the forefront, and less frequent is the use of tests that assess the exocrine function of the gland.
Non-invasive therapeutic approaches include dietary measures, including an absolute ban on alcohol. Drug therapy consists of the application of drugs containing pancreatic digestive enzymes and the treatment of pancreatic pain. The administration of capsules containing microparticles containing pancreatic enzymes, protected against inactivation of enzymes in an acidic gastric environment, is effective.
In the treatment of pancreatic pain, we use a range of analgesic drugs, but abstinence from alcohol itself leads to a decrease in the frequency of pancreatic pain. Surgical therapy is very effective. Among other treatment methods include also endoscopic therapy. From the point of view of diagnosis and therapy, chronic pancreatitis is one of the conditions requiring a multidisciplinary approach. In this review article, we discuss the possibilities of diagnosis and treatment of chronic pancreatitis according to the current recommendations of UEG (United European Gastroenterology).
Keywords:
chronic pancreatitis – TIGAR‑ O classification – Pancreas – exocrine pancreatic insufficiency – pancreatic pain – United European Gastroenterology
Autoři: Lumír Kunovský 1,2,3; Petr Dítě 1,4,5; Martina Bojková 4,5; Jiří Dolina 1,3; Jitka Vaculová 1,3; Hana Kolovratníková 1,3; Magdalena Uvírová 6; Pavel Janeček 2,3; Zdeněk Kala 2,3; Petr Jabandžiev 3,7,8
Působiště autorů: Interní gastroenterologická klinika, Fakultní nemocnice Brno 1; Chirurgická klinika, Fakultní Nemocnice Brno 2; Lékařská fakulta Masarykovy Univerzity, Brno 3; Interní klinika, Fakultní nemocnice Ostrava 4; Lékařská fakulta Ostravské univerzity, Ostrava 5; CGB Laboratoř Ostrava 6; Pediatrická klinika, Fakultní nemocnice Brno 7; Středoevropský technologický institut (CEITEC), Masarykova univerzita, Brno 8
Vyšlo v časopise: Vnitř Lék 2021; 67(2): 85-91
Kategorie: Hlavní téma
Souhrn
Chronická pankreatitida patří mezi onemocnění, jejichž incidence mírně, ale dlouhodobě vzrůstá. Zřejmě to souvisí s našimi současnými dietními návyky a obecně se způsobem života v průmyslově vyspělých společnostech.
V posledních letech dochází u chronické pankreatitidy k větší diagnostické přesnosti a spolehlivosti, i když časná stadia nemoci stále diagnostikovat neumíme. V diagnostice tak jsou na prvním místě sofistikované metody zobrazovací a méně časté je využití testů, které hodnotí exokrinní funkce žlázy.
Neinvazivní terapeutické přístupy zahrnují opatření dietetická, včetně absolutního zákazu alkoholu. Medikamentózní terapie spočívá v aplikaci léků s obsahem pankreatických trávicích enzymů a léčby pankreatické bolesti. Efektivní je podání kapslí s obsahem mikročástic, obsahujících pankreatické enzymy a chráněných proti inaktivaci enzymů v kyselém žaludečním prostředí.
V léčbě pankreatické bolesti využíváme škály analgeticky působících léků, ale již samotná abstinence vede k poklesu frekvence pankreatické bolesti. Velmi efektivní je terapie chirurgická. Mezi další léčebné metody patří také léčba endoskopická. Z pohledu diagnostiky a terapie tak chronická pankreatitida patří ke stavům, vyžadujícím multioborový přístup. V tomto přehledovém článku pojednáváme o možnostech diagnostiky a léčby chronické pankreatitidy dle současných doporučení UEG (United European Gastroenterology).
Klíčová slova:
chronická pankreatitida – TIGAR‑O klasifikace – slinivka – Exokrinní pankreatická nedostatečnost – pankreatická bolest – United European Gastroenterology
Úvod a incidence
Chronická pankreatitida patří mezi onemocnění, jejichž incidence mírně, ale trvale vzrůstá. V České republice, dle poslední dostupné publikace (1), je její incidence 7,9/100 000 obyvatel/rok. Tento výsledek nás řadí mezi evropský průměr, který je v rozmezí 7,0–10,0, s výjimkou vyššího výskytu ve Finsku. Celosvětová incidence nemoci je uváděna v rozmezí hodnot 5–14/100 000 obyvatel, s prevalencí 30–50/100 000 obyvatel (2–4). Prevalence chronické pankreatitidy stoupá s věkem, střední věk v době diagnózy je 51–58 let (5). Chronická pankreatitida u dětí a mladistvých je většinou spojena s genetickým rizikem.
Klasifikace a definice chronické pankreatitidy
Dle etiologických faktorů je na základě klasifikace TIGAR‑O nemoc dělena do 6 forem (Tab. 1) (6). Klasifikace je obrazem našich znalostí etiologických, resp. rizikových faktorů chronické pankreatitidy, ale nepřináší její definici. Ještě v roce 1995 bylo onemocnění definováno spíše skepticky, jako proces ne zcela jasné patogeneze, a ne zcela předvídatelného průběhu (7). V současné době je onemocnění popisováno jako chronický, progresivní proces, při kterém je parenchym pankreatu nahrazen vazivem, což je provázeno ztrátou jeho exokrinní funkce, terminálně i funkce endokrinní.
Tab. 1. Rozdělení chronické pankreatitidy dle etiologie (klasifikace TIGAR-O) 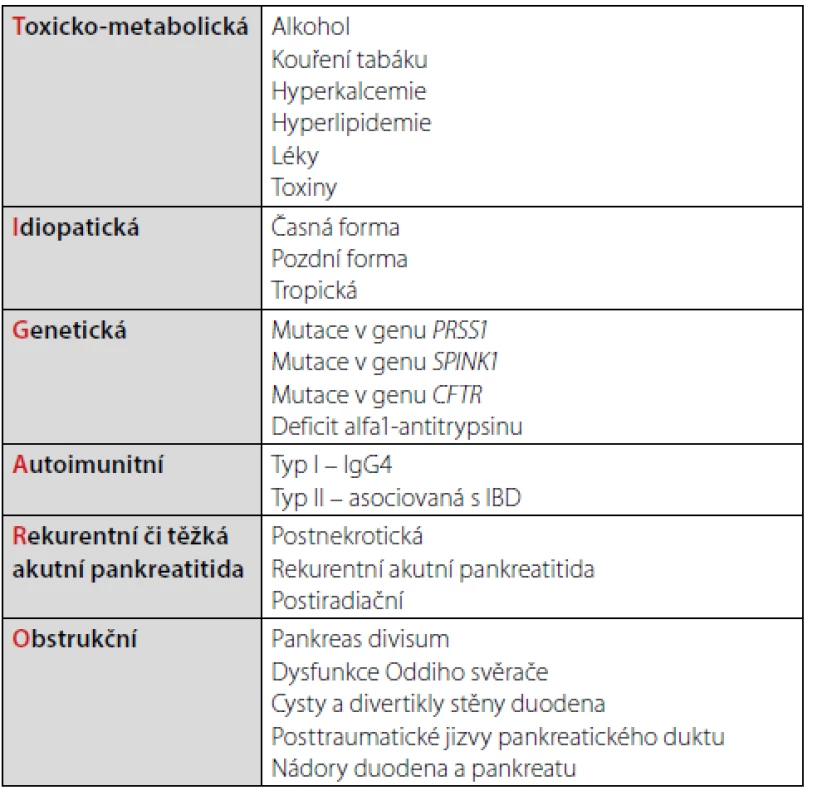
V roce 2016 byla uvedena tzv. mechanistická definice chronické pankreatitidy (8). Tato definice je založena na přítomnosti chronického zánětu, vedoucího ke změnám acinózních buněk a buněk pankreatických vývodů, kdy příčinou mohou být alkohol, kouření, hyperkalcemie, faktory genetické, resp. kombinace všech těchto uvedených faktorů. Tím je tato forma, označovaná jako forma klasické chronické pankreatitidy, odlišná od autoimunitní formy chronické pankreatitidy, pankreatitidy obstruktivní i vzácné chronické pankreatitidy infekční etiologie. Klasická forma chronické pankreatitidy je dále rozdělitelná na formu, kde zcela dominuje fibróza žlázy, a na formu atypickou, s dominancí atrofie pankreatického parenchymu. Dle mechanistické teorie a tzv. konsenzuálního modelu chronické pankreatitidy je rozvoj onemocnění rozdělen do celkem 5 fází. První fáze, v trvání několika let, je označena jako fáze asymptomatická, avšak s přítomností faktorů, které mohou vést v dalším průběhu k poškození struktury parenchymu. Následující fáze je charakterizována opakovanými rekurentními atakami akutní pankreatitidy, s aktivací intrapankreatického imunitního systému. Tato fáze trvá několik dnů a následuje ji zřejmě nejvýznamnější fáze, kdy dochází k indukci časných morfologických i funkčních změn, provázejících chronickou pankreatitidu. Tato fáze, trvající až několik měsíců, končí prokazatelnými změnami exokrinní a v poslední fázi i endokrinní pankreatické funkce. Ve žláze jsou markantní fibrotické změny parenchymu, vedoucí ke změnám jeho textury a stav terminálně může končit objevením se pankreatického karcinomu v terénu chronické pankreatitidy, nebo jiných komplikací nemoci.
Chronická pankreatitida je nemocí, kdy přítomné změny nelze zvrátit do histopatologické nebo funkční normy, na rozdíl od pankreatitidy akutní, i když i zde existují práce o vzniku pankreatitidy chronické po atace pankreatitidy akutní (9–11).
Diagnostika chronické pankreatitidy
V 70. letech 20. století převládalo v rámci diagnostiky chronické pankreatitidy hodnocení změn pankreatickcýh funkcí, což bylo hlavním diagnostickým kritériem, a to až do období zavedení metod zobrazujících změny pankreatické morfologie. Nyní jsou hlavním diagnostickým přístupem v diagnostice onemocnění zobrazovací metody, event. doplněné o vyšetření změn histomorfologických, kdy hodnocená tkáň je získána pomocí pankreatické biopsie. Přesto do diagnostického armamentária patří i dnes metody posuzující pankreatickou funkci, ve vybraných indikacích i vyšetření faktorů genetických (12, 13).
V klinické praxi jistě nejrozšířenější a široce dostupnou diagnostickou metodou je břišní sonografie, která má velmi dobrou vypovídací schopnost v identifikaci solidních i cystických změn, kalcifikací pankreatického parenchymu a změn šíře pankreatického vývodu, ale menší spolehlivost je v diagnostice difuzních parenchymových změn, které jsou ovšem změnami časné fáze chronické pankreatitidy (14, 15). Nepochybnou limitací metody je dependence na osobě vyšetřujícího sonografisty. Použití tzv. contrast-enhanced ultrazvukového vyšetření (contrast‑enhanced ultrasound – CEUS) může zvýšit diagnostickou přesnost především v diagnostice cystických a solidních změn, u difuzních procesů větší přesnost nepřináší.
Významnou diagnostickou zobrazovací metodou je počítačová tomografie (computed tomography – CT). Tato neinvazivní metoda, jejíž nevýhodou je radiační zátěž, je velmi cennou v zobrazení šířky pankreatického vývodu, včetně jeho obsahu, zobrazení konkrementů v parenchymu žlázy, posouzení vztahu pankreatu k velkým cévám a okolním orgánům a zobrazení solidních i cystických lézí. Přes tato konstatování platí, že CT vyšetření má menší senzitivitu i specificitu u lehčích i středně těžkých forem chronické pankreatitidy, ale má vyšší senzitivitu v zobrazení pankreatických kaménků oproti magnetické rezonanci (magnetic resonance imaging – MRI) (16, 17).
MRI umožní identifikaci změn v pankreatickém parenchymu, ale i zobrazení pankreatického a biliárního vývodného systému. S podáním intravenózního sekretinu se výtěžnost zobrazení a hodnocení změn pankreatického vývodného systému ještě zvyšuje (18, 19). V současnosti je jako diagnostická metoda preferována oproti klasické endoskopické retrográdní cholangiopankreatografii (endoscopic retrograde cholangiopancreatography – ERCP), jejíž diagnostické využití je omezeno vzhledem k možným komplikacím. Ovšem tam, kde kromě diagnostiky předpokládáme i terapeutický endoskopický výkon, je ERCP stále nenahraditelné.
Endoskopická ultrasonografie (endoscopic ultrasonography – EUS) je velmi citlivá diagnostická metoda, umožňující zobrazení jak změn parenchymu, tak vývodného systému, včetně např. posouzení tloušťky jeho stěny vývodu. Nevýhodou je, že metoda je dependentní na odborné úrovni a zkušenostech endoskopujícího. Velmi cenná je metoda cílené biopsie pankreatu, provedená pod endosonografickou kontrolou, resp. navedením. V diagnostice chronické pankreatitidy jsou využívána endosonografická kritéria, která tak umožňují standardizaci hodnocení.
Nové technologie, jako je MRI elastografie (22), T1-mapping MRI kvantifikačního hodnocení přítomné fibrózy v parenchymu žlázy (23), nebo hodnocení změn tkáně na mikroskopické či molekulární úrovni (24) dále zpřesňují diagnostiku, i když jejich široké uplatnění se stále teprve očekává.
Diagnostická specifika jsou spojena s diagnózou hereditární pankreatitidy. Je zajímavé, že toto nemocnění s prevalencí 0,3/100 000 obyvatel je popisováno jen v tzv. západních zemích a v Japonsku, ale není známo např. v Africe (25). Pro stanovení diagnózy hereditární pankreatitidy je zásadní průkaz mutace PRSS1, genu kódujícího trypsin 1, známý jako kationický trypsinogen. Je známo více než 35 mutací, ale významné jsou čtyři: R122H, R122C, N291 a A16V (26). Zatímco mutace PRSS1 je označitelná jako samostatný etiologický faktor, další geny jsou zařazovány do skupiny genů podílejících se na vzniku chronické pankreatitidy, ale pouze jen jejich pozitivita bez dalších rizikových faktorů nemoc nezpůsobí. Sem patří např. SPINK 1 (Serine Protease Inhibitor Kazal type 1) nebo gen CTRC, gen kódující chymotrypsin C (27). S cystickou fibrózou je spojen gen CFTR (Cystic Transmembrane Conductance Regulator). Jeho mutace je příčinou změn funkce buněk pankreatických duktů, v nichž dochází k sekreci bikarbonátů.
Exokrinní pankreatická insuficience
Exokrinní pankreatická insuficience (exocrine pancreatic insufficiency – EPI) je definována jako stav nedostatečné pankreatické sekrece, vedoucí k poruše trávení potravy, k čemuž dochází při následujících situacích:
a) ztráta funkčního parenchymu žlázy (chronická pankreatitida, cystická fibróza, resekce pankreatu, nádorová postižení pankreatu)
b) inhibice nebo inaktivace pankreatické sekrece (obstrukce pankreatického vývodu, snížená endogenní stimulace, např. celiakie nebo Crohnova nemoc tenkého střeva, intraluminální inaktivace, např. Zollinger-Ellisonův syndrom)
c) pankreatocibální asynchronie (např. resekce žaludku)
Schéma jednotlivých příčin EPI je přehledně uvedeno na obrázku 1 – upraveno dle Keller et. al. (28).
Obr. 1. Schéma jednotlivých příčin exokrinní pankreatické insuficience. Upraveno dle Keller et al. (28), vytvořeno ve spolupráci se Servisním střediskem pro e-learning, Fakulta informatiky Masarykovy univerzity 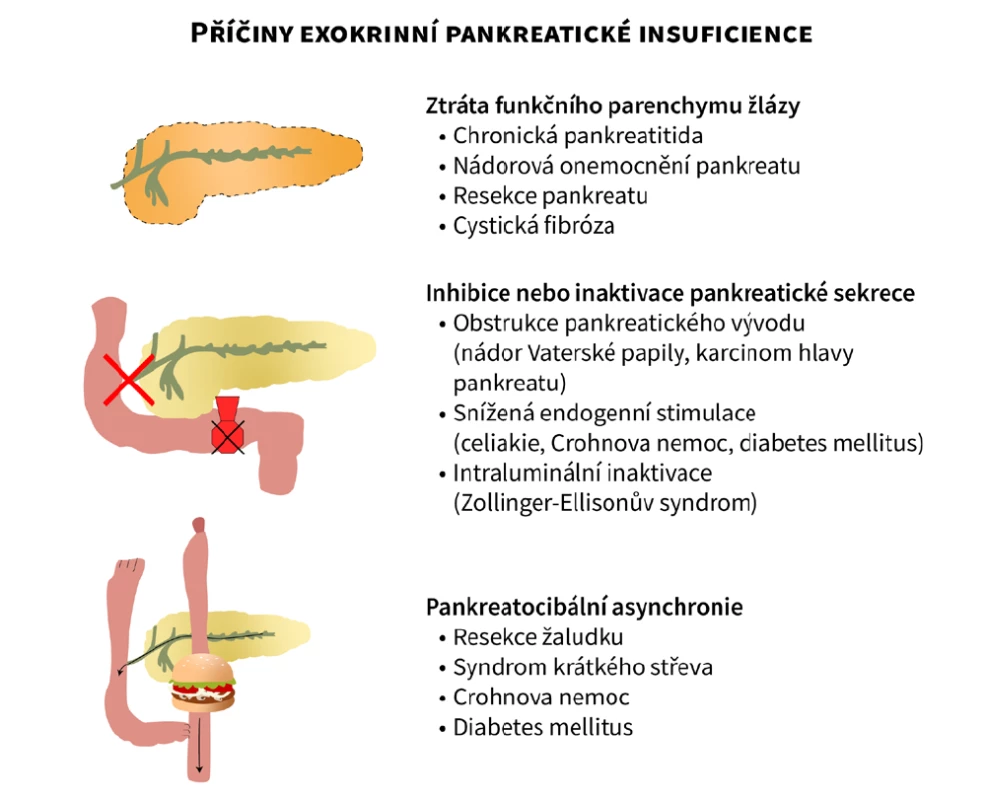
Mezi symptomy pankreatické malabsorpce patří výrazná flatulence, borborygmy, břišní dyskomfort až bolest, průjmovité, často napěněné nebo mastné, objemné, kopiózní stolice, pokles tělesné hmotnosti, sarkopenie, osteoporóza, snížené množství sérových vitaminů, především v tucích rozpustných nebo hypoproteinemie.
V terapii obecně platí absolutní zákaz alkoholu a kouření, redukce přijímaných tuků na 40–60 g/den, což činí asi 30 % z celkového příjmu kalorií, úprava stravy z pohledu její stravitelnosti, s doporučením jíst častěji, v menších objemech. Vysazení alkoholu vede k zásadním změnám, které průběh nemoci příznivě ovlivní (29). Již v roce 1877 uvedl Engesser při testování tablet s pankreatinem, že pankreatin ovlivňuje trávení tuků, aniž by ovlivnil sekreci žaludeční kyseliny chlorovodíkové. O terapii pankreatickými enzymy bude pojednáno podrobně v dalším textu.
Z praktického hlediska rozlišujeme lehkou, středně těžkou a těžkou formu exokrinní nedostatečnosti:
a) lehká forma – snížené je vylučování jednoho nebo dvou pankreatických enzymů (amyláza, lipáza), není změněna sekrece a koncentrace bikarbonátů v pankreatickém sekretu. Normální hodnotu má i množství tuku ve stolici.
b) středně těžká forma – snížení sekrece pankreatických enzymů i bikarbonátů, množství tuku ve stolici je normální.
c) těžká forma – bývá spojena s nálezem steatorey, tj. nálezu signalizujícího, že je snížená exokrinní pankreatická sekrece pod 10 % normy. V krevním séru nacházíme nízké hladiny solubilních vitaminů v tucích jako A, D, E, ale i např. vitaminu C, jež jsme sami prokázali u pacientů s těžkou formou chronické pankreatitidy (30). Dále jsou přítomny známky změn kalcium-fosfátového metabolismu (31). V praxi je terapie pankreatickou substitucí indikována u osob s chronickou pankreatitidou, nebo se známkami pankreatické malabsorpce, spojené např. s laboratorním průkazem 15 g tuku ve stolici/den, nebo s trvalou progredující ztrátou tělesné hmotnosti či i dříve zmíněné změny charakteru stolice (32). Meta‑analýza, publikovaná Iglesiasem a spol. nalezla prevalenci pankreatické endokrinní nedostatečnosti u osob s pokročilým karcinomem pankreatu v 72 %, zvláště u osob s lokalizací karcinomu v hlavě pankreatu. Nemocní s pankreatickou suplementací měli prokazatelně vyšší kvalitu života s prodloužením doby přežití o 4 měsíce (33). Nejen pankreatická substituce u osob s karcinomem pankreatu, ale i suplementace pankreatickými enzymy u osob po gastrointestinálních chirurgických výkonech je efektivní (34).
Efekt terapie pankreatickými enzymy je závislý na:
lékové formě
množství podaných pankreatických enzymů, především lipázy
časové synchronizaci mezi požitím jídla a podáním léku s obsahem pankreatických enzymů
Optimální lékovou formou jsou kapsle s obsahem mikročástic, nejlépe stejně velkých, o průměru menším než 2,0 mm, jako optimální se uvádí 1,5 mm. Mikročástice jsou uzavřeny v kapsli, jejíž povrch je pH dependentní, který přitom mikročástice v kyselém prostředí ochrání proti inaktivaci enzymů. Enzymy jsou z částic uvolňovány až v prostředí alkalickém, které svým pH je odpovídající pH v horní části duodena. Obrázek 2 ukazuje schematicky, jak k liberaci pankreatických enzymů dochází s tím, že obal kapsle je dezintegrován v žaludku v kyselém pH, uvolněné mikročástice se promíchají s žaludečním chymem, společně vstoupí mikročástice a chymus do duodena a zde se změnou pH z nich uvolní trávicí enzymy (35). Tento postup v podstatě odpovídá fyziologickým poměrům.
Obr. 2. Uvolňování pankreatických enzymů při podání substituční léčby. Obal léku se rozpouští v kyselém prostředí žaludku, následně k aktivaci enzymů dochází v duodenu při změně na zásadité pH. Vytvořeno ve spolupráci se Servisním střediskem pro e-learning, Fakulta informatiky Masarykovy univerzity 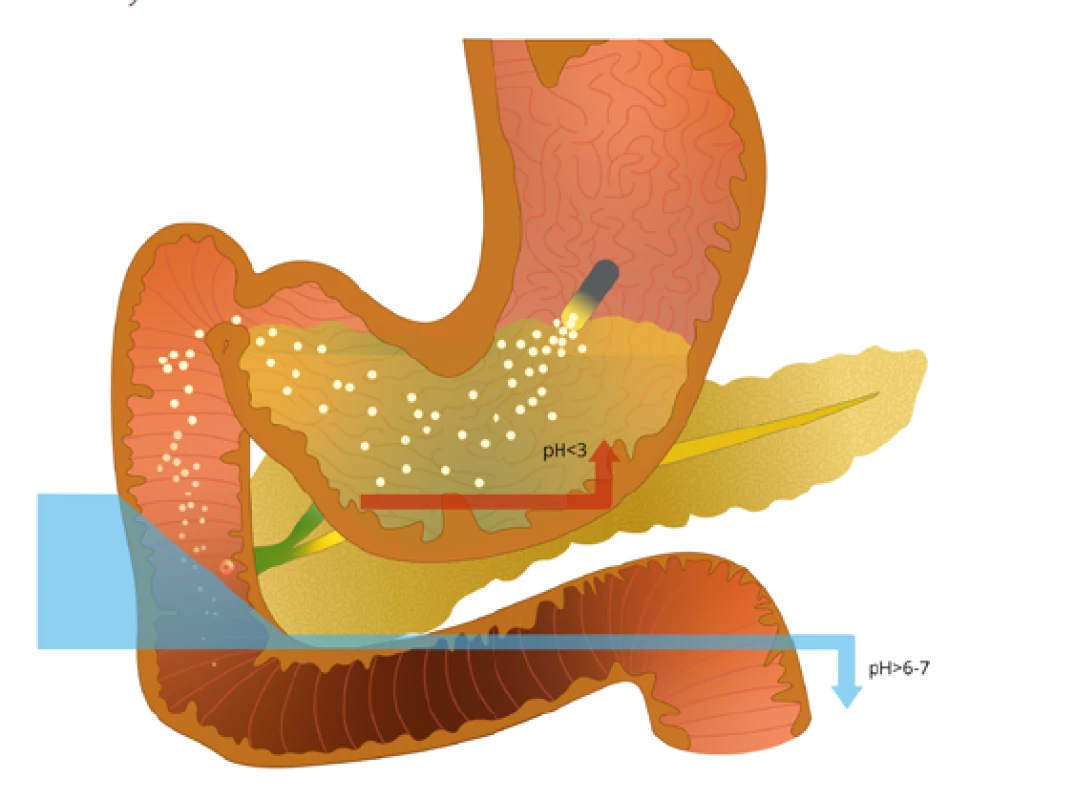
Dle doporučení United European Gastroenterology (UEG) je vhodné podat kapsli s pankreatickými enzymy během jídla nebo těsně po skončení jídla. Tabulka 2a (upraveno dle 13) a tabulka 2b ukazuje doporučené dávkování množství enzymů ve vztahu k jídlu. Při neúspěšné klinické odpovědi mohou být dávky enzymů až zdvojnásobeny.
Tab. 2a. Standardní terapie exokrinní pankreatické insuficience dle UEG 
Tab. 2b. Nová alternativa terapie exokrinní pankreatické insuficience dle UEG 
U osob s vysokou žaludeční sekrecí, když není pozorován efekt enzymatické suplementace, je nutno pomýšlet na fakt, že kyselé pH je i v horní části duodena, a dochází tak k inaktivaci enzymů – především lipázy. V takovém případě je indikováno podání léku, blokujícího kyselou žaludeční sekreci, nejlépe některého z blokátorů protonové pumpy.
Zvláštností enzymatické terapie je odlišný přístup v léčbě osob s žaludeční achlorhydrií a zachovalým žaludkem nebo u osob po resekci žaludku, která vede k nedostatečné sekreci kyseliny chlorovodíkové. V takovém případě je doporučeno podat přímo granulát vysypaný z kapsle.
V současné době je na našem trhu registrován a dostupný lék Kreon® 35 000 s obsahem 35 000 j lipázy, který tak splňuje doporučení UEG stran dávky podané lipázy k hlavnímu jídlu, respektive snižuje počet kapslí v terapii velmi těžké exokrinní pankreatické nedostatečnosti, jak je tomu např. při cystické fibróze, kde je doporučeno až 4000 j lipázy na 1 g tuku v dietě.
Terapie pankreatické bolesti
Chronická pankreatitida je nejčastěji, v 85–90 %, označena jako bolestivá forma nemoci, pouze zbylých 10–15 % se vyznačuje průběhem nebolestivým. Dle American Gastroenterological Association (AGA), je pankreatická bolest dělena do 5 typů (36):
1) epizodická mírná až středně silná bolest
2) konstantní mírná až středně silná bolest
3) bolest s epizodami bez příznaků mezi epizodami intenzivní bolesti
4) trvalá mírná bolest s epizodami bolesti velmi intenzivní
5) trvalá velmi intenzivní bolest
Pankreatická bolest je nejčastěji bolestí stálou, střední intenzity, s epizodami bolesti intenzivní (56 %). Bolest konstantní je bolestí častější než bolest intermitentní (52 % vs. 45 %) a pankreatická bolest s bezbolestnými epizodami bývá u 30 % nemocných (37).
Intenzita a charakter bolesti souvisí s vývojem onemocnění, kdy při časné fázi onemocnění bývá bolest periodická s progresí do typu bolesti konstantní (38, 39). U některých osob, obvykle po době delší než 15 let trvání nemoci, může dojít, díky destrukci žlázy, k tzv. fenoménu vyhasnutí bolesti (burn out fenomén).
V terapii bolesti existuje řada léčebných modalit:
odstranění rizikových faktorů – alkohol, kouření
nastavení diety, substituce pankreatických enzymů
ovlivnění intraduktálního pankreatického tlaku (přenáší se i do parenchymu)
analgetika – jako lék první volby bývá doporučován paracetamol, dále esteroidní antiflogistika v kombinaci s blokátorem protonové pumpy, opioidy a efektivní mohou být tzv. adjuvantní analgetika, např. gabapentin, tricyklická antidepresiva, anxiolytika
endoskopická terapie
chirurgická léčba
neuromodulace – akupunktura, transkutánní elektrická stimulace nervu apod.
experimentální terapie, např. kanabinoidy, ketamin, inhibitory nervového růstového faktoru apod.
U některých osob byl popisován efekt antioxidantů a aplikace pankreatických enzymů (40, 41). Výsledky jsou však stále nepřesvědčivé, pouze starší studie s tzv. non ‑ enteric coated tabletami přinesly příznivý výsledek (42). Vysvětlení možného efektu podaných pankreatických enzymů spočívá ve zpětné vazbě, podílející se na regulaci pankreatické zevní sekrece ve vztahu k hladině pankreatických enzymů v duodenu. Není však jasné, proč jsou popsány jako účinné kompaktní tablety, oproti lékové formě kapslí s mikročásticemi.
Závěr
Mimo rozsah této práce je uvedení invazivních a velmi efektivních způsobů terapie – terapie endoskopické a terapie chirurgické. Naše práce je tak soustředěna na postupy neinvazivní. Přesto si na základě uvedeného dovolujeme uzavřít, že diagnostika a terapie chronické pankreatitidy je záležitostí multioborovou, a proto i velmi komplikovanou.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Lumír Kunovský, Ph.D.
Interní gastroenterologická klinika, Fakultní nemocnice Brno,
Lékařská fakulta Masarykovy university
Jihlavská 20
625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(2): 85–91
Článek přijat redakcí: 16. 11. 2020
Článek přijat po recenzích: 25. 1. 2021
Zdroje
1. Dítě P, Starý K, Novotný I et al. The Incidence of chronic pancreatitis in the Czech Republic. Eur J Gastroenterol Hepatol 2001; 13(6): 749–750.
2. Yadav D, Timmons L, Benson JT et al. Incidence, prevalence and survival of chronic pancreatitis: a population‑based study. Am J Gastroenterol 2011; 106 : 2192–2199.
3. Lévy P, Domínguez‑Muñoz E, Imrie C et al. Epidemiology of chronic pancreatitis: burden of the disease and consequences. United European Gastroenterol J 2014; 2(5): 345–354.
4. Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology 2013; 144 : 1252–1261.
5. Kleeff J, Whitcomb D, Shimosegawa T et al. Chronic pancreatitis. Nature Rev Dis Primers 2017; 3 : 17060.
6. Etemad B, Whitcomb DC. Chronic pancreatitis: diagnosis, classification and new genetic developments. Gastroenterology 2001; 120 : 682–707.
7. Steer ML, Waxman I, Freedman S. Chronic pancreatitis. N Engl J Med 1995; 332 : 1482-1490.
8. Whitcomb DC, Frulloni L, Garg P et al. An international draft consensus proposal for a new mechanistic definition. Pancreatology. 2016; 16 : 218–224.
9. Bojková M, Dítě P, Kunovský L, et al. The role of metabolic syndrome in the induction of chronic pancreatitis after a first attack of acute pancreatitis -multicenter trial. Vnitř Lék 2020; 66(8): e12–e16.
10. Bertilsson S, Sward P, Kalaitzakis E. Factors that affect disease progression after first attack of acute pancreatitis. Clinical Gastroenterology and Hepatology 2015; 13 : 1662–1669.
11. Ahmed Ali U, Issa Y, Hagenaars JC et al. Risk of recurrent pancreatitis and progression to chronic pancreatitis after a first episode of acute pancreatitis. Clin Gastroenterol Hepatol 2016; 14(5): 738–746.
12. Hoffmeister A, Mayerle J, Beglinger C et al. Definition, aetiology, diagnostic examinations, medical, endoscopic and surgical management of chronic pancreatitis. Z Gastroenterol 2015; 53 : 1443–1495.
13. Löhr JM, Dominguez‑Munoz E, Rosendahl J et al. United European Gastroenterology evidence – based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterol Journal 2017; 5(2): 153–199.
14. Shmulewitz A, Teefey SA, Robinson BS et al. Factor affecting image quality and diagnostic efficacy in abdominal sonography: a prospective study of 140 patients. J Clin Ultrasound 1993; 21 : 623–630.
15. Perez‑Johnston R, Sainani NI, Sahani DV. Imaging of chronic pancreatitis (including groove and autoimmune pancreatitis). Radiol Clin North Am 2012; 50 : 447–466.
16. Anderson SW, Sato JA. Pancreatic duct evaluation: accuracy of portal venous phase 64 MDCT. Abdominal Imaging 2009; 34 : 55–64.
17. Dimastromatteo J, Brentnall T, Kelly K. Imaging in pancreatic disease Nature Reviews Gastroenterol Hepatol 2017; 14 : 97–109.
18. Sandrasegaran K, Lin C, Akisik FM. et al. State – of‑the‑art pancreatic MRI. AJR Am J Roentgenol 2010; 195 : 42–53.
19. Kim T, Murakami T, Takamura M et al. Pancreatic mass due to chronic pancreatitis: correlation of CT and MR imaging features with pathologic findings. AJR Am J Roentgenol 2001; 177(2): 367–371.
20. Catalano MF, Sahai A, Levy M et al. EUS‑based criteria for the diagnosis of chronic pancreatits. The Rosemont classification. Gastrointest Endosc 2009; 69 : 1251–1261.
21. Iglesias‑García J, Lariño‑Noia J, Lindkvist B et al. Endoscopic ultrasound in the diagnosis of chronic pancreatitis. Rev Esp Enferm Dig 2015; 107(4): 221–228.
22. Shi Y, Glaser KJ, Venkatesh SK et al. Feasibility usinig 3D MR elastography to determine pancreatic stiffness in healthy volunteers. J Magn Reson Imaging. 2015; 41 : 369–375.
23. Tirkes T, Lin C, Fogel EL et al. T1 mapping for the diagnosis of mild chronic pancreatitis. J Magn Reson Imaging. 2017; 45 : 1171–1176.
24. Akisik MF, Aisen AM, Sandrasegaran K, Jennings SG, Lin C, Sherman S, Lin JA, Rydberg M. Assessment of chronic pancreatitis: utility of diffusion‑weighted MR imaging with secretin enhancement. Radiology 2009; 250(1): 103–109.
25. Rebours V, Boutron‑Ruault MC, Schnee M et al. The natural history of hereditary pancreatitis: a national series. Gut 2009; 58 : 97–103.
26. Németh BC, Sahin‑Tóth M. Human cationic trypsinogen (PRSS1) variants and chronic pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2014; 306 : 466–473.
27. Masson E, Chen JM, Scotet V et al. Association of rare chymotrypsinogen C(CTRC) gene variations in patients with idiopathic chronic pancreatitis. Human Genetics 2008; 123 : 83–91.
28. Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut 2005; 54Suppl 6: vi1–vi28.
29. Löhr JM. Exocrine pancreatic insufficiency. Uni‑Med Verlag AG 2010. ISBN: 978 - 3895992025.
30. Přecechtělová M, Dítě P, Soška V et al. Změny plazmatických hladin vitaminů C a E a volných kyslíkových radikálů u nemocných s chronickou pankreatitidou. Čes a Slov Gastroent 1994; 48 (2): 47–51.
31. Pezzilli R, Andriulli A, Bassi C et al. Exocrine Pancreatic Insufficiency collaborative (EPIc) Group. Exocrine pancreatic insufficiency in adults: a shared position statement of the Italian Association for the Study of the Pancreas. World J Gastroenterol 2013; 19(44): 7930–7946.
32. Domínguez‑Muñoz JE, Drewes AM, Lindkvist B et al. Recommendations from United European Gastronterology evidence‑based guidelines for diagnosis and therapy of chronic pancreatitis. Pancreatology 2018; 18 : 847–854.
33. Iglesia D, Avci B, Kiriukova M et al. Pancreatic exocrine insufficiency and pancreatic enzyme replacement therapy in patients with advanced pancreatic cancer: A systematic review and meta‑analysis. United European Gastroenterol Journal 2020; 8(9): 1115–1125.
34. Chaudhary A, Domínguez‑Muñoz JE, Layer P et al. Pancreatic exocrine insufficiency as a complication of gastrointestinal surgery and the impact of pancreatic enzyme replacement therapy. Dig Dis 2020; 38 : 53–68.
35. Dutta SK, Rubin J, Harvey J. Comparative evaluation of the therapeutic efficacy of a pH‑sensitive enteric coated pancreatic enzyme preparation with conventional pancreatic enzyme therapy in the treatment of exocrine pancreatic insufficiency. Gastroenterology 1983; 84 : 476–482.
36. Warshaw AL, Banks PA, Fernándéz‑Del Castillo C. AGA technical review: treatment of pain in chronic pancreatitis. Gastroenterology 1998; 115 : 765–776.
37. Hobbs PM, Johnson WG, Graham DY. Management of pain in chronic pancreatitis with emphasis on exogenous pancreatic enzymes. World J Gastrointest Pharmacol and Ther 2016; 7(3): 370–386.
38. Pitchumoni CS. Chronic pancreatitis: pathogenesis and management of pain. J Clin Gastroenterol 1998; 27 : 101–107.
39. Enweluzo C, Tlhabano L. Pain management in chronic pancreatitis: taming the beast. Clin Exp Gastroenterol 2013; 6 : 167–171.
40. Talukdar R, Murthy HM, Reddy DN. Role of methionine containing antioxidant combination in the management of pain in chronic pancreatitis: a systematic review. Pancreatology. 2015; 15 : 136–144.
41. Winstead NS, Wilcox CM. Clinical trials of pancreatic enzyme replacement for painful chronic pancreatitis--a review. Pancreatology 2009; 9 : 344–350.
42. Isaksson G, Ihse I. Pain reduction by an oral pancreatic enzyme preparation in chronic pancreatitis. Dig Dis Sci 1983; 28 : 97–102.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Glukagon v léčbě hypoglykemie – novinky
- Hemodynamicky významný perikardiální výpotek jako možný vzácný mimostřevní projev Crohnovy choroby
- Masivní plicní embolie s rozsáhlým trombem ve foramen ovale patens – hrozící paradoxní embolie
- Perindopril – dlouholetá jistota v léčbě hypertenze
-
Jak prodloužit životy našich pacientů ve zdraví?
A lze to? - Hlavní téma: gastroenterologie
- Imonoglobulin G4 asociované onemocnění v gastroenterologii
- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Mimostřevní komplikace idiopatických střevních zánětů
- Aktuální pohled na možnosti diagnostiky a léčby diabetu typu LADA
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika a terapie chronické pankreatitidy dle UEG guidelines
- Glukagon v léčbě hypoglykemie – novinky
- Perindopril – dlouholetá jistota v léčbě hypertenze
- Mimostřevní komplikace idiopatických střevních zánětů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



