-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aortální disekce a jiné akutní aortální syndromy na urgentním příjmu
Aortic dissection and other acute aortic syndromes in the emergency department
Acute aortic syndromes are emergent life-threatening conditions affecting the aorta, which actual incidence is difficult to determine. Mortality of untreated patients increases steadily over time, so early diagnosis and initiation of therapy are crucial. Management of patients in Czech Republic follow, similar as in other European countries, the European Society of Cardiology guidelines from 2014, which were updated in 2018. The basis for diagnosis consists of history, physical examination, ECG, determination of vital signs, hemodynamic status and stratification of diagnosis probability by ADD-RS (aortic dissection detection risk score). This is followed by a series of laboratory and imaging examinations, of which the D-dimer, CT aortography and echocardiography are the most important. Recent studies show the benefit of combination of ADD-RS with D-dimer or measurement of ascendant aorta diameter by echocardiography. New emerging biomarkers are currently under investigation. Thanks to advances in technology, magnetic resonance imaging could take place as emergent diagnostic tool in the future. Initial therapy depends on the hemodynamic status of the patient. It must be followed by definitive therapy. In this publication we summarize the approach to a patient with acute aortic syndrome in the emergency department focusing on aortic dissection as its most common type.
Keywords:
ADD-RS – acute aortic syndrome – D-dimer – dissection
Autoři: Radka Volovárová 1; Štefan Volovár 2; Jan Lhotský 2; Jan Baxa 3; Martin Matějovič 1
Působiště autorů: I. interní klinika LF UK a FN Plzeň 1; Kardiologická klinika, Centrum vysoce specializované komplexní kardiovaskulární péče LF UK a FN Plzeň 2; Klinika zobrazovacích metod LF UK a FN Plzeň 3
Vyšlo v časopise: Vnitř Lék 2019; 65(7-8): 506-514
Kategorie: Přehledné referáty
Souhrn
Akutní aortální syndromy jsou emergentní život ohrožující stavy postihující aortu, jejichž skutečnou incidenci je těžké stanovit. Mortalita neléčených pacientů v čase strmě stoupá, proto jsou časná diagnostika a zahájení terapie velice důležité. Management pacientů se v České republice řídí, podobně jako v jiných evropských zemích, doporučenými postupy Evropské kardiologické společnosti z roku 2014, které byly upraveny v roce 2018. Základ v diagnostice tvoří anamnéza, fyzikální vyšetření, EKG, zhodnocení hemodynamického stavu a u stabilních pacientů stratifikace pravděpodobnosti onemocnění pomocí ADD-RS (Aortic Dissection Detection Risk Score). Na ní pak navazuje celá řada laboratorních a zobrazovacích vyšetření, ze kterých významné postavení má stanovení D-dimerů, CT aortografie a echokardiografie. Recentní studie ukazují přínos kombinace ADD-RS s D-dimery nebo echokardiografickým stanovením diametru ascendentní aorty. Současně se zkoumá přínos nových biomarkerů, které by mohly nahradit nebo doplnit D-dimery. Své místo v emergentní diagnostice si díky technologickým pokrokům může v budoucnu získat i magnetická rezonance. Iniciální terapie se odvíjí od hemodynamického stavu pacienta. Musí na ni navazovat terapie definitivní. V uvedené publikaci sumarizujeme přístup k pacientovi s akutním aortálním syndromem na urgentním příjmu se zaměřením na aortální disekci jako jeho nejčastější typ.
Klíčová slova:
ADD-RS – akutní aortální syndrom – D-dimery – disekce
Úvod
Akutní aortální syndromy (AAS) jsou definovány jako emergentní život ohrožující stavy postihující aortu, jejichž společnou patofyziologickou charakteristikou je postižení intimy a medie. Mezi AAS se řadí akutní aortální disekce, intramurální hematom aorty, penetrující vřed aorty a ruptura hrudní aorty [1,2]. Skutečnou incidenci AAS je těžké stanovit, protože u části pacientů, kteří v důsledku této skupiny onemocnění zemřou náhle nebo před příjezdem do nemocnice, nemusí být onemocnění diagnostikováno, pokud není nařízena pitva. V literatuře uváděná incidence akutní aortální disekce (AAD) jako nejčastějšího AAS se pohybuje mezi 2,6–6/100 000 obyvatel za rok [2,3].
Prognóza AAS je nepříznivá. U neléčených pacientů s AAD typu A se mortalita zvyšuje o 1–2 % za hodinu v prvních 48 hod od vzniku symptomů [4,5]. Osud pacientů tedy závisí na časnosti stanovení správné diagnózy a zahájení léčby. Proto je kladen velký důraz na to, aby již lékař prvního kontaktu na urgentním příjmu vytřídil pacienty, u kterých je onemocnění pravděpodobné a kteří by měli podstoupit další konfirmační testy, a aby u pacientů s potvrzenou diagnózou co nejčasněji zahájil terapii. Stanovení diagnózy zůstává obtížné, protože symptomy onemocnění a rutinně užívané biomarkery jsou nespecifické. Další diagnostické metody používané při prvním kontaktu s pacientem – jako EKG a skiagram hrudníku – postrádají dostatečnou senzitivitu a v případě EKG i specificitu [2].
Klasifikace
V současnosti existuje několik klasifikačních schémat, která klasifikují AAS na základě časového průběhu, anatomie a etiologie.
Původně se z hlediska časového průběhu dělila disekce aorty na akutní (čas od začátku symptomů < 14 dnů) a chronickou (≥ 14 dnů). Cut-off hodnota 14 dnů vycházela z míry přežití a data pocházela z prací z 50. let minulého století, především z práce Hirsta et al z roku 1958 se souborem 505 pacientů, z dob před moderní diagnostikou a léčbou [2,6]. Ve snaze vytvořit lepší klasifikaci pro potřeby moderní medicíny Booher et al použili data z International Registry of Aortic Dissection (IRAD) a rozdělili aortální disekce typu A a B (viz níže) podle časového průběhu na hyperakutní (čas od začátku symptomů < 24 hod), akutní (2–7 dnů), subakutní (8–30 dnů) a chronickou (> 30 dnů). Následně vytvořil Kaplanovy-Meierovovy křivky přežití pacientů podle anatomického typu disekce (typ A a B) a léčby (chirurgická nebo medikamentózní pro typ A a chirurgická, endovaskulární nebo medikamentózní pro typ B). Míra přežití klesala během všech 4 časových period bez ohledu na typ disekce a způsob léčby [7]. Evropská kardiologická společnost (European Society of Cardiology – ESC) ve svých Doporučených postupech pro diagnostiku a léčbu onemocnění aorty z roku 2014 přišla s odlišnou časovou klasifikací a aortální disekci rozdělila na akutní (čas od začátku symptomů < 14 dnů), subakutní (15–90 dnů) a chronickou (více než 90 dnů) [1].
Na základě anatomie se užívají 2 klasifikace: Stanfordská a DeBakeyho.
Podle Stanfordské klasifikace z roku 1970 se aortální disekce dělí na typ A a B. Typ A je charakterizován postižením ascendentní aorty, bez ohledu na lokalizaci intimální trhliny. Všechny ostatní aortální disekce se pak označují jako typ B [2,7]. Toto dělení je z klinického hlediska velmi významné, protože pacienti s typem A mají mnohem horší krátkodobou prognózu. Podle práce Boohera et al byla nemocniční mortalita pacientů s typem A až 2,5krát vyšší než u pacientů s typem B (29,5 vs 11,6 %) [8].
Podle DeBakeyho se dělí aortální disekce na typ I, při kterém je intimální trhlina v oblasti ascendentní aorty a disekce se propaguje do aortálního oblouku nebo distálněji. Typ II je charakterizován lokalizací intimální trhliny v ascendentní aortě, bez propagace disekce do aortálního oblouku nebo distálněji. Typ III je charakterizován přítomnosti intimální trhliny v descendentní aortě. Dál se dělí na podtyp IIIa, u něhož je disekce limitována pouze na hrudní část descendentní aorty, a podtyp IIIb, u kterého disekce zasahuje pod bránici do abdominální části aorty [2]. Pro potřeby lékaře prvního kontaktu není poměrně komplikovaná DeBakeyho klasifikace nutná, protože veškerý další management pacienta se odvíjí na základě toho, jestli je nebo není postižena ascendentní aorta. Stanfordská klasifikace se dá použít i na další typy AAS.
Svensson et al dělí AAS do 5 tříd. Do 1. třídy patří klasická disekce aorty s pravým a falešným lumen, do 2. třídy intramurální hematom anebo intramurální zakrvácení. Do 3. třídy se řadí intimální trhlina s vyklenutím bez hematomu. Ve 4. třídě je penetrující aterosklerotický vřed aorty a v 5. třídě iatrogenní nebo traumatická disekce aorty [9]. Výše uvedená klasifikační schémata jsou shrnuta v tab. 1.
Tab. 1. Nejčastěji používaná schémata pro klasifikaci AAS. Upraveno podle [2] ![Nejčastěji používaná schémata pro klasifikaci AAS. Upraveno podle [2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b9663d34c17ce80756dd99a696226cf3.png)
Diagnostika: anamnéza, fyzikální vyšetření a biomarkery
Podle dat z IRAD asi dvě třetiny pacientů s AAD tvoří muži, většinou starší 70 let. Pouze 7 % pacientů bylo mladších 40 let. Arteriální hypertenze v anamnéze byla přítomná u 74 % pacientů s AAD typ A a 81 % pacientů s AAD typ B [2]. Dalšími rizikovými faktory jsou vrozené poruchy pojivové tkáně jako např. Marfanův syndrom, Ehlersův-Danlosův syndrom nebo Loeysův-Dietzův syndrom, dále bikuspidální aortální chlopeň, chirurgický zákrok na aortě v anamnéze, onemocnění aorty v rodinné anamnéze a aneuryzma hrudní aorty [10]. Nejčastějším symptomem je bolest na hrudi, která se vyskytuje až u 80 % pacientů a je častější u typu A. Bolest zad a břicha je u typu A méně častá (pouze 40, resp. 25 %), mnohem typičtější je pro typ B, u kterého se bolest zad vyskytuje až u 70 %, nicméně bolest může při AAD i úplně absentovat [1]. Typicky má bolest náhlý začátek a je ostrá, řezavá, s pocitem „rozpárání“ a je intenzivní. Svými charakteristikami se liší od bolesti jiné etiologie. Častým nálezem při fyzikálním vyšetření je nový pulzový deficit na periferních tepnách, který je přítomen u 30 % pacientů s AAD typu A a 15 % pacientů s AAD typu B [1]. Při podezření na AAD je důležité měření tlaku krve na obou končetinách, diference větší než 20 mm Hg systolického tlaku krve je dalším typickým nálezem při fyzikálním vyšetření. Nový fokální neurologický deficit z hypoperfuze mozku nebo míchy se vyskytuje u 15–40 % pacientů a asi v polovině případů je přechodný [1,11]. Kromě klinického obrazu typického pro CMP (jako např. hemiplegie, monoparéza, fatické poruchy) se může manifestovat i akutní paraplegií, kómatem nebo raritně syndromem Claude Bernarda-Hornera [6]. Akutní aortální regurgitace se vyskytuje u 40–75 % pacientů s AAD typu A, jejímž příznakem je nově vzniklý diastolický šelest nejlépe slyšitelný mezi 2.–4. mezižebřím vlevo od sterna. V některých případech ale může být punctum maximum šelestu parasternálně vpravo [6,11]. Hypotenze a šokový stav může rezultovat z ruptury aorty, akutní těžké aortální regurgitace, extenzivní ischemie myokardu při postižení kořene aorty a koronárních tepen, tamponády srdce nebo preexistující dysfunkce levé komory. Synkopa se vyskytuje u 15 % pacientů s AAD typu A a u < 5 % pacientů s AAD typu B. Je negativním prognostickým markerem [1]. Masivní hemotorax vznikající při krvácení do mediastina nebo pleurálního prostoru není častý, protože tito pacienti většinou umírají ještě před příjezdem do nemocnice. Menší pleurální výpotky vznikající v důsledku zánětu pleury se pozorují u 15–20 % pacientů a jsou stejně časté u typu A i B [1]. Výčet subjektivních a objektivních známek při AAD přináší tab. 2.
Tab. 2. Hlavní klinické příznaky a komplikace u pacientů s AAD. Upraveno podle [1] ![Hlavní klinické příznaky a komplikace
u pacientů s AAD. Upraveno podle [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d20dc9f607dcaeb8735541eee0866733.png)
Nejčastějším projevem intramurálního hematomu a penetrujícího vředu aorty je bolest, která má podobné charakteristiky jako u AAD. U obou těchto představitelů AAS se na rozdíl od AAD ale vyskytují příznaky orgánové hypoperfuze/ischemie jen velice raritně [2,11].
Některé z výše uvedených příznaků a nálezů při fyzikálním vyšetření jsou pro svoji specifitu součástí ADD-RS (Aortic Dissection Detection Risk Score), tab. 3, které slouží k rychlé bed-side stratifikaci pravděpodobnosti AAD. Poprvé byla tato stratifikace publikována v doporučených postupech American College of Cardiology Foundation (ACCF) a American Heart Associotion (AHA) k diagnostice a managementu pacientů s onemocněním hrudní aorty z roku 2010 [11]. Senzitivita ADD-RS byla validována ve studii Rogerse et al. Z celkového počtu 2 538 pacientů s AAD bylo pouze 4,3 % klasifikovaných na základě ADD-RS jako pacienti s nízkým rizikem (ADD-RS 0), 36,5 % bylo klasifikovaných se středním rizikem (ADD-RS 1) a 59,2 % mělo vysoké riziko (ADD-RS 2–3) [12]. ADD-RS mělo tedy dostatečně vysokou senzitivitu. Tento skórovací systém je v současnosti doporučen k rizikové stratifikaci i doporučenými postupy ESC z roku 2014 [1,2].
Tab. 3. ADD-RS užívané k rychlé bed-side rizikové stratifikaci pacientů. Upraveno podle [1] ![ADD-RS užívané k rychlé bed-side rizikové stratifikaci pacientů. Upraveno podle [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/722ea6a042f432687669f922a4aacb91.png)
V případě, že je v kategorii přítomen jeden a víc rizikových faktorů dostane pacient za danou kategorii 1 bod; minimální počet bodů v skóre je tedy 0 a maximální 3 body. Nejvíc využívaným biomarkerem v úvodním diferenciálně diagnostickém procesu u pacientů se suspektním AAS jsou D-dimery. Po vzniku disekce aorty stoupá hladina D-dimerů velice rychle [1]. Doporučené postupy ACCF/AHA z roku 2010 nedoporučují rutinní používaní D-dimerů ke screeningu pacientů se suspektním AAS. Argumentují relativně nízkou negativní prediktivní hodnotou u pacientů vysokou předtestovou pravděpodobností AAS, nízkou senzitivitou k vyloučení intramurálního hematomu nebo penetrujícího vředu aorty a absencí velkých klinických studií, v nichž by bylo testováno použití D-dimerů u všech pacientů s podezřením na AAS [11]. ESC ve svých doporučených postupech z roku 2014 a aktualizací doporučených postupů z roku 2018 doporučuje stanovení D-dimerů u pacientů s nízkou předtestovou pravděpodobností AAS (ADD-RS 0–1) společně s RTG hrudníku a transtorakální echokardiografií. Jako cut-off hodnotu doporučuje použít hodnotu 500 ng/ml [1,2]. Podle různých studií je při použití této cut-off hodnoty senzitivita k vyloučení AAS 94–100 % a specificita podle většiny studií 37–57 % [13–15]. Podle jedné studie cut-off D-dimerů 1 600 ng/ml je postačující k spolehlivé identifikaci pacientů s vysokou pravděpodobností AAS, pokud jsou D-dimery nabrány do 6 hod od vzniku symptomů. ESC ale uvádí, že jsou potřebná další data k potvrzení spolehlivosti této cut-off hodnoty [2,16]. V recentní prospektivní multicentrické studii ADvISED byla testována spolehlivost integrovaného použití ADD-RS a D-dimerů k identifikaci pacientů se suspektními AAS. Pouze 0,3 % pacientů s ADD-RS 0–1 a negativními D-dimery při užití cut-off hodnoty 500 ng/ml mělo později diagnostikován AAS [17]. Výsledky této studie tedy ukazují, že společné použití ADD-RS a D-dimerů dál zvyšuje diagnostikou přesnost a dál zlepšuje stratifikaci pravděpodobnosti onemocnění, která je vyšší než při užití obou parametrů samostatně. Dalšími biomarkery, jejichž elevace byla asociována s AAD, byli sST2, kalponin a tenascin C. Elevace ADAMTS1 a ADAMTS4 je asociována s AAD ale pouze u typu A. Nízké hladiny metaloproteinázy 8 (MMP8) měly 100% senzitivitu, ale AAD vyloučily pouze u 5,6 % pacientů. Kombinace s D-dimery zvýšila přesnost MMP8 k vyloučení AAD [18–22]. Byly identifikovány konkrétní mikroRNA, jejichž elevace (miR-25, miR-29a, miR-155, miR-4787–5p a miR-4306) nebo pokles (miR-26b) je asociován s AAD [23,24]. Uvedené biomarkery mohou mít význam v časné laboratorní diagnostice AAD nebo AAS v budoucnosti. V současnosti se jejich využití pohybuje pouze v experimentální rovině.
Diagnostika: zobrazovací vyšetření
Skiagram hrudníku je doporučen ESC jako první zobrazovací vyšetření u pacientů s nízkou předtestovou pravděpodobností (ADD-RS 0–1), protože rozšířený mediastinální stín může podpořit diagnózu. Negativní skiagram hrudníku ale diagnózu AAS nevylučuje [1,11].
Transtorakální echokardiografie (TTE) je podobně jako skiagram hrudníku doporučena ESC u pacientů s ADD-RS 0–1, ale také u pacientů s ADD-RS 2–3 [1,2]. TTE může přímo diagnostikovat AAD nálezem intimálniho flapu, malé intimální trhliny mohou být diagnostikovány použitím barevného dopplerovského mapování, kterým lze vizualizovat jety kolem intimálniho flapu. Dopplerovské metody mohou pomoci odlišit pravé lumen od falešného lumen. Možným zdrojem falešně pozitivních nálezů jsou lineární artefakty [11]. Senzitivita TTE pro diagnostiku AAD je 77–80 % a specificita se pohybuje od 93–96 %. Vyšší senzitivitu vykazuje TTE pro diagnostiku AAD typu A (78–100 %) oproti typu B (31–55 %). TTE má cenu taky v diagnostice závažných komplikací AAD, jako je aortální regurgitace, tamponáda srdce, perikardiální výpotek a infarkt myokardu (obr. 1) [2]. Ze suprasternálního přístupu lze TTE zobrazit oblouk aorty a větve, které z něj odstupují. Možno posoudit ev. přechod disekce na tyto větve a průtok krve přes jejich proximální části [25]. Výhodou TTE je jeho dobrá dostupnost a mobilita, díky kterým ho je možné použít i na oddělení urgentního příjmu v iniciálním vyšetření pacienta s bolestí na hrudi. Podle recentní studie Wanga et al u pacientů s ADD-RS ≥ 1 diameter ascendentní aorty > 40 mm dle TTE měl v diagnostice AAD typu A senzitivitu 84,6 %, specifitu 87,6 %, pozitivní prediktivní hodnotu (PPV) 76,7 % a negativní prediktivní hodnotu (NPV) 92,2 %. Oproti užití samotného ADD-RS tak výrazně stoupla specifita a PPV (ADD-RS ≥ 1 má specifitu 8,7 % a PPV 33,5 %) [26].
Obr. 1. Akutní aortální disekce typu A dle Standfordské klasifikace při vyšetření TTE 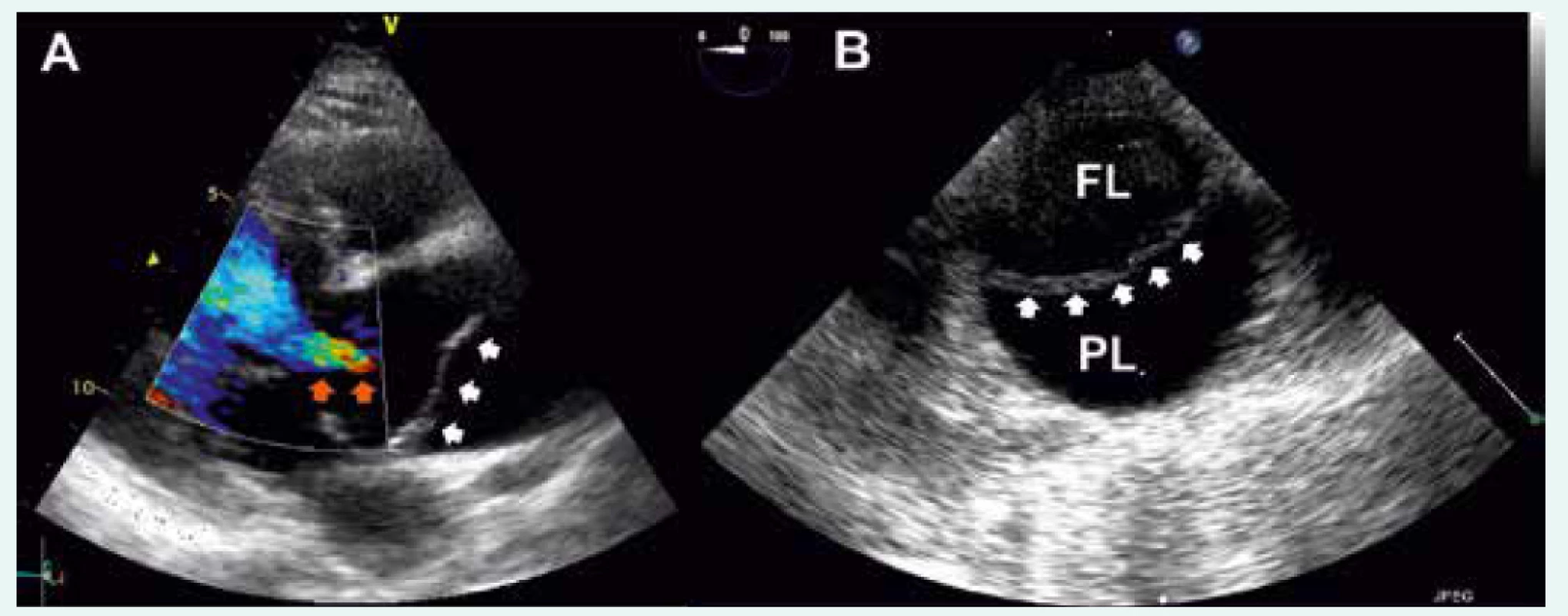
A – bílé šipky ukazují na intimální flap, oranžové šipky označují regurgitační jet při komplikující aortální insuficienci B – disekce descendentní aorty při vyšetření TEE, označeno více echogenní falešné lumen (FL) a méně echogenní pravé lumen (PL); bílé šipky ukazují na intimální flap U hemodynamicky nestabilních pacientů je bed-side ultrasonografie (Point Of Care Ultrasound – POCUS) vedle anamnézy (přímé anebo nepřímé) a fyzikálního vyšetření neocenitelnou metodou v rámci diferenciální diagnostiky příčiny hemodynamické nestability. Mezi nálezy u pacientů s AAD patří perikardiální výpotek (ev. se známkami tamponády), pleurální výpotek, tekutina intraperitoneálně a podobně jako při TTE dilatace kořene a ascendentní aorty nebo přímo průkaz intimálního flapu, pravého a falešného lumen. Rovněž můžeme posoudit stav volemie pacienta nebo přítomnost plicního edému (B linie při ultrasonografii plic).
Transezofageální echokardiografie (TEE) je dle ESC doporučena jako alternativa k CTAG u hemodynamicky nestabilních pacientů k definitivnímu potvrzení diagnózy, pokud po rychlém iniciálním bed-side vyšetření trvá suspekce na AAS. Dál je doporučena jako alternativní konfirmační zobrazovací metoda vedle CTAG a MRI u pacientů s ADD-RS 0–1 a podezřením na AAS na základě D-dimerů, skiagramu hrudníku nebo TTE a jako alternativa k CTAG u pacientů s ADD-RS 2–3 nebo typickými bolestmi na hrudi a nekonkluzivním nebo negativním TTE. Pro diagnostiku AAD je senzitivita TEE 99 %, specifita 89 %, PPV 89 % a NPV 99 % [1]. Spolehlivost TEE je tedy porovnatelná s CTAG a MRI. AAS limitované na oblast distální části ascendentní aorty mohou být přehlédnuté, nakolik tato oblast představuje „slepý bod“ pro TEE [11].
CT, resp. CTAG je nejčastěji používanou zobrazovací metodou první linie u pacientů s podezřením na AAS. Podle dat IRAD bylo CT iniciální zobrazovací metodou v letech 2010–2013 u 72,9 % pacientů s AAD typu A druhou nejčastěji využívanou metodou byla TEE, která byla použita u 23,1 % pacientů [27]. Výhodou CT je zobrazení anatomie celé aorty a jejich větví, rychlost akvizice záznamu, široká dostupnost a vysoká senzitivita (100 %) a specificita (98 %) [2]. Nevýhodou je nezanedbatelná radiační zátěž a při použití jodové kontrastní látky i riziko alergické reakce a nefrotoxicita. Častým zdrojem falešně pozitivních nálezů je pulzatilní artefakt. Použití EKG gatingu vede k minimalizaci rizika jeho vzniku. Při podezření na AAS by měl být pořízen CT záznam od kořene aorty po femorální tepny, a to nejprve bez kontrastní látky a následně s kontrastní látkou. Tímto postupem lze diagnostikovat kromě AAD i penetrující vřed aorty a intramurální hematom, který se projevuje na CT jako srpkovité nebo cirkulární ztluštění stěny aorty na > 5 mm a při vyšetření kontrastní látkou nelze identifikovat intimální flap nebo sytící se falešný lumen [2,11] (obr. 2). V současnosti lze využít 64detektorové CT s EKG gatingem k diferenciální diagnostice akutně vzniklých bolestí na hrudi na oddělení urgentního příjmu jako takzvaný triple rule-out test, kterým lze vyloučit AAD, plicní embolii a akutní koronární syndrom. Provedení CT, resp. CTAG je dle doporučených postupů ESC doporučeno ve stejných indikacích jako TEE. Úroveň a třída důkazů CT a TEE je u hemodynamicky nestabilních pacientů stejná (I C, definice úrovní a tříd doporučení uvádí tab. 4), v případě použití CT jako konfirmačního testu u hemodynamicky stabilních pacientů je ale oproti TEE CT doporučeno s vyšší třídou důkazů (I C pro CT a IIa C pro TEE) [1]. Dle našich zkušeností je vhodné u pacientů s AAD typu A spolu s CTAG provést i echokardiografické vyšetření, které doplňuje informaci o přítomnosti komplikací a jejich vlivu na hemodynamiku pacienta. Nález AAD typu A na CTAG je zachycen na obr. 3.
Tab. 4. Definice tříd doporučení a úrovně důkazů 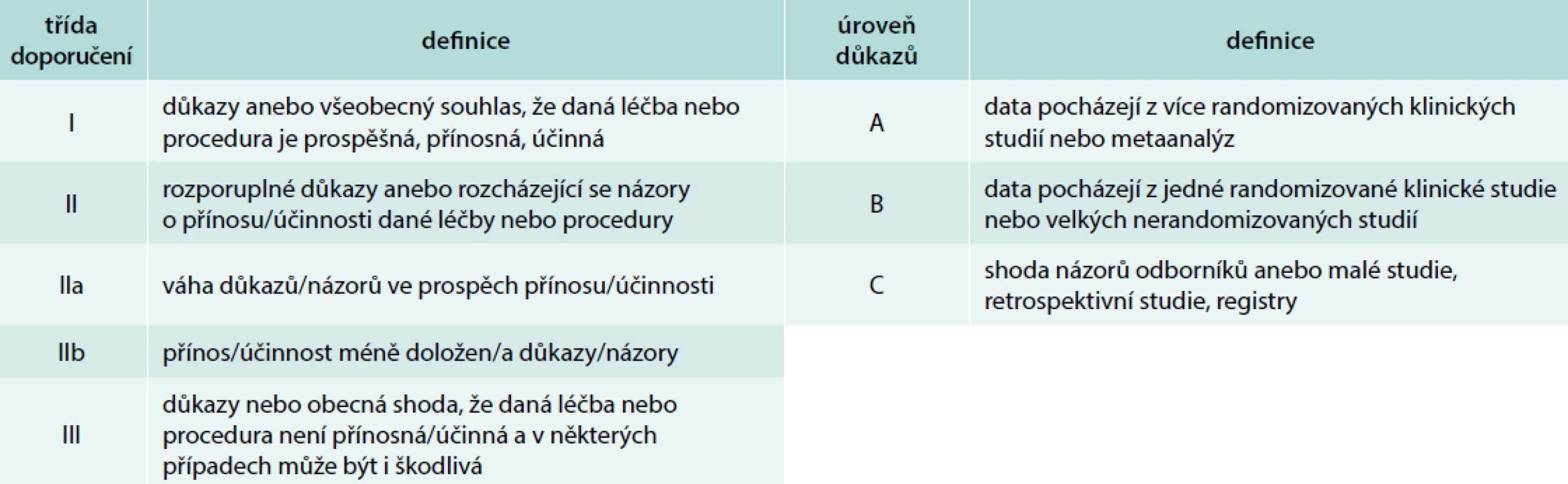
Obr. 2. Intramurální hematom (označen šipkami) při vyšetření CTAG 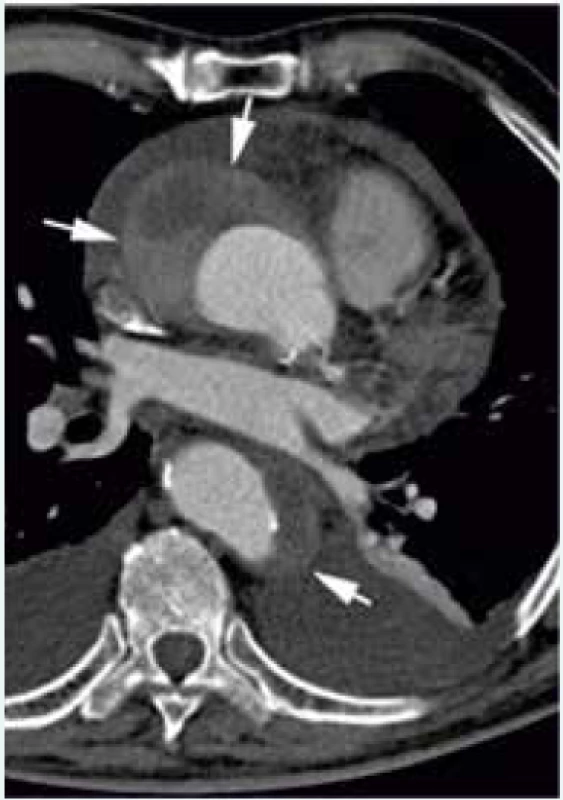
Obr. 3. Akutní aortální disekce typu A dle Stanfordské klasifikace při vyšetření CTAG s dobře patrným intimálním flapem 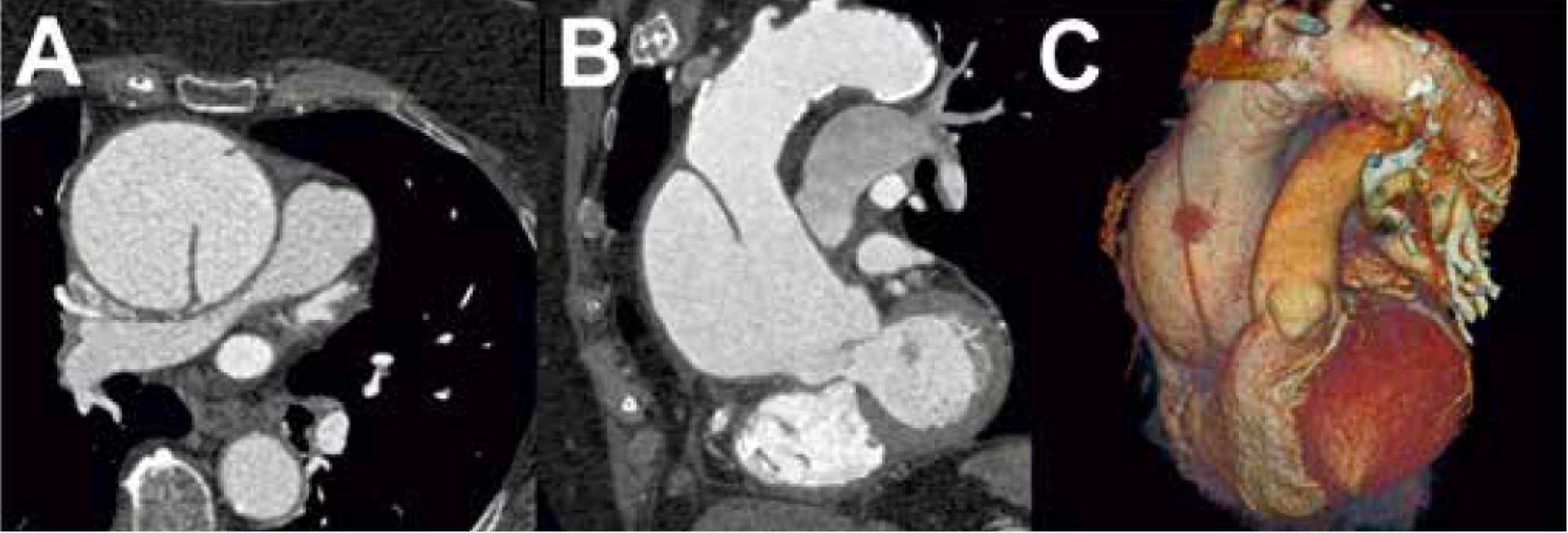
A – Axiální projekce B – frontální projekce C –3D rekonstrukce Magnetická rezonance poskytuje detailní informace o anatomii aorty a jejích větví. Senzitivita i specifita k diagnostice AAS je 98 % [4]. Výhodou je kromě dobrého prostorového rozlišení i absence ionizujíciho záření, menší nefrotoxicita kontrastní látky (gadolinia) v porovnání s jodovou kontrastní látkou používanou při CTAG a poskytnutí vedle statického obrazu i dynamického zobrazení anatomických struktur. To dovoluje získat informace o přítomnosti aortální insuficience, akutního koronárního syndromu nebo perikardiálního výpotku, které komplikují AAD typu A. Mapováním rychlosti fázového kontrastu můžeme kvantifikovat rychlost toku a např. určit závažnost aortální regurgitace nebo lépe odlišit falešné a pravé lumen [1,2]. V současnosti lze mapovat rychlost toku v 3 prostorových rovinách a současně zaznamenat 3D obraz anatomických struktur v rámci 4D PC-MRI (4-dimensional phase contrast MRI). Díky technologickému pokroku lze zkrátit čas vyšetření aorty na 8–12 min [28]. Uvedený čas akvizice záznamu, ke kterému je potřeba dál připočítat čas ke zpracování a vyhodnocení záznamu, je ale pořád příliš dlouhý pro potřeby emergentního vyšetření hemodynamicky nestabilních pacientů a je hlavní nevýhodou MRI v této indikaci. Mezi další nevýhody patří omezená dostupnost a kontraindikace: klaustrofobie, implantáty z feromagnetických látek a nekompatibilní elektronické implantáty jako např. některé trvalé kardiostimulátory nebo implantabilní kardioverter-defibrilátory. U pacientů s pokročilou renální dysfunkcí je při použití gadolinia signifikantní riziko systémové nefrogenní sklerózy [4]. Podle doporučení ESC je možné využití MRI jako konfirmační zobrazovací metody u hemodynamicky stabilních pacientů s nízkou předtestovou pravděpodobností (ADD-RS 0–1) a suspekcí na AAS na základě D-dimerů, TTE anebo skiagramu hrudníku. Úroveň a třída důkazů je I C [1,2]. Algoritmus postupu k vyloučení AAS u pacientů s akutní bolestí na hrudi je zachycen na schématu.
Schéma. Diagnostický algoritmus k vyloučení AAS při akutní bolesti na hrudi. Upraveno podle [1] ![Schéma. Diagnostický algoritmus k vyloučení AAS při akutní bolesti na hrudi. Upraveno podle [1]](https://pl-master.mdcdn.cz/media/image_pdf/65115edbb7880504635ccbf8090a8aac.png?version=1567619845)
AAS – akutní aortální syndrom AAD – akutní aortální disekce TTE – transtorakální echokardiografie TEE – transezofageální echokardiografie CTAG – CT aortografie MRI – magnetická rezonance Aortografie má v diagnostice v současnosti omezený význam. Je indikovaná u vysoce selektované skupiny pacientů, jako jsou např. pacienti s akutním koronárním syndromem, kteří vyžadují emergentní selektivní koronarografii a revaskularizaci. Další zobrazovací metody jako intravaskulární ultrasonografie (IVUS), PET/CT nebo PET/MR nemají v akutní diagnostice žádný význam [2].
Iniciální terapie na urgentním příjmu
Iniciální terapie se odvíjí od hemodynamické stability a vitálních funkcí pacienta. U hemodynamicky nestabilního pacienta je důležité co nejrychlejší zjištění příčiny hemodynamické nestability (anamnéza, fyzikální vyšetření, POCUS, TTE, TEE, CT aortografie). Další léčba se odvíjí od této příčiny. Při známkách hypovolemie je nutné zajištění dostatečného množství žilních (ev. intraoseálních) vstupů a rychlé doplňování volumu v emergentních případech krystaloidy. K udržení perfuzního tlaku se v případě potřeby přidávají vazopresory (noradrenalin). V případě, že nejsou známky hypovolemie, je pravděpodobnou příčinou hemodynamické nestability u pacienta s AAD její komplikace (tamponáda srdce vedoucí k obstrukčnímu šoku; těžká aortální regurgitace nebo akutní infarkt myokardu vedoucí ke kardiogennímu šoku) [29]. Ve všech případech po stanovení diagnózy musí být pacient co nejdříve směrován k emergentnímu chirurgickému výkonu.
U hemodynamicky stabilních pacientů by měla iniciální terapie vést ke snížení námahy cévní stěny a ke snížení rizika progrese nemoci a vzniku komplikací. Má 2 složky: analgezii a kontrolu tlaku krve a srdeční frekvence. Analgezie musí být dostatečně agresivní, aby bylo zabráněno nadměrné aktivaci sympatiku v důsledku bolesti. K analgezii jsou v této indikaci doporučena intravenózní opioidní analgetika. Ke kontrole tlaku krve a srdeční frekvence se jako lék první volby doporučují intravenózní betablokátory (metoprolol, labetalol a esmolol). V případě intolerance betablokátorů je alternativou použití non-dihydropyridinových blokátorů kalciových kanálů (verapamil) při respektování jejich kontraindikací. Evidenci k použití v této indikaci má i betablokátor propranolol a non-dihydropyridinový blokátor kalciových kanálů diltiazem, tato léčiva ale nejsou aktuálně v České republice dostupná v i.v. formě. K dosažení požadovaného tlaku krve je v případě potřeby možné přidání intravenózních vazodilatátorů (většinou nitroprusid sodný, případně jiná intravenózní antihypertenziva s krátkodobým účinkem) k výše uvedeným lékům [2,29]. Cílové hodnoty srdeční frekvence jsou pod 60 tepů za minutu a systolického tlaku krve mezi 100–120 mm Hg [1,2].
Uvedená iniciální terapie by neměla vést ke zdržení k poskytnutí definitivní terapie. Tou je v případě AAS typu A emergentní chirurgický zákrok. V případě nekomplikovaného AAS typu B je indikovaná medikamentózní terapie s následným opakovaným sledováním CT nebo MRI. U komplikovaného AAS typu B je podle ESC doporučena jako definitivní terapie endovaskulární léčba (TEVAR, úroveň a třída důkazů IIa C) nebo chirurgická léčba (úroveň a třída důkazů IIb C) [1,2]. Studie INSTEAD-XL srovnávala TEVAR s optimální medikamentózní terapií a optimální medikamentózní terapii samotnou u hemodynamicky stabilních pacientů s AAD typu B. Po 5 letech sledování byl TEVAR s optimální medikamentózní terapií asociován se signifikantně nižší aorta-specifickou mortalitou (6,9 vs 19,3 %, p = 0,04) a nižším rizikem progrese nemoci (27,0 vs 46,1 %, p = 0,04). Byl pozorován trend k nižší mortalitě z jakýchkoliv příčin (11,1 vs 19,3 %, p = 0,13). Jednou z limitací studie byl ale nízký počet zařazených pacientů [30]. Podle dat z IRAD stoupl od roku 1995 do roku 2013 počet pacientů řešených endovaskulárně ze 7,3 % na 30,9 % a recipročně klesl počet pacientů léčených pouze medikamentózně ze 75,4 % na 56,6 % [27].
Závěr
Symptomy AAS jsou často nespecifické, u mnohých pacientů s bolestí na hrudi se zprvu pomýšlí na jiné příčiny (jako např. infarkt myokardu nebo plicní embolie), což vede k oddálení správné diagnózy u onemocnění, u něhož se prognóza pacienta s časem rychle zhoršuje. Na druhé straně klinické projevy mohou být atypické, nemoc se nemusí projevovat bolestí, ale jinými symptomy jako např. synkopou nebo cévní mozkovou příhodou. Jako klasické trias, které by lékaře mělo upozornit na diagnózu, se popisuje bolest, pulzový deficit na periferních tepnách a rozšíření mediastina na RTG hrudníku. V posledních letech došlo k významným pokrokům v stratifikaci pravděpodobnosti onemocnění a diagnostice pacientů s akutně vzniklou bolestí na hrudi. Zavedení a validace ADD-RS nám umožnily rychlou stratifikaci pravděpodobnosti onemocnění u pacientů již na oddělení urgentního příjmu. Toto skóre našlo záhy oporu i v doporučených postupech odborných společností jako ACCF, AHA a ESC. Doporučené postupy ESC pro diagnostiku a léčbu onemocnění aorty z roku 2014, které byly doplněny v roku 2018, přinášejí algoritmus postupu u pacientů s akutně vzniklou bolestí na hrudi. ADD-RS je důležitou součástí tohoto algoritmu. Další pokrok v iniciální stratifikaci pravděpodobnosti AAD je kombinace ADD-RS s D-dimery nebo echokardiografickým změřením diametru ascendentní aorty. Bohužel, v současnosti chybí podobně jednoduchý a ověřený stratifikační systém pro jiné AAS. Význam v diagnostice AAS v budoucnosti mohou mít biomarkery, jako např. sST2, kalponin, tenascin C, ADAMTS1, ADAMTS4 a podobně jako při diagnostice jiných onemocnění i mikroRNA. Technologický pokrok přináší nové možnosti v diagnostice zobrazovacími vyšetřeními. Bed-side ultrasonografické vyšetření je již standardem v rychlé evaluaci hemodynamicky nestabilních pacientů. Zvyšuje se dostupnost echokardiografických a CT vyšetření. Moderní 64detektorové CT s EKG gatingem může vyloučit současně několik závažných příčin bolestí na hrudi. Neustále se zvyšuje dostupnost a zkracuje se čas akvizice záznamu při vyšetření MRI, které by v budoucnosti snad mohlo dovolit využívání této modality i jako emergentního vyšetření pacientů s vysokým rizikem AAS. Pokroky v konstrukci elektronických implantátů, jako jsou trvalé kardiostimulátory nebo implantabilní kardioverter-defibrilátory, zase umožňují kompatibilitu těchto přístrojů s MRI a dovolují použití MRI pro širší skupinu pacientů. Principy iniciálního managementu AAS se v poslední době příliš nezměnily. Významné pokroky ale nastávají v definitivní terapii, kde se u pacientů s AAD typu B stále víc uplatňuje endovaskulární terapie. I přes tyto optimistické zprávy zůstává diagnostika AAS na oddělení urgentního příjmu pro lékaře prvního kontaktu pořád výzvou.
Tato práce je podporována Programem rozvoje vědních oborů Univerzity Karlovy (Progres – projekt Q39) a Projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace (FN Plzeň, 00669806).
Doručeno do redakce 17. 10. 2018
Přijato po recenzi 2. 1. 2019
MUDr. Radka Volovárová
I. interní klinika LF UK a FN Plzeň
Zdroje
- Erbel R, Aboyans V, Boileau C et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(41): 2873–2926. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu281>.
- Bossone E, LaBounty TM, Eagle KA. Acute aortic syndromes: diagnosis and management, an update. Eur Heart J 2018; 39(9): 739–749d. Dostupné z DOI: <http:///dx.doi.org/10.1093/eurheartj/ehx319>.
- Howard DP, Banerjee A, Fairhead JF et al. Population-based study of incidence and outcome of acute aortic dissection and premorbid risk factor control: 10-year results from the Oxford Vascular Study. Circulation 2013; 127(20): 2031–2037. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.112.000483>.
- Gawinecka J, Schönrath F, von Eckardstein A. Acute aortic dissection: pathogenesis, risk factors and diagnosis. Swiss Med Wkly 2017; 147: w14489. Dostupné z DOI: <http://dx.doi.org/10.4414/smw.2017.14489>.
- Goldfinger JZ, Halperin JL, Marin ML et al. Thoracic aortic aneurysm and dissection. J Am Coll Cardiol 2014; 64(16): 1725–1739. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2014.08.025>.
- Hirst AE, Johns VJ, Kime SW. Dissecting aneurysm of the aorta: A review of 505 cases. Medicine 1958; 37(3): 217–279.Dostupné z DOI: <http://dx.doi.org/10.1097/00005792–195809000–00003>.
- Daily PO, Trueblood HW, Stinson EB et al. Management of acute aortic dissection. Ann Thorac Surg 1970; 10(3): 237–247. Dostupné z DOI: <http://dx.doi.org/10.1016/s0003–4975(10)65594–4>.
- Booher AM, Isselbachter EM, Nienaber CHA et al. The IRAD classification system for characterizing survival after aortic dissection. Am J Med 2013; 126(8): 730.e19–24. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2013.01.020>.
- Svensson LG, Labib SB, Eisenhauer AC et al. Intimal tear without hematoma. An important variant of aortic dissection that can elude current imaging techniques. Circulation 1999; 99(19): 1331–1336. Dostupné z DOI: <http://dx.doi.org/10.1161/01.cir.99.10.1331>.
- Ničovský J, Ondrášek J, Černý J et al. Chirurgická léčba aneuryzmatu aortálního kořene: srovnání Bentallovy operace a reimplantace aortální chlopně podle Davida. Vnitř Lék 2017; 63(10): 640–645.
- Hiratzka LF, Bakris GL, Beckman JA et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation 2010; 121(13): e266-e369. Dostupné z DOI: <http://dx.doi.org/10.1161/CIR.0b013e3181d4739e>.
- Rogers AM, Hermann LK, Booher AM et al. Sensitivity of the aortic dissection detection risk score, a novel guideline-based tool for identification of acute aortic dissection at initial presentation. Results from the International Registry of Acute Aortic Dissection. Circulation 2011; 123(20): 2213–2218. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.110.988568>.
- Levčík M, Kettner J, Jabor A et al. Využití stanovení plazmatických D-dimerů v diagnostice akutní disekce hrudní aorty. Cor et Vasa 2013; 55(6):e510-e514. Dostupné z DOI: <http://dx.doi.org/10.1016/j.crvasa.2013.04.009>.
- Li B, Huang B, Tian L et al. Admission D-dimer testing for differentiating acute aortic dissection from other causes of acute chest pain. Arch Med Sci 2017; 13(3): 591–596. Dostupné z DOI: <http://dx.doi.org/10.5114/aoms.2017.67280>.
- Marill KA. Serum D-dimer is a sensitive test for the detection of acute aortic dissection: A pooled meta-analysis. J Emerg Med 2008; 34(4): 367–376. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jemermed.2007.06.030>.
- Suzuki T, Distante A, Zizza A et al. Diagnosis of acute aortic dissection by D-dimer: The International Registry of Acute Aortic Dissection substudy on biomarkers (IRAD-Bio) experience. Circulation 2009; 119(20): 2702–2707. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.108.833004>.
- Nazerian P, Mueller CH, de Matos Soeiro A. Diagnostic accuracy of the aortic dissection detection risk score plus D-dimer for acute aortic syndromes: The ADvISED prospective multicenter study. Circulation 2018; 137(3): 250–258. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.117.029457>.
- Wang Y, Tan X, Gao H et al. Magnitude of soluble ST2 as a novel biomarker for acute aortic dissection. Circulation 2018; 137(3): 259–269. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.117.030469>.
- Li K, Wang Z, Hu Z et al. Assessing serum levels of ADAMTS1 and ADAMTS4 as new biomarkers for patients with type A acute aortic dissection. Med Sci Monit 2017; 23 : 3913–3922. Dostupné z DOI: <http://dx.doi.org/10.12659/msm.905092>.
- Suzuki T, Distante A, Zizza A at al. Preliminary experience with the smooth muscle troponin-like protein, calponin, as a novel biomarker for diagnosing acute aortic dissection. Eur Heart J 2008; 29(11): 1439–1445. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehn162.
- Giachino F, Loiacono M, Lucchiari M et al. Rule out of acute aortic dissection with plasma matrix metalloproteinase 8 in the emergency department. Critical Care 2013; 17(1): R33. Dostupné z DOI: <http://dx.doi.org/10.1186/cc12536>.
- Nozato T, Sato A, Hirose S et al. Preliminary study of serum tenascin-C levels as a diagnostic or prognostic biomarker of type B acute aortic dissection. Int J Cardiol 2013; 168(4): 4267–4269. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2013.04.211>.
- Wang L, Zhang S, Xu Z et al. The diagnostic value of microRNA-4787–5p and microRNA-4306 in patients with acute aortic dissection. Am J Transl Res 2017; 9(11): 5138–5149.
- Xu Z, Wang Q, Pan J et al. Characterization of serum miRNAs as molecular biomarkers for acute Stanford type A aortic dissection diagnosis. Sci Rep 2017; 7(1): 13659. Dostupné z DOI: <http://dx.doi.org/10.1038/s41598–017–13696–3>.
- Böhmeke T, Schmidt A. Aneuryzma aortae dissecans. In: Böhmeke T, Schmidt A (eds) Echokardiografie. 4th ed. Grada: Praha 2009 : 152–153. ISBN 9788024729763.
- Wang D, Wang Z, Wang J et al. Values of aortic dissection detection risk score combined with ascending aorta diameter > 40 mm for the early identification of type A acute aortic dissection. J Thorac Dis 2018; 10(3): 1815–1824. Dostupné z DOI: <http://dx.doi.org/10.21037/jtd.2018.02.42>.
- Pape LA, Awais M, Woznicki EM et al. Presentation, diagnosis, and outcomes of acute aortic dissection. 17-year trends from the International Registry of Acute Aortic Dissection. J Am Coll Cardiol 2015; 66(4): 350–358. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2015.05.029>.
- Stankovic Z, Allen BD, Garcia J et al. 4D flow imaging with MRI. Cardiovasc Diagn Ther 2014; 4(2): 173–192. Dostupné z DOI: <http://dx.doi.org/10.3978/j.issn.2223–3652.2014.01.02>.
- Vařejka P, Heller S. Onemocnění aorty. In: Táborský M, Kautzner J, Linhart A (eds) et al. Kardiologie. Mladá fronta: Praha 2018 : 784–795. ISBN 9788020449009.
- Nienaber CHA, Kische S, Rousseau H et al. Endovascular repair of type B aortic dissection long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Interv 2013; 6(4): 407–416. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCINTERVENTIONS.113.000463>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2019 Číslo 7-8- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Je to sepse, nebo není? A je presepsin tou správnou odpovědí? – editorial
- U nemocných s idiopatickými střevními záněty je potřeba vitaminu D vyšší: intervenční studie
- Pľúcna embólia: retrospektívny pohľad na známe ochorenie
- Stres v preventivní kardiologii
- Presepsin: co je nutné vědět pro korektní interpretaci
- Presepsin v diagnostice sepse
- Aortální disekce a jiné akutní aortální syndromy na urgentním příjmu
- Nehematogenní působení erytropoetinu
- Idiopatický střevní zánět a 1. typ autoimunitní formy pankreatitidy: kazuistika
- Diosmin – stále důležitá modalita v léčbě žilní nedostatečnosti
- Jiří Beneš. Antibiotika – systematika, vlastnosti, použití
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Presepsin v diagnostice sepse
- Aortální disekce a jiné akutní aortální syndromy na urgentním příjmu
- Pľúcna embólia: retrospektívny pohľad na známe ochorenie
- Diosmin – stále důležitá modalita v léčbě žilní nedostatečnosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



