-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vybrané akutní stavy v moderní onkologii
Oncologic emergencies
Oncologic emergencies and life-threatening cancer-related and treatment-related complications are the net effect of gradually increasing incidence of malignant diseases, improvement of therapeutic options and survival of oncologic patients. These complications are relatively specific for such population of patients and they are quite rare within the individuals without malignancy. Selected oncological emergencies are discussed in this review.
Keywords:
intensive care – malignancy – oncologic emergency
Autoři: Thomas Karvunidis 1,2; Martin Matějovič 1,2
Působiště autorů: Jednotka intenzivní péče I. interní kliniky LF UK a FN Plzeň 1; Biomedicínské centrum, LF UK Plzeň 2
Vyšlo v časopise: Vnitř Lék 2019; 65(6): 405-415
Kategorie: Přehledný referát
Souhrn
Spolu s rostoucí incidencí nádorových onemocnění, rozšiřujícími se možnostmi jejich léčby a zlepšením přežívání nemocných se stále častěji můžeme setkat s významnými a často až život ohrožujícími komplikacemi vlastních malignit i jejich léčby. Řada těchto komplikací je poměrně specifických a mimo populaci onkologických nemocných je jejich incidence vzácná. V tomto přehledovém článku jsou diskutovány vybrané akutní komplikace nádorových onemocnění.
Klíčová slova:
intenzivní péče – nádorová onemocnění – onkologické emergence
Úvod
Nádorová onemocnění jsou celosvětově druhou nejčastější příčinou úmrtí. Poslední dekáda přinesla významné pokroky v jejich diagnostice i léčbě. Dobá dostupnost a zpřesnění grafických vyšetření (CT, MR, PET/CT, PET/MR aj), identifikace nových nádorových biomarkerů a použití vysoce sofistikovaných metod k jejich detekci (molekulární genetika včetně microarrays, cytogenetika, průtoková cytometrie aj) jsou spolu s přirozeně narůstající incidencí a stárnoucí populací důvodem značného vzestupu počtu onkologických nemocných [1,2]. Je léčeno mnohem více jedinců než v minulých letech, více pacientů pokročilého věku a polymorbidních. Rovněž léčba je v mnoha případech agresivnější [3,4]. Pokroky v transplantologii (kostní dřeně, resp. kmenových buněk krvetvorby včetně haploidentických transplantací) také umožňují indikovat a použít tuto léčebnou modalitu u většího počtu nemocných. Vše uvedené vede k většímu počtu aktivně léčených nemocných a ke zlepšení krátkodobého i dlouhodobého přežití nemocných s malignitami [3,4], ale současně i k větší incidenci akutních komplikací samotných maligních chorob (cancer-related emergencies) i jejich léčby (treatment-related emergencies). Jejich základní přehled je uveden v tab. Komplikace alterující životně důležité funkce se vyskytují až u 5 % nemocných se solidními tumory a až u 15 % pacientů s hematologickými malignitami kdykoliv v průběhu jejich stonání [5,6].
Tab. 1. Přehled akutních stavů v onkologii 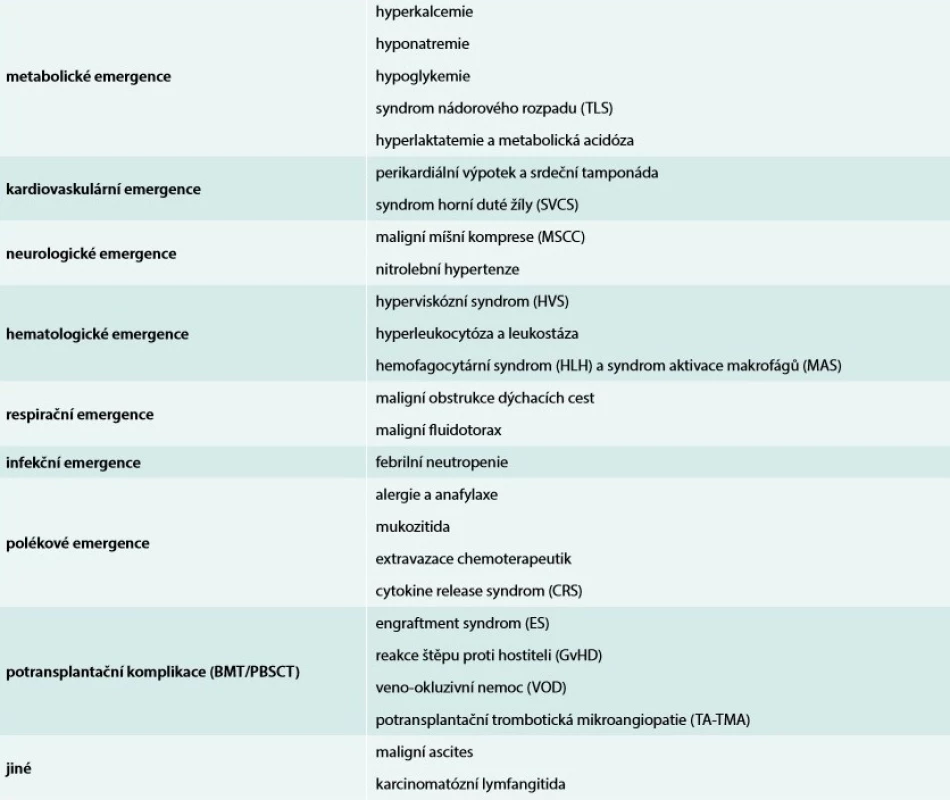
CRS – syndrom uvolnění cytokinů/Cytokine Release Syndrom ES – syndrom z přihojení/Engraftment Syndrom GvHD – reakce štěpu proti hostiteli/ Graft versus Host Disease HLH – hemofagocytární syndrom/Hemofagocytující LymfoHistiocytóza HVS – hyperviskózní syndrom MAS – syndrom aktivace makrofágů/Macrophage-Activation Syndrome MSCC – maligní míšní komprese/Metastatic Spinal Cord Compression SVCS – syndrom horní duté žíly/Superior Vena Cava Syndrome TA-TMA – potransplantační trombotická mikroangiopatie/Transplant-Associated Thrombotic Microangiopathy TLS – syndrom nádorového rozpadu/Tumor Lysis Syndrome VOD – veno-okluzivní nemoc/Veno Occlusive Disease Možnosti moderní intenzivní péče (IP) a měnící se náhled na přijímání a léčbu onkologických nemocných dávají v mnoha případech pacientům dobrou šanci na překonání níže diskutovaných akutních život ohrožujících stavů, aniž by byla negativně ovlivněna dlouhodobá prognóza jejich základního onemocnění [7].
Vybrané akutní stavy v onkologii
Akutní stavy v onkologii mohou souviset přímo s vlastní malignitou, mohou být důsledkem chemoterapie, imunoterapie či tzv. cílené léčby (targeted therapy) nebo být komplikacemi navazujícími na transplantaci kostní dřeně/kmenových buněk krvetvorby. Lze je rozdělit dle závažnosti na stavy bezprostředně život ohrožující (např. anafylaktický šok, obstrukce dýchacích cest, srdeční tamponáda apod) a akutní onkologické stavy (např. syndrom nádorového rozpadu, febrilní neutropenie apod). Lze je také kategorizovat dle postižených systémů, orgánů či tkání – metabolické, kardiovaskulární, neurologické, hematologické, infekční aj (tab).
Pojem akutní stavy v onkologii může samozřejmě zahrnovat jakékoliv významné zhoršení zdravotního stavu nemocných s malignitou z obdobných příčin jako v populaci nemocných bez nádorového stonání (akutní koronární syndromy, plicní embolie, infekční komplikace, cévní mozkové příhody, traumata atd). Tato problematika však není součástí tohoto sdělení.
Anafylaxe
Anafylaxe je akutní život ohrožující multisystémová hypersenzitivní reakce organizmu na přítomnost alergenu [8]. S rostoucím použitím speciální cílené biologické léčby, často ve formě nejrůznějších monoklonálních protilátek, riziko případné anafylaktické reakce narůstá, a to i přes nejrůznější užívanou profylaktickou premedikační léčbu (antihistaminika, kortikosteroidy).
Klinické projevy zahrnují nejčastěji toxoalergický exantém kůže a angioedém (až 90 % případů) a respirační symptomy se známkami obstrukce dýchacích cest (pískoty, chrapot), dušností, cyanózou a desaturací (až 70 % případů). Méně časté jsou příznaky gastrointestinální – abdominální bolest, průjem, zvracení (asi 35 % případů) [8,9]. Nejzávažnějším projevem anafylaktické reakce je hypotenze – anafylaktický šok. Tento stav je bezprostředním ohrožením života a není-li adekvátně léčen, ústí v krátkém časovém intervalu do zástavy oběhu. Anafylaxe se může vyskytnout kdykoliv v průběhu podání léčby, pravděpodobnější je při opakovaném podání léčiva.
Diagnostická kritéria zahrnují výše uvedené projevy v návaznosti na podání či ještě v průběhu expozice léčebnému přípravku.
Včasné rozpoznání anafylaxe a zahájení adekvátních terapeutických opatření (schéma) může účinně zabránit progresi do anafylaktického šoku. Prvním opatřením je zastavení podávání pravděpodobného vyvolávajícího agens (chemoterapie, imunoterapie, biologická léčba). V případě závažné reakce – otok v oblasti dutiny ústní včetně jazyka, krku či dýchacích cest spojený s jakýmkoliv dechovým diskomfortem anebo pokles krevního tlaku (systolický TK < 90 mm Hg či střední arteriální tlak < 65 mm Hg) – je lékem první volby adrenalin aplikovaný intramuskulárně v dávce 0,5 mg (případně 0,3 mg při použití autoinjektoru Epipen). Intravenózní podání je vyhrazeno pouze odborníkům s praxí v léčbě katecholaminy. Dávka adrenalinu může být v případě potřeby opakována po asi 5 min dle klinické odpovědi a stavu nemocného. Při podezření na těžkou anafylaktickou reakci, resp. anafylaktický šok, by měl být současně se zahájením popsané léčby neodkladně aktivován tzv. resuscitační tým (Medical Response/Emergency Team – MRT/MET), pečlivě sledovány vitální hodnoty a při známkách náhlé zástavy oběhu (porucha vědomí a abnormální dýchání) neodkladně zahájena kardiopulmonální resuscitace. Druhá linie léčby spočívá ve volumexpanzi (balancované krystaloidy), aplikaci antihistaminika (např. bisulepin 1 mg i.v.) a kortikosteroidu (hydrokortizon 200 mg i.m. či i.v. nebo ekvivalentní dávky jiného kortikoidu). Samozřejmostí je případné komplexní zajištění vitálních funkcí v prostředí IP dle klinického stavu a jeho vývoje.
Schéma. Algoritmus léčby těžké anafylaktické reakce a anafylaktického šoku. Upraveno podle [66] ![Schéma. Algoritmus léčby těžké anafylaktické reakce a anafylaktického šoku. Upraveno podle [66]](https://pl-master.mdcdn.cz/media/image_pdf/391c8b4cb86bcfb5fcdd2b496f889ffd.jpeg?version=1567327168)
Po prodělané anafylaktické reakci vyvstává otázka, jakou další léčebnou strategii pro daného nemocného zvolit. Pokud existuje alternativa se srovnatelným kurabilním potenciálem, je takový postup nejbezpečnější. Velmi často však biologická povaha malignity, její průběh a stav nemocného neumožňuje změnu protinádorové léčby, aniž by byla ovlivněna šance na kontrolu nádorového onemocnění (zvláště v případech cílené biologické terapie). V těchto případech lze zvážit pokračování v této terapii za adekvátních preventivních opatření – antihistaminikum, kortikosteroid, příp. malá dávka adrenalinu (0,1–0,3 mg i.m.), ev. pomalejší aplikace léčebného přípravku. To vše nejlépe v podmínkách intenzivní péče, za monitorace vitálních funkcí a dostupnosti veškerého vybavení a personálu k jejich bezprostřednímu zajištění při známkách recidivy anafylaxe.
Srdeční tamponáda
Až 34 % onkologických nemocných má postižení perikardu a perikardiální výpotek je v této populaci pacientů relativně častý. Přímou souvislost s malignitou má až 7 % všech akutních perikardiálních výpotků a zhruba v polovině případů se jedná o primomanifestaci nádorového onemocnění [10,11], nejčastěji karcinomů plic, prsu, melanomu a hematologických malignit – zvlášť vybraných typů akutních myeloidních leukemií (až 21 % nemocných) [12]. Primární neoplazie perikardu jsou extrémně vzácné a zahrnují např. mezoteliom [13].
Klinické projevy perikardiálního výpotku se odvíjejí od jeho objemu a zejména dynamiky rozvoje a progrese. Maloobjemový ale rychle vzniklý výpotek může být mnohem více symptomatický než chronický, pomalu progredující výpotek velkého objemu. Nejčastějším symptomem je námahová či klidová dušnost (až 80 %) a tachykardie. Může být přítomen pulsus paradoxus. Spolu se zvětšujícím se objemem výpotku v perikardiální dutině roste i perikardiální tlak a snižuje se žilní návrat a plnění pravostranných srdečních oddílů. Důsledkem může být až srdeční tamponáda s proměnlivě vyjádřenou klasickou (Beckovou) triádou: hypotenze, zvýšená náplň jugulárních žil a oslabení srdečních ozev [14]. EKG prokazuje sníženou voltáž a ev. i tzv. elektrický alternans. RTG plic pak dilataci srdečního stínu a zvětšení kardiotorakálního poměru (pouze při akumulaci > 200 ml). Všechny tyto příznaky a nálezy jsou nespecifické a málo senzitivní. Srdeční tamponáda by měla být vždy zvažována v případech relativně náhle vzniklé hemodynamické nestability (hypotenze, tachykardie), zvláště pokud není patrná jiná zjevná příčina a chybí adekvátní reakce na volumexpanzi anebo vazopresory. Je také jednou z reverzibilních příčin náhle zástavy oběhu. Diagnostickou metodou volby je echokardiografie (transtorakální echokardiografie – TTE). Umožňuje vizualizaci a kvantifikaci perikardiálního výpotku, zhodnocení kolapsibility (pravostranných) srdečních oddílů a kolísání transmitrálního průtoku. TTE má rovněž nezastupitelnou roli při navigaci a bezpečném provedení vlastní diagnostické punkce (perikardiocentéza) a terapeutické drenáže perikardu. V rámci diferenciální diagnostiky je nezbytné analýzou perikardiální tekutiny odlišit hemoperikard a infekční exsudativní perikarditidy od těch souvisejících s malignitami. Kromě běžných laboratorních metod mohou být nápomocny cytologické a flowcytometrické vyšetření výpotku.
TTE navigovaná punkce a drenáž jsou spolu s cílenou léčbou základního onemocnění klíčovými terapeutickými kroky. Maligní perikardiální výpotky recidivují až v 50 % případů [14]. Je tedy rozumné zavést a ponechat drenážní katétr v perikardu dle potřeby, průběžně výpotek derivovat a sledovat efekt systémové léčby. Není-li technicky možné provedení perkutánní punkční drenáže, je postupem volby drenáž chirurgická. Po drenáži (perkutánní či chirurgické) by měl být nemocný pečlivě monitorován, nejlépe v prostředí IP s dostupností prostředků k zajištění vitálních funkcí, nejméně 24–48 hod. Nejzávažnějšími komplikacemi těchto výkonů jsou krvácení či infekční komplikace. U chronicky recidivujících a významných perikardiálních výpotků lze zvážit provedení trvalé fenestrace/drenáže perikardiální dutiny chirurgickou cestou (chirurgická perikardiostomie) pomocí videoterakoskopie či ve formě perkutánní balonkové perikardiotomie. Intraperkardiální instilace chemoterapeutik nepřináší signifikantní benefit [15].
Syndrom horní duté žíly
Syndrom horní duté žíly (Superior Vena Cava Syndrome – SVCS) je nejčastěji způsoben extramurální kompresí SVC malignitou (až 60 %). Se stále častějším používáním implantabilních intravaskulárních zařízení (centrální žilní katétry, porty, permanentní katétry, kardiostimulátory aj) vzrůstá v posledních letech i incidence intraluminálních obstrukcí na podkladě trombóz (až 40 %) [16,17]. Vzhledem k protrombogennímu potenciálu maligních onemocnění lze trombotický SVCS v této populaci nemocných očekávat mnohem častěji než u pacientů bez nádoru. Plicní neoplazie jsou nejčastější příčnou SVCS (60–80 % případů). Z nich je to potom zejména nemalobuněčný karcinom plic (Non-Small-Cell Lung Carcinoma – NSCLC), ale jen díky jeho vyšší incidenci, neboť malobuněčný plicní karcinom (Small-Cell Lung Carcinoma – SCLC) je SVCS komplikován až v 10 % případů. NSCLC je asociován s SVCS pouze ve 2–4 % [18]. Druhým nejčastějším nádorovým onemocněním spojeným s SVCS jsou lymfomy, konkrétně non-Hodgkinovy lymfomy (až 10 % případů SVCS). Paradoxně Hodgkinovy lymfomy jsou příčinou SVCS pouze raritně, ačkoliv velmi frekventně postihují lymfatické uzliny mediastina.
Rozsah a rychlost vzniku obstrukce SVC určují klinické příznaky a urgentnost léčebné intervence. Pomaleji vznikající uzávěr vede k postupné dilataci žilních kolaterál (1–2 týdny). Plně vyjádřený SVCS je obvykle charakterizován otokem hlavy a krku, chemózou spojivek a často také klidovou dušností se stridorem a chrapotem při otoku laryngu a dysfagickými potížemi. Relativně častými příznaky jsou také otoky horních končetin a dilatace kožního kolaterálního žilního řečiště. Nejzávažnějšími, ale současně nejméně častými jsou neurologické projevy (projevy elevace nitrolebního tlaku): bolesti hlavy, porucha vědomí (kvalitativní i kvantitativní), cerebrální ischemie, mozkový edém, supratentoriální anebo infratentoriální herniace a smrt mozku. Prevencí těchto projevů je rozvinuté patentní kolaterální řečiště a popsané neurologické příznaky spíše budí podezření na nitrolební diseminaci malignity [17]. U onemocnění spojených se zesílením pleury můžeme někdy pozorovat rozvoj přemosťujících žilních spojek (systémovo-pulmonálních) vedoucích v důsledku až k významnému pravo-levému zkratu s hypoxemií [19].
Diagnostika SVCS je vzhledem k relativně typickým obtížím a klinickému průběhu snadná. Pro ucelený obraz rozsahu postižení a současnou diagnostiku primárního nádoru a jeho extenze je obvykle metodou volby výpočetní tomografie (Computed Tomography – CT), resp. CT venografie.
Léčba je založena primárně na redukci tumorózní masy cílenou chemoterapií či radioterapií, případně chirurgickou intervencí. Bezprostřední řešení vyžadují pacienti, u nichž se SVCS manifestuje dušností a stridorem při obstrukci centrálních dýchacích cest nebo laryngu otokem či u nemocných s poruchou vědomí při otoku mozku. Postupem volby je v tomto případě endovaskulární intervence – zavedení stentu a obvykle urgentní radioterapie. Případná trombotická okluze horní duté žíly není kontraindikací k endovenózní léčbě i těžkých forem SVCS. Stentáž SVC lze také použít u recidivujících obstrukcí jako paliativní léčbu a prevenci SVCS [20]. Podpůrná opatření zahrnují vše od elevace horní poloviny těla a oxygenoterapie, případně zajištění dýchacích cest intubací a umělou plicní ventilaci při jejich obstrukci otokem. Často doporučovaná kortikoterapie nemá přílišnou literární důkazní sílu s výjimkou lymfomů a tymomu [21]. Trombotické uzávěry SVC lze úspěšně léčit antikoagulační terapií a odstraněním intravaskulárních zařízení. Systémovou trombolýzu nelze u maligního onemocnění neznámého rozsahu (včetně případného intracerebrálního metastatického postižení) v první linii léčby doporučit pro riziko devastujícího a život ohrožujícího krvácení [16]. Trombolýzu (zejména lokální farmakologickou, případně mechanickou tromboektomii) však lze individuálně zvážit v případě rozsáhlých trombotických uzávěrů před vlastním endovaskulárním výkonem. Medián přežití nemocných s SVCS asociovaným s malignitou je zhruba 6 měsíců, i když přežití velké skupiny nemocných zvláště s lymfomy bývá i více než 2 roky [21,22].
Syndrom nádorového rozpadu
Akutní syndrom nádorového rozpadu (Tumor Lysis Syndrome – TLS) je potenciálně život ohrožující onkologická komplikace charakterizovaná metabolickými změnami plynoucími z rozpadu nádorových buněk a uvolněním intracelulárního obsahu do cirkulace [23]. Buněčný rozpad nastává spontánně díky velkému obratu buněk nádoru (rychle proliferující malignity, např. lymfomy a leukemie), nebo je důsledkem jakékoliv protinádorové léčby (chemoterapie, radioterapie, biologické léčby i tzv. cílené léčby). Metabolické změny zahrnují hyperkalemii, hyperfosfatemii, hypokalcemii a uvolnění velkého množství nukleových kyselin. Hyperkalemie je nejrizikovějším a nejzávažnějším projevem TLS, rozvíjí se přibližně 6–72 hod po zahájení chemoterapie a může být zvýrazněna současným poškozením funkce ledvin. Maligní buňky obsahují až 4krát více anorganického fosforu než buňky normální. Hyperfosfatemie se rozvíjí pomaleji, obvykle 24–48 hod po zahájení protinádorové léčby. Dochází k vazbě velkého množství ionizovaného kalcia na fosfát, sekundárně k hypokalcemii a případně i k akutnímu poškození ledvin (acute kidney injury – AKI) při krystalurii s obstrukční uropatií a nefrokalcinózou [24,25]. Hyperurikemie u TLS je důsledkem metabolizmu volných nukleových kyselin. Terminálním produktem je ve vodě velmi špatně solubilní kyselina močová. Urátové krystaly mohou precipitovat v renálních tubulech a také způsobit urátovou (obstrukční) nefropatii a současně i inflamatorní poškození glomerulů a tubulů (oxidativní stres). Tyto mechanizmy se spolupodílejí na rozvoji AKI při TLS [26].
Diagnostika TLS obvykle nečiní problém. Je založena na klinických souvislostech, nálezech a laboratorních vyšetřeních (např. Cairo-Bishop laboratorní kritéria TLS) [27]. Klinické symptomy obvykle plynou z metabolických abnormalit. Zahrnují nauzeu, zvracení, nechutenství, letargii, poruchy srdečního rytmu, křeče, tetanii, případně i náhlou smrt.
Pacienti s rychle proliferujícími tumory, extenzivní nádorovou masou (bulky disease), aktivně léčení, s poškozením ledvin, volumdeplecí a hyperurikemií jsou ve významném riziku rozvoje TLS. Zvláště AKI je významným nezávislým rizikovým faktorem mortality [28]. Nejlepší léčbou TLS je jeho prevence. Základními opatřeními jsou intenzivní hydratace (diuréza 3–4 ml/kg/hod), minimalizace nefrotoxických inzultů a profylaktická léčba alopurinolem. Alopurinol zabraňuje tvorbě kyseliny močové blokádou xantin oxidázy. Léčba je zpravidla zahajována 2–3 dny před aplikací chemoterapie či jiné protinádorové terapie. Doporučená dávka je 100 mg/m2 po 8 hod, do maximální denní dávky 800 mg. Indikaci často doporučované současné alkalizace moči nelze doporučit. Kumulující se xantin při léčbě alopurinolem a kalciumfosfátové komplexy jsou totiž v alkalickém prostředí moči málo rozpustné, precipitují v krystaly a rovněž způsobují tubulární lézi a poškození renálních funkcí [27,29]. Navíc prostředky používané k alkalizaci (bikarbonát sodný a acetazolamid) také samy o sobě mají své nežádoucí účinky (metabolická alkalóza, hypernatremie, retence tekutin aj). Rasburikáza, rekombinantní urátoxidáza, umožňuje účinnou konverzi kyseliny močové na ve vodě mnohem lépe rozpustný alantoin, který je dále dobře eliminován ledvinami [30]. Rasburikáza (Fasturtec) je vysoce efektivní v normalizaci hladiny urátu při profylaktickém i terapeutickém podání, řada studií dokumentuje signifikantně vyšší účinnost v porovnání s alopurinolem [31]. Je preferována, pokud jsou koncentrace kyseliny močové před onkologickou léčbou > 476 μmol/l. Opatření v léčbě hyperkalemie a hyperfosfatemie se neliší od těch obecných v nepřítomnosti TLS. Náhrada funkce ledvin (Renal Replacement Therapy – RRT) je indikována při TLS s AKI, nedostatečném efektu výše uvedené farmakoterapie a v případech život ohrožujících konzervativně neřešitelných iontových dysbalancí. Indikace intermitentní RRT (IRRT) či kontinuální RRT (CRRT) vychází z doprovodné klinické situace. Účinnost IRRT je v daném časovém intervalu větší. Možností je zahájit terapii IRRT (2–4 hod) a následně v případě potřeby přejít na CRRT.
Hyperkalcemie
Hyperkalcemie je jednou z nejčastějších komplikací malignit (Malignancy-Associated Hypercalcemia – MAH). Může se vyskytnout kdykoliv v průběhu nádorového onemocnění až u 30 % nemocných [32] a nejvyšší incidence dosahuje u nádorů prsu, ledvin, plic a mnohočetného myelomu [33].
Nejčastějším patofyziologickým mechanizmem MAH je sekrece PTHrP (ParaTHormon-related Peptide) nádorovými buňkami. Tento stav nazývaný také humorální hyperkalcemie malignit (HHM) je typickým příkladem paraneoplastického syndromu a způsobuje až 80 % všech hyperkalcemií u nádorových onemocnění, a to zejména u skvamózních karcinomů (plic, hlavy a krku), neoplazií ledvin, prsu, močového měchýře a ovariálních karcinomů. Bývá známkou pokročilého stadia onemocnění a nepříznivé prognózy [34]. PTHrP účinkuje obdobně jako parathormon (PTH) cestou vazby na PTH1 receptory v cílových tkáních: zvyšuje resorpci kalcia z kostí a jeho retenci v distálních tubulech ledvin. Vzhledem k strukturálním odlišnostem PTHrP a PTH však nedochází u HHM k významné stimulaci produkce 1,25-dihydroxivitaminu D (D3), a tedy zvýšené intestinální resorpci kalcia. Typickým laboratorním nálezem v případě HHM je kromě hyperkalcemie také snížená hladina PTH (zpětnovazebná suprese) a normální či snížená hladina kalcitriolu. Stanovení hladiny PTHrP může mít prognostický význam – PTHrP lze považovat za biomarker malignity (tumorózní marker), případně může predikovat terapeutickou odpověď na léčbu bisfosfonáty [35].
Kostní metastázy maligních onemocnění způsobují lokální osteolýzu parakrinním působením vybraných cytokinů (IL1, IL3, IL6, IL8, lokálně produkovaný PTHrP, Receptor Activator of Nuclear factor κ-B Ligand – RANKL, macrophage inflammatory protein 1a aj) stimulujících osteoklasty k resorpci kosti. Důsledkem je opět hyperkalcemie, zpětnovazebná suprese PTH, normální či snížená hladina kalcitriolu. Tato příčina MAH je přítomna u přibližně 20 % pacientů s nádorovým onemocněním – solidními tumory s kostními metastázami, mnohočetným myelomem a méně často i některými lymfomy a leukemiemi [36,37].
Excesivní produkce 1,25-dihydroxyvitaminu D (kalcitriol, D3) aktivovanými mononukleáry vedoucí k zvýšené intestinální resorpci kalcia je vzácnou příčinou MAH (< 1 %) [32]. Nesuprimovaná extrarenální produkce kalcitriolu je důvodem téměř všech hyperkalcemií u Hodgkinova lymfomu a až třetiny hyperkalcemií u non-Hodgkinových lymfomů [38,39].
Pouze raritně dochází k ektopické sekreci parathormonu (PTH) nádorovými buňkami. MAH způsobená tímto mechanizmem je popsána např. u ovariálních karcinomů, malobuněčného a skvamózního karcinomu plic, primitivních neuroektodermálních tumorů, papilárních karcinomů štítné žlázy, rabdomyosarkomu a karcinomu pankreatu [40]. V těchto případech je sérová hladina PTH zvýšená a primární malignita bývá zjištěna během diagnostiky domnělého adenomu příštítných tělísek.
Klinická manifestace hyperkalcemie je nespecifická a často zastřená příznaky a symptomy vlastního nádorového onemocnění. Může zahrnovat kvantitativní a kvalitativní poruchu vědomí (letargie, zmatenost, somnolence až kóma), obstipaci, hypovolemii či arytmie (EKG: prodloužení PR intervalu, rozšíření QRS, zkrácení QT intervalu, raménkové blokády, bradyarytmie při extrémní hyperkalcemii > 3,75 mmol/l). Příznaky hyperkalcemie jsou více vztaženy k dynamice vzestupu kalcemie a stavu volemie (hypovolemie) než k její absolutní hodnotě [17].
Diagnostické je stanovení hladiny ionizovaného kalcia (Cai > 1,29 mmol/l) a případně i PTH (iPTH). Hladinu celkového kalcia významně ovlivňuje vazba na bílkoviny (hladina albuminu, případně kalcium vázající paraprotein u mnohočetného myelomu) a divalentní anionty (fosfát) [41].
Základem léčby je kontrolovaná rehydratace/volumexpanze balancovaným krystaloidním roztokem neobsahujícím kalcium (!) s kontrolou diurézy (cíl 150–200 ml/hod). Již pouze toto opatření může vést k normalizaci kalcemie až u 30 % nemocných [17]. Také je nutné ukončení další/jiné léčby, která může přispívat k hyperkalcemii (thiazidová diuretika, lithium, kličková diuretika – volumdeplece, výživové doplňky s vysokým obsahem kalcia aj). U symptomatických hyperkalcemií současně aplikujeme (lososí) kalcitonin (iniciální dávka 4–8 IU/kg intranazálně, v případě pozitivní terapeutické odpovědi dále stejná dávka každých 6–12 hod) a současně bisfosfonát (zolendronát). Normalizace volemie a aplikace kalcitoninu vede obvykle ke snížení kalcemie během 12–48 hod. Následně se již uplatní efekt bisfosfonátů v léčbě a prevenci rekurence hyperkalcemie. Kalcitonin je léčbou bezpečnou a netoxickou, účinek nastupuje přibližně 4–6 hod po aplikaci a očekávaný ideální pokles kalcemie je o 0,3–0,5 mmol/l po jedné dávce. Vzhledem k rychlému rozvoji tachyfylaxe (downregulace receptorů) je efekt kalcitoninu časově limitován (48 hod). Problém je v současnosti jeho dostupnost v ČR. Bisfosfonáty inhibují kostní resorpci zprostředkovanou osteoklasty. Mezi dostupnými bisfosfonáty je za lék volby v současnosti považován zolendronát (kyselina zolendronová – ZA). Iniciální dávka ZA je 4 mg intravenózně; prevenci rekurence MAH (případně i primární prevence MAH) dosáhneme opakovaným podáním identické dávky po 3–4 týdnech. Efekt na normalizaci kalcemie lze již po první dávce očekávat u 85–90 % nemocných (v porovnání s asi 70 % při léčbě pamidronátem) [42]. Potenciálním a nejvyšším rizikem léčby bisfosfonáty je jejich nefrotoxicita. Jejich užití u nemocných s renální insuficiencí je možné (risk-benefit ratio). Při významném poškození funkce ledvin (Skrea > 400 μmol/l anebo Clkrea < 25–30 ml/min) je však již minimálně sporné, i když je dokumentováno jejich bezpečné užití i u hemodialyzovaných nemocných [43]. Dalším možným nežádoucím účinkem dlouhodobé léčby ZA je osteonekróza dolní čelisti, a to zvláště u pacientů s mnohočetným myelomem či metastatickým kostním postižením. U nemocných s lymfomy a extrarenální nádorovou nadprodukcí kalcitriolu (a chronickými granulomatózními chorobami – např. sarkoidóza) je indikovaná léčba glukokortikoidy – např. metylprednizolon (20–100 mg/den perorálně či intravenózně) nebo jiným kortikosteroidem v ekvivalentní dávce [17]. Efekt tohoto léčebného opatření nelze očekávat dříve než za několik dní – mechanizmem účinku je redukce tumorózní masy, a je tedy nezbytné současně užít obecná doporučení pro léčbu symptomatické hyperkalcemie popsaná výše. Tento postup může být navíc spojen s rizikem rozvoje syndromu nádorového rozpadu (viz výše). Těžkou symptomatickou MAH refrakterní k léčbě ZA či u nemocných s kontraindikací podání bisfosfonátů (pokročilá porucha funkce ledvin) lze ovlivnit podáním humánní monoklonální protilátky proti RANKL – denosumabu (Xgeva) [44]. Kalcimimetika (v současné době je dostupný pouze Cinacalcet) se mohou uplatnit v léčbě hyperkalcemie u pacientů s karcinomem příštítných tělísek a nadprodukcí PTH. Cinacalcet zvyšuje citlivost kalciových receptorů příštítných tělísek na extracelulární kalcium a zpětnovazebně tak inhibuje sekreci PTH.
Hemodialýza je léčbou volby u těžkých symptomatických MAH a současném postižení funkce ledvin anebo srdečním selháním, v těchto případech není ani kontrolovaná hydratace bezpečná. Současně lze zvážit užití hemodialýzy vždy u život ohrožující hyperkalcemie jako opatření s velmi dobrým a rychlým efektem [32]. Podmínkou je samozřejmě použití nízkokalciových, resp. bezkalciových dialyzačních roztoků.
Hyperviskózní syndrom
Hyperviskózní syndrom (HVS) je klinickým důsledkem zvýšené viskozity krve. Tato změna reologických vlastností je způsobena vysokým obsahem proteinů, obvykle imunoglobulinů. Nejčastější příčinou je Waldenströmova makroglobulinemie (až 85 %) a mnohočetný myelom (MM). HVS je však popisován i u MM s klonální produkcí pouze lehkých řetězců κ [45]. Zvýšená viskozita krve může být též následkem zvýšeného počtu buněčných elementů u hyperproliferativních onemocnění jakými jsou leukemie a některé myeloproliferativní syndromy (MPS; např. polycytemia vera – PV). Pokud je příčinou hyperviskozity zvýšení počtu leukocytů, nazýváme tento stav hyperleukocytózou. Je-li navíc i symptomatický, pak leukostázou [46,47].
Klasická triáda klinických příznaků HVS zahrnuje neurologické poškození, poruchy vizu a krvácení. Neurologické příznaky zahrnují bolesti hlavy, nystagmus, vertigo, ataxii, parestezie, křeče/epilepsii a kvalitativní i kvantitativní poruchu vědomí variabilní tíže. Poruchy vízu jsou zapříčiněny okluzemi retinálních cév. Vazba paraproteinů na povrch trombocytů vede k jejich dysfunkci a slizničnímu a kožnímu krvácení charakteru purpury. Dalšími méně častými projevy či důsledky HVS jsou kongestivní srdeční selhání/dysfunkce, akutní postižení plic (Acute Respiratory Distress Syndrome – ARDS), akutní tubulární nekróza s poruchou funkce ledvin, případně až multiorgánové selhání [45].
HVS je klinickou diagnózou postavenou na souboru příznaků s korespondujícími laboratorními výsledky a případnými nálezy z cílených zobrazovacích vyšetření. Paraproteinemie (a její klonalita) je snadno detekovatelná imunoelektroforézou séra. Častými doprovodnými abnormalitami jsou (pseudo)hyponatremie, hyperkalemie a hyperfosfatemie.
Plazmaferéza (PF; také Plasma EXchange – PEX) je nejrychlejší a nejúčinnější metoda k redukci viskozity plazmy. Zvláště v případě excesu IgM vede k rapidnímu poklesu hladiny paraproteinu, jelikož jsou multimery IgM lokalizované preferenčně intravaskulárně. IgA a IgG naopak vyžadují velkoobjemové (1,5násobku objemu krevní plazmy nemocného) a frekventní PF vzhledem k postupné redistribuci těchto Ig z extravaskulárního kompartmentu. PF by měla být opakována denně do ústupu klinických projevů HVS [48,49]. Při akutní nedostupnosti PF u významně symptomatických nemocných (orgánové poškození/selhání) lze jako dočasné opatření zvolit venepunkci (asi 500 ml krve) s náhradou objemu balancovaným krystaloidním roztokem. Tento postup lze použít i v případech myeloproliferativních onemocnění zejména PV s cílem udržet hematokrit < 45 % [50]. Nezbytnou součástí komplexní léčby HVS je samozřejmě terapie základního onemocnění, která vede ke snížení patologické produkce paraproteinu či klonální expanze krevních elementů (MPS, leukémie).
Hyperleukocytóza a leukostáza
Hyperleukocytózou označujeme laboratorní abnormalitu s počtem leukocytů > 50 × 109/l. Leukostáza je naléhavým stavem s extrémní leukocytózou a současnými známkami poruchy tkáňové perfuze a orgánového poškození (symptomatická hyperleukocytóza). Incidence hyperleukocytózy a leukostázy závisí na typu hematologické malignity. Obecně je leukostáza častější u leukemií s velkými blasty s malou deformabilitou. Incidence hyperleukocytózy u nemocných s akutní myeloidní leukemií (AML) je přibližně 10–20 %, nejvyšší je u myelomonocytární AML (FAB-M4), monocytární AML (FAB-M5) a mikrogranulární varianty akutní promyelocytární leukemie (APL; FAB-M3). Riziko leukostázy významně roste s počtem leukocytů > 100 × 109/l. U akutní lymfoblastické leukemie (ALL) nacházíme hyperleukocytózu až u 30 % nemocných, častěji dětí a jedinců do 20 let, mužů a T-lymfocytární ALL, ale leukostáza je vzácná. Pacienti s chronickou myeloidní leukemií (Chronic Myeloid Leukemia – CML) se typicky prezentují hyperleukocytózou s mediánem počtu leukocytů 100 × 109/l. Jedná se o polymorfonukleáry, metamyelocyty a myelocyty. Symptomy leukostázy jsou nejčastěji pozorovány u jedinců s blastickou krizí CML. Rovněž nemocní s chronickou lymfatickou leukemií (Chronic Lymphatic Leukemia – CLL) mají velmi často vysoký počet leukocytů, který je však tvořen malými lymfocyty, a tak je u nich leukostáza velmi raritní (alespoň do leukocytózy < 400 × 109/l) [47].
Patofyziologie leukostázy není zcela jasná. Porucha mikrocirkulace vedoucí ke tkáňové hypoperfuzi může být způsobena mechanicky okluzí hyperviskózní krví při přítomností excesivního počtu krevních elementů. Tento stav může dále zhoršit transfuze erytrocytů nebo diuretická léčba. Lokální tkáňová hypoxemie může být také způsobena či zhoršena vysokou metabolickou aktivitou blastů a parakrinními účinky některých jimi produkovaných cytokinů. Blasty mohou být také zodpovědné za přímé poškození tkání v důsledku jejich extravazální migrace [47,51].
Leukostáza může postihnout kterýkoliv orgán či tkáň. Hlavními klinickými příznaky a současně příčinami úmrtí bývá postižení plic (30 %) a CNS (40 %) [47]. Plicní postižení je charakterizováno dušností a hypoxemií s doprovodnými difuzními plicními infiltráty. Neurologické příznaky jsou identické s těmi, které byly popsány u HVS (viz výše). Přibližně 80 % nemocných s leukostázou je febrilních (> 39 °C) v důsledku inflamatorní reakce vyvolané endoteliální dysfunkcí nebo současně probíhající infekce. Málo časté jsou známky myokardiální ischemie, poškození ledvin, priapizmus, končetinové či viscerální ischemie [47].
Diagnóza leukostázy je empirická. Je na ni nutné myslet především u pacientů, u kterých je leukemie s hyperleukocytózou komplikována zejména rozvojem respiračních a neurologických symptomů, které jsou důsledkem tkáňové hypoxie. Za pozornost stojí fakt, že vystupňovaná metabolická aktivita excesivního množství blastů může vést k preanalytickému snížení parciálního tlaku kyslíku v arteriální krvi (paO2). Za této situace je přesnější metodou k hodnocení oxygenace pulzní oxymetrie. Poměrně často se také můžeme setkat s hyperlaktatemií, která (pomineme-li jiné časté příčiny) bývá způsobena preferencí anaerobní glykolýzy nádorovými buňkami/blasty (tzv. Warburgerův efekt) anebo deficitem thiaminu či riboflavinu [52,53]. Zhruba 40 % nemocných s hyperleukocytózou/leukostázou má známky diseminované intravaskulární koagulace (DIC) [47]. Až u 10 % těchto pacientů můžeme pozorovat i další laboratorní abnormality dané spontánním TLS [47], jak byly popsány výše. Můžeme se také setkat s pseudohyperkalemií v důsledku preanalytického (in vitro) uvolnění draslíku z blastů. Tomuto fenoménu lze předejít odběrem a analýzou heparinizované plazmy.
Leukostáza je život ohrožující komplikací vybraných hematologických malignit onemocnění. Mortalita neléčené leukostázy s orgánovým postižením je až 40 % v 1. týdnu a není zřejmě závislá na tíži hyperleukocytózy. Při koincidenci respiračního selhání a významného neurologického deficitu dosahuje smrtnost v 1. týdnu až 90 % [54]. Léčba tedy musí být neodkladná a agresivní. Jejím základem je tzv. cytoredukce. Ideálním prostředkem k dosažení snížení počtu leukocytů je cílená indukční chemoterapie (remisi-indukující chemoterapie). Jelikož je hyperleukocytóza a ev. leukostáza většinou primomanifestací do té doby nediagnostikované hematologické malignity, není v těchto situacích často známa detailní biologická povaha onemocnění, a nelze tedy zvolit adekvátní cílenou chemoterapii. V těchto případech lze k cytoredukci použít nespecifickou léčbu hydroxyureou. Hydroxyurea je antimetabolit selektivně inhibující ribonukleosiddifosfát reduktázu, a zabraňuje tak v průběhu buněčného cyklu konverzi ribonukleotidů na deoxyribonukleotidy. Role leukaferézy v léčbě hyperleukocytózy/leukostázy je na základě dostupných literárních dat kontroverzní. Rozhodnutí o jejím využití patří do rukou specializovaného pracoviště. Nemocní s hyperleukocytózou jsou ve významném riziku rozvoje akutního TLS. Spolu s cytoredukční léčbou je nezbytné zahájit i prevenci TLS (viz výše).
Engraftment syndrom
Engraftment syndrom (ES) je neinfekční vzácná komplikace vyskytující se po alogenní transplantaci kostní dřeně (BMT)/kmenových buněk krvetvorby (SCT) [55]. ES se obvykle rozvíjí 7–11 dní po BMT/SCT v období reparace krvetvorby, resp. granulopoézy [56]. Patofyziologie není dostatečně objasněna. Předpokládaným mechanizmem je nežádoucí cytokinová interakce (IL2, TNFα, INFγ, IL8, IL6, M-CSF a erytropoetin) vedoucí k endoteliální dysfunkci a významnému nárůstu kapilární permeabilty a sekvestraci neutrofilů v plicním řečišti [57]. Charakteristické jsou neinfekční febrilie, makulopapulózní kožní exantém, difuzní plicní postižení a orgánové dysfunkce [58]. Plicní postižení v rámci ES je označováno jako Peri-Engraftment Respiratory Distress Syndrome (PERDS). Je charakterizováno horečkou, hypoxemií, bilaterálními plicními infiltráty (opacity) a současnou absencí infekce, retence tekutin či kardiální dekompenzace. Přibližně třetina nemocných má současně otoky (zejména dependentních partií), (neinfekční) průjem anebo difuzní alveolární krvácení (DAH) [56,59]. Odhadovaná mortalita PERDS je přibližně 26 % [56,59].
Diagnóza PERDS je možná na základě přítomnosti popsaných (nespecifických) symptomů a nálezů a po vyloučení jiných etiologií, zejména infekční. Ve většině případů lze však předpokládat koincidenci zejména s infekčním postižením plic či se sekundárním ARDS při sepsi se zdrojem mimo respirační trakt/plíce. V rámci diferenciální diagnostiky lze při absenci kontraindikací (risk/benefit ratio) doporučit diagnostické bronchoskopické vyšetření s bronchoalveolární laváží (mikrobiologické vyšetření, FCM aj).
Terapie těžkého PERDS spočívá v aplikaci kortikosteroidu (např. metylprednizolon 1–2 mg/kg tělesné hmotnosti/den do rezoluce plicního postižení). Umělá plicní ventilace a další podpůrná léčba by měla respektovat současná doporučení [60].
Cytokine release syndrom
Syndrom uvolnění cytokinů (Cytokine Release Syndrome – CRS) je nejvýznamnější a potenciálně život ohrožující komplikací moderní cílené léčby (imunoterapie/targeted therapy) malignit. Tato unikátní léčba, ke které patří např. blinatumomab (bispecifická anti-CD3/CD19 protilátka, tzv. T-cell engager) či T-lymfocyty s chimerickým antigenním receptorem pro CD19 (Chimeric Antigen Receptor T-cells – CAR-TC) prokazuje velkou účinnost v léčbě relabujících či refrakterních ALL (kompletní remise ve 45–93 %) [61–63]. Incidence CRS variabilní tíže se při této léčbě pohybuje od 50 % (blinatumomab) do 100 % (CAR-TC) [64].
Aktivace T-lymfocytů navozená těmito prostředky může být velmi excesivní a vede k extenzivnímu uvolnění proinflamatorních cytokinů (INFγ, IL6, IL10 a sIL2R aj). Současně dochází k elevaci obecných markerů systémové inflamace (CRP, PCT, feritin). Klinické příznaky jsou obtížně odlišitelné především od sepse [64].
Léčba CRS se po podání blinatumomabu či CAR-TC kriticky odlišuje. Jelikož má blinatumomab velmi krátký biologický poločas (podání probíhá v kontinuální infuzi), lze jeho aplikaci již při prvních známkách CRS (zpravidla horečky) kdykoliv přerušit a zabránit tak plnému rozvoji CRS s šokem a orgánovým postižením. Po odeznění příznaků je možné v podání pokračovat. CAR-TC jsou speciálně připravovány pro každého unikátního nemocného a po jejich jednorázové aplikaci jsou schopny další klonální expanze in vivo až o několik řádů. Cena této léčby je astronomická. V cirkulaci mohou následně perzistovat měsíce až dokonce roky [65]. Tradiční postupy adjustace dávky při nežádoucích účincích nelze tedy použít. Navíc, snaha předcházet, mitigovat a léčit známky CRS významně limituje protinádorovou aktivitu CAR-TC [64]. Vzhledem k unikátnosti aplikované CAR-TC terapie je vždy nezbytné vyloučit jiné alternativy zmíněných klinických projevů – nejčastěji tedy infekční komplikaci, sepsi, septický šok. To však bývá ve většině případů vzhledem k identickým patofyziologickým mechanizmům nemožné. Na druhou stranu, CRS může být život ohrožujícím stavem, není tedy na místě se zahájením adekvátní léčby dlouho otálet. Ideální je ji zahájit ještě před rozvojem orgánového postižení. V případě CAR-TC asociovaného CRS je lékem volby tocilizumab, protilátka proti IL6 [64]. Tento postup umožňuje relativně zachovat efektivitu CAR-TC při současné kontrole symptomů CRS v porovnání s léčbou kortikosteroidy [64]. Kortikosteroidy (dexametazon) jsou pak lékem volby v prevenci a terapii CRS indukovaného blinatumomabem. U těžké, život ohrožující a kortikorezistentní formy lze zvážit aplikaci tocilizumabu [64].
Závěr
S rostoucí incidencí nádorových onemocnění je bezprostředně spojena zvyšující se prevalence akutních komplikací, z nichž mohou mnohé vést k významné deterioraci zdravotního stavu nemocných s potřebou intenzivní a resuscitační péče. Tyto stavy zahrnují jak běžné zdravotní komplikace, tak i situace specifické pro maligní onemocnění a jejich léčbu. Jejich znalost, pečlivé klinické sledování stavu a jeho vývoje, indikace a správná interpretace laboratorních vyšetření a výsledků zobrazovacích metod současně s včasným zahájením adekvátních preventivních a léčebných opatření má potenciál ve snížení morbidity a mortality této populace pacientů. Esenciální je také úzká spolupráce onkologů/hematoonkologů a intenzivistů.
Podpořeno: Programem rozvoje vědních oborů Univerzity Karlovy (PROGRES – projekt Q39), Projektem CZ.02.1.01/0.0/0.0/16_019/0000787, Centrum výzkumu infekčních onemocnění, udělený MŠMT, financovaný EFRR, Projektem institucionálního výzkumu MZČR – FNPl 00669806.
Doručeno do redakce 17. 7. 2018
Přijato po recenzi 28. 1. 2019
MUDr. Thomas Karvunidis, Ph.D.
I. interní klinika LF UK a FN Plzeň
Zdroje
- Ferlay J, Autier P, Boniol M et al. Estimates of the cancer incidence and mortality in Europe 2003. Ann Oncol 2007; 18(3): 581–592. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdl498>.
- Rodriguez-Abreu D, Bordoni A, Zucca E. Epidemiology of hematological malignancies. Ann Oncol 2007; 18: (Suppl 1): i3-i8. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdl443>.
- Coleman MP, Quaresma H, Berrino F et al. Cancer survival in five continents: a worldwide population-based study (CONCORD). Lancet Oncol 2008; 9(8): 730–56. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(08)70179–7>.
- Kinsey T, Jemal A, Liff J et al. Secular trends in mortality from common cancers in the United States by educational attainment, 1993–2001. J Natl Cancer Inst 2008; 100(14): 1003–1012. Dostupné z DOI: <http://dx.doi.org/10.1093/jnci/djn207>.
- Taccone FS, Artigas AA, Sprung CL et al. Characteristics and outcomes of cancer patients in European ICUs. Crit Care 2009; 13(1): R15. Dostupné z DOI: <http://dx.doi.org/10.1186/cc7713>.
- Puxty K, McLoone P, Quasim T et al. Risk of critical illness among patients with solid cancers: a population-based observational study. JAMA Oncol 2015; 1(8): 1078–1085. Dostupné z DOI: <http://dx.doi.org/10.1001/jamaoncol.2015.2855>.
- KarvunidisT, Lysák D, Matějovič M. Dospělý onkologický nemocný v intenzivní péči. Je již čas říci “ano, zvážíme to” než říkat “ne”?! Anest Intenziv Med 2017; 28(6): 346–353.
- Sampson HA, Munoz-Furlong A, Campbell RL et al. Second symposium on the definition and management of anaphylaxis: summary report – Second national institute of allergy and infectious disease/food allergy and anaphylaxis network symposium. J Allergy Clin Immunol 2006; 117(2): 391–397. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2005.12.1303>.
- Brown SG. Clinical features and severity grading of anaphylaxis. J Allergy Clin Immunol 2004; 114(2): 371–376. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2004.04.029>.
- McCurdy MT, Mitarai T, Perkins J. Oncologic emergencies, Part I: Spinal cord compression, superior vena cava syndrome, and pericardial effusion. Emerg Med Pract 2010; 12(2): 1–22.
- Imazio M, Demichelis B, Parrini I et al. Relation of acute pericardial disease to malignancy. Am J Cardiol 2005; 95(11): 1393–1394. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2005.01.094>.
- Sampat K, Rossi A, Garcia-Gutierrez V et al. Characteristics of pericardial effusions in patients with leukemia. Cancer 2002; 116(10): 2366–2371. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.24946>.
- Patel J, Sheppard MN. Primary malignant mesothelioma of the pericardium. Cardiovasc Pathol 2011; 20(2): 107–109. Dostupné z DOI: <http://dx.doi.org/10.1016/j.carpath.2010.01.005>.
- Karam N, Patel P, de Filippi C. Diagnosis and management of chronic pericardial effusions. Am J Med Sci 2001; 322(2): 79–87.
- Kunitoh H, Tamura T, Shibata T et al. A randomised trial of intrapericardial bleomycin for malignant pericardial effusion with lung cancer. Br J Cancer 2009; 100(3): 464–469. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.bjc.6604866>.
- Rice TW, Rodriguez RM, Light RW. The superior vena cava syndrome: Clinical characteristics and evolving etiology. Medicine (Baltimore) 2006; 85(1): 37–42. Dostupné z DOI: <http://dx.doi.org/10.1097/01.md.0000198474.99876.f0>.
- McCurdy MT, Shanholtz CB. Oncologic emergencies. Crit Care Med 2012; 40(7): 2212–2222. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e31824e1865>.
- Behl D, Hendrickson AW, Moynihan TJ. Oncologic emergencies. Crit Care Clin 2010; 26(1): 181–205. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ccc.2009.09.004>.
- Kim HC, Chung JW, Park SH et al. Systemic-to-pumonary venous shunt in superior vena cava obstruction: Depiction of computed tomography venography. Acta Radiol 2004; 45(3): 269–274.
- Marcy PY, Magné N, Bentolila F et al. Superior vena cava obstruction: Is stenting necessary? Support Care Cancer 2001; 9(2): 103–107.
- Wilson LD, Detterbeck FC, Yahalom J. Clinical practice. Superior vena cava syndrome with malignant causes. N Engl J Med 2007; 356(18): 1862–1869. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMcp067190>. Erratum in N Engl J Med 2008; 358(10): 1083.
- Yu JB, Wilson LD, Detterbeck FC. Superior vena cava syndrome – a proposed classification system and algorithm for management. J Thorac Oncol 2008; 3(8): 811–814. Dostupné z DOI: <http://dx.doi.org/10.1097/JTO.0b013e3181804791>.
- Cairo MS, Coiffier B, Reiter A et al. TLS expert panel: Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant disease: An expert TLS panel consensus. Br J Haematol 2010; 149(4): 578–586. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2010.08143.x>.
- Davidson MB, Thakkar S, Hix JK et al. Pathophysiology, clinical consequences, and treatment of tumor lysis syndrome. Am J Med 2004; 116(8): 546–554. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2003.09.045>.
- Desmeules S, Bergeron MJ, Isenring P. Acute phosphate nephropathy and renal failure. N Engl J Med 2003; 349(10): 1006–1007. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM200309043491020>.
- Lameire NH, Flombaum CD, Moreau D et al. Acute renal failure in cancer patients. Ann Med 2005; 37(1): 13–25.
- Coiffier B, AltmanA, Pui CH et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: an evidence-based review. J Clin Oncol 2008; 26(16): 2767. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2007.15.0177>. Erratum in J Clin Oncol. 2010; 28(4): 708.
- Darmon M, Guichard I, Vincent F et al. Prognostic significance of acute renal injury in acute tumor lysis syndrome. Leuk Lymphoma 2010; 51(2): 221–227. Dostupné z DOI: <http://dx.doi.org/10.3109/10428190903456959>.
- Cairo MS, Bishop M. Tumour lysis syndrome: New therapeutic strategies and classification. Br J Haematol 2004; 127(1): 3–11. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2141.2004.05094.x>.
- Coiffier B, Mounier N, Boloňa S et al. Groupe d’etude des lymphomes de l’adulte trial on rasburicase activity in adult lymphoma: Efficacy and safety of rasburicase (recombinant urate oxidase) for the prevention and treatment of hyperuricemia during induction chemotherapy of aggrssive non-Hodgkin’s lymphoma: results of the GRAAL1 study. J Clin Oncol 2003; 21(23): 4402–4406. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2003.04.115>.
- Goldman SC, Holcenberg JS, Finklestein JZ et al. A randomized comparison between rasburicase and allopurinol in children with lymphoma or leukemia at high risk for tumor lysis. Blood 2001; 97(100): 2998–3003. Dostupné z DOI: <http://dx.doi.org/10.1182/blood.v97.10.2998>.
- Stewart AF. Clinical practice. Hypercalcemia associated with cancer. N Engl J Med 2005; 352(4): 373–379. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMcp042806>.
- Gastanaga VM, Schwartzberg LS, Jain RK et al. Prevalence of hypecalcemia among cancer patients in the United States. Cancer Med 2016; 5(8): 2091–2100. Dostupné z DOI: <http://dx.doi.org/10.1002/cam4.749>.
- Pecherstorfer M, Schilling T, Blind E et al. Parathyroid hormone-related protein and life expectancy in hypercalcemic cancer patients. J Clin Endocrinol Metab 1994; 78(5): 1268–1270. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.78.5.8175989>.
- Gurney H, Grill V, Martin TJ. Parathyroid hormone-related protein and response to pamidronate in tumour-induced hypercalcaemia. Lancet 1993; 341(8861): 1611–1613. Dostupné z DOI: <http://dx.doi.org/10.1016/0140–6736(93)90756–7>.
- Horowitz MJ et al. Non-parathyroid hypercalcemia. In: Primer on the metabolic bone disease and disorders of mineral metabolism, 8th ed. Rosen CJ (ed), Bouillon R (ed) et al. Wiley-Blackwell Pub 2013 : 562. ISBN 978–1118453889.
- Terpos E, Christoulas D, Gavriatopoulou M. Biology and treatment of myeloma related bone disease. Metabolism 2018; 80 : 80–90. Dostupné z DOI: <http://dx.doi.org/10.1016/j.metabol.2017.11.012>.
- Seymour JF, Gagel RF. Calcitriol: the major humoral mediator of hypercalcemia in Hodgkin’s disease and non - Hodgkin’s lymphomas. Blood 1993; 82(5): 1383–1394.
- Roodman GD. Mechanisms of bone lesions in multiple myeloma and lymphoma. Cancer 1997; 80(8 Suppl): 1557–1563. Dostupné z DOI: <http://dx.doi.org/10.1002/(sici)1097–0142(19971015)80 : 8+<1557::aid-cncr5>3.3.co;2-k>.
- McCurdy MT, Mitarai T, Perkins J. Oncologic emergencies, Part II: Neutropenic fever, tumor lysis syndrome, and hypercalcemia of malignancy. Emerg Med Pract 2010; 12(3): 1–26.
- Slomp J, van der Voort PH, Gerritsen RT et al. Albumin-adjusted calcium is not suitable for diagnosis of hyper - or hypocalcemia in the critically ill. Crit Care Med 2003; 31(5): 1389–1393. Dostupné z DOI: <http://dx.doi.org/10.1097/01.CCM.0000063044.55669.3C>.
- Major P, Lortholary A, Hon J et al. Zolendronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: a pooled analysis of two randomized, controlled clinical trials. J Clin Oncol 2001; 19(2): 558–567. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2001.19.2.558>.
- Trimarchi H, Lombi F, Forrester M et al. Disodium pamidronate for treating severe hypercalcemia in a hemodialysis patient. Nat Clin Pract Nephrol 2006; 2(8): 459–463; quiz 464. Dostupné z DOI: <http://dx.doi.org/10.1038/ncpneph0248>.
- Lipton A, Stopeck A, Von Moos R et al. A meta-analysis of results from two randomized, double-blind studies of denosumab versus zolendronic acid for treatment of bone metastases. J Clin Oncol 2010; 28(15 Suppl): 9015. Dostupné z DOI: <http://dx.doi.org/10.1200/jco.2010.28.15_suppl.9015>.
- Lewis MA, Wahner-Hendrickson A, Moynihan TJ. Oncologic emergencies: pathophysiology, presentation, diagnosis, and treatment. CA Cancer J Clin 2011; 61(5): 287–314. Dostupné z DOI: <http://dx.doi.org/10.3322/caac.20124>.
- Mullen EC, Wang M. Recognizing hyperviscosity syndrome in patients with Waldenström macroglobulinemia. Clin J Oncol Nurs 2007; 11(1): 87–95. Dostupné z DOI: <http://dx.doi.org/10.1188/07.CJON.87–95>.
- Porcu P, Cripe LD, Ng EW et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma 2000; 39(1–2): 1–18. Dostupné z DOI: <http://dx.doi.org/10.3109/10428190009053534>.
- Leblond V, Kastritis E, Advani R et al. Treatment recommendations from the Eight international workshop on Waldenström’s macroglobulinemia. Blood 2016; 128(10): 1321–1328. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–04–711234>.
- Schwartz J, Padmanabhan A, Aqui N et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the writing committee of the American society for apheresis: the seventh special issue. J Clin Apher 2016; 31(3): 149–162. Dostupné z DOI: <http://dx.doi.org/10.1002/jca.21470>.
- Marchioli R, Finazzi G, Specchia G et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Engl J Med 2013; 368(1): 22–33. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1208500>.
- Stucki A, Rivier AS, Gikic M et al. Endothelial cell activation by myeloblasts: molecular mechanisms of leukostasis and leukemic cell dissemination. Blood 2001; 97(7): 2121–2129. Dostupné z DOI: <http://dx.doi.org/10.1182/blood.v97.7.2121>.
- Friedenberg AS, Brandoff DE, Schiffman FJ. Type B lactic acidosis as a severe metabolic complication in lymphoma and leukemia: a case series from a single institution and literature review. Medicine (Baltimore) 2007; 86(4): 225–232. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0b013e318125759a>.
- Dhuo S, Dadhich RK, Porporato PE et al. Multiple biological activities of lactic acid in cancer: influences on tumor growth, angiogenesis and metastasis. Curr Pharm Dis 2012; 18(10): 1319–1330.
- Porcu P, Danielson CF, Orazi A et al. Therapeutic leukapheresis in hyperleucocytic leukemias: lack of correlation between degree of cytoreduction and early mortality rate. Br J Haematol 1997; 98(2): 433–436.
- Franquet T, Müller NL, Lee KS et al. High-resolution CT and pathologic findings of noninfectious pulmonary complications after hematopoietic stem cell transplantation. AJR Am J Roentgenol 2005; 184(2): 629–637. Dostupné z DOI: <http://dx.doi.org/10.2214/ajr.184.2.01840629>.
- Capizzi SA, Kumar S, Huneke NE et al. Peri-engraftment respiratory distress syndrome during autologous hematopoietic stem cell transplantation. Bone Marrow Transplant 2001; 27(12): 1299–1303. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.bmt.1703075>.
- Spitzer TR. Engraftment syndrome: double-edged sword of hematopoietic cell transplantation. Bone Marrow Transplant 2015; 50(4): 469–475. Dostupné z DOI: <http://dx.doi.org/10.1038/bmt.2014.296>.
- Hong KT,Kang HJ, Kim NH et al. Peri-engraftment syndrome in allogeneis hematopoietic SCT. Bone Marrow Transplant 2013; 48(4): 523–528. Dostupné z DOI: <http://dx.doi.org/10.1038/bmt.2012.171>.
- Afessa B, Tefferi A, Litzow MR et al. Outcome of diffuse alveolar hemorrhage in hematopoietic stem cell transplant recipients. Am J Respir Crit Care Med 2002; 166(10): 1364–1368. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200208–792OC>.
- Fan E, Del Sorbo L, Goligher EC et al. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. Am J Resp Crit Care Med 2017; 195(9): 1253. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201703–0548ST>.
- Maude SL, Frey N, Shaw PA et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med 2014; 371(16): 1507–1517. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1407222>.
- Turtle CJ, Hanafi LA, Berger C et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. J Clin Investig 2016; 126(6): 2123–2138. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI85309>.
- Topp MS, Gokbuget N, Stein AS et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicenter, single-arm, phase 2 study. Lancet Oncol 2015; 16(1): 57–66. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(14)71170–2>.
- Frey NV, Porter DL. Cytokine release syndrome with novel therapeutics for acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program 2016; 2016(1): 567–572. Dostupné z DOI: <http://dx.doi.org/10.1182/asheducation-2016.1.567>.
- Maus MV, Grupp SA, Porter DL et al. Antibody-modified T cells: CARs take the front seat for hematologic malignancies. Blood 2014; 123(17): 2625–2635. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–11–492231>.
- Truhlář A, Černý V, Černá Pařízková R et al. Doporučené postupy pro resuscitaci ERC 2015: Souhrn doporučení. Urgent Med 2015; Suppl 2015.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2019 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Diagnostika akutních poruch acidobazické rovnováhy
- Vybrané akutní stavy v moderní onkologii
- Mimotělní eliminační metody v toxikologii: 1. část
- Mimotělní eliminační metody v toxikologii: 2. část
- Delirium v intenzivní péči
- Imitátory sepse
- Úloha paliativní medicíny u akutních stavů
- K životnímu jubileu prof. MUDr. Heleny Tlaskalové Hogenové, DrSc.
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika akutních poruch acidobazické rovnováhy
- Delirium v intenzivní péči
- Mimotělní eliminační metody v toxikologii: 1. část
- Vybrané akutní stavy v moderní onkologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



