-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
Radiofrequency catheter ablation of atrial fibrillation performed under general anesthesia: results of a unicentric randomized trial
Introduction:
Radiofrequency catheter ablation (RFA) has recently become a routine part of atrial fibrillation (AF) treatment. The goal of our study was to determine whether the implementation of RFA of AF under general anesthesia (GA), compared to analgosedation (AS), will affect important characteristics of the ablation procedure, comfort of the patient and whether there is any clinical impact on the complication rate and the overall success of the procedure.Methods:
50 patients with AF were randomized in a ratio of 1 : 1 into two groups for RFA in AS and in GA. Procedural characteristics, arrhythmia-free survival for the time of 12 months and subjective evaluation of pain tolerability of the procedure were monitored.Results:
Overall procedural times were comparable in GA and AS groups (111.2 ± 16.3 min vs 104.8 ± 25 min, p = NS). Time needed for preparation of patients was significantly longer in the GA group, while time needed for electrical disconnection of all pulmonary veins (PVs) was significantly shortened. Electrical isolation of the ipsilateral PVs after the last RF application was achieved in 94 % of lesions in GA and in 78 % of lesions in AS, respectively (p = 0.02). Shorter time of RF energy application to achieve electrical isolation of PVs was needed in the group of GA than in the group of AS (1 386 ± 387 s vs 1 745 ± 463 s, p = 0.005). Subjective discomfort evaluation of the procedure was more favorable in patients in the GA group. 88 % of patients in the GA group vs 68 % patients in AS (p = 0.1) had stable sinus rhythm off antiarrhythmic treatment during the 12 month period following the index procedure. While in the GA group all 3 patients with AF recurrence were willing to undergo another procedure in the GA, in the AS group only one patient out of 8 patients with AF recurrences underwent reablation.Conclusion:
RFA of AF performed under GA provided improved tolerance and positive perception of the procedure, higher final treatment success and improved quality of life.Key words:
general anesthesia – paroxysmal atrial fibrillation – pulmonary vein isolation – radiofrequency catheter ablation
Autoři: Klára Stašková 1; Alan Bulava 1,2,3; Richard Tesařík 1; František Toušek 1
Působiště autorů: Kardiologické oddělení Nemocnice České Budějovice, a. s. 1; Zdravotně sociální fakulta Jihočeské univerzity v Českých Budějovicích 2; I. interní klinika LF UP a FN Olomouc 3
Vyšlo v časopise: Vnitř Lék 2017; 63(3): 163-169
Kategorie: Původní práce
Souhrn
Úvod:
Radiofrekvenční katétrová ablace (RFA) je dnes rutinní součástí léčby fibrilace síní (FS). Cílem naší studie bylo zjistit, zda provádění RFA pro FS v celkové anestezii (CA) je ve srovnání s výkony prováděnými v analgosedaci (AS) schopno ovlivnit důležité charakteristiky ablačního výkonu, komfort pacienta a zda má klinický dopad na míru komplikací a úspěšnost výkonu.Metodika:
Celkem 50 pacientů s FS bylo randomizováno v poměru 1 : 1 do 2 skupin k RFA v AS, nebo k RFA v CA. Sledovány byly procedurální charakteristiky výkonu a přežívání bez recidiv arytmie po dobu 12 měsíců od výkonu. Pacienti také subjektivně hodnotili tolerabilitu a bolestivost výkonu.Výsledky:
Celkové časy výkonů byly mezi skupinami CA a AS srovnatelné (111,2 ± 16,3 min vs 104,8 ± 25,1 min, p = NS), ve skupině v CA byl signifikantně delší čas přípravy k výkonu a naproti tomu byl zkrácen čas potřebný k dosažení izolace všech plicních žil (PŽ). Elektrické izolace obou stejnostranných PŽ po poslední chybějící RF aplikaci bylo dosaženo u 94 % obkružujících lézí ve skupině CA, zatímco ve skupině AS u 78 % (p = 0,02). Ve skupině CA byl pro dosažení elektrické izolace oboustranných PŽ nutný signifikantně kratší čas trvání aplikace RF energie než ve skupině AS (1 386 ± 387 s vs 1 745 ± 463 s, p = 0,005). Subjektivní hodnocení diskomfortu a bolestivosti při výkonu bylo příznivější u pacientů v CA skupině. V období ročního sledování pacientů bez antiarytmické léčby byl na všech holterovských záznamech dokumentován stabilní sinusový rytmus (SR) u 88 % pacientů v CA skupině a u 68 % pacientů v AS skupině (p = 0,1). Všichni pacienti v CA skupině s recidivou arytmie (celkem 3 pacienti) byli ochotni absolvovat opakovaný výkon v CA, zatímco v AS skupině byl ochoten podstoupit reablační výkon pouze jeden pacient z celkem 8 pacientů s recidivou FS, ostatní dali přednost konzervativní terapii.Závěr:
RFA pro FS prováděná v CA přináší významné zlepšení tolerance a příznivého vnímání zákroku, vyšší výslednou úspěšnost léčby a tím i významné zvýšení kvality života pacientů podstupujících tyto zákroky.Klíčová slova:
celková anestezie – izolace plicních žil – paroxyzmální fibrilace síní – radiofrekvenční katétrová ablaceÚvod
Radiofrekvenční katétrové ablace (RFA) se staly dnes rutinní součástí léčby symptomatické fibrilace síní (FS), zejména u pacientů, u nichž selhala nebo není tolerována antiarytmická (AA) léčba [1]. U pacientů s paroxyzmální formou FS je základem nefarmakologické léčby izolace plicních žil (PŽ) [2,3]. U pacientů s perzistující nebo dlouhodobou perzistující formou arytmie je dosažení stabilního SR svízelné a léčebné ablační strategie se v jednotlivých ablačních centrech liší [4,5]. Častým důvodem selhání léčby je nekompletnost ablačních lézí, nejčastěji recidiva elektrického vedení do/z PŽ. Výkony prováděné pouze v analgosedaci (AS) přinášejí různou míru diskomfortu pro pacienta i pro operujícího lékaře. Pacienti, i přes podávané opiáty pociťují bolest, limitují potřebnou dobu či intenzitu aplikace RF energie a neklidným dýcháním zvyšují nestabilitu ablačního katétru. Každý větší pohyb pacienta na operačním stole navíc znamená ztrátu referenční polohy, a tím i 3D navigace. Tyto nevýhody mohou být překonány použitím celkové anestezie (CA). Naopak, výkon v CA přináší k ablačnímu zákroku aditivní riziko, které teoreticky nemusí být zanedbatelné [6–8].
V naší studii jsme zkoumali, zda je provádění RFA pro FS v CA schopno ovlivnit procedurální charakteristiky výkonu, komfort pro pacienta, stabilitu ablačního katétru při vytváření ablačních lézí a zda má klinický dopad na míru komplikací a úspěšnost výkonu.
Metodika
Pacienti s paroxyzmální FS byli obálkovou metodou randomizováni v poměru 1 : 1 do 2 skupin. Paroxyzmální typ FS byl definován dle současných doporučení [1]. Všichni pacienti podepsali informovaný souhlas se zařazením do studie, který byl schválen lokální etickou komisí. Den před výkonem pacienti podstoupili transezofageální echokardiografii (TEE) k vyloučení přítomnosti trombu v levé síni. Antikoagulační léčba warfarinem nebyla před výkonem vysazována, pouze bylo sníženo dávkování tak, aby INR bylo v den výkonu v rozmezí 2,0–2,5. Nová antikoagulancia (gatrany, xabany – souhrnně dále NOAK) byla vysazena den před výkonem.
U první skupiny (dále označovaná jako skupina CA) byl katétrový zákrok proveden v CA po orotracheální intubaci. Pacienti s kontraindikací provedení CA nebo vyžadující výkon v CA z jiné indikace byli ze studie vyřazeni. Pacienti byli standardně premedikováni kombinací famotidinu (Famosan) 20 mg p.o. a diazepamu (Diazepam) 5 mg p.o. 12 hod a 60 min před výkonem. CA byla uvozena dávkou indukčního intravenózně podaného anestetika (etomidat – Hypnomidate v dávce 0,12–0,15 mg/kg nebo propofol – Recofol 1% v dávce 0,15 mg/kg) v kombinaci s midazolamem (Dormicum) 1–2 mg i.v. a sufentynalem (Sufenta) 5–10 µg i.v. K zavedení orotracheální intubace bylo použito nedepolarizující myorelaxans atracurium (Tracrium) v dávce 0,4–0,6 mg/kg. Anestezie dále pokračovala bolusy sufentanylu, atrakuria a inhalačním anestetikem sevofluranem (Sevorane) 0,8–1,5 % bez oxidu dusného. Oběhová nestabilita během procedury byla korigována bolusy noradrenalinu (Noradrenalin) v dávce 0,01 mg i.v. nebo efedrinu (Ephedrin Biotika) 2,5–5 mg i.v. Během výkonu byli pacienti sledováni invazivní monitorací TK cestou a. radialis l. sin., po výkonu byli pacienti extubováni a monitorováni na lůžku intenzivní péče kardiologického oddělení.
U druhé skupiny pacientů (dále označovaná jako skupina AS) byl zákrok proveden v lokální anestezii Supracainem a po i.v. podané analgosedaci. Před zahájením podání lokální anestezie byl pacientům podán midazolam v dávce 1 mg i.v. a dávka byla dle potřeby během výkonu opakována do celkové dávky 3 mg i.v. Před zahájením aplikace RF energie byl pacientům podán fentanyl v dávce 100 µg i.v. a dle klinické potřeby byla tato dávka každých dalších 30 minut opakována. Následné dávky tohoto opioidního analgetika byly redukovány na polovinu u pacientů s hmotností < 70 kg a u pacientů, u nichž došlo po prvním podání fentanylu k významnému poklesu TK (sTK < 100 mm Hg) či k poklesu saturace O2 < 90 % přes podávanou oxygenoterapii nosními brýlemi nebo maskou.
Katétrová ablace
Všechny výkony byly prováděny za podpory kontinuální intrakardiální echokardiografie (ICE). Technika provádění široké antrální izolace PŽ byla obšírně popsána jinde [9]. Po kanylaci levé femorální žíly byl do pravé síně zaveden ICE katétr a dekapolární katétr do koronárního sinu (Dynamic XT, Boston Scientific, USA). Pravostrannou femorální žilou byly zavedeny 2 řiditelné transseptální (TS) sheathy (Agilis, St. Jude Medical, USA). Před provedením TS punkce byl podán i.v. heparin v dávce 100 j/kg. Kontinuální dávkování heparinu bylo po celou další dobu výkonu titrováno za pomoci opakovaných odběrů (à 15 min) tak, aby se cílový aktivovaný koagulační čas (ACT) pohyboval v rozmezí 300–350 s. Dvojitá TS punkce byla provedena za navigace ICE v rovině proti levostranným PŽ. Do jednoho TS sheatu byl zaveden dekapolární cirkulární mapovací katétr (PV 15–20 mm, APT, USA) a do druhého TS sheathu pak ablační katétr s 3,5 mm proplachovaným hrotem a schopností měřit sílu kontaktu s tkání (SmartTouch, Biosense Webster, USA). Elektroanatomické mapování levé síně (LS) bylo u všech pacientů provedeno za použití systému CARTO3 (Biosense Webster, USA) s obrazovou integrací CT anatomie levé síně, jež byla získána vyšetřením na multidetektorovém CT přístroji (Aquilion ONE, Toshiba) den před vlastním výkonem. RF energie byla titrována v rozmezí 30–35 W na stropě a na přední stěně LS s proplachem 20 ml/min. Na zadní stěně LS byla použita energie v rozmezí 20–25 W s proplachem 15 ml/min. Maximální teplota hrotu katétru byla limitována na 43 °C. Do každého ablačního bodu byla energie dodávána přesně po dobu 40 s, pokud to bylo klinicky tolerováno a nedocházelo k lokálnímu přehřívání tkáně v místě ablace dle vizualizace ICE. Pro zobrazování ablačních bodů na trojrozměrné elektroanatomické rekonstrukci LS byl použit modul VisitagTM (Biosense Webster, USA). Systém zobrazil ablační bod pouze v případě kumulativního splnění následujících kritérií: stabilita katétru s maximálními výchylkami nepřesahujícími 3 mm, kritérium stability splněno alespoň po dobu 4 s při minimální síle přítlaku katétru k endokardu převyšujícím 5 g po dobu převyšující 60 % času aplikace RF energie. Tyto vytvořené ablační body na cirkumferenci PŽ byly po dokončení jejich izolace manuálně spočítány. Nechtěná dislokace katétru o více než 5 mm z důvodů, které vznikly u pacienta, byla zaznamenána a vedla k přerušení dodávky RF energie a k další ablaci po renavigaci ablačního katétru na místo dislokace. U skupiny CA byla navíc po uvedení do celkové anestezie do jícnu transnazálně zavedena teplotní sonda (S-Cath, Circa Scientific, USA) a ablace byla přerušena při kritickém nárůstu teploty v jícnu nad 39 °C. Pokud nebylo možné provést lézi jinak, byl snížen výkon dodávané RF energie tak, aby teplota v jícnu nestoupala nad kritickou mez. Ve skupině AS nebyla sonda do jícnu zaváděna.
Cirkulární mapovací katétr (LassoTM, Biosense Webster, USA) byl nejprve umístěn do levé horní PŽ a poté byla provedena společná obkružující ablační léze kolem obou levostranných PŽ s cílovým momentem dosažení jejich současné izolace (tzv. entry blok), která byla navíc kontrolována postupným mapováním Lasso katétrem v obou PŽ. Pokud nedošlo při poslední RF aplikaci k současné izolaci obou levostranných PŽ, bylo provedeno mapování antra PŽ a další RF ablace v případném předpokládaném místě přetrvávajícího vedení. Pokud ani tato strategie nevedla k dokončení izolace, byla provedena spojující léze přes hranu mezi levou horní a levou dolní PŽ od jejího anteriorního aspektu posteriorním směrem. Podobná strategie byla užita při elektrické izolaci pravostranných PŽ. Na závěr výkonu byl podán protamin sulfát v dávce 3 000–5 000 jednotek i.v. a všechny sheathy a katétry byly extrahovány. Po přeložení na oddělení byl všem pacientům aplikován s.c. nízkomolekulární heparin v redukované dávce 0,008 ml/kg váhy a v případě absence lokálních komplikací bylo od večera téhož dne pokračováno v zavedené p.o. antikoagulační léčbě (warfarin nebo NOAK).
V každém ablačním místě byl kalkulován tzv. force-time integral (FTI), který odráží plochu pod křivkou síly přítlaku katétru na endokard v čase, a udává se v gramsekundách (gs). FTI byl stratifikován na pásma pod 350 gs, 350–399 gs, 400–449 gs, 450–499 a na ≥ 500 gs. Na linii tvořenou ablačními body kolem cirkumference stejnostranných plicních žil byl vždy spočten počet ablačních bodů v daném rozmezí FTI. Dále byl počítán počet nutných přerušení dodávky RF energie pro dislokaci > 5 mm vůči počátku RF aplikace. Byl zaznamenán počet úspěšných izolací PŽ po dokončení cirkulární léze poslední aplikací RF energie na designované linii kolem stejnostranných PŽ (tzv. izolace posledním ablačním bodem).
U každého pacienta byly dále zaznamenány základní klinické charakteristiky, předchozí antiarytmická léčba, velikost levé síně, celková doba trvání výkonu (Ttot) a doba od položení pacienta na operační stůl do prvního vpichu do femorální žíly (T1, tj. doba přípravy), doba od počátku vpichu do femorální žíly do 1. aplikace RF energie (T2, tj. doba zavádění katétrů a mapování LS), doba od 1. aplikace RF energie do poslední RF aplikace (T3, tj. doba potřebná k izolaci PŽ) a čas od poslední RF aplikace do přesunu pacienta a lůžko (T4, tj. doba nutná k ukončení výkonu). Dále byl počítán celkový počet RF aplikací, čas aplikace RF energie, skiaskopický čas a skiaskopická dávka (v mGy/cm-2).
Pacienti pokračovali v zavedené p.o. antikoagulační léčbě po dobu minimálně 12 měsíců po provedeném zákroku a za 3, 6 a 12 měsíců po provedeném výkonu byl jejich rytmus sledován za pomoci 7denního Holterova monitorování a v těchto intervalech byla také vždy provedena klinická kontrola se záznamem 12svodového EKG. Pokud pacienti užívali před ablací antiarytmika, byla jim tato léčba ponechána do první klinické kontroly, která byla plánována za 3 měsíce po zákroku. Dokumentace déle než 30 s trvající supraventrikulární arytmie (fibrilace síní nebo síňové tachykardie) během období sledování vyjma období prvních 3 měsíců od zákroku (tzv. blanking perioda) byla považována za selhání léčby. V případě udávaných palpitací a normálního záznamu na Holterově monitorování byli pacienti vybaveni epizodním záznamníkem a byli instruováni k nahrávce EKG v době potíží. Primárním sledovaným klinickým cílem bylo přežívání bez arytmie v celém období 12 měsíců po zákroku mimo blanking periodu bez užívání antiarytmik. V případě recidivy FS byli pacienti motivováni podstoupit druhý zákrok. Sekundárním cílem byla úspěšnost zákroku po zahrnutí reablací a AA léčby.
Pacienti dále za pomocí jednoduchého dotazníku v den bezprostředně následující po dni výkonu hodnotili míru nepříjemnosti zavádění permanentního močového katétru (PMK), provádění transezofageální echokardiografie (TEE) a vlastní RFA škálou bolestivosti od 0 do 100, podle níž 0 znamenala žádnou bolestivost a 100 nesnesitelnou, krutou bolest. Odpovídali také na otázku, zda by v případě recidivy arytmie byli ochotni výkon podstoupit ještě jednou v té podobě, v jaké jej podstoupili.
Statistická analýza
Spojité proměnné jsou prezentovány jako průměr ± směrodatná odchylka. Kategorické proměnné jsou prezentovány jako absolutní a relativní počty (v %). Pro porovnání skupin byly použity Studentův t-test, χ2 test a ev. Fisherův exaktní test adekvátně dle typu srovnávaných proměnných. Hodnota p < 0,05 byla považována za statisticky významnou.
Výsledky
Do studie bylo zařazeno celkem 50 pacientů (33 mužů, 17 žen) průměrného věku 59,8 ± 11,3 let. Klinické charakteristiky souboru jsou shrnuty v tab. 1. Mezi skupinami (CA vs AS) nebyl nalezen žádný signifikantní rozdíl s výjimkou počtu pacientů léčených pro hyperlipoproteinemii, kterých bylo významně více ve skupině CA.
Tab. 1. Základní klinické charakteristiky celého souboru a obou skupin pacientů 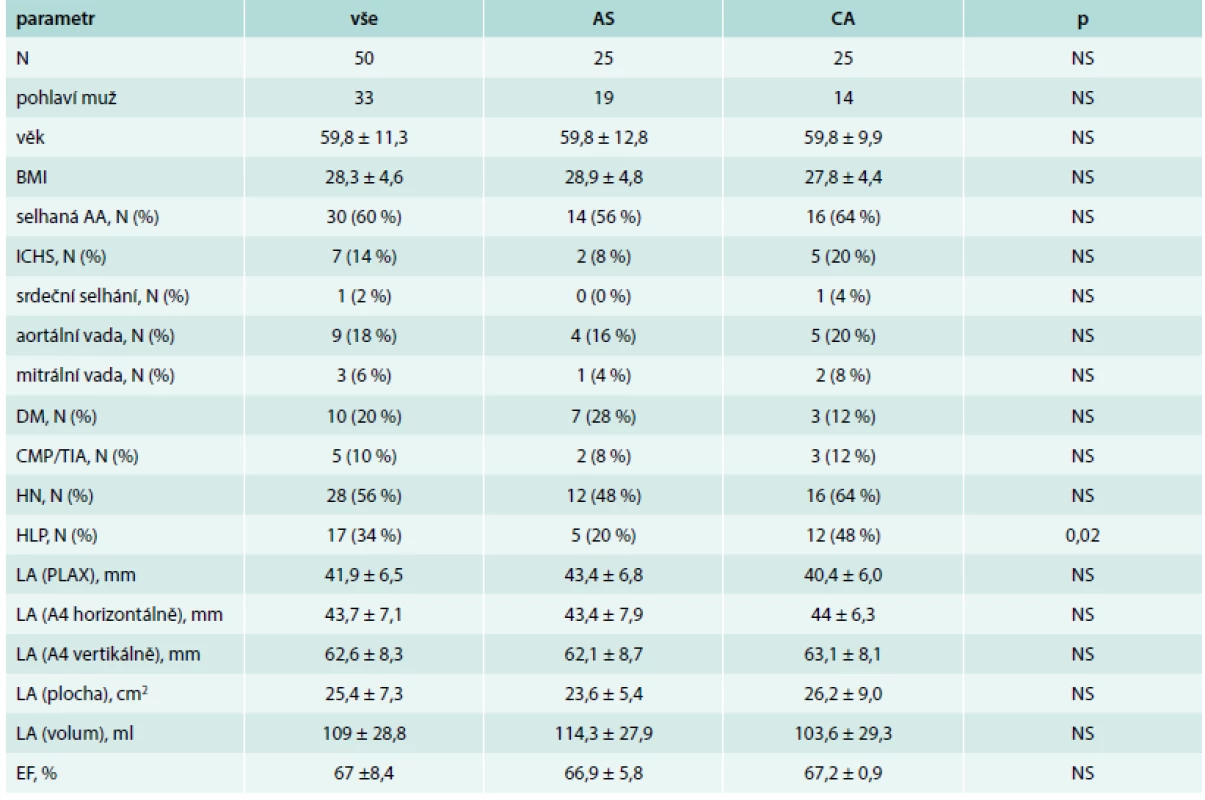
AA – antiarytmická terapie AS – analgosedace A4 – apikální čtyřdutinová projekce CA – celková anestezie CMP – cévní mozková příhoda DM – diabetes mellitus EF – ejekční frakce HLP – hyperlipidemie HN – hypertenze LA – levá srdeční síň PLAX – parasternální projekce na dlouhou osu TIA – tranzitorní ischemická příhoda Doba výkonu, procedurální úspěšnost a komplikace
Čas T1 pro přípravu pacienta byl signifikantně delší v CA skupině (19,2 ± 5,8 min vs 12,2 ± 6,5 min, p < 0,001). Naproti tomu čas T3 potřebný k dosažení izolace všech PŽ byl v CA skupině signifikantně kratší (36,4 ± 10,2 min vs 45,6 ± 16,1 min, p = 0,02). Celkové časy výkonů však byly v obou skupinách porovnatelné (tab. 2).
Tab. 2. Časové porovnání jednotlivých fází výkonu u pacientů podstupujících izolaci plicních žil v celkové anestezii (CA) nebo jen analgosedaci (AS) 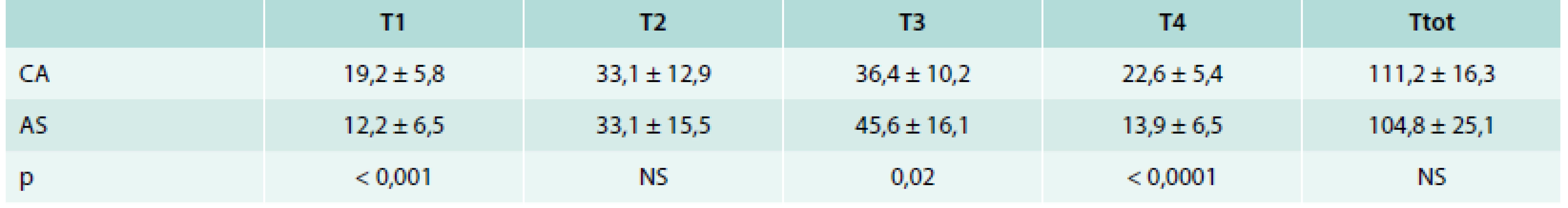
T1 – doba od položení pacienta na operační stůl do prvního vpichu do femorální žíly (tj. doba přípravy) T2 – doba od prvního vpichu jehlou do třísla do první aplikace RF energie (tj. doba zavádění katétrů a mapování levé síně) T3 – doba od první aplikace RF energie do poslední RF aplikace (tj. doba potřebná k izolaci plicních žil) T4 – doba od poslední RF aplikace do přesunu pacienta a lůžko (tj. doba potřebná k ukončení výkonu) Ttot – celková doba výkonu U pacientů v každé skupině bylo provedeno celkem 50 obkružujících lézí (25 kolem levostranných a 25 kolem pravostranných PŽ). Elektrické izolace obou stejnostranných PŽ bylo po poslední chybějící RF aplikaci na cirkumferenci kolem PŽ dosaženo u 39 (78 %) obkružujících lézí v AS skupině, zatímco v CA skupině toho bylo dosaženo u 47 (94 %) obkružujících lézí (p = 0,02). Celková doba aplikace RF energie byla v CA skupině výrazně kratší (1 386 ± 387 s vs 1 745 ± 463 s, p = 0,005) a v CA skupině byl také zaznamenán nižší počet dislokací katétru nad 5 mm z důvodů vzniklých u pacienta vynucujících si předčasné přerušení dodávky RF proudu (0,12 ± 0,33 vs 52 ± 1,92, p < 0,0001).
Pro vytvoření obkružující ablační linie jak kolem levostranných, tak i kolem pravostranných PŽ byl ve skupině CA pro dosažení elektrické izolace PŽ nutný signifikantně menší počet ablačních bodů než ve skupině AS (24,8 ± 6,4 bodů vs 33,9 ± 13,1 bodů, p = 0,003 pro levostranné PŽ a 26 ± 7,1 bodů vs 37,1 ± 12,8 bodů, p = 0,0004 pro pravostranné PŽ). Relativní počet ablačních bodů na obkružující ablační linii, které dosáhly FTI alespoň 350 gs, byl signifikantně vyšší v CA skupině: 46,8 ± 24,3 % vs 30,8 ± 17,3 %, p = 0,01 pro levostranné PŽ a 51,6 ± 20,3 % vs 35 ± 18,1 %, p = 0,004. Podobně byl relativní počet bodů na ablačních liniích s FTI < 350 gs vyšší ve skupině AS v porovnání se skupinou CA.
Celkový skiaskopický čas stejně jako skiaskopická dávka byly mezi skupinami porovnatelné (2,7 ± 1,9 min v CA skupině vs 2,9 ± 2,5 min v AS skupině, p = NS; 2 563 ± 1 524 mGy/cm-2 v CA skupině vs 2 595 ± 1 586 mGy/cm-2 v AS skupině, p = NS).
V CA skupině nebyla zaznamenána žádná celková závažná komplikace výkonu, pouze u jednoho pacienta došlo k vývoji AV píštěle v levém třísle, která byla zvládnuta konzervativně ultrazvukovou kompresí. V AS skupině došlo 1krát ke vzniku tamponády srdeční s nutností provedení perikardiocentézy. Příčina tamponády nebyla odhalena a výkon nebyl u tohoto pacienta dokončen. Drén byl odstraněn následující den bez dalších konsekvencí. V AS skupině došlo 1krát k významnému posunu mapy LS se ztrátou 3D navigace a nutností započít elektroanatomické mapování od počátku.
Délka hospitalizace byla v obou dvou skupinách srovnatelná (2,7 ± 0,8 dnů v CA skupině vs 2,8 ± 1,6 dnů v AS skupině, p = NS).
Hodnocení diskomfortu a bolestivosti
Hodnocení bolestivosti samotné katétrové ablace bylo příznivější u pacientů v CA skupině (2,8 ± 7,9 vs 39,8 ± 16,1, p < 0,0001). 23 (92 %) pacientů v CA skupině udávalo, že by v případě potřeby podstoupili výkon opakovaně, zatímco v AS skupině bylo takových pacientů pouze 17 (68 %, p = 0,033). Pacienti v CA skupině udávali jako nejnepříjemnější provedení TEE (n = 18, 72 %) následované zavedením permanentního močového katétru (n = 7, 28 %). Žádný z pacientů v CA skupině neudal vlastní katétrovou ablaci jako nepříjemnější než provedení TEE a zavedení PMK. 16 (64 %) pacientů v AS skupině udalo jako nejnepříjemnější samotnou RFA, 8 (32 %) pacientům pak nejvíce vadilo provedení TEE a jen jeden pacient (4 %) udal jako nejnepříjemnější zavedení PMK.
Klinická úspěšnost
V období blanking periody došlo k recidivě FS u 1 (4 %) pacienta v AS skupině a u 2 (8 %) pacientů v CA skupině. Během 12měsíčního sledování (s výjimkou blanking periody) byl bez antiarytmické léčby na všech 3 pořízených holterovských záznamech dokumentován stabilní SR bez recidivy arytmie u 22 pacientů v CA skupině (88 %) a u 17 pacientů v AS skupině (68 %), p = 0,1.
Všichni 3 pacienti v CA skupině byli ochotni absolvovat opakovaný výkon (opět v CA), během něhož byly buď reizolovány PŽ (u jednoho pacienta šlo o recidivu vedení do pravostranných PŽ) nebo byly cíleny extrapulmonální spouštěče arytmie (u jednoho pacienta to byla horní dutá žíla, jež byla během druhého výkonu elektricky izolována; u druhého pacienta šlo o spouštěč z oblasti mezisíňového septa a ústí koronárního sinu, spouštěč byl odstraněn fokální ablací). Všichni tito 3 pacienti byli během dalších 6 měsíců sledování bez recidivy arytmie. Z 8 pacientů s recidivou FS v AS skupině byl ochoten opakovaný výkon podstoupit jen jeden pacient (nutná reizolace jak levostranných, tak i pravostranných PŽ pro recidivu vedení), ostatní pacienti volili konzervativní postup. Pacient po reablaci měl v dalším 6měsíčním sledování normální SR bez recidivy arytmií. Všichni ostatní pacienti (n = 7) měli nadále recidivy arytmie. Úspěšnost po dobu 12měsíčního sledování po zahrnutí reablací tak byla 100 % ve skupině CA a jenom 72 % ve skupině AS (p = 0,004).
Diskuse
RFA pro FS je ve srovnání s antiarytmickou léčbou účinnější léčebnou strategií [10]. V léčbě záchvatovité formy FS je RFA účinnější než antiarytmická léčba a u selektovaných pacientů může být aplikována jako léčba první volby [1]. Vlastní RF aplikace jsou však na mnoha místech LS (zejména na její zadní stěně) bolestivé a pacienty jsou mnohdy i přes poměrně intenzivní analgetickou terapii špatně snášeny, nutí je k hlubokému dýchání či kašli. Výsledkem je předčasné přerušení dodávky RF energie, downtitrace RF energie, zvýšená nestabilita ablačního katétru, jeho opakované dislokace, což vše spolu vede k vytváření suboptimálních ablačních lézí s vysokým rizikem vzniku elektrické rekondukce PŽ. V extrémních případech musí být výkon z důvodu intolerance pacienta přerušen, což vede kromě nulového léčebného efektu i k ekonomickým ztrátám. Těmto problémům lze předejít použitím CA. Ta má však také své nežádoucí účinky (např. hyperpyrexie, potlačení laryngeálních reflexů a aspirace, bolest v hrdle, nauzea a zvracení apod). Nicméně v dnešní době moderních anestetik a anesteziologických přístrojů včetně poměrně intenzivní monitorace složení krevních plynů a vnitřního prostředí lze CA považovat samu o sobě za extrémně bezpečnou. Dalším rizikem použití CA je přehlédnutí rozvíjející se embolizační mozkové příhody a adekvátní reakce na ni. Toto riziko je však do jisté míry eliminováno použitím ICE v naší studii, protože tromby se tvoří jako první na zavedených katétrech a díky kontinuálnímu zobrazení ICE je možno na takovou situaci adekvátně reagovat (např. aspirací trombu, aplikací dalšího bolusu heparinu apod). V naší studii jsme v souvislosti s CA nezaznamenali ani jednu komplikaci. Důvodem použití jícnové teplotní sondy při výkonech prováděných v CA byly literární údaje o tom, že kapslová endoskopie jícnu po ablaci plicních žil prováděné v CA detekovala vyšší počet slizničních lézí ve srovnání s výkony prováděnými v AS [6]. Zaznamenaná tamponáda ve skupině AS je náhodnou výchylkou, která statisticky neodráží skutečný počet komplikací na pracovišti autorů: za posledních 10 let při provedení více než 2 500 komplexních výkonů pro FS byla tamponáda srdeční s nutností perikardiocentézy zaznamenána pouze 2krát, 3krát pak perikardiální výpotek nevyžadující z hemodynamického hlediska punkci.
Naše práce poprvé ukázala, že použití CA významně zkracuje vlastní proces elektrické izolace PŽ, zkracuje potřebnou dobu aplikace RF energie a počet jednotlivých RF aplikací na cirkumferenci PŽ. Dále jsme ukázali, že počet nutných přerušení dodávky RF energie pro dislokaci o > 5 mm je při použití CA významně nižší. Stejně tak při použití CA významně narůstá počet případů, v nichž posledním „pálením“ na cirkumferenci PŽ uzavírajícím kruh dojde k dokončení jejich elektrické izolace.
Di Biase et al [11] ve své randomizované práci ukázali, že použití CA je schopno zkrátit celkovou dobu výkonu – v jejich práci z 3,6 ± 1,1 hod na 2,4 ± 1,4 hod, což jsou však nesouměřitelné hodnoty v porovnání s našimi daty: zkušený elektrofyziolog z pracoviště autorky provádí tyto výkony bezpečně v časovém úseku nepřesahujícím 2 hod. To je jeden z důvodů, proč v naší práci provedení RFA v CA neprodloužilo signifikantně celkovou dobu výkonu, což z hlediska plynulosti práce na elektrofyziologickém sále považujeme za významné zjištění. Doby aplikace RF energie práce Di Biaseho et al neuvádí. Uvedeno je zkrácení skiaskopického času z průměrných 84 min na 53 min. Tyto výsledky jsou opět neporovnatelné s našimi zkušenostmi, v našem centru průměrný skiaskopický čas potřebný k izolaci PŽ nepřesahoval 3 min v žádné ze studovaných skupin pacientů. Použití jiných technologií pro léčbu paroxyzmální FS v CA, konkrétně kryoablace PŽ, vedlo k nárůstu času výkonu do té míry, že použití CA výkon signifikantně prodloužilo, protože doba pro vlastní izolaci PŽ nebyla při použití CA a kryoenergie zkrácena [12]. Z pohledu citované srovnatelně nízké klinické efektivity kryoablace (62 % vs 63 % přežívání bez recidivy arytmie) není použití CA u izolace PŽ za pomoci kryobalonu atraktivní.
V naši práci jsme neprokázali statisticky významný klinický rozdíl mezi úspěšností RFA prováděné v CA ve srovnání s AS. Nonsignifikance výsledku je dána zřejmě malým počtem pacientů v jednotlivých skupinách, lze tedy spekulovat, že při větším počtu pacientů by byl pozorovatelný minimálně trend, ne-li statisticky významný rozdíl ve prospěch výkonů prováděných v CA. Pokud však připočteme i „ochotu“ pacientů po zkušenosti s prvním výkonem podstoupit reablaci, pak v dalším sledování osudu těchto pacientů je rozdíl v klinické úspěšnosti léčby FS v CA významný – zatímco žádný z pacientů v CA skupině (tedy včetně reablací) neměl dokumentovány recidivy arytmie, ve skupině AS (včetně reablací a antiarytmické léčby) mělo recidivy FS 28 % pacientů, což byl rozdíl významný i na tak malém vzorku pacientů. Výsledky hovořící ve prospěch provádění RFA v CA dokumentují i další, byť nečetné, práce [11,13]. Práce používající kryoenergii tyto rozdíly nedetekovaly [12].
Recidivy FS po RFA jsou v drtivé většině případů spjaty s elektrickou rekonexí PŽ. Trvalé izolace PŽ lze dosáhnout jen adekvátní aplikací RF energie tak, že vytvořené léze jsou kontinuální a transmurální. Jednou z podmínek vytvoření takové léze za použití „point-by-point“ RF katétrové ablace je stabilita ablačního katétru během aplikace RF energie. Některé nerandomizované práce ukázaly, že užití CA vede k rychlejšímu snížení voltáže lokálního signálu a k větší stabilitě katétru [13]. Díky použití ablačního katétru s kontaktním senzorem jsme v naší práci poprvé ukázali, že relativní počet RF aplikací na cirkumferenci antra PŽ dosahujících předem definovaného integrálu tlakové síly v čase (FTI) je signifikantně vyšší, pokud je výkon prováděn v CA. Dostatečná hodnota FTI je prediktorem vytvoření dobré, tj. transmurální ablační léze [14].
Klinická tolerance výkonů v CA byla výborná. Zatímco žádný z pacientů operovaných v CA neudával vlastní RFA jako nejhorší část hospitalizace, ve skupině AS to byly téměř 2/3 pacientů. Většina pacientů (92 %), u nichž byl výkon proveden v CA, jej byla ochotna podstoupit ještě jednou, zatímco u výkonů prováděných v AS to bylo jen necelých 70 % pacientů. Pacienti, u nichž byl výkon proveden v AS, hodnotili RFA jako bolestivější než při provedení výkonu v CA. Data srovnávající kvalitu života či míru diskomfortu pacientů podstupujících RFA pro FS prováděnou v CA ve srovnání s AS dosud nebyla publikována. Jinou otázkou je cena výkonu, která je při použití CA navýšena o zhruba 6 000–7 000 Kč při délce trvání výkonu nepřesahující 2 hod (cena spotřebovaného zdravotnického materiálu a léčiv včetně mzdových nákladů na anesteziologa a asistující sestru). Tato cena však představuje zhruba 3 % ceny zúčtovatelného zdravotnického materiálu spotřebovaného při výkonu, což je z ekonomického hlediska nevýznamný podíl. Proti takovému navýšení je navíc zapotřebí postavit cenu výkonu, který nemůže být přes maximalizovanou analgosedaci zdárně dokončen (zhruba 1 ze 100 pacientů), a vyšší počet recidiv arytmie v následném období, které musí být řešeny buď antiarytmickou léčbou nebo reablací, což dále navyšuje zatížení rozpočtu. Zásadní překážkou, která brání rozšíření CA u těchto zákroků, však není navýšení ceny, ale nedostupnost anesteziologických týmů, které by byly každodenně k dispozici pro potřeby katetrizačních sálů.
Limitace studie
Náš soubor je poměrně malý a čítá pouze 50 pacientů. Jde však o pilotní projekt, jehož cílem bylo zhodnotit technickou proveditelnost RFA pro FS v CA a vliv takového přístupu na plynulost provozu elektrofyziologického sálu v jednom vysokoobjemovém ablačním centru, počty komplikací a klinický dopad pro pacienty. Subjektivně příznivý efekt provádění výkonů v CA u pacientů byl očekávatelný. Nicméně naše práce je první svého druhu, která jej hodnotila.
Závěr
Izolace PŽ prováděná v CA je celkovou délkou výkonu srovnatelná s výkony prováděnými pouze v AS. Ačkoliv CA přináší delší čas přípravy na operačním sále, samotná elektrická izolace PŽ je rychlejší, vyžaduje kratší celkovou dobu aplikace RF energie, méně ablačních bodů na cirkumferenci kolem PŽ a léze jsou vytvářeny s vyšší stabilitou ablačního katétru.
RFA pro FS prováděná v CA přináší významné zlepšení tolerance a pozitivního vnímání zákroku, po zahrnutí reablací i vyšší výslednou úspěšnost léčby, a tím i významné zvýšení kvality života pacientů podstupujících tyto zákroky. K definitivnímu potvrzení našich závěrů je zapotřebí provedení multicentrické randomizované studie.
MUDr. Klára Stašková
hajkok@seznam.cz
Kardiologické oddělení Nemocnice České Budějovice, a.s.
www.nemcb.cz
Doručeno do redakce 28. 12. 2016
Přijato po recenzi 20. 2. 2017
Zdroje
1. Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893–2962.
2. Haissaguerre M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339(10): 659–666.
3. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation: efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104(21): 2539–2544.
4. Kautzner J. Je potřeba léčit agresivně fibrilaci síní? Vnitř Lék 2015; 61(5): 417–420.
5. Bulava A, Mokracek A, Hanis J et al. Sequential hybrid procedure for persistent atrial fibrillation. J Am Heart Assoc 2015;4(3): e001754. Dostupné z DOI: <http://dx.doi.org/10.1161/JAHA.114.001754>.
6. Di Biase L, Saenz LC, Burkhardt DJ et al. Esophageal capsule endoscopy after radiofrequency catheter ablation for atrial fibrillation: documented higher risk of luminal esophageal damage with general anesthesia as compared with conscious sedation. Circ Arrhythm Electrophysiol 2009; 2(2): 108–112. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCEP.108.815266>.
7. Sophocles A, Chen L, Lin D et al. Postoperative amnesia in a patient undergoing general anesthesia for electro-physiologic (EP) catheter ablation of an irritable atrial focus. Transl Perioper Pain Med 2014; 1(2): 35–38.
8. Rössel T, Paul R, Richter T et al. Management of anesthesia in endovascular interventions. Anaesthesist 2016; 65(12)12 : 891–910.
9. Kanj MH, Wazni OM, Natale A. How to do circular mapping catheter-guided pulmonary vein antrum isolation: the Cleveland Clinic approach. Heart Rhythm 2006; 3(7): 866–869.
10. Eckardt L, Häusler KG, Ravens U et al. ESC guidelines on atrial fibrillation 2016: Summary of the most relevant recommendations and modifications. Herz 2016; 41(8): 677–683.
11. Di Biase L, Conti S, Mohanty P et al. General anesthesia reduces the prevalence of pulmonary vein reconnection during repeat ablation when compared with conscious sedation: results from a randomized study. Heart Rhythm 2011; 8(3): 368–372. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hrthm.2010.10.043>.
12. Wasserlauf J, Knight BP, Li Z et al. Moderate Sedation Reduces Lab Time Compared to General Anesthesia during Cryoballoon Ablation for AF Without Compromising Safety or Long-Term Efficacy. Pacing Clin Electrophysiol 2016; 39(12): 1359–1365. Dostupné z DOI: <http://dx.doi.org/10.1111/pace.12961>.
13. Malcolme-Lawes LC, Lim PB, Koa-Wing M et al. Robotic assistance and general anaesthesia improve catheter stability and increase signal attenuation during atrial fibrillation ablation. Europace 2013; 15(1): 41–47. Dostupné z DOI: <http://dx.doi.org/10.1093/europace/eus244>.
14. Reddy VY, Shah D, Kautzner J et al. The relationship between contact force and clinical outcome during radiofrequency catheter ablation of atrial fibrillation in the TOCCATA study. Heart Rhythm 2012; 9(11): 1789–1795. Dostupné z DOI: <http://dx.doi.org/10.1016/j.hrthm.2012.07.016>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- CT kolografie v klinické praxi – editorial
- Kardio-onkologie, onko-kardiologie – editorial
- Publikační soutěž 2017
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
- Přínos CT kolografie v klinické praxi
- Diabetes mellitus 2. typu a chronická obličková choroba
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část I - Kardiovaskulární komplikace nádorů a jejich léčby
- Komentár k aktuálnym odporúčaniam v liečbe diabetu 2. typu
- Prof. MUDr. Pavel Klener, DrSc. se v dubnu roku 2017 dožívá 80 let
- Dopis redakci Vnitřního lékařství – reakce na článek Predátorské časopisy: praktiky jejich vydavatelů a jak se jim bránit
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Přínos CT kolografie v klinické praxi
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



