-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část I
The role of cardiovascular magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Part I
Hypertrophic cardiomyopathy is the most common genetic cardiomyopathy in our population. The diagnosis of this disease is based on imaging methods, mainly echocardiography. Cardiac magnetic resonance offers more accurate and detailed information about the disease than echocardiography. Development of this method has become a standard part of the diagnostic algorithm. In the first part of review, the authors analyze the potential and significance of cardiac magnetic resonance in the diagnosis of hypertrophic cardiomyopathy.
Key words:
cardiac magnetic resonance – fibrosis – hypertrophic cardiomyopathy
Autoři: Martin Pleva 1,2; Júlia Borová 1; Ilona Plevová 3; Jaroslav Januška 1; Margita Belicová 4
Působiště autorů: Komplexní kardiovaskulární centrum Nemocnice Podlesí a. s., Třinec 1; Vaskulární centrum Vítkovické nemocnice, a. s., Ostrava 2; Ústav ošetřovatelství a porodní asistence LF OU, Ostrava 3; I. interná klinika JLF UK a UNM, Martin, Slovenská republika 4
Vyšlo v časopise: Vnitř Lék 2017; 63(3): 194-198
Kategorie: Přehledné referáty
Souhrn
Hypertrofická kardiomyopatie je v naší populaci nejčastější geneticky podmíněnou kardiomyopatií. Základem pro její diagnostiku jsou zobrazovací metody, a to především echokardiografie. Zobrazení srdce pomocí magnetické rezonance nabízí mnohem přesnější a detailnější informace o tomto onemocnění a s rozvojem dostupnosti této metody se stává standardní součástí algoritmu vyšetření. V první části přehledového článku se autoři věnují možnostem a významu zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie.
Klíčová slova:
fibróza – hypertrofická kardiomyopatie – magnetická rezonance srdceÚvod
Hypertrofická kardiomyopatie (HCM) se s ohledem na svou prevalenci v populaci odhadovanou na 1 : 500 řadí mezi nejčastější kardiomyopatie. Onemocnění se dědí autosomálně dominantně s variabilní expresivitou a s penetrací související s věkem [1]. Její klinická manifestace je nesmírně heterogenní. Řada pacientů nemusí mít po celou dobu života závažnější symptomy, zároveň se ale jedná o nejčastější příčinu náhlé srdeční smrti u mladých jedinců [2]. Charakteristickým rysem hypertrofické kardiomyopatie je zvětšení tloušťky srdeční stěny nebo hmotnosti myokardu za nepřítomnosti hypertenze nebo chlopenní vady schopné tento stav způsobit [3]. Aktuální Doporučené postupy Evropské kardiologické společnosti (ESC) pro diagnostiku a management hypertrofické kardiomyopatie [4] vyžadují přítomnost hypertrofie jednoho nebo více segmentů levé komory (LK) ≥ 15 mm naměřenou některou z níže uvedených zobrazovacích metod (echokardiografie, magnetická rezonance srdce, výpočetní tomografie srdce). Pokud se jedná o příbuzné v první linii, postačí průkaz hypertrofie jednoho nebo více segmentů LK ≥ 13 mm. Dle současné definice se mezi HCM řadí nejen geneticky podmíněné onemocnění ve smyslu mutace genů kódujících sarkomerické proteiny, ale např. i střádavá onemocnění, kdy nedochází k hypertrofii kardiomyocytů, ale k postižení intersticia. S ohledem na to, že se jedná o diametrálně odlišná onemocnění, budeme v další části textu výraz HCM používat striktně pro hypertrofii LK způsobenou mutací genů kódujících sarkomerické proteiny (sarkomerická HCM) a ostatní nozologické jednotky hypertrofie LK uvádět zvlášť.
Vzhledem k horší dostupnosti genetického vyšetření a stále narůstajícímu počtu objevených kauzálních genetických mutací je diagnostika HCM odkázána na zobrazovací metody. Nejdostupnější a také nejlevnější zobrazovací metodou je echokardiografie (ECHO), která je základním pilířem diagnostiky tohoto onemocnění. Zobrazení srdce pomocí magnetické rezonance (CMR) ale nabízí další možnosti v diagnostice HCM, a to jak ve smyslu přesnějšího stanovení tíže hypertrofie a celkové hmotnosti myokardu LK, tak ve smyslu možnosti detekce abnormalit celého mitrálního aparátu, myokardiálních krypt, hypertrofie pravé komory (PK) či myokardiální fibrózy [5]. CMR v řadě případů rovněž umožňuje odlišení HCM od jejích fenokopií [6].
Hypertrofie levé komory
CMR je zlatým standardem pro diagnostiku hypertrofie stěn LK a stanovení hmotnosti jejího myokardu (left ventricular mass – LVM). Oproti echokardiografii má mnohem lepší rozlišení kontur endokardu a epikardu a není limitováno přítomností akustického okna, což umožňuje volit libovolnou rovinu vyšetření, např. provést skeny („řezy“) napříč LK od její báze až po hrot. Díky tomu je CMR mnohem přesnější ve stanovení řady parametrů včetně tíže hypertrofie.
Při echokardiografickém vyšetření můžeme v řadě případů hypertrofii nadhodnocovat – pokud jsou nesprávně zavzaty trabekuly PK do diametru mezikomorového septa (obr. 1), či naopak podhodnocovat – pokud je hypertrofie nekontinuální (obr. 2).
Obr. 1. B-TFE (balanced turbo field echo) sekvence v krátké ose LK. 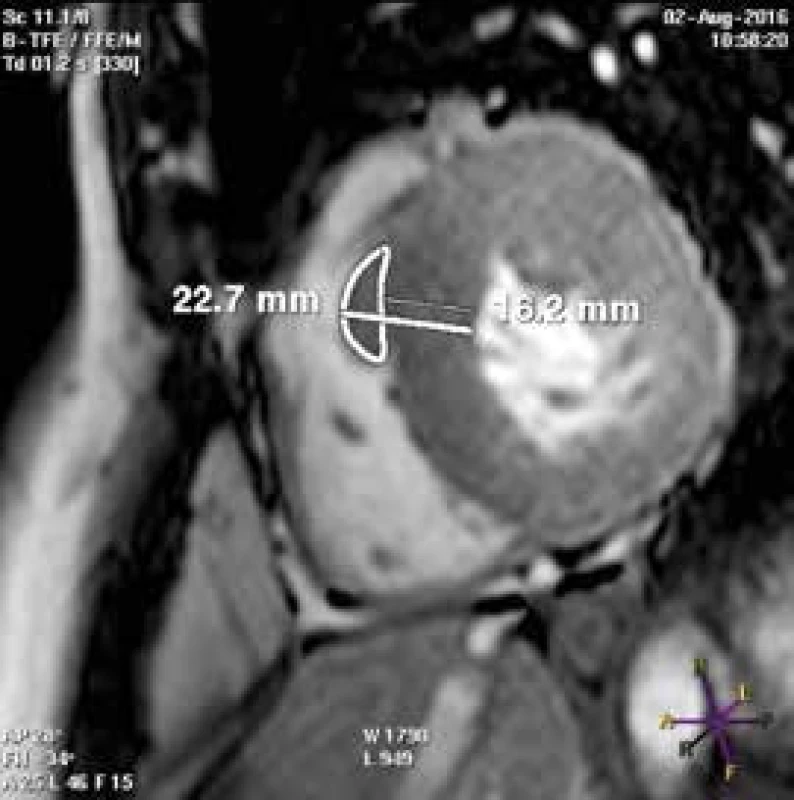
Při chybném zavzetí crista supraventricularis PK do diametru mezikomorového septa dochází k nadhodnocení maxima hypertrofie Obr. 2. B-TFE sekvence v krátké ose LK. 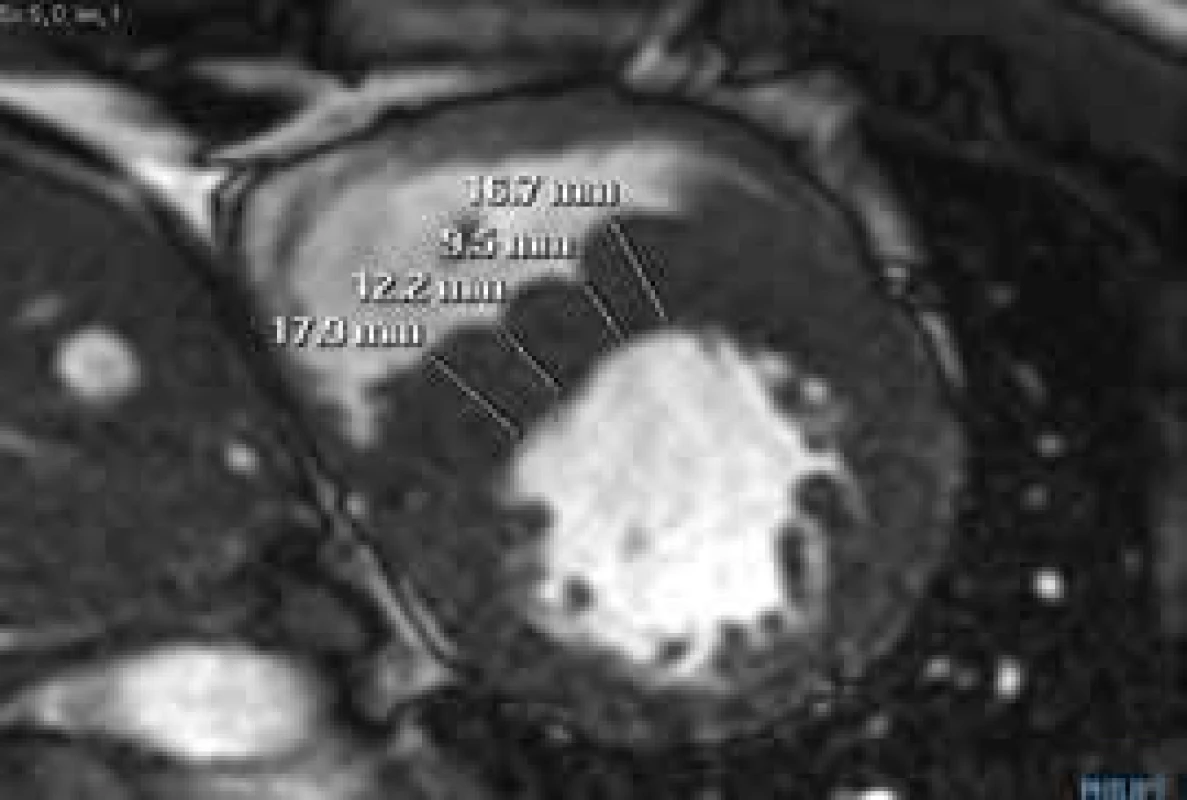
Patrná nekontinuální hypertrofie mezikomorového septa Rickers et al [7] srovnávali ve své studii přesnost echokardiografie a CMR v diagnostice hypertrofie stěn levé komory. Autoři udávají větší přesnost CMR ve stanovení tloušťky extrémně hypertrofických segmentů (10 % pacientů s echokardiograficky stanovenou tloušťkou segmentu < 30 mm mělo dle CMR tloušťku > 30 mm) a ve stanovení tloušťky anterolaterální stěny (6 % pacientů s hypertrofií anterolaterální stěny LK nebylo echokardiograficky vůbec diagnostikováno) [8]. CMR je rovněž přesnější v detekci hypertrofie apikálních segmentů LK. Z výše uvedeného vyplývá i dominance CMR ve stanovení hmotnosti myokardu LK. Již Steward et al prokázali, že přesnost echokardiografie pro stanovení LVM klesá s nárůstem asymetričnosti hypertrofie jejích stěn [9]. Olivotto et al [10] měřili hmotnost levé komory u 264 pacientů s HCM a studovali její klinický význam. Zjistili, že až 21 % pacientů s HCM má normální hmotnost levé komory (dokonce 3 z těchto pacientů měli maximální tloušťku stěny ≥ 30 mm). Pacienty prospektivně sledovali po dobu 2,6 ± 0,7 let. Došli k závěru, že hmotnost levé komory je senzitivnějším prediktorem náhlé srdeční smrti než maximální hypertrofie stěny ≥ 30 mm [8].
Při popisu hypertrofie LK se v rámci CMR hodnotí:
- maximum hypertrofie a její lokalizace
- stanovení neindexované a indexované hmotnosti myokardu LK (současně i stanovení objemů a systolické funkce LK)
- počet hypertrofických segmentů LK – hypertrofie může být fokální (1–2 segmenty), asymetrická/intermediální (3–7 segmentů) a difuzní (≥ 8 segmentů) [11]
- tvar mezikomorového septa – reverzní, sigmoidální, apikální, neutrální (obr. 3)
- případná nekontinuálnost hypertrofie – mezi hypertrofické segmenty je vmezeřen segment s normální tloušťkou stěny
Obr. 3. B-TFE sekvence v dlouhé ose LK – tvary mezikomorového septa. 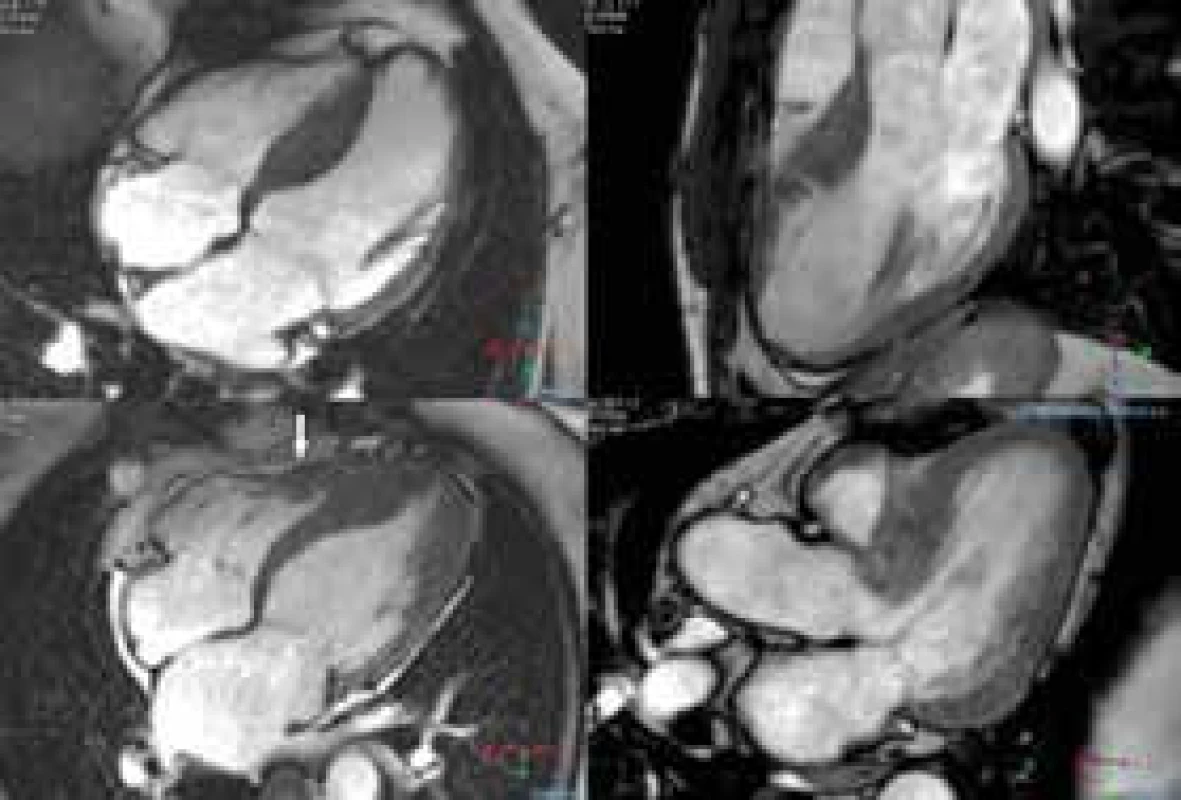
1. reverzní (obr. vlevo nahoře), 2. sigmoidální (obr. vpravo nahoře) – současně patrné krypty ve středním segmentu anterosepta, 3. apikální (obr. vlevo dole) – šipkou označena přidružená fokální hypertrofie PK, 4. neutrální (obr. vpravo dole) Hodnocení přítomnosti nitrokomorové obstrukce a abnormalit mitrálního aparátu
Dynamická nitrokomorová obstrukce je definována přítomností vrcholového gradientu ≥ 30 mm Hg v klidu nebo při provokačních manévrech či zátěži [4]. Nejčastěji se jedná o nitrokomorovou obstrukci ve výtokovém traktu LK (left ventricular outflow tract – LVOT). Jako nejpravděpodobnější princip jejího vzniku se uvádí akcelerace toku v LVOT při kontrakci hypertrofické báze septa. Následující pokles tlaku vede k dopřednému pohybu předního cípu a závěsného aparátu mitrální chlopně (tzv. SAM – systolic anterior motion) vedoucímu k výtokové obstrukci (Venturiho efekt). Obstrukce v LVOT může být přítomna v klidu (klidová forma obstruktivní HCM) nebo může být provokována zátěží, Valsalvovým manévrem nebo podáním nitroglycerinu (latentní forma obstruktivní HCM). Vzácněji se může vyskytovat obstrukce ve střední části LK (mid–ventrikulární forma). Její přítomnost je v rámci CMR vyšetření hodnocena vizuálně na podkladě detekce ztráty signálu akcelerovaného toku krve (detekce „jetu“). Ačkoliv SAM lze pomocí CMR velmi dobře zobrazit, v samotném stanovení tíže obstrukce je výrazně přesnější echokardiografie, která navíc umožňuje i verifikaci zátěžové formy. Na přítomnosti nitrokomorové obstrukce se vyjma hypertrofie LK často podílí i elongace cípů mitrální chlopně či abnormalita papilárních svalů LK. V práci Marona et al [12] bylo prokázáno, že vyšší poměr velikosti předního cípu mitrální chlopně k diametru LVOT (měřeno pomocí CMR) predikuje výskyt nitrokomorové obstrukce. Abnormalita papilárních svalů je častější u pacientů s HCM než u zdravé populace [13,14] a je mnohem lépe hodnotitelná pomocí CMR než echokardiograficky. Hypertrofie papilárních svalů, jejich vícehlavost a atypická lokalizace ve smyslu jejich posunu dopředu a apikálně může vést ke vzniku mid-ventrikulární obstrukce a případně následnému vzniku aneuryzmatu hrotu LK, chybná inzerce či chybějící interpozice šlašinek se pak může podílet na nitrokomorové obstrukci v LVOT [14–16]. CMR má proto nezastupitelnou roli při plánování způsobu řešení symptomatické závažné nitrokomorové obstrukce, zda nález umožňuje provedení alkoholové septální ablace nebo je nutný komplexní kardiochirurgický výkon.
Myokardiální krypty
Myokardiální krypty se řadí mezi embryonální poruchy vývoje architektury LK, které jsou u pacientů s HCM dávány do souvislosti s přítomností mutace genů kódujících sarkomerické proteiny [17]. Myokardiální krypta je definována jako diskontinuita (rozštěp) stěny LK ≥ 50 % její tloušťky v diastole [18]. Jedná se o drobnou invaginaci dutiny LK do její stěny mizející při její kontrakci. Vyskytuje se nejčastěji v bazálním segmentu spodní stěny a inferosepta v místě úponu spodní stěny PK. Maron et al [18] nalezli krypty u 4 % pacientů s HCM a až u 61 % genotyp pozitivních/fenotyp negativních (G+/P-) příbuzných. Navázali tak na pilotní studii Germans et al [19], kteří provedli CMR u 16 G+/P- jedinců a až u 13 z nich (81 %) detekovali přítomnost myokardiálních krypt. Naproti tomu u kontrolního souboru 16 zdravých dobrovolníků nebyly krypty nalezeny. Na podkladě toho byly myokardiální krypty zpočátku považovány za prefenotypový marker HCM. Následné studie ale prokázaly, že se krypty v určitém procentu vyskytují i u jiných onemocnění a také u zdravých jedinců [20]. Jejich detekce tedy automaticky neznamená průkaz mutace genů kódující sarkomerické proteiny, ale zvyšuje pravděpodobnost přítomnosti mutace u fenotyp negativních přímých příbuzných (obzvláště přítomnost vícečetných hlubokých krypt), obr. 4.
Obr. 4. B-TFE sekvence v dlouhé ose LK. 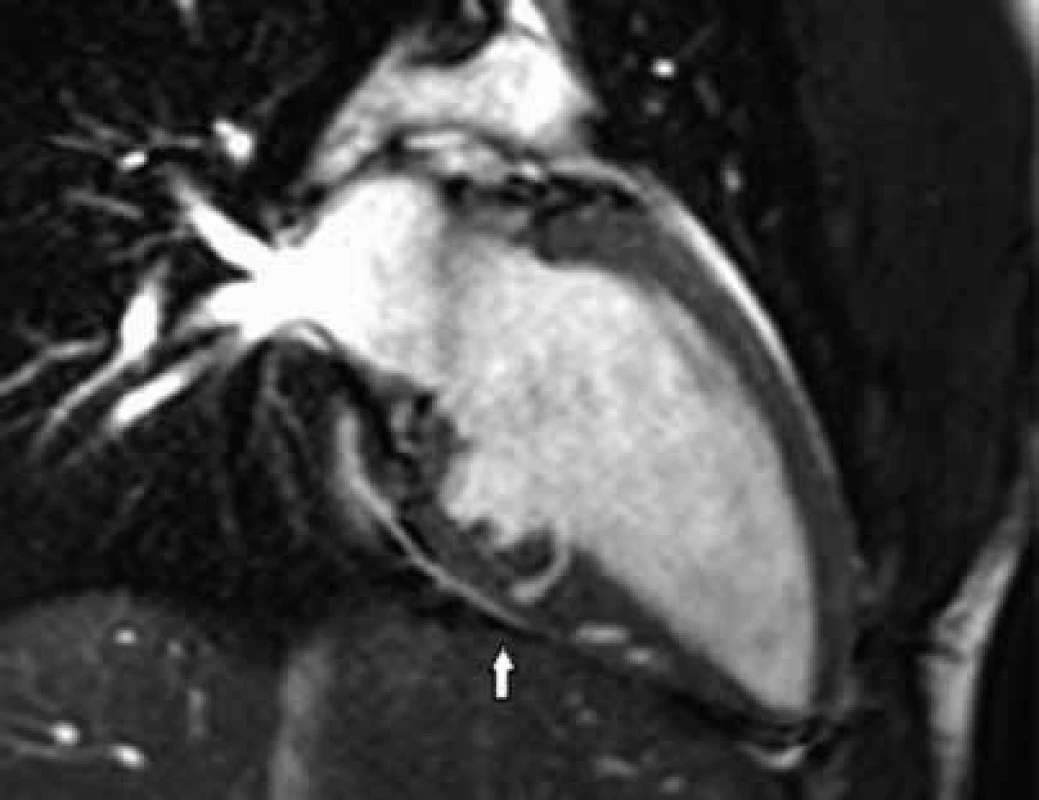
V bazální polovině spodní stěny LK jsou patrné myokardiální krypty (přímý příbuzný pacienta s HCM) Hypertrofie pravé komory
Hypertrofie pravé komory se dle literárních údajů vyskytuje u 17,6 % pacientů s hypertrofickou kardiomyopatií [21], v práci Marona et al [22] se dokonce vyskytla až u 33 % pacientů. Hypertrofie může být difuzní, diagnosticky cennější je ale průkaz hypertrofie fokální, která s vysokou pravděpodobností svědčí pro diagnózu HCM. Poměrně často bývá nalézána hypertrofie trabekul PK, a to především crista supravenricularis, která může vzácně vést až k rozvoji dynamické nitrokomorové obstrukce ve výtokovém traktu PK.
Přítomnost a kvantifikace pozdního sycení kontrastní látkou
CMR má unikátní vlastnost identifikovat patologický substrát v myokardu pomocí kontrastní látky. Použitím gradientní echo sekvence s přípravnými pulzy lze v pozdních postkontrastních skenech (late gadolinium enhancement – LGE) detekovat ložiska vyšší signálové intenzity, která u HCM odpovídají ložiskům fibrózy (obr. 5) [23].
Obr. 5. Postkontrastní T1 vážené obrazy (LGE) v krátké ose LK. 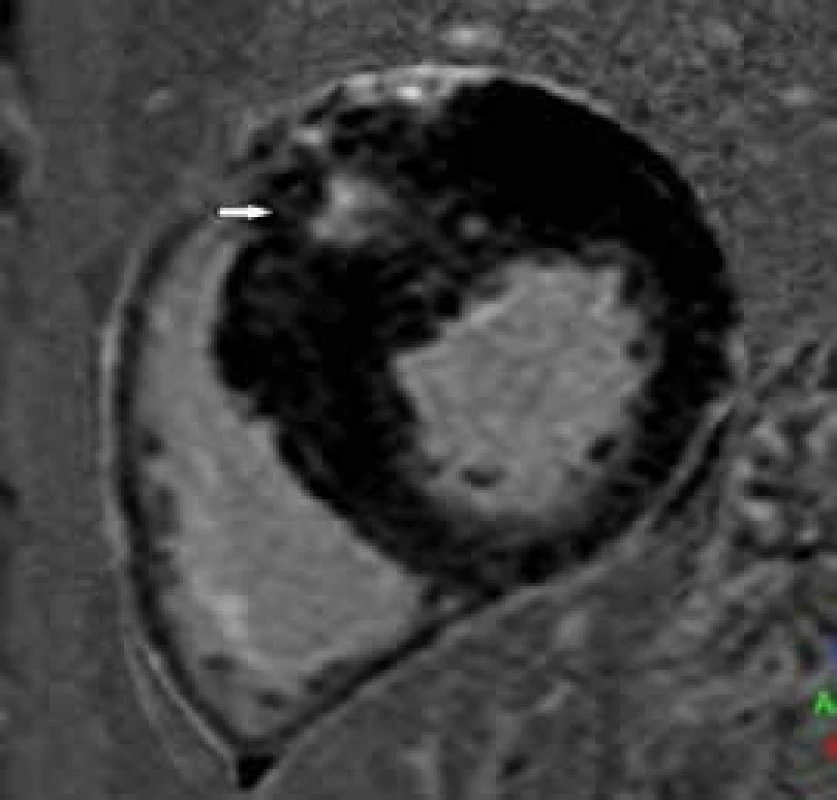
Fokální intramurální ložisko pozdního sycení v bázi anterosepta (šipka) Tato ložiska pozdního sycení se typicky nacházejí v segmentech s největší hypertrofií, tedy nejčastěji v mezikomorovém septu (často v místech úponů přední a spodní stěny PK). Software moderních přístrojů umožňuje rovněž kvantifikaci množství LGE, ať již v gramech nebo v procentuálním poměru k celkovému objemu myokardu levé komory. Používána je různá standardní odchylka (standard deviation – SD) od hodnoty signálu vizuálně nepostiženého myokardu. Vyšší SD (≥ 6) zobrazuje spíše ložiska fibrózy nahrazující myokard, nižší SD (4–5) navíc detekuje i myokard se zmnoženou intersticiální fibrózou [24]. Přítomnost pozdního sycení myokardu LK lze detekovat u více než poloviny pacientů (průměrný výskyt LGE v publikovaných studiích je 65 %) [25]. Řada studií se snažila prokázat vztah mezi přítomností LGE a prognózou pacientů. Ačkoliv pacienti s průkazem fibrózy mají např. 7krát vyšší riziko výskytu nesetrvalých komorových tachykardií než pacienti bez průkazu fibrózy [26], větší hypertrofii stěn LK a její nižší ejekční frakci (EF), samotná přítomnost LGE jako jednoznačného nezávislého rizikového faktoru statisticky prokázána nebyla [27], na čemž se jistě podílí i kombinace vysoké prevalence LGE a nízkého rizika náhlé srdeční smrti (NSS) v selektované populaci pacientů s HCM (do studie nebývají zařazováni např. pacienti s implantovaným defibrilátorem apod). Z výsledků studií ale vyplývá, že nepřítomnost LGE obecně značí menší riziko NSS, a naopak přítomnost rozsáhlejšího LGE je spojena s poklesem EF LK a rozvojem srdečního selhání [28,29]. Existují práce, které zkoumaly prognózu pacientů v závislosti na množství LGE. Rozsáhlá multicentrická studie Chan et al [29] prokázala souvislost mezi rozsahem LGE a rizikem NSS. Pacienti s LGE ≥ 15 % měli dvojnásobné riziko NSS bez ohledu na přítomnost či nepřítomnost dalších rizikových faktorů. V současné době ale není přítomnost LGE součástí stratifikačního schématu rizika NSS v doporučeních ESC, v doporučeních Americké kardiologické asociace pro diagnostiku a terapii hypertrofické kardiomyopatie však figuruje jako modifikátor rizika NSS [30].
Hodnocení přítomnosti a množství myokardiální fibrózy pomocí standardních pozdních postkontrastních skenů (LGE) je založeno na detekci a kvantifikaci okrsků myokardu LK se signálem vyšším signálem, než je signál vizuálně nepostiženého myokardu, i ten ale ve skutečnosti může mít vyšší signál v důsledku přítomnosti difuzních fibrotických změn (tedy může docházet k podhodnocení celkového množství fibrózy). Pro přesnější kvantifikaci difuzní fibrózy se v posledních letech používá před a postkontrastní T1 mapping se stanovením T1 relaxačního času myokardu a výpočtem extracelulárního objemu (frakce) myokardu LK (podrobněji v 2. části článku). Tato nová možnost tkáňové charakteristiky myokardu se uplatňuje nejen v diagnostice HCM, ale i obecně v rámci diferenciální diagnostiky hypertrofie LK. V současné době T1 mapping není standardní součástí programového vybavení většiny pracovišť v České republice, do budoucna lze však předpokládat jeho běžné použití v klinické praxi.
Závěr
Sarkomerická HCM je nejčastější geneticky podmíněnou kardiomyopatií. Na její diagnostice a dlouhodobém sledování by se měly podílet obě zobrazovací metody, tedy jak ECHO, tak CMR. ECHO má nezastupitelnou roli v samotném záchytu onemocnění, je tedy základním sítem, které určuje další diagnostický postup. ECHO je nejpřesnější metoda pro detekci a kvantifikaci dynamické zátěžové obstrukce, umožňuje provést zátěžové testy, přesněji zhodnotí mitrální regurgitaci včetně její příčiny, je mnohem levnější, a tedy vhodnější pro dlouhodobé sledování pacientů a hraje hlavní roli v screeningu přímých příbuzných. CMR detailněji popíše morfologii LK včetně případné patologie papilárních svalů, zpřesní echokardiograficky získané parametry, jako je maximum hypertrofie, LVM a EF LK. CMR dokáže zobrazit myokardiální krypty, fokální hypertrofii PK a jako jediná ze zobrazovacích metod umožňuje in vivo zobrazit a kvantifikovat myokardiální fibrózu. V řadě případů napomáhá odlišit HCM od adaptační hypertrofie i sarkomerickou HCM od jejích fenokopií, čemuž se bude detailně věnovat 2. část přehledového článku. Úvaze o možnostech řešení symptomatické závažné dynamické obstrukce by pak měla předcházet syntéza informací z obou zobrazovacích metod.
MUDr. Martin Pleva
martin.pleva@vtn.agel.cz
Vaskulární centrum Vítkovické nemocnice, a.s., Ostrava
www.nemocnicevitkovice.agel.cz
Doručeno do redakce 5. 11. 2016
Přijato po recenzi 13. 3. 2017
Zdroje
1. Maron BJ, Ommen SR, Semsarian C et al. Hypertrophic cardiomyopathy. Present and future, with translation into contemporary cardiovascular medicine. J Am Coll Cardiol 2014; 64(1): 83–99. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2014.05.003>.
2. Maron BJ. Contemporary insights and strategies for risk stratification and prevention of sudden death in hypertrophic cardiomyopathy. Circulation 2010; 121(3): 445–456. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.109.878579>. Erratum in Circulation 2010; 122(1): e7.
3. Elliott PM, Andersson B, Arbustini E et al. Classification of the cardiomyopathies: a position statement from the European Society of Cardiology working group on myocardial and pericardial diseases. Eur Heart J 2008; 29(2): 270–276.
4. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. Eur Heart J 2014; 35(39): 2733–2779. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu284>.
5. Maron MS. Clinical utility of cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2012; 14 : 13. Dostupné z DOI: <http://dx.doi.org/10.1186/1532-429X-14-13>.
6. Germans T, Nijveldt R, Brouwer WP et al. The role of cardiac magnetic resonance imaging in differentiating the underlying causes of left ventricular hypertrophy. Neth Heart J 2010; 18(3): 135–143.
7. Rickers C, Wilke NM, Jerosch-Herold M et al. Utility of cardiac magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Circulation 2005; 112(6): 855–861.
8. Pleva M, Ouředníček P. MRI srdce. Praktické využití z pohledu kardiologa. Grada Publishing: Praha 2012. ISBN 978–80–247–3931–1.
9. Stewart GA, Foster J, Cowan M et al. Echocardiography overestimates left ventricular mass in hemodialysis patients relative to magnetic resonance imaging. Kidney Int 1999; 56(6): 2248–2253.
10. Olivotto I, Maron MS, Autore C et al. Assessment and significance of left ventricular mass by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Am Coll Cardiol 2008; 52(7): 559–566. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2008.04.047>.
11. Maron MS, Maron BJ, Harrigan C et al. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol 2009; 54(3): 220–228. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2009.05.006>.
12. Maron MS, Olivotto I, Harrigan CJ et al. Mitral valve abnormalities identified by cardiovascular magnetic resonance represent a primary phenotypic expression of hypertrophic cardiomyopathy. Circulation 2011; 124(1): 40–47. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.110.985812>.
13. Kwon DH, Setser RM, Thamilarasan M et al. Abnormal papillary muscle morphology is independently associated with increased left ventricular outflow tract obstruction in hypertrophic cardiomyopathy. Heart 2008; 94(10): 1295–1301.
14. Harrigan CJ, Appelbaum E, Maron BJ et al. Significance of papillary muscle abnormalities identified by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. Am J Cardiol 2008; 101(5): 668–673. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2007.10.032>.
15. Veselka J, Linhartová K, Zemánek D. Kardiomyopatie. Galén: Praha 2009. ISBN 978–80–7262–640–3.
16. To AC, Dhillon A, Desai MY. Cardiac magnetic resonance in hypertrophic cardiomyopathy. JACC Cardiovasc Imaging 2011; 4(10): 1123–1237. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2011.06.022>.
17. Moon JC, McKenna WJ. Myocardial crypts: a prephenotypic marker of hypertrophic cardiomyopathy? Circ Cardiovasc Imaging 2012; 5(4): 431–432. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCIMAGING.112.975888>.
18. Maron MS, Rowin EJ, Lin D et al. Prevalence and clinical profil of myocardial crypts in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging 2012; 5(4): 441–447. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCIMAGING.112.972760>.
19. Germans T, Wilde AAM, Dijkmans PA et al. Structural abnormalities of the inferoseptal left ventricular wall detected by cardiac magnetic resonance imaging in carriers of hypertrophic cardiomyopathy mutations. J Am Coll Cardiol 2006; 48(12): 2518–2523.
20. Child N, Muhr T, Sammut E et al. Prevalence of myocardial crypts in a large retrospective cohort study by cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2014; 16 : 66. Dostupné z DOI: <http://dx.doi.org/10.1186/s12968-014-0066-0>.
21. Hansen MW, Merchant N. MRI of hypertrophic cardiomyopathy: part I, MRI appearances. AJR Am J Roentgenol 2007; 189(6): 1335–1343.
22. Maron MS, Hauser TH, Dubrow E et al. Right ventricular involvement in hypertrophic cardiomyopathy. Am J Cardiol 2007; 100(8): 1293–1298.
23. Maron MS. Contrast-enhanced CMR in HCM. What lies behind the bright light of LGE and why it now matters. JACC Cardiovasc Imaging 2013; 6(5): 597–599. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2012.10.028>.
24. Moravsky G, Ofek E, Rakowski H et al. Myocardial fibrosis in hypertrophic cardiomyopathy. Accurate reflection of histopathological findings by CMR. JACC Cardiovasc Imaging 2013; 6(5): 587–596. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2012.09.018>.
25. Noureldin RA, Liu S, Nacif MS et al. The diagnosis of hypertrophic cardiomyopathy by cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2012; 14 : 17. Dostupné z DOI: <http://dx.doi.org/10.1186/1532-429X-14-17>.
26. Adabag AS, Maron BJ, Appelbaum E et al. Occurrence and frequency of arrhythmias in hypertrophic cardiomyopathy in relation to delayed enhancement on cardiovascular magnetic resonance. J Am Coll Cardiol 2008; 51(14): 1369–1374. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2007.11.071>.
27. Ismail TF, Jabbour A, Gulati A et al. Role of late gadolinium enhancement cardiovascular magnetic resonance in the risk stratification of hypertrophic cardiomyopathy. Heart 2014; 100(23): 1851–1858. Dostupné z DOI: <http://dx.doi.org/10.1136/heartjnl-2013-305471>.
28. Olivotto I, Maron BJ, Appelbaum E et al. Olivotto I, Maron BJ, Appelbaum E et al. Spectrum and clinical significance of systolic function and myocardial fibrosis assessed by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. Am J Cardiol 2010; 106(2): 261–267. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2010.03.020>.
29. Chan RH, Maron BJ, Olivotto I et al. Late gadolinium enhancement score (LGE-Score) for prediction of extensive late gadolinium enhancement in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2015; 17(Suppl 1): Q59. Dostupné z DOI: <http://dx.doi.org/10.1186/1532-429X-17-S1-Q59>.
30. Gersh BJ, Maron BJ, Bonow RO et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrofic cardiomyopathy. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2011; 58(25): e212-e260. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2011.06.011>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Publikační soutěž 2017Článek Z odborné literaturyČlánek Z odborné literaturyČlánek Z odborné literaturyČlánek Z odborné literatury
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- CT kolografie v klinické praxi – editorial
- Kardio-onkologie, onko-kardiologie – editorial
- Publikační soutěž 2017
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
- Přínos CT kolografie v klinické praxi
- Diabetes mellitus 2. typu a chronická obličková choroba
-
Význam zobrazení srdce pomocí magnetické rezonance v diagnostice hypertrofické kardiomyopatie
Část I - Kardiovaskulární komplikace nádorů a jejich léčby
- Komentár k aktuálnym odporúčaniam v liečbe diabetu 2. typu
- Prof. MUDr. Pavel Klener, DrSc. se v dubnu roku 2017 dožívá 80 let
- Dopis redakci Vnitřního lékařství – reakce na článek Predátorské časopisy: praktiky jejich vydavatelů a jak se jim bránit
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Z odborné literatury
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Přínos CT kolografie v klinické praxi
- Možnosti efektivní edukace v diabetologii – návod pro edukátory
- Radiofrekvenční katétrová ablace pro fibrilaci síní prováděná v celkové anestezii: výsledky unicentrické randomizované studie
- Nepravidelnosti dýchání při spiroergometrickém vyšetření – od mírné nepravidelnosti dechového vzoru až po periodické dýchání typu oscilující ventilace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



