-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNová verze klasifikace plicní hypertenze
New version of classification of pulmonary hypertension
Pulmonary hypertension has multifactorial pathophysiology with endothelial dysfunction, vasoconstriction, pulmonary vessel wall remodeling and plexiform lesions contributing to increased pulmonary vascular resistance. Recent studies showed the importance of several mediators in PH pathophysiology, including prostacyclin, nitric oxide, serotonine, endothelin 1, several cytokines, chemokines, as well as members of the transforming growth factor β family (TGF-β). Current article summarizes new classification version of pulmonary hypertension, which was presented at World pulmonary hypertension symposium in 2013. This classification has five main groups with similar pathological findings, hemodynamic characteristics and similar management.
Key words:
classification – pulmonary arterial hypertension – pulmonary hypertension
Autoři: Michael Aschermann
Působiště autorů: II. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Aleš Linhart, DrSc., FESC, FCMA
Vyšlo v časopise: Vnitř Lék 2015; 61(5): 387-391
Kategorie: Přehledné referáty
Souhrn
Plicní arteriální hypertenze je onemocnění, na jehož patofyziologii se podílí řada faktorů, především dysfunkce endotelu, vazokonstrikce, remodelace cév v plicní cirkulaci, trombóza, tvorba tzv. plexiformních lézí. Patofyziologické studie prokázaly význam mediátorů, které se na patologickém procesu v počátcích podílejí. Patří k nim prostacyklin, oxid dusnatý, endotelin 1, serotonin, cytokiny, chemokiny, a především některé mediátory z rodiny transformujícího růstového faktoru β. Práce přináší souhrn inovované klasifikace plicní hypertenze, která byla uvedena do praxe v roce 2013. Tato klasifikace zachovává 5 hlavních skupin: plicní arteriální hypertenze, plicní hypertenze u nemocí levého srdce, u onemocnění plic a při hypoxii, chronická tromboembolická plicní hypertenze a skupina s multifaktoriálním mechanizmem vzniku. Diskutovány jsou změny, které jsou v této verzi klasifikace nové.
Klíčová slova:
klasifikace – plicní arteriální hypertenze – plicní hypertenzeÚvod
Až do roku 1998 byla plicní hypertenze (PH) rozdělována pouze do 2 základních kategorií – první byla tzv. primární plicní hypertenze, druhá pak sekundární PH zahrnující podskupiny různých onemocnění, u kterých k rozvoji PH dochází. Klasifikace plicní hypertenze byla poprvé ustanovena v roce 1998 na 2. světovém sympoziu PH, s cílem rozdělit PH do jednotlivých skupin, které mají podobnou patofyziologii, hemodynamické charakteristiky a léčebné postupy [1]. Na 5. světovém sympoziu PH, které proběhlo v roce 2013 v Nice, došlo k dosavadní klasifikaci PH k několika úpravám, bylo zachováno rozdělení do 5 základních skupin, které byly lehce modifikovány (podskupiny 1´ a 1´´), tab.1. V tomto sdělení jsou shrnuty hlavní změny inovované verze klasifikace PH.
Tab. 1. Revidovaná nomenklatura a klasifikace plicní arteriální hypertenze (Nice, 2013) 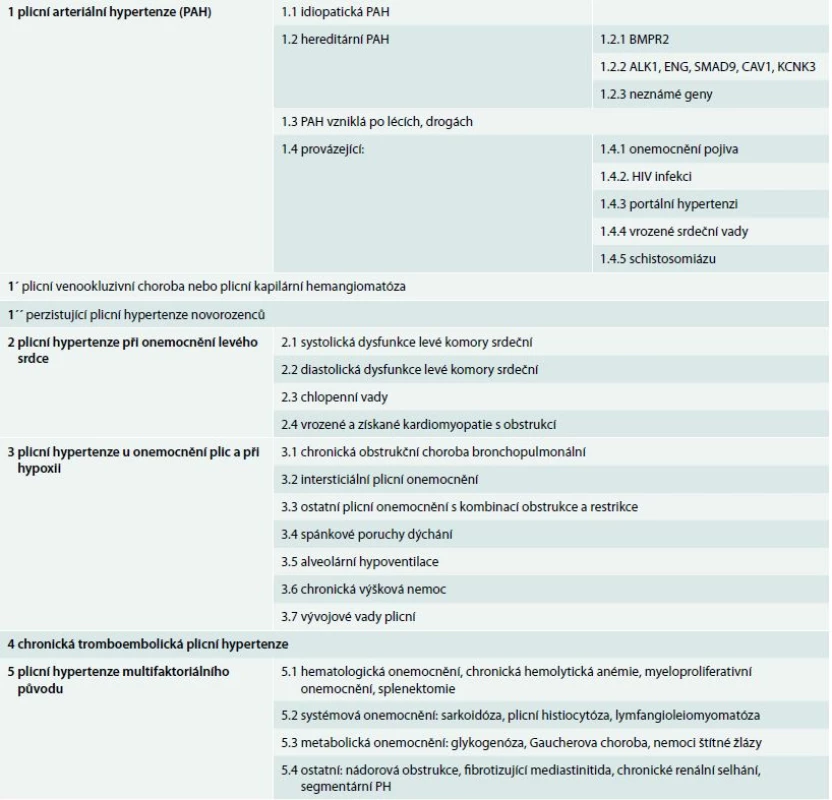
Skupina 1
Plicní arteriální hypertenze
V první skupině plicní arteriální hypertenze (PAH) došlo proti předchozí verzi klasifikace PH k několika zásadním změnám. PAH může být hereditární (HPAH), idiopatická (IPAH), nebo se vyskytuje při expozici toxinům/lékům, případně provází jiná onemocnění – onemocnění pojivových tkání, vrozené srdeční vady, HIV infekci a portální hypertenzi [1].
Hereditární (familiární) PAH
Geneticky podmíněná forma plicní arteriální hypertenze (PAH) byla poprvé popsána v roce 1948, incidence dědičné formy v populaci je odhadována na 1–2 případy na 1 milion obyvatel. Postupně bylo prokázáno, že jde o onemocnění s autozomálně dominantní dědičností s vysokou variabilitou a nekompletní expresí v jednotlivých rodinách, typické je postižení všech generací v rodokmenu. Dostupnost genetických map od roku 1980 umožnila rychlý rozvoj možností hledání genů zodpovědných za vznik onemocnění. V některých případech jsou známé evidentní kandidátní geny, které je možné s pomocí některých z metod pro hledání mutací vyšetřit. Tato strategie kandidátních genů se obecně zaměřuje na hledání variant v genech, u kterých je možné z nějakých důvodů předpokládat, že mohou mít souvislost se zkoumaným onemocněním. Proces hledání odpovědných genů začíná většinou výběrem dostatečně velkého rodokmenu s minimálně 5–10 postiženými jedinci v příbuzenstvu, u plicní hypertenze tedy s PAH. Z těchto rodin s výskytem postižených i nepostižených jedinců jsou pak shromážděny vzorky deoxyribonukleové kyseliny (DNK). Při jejich dostatečném počtu je možné provést vazebné studie tzv. mikrosatelitních markerů, které vedou nejprve k identifikaci postiženého chromozomu, později pak i k rozpoznání lokusu tohoto chromozomu s mutací. Ze známých dat projektu Lidský genom (Human Genom Project) jsou v této oblasti chromozomu vybrány kandidátní geny, a ty jsou pak testovány metodou DNK sekvenace – stanovení nukleotidové sekvence DNK. Dnes se sekvenace DNK provádí pomocí automatických sekvenátorů, typická délka sekvenovaného fragmentu DNK je do 1 000 párů bazí (bp). U FPAH prokázaly studie mutace v genech pro 2 typy receptorů z rodiny transformujícího růstového faktoru β (TGFβ).
Bone morphogenetic protein receptor type-2
První je gen na 2. chromozomu v oblasti 2q32 kódující tzv. bone morphogenetic protein receptor typu-2 (BMPR2) [2,3]. V současné době již bylo identifikováno více než 300 mutací v tomto genu, nacházejí se u 75 % nemocných s familiární formou a přibližně ve 25 % u nemocných s IPAH. U ostatních idiopatických PAH (75 % případů) se mohou u malého počtu případů nacházet jiné typy mutací: intronové v BMPR2, mutace ALK1.
U familiárních forem PAH (FPAH) tedy prokázaly uvedené studie mutace v genu pro receptor BMPR2 na 2. chromozomu a lokusu 2q32 [4]. Tento gen má celkem 13 exonů (130 000 bp), jednotlivé exony kódují různé části proteinového receptoru (extracelulární doména, transmembránová doména, serin/treoninkinázová doména a velká intracelulární C terminální část). Mutace byla popsána ve všech exonech s výjimkou 5 a 13 exonu, každá postižená rodina má unikátní mutaci. Např. bodové mutace, které vedou k záměně aminokyselin v proteinu receptoru, postihují domény, které mají zásadní význam pro funkci receptoru. Je zajímavé, že mutace se nalézá pouze u 75 % rodin, u řady ze zbylých 25 % rodin byla sice prokázána vazba k lokusu BMPR2, ale dosud nebyly nalezeny specifické mutace.
BMPR2 je široce rozšířený receptor z rodiny TGFβ receptorů. Tyto receptory zprostředkují buněčné reakce na jednotlivé členy TGFβ rodiny, mezi které patří TGFβ, aktiviny, inhibiny, a bone morphogenetic proteiny (BMP). Tyto proteiny mají pleiotropní aktivity v řadě tkání, účastní se na regulaci buněčného růstu, apoptózy a diferenciace buněk, podílejí se např. také na organogeneze rostoucího embrya. Přenos signálu vázaný na BMPR2 ovlivňuje mimo jiné také proliferativní reakci buněk hladkého svalstva ve stěně plicních tepen. Bylo prokázáno, že BMP2 a BMP7 inhibují proliferaci těchto buněk. Z toho je odvozena pracovní hypotéza, podle které mutace v genu pro BMPR2 vede k proliferaci buněk hladkého svalstva v plicním řečišti, což je následováno zvýšením plicní cévní rezistence a plicní hypertenzí [5].
Frekvence nositelů mutace BMPR2 v populaci není známa, odhady se pohybují v rozmezí mezi 0,001 % do 0,01 %. Byla publikována data od 350 vyšetřených normálních osob, v této skupině nebyla nalezena exonická mutace v genu pro BMPR2.
Na vzniku onemocnění se však musí podílet také další faktory, uvádí se možné postižení jiných, dosud neznámých genů, genetické polymorfizmy, ale také faktory zevního prostředí, které mohou působit jako spouštěcí faktory patologických reakcí vedoucích k manifestaci choroby. V rodinách s FPAH mají sourozenci a děti nemocných s FPAH riziko přenosu genu s mutací 50 %, při penetranci 20 % je tedy riziko vzniku onemocnění přibližně 10 %. Znamená to, že většina osob s mutací nemá PAH, přesto mohou přenést mutaci na své potomky. Onemocnění se manifestuje v různém věku, v průměru je udáván věk nemocných 36 let, s širokým rozptylem od jednoho až do 74 roků. U FPAH je známa zatím neobjasněná tendence časnějšího rozvoje v následujících generacích, tento fenomén je označován jako „genetická anticipace“ [6]. Molekulární genetické vyšetření je v současné době prováděno pouze u osob z rodin s prokázanou familiární PAH. Pokud byla prokázána mutace BMPR2, je doporučováno genetické testování také u symptomatických příbuzných.
Activin-like kinase typ 1“ (ALK1) a další: ENG, SMAD9, KCNK3
Druhý je gen, nalezený u osob s hereditární hemoragickou teleangiektazií, kódující receptor označovaný jako activin A receptor type II-like kinase-1 (dříve ALK1, nyní ACVRL1) [7]. Také u těchto jedinců je zvýšený výskyt PAH, vztah ke vzniku plicní hypertenze je však volnější. V inovované klasifikaci PH jsou nově zařazeny některé další varianty genů kódujících BMP, u kterých byly prokázány u PAH mutace – SMAD9 a SMAD4, dále pak nový gen s mutacemi prokázanými u FPAH: caveolin (CAV1). CAV1 kóduje membránový protein caveolin, který je přítomný v endoteliích, a bylo prokázáno, že u FPAH jsou v genu CAV1 přítomny mutace – význam tohoto pozorování pro porozumění patofyziologie PAH je dále studován [8]. Jinou novinkou v této oblasti jen zařazení „missense“ variant kaliového kanálu KCNK3, která byla nalezena u nemocných s FPAH, u kterých nebyly prokázány mutace v genu pro BMPR2. Jiným příkladem proteinu z TGFβ rodiny je endoglin (ENG), také v genu pro tento protein byly u PAH prokázány mutace u nemocných s PAH.
Léky a toxiny navozující rozvoj plicní hypertenze
Látek, které mohou navodit PH, je celá řada a v inovované klasifikaci byly rozděleny podle síly důkazů jejich rizika do 4 kategorií: průkaz je jednoznačný, možný, pravděpodobný a nepravděpodobný (tab. 2). V 1. kategorii jsou látky, u nichž bylo spojení s PAH prokázáno ve velkých multicentrických studiích, v 2. kategorii látky, u nichž je průkaz pouze na podkladu jedné kontrolované studie, do kategorie možného vlivu jsou pak zařazeny látky působící obdobným mechanizmem účinku jako látky z předchozích dvou kategorií. V poslední kategorii jsou pak látky, u nichž bylo podezření z možného vlivu na výskyt PH, ale toto podezření bylo následně vyloučeno. V poslední 5 letech byly identifikovány nové látky, zařazené do 1. nebo 2. kategorie. Patří mezi ně benfluorex, který byl sice v Evropě stažen již v roce 1998, ale dále byl používán ve Francii, kde pak bylo popsáno 85 případů PAH při jeho používání [9]. Jinou skupinou látek jsou pak léky používané v léčbě chronických myeloproliferativních onemocnění – inhibitorů tyrozinkinázy. Patří k nim dasatinib, imatinib a nilotinib. Ve francouzském registru PAH bylo dosud zařazeno celkem 13 nemocných s rozvojem PAH z celkového počtu 2 900 nemocných, kteří byli léčeni dasatinibem při chronické myeloidní leukemii [10]. Po vysazení léku došlo u některých nemocných k přechodnému zlepšení hemodynamiky, funkčního stavu i symptomatologie, avšak ani po 9 měsících nedošlo ke kompletní úpravě stavu a 2 nemocní zemřeli. Při léčbě inhibitory tyroyinkinázy je tedy nutné nemocného echokardiograficky cíleně sledovat. Také léčba interferonem může vést ke zvýšení plicní vaskulární rezistence a INFα i INFβ jsou proto zařazovány mezi látky s rizikem rozvoje PAH. Také inhibitory zpětného vychytávání serotoninu (SSRIs) jsou léky, u nichž je jasné riziko rozvoje PAH, řada studií prokázala, že jejich používání během těhotenství zvyšuje riziko vzniku perzistující PAH novorozenců až 6krát [11]. Další léky, u nichž je jisté riziko vzniku PAH, jsou amfetaminy, léky používané v léčbě obezity (fentermin/topiramat), Parkinsonovy choroby (ropinirol) nebo narkolepsie (mazindol).
Tab. 2. Léky a toxiny s rizikem vzniku plicní hypertenze 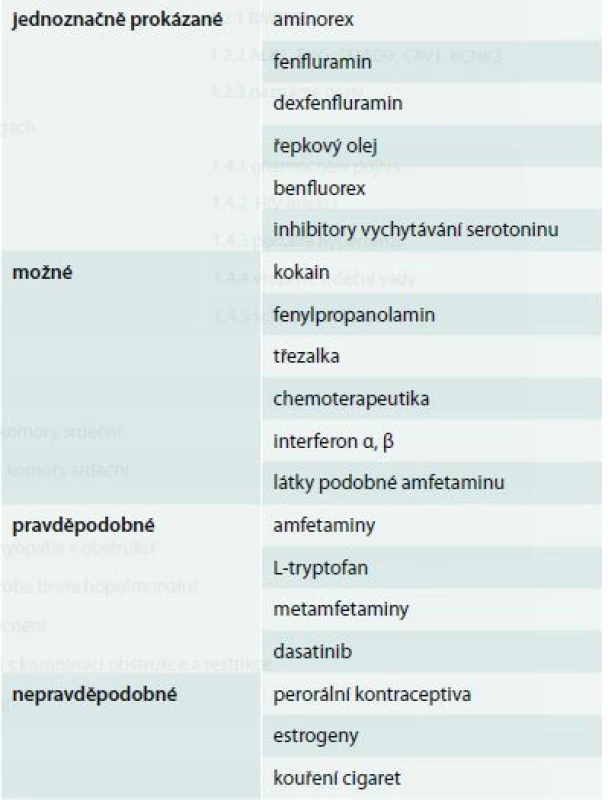
PAH u onemocnění pojiva
Plicní arteriální hypertenze se nachází v menším počtu téměř u všech onemocnění pojivových tkání. U nemocných se sklerodermií je výskyt častější, popisován je v rozmezí 7–12 %, v průměru z řady studií činí pak výskyt 16 % [12]. U ohraničených forem sklerodermie je PAH příčinou úmrtí u více než poloviny nemocných, typický je výskyt u tzv. CREST syndromu [13]. Méně často se PAH nachází u difuzní formy sklerodermie, v těchto případech je to většinou u nemocných s pozitivními antinukleárními protilátkami anti-U3-RNP. Prognóza nemocných se sklerodermií a PAH je nepříznivá a roční mortalita je uváděna až 30 %, u idiopatické PAH je to 15 %. Důležité je preventivní sledování stavu plicní cirkulace, bylo prokázáno, že u nemocných se středním tlakem 21–24 mm Hg mají vysoké riziko rozvoje PAH do 3 let, a musí být proto přísně sledováni [14].
PAH u infekce HIV
Prevalence PAH u nemocných s HIV zůstává stejná již řadu let a je odhadována na 0,5 %, před používáním vysoce aktivní léčby cílené na retroviry byla jednoroční mortalita nemocných s HIV a s PAH až 50 %. V současné době je prognóza významně lepší, 5 roků přežívá až 70 % nemocných s HIV a PAH, asi u 20 % nemocných se s léčbou zlepšují i hemodynamické parametry [15].
PAH provázející portální hypertenzi
U nemocných s portální hypertenzí se vyskytuje PAH (tzv. portopulmonální hypertenze) ve 2–6 %, rozvoj PAH nemá vztah k závažnosti jaterního onemocnění [16]. Prognóza je zde ovlivňována především stupni postižení jater a také kardiálním postižením. Rozdíly v udávaných hodnotách přežívání mezi Evropou a USA je dána především rozdílným stupněm jaterního postižení nemocných, kteří jsou do registrů sledování zařazováni – v USA jsou to nemocní s menším stupněm postižením, proto jsou i výsledky příznivější – 3leté přežívání v Evropě 40 %, v USA 64 %.
PAH u vrozených srdečních vad
V upravené klasifikaci PH je uvedena samostatná klasifikace PAH u vrozených srdečních vad (tab. 3), odhaduje se, že v současné době má PAH asi 10 % nemocných s vrozenou srdeční vadou [17]. Nově jsou také uvedena kritéria pro uzavírání zkratových vad s levo-pravým zkratem (tab. 4).
Tab. 3. Klinická klasifikace plicní arteriální hypertenze u vrozených srdečních vad 
Tab. 4. Kritéria pro uzávěr zkratu u nemocných s vrozenou srdeční vadou a PAH 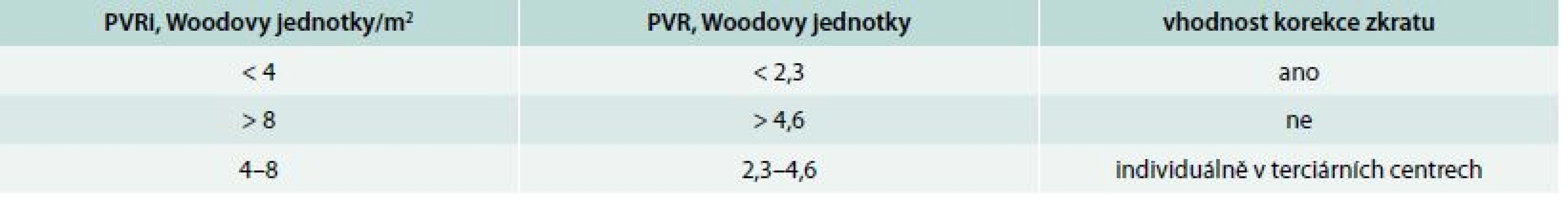
PVR – plicní vaskulární rezistence PVRi – index plicní vaskulární rezistence PAH u schistosomiázy
PAH u schistosomiázy byla zařazena do první skupiny v roce 2008, schistosomiáza dnes představuje nerozšířenější příčinu vzniku PAH. Celosvětově je postiženo více než 200 miliónů nemocných, 10 % z nich trpí hepatosplenickou formou (20 miliónů nemocných) a z nich pak rozvine PAH 5 %, což je přibližně 1 milión nemocných. Mortalita dosahuje až 15 % do 3 roků od diagnózy onemocnění [18].
Skupina 2
Plicní hypertenze u onemocnění levého srdce
V této skupině nedošlo v klasifikaci ke změně proti klasifikaci z roku 2008, zůstává rozdělení na postižení systolické nebo diastolické funkce, třetí skupinu představují nemocní s chlopenními vadami. Nově byly zařazeny pouze stavy obstrukcí výtokového traktu levé komory srdeční a vrozené kardiomyopatie.
Skupina 3
Plicní hypertenze u onemocnění plic a při hypoxii
Také v této skupině nedošlo ke změnám, viz tab. 1.
Skupina 4
Chronická tromboembolická plicní hypertenze (CTEPH)
Další skupina, u které se klasifikace nezměnila, v literatuře přibývá pozitivních referencí o úspěšnosti chirurgické léčby této skupiny nemocných s PH, nově se objevují práce shrnující výsledky léčby využívající balonkové angioplastiky větví a. pulmonalis u nemocných, kteří nejsou indikováni k léčbě chirurgické (endarterektomie plicnice).
Skupina 5
Plicní hypertenze s nejasným nebo multifaktoriálním mechanizmem vzniku
Poslední nesourodá skupina, do které byly ze skupiny první přesunuty chronické hemolytické anémie, a zůstává v ní řada dalších onemocnění. V této skupině nedošlo od klasifikace z roku 2008 kromě uvedeného k zásadním změnám, nově byla ještě zařazena segmentární plicní hypertenze.
Závěr
Klasifikace plicní hypertenze byla zavedena k rozdělení PH do skupin s podobným mechanizmem vzniku, obdobnými změnami hemodynamiky a přístupy v léčbě. Zůstává 5 hlavních skupin: plicní arteriální hypertenze, plicní hypertenze u nemocí levého srdce, u onemocnění plic a při hypoxii, chronická tromboembolická plicní hypertenze a skupina s multifaktoriálním mechanizmem vzniku. Vývoj diagnostiky a léčby v posledních letech doznal pozitivního vývoje u všech uvedených skupin PH.
prof. MUDr. Michael Aschermann, DrSc., FESC, FACC
aschermann@seznam.cz
II. interní klinika 1. LF UK a VFN Praha
www.vfn.cz
Doručeno do redakce 9. 3. 2015
Přijato po recenzi 8. 4. 2015
Zdroje
1. Simonneau G, Gatzoulis MA, Adatia I et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2013; 62(25 Suppl): D34-D41.
2. Lane KB, Machado RD, Pauciulo MW et al. International PPH Consortium. Heterozygous germline mutations in BMPR2, encoding a TGF-beta receptor, cause familial primary pulmonary hypertension. Nat Genet 2000; 26(1): 81–84.
3. Machado RD, Pauciulo MW, Thomson JR et al. BMPR2 haploinsufficiency as the inherited molecular mechanism for primary pulmonary hypertension. Am J Hum Genet 2001; 68(1): 92–102.
4. Thomson JR, Machado RD, Pauciulo MW et al. Sporadic primary pulmonary hypertension is associated with germline mutations of the gene encoding BMPR-II, a receptor member of the TGF-β family. J Med Genet 2000; 37(10): 741–745.
5. Loscalzo J. Genetic clues to the cause of primary pulmonary hypertension. N Engl J Med 2001; 345(5): 367–371.
6. Loyd JE, Butler MG, Foroud TM et al. Genetic anticipation and abnormal gender ratio at birth in familial primary pulmonary hypertension. Am J Respir Crit Care Med 1995; 152(1): 93–97.
7. Trembath RC, Thomson JR, Machado RD et al. Clinical and molecular genetic features of pulmonary hypertension in patients with hereditary hemorrhagic telangiectasia. N Engl J Med 2001; 345(5): 325–334.
8. Soubrier F, Chung WK, Machado R et al. Genetics and genomics of pulmonary arterial hypertension. J Am Coll cardiol 2013; 62(25 Suppl): D13-D21.
9. Savale L, Chaumais MC, Cottin V et al. Pulmonary hypertension with benfluorex exposure. Eur Respir J 2012; 40(5): 1164–1172.
10. Montani D, Bergot E, Gunther S et al. Pulmonary hypertension in patients treated by dasatinib. Circulation 2011; 125(17): 2128–2137.
11. Wijson KL, Zelig CM, Harvey JP et al. Persistent pulmonary hypertension of the newborn is associated with mode of delivery and not with maternal use of selective serotonin reuptake inhibitors. Am J Perinatol 2011; 28(1): 19–24.
12. MacGregor AJ, Canavan R, Knight C et al. Pulmonary hypertension in systemic sclerosis: risk factors for progression and consequences for survival. Rheumatology (Oxford) 2001; 40(4): 453–459.
13. Stupi AM, Steen VD, Owens GR et al. Pulmonary hypertension in the CREST syndrome variant of systemic sclerosis. Arthritis Rheum 1986; 29(4): 515–524.
14. Valerio CJ, Schreiber BE, Handler CE et al. Borderline mean pulmonary artery pressure in patients with systemic sclerosis: transpulmonary gradient predicts risk of developing pulmonary hypertension. Arthritis Rheum 2013; 65(4): 1074–1084.
15. Degado B, Yaici A, Le Pavec J et al. Long term effect of bosentan in patients with HIV-associated pulmonary hypertension. Eur Respir J 2009; 33(1): 92–98.
16. Sitbon O, Lascoux-Combe C, Delfraissy JF et al. Prevalence of HIV-related pulmonary hypertension in the current antiretroviral therapy era. Am J Respir Care Med 2008; 177(1): 108–113.
17. Engelfreit PM, Duffels MG, Möller T et al. Pulmonary arterial hypertension in adults born with a heart septal defect: the Euro Heart Survey on adult congenital heart disease. Heart 2007; 93(6): 682–687.
18. Dos Santos Fernandez CJ, Jardim CV, Hovnanian A et al. Survival in schistosomiasis-associated pulmonary arterial hypertension. J Am Coll Cardiol 2010; 56(9): 715–720.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 5- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Významné životní jubileum prof. MUDr. Jiřího Widimského, DrSc., FESC, FAHA
- Brňáci přejí profesoru Jiřímu Widimskému k životnímu jubileu a vzpomínají na společné chvíle
- Několik vzpomínek až příliš osobních
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Kardiologie ve FN Královské Vinohrady v Praze má 80 let a Kardiocentrum FNKV a 3. LF UK 20 let
- Cholesterol – mýtus nebo největší zabiják?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



