-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Co přináší přehledný článek o důkazech redukce makrovaskulárního rizika u pacientů s aterogenní dyslipidemií?
Zpráva o konsenzu expertů o významu kombinované terapie fenofibrátem a statinem Hana Rosolová
What is the contribution of the review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidemia?
Report on consensus of experts in the importance of the combined therapy by fenofibrate with statinA meeting of European experts in cardiovascular (CV) disease and lipids was convened in Paris, November 2014, where an important problem of preventive cardiology – residual vascular risk done by atherogenic dyslipidemia (AD) – was discussed. On the basis of discussion have the experts summarised a consensus concerning AD, its CV risk and up to date evidence of combined therapy with statin and fenofibrate on CV risk. Atherogenic dyslipidemia should be the secondary aim of dyslipidemia treatment, because it is a reason of residual vascular risk. Non-HDL-cholesterol should be the secondary target of AD treatment, which is a most unexpensive and easiest marker of residual vascular risk. Combined therapy with statin and fenofibrate is safe, well tolerated and reduces plasma atherogenity and CV events in patients with AD and high CV risk, type 2 diabetes or metabolic syndrome.
Key words:
atherogenic dyslipidemia – cardiovascular risk – combined therapy – fenofibrate – statins – triglycerides
Autoři: Hana Rosolová
Působiště autorů: Centrum preventivní kardiologie II. interní kliniky LF UK a FN Plzeň, přednosta prof. MUDr. Jan Filipovský, CSc.
Vyšlo v časopise: Vnitř Lék 2015; 61(11): 971-975
Kategorie: Přehledné referáty
Souhrn
V listopadu roku 2014 se konal v Paříži mítink evropských expertů v kardiovaskulárních (KV) onemocněních a lipidech, na kterém se diskutoval závažný problém preventivní kardiologie – reziduální vaskulární riziko dané aterogenní dyslipidemií (AD), tj. zvýšenými triglyceridy a sníženým HDL-cholesterolem. Experti přijali na základě diskuse konsenzus o vlivu AD na KV riziko a o dosud existujících důkazech o snížení KV rizika kombinovanou léčbou staninem a fenofibrátem. Aterogenní dyslpidemie by měla být sekundárním cílem léčby dyslipidemií, protože se podílí na makrovaskulárním i mikrovaskulárním reziduálním riziku. Sekundárním cílem léčby je non-HDL-cholesterol jako nejlevnější a nejdostupnější marker reziduálního vaskulárního rizika. Kombinovaná terapie statinem a fibrátem je bezpečná, dobře tolerovaná, snižuje aterogenitu plazmy a výskyt KV příhod u pacientů s AD a vysokým KV rizikem, diabetem 2. typu nebo metabolickým syndromem.
Klíčová slova:
aterogenní dyslipidemie – fenofibrát – kardiovaskulární riziko – kombinovaná terapie – statiny – triglyceridyÚvod
V září roku 2015 byl publikován konsenzus expertů v kardiovaskulárních (KV) chorobách a lipidech. Konsenzus vznikl na zasedání konaném v listopadu roku 2014 v Paříži [1]. Hlavním smyslem zasedání bylo diskutovat současné poznatky o aterogenní dyslipidemii (AD), o jejím KV riziku i o důkazech z velkých studií o vlivu kombinované léčby fenofibrátem a statinem na redukci makrovaskulárního rizika u pacientů s AD.
Aterogenní dyslipidemie
Aterogenní dyslipidemie (AD) je charakterizovaná zvýšenou hladinou celkových triglyceridů (TG) a VLDL TG, sníženou hladinou HDL-cholesterolu, zatímco LDL-cholesterol může být lehce zvýšený nebo v normálních mezích. Částice LDL-cholesterolu u pacientů s AD jsou menší a více denzní, a tím také více aterogenní, podobně je tomu i u částic HDL-cholesterolu. Tato dyslipidemie se vyskytuje především u pacientů s diabetes mellitus 2. typu (DM2T) nebo u pacientů s metabolickým syndromem (MS). Na rozdíl od hypercholesterolemie (zvýšení LDL-cholesterolu), o níž existují jasná data o kauzální asociaci mezi koncentrací LDL-cholesterolu a výskytem aterosklerózy a KV příhod, vztah mezi AD a KV chorobami není tak snadno vysvětlitelný. U AD jsou částice LDL-cholesterolu i HDL-cholesterolu velmi heterogenní; liší se velikostí, denzitou, tvarem, apolipoproteiny na svém povrchu, a tím mají různé vlastnosti a následně různé funkce v lipidovém metabolizmu i v aterogenezi.
V tomto dokumentu jsou uvedeny všechny klíčové studie, ve kterých byla prokázána aterogenita a zvýšené KV riziko u pacientů s vyššími TG nebo nižším HDL-cholesterolem. Jedná se o známé studie, jako např. PROVE IT-TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy – Thrombolysis in Myocardial Infarction) [2] nebo kodaňské studie (Copenhagen City Heart Study, Copenhagen General Population Study) [3], ACCORD-Lipid (Action to COntrol cardiovascular Risk in Diabetes) [4], IDEAL (Incremental Decrease in End Points through Aggressive Lipid Lowering) a TNT (Treating to New Targets) [5]. V některých studiích byly sledované TG nalačno, v některých postprandiálně. Ve všech studiích se ukázalo, že vyšší TG jsou v asociaci s vyšším výskytem KV příhod a vyšším úmrtím; kombinace vysokého LDL-cholesterolu a vyšších TG (PROVE IT TIMI 22) stejně jako kombinace vyšších TG a nízkého HDL-cholesterolu (ACCORD-Lipid) jsou bez pochyby spojeny s nejvyšším KV rizikem. Synergický vliv vyšších TG a nízkého HDL-cholesterolu uvádí tab. 1 [6].
Tab. 1. Synergický účinek vyšších TG a nízkého HDL-cholesterolu na reziduální kardiovaskulární riziko u pacientů s cílovou hodnotou LDL-cholesterolu. 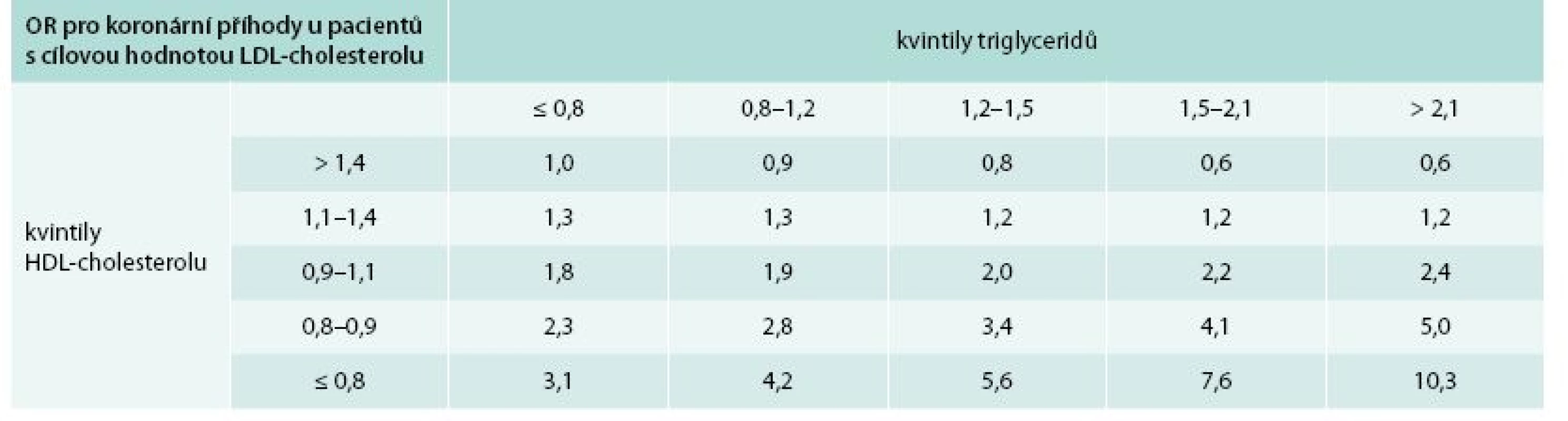
OR (odds ratio/poměr šancí) vzniku koronární příhody u 345 pacientů s LDL-cholesterolem < 2,1 mmol/l. Pacienti v nejvyšším kvintilu TG a nejnižším kvintilu HDL-cholesterolu mají 10krát vyšší riziko vzniku koronární příhody ve srovnání s pacienty v nejvyšším kvintilu HDL-cholesterolu a nejnižším kvintilu TG. Upraveno podle [6]. Snížení LDL-cholesterolu zůstává primárním cílem v prevenci KV chorob, avšak i u pacientů s nízkým LDL-cholesterolem dochází k další progresi aterosklerózy, jak prokázala nedávná metaanalýza studií, ve kterých byla použita intravaskulární ultrasonografie (IVUS); právě u pacientů s vyššími TG a vyšším apolipoproteinem B docházelo k progresi plátů, z čehož vyplývá, že je třeba ovlivnit nejen LDL-cholesterol [7]. Stejně tak existují důkazy, že AD je v asociaci s vyšším rizikem pro ischemické cévní mozkové příhody. Prospektivní randomizované studie PERFORM (Prevention of Cerebrovascular and Cardiovascular Events of Ischemic Origin with Terutroban in Patients with a History of Ischemic Stroke or Transient Ischemic Attack) a SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels) u pacientů po cévní mozkové příhodě léčených statiny prokázaly, že pacienti s AD měli vyšší reziduální vaskulární riziko ve srovnání s pacienty bez AD [8,9].
Zdá se, že právě remnanty částic bohatých na TG (tj. remnanty VLDL, IDL) mají také vztah ke KV riziku. Největší důkazy pocházejí z již zmíněných kodaňských studií. Autoři těchto studií prokázali, že remnantní cholesterol (tj. cholesterol obsažený ve zmíněných remnantech) je nezávislý rizikový faktor pro KV příhody [10,11]. Také subanalýza studie ACCORD-Lipid prokázala větší pokles postprandiálních TG u pacientů léčených kombinací simvastatinu s fenofibrátem ve srovnání s pacienty léčenými pouze statinem [12].
Evropská doporučení pro léčbu dyslipidemií z roku 2011 (EAS a ESC) uvádějí non-HDL-cholesterol jako sekundární cílovou hodnotu v léčbě dyslipidemií u pacientů s vyššími TG a DM, MS nebo chronickým renálním onemocněním. Úprava non-HDL-cholesterolu je doporučena u pacientů s velmi vysokým celkovým KV rizikem, pokud již dosáhli cílové hodnoty LDL-cholesterolu. Cílová hodnota non-HDL-cholesterolu je u velmi vysokého rizika < 2, 6 mmol/l, u vysokého KV rizika < 3,3 mmol/l. Výsledky metaanalýzy u více než 62 000 pacientů léčených statiny ukázaly, že pacienti, kteří dosáhli cílového LDL-cholesterolu, ale nedosáhli non-HDL-cholesterolu, měli o 32 % vyšší riziko KV příhod ve srovnání s pacienty, kteří dosáhli obou cílových ukazatelů [13]. Non-HDL-cholesterol lze tedy považovat za dobrý, nebo dokonce lepší marker KV rizika, než je LDL-cholesterol. Non-HDL-cholesterol je ovlivněn primárně lipoproteiny bohatými na TG, a proto je klíčový v ovlivnění KV rizika u pacientů s AD.
V článku evropských expertů jsou zmíněny studie, které podávají důkaz o vztahu mezi AD a rizikem mikrovaskulárních komplikací u pacientů s DM2T (diabetickou retinopatií, nefropatií a neuropatií); nejnovější z nich je studie REALIST (REsiduAL risk, LIpids and Standard Therapies), která proběhla ve 13 zemích světa u 2 535 pacientů s DM2T. I v této studii byla AD prokázána jako nezávislý rizikový faktor především pro diabetickou nefropatii, méně významně pro retinopatii a nejméně pro neuropatii [14]. Ze všech důkazů vyplývá, že ovlivnění AD jako přídatná terapie k léčbě základních rizikových faktorů by byla správná cesta k ovlivnění nejen makrovaskulárních, ale i mikrovaskulárních diabetických komplikací. Přesto léčba fenofibrátem v monoterapii i v kombinaci se simvastatinem u diabetiků 2. typu zařazených do studií FIELD a ACCORD-Lipid snížila progresi mikrovaskulárních komplikací nezávisle na přítomnosti AD. Předpokládají se proto i jiné mimolipidové účinky fibrátů (viz níže).
Fibráty
Fibráty jsou deriváty kyseliny fibrové, které působí jako exogenní ligandy nukleárních receptorů PPARα (peroxisome-proliferator activated receptors – receptory aktivované peroxizomálními receptory). Tyto receptory se v jádrech buněk účastní regulace metabolizmu lipidů a také funkce buněk cévního systému. Fibráty zvyšují transkripci apoA a podporují první fázi reverzního transportu cholesterolu (zvyšují odebírání cholesterolu z HDL částic v játrech a přebírání cholesterolu z periferních buněk do nezralých HDL částic). Fibráty stimulují expresi lipoproteinové lipázy a současně inhibují expresi jejího inhibitoru – apoCIII. Stimulují expresi genu pro vychytávání volných mastných kyselin v játrech, jejich transport do mitochondrií a jejich beta-oxidaci. To vše má za následek snížení koncentrace TG v průměru o 30 %, zvýšení HDL-cholesterolu o 15 % a remodelaci LDL částic (ve prospěch velkých méně denzních LDL částic). Mezi pleiotropií účinky fibrátů patří jejich protizánětlivé působení; bylo prokázáno, že snižují koncentraci C-reaktivního proteinu, fibrinogenu a interleukinu 6.
Kombinace statinu s fenofibrátem byla opakovaně testována a zhodnocena jako dobře tolerovaná kombinovaná hypolipidemická léčba, která upravuje lipidový profil tak, že snižuje aterogenitu plazmy. Např. ve studii SAFARI (Effectiveness and Tolerability of Simvastatin plus Fenofibrate for Combined Hyperlipidemia), která randomizovala více než 600 pacientů se smíšenou dyslipidemií k monoterapii simvastatinem nebo ke kombinované terapii simvastatinem a fenofibrátem, byla větší redukce TG (o 24 %) a LDL-cholesterolu (o 6 %) a větší zvýšení HDL-cholesterolu (o 9 %) u kombinované léčby ve srovnání s monoterapií simvastatinem. Ve skupině léčené kombinací statinu a fibrátu byla prokázána významná redukce malých denzních LDL částic [15].
V článku jsou komentovány známé studie FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) a ACCORD-Lipid; do obou studií byli zařazeni pacienti s DM2T, kteří ale ne všichni byli z klinického hlediska (tj. podle koncentrací lipidů) vhodní k indikaci fenofibrátu. Ve studii FIELD byl fenofibrát indikován v monoterapii vs placebo, ale jiná hypolipidemika (většinou statin) se mohla volně přidávat. Následkem toho bylo v placebové skupině více pacientů léčených statiny než ve skupině léčené fenofibrátem, a to mohlo samozřejmě negativní výsledky v ovlivnění kombinovaného KV cíle zkreslit [16]. Ve studii ACCORD byla sledovaná kombinace statinu s fenofibrátem vs monoterapie statinem. Primární kombinovaný KV cíl studie opět nebyl významně ovlivněn. Pokud se však z této studie vybrali předdefinovaní pacienti s AD (TG ≥ 2,3 a HDL-cholesterolu < 0,9 mmol/l), fenofibrát v kombinaci se statinem významně snížil kombinovaný cíl (KV úmrtí, nefatální infarkt myokardu a nefatální cévní mozková příhoda) relativně o 31 %. Ve studii FIELD vedla 5letá léčba fenofibrátem k významnému poklesu potřeby laserové terapie (-31 %) pro progresi diabetické retinopatie, k 15% snížení progrese albuminurie a k významnému poklesu netraumatické amputace končetin. Ve studii ACCORD-eyes bylo zjištěno, že fenofibrát v kombinaci se simvastatinem redukoval progresi diabetické retinopatie o 40 % [17].
Metaanalýza fibrátových studií provedená Sacksem v roce 2010 jasně ukázala, že pokud se fibráty indikují pacientům s AD, pak významně snižují výskyt KV příhod až o 35 % (graf 1) [18].
Graf 1. Metaanalýza fibrátových studií. Upraveno podle [18] ![Metaanalýza fibrátových studií. Upraveno podle [18]](https://pl-master.mdcdn.cz/media/image/3fc7003c27c796df0ff6ec72c5224ef0.jpg?version=1537793622)
A – podskupiny pacientů s aterogenní dyslipidemií (TG ≥ 2,3 mol/l, HDL-cholesterol < 0,9 mol/l) B– podskupina všech ostatních pacientů ACCORD – Action to Control Cardiovascular Risk in Diabetes – lipid trial FIELD – Fenofibrat Intervention and Event Lowering in Diabetes BIP – Bezafibrate Infarction Prevention HHS – Helsinky Heart Study VA-HIT – Veterans Affairs – HDL Intervention Trial Závěr
Experti zmíněného konsenzu uvádějí, že bezpečnost kombinované léčby fenofibrátem se statinem je vysoká, a proto se není třeba obávat současného podání obou léků v jeden den. V konsenzu je dále uvedeno, že výsledky z observačních klinických studií i dlouhodobých intervenčních studií jsou pro kombinaci statinu s fenofibrátem dostatečné u pacientů s vyjádřenou aterogenní dyslipidemií, u nichž lze s největší pravděpodobností očekávat klinický prospěch ve smyslu redukce makrovaskulárních (aterosklerotických) příhod. Je třeba určité opatrnosti při výběru pacienta k této léčbě pro potenciální riziko pankreatitidy.
Aterogenní dyslipidemie je relativně častá u nemocných s inzulinovou rezistencí, a i když byla její patofyziologie v poslední době více objasněna, jsou zde stále ještě určité nejasnosti. Další výzkum si zasluhuje i léčba AD. Primárním cílem léčby dyslipidemií je v současné době dosažení cílové hodnoty LDL-cholesterolu, a proto lékem první volby jsou statiny, eventuálně kombinace statinu s dalšími hypolipidemiky ovlivňujícími LDL-cholesterol. Po dosažení cílového LDL-cholesterolu je možno zahájit kombinovanou terapii AD nebo vyšších TG kombinací statinu s fenofibrátem. Diagnostika AD se dělá většinou z lačné krve, i když postprandiální hodnota TG lépe koreluje s lipoproteiny bohatými na TG i s KV rizikem. Za nejlepší a nejjednodušší marker reziduálního vaskulárního rizika se považuje non-HDL-cholesterol, který je zároveň terapeutickým cílem při léčbě AD; jeho cílová hodnota závisí na celkovém KV riziku. Zjišťování apolipoproteinu B není dostupné všude, a proto se nepreferuje. Experti dále připomínají, že komplexní ovlivnění všech rizikových faktorů je správný přístup v prevenci KV onemocnění, tj. úprava životního stylu, léčba LDL-cholesterolu a individuálně AD, krevního tlaku i glykemie.
Je třeba si uvědomit, že každý konsenzus je obrazem shody nebo souhlasu řady expertů s rozdílnými názory na určitý problém. Pouze to, na čem se všichni odborníci shodnou, je uvedeno v konsenzu. Konsenzus je užitečný v tom, že shrnuje všechny současné důležité (a třeba i kontroverzní) informace určitého problému. Všechna konečná tvrzení jsou většinou podložena výsledky studií (evidence-based medicine) nebo zkušeností expertů. Pokud výsledky studií chybí, konsenzus na to upozorní. Konsenzus se samozřejmě bude modifikovat po dosažení dalších výsledků v daném problému. Konsenzus je často předvojem doporučení (guidelines), která zahrnují širší problematiku (např. léčbu všech dyslipidemií apod) a která již striktně hodnotí důkazy z evidence-based medicine.
Co lze tomuto přehledu o konsenzu expertů o kombinované léčbě (statinem a fenofirbátem) aterogenní dyslipidemie vytknout? Myslím, že jeho větší rozsah, přičemž se některé informace opakují. Přestože byly provedeny studie i s jinými fibráty (viz metaanalýza), konsenzus se v podstatě zabývá pouze fenofibrátem; snad je to tím, že je v současnosti nejpoužívanějším fibrátem a že v největších studiích léčby AD se také používal fenofibrát. V názvu konsenzu je uvedeno, že se bude jednat o důkazy v redukci makrovaskulárních komplikací, ale přitom je celý odstavec v konsenzu věnován i mikrovaskulárním komplikacím a jejich vztahu k AD, a proto si myslím, že by to v názvu mělo být uvedeno. Podle mého názoru není non-HDL-cholesterol tím nejlepším markerem reziduálního vaskulárního rizika, i když uznávám, že je nejjednodušším a nejdostupnějším. Výpočet aterogenního indexu plazmy [AIP = log (TG/HDL-cholesterol)] také není složitý v dnešní době PC (výpočet snadno provede jakákoliv biochemická laboratoř) a jeho výpovědní hodnota je mnohem větší z hlediska aterogenity i kardiovaskulárního rizika [19]. Je však třeba zdůraznit, že tento konsenzus upozorňuje na důležitý problém v prevenci KVO, tj. na lipidové reziduální vaskulární riziko, které je tvořeno non-LDL dyslipidemiemi a kterému není v současné době v klinické praxi věnována téměř žádná pozornost.
prof. MUDr. Hana Rosolová, DrSc., FESC
rosolova@fnplzen.cz
Centrum preventivní kardiologie II. interní kliniky LF UK a FN, Plzeň
www. fnplzen.cz
Doručeno do redakce 16. 10. 2015
Přijato po recenzi 11. 11. 2015
Zdroje
1. Aguiar C, Alegria E, Bonadonna RC et al. A review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidemia: A report from an expert consensus meeting on the role of fenofibrate-statin combination therapy. Atheroscl Suppl 2015; 19 : 1–12. Dostupné z DOI: <http://dx.doi.org/10.1016/S1567–5688(15)30001–5>.
2. Miller M, Cannon CP, Murphy SA et al. Impact of triglyceride levels beyond LDL cholesterol after acute coronary syndrome in the PROVE IT – TIMI 22 trial. J Am Coll Cardiol 2008; 51(7): 724–730.
3. Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet 2014; 384(9943): 626–635.
4. Ginsberg HN, Elam MB, Lovato LC et al. ACCORD Study Group. Effects of combination lipid therapy in type2 diabetes mellitus. N Engl J Med 2010; 362(17): 1563–1574. Erratum in: N Engl J Med 2010; 362(18): 1748.
5. Faergeman O, Holme I, Fayyad R et al. Plasma triglycerides and cardiovascular events in the Treating to New Targets and Incremental Decrease in End Points through Aggressive Lipid Lowering trials of statins in patients with coronary artery disease. Am J Cardiol 2009; 104(4): 459–463.
6. Carey VJ, Bishop L, Laranjo N et al. Contribution of high plasma triglycerides and LDL cholesterol to residual risk of coronary heart disease after establishment of LDL cholesterol control. Am J Cardiol 2010; 106(6): 757–763.
7. Bayturan O, Kapadia S, Nicholls SJ et al. Clinical predictors of plaque progression despite very low levels of LDL cholesterol. J Am Coll Cardiol 2010; 55(24): 2736–2742.
8. Di Angelantonio E, Sarwar N, Perry P et al. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302(18): 1993–2000.
9. Sirimarco G, Labreuche J, Bruckert E et al. Atherogenic dyslipidemia and residual cardiovascular risk in statin-treated patients. Stroke 2014; 45(5): 1429–1436.
10. Varbo A, Benn M, Tybjaerg-Hansen A et al. Remnant cholesterol as a causal risk factor for ischemic heart disease. J Am Coll Cardiol 2013; 61(4): 427–436.
11. Jorgensen AB, Frikke-Schmidt R, West AS et al: Genetically elevated non-fasting triglycerides and calculated remnant cholesterol as causal risk factors for myocardial infarction. Eur Heart J 2013; 34(24): 1826–1833.
12. Reyes-Soffer G, Ngai CI, Lovato L et al. Effect of combination therapy with fenofibrate and simvastatin on postprandial lipemia in the ACCORD lipid trial. Diabetes Care 2013; 36(2): 422–428.
13. Zambon A, Puato M, Faggin E et al. Lipoprotein remnants and dense LDL cholesterol are associated with features of unstable plaque: a flag for non-HDL-C. Atherosclerosis 2013; 230(1): 106–109.
14. Scks FM, Hermans MP, Fioretto P et al. Association between plasma triglycerides and HDL cholesterol and microvascular kidney disease and retinopathy in type 2 diabetes mellitus: a global case-control study in 13 countries. Circulation 2014; 129(9): 999–1008.
15. Grundy S, Vega GL, Juan Z et al. Effectiveness and tolerability of Simvastatin plus Fenofibrate for combined hyperlipidemia (The SAFARI Trial). Am J Cardiol 2015; 95(4): 462–468.
16. Keech AC, Simek RJ, Barter P et al. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005; 366(9500): 1849–1861.
17. Wright AD, Dodson PM. Medical management of diabetic retinopathy: fenofibrate and ACCORD Eye studies. Eye (Lond) 2011; 25(7): 843–849.
18. Sacks FM, Carey VJ, Fruchart JC et al. Combination lipid therapy in type 2 diabetes. N Engl J Med 2010; 363(7): 684–692.
19. Dobiášová M. AIP aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe. Vnitř Lék 2006; 52(1): 64–71.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Ateroskleróza, lipidy a vnitřní lékařství
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Stanovisko k nové moderní hypolipidemické léčbě
- Praktický přístup ke statinové intoleranci
- Včasná diagnostika familiární hypercholesterolemie v České republice v rámci projektu MedPed
- Inhibice PCSK9 jako nová naděje pro nemocné s familiární hypercholesterolemií, statinovou intolerancí a posléze pro všechny pacienty v nejvyšším kardiovaskulárním riziku? Zaměřeno na alirokumab – Praluent®
- Evolokumab a projekt PROFICIO: první výsledky
- Postavení lipoproteinové aferézy v současnosti
- Vliv kombinace simvastatinu s ezetimibem na krevní lipidy a na kardiovaskulární příhody u diabetiků (komentář k výsledkům subanalýzy studie IMPROVE-IT)
-
Co přináší přehledný článek o důkazech redukce makrovaskulárního rizika u pacientů s aterogenní dyslipidemií?
Zpráva o konsenzu expertů o významu kombinované terapie fenofibrátem a statinem Hana Rosolová - Studie TECOS, EXAMINE a SAVOR – čím se liší a co přinášejí?
- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- I. sympozium pracovní skupiny Kardio 35 České kardiologické společnosti
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Postavení lipoproteinové aferézy v současnosti
- Praktický přístup ke statinové intoleranci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



