-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postavení lipoproteinové aferézy v současnosti
Position of lipoprotein apheresis in present
Lipoprotein apheresis (LA) is an effective treatment method the patients with severe hypercholesterolemia, resistant to the standard therapy. LA is an extracorporeal elimination technique, which specifically removes low density lipoprotein (LDL) cholesterol from the circulation. At present, lipoprotein apheresis, combined with high-dose statin and ezetimibe therapy, is the best available means of treating patients with homozygous and statin refractory heterozygous familial hypercholesterolaemia (FH). However, the extent of cholesterol-lowering achieved is often insufficient to meet the targets set by current guidelines. The recent advent of new classes of lipid-lowering agents provides new hope that the latter objective may now be achievable. These compounds act either by reducing low density lipoprotein (LDL) cholesterol production by inhibiting apolipoprotein B synthesis with an antisense oligonucleotide (mipomersen), or by inhibiting microsomal triglyceride transfer protein (lomitapid), or by enhancing LDL catabolism via monoclonal antibody-mediated inhibition of the activity of proprotein convertase subtilisin/kexin 9 (PCSK9 – alirocumab, evolocumab etc). The promising is the combination of LDL-apheresis with new drugs, namely for its potential to further decrease of LDL-cholesterol between apheresis. Depending on the outcome of current trials, it seems likely that these compounds, used alone or combined with lipoprotein apheresis, will markedly improve the management of refractory FH.
Key words:
alirocumab – atherosclerosis – cardiovascular disease – evolocumab – hypercholesterolemia –lipoprotein apheresis – lomitapid – mipomersen
Autoři: Vladimír Bláha 1; Milan Bláha 2; Miriam Lánská 2; Eduard Havel 1; Pavel Vyroubal 1; Zdeněk Zadák 1; Michal Vrablík 3; Jan Piťha 4; Pavel Žák 2; Luboš Sobotka 1
Působiště autorů: III. interní gerontometabolická klinika LF UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc. 1; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, CSc. 2; Centrum preventivní kardiologie III. interní kliniky 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 3; Institut klinické a experimentální medicíny Praha, ředitel MUDr. Aleš Herman, Ph. D. 4
Vyšlo v časopise: Vnitř Lék 2015; 61(11): 958-964
Kategorie: Přehledné referáty
Souhrn
Lipoproteinová aferéza (LA) je metodou volby v léčbě pacientů se závažnou hypercholesterolemií, kteří jsou rezistentní na konvenční terapii. Patří mezi extrakorporální eliminační metodiky a usiluje o pokud možno specifické odstranění low density lipoprotein (LDL) cholesterolu z cirkulující krve. LA v kombinaci s vyššími dávkami statinů a ezetimibem představuje v současnosti nejúčinnější způsob léčby homozygotů a statin-refrakterních heterozygotů familiární hypercholesterolemie (FH). Reziduální kardiovaskulární riziko těchto pacientů zůstává přesto vysoké, zejména proto, že i přes zmíněnou léčbu nelze dosáhnout cílových hodnot lipidů podle současných doporučení. Novou nadějí pro pacienty jsou nové lékové skupiny hypolidemik. Jejich účinek je založen na snížení tvorby LDL inhibicí syntézy apolipoproteinu B pomocí antisense oligonukleotidu (mipomersen), inhibicí mikrosomálního triglyceridového transportního proteinu (lomitapid), nebo posílením katabolizmu LDL vlivem monoklonální protilátek, inhibujících aktivitu proprotein konvertázy subtilizin/kexin 9 (PCSK9 – alirokumab, evolokumab aj). Kombinace LA s novými léčivy je slibná, zejména pro potenciál dalšího snížení LDL-cholesterolemie mezi jednotlivými aferézami. Předběžné výsledky probíhajících studií naznačují, že nová hypolipidemika v kombinaci s LA nebo samostatně podstatně obohatí a vylepší léčbu refrakterní FH.
Klíčová slova:
alirokumab – ateroskleróza – evolokumab – hypercholesterolemie – kardiovaskulární onemocnění – lipoproteinová aferéza – lomitapid – mipomersenÚvod
Princip léčby pomocí lipoproteinové aferézy (LA) spočívá v selektivním odstranění lipoproteinů obsahujících apolipoprotein (apo) B z plazmy, čímž dojde ke snížení LDL-cholesterolu o 70 % až 80 % [1]. Léčba pomocí LA však také vede k signifikantnímu snížení další aterogenních lipoproteinů, např. chylomikronů, very-low-density lipoproteinu (VLDL) a lipoproteinu (a) – Lp (a). V závislosti na typu použití metody LA dochází dále k odstraňování dalších substancí – např. fibrinogenu, CRP, selektinů a některých cytokinů spojených s prozánětlivým aterogenním profilem a kardiovaskulárním rizikem [2–4].
Aferéza je slovo řeckého původu (aphairesis/apheresis = odebrání). Znamená extrakorporální odstranění částí krve a je využívána v různých modifikacích v hematologii, imunologii, nefrologii a lipidologii. První snahy o eliminaci cholesterolu byly uskutečněny pomocí neselektivní plazmaferézy v roce 1964 v Londýně Myantem a Lewisem u dítěte s homozygotní formou FH, ale nebyly úspěšné. Skutečný průlom představovalo úsilí de Gennese et al [5], kterému se podařilo v Paříži zavést léčbu pomocí plazmaferézy u dospělého homozygota FH. Ačkoliv manuální plazmaferéza odstranila asi 40 % cholesterolu, její opakované provádění bylo náročné a neumožňovalo dlouhodobé použití, a proto de Gennes léčbu plazmaferézou po 4 měsících přerušil. Další pokrok nastal zavedením kontinuálních separátorů krve, které byly schopné zpracovat velké objemy plazmy vysokým průtokem. V roce 1972 použil Turnberg et al [6] separátor krevních tělísek k výměně plazmy u hypercholesterolemických pacientů s biliární cirhózou a následně o 3 roky později začal Thompson et al s léčbou 2 homozygotů FH podobnou metodikou [7]. Výměna plazmy byla potom zavedena do klinického použití v léčbě homozygotů FH v Jihoafrické republice [8] a v USA [9].
První pokusy o selektivní extrakorporální odstranění LDL-cholesterolu byly realizovány sérií venesekcí, s ex vivo smíšením krve s heparinem, navázaných na agarozové částice a s následnou reinfuzí zpět pacientovi [10]. Metoda vede k selektivní vazbě a odstranění LDL, ale celá procedura je zdlouhavá a náročná. Skutečný základ moderní LA byl položen v roce 1981, kdy německý biochemik Stoffel spolu s internistou a klinikem Borbergem [11] zkombinovali dva přístupy a použili separátor krevních tělísek k odstranění plazmy a následně promývali získanou plazmu speciální kolonou obsahující protilátky vázající LDL. Metodu nazvali LDL aferéza. V současnosti používáme spíše pojem lipoproteinová aferéza, protože léčba LA vede k odstranění nejen LDL, ale také dalších lipoproteinů obsahujících apoB, chylomikronů, very-low-density lipoproteinu (VLDL) a lipoproteinu (a) – Lp(a) [12]. Plazmaferéza je z pohledu lipidologie využívána v současné době zejména pro léčbu těžké hypertriglyceridemie [12].
V současnosti je používáno 6 účinných metod k selektivnímu odstranění LDL-cholesterolu (tab. 1). Principy lze jednoduše sumarizovat – LDL-cholesterol lze z krve oddělit buď imunoadsorpcí, iontovou vazbou, filtrací, anebo precipitací. 2 metody odstraňují LDL-cholesterol přímo z plné krve (DALI a dextransulfátová přímá adsorpce), další 4 primárně získávají plazmu buď centrifugací nebo filtrací a s ní dále pracují.
Tab. 1. Přehled současných možností LDL aferézy. 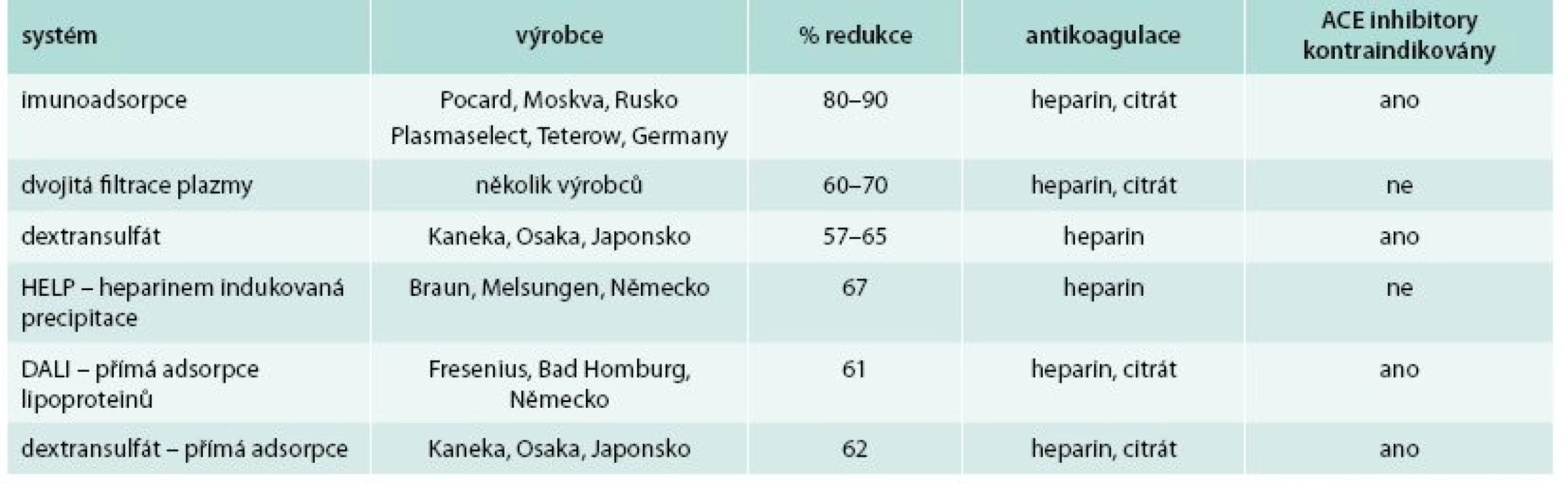
Upraveno dle [13] Akutní snížení LDL-cholesterolu vlivem léčby LA činí od 49 do 76 %, v závislosti na zpracovaném objemu plazmy či krve, průměrně dochází ke snížení o > 60 % a rozdíly mezi jednotlivými metodami jsou relativně malé. Pokud porovnáváme dlouhodobé průměrné snížení LDL-cholesterolu, jde o změnu o 45–52 % oproti bazálním hodnotám [14]. Hemoperfuzní systémy jsou jednodušší než např. metody HELP a dextransulfátová metoda, ale jsou dražší než immunoadsorpce s opakovaně použitelnými kolonami. Pro provádění LA je nutný dostatečný cévní přístup. Nejčastěji se využívá bilaterální antekubitální kanylace periferních žil. Obvykle není nutné použít chirurgicky zhotovené arteriovenózní shunty, kterým se vyhýbáme zejména u dětí nebo u kardiálně kompromitovaných pacientů. K antikoagulaci se využívá citrát a heparin, někdy s iniciálním bolusem heparinu i.v. Celkový výskyt nežádoucích klinických účinků LA nepřesahuje 4 % [15]. Sami jsme zaznamenali komplikace u 3,1 % pacientů, obdobný výsledek udává celosvětový registr WAA (World Apheresis Registry), do nějž údaje o všech výkonech pravidelně hlásíme. Obvykle se jedná o nezávažné nespecifické symptomy, jako je slabost, nauzea, lehká hypotenze zejména tehdy, když extrakorporální objem přesáhne 10 % celkového objemu krve bez dostatečné substituce tekutinami. Mezi závažné nežádoucí účinky patří anafylaktoidní reakce u pacientů, kteří užívají inhibitory angiotenzin-konvertujícího enzymu při dextransulfátové LA. Reakce vzniká v důsledku konverze kininogenu na bradykinin na povrchu dextransulfátu a polyakrylátového gelu kapsle a projevuje se lehkou až závažnou hypotenzí a flushingem. Mezi nežádoucí účinky, které se objevují při dlouhodobé léčbě, patří anémie vyžadující substituci železa a folátu. LA je možné využít i u gravidních žen během těhotenství [16]. Metoda imunoadsorpce a dvojité filtrace plazmy je v tabulce podle Winterse et al [13] modifikována podle vlastních zkušeností; redukce je vyšší nežli podle Winterse, především proto, že zpracováváme větší množství plazmy.
Kritéria pro léčbu LA
V zahraničí nejsou stanovena jednotná indikační kritéria k LA, a liší se tak mezi jednotlivými zeměmi. Všeobecně jsou LA léčení pacienti s diagnózou homozygotní familiární hypercholesterolemie, heterozygotní familiární hypercholesterolemie refrakterní na standardní léčbu nebo při intoleranci ke standardní léčbě, pacienti s klinicky závažným aterosklerotickým postižením a i přes léčbu přetrvávající vysokou hladinou LDL-cholesterolu a pacienti se zvýšením lipoproteinu(a) refrakterní k léčbě. Česká společnost pro aterosklerózu zřídila v roce 2015 pracovní multidisciplinární skupinu, jejímž cílem je zajištění dostupnosti léčby takto postižených pacientů. Skupina vypracovala a navrhla následující kritéria pro lipoproteinovou aferézu [17].
Kritéria pro lipoproteinovou aferézu
- závažná aterogenní dyslipidemie – potvrzená homozygotní a těžká heterozygotní forma familiární hypercholesterolemie (fenotypicky homozygotní)
- progredující aterosklerotické postižení v oblasti koronárních, karotických a končetinových tepen: opakované klinické příhody nebo opakované revaskularizační výkony v těchto povodích nebo nerekonstruovatelný nález na těchto tepnách a klinická manifestace ischemie v daných tepenných povodích
- hladina LDL-cholesterolu opakovaně > 3,0 mmol/l i přes maximální terapii statiny a kombinační terapii dalšími hypolipidemiky, především ezetimibem, ale i fibráty nebo
- absolutní intolerance statinů – vyzkoušeny nejméně 3 statiny nebo
- vysoká hladina Lp(a) > 50 mg/dl
Současné možnosti kombinované hypolipidemické léčby s LA
Současné farmakoterapeutické postupy v léčbě homozygotní a závažné heterozygotní FH zahrnují inhibitory HMGCoA-reduktázy (statiny) v maximálně tolerovatelných dávkách, v kombinaci s ezetimibem a eventuálně s pryskyřicemi [18]. Kombinace maximální dávky atorvastatinu 80 mg a ezetimibu 10 mg denně vedla u homozygotů FH, léčených LA k dalšímu snížení LDL-cholesterolemie o 27,5 % [19], ale zcela výjimečně dokázala léčba dosáhnout cílových hodnot LDL-cholesterolu s ohledem na vysoké riziko. Je jasné, že dosavadní léčba není u řady pacientů dostatečná. V současnosti je LA obvykle prováděna 1krát za 2 týdny, a jen ojediněle každý týden [20]. Frekvence extrakorporálních procedur je determinována závažností aterosklerotického postižení koronárních tepen a aortální chlopně a rychlostí progrese [21]. Alternativní metodou volby je transplantace jater, která s sebou ovšem přináší řadu závažných problémů jako je dostupnost orgánů k transplantaci, riziko spojené s intervencí – doživotní imunosupresivní léčba, možnost chronické rejekce, a dále také možnost nedostatečného efektu, protože LDL receptory nejsou lokalizovány pouze v játrech [22]. Existuje proto možnost perzistence reziduální dyslipidemie, navíc zhoršovaná dlouhodobou imunosupresí, která potom vyžaduje pokračování v hypolipidemické léčbě. Prognóza transplantace jater ze středně - a dlouhodobého hlediska je limitována současných výskytem kardiovaskulárních onemocnění. Ke korekci genetického defektu u homozygotní FH se objevily také snahy o genetickou léčbu, ale výsledky nejsou příliš nadějné a dosud nebyly uvedeny do použití v humánní medicíně [23]. Lipoproteinová aferéza je proto v současnosti jedinou bezpečnou a efektivní léčbu pro homozygoty FH, a v kombinaci s dalšími léky vede ke zpomalení rychlosti nárůstu (rebound) LDL-cholesterolu mezi jednotlivými procedurami ve snaze dosáhnout co nejnižších hodnot LDL-cholesterolemie po co nejdelší období. V japonské studii byl podáván inhibitor absorpce cholesterolu ezetimib 6 homozygotům FH současně s atorvastatinem nebo simvastatinem [24]. S výjimkou 1 pacienta léčba ezetimibem vedla ke statisticky signifikantnímu snížení LDL-cholesterolu po dobu dvou týdnů mezi každou aferézou o průměrných 9,0 % (rozmezí 4,3–12,6 %). Autoři práce shrnují, že ačkoliv efekt ezetimibu nebyl impresivní, jeho využití v kombinaci se statiny je v léčbě homozygotů FH relevantní.
Budoucnost kombinované hypolipidemické léčby s LA
Lipidologie prožívá v současné době fascinující období, v němž se podařilo dovést do klinického využití zcela nové a velice účinné farmakologické postupy, které dokáží snížit produkci LDL-cholesterolu buď omezením syntézy apolipoproteinu B100 (apoB), a to pomocí antisense oligonukleotidů k apoB (mipomersen) nebo inhibicí MTP (mikrosomálníl triglyceridový transportní protein – lomitapid), či posílením katabolizmu LDL prostřednictvím inhibice aktivity proproteinové ckonvertázy subtilizin/kexin 9 (PCSK9). Léčba je efektivní i u homozygotů FH [25–27]. Úřad FDA (US Food and Drug Administration) tyto prostředky schválil ke klinickému využití u homozygotů FH v roce 2012 (antisense oligonukleotid mipomersen a MTP inhibitor lomitapid) v USA, a v roce 2015 byla schválena i léčba pomocí monoklonálních protilátek PCSK9, evolokumabu a alirokumabu. V Evropě byly schváleny k používání lomitapid, evolokumab a alirokumab.
Mipomersen v dávce 200 mg týdně s.c. byl v randomizované dvojitě zaslepené a placebem kontrolované studii podáván u homozygotů FH v kombinaci (add-on) po dobu 26 týdnů. Do studie nebyli zařazeni pacienti léčení LA. Autoři prokázali při léčbě mipomersenem statisticky signifikantní snížení LDL-cholesterolu o 24,7 %. Nejčastějšími nežádoucími účinky byly lokální reakce v místě vpichu, chřipkové příznaky a zvýšení jaterních transamináz. Mipomersen v kombinaci s LA byl také studován u 123 heterozygotů FH s ischemickou chorobou srdeční a maximálně tolerovanou hypolipidemickou léčbou. Mipomersen snížil LDL-cholesterol o 28 %, Lp(a) o 21 %, podávání placeba bylo bez efektu. Léčba mipomersenem vedla k úspěšnějšímu dosahování cílového LDL-cholesterolu (LDL-C), vedla ke snížení počtu pacientů s LDL-C ≥ 4,14 mmol/l z 39 na 2 %, s LDL-C ≥ 3,36 mmol/l z 62 na 16 %, s LDL ≥ 2,59 mmol/l z 98 na 54 %, a s Lp(a) ≥ 60 mg/dl z 39 na 23 %. Autoři tedy uzavírají, že v této skupině pacientů by bylo možné asi u 50 % z nich přerušit léčbu LA [28].
Lomitapid byl v roce 2013 ve studii Cuchelové et al podáván v otevřené studii fáze 3 ve skupině 29 homozygotů FH, mužů i žen [26,32]. Lomitapid byl podáván minimálně 26 týdnů. V souboru bylo celkem 18 pacientů léčeno LA. Dávka lomitapidu byla progresivně zvyšována dle tolerance pacientů od 5 mg až a 60 mg denně, medián byl 40 mg denně. LDL-cholesterol se v průběhu studie snížil o 50 % (z průměrné hodnoty 8,7 mmol/l na 4,3 mmol/l). 16 nemocných dokonce při léčbě lomitapidem dosáhlo cílových hodnot LDL-cholesterolu < 2,6 mmol/l a 9 pacientů dokonce hodnot < 1,8 mmol/l. Snížení LDL-cholesterolu při léčbě lomitapidem bylo obdobné u pacientů, kteří byli i nebyli léčeni současně pomocí LA. Nejčastější nežádoucí účinky byly gastrointestinální obtíže a zvýšení transamináz, které byly reverzibilní a regredovaly po snížení dávky nebo dočasném přerušení léčby lomitapidem. Stefanutti et al [29] studovala vliv kombinované léčby LA a lomitapidem v dávce 5 mg až 60 mg denně u homozygotů FH. V úvodu byl lomitapid podáván po dobu 26 týdnů části pacientů, která nebyla léčena LA. Titrace dávky lomitapidu probíhala v úvodu studie a následně byli všichni pacienti sledováni celkem 78 týdnů. Před zahájením léčby lomitapidem bylo ze souboru celkem 29 pacientů 18 (62 %) léčeno LA. 23 pacientů (z toho 13 léčených LA) dokončilo sledování do 26. týdne. Léčba lomitapidem byla stejně efektivní jako LA. Ve snížení LDL-cholesterolemie nebyly signifikantní rozdíly (pokles LDL-cholesterolu činil 48 % při léčbě LA, 55 % při léčbě lomitapidem (p = 0,545). Po 26 týdnech byl v rámci protokolu pacientům léčeným LA přidán do léčby také lomitapid. Léčba lomitapidem měla aditivní hypolipidemický vliv. U 6 ze 13 pacientů (46 %) léčených LA bylo možné upravit režim LA: 3 pacienti ukončili léčbu LA (graf 1: A,B,C) a u dalších 3 pacientů byla snížena frekvence LA (graf 1: D, E, F).
Graf 1. Vliv kombinované léčby LA alomitapidem na LDL-cholesterolemii u homozygotů FH. 
Upraveno podle [29] Po zavedení léčby lomitapidem ukončili léčbu LA 3 pacienti (A, B, C) a u dalších 3 pacientů byla snížena frekvence LA (D, E, F). Monoklonální protilátky proti PCSK9
Protilátky proti proteinu PCSK9 (proprotein convertase subtilisin/kexin 9) jsou v současnosti asi nejsledovanější lékovou skupinou v lipidologii. Prokázaly, že snižují LDL-cholesterol na hodnoty, které jsou statiny prakticky nedosažitelné. Letos, tedy r. 2015, byly schváleny ke klinickému využití jak v USA, tak v Evropě. Protilátky proti proteinu PCSK9 mají vysokou afinitu a specificitu k proprotein konvertáza subtilizinu/kexinu typu 9. PCSK9 se váže na receptory pro lipoprotein s nízkou hustotou (low density lipoprotein receptor – LDLR) na povrchu hepatocytů, což podporuje degradaci LDLR v játrech. LDLR je hlavním receptorem, který vychytává cirkulující LDL-cholesterol, proto pokles exprese LDLR pomocí PCSK9 má za následek vyšší hladiny LDL-cholesterolu v krvi. Inhibicí navázání PCSK9 na LDLR zvyšují tyto léky počet LDLR dostupných k vychytávání LDL, čímž se snižuje hladina LDL-cholesterolu. LDLR také váže na triglyceridy bohaté VLDL remnantní lipoproteiny a lipoproteiny střední hustoty (IDL). Proto léčba monoklonálními protilátkami proti PCSK9 může snížit hladinu těchto remnantních lipoproteinů, což se projeví snížením apolipoproteinu B, nonHDL-cholesterolu a triglyceridů (TG). Podání monoklonální protilátky proti PCSK9 má také za následek snížení lipoproteinu (a). Stein et al [27] podával monoklonální protilátku evolokumab v otevřené multicentrické studii homozygotům FH. 8 pacientů bylo receptor-negativních nebo receptor-defektních, byli léčeni stabilní hypolipidemickou konvenční léčbou a aditivně také 420 mg evolokumabu subkutánně každé 4 týdny po ≥12 týdnů, a poté 420 mg každé 2 týdny následujících 12 týdnů. Ti pacienti, kteří byli léčení LA, v léčbě pokračovali. Při výše uvedené léčbě došlo k poklesu LDL-cholesterolu u 6 LDL receptor-defektních pacientů o 19,3 resp. 26,3 % při podávání injekcí evolokumabu po 4, resp. 2 týdnech. Evolokumab neměl žádný prokazatelný účinek u 2 receptor-negativních pacientů. Nejčastější nežádoucí účinky byly infekce horních cest dýchacích, chřipka, gastroenteritida a nazofaryngitida. Léčbu evolokumabem u pacientů s familiární (homozygoti i heterogyzoti) FH při současné léčbě pomocí LA dále hodnotí probíhající otevřená multicentrická studie TAUSSIG (Trial Assessing Long Term Use of PCSK9 Inhibition in Subjects With Genetic LDL Disorders) [30]. Léčba je podávána pacientům v dávce 420 mg evolukumabu každé dva týdny, injekce jsou aplikovány s.c. po každé aferéze. Výsledky studie budou známy cca roku 2020. Průběžná data byla prezentována na kongresu American Heart Association v roce 2014. V souboru je sledováno 34 homozygotů FH a 16 pacientů se závažnou FH. Při léčbě evolokumabem bylo zaznamenáno snížení LDL-cholesterolu o 17 %, resp. 62 % (graf 2 a graf 3).
Graf 2. Změna LDL cholesterolemie při léčbě evolokumabem a LA. 
Při léčbě evolokumabem bylo zaznamenáno snížení LDL-cholesterolu o 17 % u homozygotů FH, resp. o 62 % u pacientů se závažnou FH. Upraveno podle [30] Graf 3. Individuální změna LDL-cholesterolemie při léčbě evolokumabem a LA. 
Upraveno podle [30] U homozygotů FH 5 ze 34 pacientů (15 %) buďto ukončilo nebo snížilo frekvenci LA: 2 pacienti (6 %) ukončili léčbu LA a 3 pacienti (9 %) snížili frekvenci léčby z 1krát za 2 týdny na 1krát za měsíc. U skupiny pacientů s těžkou FH 5 ze 16 pacientů (31 %) buďto ukončilo nebo snížilo frekvenci LA: 4 pacienti (25 %) ukončili léčbu LA a 1 pacient (6 %) snížil frekvenci léčby z 1krát za 2 týdny na 1krát za měsíc. Je třeba v tomto kontextu také poznamenat, že léčba LA také sama o sobě vede ke snížení plazmatických koncentrací PCSK9, i bez léčby inhibitory PCSK9 [31], takže při souběžné léčbě LA a inhibitory PCSK9 dochází k sumaci účinků léčby.
Závěr
Selektivní odstranění LDL-lipoproteinů z krve nebo plazmy, zejména LDL a Lp (a) pomocí lipoproteinové aferézy, v kombinaci s vysokou dávkou statinu a ezetimibem vede ke snížení aterogenních lipoproteinů o 60–70 %. Observační data demonstrovala, že léčba vede k redukci aterosklerotických změn v aortě a koronárních tepnách, prodlužuje živost homozygotům FH a snižuje výskyt koronárních příhod u heterozygotů FH. Přes veškeré snahy ovšem není možné u řady pacientů, zejména u LDL receptor negativních homozygotů FH, dosáhnout cílových hodnot lipidů. Novou nadějí pro tyto pacienty představují moderní hypolipidemika. Mezi ně patří lomitapid (Juxtapid, Lojuxta), určený k perorálnímu podávání, a subkutánní injekce mipomersenu (Kynamro). Lomitapid je schválený pro léčbu homozygotů FH v Evropě i USA, mipomersen pouze v USA. Velmi slibné výsledky přinášejí také monoklonální protilátky proti PCSK9 (evolokumab – Repatha, alirokumab – Praluent), které jsou od letošního roku schváleny ke klinickému využití v USA a od konce září 2015 také v Evropě. I když jsou data z dostupných klinických studií s novými hypolipidemiky velice slibná, je ke zhodnocení dlouhodobého vlivu na kardiovaskulární morbiditu, mortalitu a bezpečnost léčby třeba vyčkat na závěry dlouhodobých recentně probíhajících studií. Je také nutné zhodnotit a posoudit dlouhodobý výskyt eventuálních nežádoucích účinků, steatózu jater, interakce mezi léky apod. Chybí nám také data z využití nových léků u dětí či adolescentů s FH, zejména u homozygotů, protože k zahájení léčby by mělo dojít co nejdříve. Nezanedbatelným aspektem nových hypolipidemik je také vysoká cena, proto nutně potřebujeme také zhodnocení poměru efektivity a schopnosti zdravotnických systémů v Evropě i jinde takovou léčbu zaplatit. Proto v současné době, do vyřešení výše uvedených problémů, představuje léčba lipoproteinovou aferézou v kombinaci s konvenční farmakologickou léčbou hypolipidemiky nejvíce prověřený, efektivní a bezpečný způsob léčby refrakterní familiární hypercholesterolemie.
Práce byla podpořena projekty IGA MZ ČR NT/12287–5 a PRVOUK P37/12.
prof. MUDr. Vladimír Bláha, CSc.
blaha@lfhk.cuni.cz
III. interní gerontometabolická klinika LF UK a FN, Hradec Králové
www.fnhk.cz
Doručeno do redakce 27. 11. 2015
Přijato po recenzi 30. 11. 2015
Zdroje
1. Stein EA. Drug and alternative therapies for hyperlipidemia. Atherosclerosis 1994;108(Suppl): S105–S116.
2. Kobayashi S, Oka M, Moriya H et al. LDL-apheresis reduces P-Selectin, CRP and fibrinogen – possible important implications for improving atherosclerosis. Ther Apher Dial 2006; 10(3): 219–223.
3. Bláha V, Bláha M, Lánská M et al. LDL-aferéza v léčbě familiárních hyperlipoproteinemií. Vnitř lék 2014; 60(11): 970–976.
4. Stefanutti C, Morozzi C, Petta A. Lipid and low-density-lipoprotein apheresis. Effects on plasma inflammatory profile and on cytokine pattern in patients with severe dyslipidemia. Cytokine 2011; 56(3): 842–849.
5. de Gennes JL, Touraine R, Maunand B et al. Homozygous cutaneo-tendinous forms of hypercholesteremic xanthomatosis in an exemplary familial case. Trial of plasmapheresis an heroic treatment. Bull Mem Soc Med Hôp Paris 1967; 118 : 1377–1402.
6. Turnberg LA, Mahoney MP, Gleeson MH et al. Plasmapheresis and plasma exchange in the treatment of hyperlipaemia and xanthomatous neuropathy in patients with primary biliary cirrhosis. Gut 1972; 13(12): 976–981.
7. Thompson GR, Lowenthal R, Myant NB. Plasma exchange in the management of homozygous familial hypercholesterolaemia. Lancet 1975; 1(7918): 1208–1211.
8. Berger GM, Miller JL, Bonnici F et al. Continuous flow plasma exchange in the treatment of homozygous familial hypercholesterolemia. Am J Med 1978; 65(2): 243–51.
9. King ME, Breslow JL, Lees RS. Plasma-exchange therapy of homozygous familial hypercholesterolemia. N Engl J Med 1980; 302(26): 1457–1459.
10. Lupien PJ, Moorjani S, Awad J. A new approach to the management of familial hypercholesterolaemia: removal of plasmacholesterol based on the principle of affinity chromatography. Lancet. 1976; 1(7972): 1261–1265.
11. Stoffel W, Borberg H, Greve V. Application of specific extracorporeal removal of low density lipoprotein in familial hypercholesterolaemia. Lancet 1981; 2(8254): 1005–1007.
12. Thompson GR. Lipoprotein apheresis. Curr Opin Lipidol 2010; 21(6): 487–491.
13. Winters JL. American society for apheresis guidelines on the use of apheresis in clinical practice: Practical, concise, evidence-based recommendations for the apheresis practitioner. J Clin Apher 2014; 29(4): 191–193.
14. Bosch T, Schmidt B, Blumenstein M et al. Lipid apheresis by hemoperfusion: in vitro efficacy and ex vivo biocompatibility of a new low-density lipoprotein adsorber compatible with human whole blood. Artif Organs 1993; 17(7): 640–652.
15. Richter WO, Donner MG, Schwandt P. Three low density lipoprotein apheresis techniques in treatment of patients with familial hypercholesterolemia: a long-term evaluation. Ther Apher 1999; 3(3): 203–208.
16. Cashin-Hemphill L, Noone M, Abbott JF et al. Low-density lipoprotein apheresis therapy during pregnancy. Am J Cardiol 2000; 86(10): 1160.
17. Bláha V, Bláha M, Lánská M et al. Lipoproteinová aferéza. Aktuality z vnitřního lékařství. Axonite CZ, Praha 2015.
18. Naoumova RP, Thompson GR, Soutar AK. Currentmanagement of severe homozygous hypercholesterolaemias. Curr Opin Lipidol 2004; 15(4): 413–22.
19. Gagné C, Gaudet D, Bruckert E et al. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation 2002; 105(21): 2469–2475.
20. Gordon BR. Incorporation of low-density lipoprotein apheresis into the treatment programof patientswith severe hypercholesterolemia. Curr Atheroscler Rep 2000; 2(4): 308–313.
21. Raal FJ, Pilcher GJ, Panz VR et al. Reduction in mortality in subjects with homozygous familial hypercholesterolemia associated with advances in lipid-lowering therapy. Circulation 2011; 124(20): 2202–2207.
22. Bilheimer DW, Goldstein JL, Grundy SM et al. Liver transplantation to provide low-density-lipoprotein receptors and lower plasma cholesterol in a child with homozygous familial hypercholesterolemia. N Engl J Med 1984; 311(26): 1658–1664.
23. Van Craeyveld E, Jacobs F, Gordts SC, De Geest B. Gene therapy for familial hypercholesterolemia. Curr Pharm Des 2011; 17(24): 2575–2591.
24. Yamamoto A, Harada-Shiba M et al. The effect of ezetimibe on serum lipids and lipoproteins in patients with homozygous familial hypercholesterolemia undergoing LDL-apheresis therapy. Atherosclerosis 2006; 186(1): 126–131.
25. Raal FJ, Santos RD, Blom DJ et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet 2010; 375(9719): 998–1006.
26. Cuchel M, Meagher EA, du Toit Theron H et al. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet 2013; 381(9860): 40–46.
27. Stein EA, Honarpour N, Wasserman SM et al. Effect of the proprotein convertase subtilisin/kexin 9 monoclonal antibody, AMG145, in homozygous familial hypercholesterolemia. Circulation 2013; 128(19): 2113–2120.
28. Vogt A, Parhofer KG. The potential of mipomersen, an ApoB synthesis inhibitor, to reduce necessity for LDL-apheresis in patients with heterozygous familial hypercholesterolemia and coronary artery disease. Expert Opinion on Pharmacotherapy 2013; 14(6): 691–697.
29. Stefanutti C, Blom DJ, Averna MR et al. The lipid-lowering effects of lomitapid are unaffected by adjunctive apheresis in patients with homozygous familial hypercholesterolaemia A post-hoc analysis of a Phase 3, single-arm, open-label trial. Atherosclerosis 2015; 240(2): 408–414.
30. Bruckert E, Blaha V, Stein EA et al. Trial Assessing Long-Term Use of PCSK9 Inhibition in Patients with Genetic LDL Disorders (TAUSSIG): Efficacy and Safety in Patients with Familial Hypercholesterolemia Receiving Lipid Apheresis. Circulation 2014; 130: A17016.
31. Tavori H, Giunzioni I, Linton MF et al. Loss of plasma proprotein convertase subtilisin/kexin 9 (PCSK9) after lipoprotein apheresis. Circ Res 2013; 113(12):1290–1295.
32. Stefanutti C, Thompson GR. Lipoprotein Apheresis in the Management of Familial Hypercholesterolaemia: Historical Perspective and Recent Advances. Curr Atheroscler Rep 2015; 17(1): 465. Dostupné z DOI: <http://doi 10.1007/s11883–014–0465–6>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 11- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Ateroskleróza, lipidy a vnitřní lékařství
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Stanovisko k nové moderní hypolipidemické léčbě
- Praktický přístup ke statinové intoleranci
- Včasná diagnostika familiární hypercholesterolemie v České republice v rámci projektu MedPed
- Inhibice PCSK9 jako nová naděje pro nemocné s familiární hypercholesterolemií, statinovou intolerancí a posléze pro všechny pacienty v nejvyšším kardiovaskulárním riziku? Zaměřeno na alirokumab – Praluent®
- Evolokumab a projekt PROFICIO: první výsledky
- Postavení lipoproteinové aferézy v současnosti
- Vliv kombinace simvastatinu s ezetimibem na krevní lipidy a na kardiovaskulární příhody u diabetiků (komentář k výsledkům subanalýzy studie IMPROVE-IT)
-
Co přináší přehledný článek o důkazech redukce makrovaskulárního rizika u pacientů s aterogenní dyslipidemií?
Zpráva o konsenzu expertů o významu kombinované terapie fenofibrátem a statinem Hana Rosolová - Studie TECOS, EXAMINE a SAVOR – čím se liší a co přinášejí?
- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- I. sympozium pracovní skupiny Kardio 35 České kardiologické společnosti
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Klinický význam nových bazálních inzulinů a inzulin Toujeo® 300 U/ml
- Ateroskleróza: od etiologie po možnosti ovlivnění
- Postavení lipoproteinové aferézy v současnosti
- Praktický přístup ke statinové intoleranci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



