-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mezinárodní doporučení pro léčbu těžké sepse a septického šoku 2012 – komentovaný výběr
International guidelines for management of severe sepsis and septic shock 2012 – comment
Sepsis is one of the leading and grossly under recognized cause of death in the world. If not recognized early and treated promptly, sepsis leads to septic shock, multiorgan failure and death. This article summarizes recently updated international guidelines for management of severe sepsis and septic shock.
Key words:
recommendation – infection – sepsis – septic shock
Autoři: Jiří Chvojka; Martin Matějovič
Působiště autorů: Biomedicínské centrum LF UK v Plzni ; jednotka intenzivní péče, I. interní klinika LF UK v Plzni a FN Plzeň, přednosta prof. MUDr. Martin Matějovič, Ph. D.
Vyšlo v časopise: Vnitř Lék 2014; 60(1): 59-67
Kategorie: Přehledné referáty
Pasáže citované z guidelines přeložené z anglického originálu jsou v textu článku vyznačeny podbarvením (redakce).
Souhrn
Sepse je celosvětově jednou z nejčastějších a současně výrazně podceněných příčin smrti. Pokud není onemocnění včas rozpoznáno a léčeno, vede sepse k rozvoji septického šoku, multiorgánovému selhání a smrti. Článek komentuje recentně aktualizovaná nadnárodní doporučení pro léčbu těchto závažných stavů.
Klíčová slova:
doporučení – infekce – sepse – septický šokProč právě sepse a septický šok?
Tak jak celosvětově prudce narůstá incidence sepse a septického šoku, představují tyto stavy na jednotkách intenzivní péče jednu z nejčastějších příjmových diagnóz. Počty septických pacientů se v USA za posledních 20 let ztrojnásobily a nejinak tomu je i v Evropě. Ročně onemocní těžkou sepsí více než 18 miliónů osob a denně na ni umírá více než 1 400 osob [1]. Sepse se tak stala 10. nejčastější příčinou úmrtí. I přes nesporný pokrok medicíny zůstává mortalita těchto pacientů i ekonomické náklady s léčbou spojené neúnosně vysoké. Ani antimikrobiální, ani extenzivní multiorgánová podpora nedokázala mortalitu dosahující 20–30 % snížit [2–4]. Sepse tak představuje klinický problém, jehož význam bude, vzhledem ke stárnoucí populaci, migraci, vzrůstajícímu počtu polymorbidních a imunosuprimovaných pacientů a vzrůstající rezistenci infekčních agens na antibiotika, dále stoupat. Obdobně jako u jiných kritických stavů, např. akutních koronárních syndromů, cévních mozkových příhod či polytraumat, je zásadním předpokladem pro zvýšení pravděpodobnosti přežití pacienta včasnost a adekvátnost úvodní léčby [5,6].
Surviving Sepsis Campaign
Logickým krokem proto byl vznik globální iniciativy se snahou sjednotit hlavní zásady a diagnosticko-léčebné postupy při léčbě septického pacienta. Pod záštitou tří odborných společností (Society of Critical Care Medicine, European Society of Intensive Care Medicine a International Sepsis Forum) byla v roce 2002 spuštěna tzv. Surviving Sepsis Campaign, která vedla o 2 roky později k vydání prvních nadnárodních doporučení pro léčbu těžké sepse a septického šoku. Tato doporučení vycházející z principu medicíny založené na důkazech (evidence-based medicine – EBM) byla poprvé aktualizována v roce 2008 a jejich nejnovější verze byla publikována v únoru roku 2013 [7].
Vzniklá doporučení jsou konsenzem 68 představitelů 30 nadnárodních společností a organizací. Autoři při jejich tvorbě vycházeli z obecného principu EBM založeného na systému GRADE (Grade of Recommendation, Assessment, Development and Evaluation). Tento systém hodnotí kvalitu důkazů od vysoké (A) po velmi nízkou (D) a rozděluje jednotlivá doporučení dle jejich síly na silné (1) a slabé doporučení (2), jinými slovy „je doporučeno“ (recommended) a „je navrženo“ (suggested). V originálním textu zůstala některá doporučení nehodnocena (UG – ungraded) a jednotlivá doporučení jsou rozdělena do 3 skupin týkajících se:
- diagnostiky a léčby těžké sepse/septického šoku
- obecných léčebných principů kriticky nemocných
- léčby pediatrické populace
Níže uvádíme výběr nejpodstatnějších doporučení opatřených komentáři autorů tohoto článku. Zmíníme i doporučení, která se nemusela nutně od posledního vydání v roce 2008 měnit, považujeme je však v léčbě sepse za klíčová. Nevěnujeme se pediatrické problematice.
Definice a diagnostická kritéria sepse
Sepse je definována jako přítomnost (pravděpodobné nebo dokumentované) infekce společně se známkami systémové zánětlivé odezvy. Těžká sepse je definována jako sepse s projevy orgánové dysfunkce nebo tkáňové hypoperfuze způsobené sepsí. Tkáňová hypoperfuze při sepsi je definována jako infekcí způsobená hypotenze, elevace sérového laktátu nebo oligurie. Septický šok je definován jako sepsí indukovaná hypotenze přetrvávající i přes adekvátní tekutinovou resuscitaci [8].
Diagnostická kritéria těžké sepse (sepsí indukovaná tkáňová hypoperfuze nebo známky orgánové dysfunkce)
- sepsí indukovaná hypotenze
- zvýšení laktátu nad normu
- akutní oligurie (pokles diurézy < 0,5 ml/kg/hod trvající 2 hod při adekvátní tekutinové resuscitaci
- akutní poškození plic (ALI – acute lung injury) s PaO2/FiO2 < 250 při nepřítomnosti pneumonie
- akutní poškození plic (ALI – acute lung injury) s PaO2/FiO2 < 200 při přítomnosti pneumonie
- kreatinin > 176,8 µmol/l
- bilirubin > 34,2 µmol/l
- trombocytopenie < 100 000/µmol/l
- poruchy koagulace (INR > 1,5)
Pro přehlednost shrnujeme diagnostická kritéria do tabulky (tab).
Tab. 1. Diagnostická kritéria sepse infekce 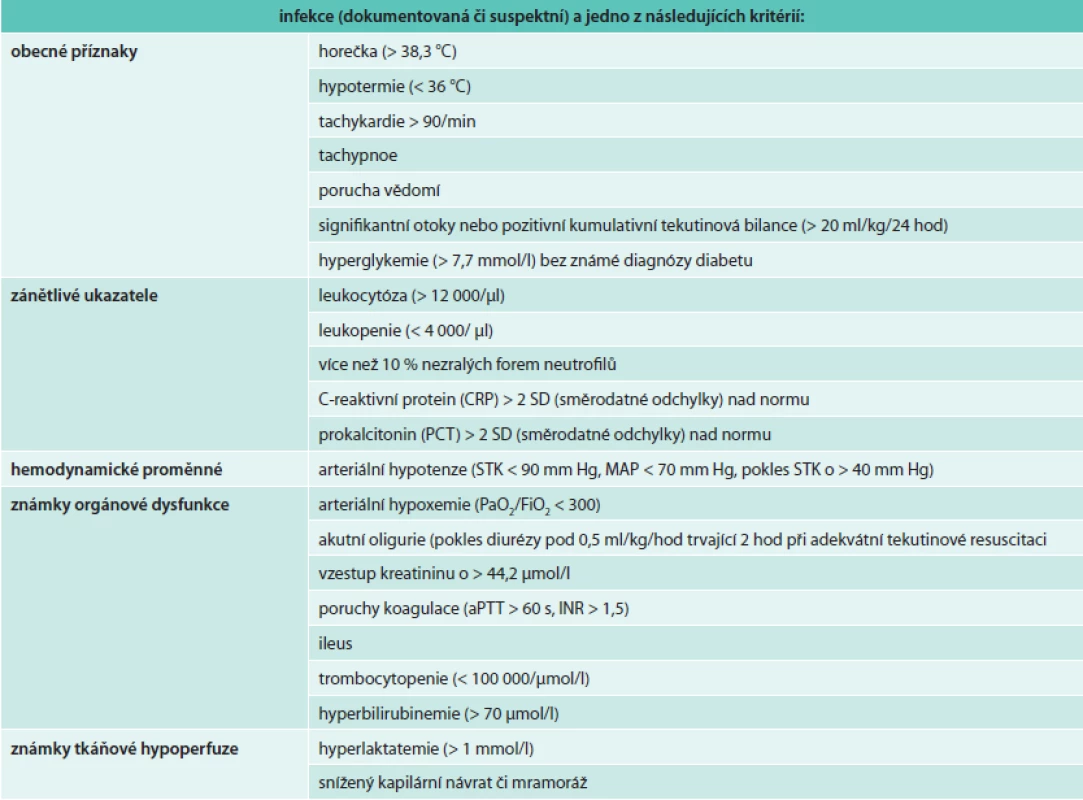
Sepse je tak již od roku 1991 definována jako systémová zánětlivá odezva na infekci. Ke stanovení diagnózy stačí přítomnost infekce a 2 z kritérií systémové zánětlivé odezvy (SIRS). Ta pro jednoduchost zahrnují 4 proměnné – teplotu, srdeční a dechovou frekvenci a počet leukocytů. Jak definice, tak i diagnostická kritéria jsou zatížena řadou zásadních problémů. Senzitiva kritérií SIRS je příliš vysoká. Vysoké procento pacientů s „normální“ odezvou imunitního systému na nezávažnou infekci tak tato kritéria snadno naplní. Tato odezva však nemusí být pro svého nositele škodlivá, naopak. Navíc SIRS nemá jen infekční příčiny (tzv. sterilní inflamace – trauma, popáleniny, pankreatitis). Sepse by proto měla být definována jako život ohrožující stav, který vzniká, pokud odezva organizmu na infekci poškozuje vlastní tkáně a orgány [9]. Sepse tudíž není prostou odezvou organizmu na infekci. S cílem sjednotit definici a klinické vnímání sepse, zabránit často zaměnitelnému používání výrazů sepse a těžká sepse, sílí volání expertů po úpravě stávající definice [10]. Navrhují, aby přítomnost akutní orgánové dysfunkce byla zahrnuta do diagnostických kritérií sepse. Prosazení tohoto názoru ještě čeká široká odborná diskuse.
Léčba sepse/těžké sepse
Bundles – balíčky péče pro léčbu těžké sepse
Ve snaze usnadnit transformaci rozsáhlých doporučení do jednodušších návodů, které by zlepšily komplianci lékařů k doporučením v klinické praxi, byly zavedeny i v léčbě těžké sepse/septického šoku tzv. bundles, balíčky. Balíček péče představuje soubor vědecky podložených intervencí, které, jsou-li použity společně, mají větší šanci příznivě ovlivnit výsledky léčby, než pokud by byla každá z těchto léčebných intervencí použita izolovaně. Opakovaně bylo prokázáno, že zavedení těchto jednoduchých balíčků do praxe vedlo ke zkvalitnění péče o septické pacienty a k příznivému ovlivnění jejich mortality [11,12]. Stávající doporučení v sobě zahrnují 2 základní balíčky opatření, které by měly být provedeny do 3 a do 6 hod od stanovení diagnózy těžké sepse. Obecně platí, čím dříve tím lépe.
Do 3 hod od stanovení diagnózy
- změřit hladinu laktátu
- odebrat hemokultury před podáním antibiotik (ATB)
- podat širokospektrá ATB
- v případě hypotenze či hladiny laktátu ≥ 4 mmol/l podat 30 ml/kg krystaloidu
Do 6 hod od stanovení diagnózy
- při hypotenzi nereagující na úvodní tekutinovou resuscitaci zahájit podávání vazopresorů k udržení středního arteriálního tlaku (MAP) ≥ 65 mm Hg
- v případě trvající hypotenze i přes tekutinovou resuscitaci nebo při hladině laktátu ≥ 4 mmol/l:
- změřit centrální žilní tlak (CVP)
- změřit saturaci hemoglobinu kyslíkem z centrální žíly (ScVO2 – central venous oxygen saturation)
Úvodní hemodynamická stabilizace
Po rozpoznání známek tkáňové hypoperfuze je doporučeno používat co nejdříve protokolizovaný management tekutinové resuscitace se snahou dosáhnout predefinovaných cílů v prvních 6 hod od stanovení diagnózy.
- CVP 8–12 mm Hg
- MAP ≥ 65 mm Hg
- močový výdej ≥ 0,5 ml/kg/hod
- saturace žilní krve z horní duté žíly (ScvO2) či smíšené žilní krve (SvO2 – mixed venous oxygen saturation) nad 70 %, resp. 65 % (1C)
U pacientů se zvýšenou hladinou laktátu je navrženo normalizovat jeho hladiny hemodynamickou resuscitací (2C).
Stanovené predefinované fyziologické cíle jsou jednou z nejvíce diskutovaných a kontroverzních částí doporučení SSC. Autoři doporučení vycházeli pro úvodní léčbu z Riversovy studie, v níž využití early goal-directed therapy (EGDT) příznivě ovlivnilo mortalitu [6]. I přes kritické názory je nutné principy EGDT konceptu akceptovat. Jeho podstata totiž nespočívá v bezesporu diskutabilních fixních cílech. Hlavní přínos časné, na fyziologické cíle orientované léčby je, že nás nutí u každého nemocného v těžké sepsi/septickém šoku klást a hledat odpovědi na 3 zcela zásadní otázky, které vyžadují léčebné intervence:
- Je objemová resuscitace adekvátní?
- Je perfuzní tlak (MAP) dostatečný pro dosažení uspokojivé tkáňové perfuze?
- Je rovnováha mezi dodávkou a spotřebou kyslíku dostatečná pro udržení orgánových funkcí? (ScvO2, laktát)
Moderní intenzivní medicína disponuje bezesporu řadou nástrojů, jak uvedené otázky vyhodnotit. Pokud vysoce erudovaný personál jednotek intenzivní péče ovládá k vyhodnocení hemodynamiky echokardiografické metody a další dynamické ukazatele preloadu (pulse pressure variation, stroke volume variation), jistě budou mít přednost před izolovaným hodnocením centrálního žilního tlaku (central venous pressure – CVP). Samotný CVP představuje v klinické praxi relativně snadno dostupný parametr. K jeho hodnocení však klinik musí přistupovat značně obezřetně a být si vědom všech limitací takového měření, jako je vliv nitrohrudních a nitrobřišních tlaků, umělé plicní ventilace, plicní hypertenze, poddajnosti pravé komory apod. Izolované hodnocení bez zasazení do celkového kontextu klinických vyšetření a biochemických dat může být zavádějící a vést k nesprávně vedené tekutinové léčbě. V rukou dobře informovaného intenzivisty je monitorace CVP přes všechny limitace stále užitečným pomocníkem v hemodynamické léčbě kriticky nemocných. Je informativní, zejména pokud jsou jeho hodnoty nízké nebo naopak vysoké (samotná hodnota ale neříká nic o příčinách). Zavedení centrálního žilního katétru navíc umožňuje intermitentní či kontinuální monitoraci ScvO2. Navržená hodnota ScvO2 (nad 70 %) představuje neméně diskutabilní komponentu resuscitačních cílů. Nízké hodnoty ScvO2 sice upozorňují na riziko možného nepoměru mezi dodávkou a spotřebou kyslíku, normální či dokonce vysoké hodnoty však negarantují adekvátní poměry tkáňové oxygenace a nejsou vždy zárukou dostatečné hemodynamické resuscitace! Jinými slovy, normální hodnoty ScvO2 nevylučují, že septický pacient nebude mít prospěch z další optimalizace preloadu. Z těchto důvodů je logické sledovat i další parametr tkáňového metabolizmu – laktát. Nová doporučení proto navrhují sledovat hladiny laktátu a zejména jeho odezvu na úvodní léčbu. Ačkoliv doporučení Surviving Sepsis Campaign (SSC) uvádí jako důvod k zahájení agresivní úvodní hemodynamické resuscitace hladinu laktátu vyšší než 4 mmol/l, bylo prokázáno, že i hladiny mezi 2–4 mmol/l jsou spojeny s významně vyšší mortalitou [13]. Zvýšené hladiny laktátu jsou rovněž velmi varovným signálem i u pacientů bez současné hypotenze (tzv. utajený šok) a vždy by měly být impulzem k rychlému vyhodnocení stavu nemocného a zahájení příslušné léčby [14]. Obdobně jako u ScvO2 platí i v případě laktátu, že ani jeho normální hodnoty nejsou argumentem k terapeutické pasivitě a nemohou být interpretovány v izolaci.
Tekutinová léčba
Jako iniciální tekutinu volby v resuscitaci sepse/septického šoku je doporučeno použít krystaloidní roztoky (1B).
V úvodní tekutinové léčbě se nedoporučuje používat roztoky na bázi hydroxyetyl škrobu (HES) (1B).
U septických pacientů vyžadujících nadměrné množství krystaloidů v resuscitaci oběhu se navrhuje použít albumin (2C).
Intravenózní tekutinová léčba je jedním ze základních a rutinních pilířů péče o kriticky nemocné. Poněkud překvapivě až teprve v posledních letech rozpoznáváme rizika plynoucí z různých typů roztoků, podaného množství a rychlosti aplikace. Doporučení nepoužívat syntetické koloidní roztoky, včetně tzv. škrobů nové generace (6% HES 130/0,4), při úvodní tekutinové léčbě se opírá zejména o závěry 2 recentně publikovaných velkých randomizovaných studií. Skandinávská studie 6S Trial prokázala na téměř 800 pacientech v septickém šoku horší přežití skupiny tekutinově resuscitované 6% HES 130/0,42 oproti skupině léčené Ringer-acetátem (mortalita 51 % vs 43 %, p = 0,03) [15]. Dosud největší studie CHEST pak na 7 000 pacientech demonstrovala vyšší riziko rozvoje akutního poškození ledvin a větší potřebu náhrady funkce ledvin u kriticky nemocných pacientů, kteří byli léčeni opět koloidním škrobovým roztokem nové generace [16]. Společně s výsledky předchozích menších klinických či experimentálních studií tak v současnosti máme dostatek argumentů, proč u pacientů v těžké sepsi/septickém šoku není vhodné syntetické koloidní roztoky používat. Tento závěr podporuje řada světových autorit, včetně zcela recentních, na sobě nezávislých metaanalýz [17–22] a připojila se k němu svým stanoviskem i Česká společnost intenzivní medicíny (stanovisko je dostupné na adrese . Při výběru krystaloidních roztoků nelze zatím vycházet z žádných robustních klinických studií. Poslední studie však potvrzují obavy, že hyperchloremie navozená tzv. fyziologickým roztokem není benigním fyziologickým jevem [23,24]. V současnosti je proto bezpečné doporučit preferenční používání tzv. balancovaných krystaloidních roztoků. Kontroverzním zůstává návrh doporučení SSC využít albuminu jako plazmaexpanderu u pacientů vyžadujících velkoobjemovou resuscitaci (stavy s excesivním kapilárním únikem). Přesnější vodítko ke klinické praxi by měla přinést dokončená studie ALBIOS (Albumin for Volume Replacement in Severe Sepsis).
Vazopresory
Jako katecholamin první volby je doporučeno používat noradrenalin (1B).
Při selhání noradrenalinu k dosažení cílů je navrženo přidat/nahradit noradrenalin adrenalinem (2B).
Vazopresin v dávce 0,03 U/min může být přidán k noradrenalinu s cílem zvýšit MAP nebo snížit dávku katecholaminu (ungraded).
Vazopresin není doporučen jako vazopresor první volby a v dávkách vyšších než 0,03–0,04 U/min by měl být rezervován pouze pro „salvage“ (záchrannou) léčbu při selhání schopnosti ostatních vazopresorů dosáhnout adekvátního MAP (ungraded).
Dopamin může být alternativou noradrenalinu pouze u vysoce selektované populace (pacienti s nízkým rizikem arytmií, s absolutní/relativní bradykardií) (2C).
Dopamin v tzv. nízkých dávkách (low-dose 3–5 µg/kg/min) by neměl být užit z důvodu renální protekce (1A).
Inotropní léčba
Při přítomnosti myokardiální dysfunkce (nízký srdeční výdej, vysoké plnící tlaky) nebo při pokračujících známkách hypoperfuze přes adekvátní MAP a dostatečný stav volemie (dostatečný Hb, SaO2) (1C) je doporučeno použít dobutamin (v dávce do 20 µg/kg/min).
Důležitou změnou oproti poslední verzi guidelines SSC z roku 2008 je doporučení používat noradrenalin jako vazopresor volby ke korekci septické hypotenze. Doporučení vychází z výsledků 5 randomizovaných studií a jejich metaanalýz, které ukazují na nižší mortalitu a nižší výskyt arytmií v porovnání s dopaminem [25,26]. Obavy ze snížení renálního průtoku, a tudíž ze zhoršení ledvinných funkcí při použití noradrenalinu, se ukázaly jako liché, noradrenalin je naopak lékem schopným renální průtok zvýšit [27]. Pokud noradrenalin není schopen udržet dostatečný perfuzní tlak, je druhou volbou u refrakterního septického šoku adrenalin, který může být přidán k noradrenalinu či jej postupně nahradit. Vazopresin či jeho analog terlipresin nelze doporučit k rutinnímu používání. Tyto vazopresory zůstávají pouze jako doplňkový, resp. záchranný lék u přísně selektovaných pacientů s refrakterním, hyperdynamickým, vazoplegickým šokem, při němž nelze dosáhnout adekvátního perfuzního tlaku při použití noradrenalinu, adrenalinu či jejich kombinace. V těchto indikacích patří vždy do rukou zkušeného intenzivisty a za podmínek pečlivé monitorace hemodynamiky a tkáňové perfuze. Doporučení týkající se výše středního arteriálního tlaku vychází z předpokladu, že při MAP < 65 mm Hg je vysoké riziko ztráty autoregulace krevního průtoku orgány, a tím jejich hypoperfuze. Přesto je však při titraci vazopresorické podpory vždy nutné individuální posouzení každého pacienta. Např. u pacientů s aterosklerózou, špatně léčenou dlouhodobou hypertenzí, nemusí být doporučovaný MAP dostatečný. Dosud nepublikované výsledky studie SEPSISMAP naznačují, že u těchto skupin nemocných může být dosažení MAP 80–85 mm Hg prospěšné z pohledu renálních funkcí a potřeby jejich náhrady. Nezodpovězenou otázkou je načasování zahájení léčby noradrenalinem. První experimentální a klinické studie spíše podporují jeho časné nasazení, souběžně s tekutinovou resuscitací, zejména v případě život ohrožující hypotenze (diastolický tlak pod 40 mm Hg) [28,29].
Kortikoidy
Je-li dosaženo pomocí tekutinové a katecholaminové léčby hemodynamické stabilizace, je navrženo v léčbě septického šoku nepoužívat hydrokortizon. V opačném případě je navrženo použít hydrokortizon v denní dávce 200 mg (2C).
Východiskem k podávání kortikoidů v septickém šoku byly závěry klinických studií, demonstrující zkrácení doby šokového stavu (definováno délkou potřeby vazopresorické podpory oběhu). Tyto závěry zpochybnila dosud největší studie CORTICUS, která neprokázala jednoznačný prospěch z paušálního podávání hydrokortizonu všem nemocným v septickém šoku [30]. Současná doporučení SSC vycházejí z rozboru všech dosud provedených randomizovaných klinických studií, které ukazují, že zřejmě rozhodujícím faktorem prospěšnosti ze suplementace hydrokortizonu je odezva na úvodní hemodynamickou resuscitaci, resp. tíže šokového stavu [7]. Bližší návod však doporučení nedávají. Na našem pracovišti se k podání kortikoidů rozhodujeme u pacientů, u kterých přetrvává potřeba noradrenalinu v dávce > 0,5–1 µg/kg/min i přes optimalizaci srdečního preloadu a kteří jsou ve vysokém riziku úmrtí. Tato strategie vychází z populace pacientů, u kterých podávání kortikoidů zlepšilo přežití. U nich by pak měl být podán hydrokortizon v denní dávce 200 mg intravenózně a po odeznění šoku by mělo dojít co nejrychleji k jeho postupnému vysazení. Vzhledem k možnosti nežádoucích účinků v podobě hyperglykemie a hypernatremie je možné upřednostnit kontinuální podávání před bolusovým (tj. 4krát 50 mg) [31].
Diagnostika a léčba infekce
Screening sepse
U potencionálně infikovaných kriticky nemocných pacientů se doporučuje provádět rutinní screening s cílem včasného diagnostikování a zahájení léčby sepse (1C).
Prvním a zásadním krokem ve snaze příznivě ovlivnit mortalitu septických nemocných je co nejkratší čas do diagnózy. Zkrácení tohoto intervalu snižuje nejen mortalitu, ale též sepsí indukovaný rozvoj multiorgánové dysfunkce [12]. Důležitým prvkem v řetězci vedoucím ke správné diagnóze je na sepsi vůbec pomýšlet. V současné době neexistuje žádný laboratorní či klinický ukazatel, který by byl pro sepsi specifický. Šíře a nespecifičnost vstupních klinických příznaků diagnostiku sepse značně ztěžuje. Ne každý pacient se sepsí totiž vykazuje známky systémové inflamatorní odezvy, přesto je u něj závažná infekce přítomná [32]. U lůžka nemocného by se tak diagnóza měla opírat o pečlivou anamnézu, fyzikální vyšetření a posouzení přítomnosti či nepřítomnosti klinických a laboratorních známek SIRS a orgánové dysfunkce (alterace vědomí, hemodynamická nestabilita, hypoxemie, oligurie, koagulopatie, nejasná elevace jaterních testů apod). Např. u staršího, chronicky dialyzovaného diabetika může být jedinou známkou těžké sepse alterace stavu vědomí a neočekávaná intolerance dialyzační procedury. V případě, že pacient „vypadá septicky“, by neměl ošetřující lékař váhat s podáním antibiotik a zahájením léčby dle příslušných balíčků pro léčbu sepse.
Diagnóza infekce
Je doporučeno odebrat alespoň 2 sady hemokultur a získat kultivační materiál z dalších potencionálních zdrojů (např. moč, sputum, likvor, stěry ran atd) optimálně před zahájením antibiotické léčby (1C).
Je doporučeno provést co nejdříve zobrazovací vyšetření k nalezení zdroje infekce a k cílenému odběru vzorků na mikrobiologii, pokud je to bezpečné (ungraded).
Doporučení nabírat vždy alespoň 2 sady hemokultur vychází z prací z 80. let 20. století, kdy byla prokázána 99% senzitivita v detekci bakteremie při nabrání 2 sad hemokultur při metodikách manuální kultivace [33]. Recentní práce s automatizovanými přístroji ke kultivaci prokazují pouze 80% senzitivitu při odebrání 2 hemokultur a 96% senzitivitu při získání 3 sad hemokultur [34]. Vzhledem k časovému a často i praktickému faktoru, kdy by antibiotická léčba měla být podána do 1 hod od stanovení diagnózy, jsou 2 sady hemokultur o jednotlivém objemu > 10 ml krve [35] pragmatickým kompromisem. U pacientů se zavedenými centrálními cévními vstupy, které jsou in situ déle než 48 hod, je doporučeno odebrat jeden vzorek z periferní krve, zatímco další z každého lumen příslušného katétru. Je-li kultivace obou vzorků pozitivní na stejný patogen, je vysoce pravděpodobné, že identifikovaný mikrob je původcem sepse. Podobně, je-li hemokultura z katétru pozitivní rychleji (např. o více než 2 hod) než z periferní krve, je pravděpodobné, že katétr je zdrojem infekce. Získání mikrobiologických vzorků je základním předpokladem pro volbu adekvátní antibiotické léčby, resp. případnou následnou deeskalaci dle citlivosti. Ta je významným nástrojem ke snížení rizika nárůstu bakteriální rezistence [36]. Při diagnostice sepse je nutné pomýšlet i na možnost virové či mykotické infekce a dále neopomíjet zobrazovací metody při identifikace zdroje infekce. Je-li to indikováno, musí být antimikrobiální léčba doplněna časnou intervencí (< 12 hod) se sanací potencionálního fokusu, a to pokud možno co nejméně invazivním způsobem (např. perkutánní drenáž, včasné odstranění katétrů a potenciálně infikovaných cizorodých systémů).
Antimikrobiální léčba
Je doporučeno podat antibiotika do 1 hod od stanovení diagnózy septického šoku (1B) a těžké sepse (1C).
Je doporučeno zvolit adekvátní vstupní empirickou antiinfekční léčbu jedním nebo kombinací antibiotik v adekvátní dávce s účinkem proti předpokládanému infekčnímu agens (1B).
Je doporučeno denně přehodnocovat antibiotický režim s cílem včas deeskalovat či optimalizovat léčbu, snižovat riziko rozvoje mikrobiální rezistence, snižovat náklady na léčbu (1B).
Je navrženo používat prokalcitonin či jiné biomarkery v rozhodování o ukončení empirické antibiotické léčby (2C).
Je navrženo použít kombinaci ATB u neutropenických pacientů s těžkou sepsí (2B) a u pacientů infikovaných MDRD (multidrug-resistant difficult-to-treat) kmeny (Acinetobacter, Pseudomonas) (2B).
U vybraných pacientů v septickém šoku s respiračním selháním je navrženo zvážit kombinaci betalaktamového ATB s rozšířeným spektrem buď s aminoglykosidy nebo fluorochinolony u PSAE bakteremie (2B) a u infekce Streptococcus pneumoniae s bakteremií kombinaci beta-laktamu s makrolidem (2B).
Je navrženo nepoužívat empirickou kombinační léčbu ATB déle než 3–5 dní a při známé citlivosti patogenu deeskalovat na adekvátní monoterapii (2B).
Je navrženo, aby trvání léčby nepřekračovalo obvykle 7–10 dní. Ponechání antibiotik delší dobu je doporučeno pouze v případech pomalé odezvy na léčbu, bakteremické infekce kmeny Stafylococcus aureus, některých mykotických a virových infekcí, nedrénovaného ložiska infekce nebo u pacientů s imunitním deficitem (neutropenie) (2C).
U pacienta s virovou infekcí a těžkou sepsí/septickým šokem je navrženo zahájit antivirovou léčbu co nejdříve (2C).
Kontrola zdroje infektu
Je doporučeno co nejdříve lokalizovat zdroj infekce a provést patřičnou intervenci tam, kde je to vhodné, do 12 hod od stanovení diagnózy (1C).
Pokud kontrola zdroje infektu vyžaduje intervenci, je navrženo volit intervenci s nejmenším potenciálem dalšího inzultu, např. perkutánní drenáž (ungraded).
Pokud podezíráme cévní vstupy z toho, že jsou pravděpodobným zdrojem infektu, je navrženo promptní odstranění intravaskulárních materiálů, po zajištění jiného cévního přístupu (ungraded).
Doporučení SSC zdůrazňují fakt, že kromě úvodní hemodynamické resuscitace je včasná antibiotická léčba dalším základním pilířem terapie sepse. Doporučení vycházejí z prací, ve kterých podání antibiotik do 1 hod od stanovení diagnózy septického šoku bylo spojeno s významně lepším přežitím septických pacientů [37]. Např. práce Kumara et al prokázala 7,6% nárůst mortality s každou hodinou o kterou bylo podání antibiotik opožděno, obr. 1 [38]. Nejen faktor času, ale i adekvátní volba antibiotik a jejich dávka jsou klíčovými determinantami klinického výsledku. Nesprávně zvolená antibiotická léčba je jednoznačně spojena s vyšší mortalitou. Mortalita pacientů léčených neadekvátně zvolenými antibiotiky byla v jedné studii 62 % oproti 28 % ve skupině s účinnou antibiotickou léčbou [39]. Přestože v duchu anglického hesla hit hard and hit fast vnímáme tyto závěry jako logické, sami autoři SSC připouštějí, že právě volba a načasování vstupní antimikrobiální terapie představuje jeden z největších klinických problémů. Svoji roli zde nepochybně sehrává i fakt často pozdního diagnostikování vlastní sepse [12]. Volba antibiotika musí mj. zohlednit komunitní či nozokomiální, případně health-care asociované typy infekce, antibiotickou terapii v předchozích 3 měsících, recentní znalosti kolonizace daného pacienta a jeho imunitní status. Mezi nejčastěji podceněné patogeny, zejména u selektovaných pacientů (např. imunosuprimovaných), proti nimž není vstupní léčba namířena, jsou kvasinkové infekce, viry, meticilinrezistentní Stafylococcus aureus (MRSA), vankomycinrezistentní enterokoky (VRE) či rezistentní gramnegativní kmeny. K dalším možným příčinám nedostatečné efektivity antibiotické léčby může přispět i neadekvátní dávka či volba antibiotika s nedostatečným průnikem do infikované tkáně [40]. Jelikož dosažení požadovaných hladin minimální inhibiční koncentrace je předpokladem účinku, je vhodné využívat stále více dostupné monitorování hladin antibiotik, jejichž znalost pak může pomoci k úpravě zvolené dávky. Kombinovaná antibiotická léčba zůstává diskutabilní. Doporučení SSC navrhují zvážit kombinační terapii při podezření na infekci multirezistentními kmeny Pseudomonas aeruginosa či Acinetobacter spp. nebo v případě těžké sepse/septického šoku u neutropenických pacientů [41]. U pseudomonádové infekce s bakteremií, respiračním selháním či šokem lze individuálně zvážit doplnění širokospektrého beta-laktamového antibiotika aminoglykosidem či chinolonem. Smyslem je zvýšení pravděpodobnosti, že alespoň jedno ze zvolených léčiv bude účinné [42]. Kombinace beta-laktamu s klaritromycinem je navržena pro pacienty v septickém šoku s bakteremickými formami infekcí vyvolaných Streptococcus pneumoniae [43].
Graf 1. Mortalita narůstá s každou hodinou, o kterou bylo podání antibiotik opožděno. Upraveno podle [5] ![Mortalita narůstá s každou hodinou, o kterou bylo podání antibiotik opožděno. Upraveno podle [5]](https://pl-master.mdcdn.cz/media/image/95bf3467a14f2c5a7177f8e61e011f73.jpg?version=1537795387)
Pokud antibiotická léčba selhává navzdory své adekvátnosti, je nutné:
- pátrat po neošetřeném ložisku infekce (kolekce, katétry/cizorodý materiál, nekrotické tkáně, nevyřešená obstrukce např. biliární, renální apod)
- zvážit rozvoj rezistence k podávaným antibiotikům nebo superinfekci rezistentními kmeny
- posoudit faktory pacienta (imunitní status, reaktivace cytomegalovirové infekce apod)
Samotná délka antibiotické léčby je předmětem debat plynoucích z nedostatku dat. Při volbě délky terapie je nutné postup individualizovat dle klinické odezvy pacienta na léčbu, dle přítomných komorbidit, zdroje infektu a vyvolávajícího patogenu. Např. metaanalýza 15 randomizovaných studií pacientů s komunitní pneumonií (community-acquired pneumonia – CAP) prokázala, že léčba ATB trvající 7 dní či méně byla stejně efektivní jako léčba trvající > 7 dní [44]. Nejednalo se však o kriticky nemocné pacienty na JIP. K obdobným závěrům dospěla studie sledující minimální délku léčby CAP u hospitalizovaných pacientů, která prokázala, že v případě sepse při pneumonii není výhoda prolongovaného podávání ATB oproti 8 dnům [45,46]. Výjimkou jsou infekce způsobené MRSA, při nichž je optimální doba léčby obvykle delší (14–21 dní) [47].
Obecná a podpůrná léčba
Vzhledem k rozsahu originálního článku v následujícím textu uvádíme pouze zkratkovitě výběr dalších doporučení.
Krevní deriváty
Při absenci myokardiální ischemie, akutního krvácení, ischemické choroby srdeční, těžké hypoxemie je doporučeno podat krevní deriváty při poklesu Hb < 70 g/l s cílovým Hb 70–90 g/l (1B).
U pacientů s těžkou sepsí je navrženo profylakticky podávat trombocytární nálev v případě poklesu trombocytů pod 10 000/mm3 při absenci rizika krvácení. Je-li přítomno riziko krvácení, pak při poklesu pod 20 000/mm3. Při plánovaných chirurgických či invazivních výkonech či při krvácení je navrženo dosáhnout trombocytů nad 50 000/mm3 (2D).
Imunoglobuliny se v léčbě sepse a septického šoku nedoporučují (2B).
Kontrola glykemie
Při 2krát po sobě změřené glykemii > 10 mmol/l je doporučeno zahájit protokolizovanou léčbu inzulinem (1A).
Náhrada funkce ledvin
U pacientů s těžkou sepsí/septickým šokem a akutním renálním selháním je navrženo použít kontinuální nebo intermitentní náhradu funkce ledvin. Obě metody jsou ekvivalentní, protože krátkodobá mortalita je srovnatelná (2B).
U hemodynamicky nestabilních pacientů je k optimalizaci tekutinového managementu navrženo preferovat kontinuální metody (2D).
Bikarbonát
K ovlivnění potřeby katecholaminu a ovlivnění hypoperfuzí navozené laktátové acidózy s pH > 7,15 se nedoporučuje používat bikarbonát sodný (2B).
Výživa
Je-li tolerována, je navrženo preferovat časnou (do 48 hod) enterální výživu před hladověním (2C).
V prvních 7 dnech od diagnózy sepse/těžké sepse je navrženo používat intravenózní roztok glukózy a enterální nutrici spíše než totální parenterální výživu samotnou či v kombinaci s enterální výživou (2B).
Je navrženo preferovat nízkokalorický (např. do 500 kcal/den) příjem před plnou kalorickou výživou v prvním týdnu (2B).
Nedoporučuje se žádná specifická imunonutrice (2C).
Závěr
Vzhledem k vzrůstající incidenci sepse a septického šoku s nadále alarmující mortalitou jsou pravidelně aktualizovaná doporučení založená na analýze dostupných dat logickou snahou v ovlivnění tohoto nepříznivého trendu. Přesto je nutné si uvědomit, že každá doporučení jsou pouze všeobecným návodem, nikoli závazným textem, jak v dané populaci nemocných postupovat. U každého pacienta je nezbytný individuální přístup s přihlédnutím k aktuálnímu klinickému stavu a komorbiditám.
Tento projekt byl podpořen Programem rozvoje vědních oborů Karlovy Univerzity (projekt P36) a projektem CZ.1.05/2.1.00/03.0076 Evropského fondu pro regionální rozvoj.
prof. MUDr. Martin Matějovič, Ph.D.
MATEJOVIC@fnplzen.cz
I. interní klinika LF UK a FN, Plzeň
www.fnplzen.cz
Doručeno do redakce: 26. 7. 2013
Přijato po recenzi: 4. 10. 2013
Zdroje
1. Kochanek KD, Murphy SL, Anderson RN et al. Deaths: final data for 2002. Natl Vital Stat Rep 2004; 53(5): 1–115.
2. Martin GS, Mannino DS, Eaton S et al. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med 2003; 348(16): 1546–1554.
3. Gaieski DF, Edwards JM, Kallan MJ et al. Benchmarking the incidence and mortality of severe sepsis in the United States. Crit Care Med 2013; 41(5): 1167–1174.
4. Angus DC, Linde-Zwirble WT, Lidicker J et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome and associated costs of care. Crit Care Med 2001; 29(7): 1303–1310.
5. Kumar A, Kazmi M, Roberts D et al. Duration of shock prior to antimicrobial administration is the critical determinant of survival in human septic shock. Crit Care Med 2004; 32(Suppl): 41.
6. Rivers E, Nguyen B, Havstad S et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345(19): 1368–1377.
7. Dellinger RP, Levy MM, Rhodes A et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med 2013; 39(2): 165–228.
8. Levy MM, Fink MP, Marshall JC et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med 2003; 31(4): 1250–1256.
9. Czura CJ. „Merinoff symposium 2010: sepsis” – speaking with one voice. Mol Med 2011; 17(1–2): 2–3.
10. Vincent JL, Opal SM, Marshall JC et al. Sepsis definitions: time for change. Lancet 2013; 381(9868): 774–775.
11. Gao F, Melody T, Daniles DF et al. The impact of compliance with 6-hour and 24-hour sepsis bundles on hospital mortality in patients with severe sepsis: a prospective observational study. Crit Care 2005; 9(6): 764–770.
12. Levy MM, Dellinger RP, Townsend SR et al. The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis. Intensive Care Med 2010; 36(2): 222–231.
13. Wacharasint P, Nakada TA, Boyd JH et al. Normal-range blood lactate concentration in septic shock is prognostic and predictive. Shock 2012; 38(1): 4–10.
14. Puskarich MA, Trzeciak S, Shapiro NI et al. Outcomes of patients undergoing early sepsis resuscitation for cryptic shock compared with overt shock. Resuscitation 2011; 82(10): 1289–1293.
15. Perner A, Haase N, Guttormsen AB et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med 2012; 367(2): 124–134.
16. Myburgh JA, Finfer S, Bellomo R et al. Australian and New Zealand Intensive Care Society Clinical Trials Group: Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med 2012; 367(20): 1901–1911.
17. Shaw AD, Kellum JA. The risk of AKI in patients treated with Intravenous solutions containing hydroxyethyl starch. Clin J Am Soc Nephrol 2013; 8(3): 497–503.
18. Antonelli M, Sandroni C. Hydroxyethyl starch for intravenous volume replacement: more harm than benefit. JAMA 2013; 309(7): 723–724.
19. Patel A, Waheed U, Brett SJ. Randomised trials of 6% tetrastarch (hydroxyethyl starch 130/0.4 or 0.42) for severe sepsis reporting mortality: systematic review and meta-analysis. Intensive Care Med 2013; 39(5): 811–822.
20. Haase N, Perner A, Hennings LI et al. Hydroxyethyl starch 130/0.38–0.45 versus crystalloid or albumin in patients with sepsis: systematic review with meta-analysis and trial sequential analysis. BMJ 2013; 346 : 839. Dostupné z DOI: <http://doi: 10.1136/bmj.f839>.
21. Zarychanski R, Abou-Setta AM, Turgeon AF et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. JAMA 2013; 309(7): 678–688.
22. KDIGO AKI Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter 2012; 2(Suppl): 1–138.
23. Yunos NM, Bellomo R, Hegarty C et al. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA 2012; 308(15): 1566–1572.
24. Shaw AD, Bagshaw SM, Goldstein SL et al. Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma-Lyte. Ann Surg 2012; 255(5): 821–829.
25. De Backer D, Biston P, Devriendt J et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010; 362(9): 779–789.
26. De Backer D, Aldecoa C, Njimi H et al. Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis. Crit Care Med 2012; 40(3): 725–730.
27. Matejovic M, Träger K, De Backer D. Noradrenaline and the kidney: foe, friend, or both? Intensive Care Med 2005; 31(11): 1476–1478.
28. Marik PE. Surviving sepsis: going beyond the guidelines. Ann Intensive Care 2011; 1(1): 17. Dostupné z DOI: <http://doi: 10.1186/2110–5820–1-17>.
29. Hamzaoui O, Georger JF, Monnet X et al. Early administration of norepinephrine increases cardiac preload and cardiac output in septic patients with life-threatening hypotension. Crit Care 2010; 14(4): 142.
30. Sprung CL, Annane D, Keh D et al. Hydrocortisone therapy for patients with septic shock. N Engl J Med 2008; 358(2): 111–124.
31. Annane D, Sébille V, Charpentier C et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 2002; 288(7): 862–871.
32. Shapiro N, Howell MD, Bates DW et al. The association of sepsis syndrome and organ dysfunction with mortality in emergency department patients with suspected infection. Ann Emerg Med 2006; 48(5): 583–590.
33. Weinstein MP, Reller LB, Murphy JR et al. The clinical significance of positive blood cultures: a comprehensive analysis of 500 episodes of bacteremia and fungemia in adults. I. Laboratory and epidemiologic observations. Rev Infect Dis 1983; 5(1): 35–53.
34. Cockerill FR 3rd, Wilson JW, Vetter EA et al. Optimal testing parameters for blood cultures. Clin Infect Dis 2004; 38(12): 1724–1730.
35. Mermel LA, Maki DG. Detection of bacteremia in adults: consequences of culturing an inadequate volume of blood. Ann Intern Med 1993; 119(4): 270–272.
36. Höffken G, Niederman MS. Nosocomial pneumonia: the importace of a de-escalation strategy for antibiotic treatment of pneumonia in the ICU. Chest 2002; 122(6): 2183–2196.
37. Gaieski DF, Mikkelsen ME, Band RA et al. Impact of time to antibiotics on survival in patients with severe sepsis or septic shock in whom early goal-directed therapy was initiated in the emergency department. Crit Care Med 2010; 38(4): 1045–1053.
38. Kumar A, Roberts D, Wood KE et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006; 34(6): 1589–1596.
39. Ibrahim EH, Sherman G, Ward S et al. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting. Chest 2000; 118(1): 146–155.
40. Radej J, Matejovic M. Antimicrobial dosing in critically ill patients requiring renal replacement therapy – maximize efficacy and minimize toxicity! Vnitř Lék 2012; 58(6): 427–429.
41. Kumar A, Zarychanski R, Light B et al. Early combination antibiotic therapy yields improved survival compared with monotherapy in septic shock: A propensity-matched analysis. Crit Care Med 2010; 38(9): 1773–1785.
42. Al-Hasan MN, Wilson JW, Lahr BD et al. Beta-lactam and fluoroquinolone combination antibiotic therapy for bacteremia caused by gram-negative bacilli. Antimicrob Agents Chemother 2009; 53(4): 1386–1394.
43. Martin-Loeches I, Lisboa T, Rodriguez A et al. Combination antibiotic therapy with macrolides improves survival in intubated patients with community-acquired pneumonia. Intensive Care Med 2010; 36(4): 612–620.
44. Li JZ, Winston LG, Moore DH et al. Efficacy of short-course antibiotic regimens for community-acquired pneumonia: a meta-analysis. Am J Med 2007; 120(9): 783–790.
45. Chastre J, Wolff M, Fagon JY et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA 2003; 290(19): 2588–2598.
46. Hedrick TL, McElearney ST, Smith RL et al. Duration of antibiotic therapy for ventilator-associated pneumonia caused by non-fermentative gram-negative bacilli. Surg Infect (Larchmt) 2007; 8(6): 589–597.
47. Liu C, Bayer A, Cosgrove SE et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011; 52(3): 18–55.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Ohlédnutí za atestacemi z vnitřního lékařství – in medias res!
- Autoinflamace: patologický důsledek dysregulace zánětlivé reakce – editorial
- Vitamin D ve vztahu ke karcinomu hlavy a krku – editorial
- Terapie těžké sepse v roce 2013 – editorial
- Familiární středozemní horečka v České republice
-
Úvodní slovo předsedy České internistické společnosti, profesora MUDr. Richarda Češky, CSc., FACP, FEFIM
Česká interna a časopis Vnitřní lékařství v roce 2014 - Familiárna stredomorská horúčka – klinický obraz, diagnóza a liečba
- Food intake regulation – 2nd part
-
Úvodné slovo prezidentky Slovenskej internistickej spoločnosti, profesorky MUDr. Ivice Lazúrovej, CSc., FRCP
Quo vadis interná medicína? - Vitamin D ve vztahu ke karcinomu hlavy a krku
- Mezinárodní doporučení pro léčbu těžké sepse a septického šoku 2012 – komentovaný výběr
- Perspektivní přístupy v léčbě sepse založené na principu nových patogenetických poznatků
-
Úvodní slovo šéfredaktora časopisu Vnitřní lékařství,primáře MUDr. Petra Svačiny
60 let časopisu Vnitřní lékařství – retrospektiva, realita a perspektiva - Vliv konzumace alkoholu na srdeční elektrofyziologii
- Familiárna stredomorská horúčka – prvé skúsenosti na Slovensku
- Býti internistou
- K 30. výročí úmrtí profesora Josefa Charváta
- Oznam/Oznámení
- Nový občanský zákoník a poskytování zdravotních služeb
- Ondřej Viklický et al. Predialýza.
- Pavel Klener jr, Pavel Klener. Principy systémové protinádorové léčby.
- Vítězslav Kolek et al. Doporučené postupy v pneumologii.
- Vladimír Koblížek et al. CHOPN.
- Petr Ošťádal, Jan Bělohlávek. ECMO – Extrakorporální membránová oxygenace.
- Boris Krahulec, Ľubomíra Fábryová, Pavol Holéczy, Iwar Klimeš (eds) et al. Klinická obezitológia.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv konzumace alkoholu na srdeční elektrofyziologii
- Familiární středozemní horečka v České republice
- Familiárna stredomorská horúčka – klinický obraz, diagnóza a liečba
- Mezinárodní doporučení pro léčbu těžké sepse a septického šoku 2012 – komentovaný výběr
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



