-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vede fyzická aktivita při přerušení dodávky inzulinu inzulinovou pumpou u pacientů s diabetem 1. typu ke klinicky významným změnám?
Does physical activity produce clinically significant changes during discontinuation of insulin pump in type 1 diabetic patients?
Introduction:
Discontinuation of insulin pump treatment (CSII) before, during and after physical activity is a common practice among a number of patients. The aim of the study was to evaluate the course of insulinemia during a 3 - hour insulin pump suspension and after consecutive insulin bolus administration, and additionally, to assess the effect of physical activity (mid ‑ intensity aerobic exercise).Patient and methods:
We enrolled 12 patients with diabetes mellitus type 1 in the study (men, mean age 33.4 ± 8.66 years, diabetes duration 16.3 ± 8.76 years, CSII treatment duration 6.9 ± 4.60 years, BMI 25.7 ± 3.75 mg/ m2, HbA1c 8.4 ± 0.95%, total insulin dose 50.3 ± 12.50 IU/ day). The tests were performed after night fasting at usual insulin doses, without serving breakfast and morning bolus dose. In the course of the test, insulin administration by a pump was suspended for 3 hours. Blood for assessment of blood glucose and insulinemia was taken in 30 - minute intervals during the test. A test with or without physical exercise on bicycle ergometer was performed in each patient 2 weeks later.Results:
We did not prove any influence of physical exercise on insulinemia during suspended insulin delivery by an insulin pump. Insulinemia of approximately 50% of the original value persisted for another 90 minutes following insulin pump suspension. A rapid increase in insulinemia occurred after bolus administration in the 180th minute of the test. However, the decrease in blood glucose level did not occur until after another 90 minutes.Conclusion:
When modifying CSII treatment by reduction or suspension of insulin delivery it is essential to bear in mind the gradual decrease in insulinemia as well as the delay in insulin action following bolus administration.Key words:
type 1 diabetes mellitus – CSII – insulin pump – insulinemia – physical exercise
Autoři: Z. Jankovec; D. Čechurová; V. Česák; M. Krčma; M. Žourek; Z. Rušavý
Působiště autorů: I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MU Dr. Martin Matějovič, Ph. D.
Vyšlo v časopise: Vnitř Lék 2013; 59(9): 764-768
Kategorie: Původní práce
Souhrn
Úvod:
U řady pacientů se setkáváme s přerušením léčby inzulinovou pumpou (CSII) před, v průběhu a po fyzické aktivitě. Cílem práce bylo posoudit vývoj inzulinemie během 3hodinového zastavení inzulinové pumpy a po následném podání bolusu inzulinu a porovnat i vliv fyzické aktivity (aerobní zátěž střední intenzity).Pacienti a metody:
Do studie jsme zařadili 12 pacientů s diabetem 1. typu (muži, průměrný věk 33,4 ± 8,66 roku, trvání diabetu 16,3 ± 8,76 roku, trvání léčby CSII 6,9 ± 4,60 roku, BMI 25,7 ± 3,75 mg/ m2, HbA1c 8,4 ± 0,95 %, celková dávka inzulinu 50,3 ± 12,50 IU/ den). Testy byly provedeny po nočním lačnění při zavedených dávkách inzulinu, bez podání snídaně a ranní bolusové dávky. Během testu byla na 3 hod zastavena dodávka inzulinu pumpou. Po dobu testu byly v 30minutových intervalech prováděny náběry na stanovení glykemie a inzulinemie. U každého pacienta byl v náhodném pořadí s odstupem 2 týdnů proveden test s nebo bez fyzické zátěže na bicyklovém ergometru.Výsledky:
Neprokázali jsme vliv fyzické aktivity na inzulinemii při zastavené dodávce inzulinu inzulinovou pumpou. Po zastavení inzulinové pumpy přetrvávala po dobu dalších 90 min inzulinemie na asi 50 % výchozí hodnoty. Po aplikaci bolusu v 180. min testu došlo rychle k vzestupu inzulinemie. K poklesu hodnot glykemie však došlo až během dalších 90 min.Závěr:
Při úpravách terapie CSII formou snížení nebo zastavení dodávky inzulinu je nutno brát v úvahu postupný pokles inzulinemie i zpoždění vlastního účinku inzulinu po aplikaci bolusu.Klíčová slova:
diabetes mellitus 1. typu – CSII – inzulinová pumpa – inzulinemie – fyzická aktivitaÚvod
Léčba kontinuální podkožní inzulinovou infuzí (continuous subcutaneous insulin infusion – CSII) neboli inzulinovou pumpou je variantou intenzifikované inzulinové terapie a využívá trvalý přívod inzulinu v malých dávkách podkožně, který pokrývá základní (bazální) potřebu inzulinu doplněnou o bolusové dávky inzulinu prandiálně. Toto umožňuje mnohem efektivnější a flexibilnější nastavení inzulinové léčby a přizpůsobení životnímu stylu a potřebám diabetiků. CSII je v současnosti široce využívána v léčbě pacientů s diabetes mellitus.
Přes řadu výhod je nutné brát v úvahu malé subkutánní depo inzulinu při jeho kontinuálním podávání. To může zvyšovat riziko ketoacidózy rychlejším nástupem symptomů plynoucích z nedostatku inzulinu, což dokumentují zejména práce z 80. a 90. letminulého století. Již po 2 – 3 hod přerušení aplikace inzulinu CSII může dojít k rozvoji závažné ketoacidózy, zejména v kombinaci s dalšími nepříznivými faktory [1,2]. Rizika spojená s přerušením dodávky inzulinu teoreticky narůstají i s užitím krátce působících analog inzulinu. Studie z poslední doby ale nepopisují vyšší riziko ketoacidózy při léčbě CSII ve srovnání s bolusovou aplikací inzulinu [3 – 7]. Snížení rizika ketoacidózy je dáno hlavně zlepšením technické úrovně inzulinových pump i většími zkušenosti zdravotnického personálu a komplexní edukací pacientů [8].
Na druhé straně fyzická aktivita spolu s léčbou inzulinem vede k zvýšenému riziku hypoglykemie. Výhodou CSII je i možnost redukce dávky inzulinu (případně zastavení inzulinové pumpy), která je obecně doporučována. V tomto případě může hrát roli i reziduální depo inzulinu při zastavení inzulinové pumpy. Již práce z roku 1986 ukázala, že např. při rychlosti podávání inzulinu 1 IU/ hod tvoří depo asi 3 – 5 IU inzulinu a k ustálení rovnovážného stavu mezi dodávkou inzulinu a jeho absorpcí dochází asi za 2,5 – 4 hod po změně rychlosti dodávky. Ještě delší doba je nutná k nastavení rovnováhy po delším zastavení CSII – asi 8 – 12 hod [9,10].
V reálném životě je řada situací, kdy je nutné na krátkou či delší dobu zastavit dodávku inzulinu inzulinovou pumpou – servis CSII, denní hygiena, fyzická aktivita (zejména kontaktní a vodní sporty), případně i intimní aktivity. Obecně je však doporučováno nepřerušovat dodávku inzulinu při léčbě CSII na déle než 2 hod [8]. Např. práce z roku 1990 ukázala, že ani 60minutové přerušení léčby CSII nevede ke klinicky významným metabolickým a hormonálním změnám a redukce dávky inzulinu (před, během i po fyzické aktivitě v závislosti na intenzitě a trvání) příznivě ovlivňuje četnost hypoglykemií [11].
Vliv fyzické aktivity byl studován ve vztahu k bolusovému podávání inzulinu, byl popsán vliv na absorpci inzulinu stran řady faktorů – složení inzulinů (monomery, dimery, hexamery), objemu aplikované dávky, koncentrace inzulinu, způsobu (s.c. a i.m.) a místa aplikace, lokální teploty [12 – 15]. Dosavadní poznatky o vlivu fyzické aktivity na vstřebávání inzulinu jsou rozporné. Část studií popisuje zvýšené vstřebávání vlivem svalové práce v blízkosti aplikovaného inzulinu, jiné práce nepopisují žádné rozdíly [16,17]. Ve většině případů se ale jedná o práce z 80. – 90. let 20. století zkoumající humánní inzuliny. Práce srovnávající absorpci inzulinu glargin neprokázala žádný vliv fyzické aktivity [18].
Cílem naší práce bylo posoudit vývoj inzulinemie během 3hodinového zastavení inzulinové pumpy a po následném podání bolusu inzulinu, porovnat i vliv fyzické aktivity (aerobní zátěž střední intenzity) u pacientů s diabetem 1. typu a ověřit vhodnost zastavení bazální dodávky krátkodobě působícího inzulinového analoga inzulinovou pumpou při fyzické aktivitě.
Metodika
Do randomizované crossover studie bylo zařazeno 12 pacientů (mužů) s diabetem 1. typu, léčených inzulinovou pumpou po dobu minimálně 12 měsíců. Tři pacienti byli léčeni inzulinem aspart (Novorapid, Novo Nordisk, Bagsvaerd, Dánsko) a 9 inzulinem lispro (Humalog, Eli Lilly, Indianapolis IN). Žádný z pacientů neměl závažné makrovaskulární nebo mikrovaskulární komplikace diabetu, jiná onemocnění, ani neužíval jiné léky než inzulin. Klinické charakteristiky pacientů jsou uvedeny v tab. 1.
Tab. 1. Charakteristiky pacientů – ve formátu průměr ± SD. 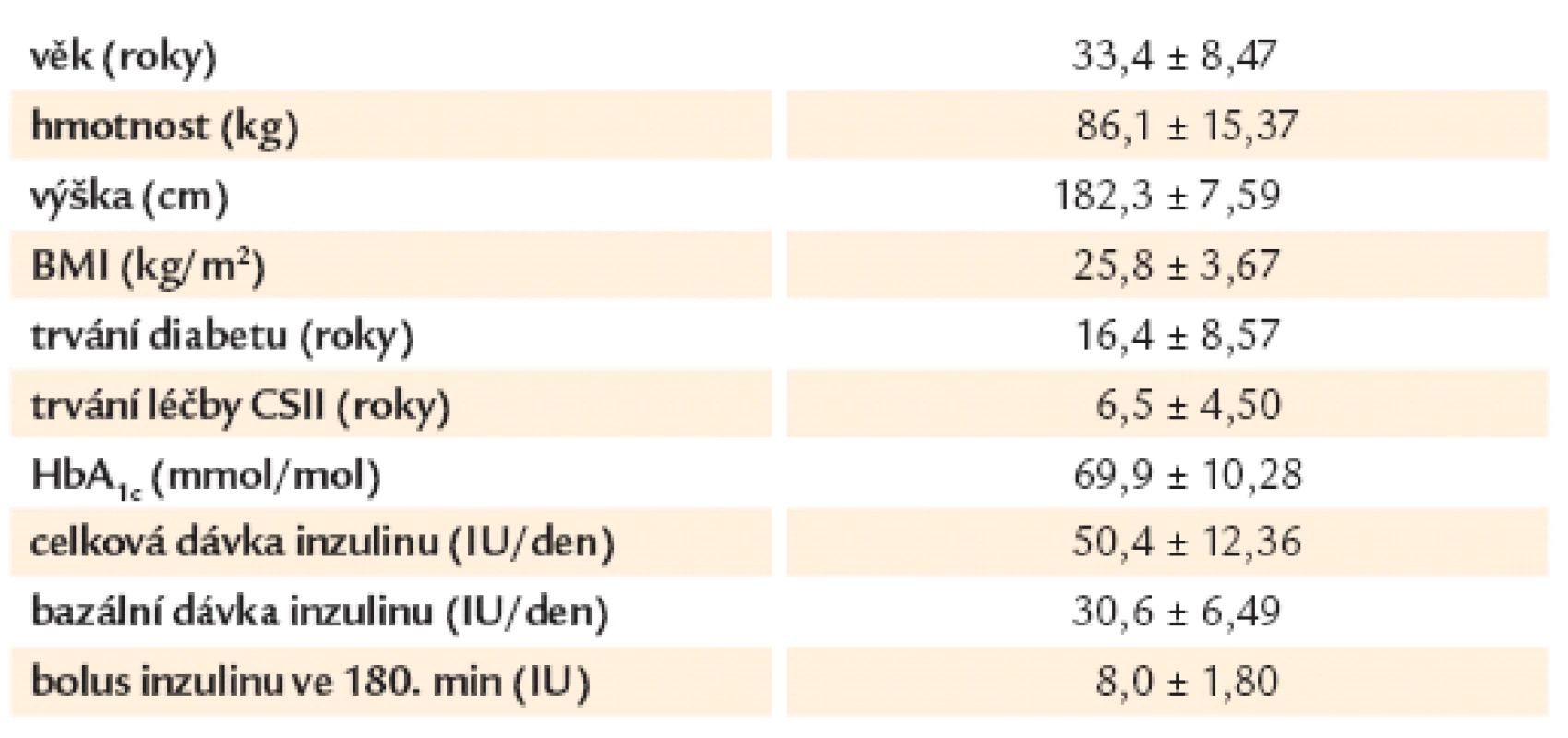
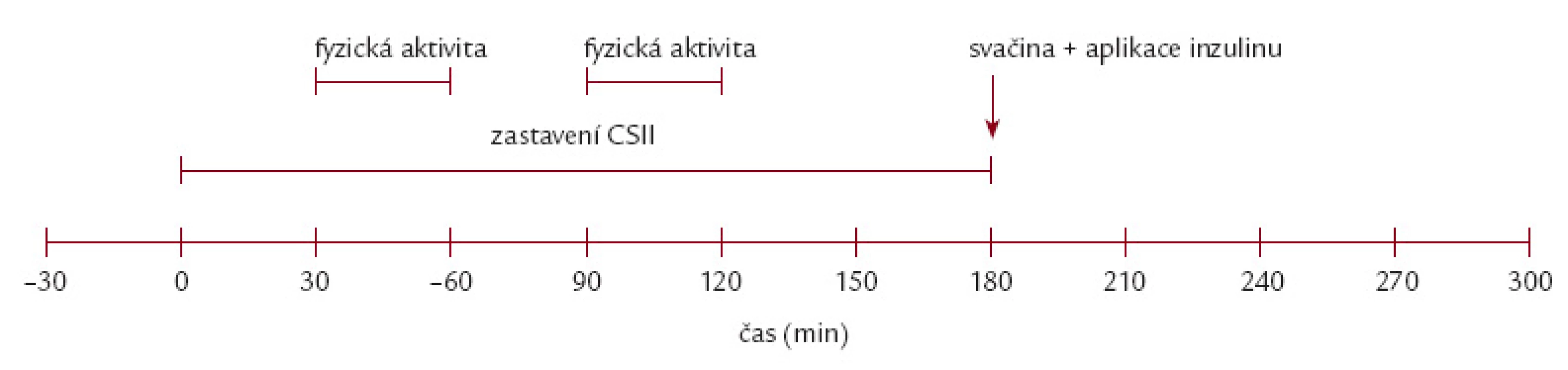
V den vyšetření se pacient dostavil v 6.45 hod nalačno, bez aplikace ranního bolusu a na zavedené bazální dávce inzulinu. Vyšetření byla provedena při výchozí glykemii 4 – 10 mmol/ l, v případě předcházející noční hypoglykemie nebyl test proveden. Byla zavedena i.v. kanyla k odběru krevních vzorků. V čase T0 byla zastavena aplikace inzulinu pumpou na 180 min, poté (T180) byla obnovena aplikace inzulinu (pacientova obvyklá bazální rychlost inzulinu) a podána standardní svačina (40 g sacharidů, 32 g tuků, 32 g bílkovin, 585 kcal) spolu s aplikací bolusové dávky inzulinu (stanovena jako 4 IU + množství nepodaného inzulinu za 3 hod zastavení CSII). Po dalších 120 min (T300) byl test ukončen. Časové schéma studie zobrazuje obr. 1.
Každý pacient byl v náhodném pořadí v odstupu 2 týdnů vyšetřen S a BEZ fyzické aktivity. V testu BEZ fyzické aktivity měl pacient klidový režim bez větší fyzické nebo duševní aktivity. V testu S fyzickou aktivitou podstoupil pacient 2krát 30minutovou zátěž na bicyklovém ergometru (Kettler X1, Heinz Kettler GmbH & Co. KG, Ense - Parsit, Germany) ve 30. – 60. a 120. – 150. min po zastavení CSII (T30 – T160 a T120 – T150). Cílová tepová frekvence odpovídající střední aerobní zátěži byla stanovena jako 60 % tepové rezervy, tzn. (TFmax – TFrest) × 0,6 + TFrest (klidová tepová frekvence TFrest; maximální tepová frekvence TFmax; TFmax = 220 – věk). Ve sledované skupině byly průměrné hodnoty klidové tepové frekvence 70,6 ± 10,41 tepů/ min a cílové tepové frekvence 140,1 ± 5,37 tepů/ min.
Po dobu testu byly monitorovány v intervalech 30 min: krevní tlak, tepová frekvence, glykemie a odebrány vzorky krve ke stanovení inzulinemie. Acidobazická rovnováha z kapilární krve byla vyšetřena v čase T0, T120, T180 a T300.
Stanovení žilní glykemie bylo provedeno glukózo - dehydrogenázovou metodou (HemoCue 201 – HemoCue, Ängelholm, Sweden), stanovení inzulinemie chemiluminiscenční imunoanalýzou na mikročásticích (Architect Insulin, Abbott, Tokyo, Japan).
Ke statistickému hodnocení byly použity neparametrické testy: Wilcoxonův test a Spearmanův koeficient pořadové korelace. Charakteristiky souboru jsou uvedeny ve formě průměr ± směrodatná odchylka, ostatní výsledky ve formě medián (1. kvartil, 3. kvartil).
Protokol byl schválen místní etickou komisí a každý vyšetřovaný pacient podepsal informovaný souhlas se studií.
Výsledky
Srovnání hodnot základních sledovaných parametrů mezi testem S fyzickou aktivitou a BEZ fyzické aktivity zobrazuje graf 1.
Graf 1. Změny glykemie a inzulinemie. Zastavení dodávky inzulinu 0.–180. min, fyzická aktivita (FA) během 30.–60. min a 120.–150. min. Výsledky jsou ve formátu medián (1. kvartil, 3. kvartil). 
Inzulinemie
V průběhu inzulinemie po zastavení dodávky inzulinu i po jejím obnovení jsme nenalezli statisticky signifikantní rozdíly mezi skupinou S fyzickou aktivitou a BEZ fyzické aktivity. Po 180. min zastavení CSII došlo v testu S fyzickou aktivitou k poklesu z 16,2 (10,2; 25,73) na 4,7 (2,88; 10,68) μU/ ml a v testu BEZ fyzické aktivity z 15,3 (12,5; 21,48) na 4,7 (2,8; 8,85) μU/ ml. Po aplikaci bolusu inzulinu došlo k rychlému vzestupu inzulinemie již po 30 min – S fyzickou aktivitou 27,7 (20,15; 39,45) vs BEZ fyzické aktivity 30,0 (18,95; 41,63) μU/ ml, NS.
Glykemie
Během testu S a BEZ fyzické aktivity jsme nalezli rozdíl pouze v glykemii v T270 – S fyzickou aktivitou 13,9 (9,10; 16,50) mmol/ l vs BEZ fyzické aktivity 15,2 (13,65; 16,70) mmol/ l, p < 0,05. Dále hraničně nesignifikantní rozdíly byly přítomny ihned po skončení fyzické aktivity v T60 – S fyzickou aktivitou 5,9 (4,20; 8,63) mmol/ l vs BEZ fyzické aktivity 7,65 (6,58; 9,00) mmol/ l, p = 0,12 a v T150 – S fyzickou aktivitou 8,55 (5,70; 11,53) mmol/ l vs BEZ fyzické aktivity 10,15 (8,98; 12,18) mmol/ l, p = 0,10.
Acidobazická rovnováha
Mezi oběma testy jsme nenalezli žádné statisticky signifikantní rozdíly v parametrech acidobazické rovnováhy. Hodnoty kapilární pH a base excess (BE) jsou uvedeny v tab. 2.
Tab. 2. Parametry acidobazické rovnováhy – ve formátu medián (1. kvartil, 3. kvartil). Žádný z parametrů se ve vyšetřovaných skupinách (s a bez fyzické aktivity) statisticky významně nelišil. Hodnoty base excess (BE) jsou uvedeny v mmol/l. 
Diskuze
Přerušení dodávky inzulinu inzulinovou pumpou vedlo u obou testů k vzestupu glykemie a k poklesu inzulinemie. Po obnovení dodávky inzulinu a aplikaci bolusu došlo k rychlému vzestupu inzulinemie. Neprokázali jsme významný vliv fyzické aktivity na inzulinemii během 3hodinového zastavení inzulinové pumpy.
V naší studii fyzická aktivita nijak neovlivnila vstřebávání krátce působícího inzulinu. Vzhledem k tomu, že jsme testy prováděli v ranních hodinách, nalačno, bez podání bolusu, nelze ale předpokládat větší podkožní depo inzulinu, jehož vstřebání by mohlo být fyzickou aktivitou ovlivněno. Po zastavení inzulinové pumpy přetrvávala v 90. min inzulinemie asi na 50 % výchozí hodnoty u obou testů – medián 56,3 % (49,8 %; 75,2 %). Ve 180. min byla inzulinemie stále asi na třetině výchozí hodnoty – medián 30,8 % (25,0 %; 55,3 %). Velké rozdíly mezi jednotlivými pacienty s diabetem jsou zřejmě dány rozdílným nastavením bazálních dávek, a tím velikostí podkožního depa inzulinu před zastavením inzulinové pumpy, svou roli jistě hraje i rozdílná absorpce inzulinu z podkoží a jeho následná degradace. Po aplikaci bolusu ve 180. min došlo u obou testů rychle k vzestupu inzulinemie, ve shodě s publikovanými studiemi [1,7,18,19]. Ani tento vzestup nebyl ovlivněn předchozí fyzickou aktivitou.
Přestože jsme předpokládali výraznější rozdíly v glykemiích, zejména nižší hodnoty v testu s fyzickou aktivitou, oba testy se vzájemně statisticky nelišily. Zjistili jsme pouze signifikantně nižší glykemii v 270. min po fyzické aktivitě. Hodnoty glykemií po skončení fyzické aktivity (ve 60. a 150. min) vykazovaly větší tendenci k poklesu, ale bez statistické významnosti (ta může být ovlivněna i malým počtem hodnocených pacientů). Menší pokles glykemie po fyzické aktivitě mohl být způsoben kontraregulační odpovědí na zátěž a přiměřenou glukoneogenezí, případně trváním a intenzitou zvolené fyzické aktivity. Naopak výraznější vzestup glykemií jsme pozorovali až po 60 – 90 min zastavení dodávky inzulinu, což odpovídalo výraznějšímu poklesu inzulinemie. Po aplikaci bolusu inzulinu a podání svačiny ve 180. min testu začala glykemie klesat až po dalších 120 min, což je zřejmě dáno opožděným nástupem účinku inzulinu, nevyloučíme ani podhodnocení korekční dávky inzulinu.
Během studie nedošlo u žádného pacienta k výraznějšímu ovlivnění acidobazické rovnováhy ve smyslu rozvoje diabetické ketoacidózy. Dále jsme nezaznamenali žádnou hypoglykemii, 1 test musel být odložen pro předcházející noční hypoglykemii. Výsledky jsou ve shodě s podobnými publikovanými pracemi, které prokázaly významně nižší sklon k hypoglykemiím a vedou k doporučením redukce (event. úplné zastavení) aplikované dávky inzulinu během fyzické aktivity [5,6,11,20,21]. V našem případě probíhala fyzická aktivita v ranních hodinách, nalačno, tedy v době relativně nižší počáteční inzulinemie. Zejména v situacích po aplikaci bolusu inzulinu a vyšší inzulinemie roste riziko hypoglykemie během nebo po fyzické aktivitě.
Závěr
Závěrem, při pozvolném poklesu inzulinemie dochází k vzestupu glykemií bez většího ovlivnění fyzickou aktivitou (v našem případě 2krát 30 min aerobní zátěže střední intenzity). Tříhodinové přerušení aplikace inzulinu inzulinovou pumpou za podmínky předchozí normoglykemie a vyrovnaného metabolického stavu je bezpečné a nevede k rozvoji diabetické ketoacidózy. Aplikace korekčního bolusu vede k rychlé normalizaci inzulinemie, pokles glykemie však můžeme očekávat se zpožděním asi 2 hod. Naopak i přes zastavení dodávky inzulinu je třeba počítat s přetrvávající metabolickou aktivitou inzulinu minimálně po dobu 60 – 90 min a následně s postupným nástupem a stabilizací účinku (asi 2 – 4 hod) po obnovení dodávky inzulinu [22,23]. Existují však rozdíly mezi jednotlivými vyšetřovanými pacienty v hodnotách inzulinemie i relativní rychlosti jejího poklesu po zastavení inzulinové pumpy. Tyto okolnosti je třeba vždy uvážit při individuálních úpravách léčby inzulinovou pumpou konkrétního pacienta, zejména při úplném přerušení aplikace inzulinu ve vztahu k fyzické aktivitě.
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
MU Dr. Zdeněk Jankovec, Ph.D.
www.fnplzen.cz
e‑mail: jankovec@fnplzen.cz
Doručeno do redakce: 8. 1. 2013
Přijato po recenzi: 2. 4. 2013
Zdroje
1. Radermecker RP, Scheen AJ. Continuous subcutaneous insulin infusion with short ‑ acting insulin analogues or human regular insulin: efficacy, safety, quality of life, and cost‑effectiveness. Diabetes Metab Res Rev 2004; 20 : 178 – 188.
2. Newton CA, Raskin P. Diabetic ketoacidosis in type 1 and type 2 diabetes mellitus. Clinical and biochemical differences. Arch Intern Med 2004; 164 : 1925 – 1931.
3. Egger M, Davey Smith G, Stettler C et al. Risk of adverse effects of intensified treatment in insulin‑dependent diabetes mellitus: a meta‑analysis. Diabet Med 1997; 14 : 919 – 928.
4. Hoogma RP, Hammond PJ, Gomis R et al. Comparison of the effects of continuous subcutaneous insulin infusion (CSII) and NPH‑based multiple daily insulin injections (MDI) on glycaemic control and quality of life: results of the 5 - nations trial. Diabet Med 2005; 23 : 141 – 147.
5. Hanas R, Ludvigsson J. Hypoglycemia and ketoacidosis with insulin pump therapy in children and adolescents. Pediatr Diabetes 2006; 7 (Suppl 4): 32 – 38.
6. Weissberg ‑ Benchell J, Antisdel ‑ Lomaglio J, Seshadri R. Insulin pump therapy. A meta‑analysis. Diabetes Care 2003; 26 : 1079 – 1087.
7. Guerci B, Meyer L, Salle A et al. Comparison of metabolic deterioration between insulin analog and regular insulin after a 5 - hour interruption of continuous subcutaneous insulin infusion in type 1 diabetic patients. JCEM 1999; 84 : 2673 – 2678.
8. Guilhem I, Leguerrier AM, Lecordier F et al. Technical risk with subcutaneous insulin infusion. Diabetes Metab 2006; 32 : 279 – 284.
9. Hildebrandt P, Birch KJ, Jensen BM et al. Absorption of subcutaneously infused insulin: Influence of the basal rate pulse interval. Diabetes Care 1985; 8 : 287 – 289.
10. Hildebrandt P, Birch KJ, Jensen BM et al. Subcutaneous insulin infusion: Chenge in basal infusion rate has no immediate effect on insulin absorption rate. Diabetes Care 1986; 9 : 561 – 564.
11. Sonnenberg GE, Kemmer FW, Berger M. Exercise in Type 1 (insulin‑dependent) diabetic patients treated with continuous subcutaneous insulin infusion. Diabetologia 1990; 33 : 696 – 703.
12. Berger M, Cüppers HJ, Hegner H et al. Absorption kinetics and biologic effects of subcutaneously injected insulin preparations. Diabetes Care 1982; 5 : 77 – 91.
13. Mosekilde E, Jensen K, Binder C et al. Modeling absorption kinetics of subcutaneous injected soluble insulin. J Pharmacokinet Biopharm 1989; 17 : 67 – 87.
14. Ariza ‑ Andraca CR, Altamirano ‑ Busta-mante P, Graef A et al. Delayed insulin absorption due to subcutaneous edema. Arch Invest Med 1991; 22 : 229 – 233.
15. Hildebrandt P. Subcutaneous absorption of insulin in insulin‑dependent diabetic patients: influence of species, physicochemical properties of insulin and physiological factors. Dan Med Bull 1991; 38 : 337 – 346.
16. Kemmer FW, Berchtold P, Berger M et al. Exercise‑induced fall of blood glucose in insulin‑treated diabetics unrelated to alteration of insulin mobilisation. Diabetes 1979; 28 : 1131 – 1137.
17. Ferrannini E, Linde B, Faber O. Effect of bicycle exercise on insulin absorption and subcutaneous blood flow in the normal subject. Clin Physiol 1982; 2 : 59 – 70.
18. Peter J, Luzio SD, Dunseath G et al. Effects of exercise on the absorption of insulin glargine in patients with type 1 diabetes. Diabetes Care 2005; 28 : 560 – 565.
18. Attia N, Jones TW, Holcombe J et al. Comparison of human regular and lispro insulins after interruption of continuous subcutaneous insulin infusion and in the treatment of acutely decompensated IDDM. Diabetes Care 1998; 21 : 817 – 821.
19. Guelfi JK, Jones TW, Fournier PA. The decline in blood glucose levels is less with intermitent high‑intensity compared with moderate exercise in individuals with type 1 diabetes. Diabetes Care 2005; 28 : 1289 – 1294.
20. Admon G, Weinstein Y, Falk B et al. Exercise with and without an insulin pump among children and adolescents with type 1 diabetes mellitus. Pediatrics 2005; 116: e348 – e355.
21. The Diabetes Research in Children Network (DirectNet) Study Group. Prevention of hypoglycemia during Exercise in children with type 1 diabetes by suspending basal insulin. Diabetes Care 2006; 29 : 2200 – 2204.
22. Zisser H. Quantifying the impact of a short ‑ interval interruption of insulin‑pump infusion sets on glycemic excursion. Diabetes Care 2008; 31 : 238 – 239.
23. Heinemann L, Nosek L, Kapitza C et al. Changes in basal insulin infusion rates with subcutaneous insulin infusion. Diabetes Care 2009; 32 : 1437 – 1439.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory u obézních hypertoniků s metabolickým syndromem – editorial
- Jak zlepšit adherenci k lékovému režimu u klinicky komplexních polymorbidních seniorů? Editorial
- Vede fyzická aktivita při přerušení dodávky inzulinu inzulinovou pumpou u pacientů s diabetem 1. typu ke klinicky významným změnám?
- Využití natriuretických peptidů v diagnostice hypertrofie levé komory srdeční u obézních hypertoniků s metabolickým syndromem
- Význam stanovení kardiálních biomarkerů ve stratifikaci a sledování nemocných s AL‑ amyloidózou – zkušenosti jednoho centra
- Hodnocení vybraných ukazatelů apoptózy a angiogeneze u chronické lymfocytární leukemie
- Compliance starších nemocných s kognitivní poruchou
- Studie RESOLUTE v České republice: inzulin glargin zlepšuje kompenzaci diabetu 2. typu u pacientů s dosud neuspokojivým výsledkem terapie kombinací inzulin detemir a perorální antidiabetika. Výsledky neintervenčního projektu RESOLUTE v České republice
- Food intake regulation – 1st part
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Regionální migrující osteoporóza – diferenciálně diagnostický problém
- Nová data a indikace pro sulodexid
-
ERS 2013
Duální bronchodilatace aneb Ve dvou (se) to lépe táhne - Dabigatran – klinická zkušenost z více než dvou miliónů pacientoroků
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Cold agglutinin disease – no response to glucocorticoids and rituximab, what treatment is best for the 3rd line of therapy? Case report and review of the literature
- Food intake regulation – 1st part
- Nová data a indikace pro sulodexid
- Doporučení České endokrinologické společnosti pro léčbu Cushingova syndromu v dospělosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání