-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Súčasnosť a budúcnosť farmako-artériotromboprofylaxie v klinickej praxi. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory
Present and future of pharmaco-arteriothromboprophylaxis in clinical practice. Guidelines of Angiology Section of Slovak Medical Chamber
Antiplatelet therapy by acetylsalicylic acid (aspirin) provided pivotal advances in the prevention and treatment of organovascular (cardiovascular, cerebrovascular, extremitovascular, renovascular, genitovascular, mesenteriovascular, bronchopulmovascular, oculovascular, otovascular and other) arterial ischemic diseases. Currently available antiplatelet drugs have some limitations which might be overcomed by improved dosing regimens, use of combination of agents affecting different platelet functions and, in particular, by the new antiplatelet drugs (new arterial antithrombotics) with distinct pharmacodynamic properties offering new advantages, including faster onset of action, greater potency, and reversibility of effects. Document (Guidelines) of the Angiology Section of the Slovak Medical Chamber (AS SMS, 2013).
Key words:
organovascular arterial diseases – arterial thrombosis – arteriothromboprophylaxis – classic antiplatelet drugs – new antiplatelet agents
Autoři: P. Gavorník 1 3; A. Dukát 1,3; Ľ. Gašpar 1,3
Působiště autorů: II. interná klinika Lekárskej fakulty UK a UN Bratislava, Slovenská republika, prednosta doc. MUDr. Ľudovít Gašpar, CSc. 1; Prvé angiologické pracovisko (PAP), vedúci lekár doc. MUDr. Peter Gavorník, PhD., mim. prof. 2; Angiologická sekcia Slovenskej lekárskej komory, predseda doc. MUDr. Peter Gavorník, PhD., mim. prof. 3
Vyšlo v časopise: Vnitř Lék 2013; 59(12): 1081-1087
Kategorie: Doporučené postupy
Souhrn
Antitrombocytová liečba kyselinou acetylsalicylovou (aspirínom) viedla k zásadným pokrokom v prevencii a liečbe orgánovovaskulárnych (kardiovaskulárnych, cerebrovaskulárnych, extremitovaskulárnych, renovaskulárnych, genitovaskulárnych, mezentériovaskulárnych, bronchopulmovaskulárnych, okulovaskulárnych, otovaskulárnych a iných) artériových ischemických chorôb. V súčasnosti dostupné antitrombocytové lieky (artériotromboprofylaktiká) však majú určité limitácie, ktoré by mohlo prekonať zlepšenie dávkovacích režimov, použitie kombinácií liekov s pôsobením na rôzne funkcie trombocytov a predovšetkým nové antitrombocytové lieky (nové artériové antitrombotiká) so zreteľnými farmakodynamickými účinkami, ktoré ponúkajú výhody rýchlejšieho nástupu, silnejšieho účinku, prípadne reverzibilného pôsobenia na trombocyty. Dokument (Odporúčania) Angiologickej sekcie Slovenskej lekárskej komory (AS SLK, 2013).
Kľúčové slová:
orgánovocievne artériové choroby – artériová trombóza – artériotromboprofylaxia – klasické antitrombocytové lieky – nové antitrombocytové liekyÚvod
Trombóza je intravitálne zrážanie krvi v cievach (intravaskulárna trombóza) alebo v srdci (intrakardiálna trombóza). Angiotrombóza, ktorá vzniká v artériách, sa nazýva artériová trombóza, pri uvoľnení trombu a jeho pohybe do periférnejších, distálnejších častí tepnového systému sa hovorí o artériovej tromboembólii (ATE); artériovej tromboembolickej chorobe (ATECH). Angiotrombóza, ktorá vzniká v malých cievach, sa nazýva presnejšie mikrovaskulárna trombóza; mikroangiopatická trombóza [1–79]. Akútne trombotické a tromboembolické orgánovovaskulárne komplikácie patria k hlavným príčinám vysokej vaskulárnej morbidity a mortality – angiopandémia 3. milénia [1]. Na rozdiel od vénovej trombózy [2] sa v etiopatogenéze artériovej tromboembólie zúčastňujú predovšetkým trombocyty a dysfunkcia endotelu [1,3]. Treba zdôrazniť, že dysfunkcia endotelu a aktivácia trombocytov majú ústredný význam aj pri vzniku a progresii všetkých stenotizujúco-obliterujúcich artériových chorôb, vrátane/nielen aterosklerózy (obr. 1). Artériová trombóza a vazospazmus (vazokonstrikcia) sú 2 hlavné dynamické faktory akútnej instabilnej artériovej stenózy (obštrukcie) a príslušných orgánovovaskulárnych akútnych instabilných ischemických chorôb (syndrómov) [1]. Z toho vyplýva, že antitrombocytové lieky (predtým nazývané aj ako antiagreganciá) by mali mať nielen antitrombogénne, ale aj angioprotektívne (vaskuloprotektívne) účinky [1–14].
Obr. 1. Dysfunkcia endotelu a jej význam v patogenéze aterosklerózy, artériovej trombózy, iných cievnych chorôb a orgánovovaskulárnych artériových ischemických chorôb. 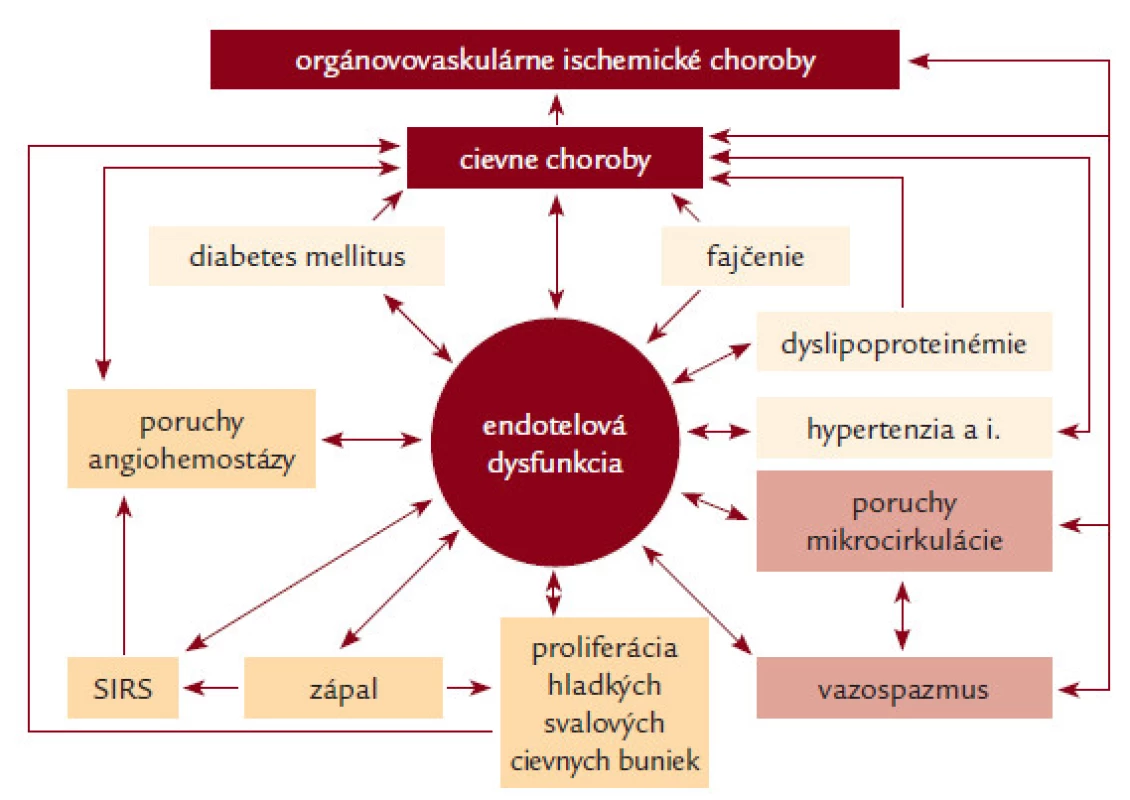
Udržiavanie trombocytov v neaktívnom (pokojovom) stave v cirkulujúcej krvi je jednou z mnohých funkcií endotelu (endotelových buniek ciev), ktoré produkujú antiagregačne pôsobiaci prostacyklín (PGI1) a oxid dusnatý (NO) a na svojom povrchu exprimujú ADP-ázu, ktorá štiepi ADP na AMP. Pri porušení integrity cievneho endotelu adherujú trombocyty na kolagén obnaženého subendotelového tkaniva prostredníctvom adhezívneho proteínu – von Willebrandovho faktora (vWF), ktorý sa viaže na špecifický membránový glykoproteín Ib-IX (GPIb-IX) trombocytu a sám má receptor pre kolagén. Okrem kolagénu aktivujú trombocyty ďalšie agonisty: trombín sa viaže na receptory aktivované proteázami (Protease Activated Receptors) PAR1 a PAR4; ADP na špecifické receptory pre ADP: P2X1, P2Y1 a P2Y12. Táto väzba prostredníctvom párových G proteínov spúšťa proces intracelulárnych signálov, vedúcich k viacerým na seba nadväzujúcim procesom: aktivácia membránovej fosfolipázy A2 a uvoľnenie kyseliny arachidónovej (AA), ktorá za účasti 2 enzýmov – cyklooxygenázy (COX1) a tromboxan-syntetázy (TS) – konvertuje na tromboxan A2 (TXA2), látku, ktorá má vazokonstriktorický, proagregačný a mitogénny účinok; zvýšenie koncentrácie vnútrobunkového Ca2+; aktivácia myozínkinázy; uvoľnenie obsahu trombocytových granúl; zmena tvaru trombocytov a konformačné zmeny glykoproteínu IIb/IIIa (GPIIb/IIIa) s aktiváciou väzobných miest pre fibrinogén a vWF [4]. Molekulovým základom agregácie trombocytov je premostenie GPIIb/IIIa receptorov susedných trombocytov fibrinogénom. Agregáciu amplifikuje väzba endogénneho ADP uvoľneného z delta granúl na receptory P2X1, P2Y1 a P2Y12 a väzba v trombocytoch generovaného TXA2 na tromboxán-prostaglandínový receptor trombocytovej membrány (TP receptor). Kolagén a trombín majú priamy efekt na uvoľnenie granúl, TXA2 a zvýšená koncentrácia intracelulárneho Ca2+ zvyšujú priamo expozíciu GPIIb/IIIa. Naopak intracelulárny cAMP, ktorý vzniká z ADP za účasti adenylátcyklázy (AC), pôsobí antiagregačne [15–18,30]. Za patologických okolností môže aktivovať trombocyty celý rad rizikových vaskulárnych faktorov, buď priamo, alebo väčšinou prostredníctvom endotelovej dysfunkcie (obr. 1). Pod názvom dysfunkcia endotelu (DE) sa rozumie akákoľvek kvantitatívna a/alebo kvalitatívna zmena jednej funkcie (selektívna, simplexná endotelová dysfunkcia) alebo 2 či viacerých funkcií (kombinovaná endotelová dysfunkcia) alebo dokonca všetkých funkcií endotelu (globálna endotelová dysfunkcia). Každá z funkcií môže byť porušená čiastočne (parciálna DE), rôzneho stupňa, alebo úplne (totálna DE). Vzájomné interakcie sú mimoriadne zložité aj z hľadiska etiopatogenézy endotelovej dysfunkcie (vrodená, primárna a sekundárna endotelová dysfunkcia) [1,3–14]. Poznanie angiohemostázy je základným predpokladom pre racionálne používanie antitrombocytových liekov pri chorobách artériového a mikrovaskulárneho cievneho systému [1–37]. Jestvuje veľa rôznych testov na sledovanie antitrombocytovej liečby: čas krvácania; meranie agregácie trombocytov turbimetrickou metódou alebo elektrickou impedančnou metódou; analýza funkcií trombocytov (platelet function analyzer – PFA; rapid platelet function assay – RPFA); určovanie tromboxanu (meraním TXB2 v krvi alebo meraním 11-dehydro-TXB2 v moči), prietoková cytometria; tromboelastografia atď. Na rutinné monitorovanie účinnosti antitrombocytových liekov nie je dostatočne spoľahlivý a vhodný žiaden z dostupných laboratórnych testov a žiadna štúdia doteraz nepotvrdila význam testovania funkcie trombocytov pre adjustáciu dávok [34]. Preto sa monitorovanie antitrombocytovej liečby všeobecne neodporúča [17–19,34,37]. O to významnejší je adekvátny klinický internisticko-angiologický manažment [1,37].
Klasické antitrombocytové lieky (klasické artériové antitrombotiká)
Podľa mechanizmov účinku sa klasické antitrombocytové lieky, používané v prevencii artériovej trombózy, obvykle delia na 4 skupiny [1–79] (tab. 1).
Tab. 1. Klasické artériové antitrombotiká (klasické antitrombocytové lieky). 
- 1. Inhibítory cyklooxygenázy sú lieky, ktoré inhibujú enzým cyklooxygenázu (COX1) a tým tvorbu tromboxanu A2 (TXA2). Acetylsalicylová kyselina (ASK; ASA) je najpoužívanejším antitrombocytovým liekom v klinickej medicíne. Účinok ASK je ireverzibilný a kompletný, už pri pomerne malej dávke (30 mg) zasiahne celú populáciu cirkulujúcich trombocytov a účinok trvá počas celého ich života (7–10 dní). Pri dlhotrvajúcej liečbe je účinná dávka 75–160 (325) mg denne. Pri tejto dávke nie je ovplyvnená cyklooxygenéza (COX2) v monocytoch a makrofágoch, nedochádza k potlačeniu tvorby prostacyklínu v endotelových bunkách, navyše pri vyšších dávkach stúpa aj riziko nežiaducich účinkov, predovšetkým gastrointestinálnych erózií a krvácania. Veľký počet štúdií (prehľad 332 prác je uvedený v 8. vydaní konferencie ACCP) potvrdil asi 25% redukciu relatívneho rizika vaskulárneho úmrtia, čo viedlo k zavedeniu ASK ako štandardného lieku pri primárnej i sekundárnej prevencii artériových stenotizujúcich (obliterujúcich) chorôb a orgánovovaskulárnych ischemických chorôb [1,17,18,37–39] (obr. 1). V súčasnosti nie je ASK v primárnej prevencii bez dôkazu orgánovovaskulárnej choroby odporúčaná [65,78]. Dávno diskutovaným problémom je aspirínová rezistencia, fenomén klinickej neúčinnosti (zlyhania ASK v prevencii artériovej trombózy) a/alebo fenomén laboratórnej neúčinnosti ASK (neschopnosť laboratórne dokázať inhibíciu trombocytových funkcií). Vyskytuje sa v rozmedzí 5–45 %, etiopatogenéza je multifaktoriálna. Okrem menšieho podielu farmakokinetických a farmakodynamických príčin sa všeobecne zdôrazňuje faktor nonkompliancie [20,37–39]. V skutočnosti sa za fenoménom zlyhania akejkoľvek vaskulárnej prevencie skrýva s veľkou pravdepodobnosťou komplexný problém endotelovej dysfunkcie, ktorú zatiaľ ani kvantitatívne, ani kvalitatívne štandardne neurčujeme (obr. 1).
Medzi lieky, ktoré reverzibilne inhibujú cyklooxygenázu (COX1) a tým aj tvorbu tromboxanu TX2 (pri ukončení liečby sa obnovuje funkcia trombocytov do 24 hod) patrí indobufen (Ibustrin®) 200 mg tbl. a sulfinpyrazon (Anturan®), ktorý má naviac aj urikozurický efekt [1,21].
- 2. Antagonisty receptorov P2Y12 (tienopyridíny). Tienopyridinové deriváty selektívne inhibujú trombocytový ADP receptor P2Y12, kľúčový pre signálnu aktiváciu, adhéziu a agregáciu trombocytov. Patrí sem tiklopidín (Ticlid®) 250 mg tbl.; a jeho 6krát účinnejší novší následník klopidogrel (Plavix®) 75 mg tbl., zároveň s menším rizikom nežiaducich účinkov, najmä neutropénie a trombotickej trombocytopenickej purpury (TTP). Inhibícia trombocytov závisí od dávky, pričom účinné potlačenie funkcií sa dosiahne po 2–3 dňoch užívania 500 mg tiklopidínu alebo 75 mg klopidogrelu. Blokáda je ireverzibilná, nie je ovplyvniteľná trombocytovým koncentrátom, funkcia sa upravuje 5–7 dní po vynechaní klopidogrelu. Postupy pre použitie klopidogrelu sa neustále prehodnocujú a inovujú [17,18,22,37–67], keďže ostatné štúdie prinášajú nové výsledky i prekvapenia pri duálnej antitrombocytovej liečbe (kombinácia kyselina acetylsalicylová a klopidogrel) [46,52] i pri tripletnej antitrombocytovej liečbe (naviac aj cilostazol alebo antagonista GPIIb/IIIa receptorov) a tiež tripletnej antitrombotickej liečbe (okrem ASA a klopidogrelu buď warfarín, alebo nové antikoagulačné lieky) [48,52]. Klopidogrelová rezistencia sa opisuje u 10–33 % pacientov. Príčinou „slabej odpovede“ na klopidogrel môže byť okrem nedostatočnej dávky, nedostatočnej absorpcie, nonkompliancie, variabilnej transformácie lieku na aktívny metabolit (závislej od aktivity cytochrómu P-450-3A4) aj multifaktoriálna patogenéza artériovej endotelovej dysfunkcie a artériovej tromboembólie [37].
- 3. Antagonisty receptorov GPIIb/IIIa (αIIbβ3); blokátory trombocytových fibrinogénových receptorov sú treťou skupinou klasických antitrombocytových liekov, ktorej vývoj bol inšpirovaný Glanzmanovou trombasténiou, pri ktorej tento receptor chýba [15–18]. V súčasnosti sa používajú tri lieky na parenterálne intravénové použitie. Abciximab (ReoPro®) je Fab fragment monoklonálnych myších protilátok proti humánnemu glykoproteínu IIb/IIIa. Eptifibatid (Integrilin® 0,75 mg; 2 mg/ml amp.) je cyklický heptapeptid, obsahujúci sekvenciu Lys-Gly-Asp. Tirofiban (Aggrastad®) je nepeptidický tyrozínový derivát s nízkou molekulovou hmotnosťou, ktorého štruktúra napodobňuje sekvenciu Arg-Gly-Asp na molekule fibrinogénu, ktorá zodpovedá za jeho väzbu na receptor GPIIb/IIIa [17,18]. Spolu s nárazovou liečbou klopidogrelom majú svoje miesto v neinvazívnej liečbe akútnych cievnych trombotických príhod, najmä v koronárnej oblasti cirkulácie u vysokorizikových osôb [17,22,37,47,52,54,55]. K hlavným nežiaducim účinkom patrí krvácanie a trombocytopénia. V predklinickom sledovaní je Z4A5 [47].
- 4. Inhibítory fosfodiesterázy (PDE3) a akcelerátory zvyšovania cAMP v trombocytoch blokádou konverzie cAMP na neaktívny AMP sú štvrtou skupinou klasických artériových antitrombotík. Dipyridamol nemá samotne podávaný lepšie výsledky ako ASK a klopidogrel [17,52]. Kombinovaný liek dipyridamol 200 mg v kombinácii s 25 mg acetylsalicylovej kyseliny (Aggrenox 200/25 mg tbl.) sa uprednostňuje pri sekundárnej prevencii náhlych cievnych mozgových ischemických príhod [17,52].
Cilostazol (Pletal®) je chinolínový derivát, inhibujúci fosfodiesterázu (PDE3) a pôsobiaci ako vazodilatátor, má aj účinok na plazmatické lipidy (znižuje triacylglyceroly a zvyšuje HDL-cholesterol). Je schválený americkým FDA už od roku 1999 pre liečbu končatinovocievnej artériovej choroby. Porovnávacia štúdia cilostazolu a pentofylínu, ktoré sú v USA schválené na liečbu končatinovocievnej artériovej choroby, preukázala vyššiu účinnosť cilostazolu [31]. V súčasnosti je cilostazol súčasťou aj tripletnej liečby aj v iných orgánovovaskulárnych oblastiach [38,47,48,52–55]. Okrem Veľkej Británie nie je v Európe cilostazol registrovaný.
Triflusal (Disgren®) má napriek štruktúrnej i funkčnej podobnosti s acetylsalicylovou kyselinou, vrátane ireverzibilnej blokády cyklooxygenázy (preferenčne COX-2), viacero odlišností. Jeho hlavný metabolit – kyselina hydroxytrifluormetylbenzoová (HTB) – inhibuje fosfodiesterázu a zvyšuje obsah cAMP v trombocytoch [17,18]. U nás bol deregistrovaný.
Slabšie antitrombocytové antitrombotické účinky majú aj niektoré vazoaktívne lieky, napr. naftidrofuryl (Enelbin 100 ret. tbl.) blokuje serotonínové receptory typu 5-HT2; skúša sa sarpogrelat; molsidomín (Corvaton, Corvaton forte, Corvaton retard tbl.) zvyšuje cGMP v trombocytoch, obdobne ako niektoré vazodilatačné prostanoidy – alprostadil (Prostavasin 20 µg amp. pro inf.; Alprostan 0,1 mg amp. pro inf.), treprostinil (Remodulin 1 mg; 2,5 mg; 5 mg amp.) a iné [1,15,17,23,47–52].
Nové antitrombocytové lieky (nové artériové antitrombotiká)
Vývoj nových protidoštičkových liekov dnes smeruje ku komplexnejšiemu potlačeniu funkcií trombocytov. Podľa mechanizmu účinku sa rozdeľujú do minimálne 6 skupín (tab. 2).
Tab. 2. Nové artériové antitrombotiká (nové antitrombocytové lieky). 
- 1. Inhibítory adhézie trombocytov sa zatiaľ v klinickej praxi nepoužívajú [52]. Možno ich rozdeliť na 3 podskupiny [47]:
- 1.1. Antagonisty von Willebrandovho faktora (vWF) sú väčšinou v II. fáze klinického skúšania (AJW200; ARC1779; ALX-0081; ALX-0681), v predklinickom skúšaní je ARC15105 a 82D6 A3.
- 1.2. Antagonisty receptoru GPVI nedávno úspešne ukončili I. fázu klinického skúšania. Do tejto podskupiny patrí PR-15 (revacept) a DZ-697b.
- 1.3. Antagonisty receptoru GPIb, napr. h6B4-Fab; GPGP-290; SZ2 sú v predklinickom sledovaní.
- 2. Inhibítory TP (tromboxan A2//prostaglandín H2) receptorov. Klinické skúšanie vapiprostu sa zastavilo pre neúčinnosť v prevencii artériovej restenózy, novší terutroban (S-18886) je derivát 2-aminotetralínu s prolongovaným účinkom, ktorý v predklinických skúškach ukázal trojaký (antitrombotický, vazodilatačný a antisklerotický) účinok. V súčasnosti prebieha už III. fáza klinického skúšania v sekundárnej prevencii artériovej trombózy [24,52]. V I. fáze je Z-335, v predklinickom sledovaní je BM-573 [47].
- 3. Kombinované inhibítory tromboxan-syntetázy a TP receptorov. Takúto kombinovanú inhibíciu spôsobujú tri prípravky. Terbogrel je orálne účinná látka, ktorej klinické skúšanie bolo zastavené v II. fáze pre nežiaduce účinky (bolesti v dolných končatinách). Ridogrel je aminooxypentanová kyselina, používaná aj v liečbe zápalových črevných chorôb. Pikotamid znižoval kardiovaskulárnu mortalitu u diabetikov s končatinovocievnou artériovou chorobou. V ostatných ACCP odporúčaniach nie je spomínaný [17,18].
- 4. Inhibítory trombínových (PAR-1, PAR-4) receptorov. Okrem inhibície „proteázami aktivovaných receptorov“ a následnej inhibície agregácie trombocytov potláčajú aj uvoľnenie a expresiu zápalových mediátorov, čím blokujú účasť zápalu na aterogenéze [25]. SCH 530348 (Voraparax®) – syntetický analóg himbacínu, mal zastavený vývoj v III. fáze klinického skúšania pre vysoký výskyt intrakraniálneho krvácania [25]. E5555 (Atoparax®) je v II. fáze. V predklinickom sledovaní sú ďalšie 2 látky tejto skupiny: SCH 205831 a SCH 602539 [47].
- 5. Nové antagonisty receptorov P2Y12 sú snáď najviac v súčasnosti sledovanou skupinou antitrombocytových liekov.
Ticagrelor (Brilique®) 90 mg tbl. je reverzibilný inhibítor, indikovaný pri Non-STE akútnych koronárnych syndrómoch bez pokračujúcej ischémie (without ongoing myocardial ischemia – OMI). Liek sa ma začať iniciálnou dávkou 180 mg (2 tablety) a potom sa má pokračovať v dávke 1 tableta 2krát denne. Súčasne sa podáva ASA [26,37–39,54,55].
Prasugrel (Efient® 5 mg; 10 mg tbl.) je ireverzibilný ostatný tienopyridínový derivát, účinnejší než klopidogrel [17,27,28,52,54,55], ktorý je indikovaný pri STEMI akútnych koronárnych syndrómoch s pokračujúcou ischémiou myokardu (with ongoing myocardial ischemia – OMI, pri primárnej perkutánnej koronárnej intervencii (p-PKI) [71]. Súhlas Európskej liekovej agentúry (EMA) vzišiel 18. 12. 2008, v SR je registrovaný od 23. 2. 2009 [27]. Liečba sa zahajuje obvykle jednorazovou nárazovou dávkou 60 mg užitou nalačno a potom sa pokračuje v dávke 1 tableta (10 mg) 1krát denne. Pacienti užívajúci tento liek majú tiež denne užívať ASA v dávke 75 mg až 325 mg.
V III. fáze klinického skúšania sú aj ďalšie antagonisty receptorov P2Y12, napr. elinogrel (PRT060128) a cangrelor (ARC-69931MX) [26], analóg ATP. Je to selektívny priamy a reverzibilný inhibítor P2Y12 receptora na intravénovú aplikáciu s rýchlym nástupom účinku a biologickým polčasom 3–5 min. Účinok trvá asi 30 min, čo môže byť výhodou pri perkutánnych koronárnych intervenciách, vyžadujúcich urgentný chirurgický výkon. V predklinickom skúšaní je BX 667 [47].
- 6. Nové perorálne inhibítory GPIIb/IIIa (αIIbβ3) receptorov. Na rozdiel od vysokoúčinných intravénových antagonistov GPIIb/IIIa receptorov, štúdie s perorálnymi prípravkami (xemilofiban, orbofiban, sibrafiban, lotrafiban), ktoré zahŕňali asi 40 000 pacientov, neukázali vyššiu účinnosť oproti ASK, ani v kombinácii s ASK nemali vyššiu účinnosť ako placebo. Celkovo sa pozoroval aj vyšší výskyt krvácania [15,47,52].
Antitrombocytová liečba kardiaka//angiaka v perioperačnom období
Kardiaci/angiaci tvoria zvláštnu a početnú skupinu pacientov, ktorých optimálny manažment pri nekardiálnych operáciách si vyžiadal, aby Európska kardiologická spoločnosť (ESC) a Európska anestéziologická spoločnosť (ESA) vydali vlastné odporúčania [32]. Osobitným problémom kardiakov/angiakov je antitrombocytová i antikoagulačná prevencia/liečba [2,33,68–70], ktorej pokračovanie a/alebo prerušenie treba prísne individuálne dôkladne zvážiť. Zhodnotiť treba najmä riziko perioperačných krvácavých komplikácií v porovnaní s perioperačným tromboembolickým rizikom a do úvahy je nutné brať aj silu indikácie antitrombocytovej antitrombotickej liečby v porovnaní so silou indikácie chirurgického zákroku [17,32].
Pokiaľ ide o acetylsalicylovú kyselinu, obava pred perioperačnými hemoragickými komplikáciami vedie v klinickej praxi často k jej vynechaniu (prerušeniu). Metaanalýza viacerých štúdií však ukázala, že riziko krvácania je síce pri neprerušenej liečbe 1,5krát vyššie, ale nevedie k závažným formám hemoragických komplikácií; avšak riziko závažných život ohrozujúcich tromboembolických komplikácií je pri prerušenej liečbe až 3krát vyššie. Preto artériotromboprofylaxiu acetylsalicylovou kyselinou nie je potrebné pred malými chirurgickými alebo endoskopickými operáciami prerušovať. Prerušovať sa má len v prípade, ak riziko krvácania vysoko prevyšuje potenciálny kardiovaskulárny benefit [17,32,68].
Rovnako klopidogrel je súčasťou štandardnej duálnej antitrombocytovej liečby po perkutánnej koronárnej intervencii (PCI) alebo v rámci akútneho koronárneho syndrómu a jeho užívanie by sme nemali prerušovať 12 mesiacov po implantácii stentu. Prerušenie duálnej liečby pred predpokladanou endotelizáciou stentu môže viesť k zvýšenému riziku trombózy stentu. Po predpokladanom skončení endotelizácie stentu sa môže nekardiálna operácia realizovať len pri arteriotromboprofylaxii acetylsalicylovou kyselinou. Chirurgia nutná počas duálnej antitrombocytovej liečby vyžaduje prísne individuálne zváženie rizika trombózy stentu v porovnaní s rizikom odkladu operácie.
Ak je artériotromboprofylaxia acetylsalicylovou kyselinou a/alebo klopidogrelom prerušovaná pred elektívnou operáciou, je vhodné lieky vynechať aspoň 5 dní (optimálne 10 dní) pred chirurgickou liečbou. Artériotromboprofylaxia môže byť znovu začatá po 24 hod od operácie (nasledujúce ráno), ak to dovolí angiohemostáza. U pacientov, ktorí podstupujú urgentný chirurgický alebo invazívny výkon s potenciálnym excesívnym alebo život ohrozujúcim krvácaním, je namieste perioperačné podanie transfúzií trombocytov alebo iných prohemostatických agensov [17,32,35,36].
Pokiaľ ide o antikoagulačnú tromboprofylaxiu orálnymi antagonistami vitaminu K (kumaríny) – warfarín, alebo novými perorálnymi antikoagulačnými liekmi – rivaroxaban (Xarelto®), apixaban (Eliquis®), dabigatran etexilát (Pradaxa®), riziko perioperačného a postoperačného krvácania je ešte vyššie. Ak je INR (international normalized ratio) pod 1,5, je chirurgická liečba bezpečná, ale u pacientov s vysokým rizikom tromboembólie je prerušenie kumarínovej liečby nebezpečné a títo pacienti potrebujú premosťujúcu tromboprofylaxiu nefrakcionovaným heparínom (UFH) alebo terapeutické dávky heparínov s nízkou molekulovou hmotnosťou (LMWH). Kumaríny vynechávame 5 dní pred plánovanou operáciou. Liečbu LMWH alebo UFH potom začíname 2 dni po prerušení kumarínov. Posledná dávka LMWH má byť podaná 12 hod pred operáciou (pri podávaní UFH i.v. 4 hod pred operáciou) a pokračuje ďalej po operácii až do reštitúcie INR do terapeutickej hladiny po znovuzačatí tromboprofylaxie kumarínmi, obvykle 1 alebo 2 dni po operácii (záleží na angiohemostáze) [2,17,32–36,53–68].
Pred urgentnou chirurgickou liečbou sa odporúča pacientom užívajúcim antikoagulačnú liečbu chronicky, podanie nízkej dávky vitamínu K1 (Kanavit) i.v., ale treba vedieť, že jeho účinok začína najskôr za 2 hod a maximálny efekt až za 12–16 hod. V prípade potreby rýchlejšieho odbúrania antikoagulačného efektu kumarínov alebo pri difúznom krvácaní bez identifikovateľného zdroja, pri závažnom alebo život ohrozujúcom krvácaní (ŽOK) je indikované i.v. podanie plazmy alebo koncentrátu protrombínového komplexu (f. II, f. VII, f. IX, f. X) – Prothrombex Total TIM 4®. Podľa ACCP z roku 2012 je možné podať i eptacog α (rekombinovaný aktivovaný koagulačný faktor VIIa) – NovoSeven®. Antidótom heparínov je protamín (Protamin® ME 1 000 U.I./ml) s pomalým podávaním i.v. [2,17,32,33,35,36,68].
Záver
V súčasnosti dostupné antitrombocytové lieky (artériotromboprofylaktiká) sú účinné v primárnej i sekundárnej artériovej tromboprofylaxii nielen kardiovaskulárnych, ale aj cerebrovaskulárnych, extremitovaskulárnych, renovaskulárnych, mezentériovaskulárnych a iných orgánovovaskulárnych artériových ischemických chorôb. Napriek tomu majú určité limitácie, dané najmä rizikom krvácania a fenoménom rezistencie s recidívami artériovej tromboembólie a akútnych orgánovovaskulárnych ischemických príhod. Ak nové artériové antitrombotiká zlepšia účinnosť, bezpečnosť a pohodlné dávkovanie, mohlo by to viesť k zmenám súčasných postupov pri artériovej tromboprofylaxii. V blízkej budúcnosti však žiadnu radikálnejšiu zmenu, zdá sa, nemožno očakávať. Racionálna angioprotektívna liečba by mala byť čo najúčinnejšie endotelnormofunkčná, antitrombogénna, antilipidogénna, antiproliferatívna a mala by eliminovať všetky vaskulárne rizikové faktory. Základom orgánovovaskulárnej prevencie ostávajú nonfarmakoprofylaktické piliere (imperatívy): Nefajčiť! Zdravo jesť a piť! Aktívne sa pohybovať! Predložené odporúčania Angiologickej sekcie SLK o artériotromboprofylaxii sú integrálnou súčasťou racionálneho manažmentu všetkých orgánovovaskulárnych artériových ischemických chorôb.
doc. MUDr. Peter Gavorník, PhD., mim. prof.
www.fmed.uniba.sk
e-mail: peter.gavornik@sm.uniba.sk
Doručeno do redakce: 5. 7. 2013
Zdroje
1. Gavorník P. Všeobecná angiológia. Angiologická propedeutika. Cievne choroby. Bratislava: Univerzita Komenského – Vydavateľstvo UK 2001.
2. Gavorník P. Flebotromboprofylaxia v klinickej praxi. Kardiológia/Cardiology 2010; 19 : 98–102.
3. Gavorník P. Vaskulárna endotelová dysfunkcia – etiopatogenéza, základné diagnostické metódy a liečebné možnosti. Gen Angiol 2002; 2 : 59–66.
4. Osto E, Coppolino G, Volpe M et al. Restoring the Dysfunctional Endothelium. Curr Pharm Des 2007; 13 : 1053–1068.
5. Morel O, Toti F, Hugel B et al. Procoagulant microparticles: disrupting the vascular equation? Arterioscler Thromb Vasc Biol 2006; 26 : 2594–2604.
6. Pericleous C, Giles I, Rahman A. Are endothelial microparticles potential markers of vascular dysfunction in the antiphospholipid syndrome? Lupus 2009; 18 : 671–675.
7. Kerachian MA, Harvey EJ, Cournoyer D et al. Avascular necrosis of the femoral head: Vascular hypotheses. Endothelium 2006; 13 : 237–244.
8. Topaloglu S, Boyaci A, Ayaz S et al. Coagulation, fibrinolytic system activation and Endothelial dysfunction in patients with mitral stenosis and sinus rhytm. Angiology 2007; 58 : 85–91.
9. Niboshi A, Hamaoka K, Sakata K et al. Endothelial dysfunction in adult patients with a history of Kawasaki disease. Eur J Pediatr 2008; 167 : 189–196.
10. Binotto MA, Maeda NY, Lopez AA. Altered endothelial function following the Fontan procedure. Cardiol Young 2008; 18 : 70–74.
11. Remkova A, Kratochvilova H, Durina J. Impact of the therapy by renin-angiotensin system targeting antihypertensive agents perindopril versus telmisartan on prothrombotic state in essential hypertension. J Human Hypertension 2008; 22 : 338–345.
12. Prázný M, Ježková J, Horová E et al. Impaired Microvascular Reactivity and Endothelial Function in Patients with Cushing´s syndrome: Influence of Arterial Hypertension. Physiol Res 2008; 57 : 13–22.
13. Gross PL, Aird WC. Endothelium and thrombosis. Semin Thromb Hemost 2000; 26 : 463–478.
14. Poderos P. Endothelial dysfunction in the pathogenesis of atherosclerosis. Int Angiol 2002; 21 : 109–116.
15. Michelson AD. Platelets. San Diego: Elsevier/Academic Press 2007.
16. Bátorová A. Protidoštičkové lieky – súčasnosť a nové perspektívy. Kardiol Prax 2008; 6 : 79–86.
17. Guyatt GH, Akl EA, Crowther M et al. Antithrombotic Therapy and Prevention of Thrombosis: American College of Chest Physicians (ACCP) evidence-based clinical practice guidelines (9th edition). Chest 2012; 141 (Suppl 2): e1S-e801S.
18. Hirsh J, Guyatt GH, Albers GW et al. Antithrombotic and thrombolytic therapy: American College of Chest Physicians (ACCP) evidence-based clinical practice guidelines (8th edition). Chest 2008; 133 (Suppl 6): 67S–70S.
19. Gachet C, Aleil B. Testing antiplatelet therapy. Eur Heart J 2008; 10 (Suppl A): A28–A34.
20. Kriška M, Rajec J. Aspirínová dilema. Intern Med 2008; 8 : 361–364.
21. Uhrinová A, Pišková T. Klinický význam a liečba hyperurikémie pri cievnych chorobách a cievnych poruchách. Prakt Flebol 2007; 16 : 45–48.
22. Hricák V. Aktualizované odporúčania pre používanie klopidogrelu u pacientov s akútnym koronárnym syndrómom, stabilnou angínou pektoris a pri sekundárnej prevencii aterotrombotických príhod. Kardiológia/Cardiology 2009; 18 : 87–90.
23. Bates SM, Weitz JI. New antitrombotic drugs. In: Coman RW, Marder VJ, Clowes AW (eds). Hemostasis and Thrombosis. Basic principles of clinical practice. Philadelphia: Lippincott Williams and Wilkins 2006 : 1763–1783.
24. Chamorro A. TP receptor antagonism: a new concept in atherothrombosis and stroke prevention. Cerebrovasc Dis 2009; 27 : 20–27.
25. Becker RC, Moliterno DJ, Jennings LK et al. TRA-PCI Investigators. Safety and tolerability of SCH 530348 in patients undergoing non-urgent percutaneous coronary intervention: a randomized, double-blind, placebo-controled phase II study. Lancet 2009; 373 : 919–928.
26. Wallentini L. Ticagrelol versus Clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361 : 1045–1057.
27. Hudec R. Prasugrel (Efient). Intern Med 2009; 9 (Suppl 1): S44–S45.
28. Morrow DA, Wiviott SD, White HD et al. Effect of the novel thienopyridine prasugrel compared with clopidogrel on spontaneous and procedural myocardial infarction in the trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel-thrombolysis in myocardial infarction: An application of the classification system from the universal definition of myocardial infarction. Circulation 2009; 119 : 2758–2764.
29. Remková A. Aktuálne otázky antidoštičkovej liečby kyselinou acetylsalicylovou v primárnej a sekundárnej prevencii cievnych ochorení u diabetikov. Intern Med 2007; 7 : 36–39.
30. Pecka M, Malý J. Metabolické a aktivační děje v krevních destičkách a možnosti jejich inhibice. Vnitř Lék 2009; 55 : 263–266.
31. Dawson DL, Cutler BS, Hiatt WR et al. A comparison of cilostazol and pentoxifylline for treating intermittent claudication. Am J Med 2000; 109 : 523–530.
32. Poldermans D, Bax JJ, Boersma et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery. The task force for preoperative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery of the European Society of Cardiology (ESC) and endorsed by the European Society of Anaesthesiology (ESA). Eur Heart J 2009; 30 : 2769–2812.
33. De Caterina R, Husted S, Wallentin L et al. Anticoagulants in heart disease: current status and perspectives. Eur Heart J 2007; 28: 880–913.
34. Gorog DA, Fuster V. Platelet Function Tests in Clinical Cardiology: Unfulfilled Expectations. J Am Coll Cardiol 2013; 61 : 2115–2129.
35. Amin AP, Bachuwar A, Reid KJ et al. Nuisance Bleeding With Prolonged Dual Antiplatelet Therapy After Acute Myocardial Infarction and its Impact on Health Status. J Am Coll Cardiol 2013; 61 : 2130–2138.
36. Dauerman HL. The Softer Side of Bleeding. J Am Coll Cardiol 2013; 61 : 2139–2141.
37. Gavorník P. Artériotromboprofylaxia v klinickej praxi. Kardiológia/Cardiology 2010; 19 : 293–299.
38. Angiolillo DJ. The Evolution of Antiplatelet Therapy in the Treatment of Acute Coronary Syndromes. From Aspirin to the present day. Drugs 2012; 72 : 2087–2116.
39. Casado-Arroyo R, Sostres C, Lanas A. Optimizing the Use of Aspirin for Cardiovascular Prevention. Drugs 2013; 73 : 803–814.
40. Keating GM. Apixaban: A Review of its Use for Reducing the Risk of Stroke and Systemic Embolism in Patients with Nonvalvular Atrial Fibrillation. Drugs 2013; 73 : 825–843.
41. Deeks ED. Apixaban. Drugs 2012; 72: 1271–1291.
42. Brass EP. Intermittent Claudication: New Targets for Drug Development. Drugs 2013; 73 : 999–1014.
43. Poulsen BK, Grove EL, Husted SE. New Oral Anticoagulants. Drugs 2012; 72 : 1739–1753.
44. Ali FN, Carman TL. Medical Management for Chronic Atherosclerotic Peripheral Arterial Disease. Drugs 2012; 72 : 2073–2085.
45. Demchuk AM, Bal S. Thrombolytic Therapy for Acute Ischaemic Stroke. Drugs 2012; 72 : 1833–1845.
46. Oldgren J, Wallentin L, Alexander JH et al. New oral anticoagulants in addition to single or dual antiplatelet therapy after an acute coronary syndrome: a systematic review and meta-analysis. Eur Heart J 2013; 34 : 1670–1680.
47. Jeung J, Holinstad M. Newer agents in antiplatelet therapy: a review. J Blood Med 2012; 3 : 33–42.
48. Balta S, Demirkol S, Celik T et al. Triple antiplatelet therapy in obese patients undergoing stent implantation. Angiology 2013; 64: 559–560.
49. Paraskevas KI, Mikhailidis DP, Roussas N et al. Effect of antiplatelet agents, statins and other drugs on vascular access patency rates. Angiology 2012; 63 : 5–8.
50. Curial M, Nath E, Lang E. Novel antiplatelet agent use for acute coronary syndrom in Emergence Department. Cardiol Res Pract 2013; 2013 : 127–270.
51. Wong PF, Chong LY, Stansby G. Antiplatelet Therapy to Prevent Cardiovascular Events and Mortality in Patients With Intermittent Claudication. JAMA 2013; 309 : 926–927.
52. Eikelboom JW, Hirsh J, Spencer FA et al. Antiplatelet drugs. In: Guyatt GH, Akl EA, Crowther M et al (eds). Antithrombotic therapy and prevention of thrombosis. 9th ed. American College of Chest Physicians (ACCP) evidence-based clinical practice guidelines. Chest 2012; 141 (Suppl): e89S–e119S.
53. Fox K, Garcia MA, Ardissino D et al. Guidelines on the management on stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J 2006; 27 : 1341–1381.
54. Hamm CW, Bassand JP, Agewall S et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 2999–3054.
55. Van de Werf F, Bax J, Betriu A et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology. Eur Heart J 2008; 29 : 2909–2945.
56. Rydén L, Standl E, Bartnik M et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary: The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J 2007; 28: 88–136.
57. Diskstein K, Cohen-Solal A, Filippatos G et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J 2008; 29 : 2388–2442.
58. Regitz-Zagrosek V, Lundquist CB, Borghi C et al. ESC Guidelines on the management of cardiovascular diseases during pregnancy: The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 3147–3197.
59. Tendera M, Aboyans V, Bartelink ML et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. The Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 2851–2906.
60. Gavorník P. Končatinovocievne ischemické choroby. In: Gavorník P, Hrubiško M, Rozborilová E (eds). Diferenciálna diagnostika kardio-vaskulárnych, respiračných a hematologických ochorení. I. Bratislava: Dr. Josef Raabe 2010 : 1–92.
61. Graham I, Atar D, Borch-Johnsen K et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts). Eur Heart J 2007; 28 : 2375–2414.
62. Banegas JR, López-Garcia E, Dallongeville J et al. Achievement of treatment goals for primary prevention of cardiovascular disease in clinical practice across Europe: the EURIKA study. Eur Heart J 2011; 32 : 2143–2152.
63. Smith SC Jr, Benjamin EJ, Bonow RO et al. AHA/ACCF Secondary Prevention and Risk Reduction Therapy for Patients With Coronary and Other Atherosclerotic Vascular Disease: 2011 Update. A Guideline From the American Heart Association and American College of Cardiology Foundation. J Am Coll Cardiol 2011; 58 : 2432–2446.
64. Rooke TW, Hirsch AT, Misra S et al. 2011 ACCF/AHA Focused Update of the Guideline for the Management of Patients With Peripheral Artery Disease (Updating the 2005 Guideline). A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2011; 58 : 2020–2045.
65. Perk J, De Backer G, Gohlke H et al. Joint ESC Guidelines. European Guidelines on cardiovascular disease prevention in clinical practice (Version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis 2012; 223 : 1–68.
66. McMurray JJ, Adarnopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787–1847.
67. Gavorník P, Dukát A, Gašpar Ľ. Manažment stabilnej anginy pectoris a iných foriem chronickej kardiovaskulárnej artériovej choroby. Vnitř Lék 2012; 58 : 29–36.
68. Gavorník P, Gašpar Ľ, Dukát A. Kombinovaná kinezio-flebotromboemboloprofylaxia, mechano-flebotromboemboloprofylaxia a farmako-flebotromboemboloprofylaxia vénovej tromboembólie v internej medicíne. Odporúčania Sekcie angiológov Slovenskej lekárskej komory (SA SLK). Vnitř Lék 2012; 58 : 851–855.
69. Kala P, Němec P, Želízko M et al. Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass. Vnitř Lék 2012; 58 (Suppl 1): S79–S103.
70. Malý J, Pecka M, Malý R. Nová antitrombotika v prevenci žilní tromboembolie a nové protidestičkové léky. Vnitř Lék 2011; 57 : 733–739.
71. Widimský P, Rokyta R, Šťásek J et al. Acute coronary syndromes with ongoing myocardial ischemia (ACS with OMI) versus acute coronary syndromes without ongoing ischemia (ACS without OMI). The new classification of acute coronary syndromes should replace old classification based on ST segment elevation presence or absence – Expert consensus statement of the Czech Society of Cardiology). Cor Vasa 2013; 55 : 290–292.
72. Armstrong PW, Gershlick AH, Goldstein P et al. STREAM Investigative Team. Fibrinolysis or Primary PCI in ST-Segment Elevation Myocardial Infarction. N Engl J Med 2013; 368: 1379–1387. DOI: 10.1056/NEJMoa1301092
73. Creager MA, Kaufman JA, Conte MS. Acute Limb Ischemia. N Engl J Med 2012; 366: 2198–2206. DOI: 10.1056/NEJMcp1006054
74. Borissoff JI, Spronk HMH, Cate H. The Hemostatic System as a Modulator of Atherosclerosis. N Engl J Med 2011; 364 : 1746–1760. DOI: 10.1056/NEJMra1011670
75. Paneni F, Beckman JA, Creager MA, Cosentino F. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I. Eur Heart J 2013; 34: 2436–2443.
76. Beckman JA, Paneni F, Cosentino F, Creager MA. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part II. Eur Heart J 2013; 34: 2444–2452.
77. Izzo R, de Simone G, Trimarco V et al. Hypertensive target organ damage predicts incident diabetes mellitus. Eur Heart J 2013 eht281 DOI:10.1093/eurheartj/eht281
78. Rydén L, Grant PJ, Anker SD et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. The Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013; 34 : 3035–3087. DOI: 10.1093/eurheartj/eht108
79. Jacomella V, Corti N, Husmann M. Novel anticoagulants in the therapy of peripheral arterial and coronary artery disease. Curr Opin Pharmacol 2013; 13 : 1–7. http://dx.doi.org/10.1016//j.coph.2012.12.005.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Indikátory zánětu u pacientů s koronární aterosklerózou – editorial
- Komentář ke studii EDGE – editorial
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc – editorial
- Prospektivní, multicentrická, neintervenční studie na zhodnocení současné léčby pacientů s diabetes mellitus 2. typu, nedostatečně kompenzovaných monoterapií metforminem – KOMETA CZ
- Účinnost a bezpečnost vildagliptinu jako léku druhé volby ve srovnání s jinými perorálními antidiabetiky u pacientů s diabetes mellitus 2. typu: české výsledky v rámci celosvětové prospektivní kohortové studie EDGE
- Indikátory zápalu u pacientov s koronárnou aterosklerózou – úloha usCRP v diagnostike a predikcii prognózy ochorenia
- Současný pohled na onemocnění jater u srdečního selhání
- Pozice tiotropia v nových léčebných doporučeních pro chronickou obstrukční plicní nemoc
- Súčasnosť a budúcnosť farmako-artériotromboprofylaxie v klinickej praxi. Odporúčania Angiologickej sekcie Slovenskej lekárskej komory
- Doporučené postupy v léčbě starších pacientů s diabetes mellitus v ČR
- Doporučení KDIGO pro léčbu zvýšeného krevního tlaku u chronického onemocnění ledvin
- Zánětlivá borreliová dilatační kardiomyopatie
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
- Histiocytární sarkom
- Effects of the angiotensin receptor blocker Valsartan (Valsacor®) on arterial pressure, indices of myocardial diastolic function and global longitudinal strain in patients with uncontrolled arterial hypertension
- Mechanizmus pleiotropního účinku sulodexidu
- Rifaximin v léčbě jaterní encefalopatie
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Současný pohled na onemocnění jater u srdečního selhání
- Rifaximin v léčbě jaterní encefalopatie
- Histiocytární sarkom
- Závažná rizika spojená s užíváním natrium-fosfátových projímadel
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



