-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace
Autoři: R. Čihák 1; P. Heinc 2; L. Haman 3; M. Fiala 4; P. Neužil 5; O. Toman 6
Působiště autorů: Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc., FESC 1; I. interní klinika – kardiologická Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Miloš Táborský, CSc., FESC, MBA 2; I. interní kardio-angiologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jan Vojáček, DrSc., FESC 3; Oddělení kardiologie, Nemocnice Podlesí a. s., Třinec, přednosta prim. MUDr. Marian Branny 4; Kardiocentrum Nemocnice Na Homolce Praha, přednosta prim. MUDr. Štěpán Černý, CSc. 5; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 6
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 1): 41-69
Kategorie: Doporučené postupy
Obsah
- Úvod
- Definice, klasifikace, etiologie
2.1. Definice fibrilace síní
2.2. Jiné arytmie, které se vyskytují s fibrilací síní
2.3. Klasifikace fibrilace síní
2.4. Příčiny a rizikové faktory vzniku fibrilace síní
2.5. Patofyziologie a mechanizmus vzniku
2.5.1. Anatomický substrát
2.5.2. Mechanizmus vzniku - Výskyt, prognóza, vyšetření
3.1. Epidemiologie fibrilace síní
3.2. Prognóza
3.3. Klinický obraz
3.4. Vyšetření pacientů s fibrilací síní
3.4.1. Vstupní vyšetření u všech pacientů
3.4.2. Vyšetření indikovaná u vybraných pacientů
3.4.3. Vyšetření většinou neindikovaná u pacientů s fibrilací síní
3.4.4. Sledování pacientů s fibrilací síní
3.4.5. Náklady na péči - Farmakoterapie fibrilace síní
4.1. Antitrombotická léčba
4.1.1. Riziko tromboembolických komplikací
4.1.1.1. Riziková stratifikace
4.1.1.2. Nové možnosti rizikové stratifikace
4.1.2. Doporučení k antitrombotické léčbě podle rizikové stratifikace
4.1.3. Riziko krvácivých komplikací
4.1.4. Optimální antikoagulační léčba
4.1.4.1. Antikoagulační léčba antagonisty vitaminu K vs kontrolní skupina
4.1.4.2. Protidestičková léčba
4.1.4.3. Antikoagulační léčba antagonisty vitaminu K vs protidestičková léčba
4.1.4.4. Kombinovaná antitrombotická léčba
4.1.5. Alternativy antikoagulační léčby
4.1.5.1. Nová antitrombotika
4.1.5.2. Postavení nových antitrombotik v rámci doporučení
4.1.6. Současná doporučení pro antitrombotickou léčbu
4.1.6.1. Selfmonitoring INR u fibrilace síní
4.1.6.2. Riziko tromboembolizmu u paroxyzmální vs perzistující fibrilace síní
4.1.6.3. Riziko tromboembolizmu u flutteru síní
4.1.7. Zvláštní klinické situace
4.1.7.1. Perioperační antikoagulační léčba – dočasné přerušení antikoagulace
4.1.7.2. Perioperační antitrombotická léčba u nemocných indikovaných k duální či trojkombinační antitrombotické léčbě
4.1.7.3. Stabilní tepenné onemocnění
4.1.7.4. Akutní koronární syndrom a/nebo provedená perkutánní koronární intervence
4.1.7.5. Plánovaná koronární intervence
4.1.7.6. Infarkt myokardu
4.1.7.7. Prevence gastrointestinálního krvácení při kombinované antitrombotické léčbě
4.1.7.8. Akutní cévní mozková příhoda
4.1.7.9. Asymptomatická cévní mozková příhoda
4.1.8. Kardioverze
4.1.8.1. Kardioverze kontrolovaná jícnovou echokardiografií
4.2. Kontrola srdečního rytmu
4.2.1. Kontrola rytmu vs kontrola frekvence
4.2.2. Akutní kontrola rytmu – konverze na sinusový rytmus
4.2.2.1. Elektrická kardioverze
4.2.2.2. Farmakologická kardioverze
4.2.2.3. Jednorázové použití antiarytmika při obtížích (pilulka v kapse, „pill-in-the - pocket“)
4.2.3. Dlouhodobá kontrola rytmu
4.2.3.1. Nová antiarytmika
4.2.3.2. Volba antiarytmika
4.3. Kontrola frekvence
4.3.1. Akutní kontrola srdeční frekvence
4.3.2. Dlouhodobá kontrola srdeční frekvence
4.3.2.1. Intenzita kontroly srdeční frekvence
4.3.2.2. Farmakologická kontrola frekvence
4.4. Upstream léčba
4.4.1. Teoretické předpoklady
4.4.2. Inhibitory ACE a blokátory receptorů AT1 pro angiotenzin II
4.4.3. Statiny
4.4.4. Ostatní látky v upstream léčbě - Nefarmakologická léčba FS
5.1. Kardiostimulace
5.2. Implantabilní síňové kardiovertery-defibrilátory
5.3. Katetrizační ablace AV uzlu a kardiostimulace
5.3.1. Principy výkonu, klinický přínos
5.3.2. Indikace ablace AV uzlu
5.4. Selektivní ablace pro FS
5.4.1. Princip účinku
5.4.2. Provedení výkonu a technologie
5.4.3. Cílové momenty ablačního výkonu
5.4.4. Dlouhodobé udržení sinusového rytmu
5.4.5. Klinický přínos ablace fibrilace síní
5.4.6. Komplikace výkonu
5.4.7. Indikace selektivní ablace
5.4.8. Sledování po ablaci
5.5. Chirurgická léčba fibrilace síní
5.5.1. Úvod
5.5.2. Operace pro fibrilace síní
5.5.3. Technika výkonu a používané energie
5.5.4. Indikace chirurgické léčby
5.5.5. Sledování po chirurgické ablaci
5.6. Nefarmakologické metody prevence mozkových příhod
1. Úvod
Fibrilace síní (FS) je nejčastější setrvalou poruchou srdečního rytmu. Je diagnostikována u 1–2 % populace a výskyt stále roste. FS je spojena se zvýšenou morbiditou a mortalitou, riziko iktu je 5násobné. To je důvodem stálého hledání optimální léčby pacientů s FS.
Doporučené postupy u pacientů s FS byly publikovány v letech 2001 a 2006 [1]. Šlo o společná guidelines Evropské kardiologické společnosti (European Society of Cardiology – ECS) a amerických kardiologických asociací (AHA, ACC). Od té doby bylo prezentováno mnoho důležitých studií a vyvstala potřeba inovace. V srpnu roku 2010 byla zveřejněna kompletně přepracovaná nová evropská guidelines, vypracovaná jen Evropskou kardiologickou společností [2]. Pro americký kontinent bylo na přelomu let 2010 a 2011 zahájeno vydávání zatím jen velmi mírných aktualizací guidelines z roku 2006 [3,4]. Další aktualizace budou patrně následovat podle průběhu schvalování nových léčebných postupů.
V České republice byla doporučení pro léčbu pacientů s fibrilací síní oponována na podzim roku 2003 [5]. Vzhledem k výraznému rozvoji léčebných metod nyní předkládáme novou verzi. Ta vychází zejména z evropských guidelines, ale přihlíží i k americkým aktualizacím a k dalším zdrojům a studiím, které byly od prezentace evropských guidelines zveřejněny. Protože vývoj poznatků o FS je velmi dynamický, zejména v oblasti prevence tromboembolických příhod, lze předpokládat nutnost častějších inovací, patrně také formou doplňků.
2. Definice, klasifikace, etiologie
2.1. Definice fibrilace síní
Jde o supraventrikulární arytmii charakterizovanou rychlou nekoordinovanou akcí síní. Na elektrokardiografickém záznamu nejsou patrné jasné vlny P, někdy lze rozpoznat vlnění izoelektrické linie či rychlé fibrilační vlnky o frekvenci > 300/min, a to zejména ve svodu V1. Vlnky se mohou místy do určité míry zpravidelnit a zvětšit (tzv. hrubovlnná FS síní, zaměňovaná někdy za flutter síní či síňové tachykardie nebo nesprávně popisovaná jako fibrilo-flutter síní). Frekvence komor je závislá na převodních vlastnostech AV uzlu, přítomnosti akcesorních drah, tonu sympatiku a vagu a velmi podstatně také na vlivu medikace. U neléčeného nemocného je zcela nepravidelný R-R interval („absolutní“ arytmie) a frekvence komor 100–160/min. Někdy je akce komor relativně vyrovnaná a kolísá v malém rozmezí, jindy je zcela nevyrovnaná. Při vyšším převodu na komory mohou být některé nebo všechny komplexy QRS aberované. Pravidelná akce komor je typická pro atrioventrikulární blokádu a náhradní junkční či komorový rytmus, aktivní náhradní rytmus a při přechodu fibrilace síní v jinou arytmii. Fibrilací síní může maskovat také pravidelný stimulovaný rytmus. Jako fibrilace síní se označují epizody trvající ≥ 30 s, za určitých okolností mohou mít význam i arytmie kratší, naopak klinický význam mívají většinou až delší epizody [2,6].
Pro stanovení diagnózy fibrilace síní jsou tedy důležitá následující kritéria:
- nepravidelná akce komor s nepravidelnými RR intervaly,
- absence jednoznačných a pravidelných vln P, fibrilační vlnky jsou nejlépe hodnotitelné ve svodu V1,
- frekvence fibrilačních vlnek > 300/min (< 200 ms),
- arytmie trvající minimálně 30 s.
2.2. Jiné arytmie, které se vyskytují s fibrilací síní
Fibrilace síní se může vyskytovat samostatně, nebo může být spojena s jinými supraventrikulárními arytmiemi. Častý je společný výskyt s flutterem síní, kdy se mohou obě arytmie u téhož nemocného střídat či přecházet jedna v druhou. Při léčbě antiarytmiky skupiny IC či III se síně mohou stabilizovat jen do určité míry a místo fibrilace síní dochází k atakám flutteru („flutter IC či III“). Typický flutter síní má definovaný reentry okruh kolem anulu trikuspidální chlopně. Šíří se nejčastěji proti směru hodinových ručiček (counter-clockwise flutter), je charakteristický aktivitou síní připomínající v EKG zuby pily ve svodech II, III, aVF. Při opačném směru šíření (clockwise flutter) jsou vlny P ve svodech II, III, aVF pozitivní. Frekvence síní u neléčeného flutteru bývá obvykle 240–300/min, převod pak obvykle 2 : 1 nebo obecně n : 1. K ozřejmení síňové aktivity u arytmie s rychlou odpovědí komor lze využít farmaka či manévry zpomalující vedení v atrioventrikulárním (AV) uzlu (masáž karotického sinu, Valsalvův manévr, i.v. adenosin). Vzácně může při tzv. deblokaci flutteru dojít k převodu 1 : 1. Při reentry okruhu mimo trikuspidální anulus (např. kolem mitrálního anulu, jizvy nebo fibrotického ložiska v síních) hovoříme o atypickém flutteru. Fibrilace síní může být spojena i se síňovými tachykardiemi, s AV nodální a AV reentry tachykardií: tyto tachykardie ji mohou dokonce spouštět. Velmi často lze u pacientů s paroxyzmální fibrilací síní při EKG monitoraci zachytit četné supraventrikulární extrasystoly nebo jejich salvy, které fibrilace síní spouštějí.
2.3. Klasifikace fibrilace síní
Fibrilace síní můžeme klasifikovat podle řady hledisek. Jako izolovaná („lone“) fibrilace síní je označována arytmie bez přítomného kardiovaskulárního onemocnění. Pojem idiopatická fibrilace síní vyjadřuje spíše skutečnost, že jsme nenalezli jasnou vyvolávající příčinu či známé onemocnění. V literatuře se lze často setkat s pojmem „nechlopenní“ („nonvalvular“) fibrilace síní, která popisuje arytmie bez přítomnosti závažné chlopenní vady či náhrady a má význam v posuzování rizika tromboembolie. Jako sekundární fibrilace síní popisujeme příhody vzniklé při infarktu myokardu, po kardiochirurgických operacích, při perikarditidě či myokarditidě, plicní embolii, tyreopatii, pneumonii a dalších onemocněních. V současnosti se nejčastěji doporučuje dělení na fibrilace síní jako první dokumentovanou ataku, paroxyzmální, perzistující, dlouhodobě perzistující a permanentní fibrilace síní (tab. 1).
Poprvé zjištěná epizoda fibrilace síní u daného pacienta může být symptomatická i asymptomatická, spontánně končící i přetrvávající. Může jít o jedinou epizodu, nebo může v budoucnu recidivovat. Jako recidivující fibrilace síní se označuje případ, kdy má pacient dokumentovány alespoň 2 ataky. Paroxyzmální fibrilace síní je pojmenování pro recidivy fibrilace síní, které končí spontánně. Označujeme tak epizody trvající alespoň 30 s, i když za určitých okolností mají význam i epizody kratší. Pokud fibrilace síní přetrvává déle než 7 dní, hovoříme o perzistující fibrilaci síní. Epizody obvykle končí až po provedené kardioverzi, ať už medikamentózní, nebo po elektrokardioverzi. U jednoho pacienta se mohou současně vyskytovat kratší paroxyzmy fibrilace síní i epizody perzistující formy. Dlouhodobě perzistující fibrilace síní trvá déle než rok, ale stále zvažujeme kontrolu rytmu. Permanentní fibrilace síní většinou přetrvává nebo časně recidivuje i po kardioverzích a přijali jsme ji již jako trvalý rytmus pacienta [2].
Při posuzování FS u individuálního nemocného však musíme přihlédnout k řadě jiných faktorů, jako je symptomatologie, hemodynamický vliv, trvání fibrilace či frekvence atak, věk pacienta, přítomnost a závažnost kardiálního onemocnění a dalších přidružených chorob.
Fibrilace síní obvykle začíná jako paroxyzmální, v průběhu let u většiny pacientů progreduje do setrvalejších forem. K této progresi nedochází pouze u minimálního počtu pacientů (2–3 %) [7]. Nezávislými prediktory progrese fibrilace síní jsou srdeční selhání, věk nad 75 let, předchozí CMP nebo tranzitorní ischemická ataka (TIA), chronická obstrukční plicní nemoc a hypertenze (tzv. HATCH skóre [8]). U nově zjištěné fibrilace síní je riziko rekurence v 1. roce 10 %, v dalších letech 5 %. Asymptomatické záchvaty fibrilace síní jsou četné i u symptomatických pacientů.
2.4. Příčiny a rizikové faktory vzniku fibrilace síní
Výskyt přibývá s věkem, patrně v důsledku fibrotizace myokardu a ztráty myocytů (tab. 2). Z kardiovaskulárních onemocnění je nejčastějším rizikovým faktorem hypertenze. Jak s věkem, tak i s přítomností hypertenze také stoupá riziko tromboembolických komplikací. Další příčinou FS může být srdeční selhání. Chlopenní vady lze zjistit až u 30 % pacientů s fibrilací síní. Častěji se s ní setkáváme u kardiomyopatií, ať již jde primárně o onemocnění s porušenými elektrofyziologickými vlastnostmi při různých mutacích elektrických kanálů, nebo o různé myopatie. U 10–15 % nemocných lze zjistit defekt síňového septa, který je také spojen s rizikem CMP. Ischemická choroba srdeční s postižením koronárních tepen je přítomna u 20 % pacientů s fibrilací síní. Z endokrinních chorob je nejčastější porucha funkce štítné žlázy, ať už ve formě manifestní, nebo subklinické. Četnost výskytu dysfunkce štítné žlázy zvyšuje antiarytmická medikace amiodaronem. Až 25 % pacientů s fibrilací síní je obézních – s tím je částečně spojen i výskyt diabetes mellitus, který představuje riziko pro vznik fibrilace síní i tromboembolizmu. Z dalších rizikových faktorů je důležitá chronická obstrukční plicní nemoc, spánková apnoe a chronické onemocnění ledvin [9,10].
Tab. 2. Remodelační změny v síních, spojené se vznikem a udržováním fibrilace síní. 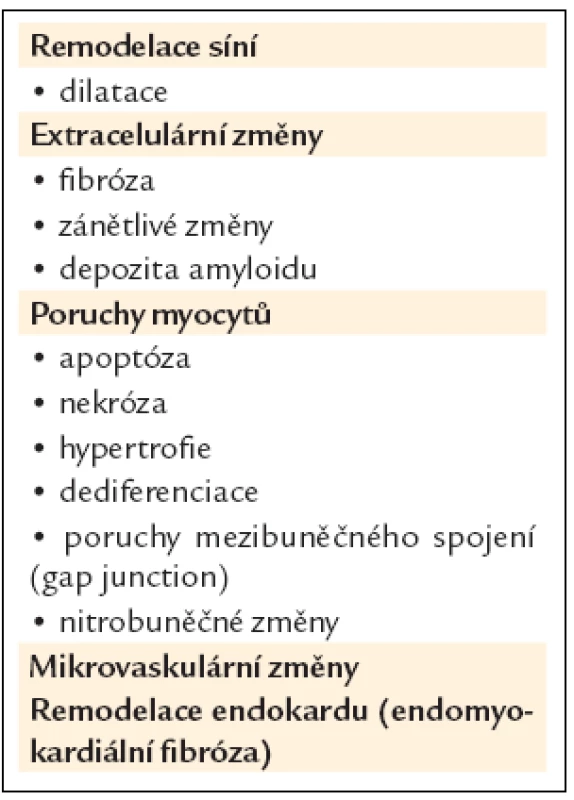
Existuje také genetická predispozice k fibrilaci síní. Vyskytuje se častěji u syndromu dlouhého i krátkého intervalu QT, syndromu Brugadových, hypertrofické kardiomyopatie a dalších chorob s familiárním výskytem. Kromě toho existuje familiární výskyt i samotné izolované fibrilace síní – byly popsány rodiny s vyšším výskytem této arytmie.
2.5. Patofyziologie a mechanizmus vzniku
2.5.1. Anatomický substrát
Fibrilace síní vzniká na podkladě strukturálně změněných, ale i poměrně zdravých srdečních síní. Strukturální změny síní jsou geometrické (dilatace) a anatomicko-histologické (vazivová přestavba, ukládání amyloidu apod.) [11–14]. Dominantním srdečním oddílem pro vznik fibrilace je levá síň, účast pravé síně je méně významná. Strukturální změny síní vznikají v důsledku primárních kardiovaskulárních onemocnění a stavů a současně jsou navozovány a zhoršovány vlastní fibrilací. Tato tzv. arytmií indukovaná remodelace se děje časně na elektrické úrovni a později i na strukturální a mechanické úrovni [15,16]. Fibrilace síní tak uzavírá bludný kruh, ve kterém sama sebe dále zhoršuje. Čím déle trvá, tím více jsou strukturální změny zpravidla vyjádřeny. Všeobecně platí, že změny jsou u paroxyzmální formy výraznější než u perzistentní, existují však časté výjimky [20,21]. Pokročilá remodelace síní je příčinou nižší úspěšnosti léčby, konkrétně kontroly rytmu u fibrilace síní, a to farmakologické i nefarmakologické (např. kardioverze, ablace).
Obnovení sinusového rytmu bývá spojeno s úplnou nebo jen částečnou úpravou těchto změn, tj. s tzv. reverzní remodelací [17–19]. Některé změny, jako je fibróza a jizvení v myokardu, však reverzibilní nejsou.
2.5.2. Mechanizmus vzniku
Na mechanizmu vzniku fibrilace síní se podílí ektopická i reentry aktivita. U žádné formy fibrilace síní neplatí uniformní mechanizmus, i když ektopie je častější i paroxyzmálních forem a reentry u forem perzistujících. Spouštěčem i udržovacím faktorem může být pokračující ektopická aktivita. Ektopická ložiska se většinou nacházejí v oblasti ústí plicních žil, ale také např. v koronárním sinu, Marshallově ligamentu, ústí horní duté žíly nebo ve volné stěně levé i pravé síně. Kromě toho může být fibrilace síní udržována setrvalou aktivací lokalizovaných reentry okruhů nebo velkých makro-reentry okruhů. Spektrum mechanizmů vzniku fibrilace síní se tedy může individuálně pohybovat od izolovaného ektopického fokusu z plicní žíly až po kombinaci všech uvedených zdrojů. Dále se na jejím spouštění a udržování podílí autonomní nervový systém, a to prostřednictvím perikardiálních autonomních ganglií.
Fibrilace síní se často vyskytuje u pacientů se srdečním selháním. Mechanizmem jsou zde strukturální změny, zejména vznik jizev a fibrotizace myokardu, dilatace a přetížení síní i vliv zvýšené neurohumorální regulace. Rychlá frekvence síní však sama o sobě zhoršuje jejich funkci a může vést k poklesu funkce levé komory (tzv. tachykardická kardiomyopatie). Kromě frekvence má vliv i nepravidelná akce komor, případně medikace. Studie po ablaci AV junkce i po selektivní ablaci pro fibrilaci síní ukázaly, že část těchto změn je reverzibilní. Po ablaci se zlepší, či v některých případech zcela normalizuje, funkce levé komory. Fibrilace síní tedy může být následkem i příčinou srdečního selhání.
Zvýšené riziko tromboembolie u fibrilace síní se klasicky vysvětluje stagnací krve ve změněné levé síni a jejím oušku. Kromě toho je pravděpodobné, že fibrilace síní sama navozuje určitý hyperkoagulační stav. Současně je i markerem jiných chorob predisponujících k CMP, jako je ateroskleróza aorty, cerebrovaskulární onemocnění a kalcifikace mitrálního prstence.
3. Výskyt, prognóza, vyšetření
3.1. Epidemiologie fibrilace síní
Fibrilace síní bývá právem označována jako kardiovaskulární epidemie. Touto nejčastější poruchou srdečního rytmu je postiženo asi 6 milionů Evropanů, odhadovaná prevalence v celkové populaci je 1–2 % [2]. Mnoho dalších jedinců v populaci má formu asymptomatickou, nediagnostikovanou. V příštích 50 letech se zřejmě prevalence FS až zdvojnásobí, neboť vzrůstá s věkem – ve věku do 40–50 let < 0,5 %, ale ve věku nad 80 let dosahuje 5–15 % [22]. Evropské populační studie udávají prevalenci 5,5 % u jedinců nad 55 let, incidenci 9,9/1 000 osobo-roků [23]. Častěji postihuje muže. Riziko onemocnění FS pro jedince staršího 40 let je asi 25 % [24]. To je pro srovnání více než např. pravděpodobnost onemocnění karcinomem prsu u žen (asi 11 %).
3.2. Prognóza
Pacienti s fibrilací síní mají zvýšenou morbiditu i mortalitu oproti pacientům se sinusovým rytmem. Mortalita pacientů s FS je dvojnásobná, nezávisle na ostatních faktorech [25].
Základní příčinou zvýšené morbidity při fibrilaci síní jsou tromboembolické příhody. Riziko CMP je zvýšeno přibližně 5krát, v závislosti na faktorech rizikové stratifikace tromboembolizmu. Přibližně každá pátá CMP je podmíněna fibrilací síní [26], bývá navíc závažnější než CMP jiného původu. CMP spojené s fibrilací síní mají vyšší 30denní mortalitu, horší průběh, častější recidivy a jsou 2krát častěji fatální. Rezidua po CMP při fibrilaci síní jsou výrazně horší než po CMP jiného původu. Pacienti s paroxyzmální formou fibrilace síní mají podobné riziko CMP jako pacienti s formou perzistentní či permanentní [27]. Riziko periferní embolizace mimo CNS je u mužů s fibrilací síní vyšší 4krát, u žen až 5,7krát [28].
Fibrilace síní může být spojena se zhoršením kognitivních funkcí včetně vaskulární demence, zřejmě na podkladě asymptomatických cerebrálních mikroinfarktů [29]. Zhoršuje kvalitu života, snižuje toleranci námahy, což bylo objektivizováno v několika studiích standardizovanými dotazníky [30]. Hospitalizace při fibrilaci síní tvoří až 1/3 všech hospitalizací pro arytmie. Hlavními důvody jsou akutní symptomy vyžadující léčbu, dále tromboembolické příhody, srdeční selhání a další. Srdeční selhání a fibrilace síní jsou provázaná onemocnění. Výskyt fibrilace síní při srdečním selhání je častější, v závislosti na jeho stupni o 10–25 %. Samotná fibrilace síní však může srdeční selhání zhoršovat nebo vyvolávat. U části pacientů se projevy srdečního selhání a dysfunkce levé komory vyskytují jen v důsledku fibrilace síní.
3.3. Klinický obraz
Fibrilace síní může být symptomatická i asymptomatická. Obtíže kolísají i u téhož pacienta, asymptomatických atak může být až 70 %. Symptomy závisí na frekvenci a pravidelnosti akce komor, trvání arytmie, přítomnosti srdečního onemocnění a individuální vnímavosti pacienta. Obvyklé jsou palpitace, bolest na hrudi, snížená tolerance zátěže, dušnost, únava, závratě. Prvním projevem může být i mozková cévní příhoda nebo zhoršení srdečního selhání. Hemodynamické důsledky fibrilace síní souvisejí se 3 faktory: nepřiměřenou frekvencí komor, která je dána převodními vlastnostmi AV uzlu, nepravidelností akce komor a také ztrátou synchronizované akce síní. Pacienti s pomalejší a vyrovnanější akcí komor mají obtíže menší. Symptomatická bývá spíše paroxyzmální FS, a to hlavně ve svých počátcích. U starších pacientů mohou být zhoršeny kognitivní funkce, a to jednak v důsledku hypoperfuze mozku, jednak v důsledku opakovaných mozkových embolizací. Nerozpoznané mikroembolizace jsou u některých nemocných s fibrilací síní patrně příčinou předčasné demence. K posouzení symptomů u fibrilace síní je navrhováno tzv. skóre EHRA I–IV [2], podobné klasifikaci symptomů při srdečním selhání NYHA I–IV. V praxi je jednodušší stupeň obtíží popsat jen slovně. Lze např. uvést, zda je fibrilace síní asymptomatická, symptomatická mírně nebo výrazně, případně typ symptomů popsat.
Pacienti s fibrilací síní mají sníženou kvalitu života, především v závislosti na projevech arytmie. Kvalitu života však výrazně ovlivňuje i léčba. Např. nutnost častých kontrol je důvodem nízké adherence k dlouhodobé antikoagulační léčbě. Přispívá k tomu i výskyt krvácivých komplikací či jejich riziko, které by měl nemocný vzít v úvahu při výkonu některých povolání či sportovních aktivit s rizikem úrazu.
3.4. Vyšetření pacientů s fibrilací síní
Vstupní vyšetření pacientů s fibrilací síní nebo se suspektní fibrilací síní by mělo být zaměřeno na symptomy arytmie, přídatná onemocnění a event. komplikace fibrilace a rizikové faktory tromboembolie. Na základě těchto vyšetření by měla být pro daného pacienta stanovena klasifikace arytmie a strategie další léčby.
3.4.1. Vstupní vyšetření u všech pacientů
- Anamnéza: přítomnost fibrilace síní v rodině, základní symptomy (palpitace, dušnost, únavnost, snížená tolerance námahy, závratě, oprese na hrudi, synkopa), event. spouštějící faktory arytmie (zátěž, emoce, alkohol), přídatná onemocnění (hypertenze, diabetes mellitus, srdeční selhání, ICHS, cévní mozkové příhody, onemocnění periferních tepen, tyreopatie, chronické plicní onemocnění), předchozí a stávající farmakoterapie, abúzus alkoholu;
- Fyzikální vyšetření včetně změření krevního tlaku, váhy, výšky;
- 12svodové EKG: základní rytmus, ischemické změny, hypertrofie levé komory, raménkové blokády, preexcitace, převodní intervaly (PR, QRS, QT);
- Transtorakální echokardiografie (TTE): funkce levé komory, velikost síní, tloušťka stěn, chlopenní vady;
- Laboratorní vyšetření: hormony štítné žlázy, základní biochemie včetně iontů, koncentrace kreatininu, glykemie, lipidové spektrum, krevní obraz, základní koagulogram.
3.4.2. Vyšetření indikovaná u vybraných pacientů
- Zátěžový test (ergometrie, běhátko): při podezření na ICHS, ke kontrole odpovědi komor při zátěži;
-
Ambulantní EKG monitorace:
- u jedinců s podezřením na fibrilaci síní: k záchytu fibrilace, korelace se symptomy, u pacientů s opakovanými synkopami, po mozkové příhodě (včetně „kryptogenní“);
- u jedinců s již zjištěnou fibrilací síní: k záchytu fibrilace včetně asymptomatických epizod, kontrola účinku léčby, kontrola odpovědi komor při FS; možnosti EKG monitorace: kontinuální (holterovské) EKG monitorování (24 hod až 7 dnů), transtelefonní epizodické záznamníky, externí smyčkové záznamníky (až několik týdnů), detekce síňových signálů z implantovaných kardiostimulátorů, defibrilátorů, implantabilní smyčkové záznamníky;
- Transezofageální echokardiografie k vyloučení intrakardiální trombózy před elektrickou kardioverzí či katetrovou ablací, upřesnění nálezu z transtorakální echokardiografie.
3.4.3. Vyšetření většinou neindikovaná u pacientů s fibrilací síní
- Koronarografie: indikována dle platných doporučení pouze při symptomech či průkazu myokardiální ischemie, suspektní ICHS;
- Elektrofyziologické vyšetření: indikováno pouze při záchytu jiných supraventrikulárních arytmií, které mohou fibrilace síní spouštět a mohou být vyřešeny katetrovou ablací nebo jako součást vlastní katetrové ablace fibrilace síní.
3.4.4. Sledování pacientů s fibrilací síní
Vstupní vyšetření, klasifikaci a rozvahu o strategii léčby by měl zajistit kardiolog. Další sledování by mělo probíhat ve spolupráci kardiologa, internisty a praktického lékaře. Záleží na typu fibrilace, onemocnění srdce a dalších chorobách.
Kontrolní 12svodové EKG by mělo být sledováno v pravidelných intervalech, k ozřejmení aktuálního rytmu, vyloučení proarytmogenního vlivu antiarytmik atd. Při zhoršení stavu či změně charakteru onemocnění by měla být provedena kontrolní vyšetření, včetně např. EKG monitorace, echokardiografie atd.
Změny zdravotního stavu podmiňují nutnost opakované klasifikace stavu a rizik (tromboembolie, krvácivých komplikací, lékových interakcí, nežádoucích účinků léčiv apod.). Pacienti, u nichž je stávající terapie neúčinná, nebo je u nich zvažováno invazivní řešení fibrilace síní, by měli být odesláni do specializovaných kardiocenter.
3.4.5. Náklady na péči
Náklady na péči o pacienty s fibrilací síní jsou vysoké. Největší část z nich je spojena s hospitalizacemi (pro srdeční selhání, CMP, při provádění kardioverzí atd.) a dále s intervencí pro fibrilaci síní. Farmakoterapie se na všech vynaložených nákladech podílí asi 10 %, a to v zahraničí i v ČR [31]. Podobnou finanční zátěž vyžaduje ambulantní sledování.
4. Farmakoterapie pro fibrilaci síní
Léčba fibrilace síní je zaměřena na léčbu a prevenci onemocnění, které k fibrilaci vedou, na prevenci tromboembolických příhod a vlastní léčbu fibrilace. Tou rozumíme 2 směry: obnovení a udržení sinusového rytmu – kontrolu srdečního rytmu, a optimalizaci srdeční frekvence – kontrolu frekvence. Rozhodnutí o konkrétním způsobu počáteční léčby vyžaduje zohlednění specifik individuálního nemocného, měla by tedy být „šitá na míru“ („patient-tailored therapy“). Zvolený postup pak musí být opakovaně aktualizován s ohledem na změny stavu pacienta a jeho reakce na dosavadní léčbu.
Pacient musí být detailně a opakovaně informován o individuálních možnostech terapie, její účinnosti a možných nežádoucích účincích, a to při použití všech způsobů léčby včetně antitrombotik, antiarytmik i postupů invazivních.
4.1. Antitrombotická léčba
Na základě mnoha studií byla v posledních 5 letech zjištěna větší nehomogennost rizikových faktorů pro vznik cévní mozkové příhody či tromboembolizmu, než se předpokládalo. Ukázalo se, že existují možnosti přesnější predikce jejich rizika než dosud užívané CHADS2 skóre (tab. 3). Současně jsou objevována nová účinná antitrombotika při sníženém riziku krvácení. To vše vedlo k potřebě obnovy doporučení pro antitrombotickou léčbu nemocných s fibrilací síní.
Tab. 3. Kritéria rizikové stratifikace tromboembolie CHADS<sub>2</sub>. 
4.1.1. Riziko tromboembolických komplikací
4.1.1.1. Riziková stratifikace
Všechna schémata rizikové stratifikace cévní mozkové příhody nebo tromboembolizmu rozdělují nemocné do 3 rizikových skupin – nízce riziková, středně riziková a vysoce riziková. Dle míry rizika se doporučovala warfarinizace pro vysoce rizikovou skupinu a kyselina acetylsalicylová pro nízce rizikovou skupinu [32].
Nejjednodušším schématem pro hodnocení rizik je skóre CHADS2 (tab. 3). CHADS2 je zkratka vytvořená z prvních písmen názvů rizikových faktorů [srdeční selhání – cardiac failure, hypertenze, věk – age, diabetes mellitus, předchozí mozková příhoda – stroke (dvojnásobná váha)]. Skóre je index rizika vyvinutý na základě kritérií zjištěných při výzkumu fibrilace síní a prevence mozkové příhody. Je založeno na bodovém systému, v němž se za cévní mozkovou příhodu nebo tranzitorní ischemickou ataku v anamnéze přidělují 2 body a po 1 bodu pak za každý z ostatních rizikových faktorů: věk vyšší než 75 let, vysoký krevní tlak v anamnéze, diabetes mellitus nebo nedávné srdeční selhání [33,34].
Řada studií sledovala nové rizikové faktory. Cílem je zvýšení prediktivní hodnoty rizikové stratifikace CMP či tromboembolizmu. Kromě dosavadních rizikových faktorů se zjistilo, že riziko představuje věk již od 65 let, význam má také přítomnost aterosklerotického cévního postižení a ženské pohlaví.
4.1.1.2. Nové možnosti rizikové stratifikace
Modifikaci přístupu hodnocení rizikových faktorů tromboembolie u pacientů s nevalvulární fibrilací síní lze vyjádřit zkratkou CHA2-DS2-VASc [městnané selhání srdce – chronic heart failure, hypertenze, věk ≥ 75 let – age (dvojnásobná váha), diabetes mellitus, mozková příhoda v anamnéze – stroke (dvojnásobná váha), cévní choroba – vascular disease, věk 65–74 let – age a ženské pohlaví – sex category] [35]. Toto schéma je založeno na bodovacím systému, v němž se 2 body přidělují za CMP či tranzitorní ischemickou ataku v anamnéze a za věk vyšší než 75 let. Po 1 bodu se pak přiděluje za věk v rozmezí 65–74 let a předchozí výskyt hypertenze, dia-betu, nedávného srdečního selhání, cévní choroby (infarktu myokardu, komplikovaného plátu v aortě a onemocnění periferních tepen, včetně předchozí revaskularizace, amputace zaviněné onemocněním periferních tepen či angiograficky prokázaného onemocnění apod.) a ženské pohlaví (tab. 4). Schéma charakterizované zkratkou CHA2-DS2-VASc tedy rozšiřuje skóre CHADS2.
Tab. 4. Riziko embolizační mozkové příhody u nemocných s fibrilací síní bez přítomné chlopňové vady pro stanovení antitrombotické léčby dle skórovací stratifikace CHA<sub>2</sub>DS<sub>2</sub>-VASc. 
Za rizikový faktor se pokládá neléčená hypertenze > 160/95 mm Hg nebo hypertenze korigovaná léčbou. Přítomnost závažnější systolické dysfunkce levé komory při echokardiografickém vyšetření [ejekční frakce levé komory (EFLK) ≤ 40 %] se ukázala jako jasný nezávislý rizikový faktor CMP. Riziko tromboembolizmu u srdečního selhání při zachované systolické funkci levé komory není zatím přesně definováno.
Také přítomnost aterosklerotického cévního onemocnění představuje zvýšené riziko CMP. Závažnost jednotlivých cévních onemocnění však není stejná. Prodělaný infarkt myokardu zvyšuje riziko CMP/tromboembolizmu [36], ale diagnóza samotné anginy pectoris je nespolehlivá, jelikož část těchto nemocných nemusí mít sklerotické postižení koronárních tepen. Fibrilace síní značí špatnou prognózu také u pacientů s onemocněním periferních tepen. Nezávislým rizikovým faktorem pro cévní mozkovou příhodu a tromboembolii je přítomnost komplikovaného plátu v sestupné části aorty zjištěné jícnovou echokardiografií. Analýza četných studií a registrů nově stanovila, že ženy mají vyšší riziko tromboembolizmu, jako je tomu u rizikových faktorů věku a hypertenze. Při jícnovém echokardiografickém vyšetření jsou nezávislými indikátory hrozící cévní mozkové příhody a tromboembolie sraženina v levé síni [relativní riziko (RR) 2,5], komplikované pláty v aortě (RR 2,1), spontánní echokontrast (RR 3,7) a nízké rychlosti průtoku v oušku levé síně srdeční (< 20 cm/s). Jsou-li přítomny rizikové faktory u pacientů s paroxyzmální fibrilací síní, mělo by u nich být riziko cévní mozkové příhody stejné jako při formě perzistující.
Při sledování dalších onemocnění u nemocných s fibrilací síní byly zjištěny i další faktory, které představují zvýšené riziko tromboembolizmu. Je to např. chronické onemocnění ledvin. Nedávná analýza naznačuje, že proteinurie zvyšuje riziko tromboembolie o 54 %, přičemž zvýšené riziko cévní mozkové příhody nastává u odhadované úrovně glomerulární filtrace < 45 ml/min. Dalšími riziky mohou být hypertyreóza, hypertrofická kardiomyopatie, amyloidóza a řada dalších. Tyto faktory však současně zvyšují mortalitu a krvácivé komplikace a nebyly prospektivně sledovány, proto jejich závažnost ve vztahu k tromboembolii není stanovena.
4.1.2. Doporučení k antitrombotické léčbě podle rizikové stratifikace
Evropská doporučení navrhují, aby se lékaři při stratifikací rizika cévní mozkové příhody/tromboembolie nadále zpočátku řídili dle skóre CHADS2. Tento návrh odůvodňují jednoduchostí a dobrou zapamatovatelností již vžitého skórovacího systému. Nová stratifikace rizika skóre CHA2DS2-VASc není proti původní stratifikaci rizika dle CHADS2 výrazněji složitější, ale má podstatně větší prediktivní hodnotu pro stanovení rizika cévní mozkové příhody nebo tromboembolie.
Nové schéma velmi dobře identifikuje nemocné s fibrilací síní, kteří jsou skutečně v nízkém riziku (CHA2DS2-VASc skóre = 0) [35] a u kterých není nutná žádná prevence tromboembolie. Nové skóre také dobře vymezuje skupinu nemocných se středním rizikem tromboembolizace (CHA2DS2-VASc skóre = 1) – v tom případě lze volit mezi léčbou antikoagulační a antiagregační, přičemž preferenční je léčba antikoagulační. Pacientů v tomto středním riziku s možností volby léčby je podle skóre CHA2DS2-VASc 15 %, tedy daleko méně než dřívějších 62 % podle skóre CHADS2. U ostatních pacientů s CHA2DS2-VASc skóre ≥ 2 je doporučena léčba antikoagulační (tab. 5).
Tab. 5. Doporučení pro prevenci tromboembolizmu dle rizikových faktorů stratifikace CHA<sub>2</sub>DS<sub>2</sub>-VASc. 
U skupiny nemocných s CHADS2 skóre = 0 byl roční výskyt CMP či embolizace 1,4 %. Při nové stratifikací nedošlo u nemocných ve skutečně nízkém riziku (CHA2DS2-VASc skóre = 0) k žádné tromboembolické příhodě, proto se těmto nemocným nemusí podávat žádná antitrombotická léčba. Doposud se u nemocných v nízkém riziku (CHADS2 skóre = 0) doporučovalo podání kyseliny acetylsalicylové, což vedlo k určitému množství krvácivých komplikací. Navíc kyselinu acetylsalicylovou dostávala také velká část nemocných ve středním riziku (CHADS2 skóre = 1), což při podhodnocení rizika vedlo k tromboembolickým komplikacím.
Podle CHA2DS2-VASc stratifikace tromboembolizmu má více než 90 % pacientů s fibrilací síní skóre ≥ 1. Lze tedy shrnout, že v současné době je antikoagulační léčba vhodná pro naprostou většinu pacientů s fibrilací síní, s výjimkou mužů mladších než 65 let a bez dalších rizikových faktorů. Také u žen mladších 65 let, u nichž se nevyskytují žádné další rizikové faktory, lze uvažovat spíše o použití kyseliny acetylsalicylové než o léčbě perorálními antikoagulancii.
4.1.3. Riziko krvácivých komplikací
Přínos antikoagulační léčby v prevenci CMP mnohonásobně převažuje nad rizikem intrakraniálního krvácení. Přesto je potřeba od počátku rizika krvácení zhodnotit. Antikoagulační léčba se dnes používá u starších pacientů s fibrilací síní, avšak procentuální výskyt nitrolebního krvácení je podstatně nižší než v minulosti a typicky se v současných výsledkových zprávách pohybuje v rozmezí 0,1–0,6 %. Příčinou může být nižší intenzita antikoagulační léčby, pečlivější úprava dávkování nebo lepší kontrola vysokého krevního tlaku. Výskyt nitrolebního krvácení stoupá až s hodnotami INR převyšujícími 3,5–4,0, hodnoty v rozmezí 2,0–3,0 nevykazují ve srovnání s nižšími hodnotami INR žádný nárůst rizika krvácení.
Lze předpokládat, že riziko závažného krvácení při podávání kyseliny acetylsalicylové je obdobné jako u antagonistů vitaminu K, zejména u starších osob [37]. Strach z pádů je patrně přeceňován, protože k tomu, aby riziko nitrolebního krvácení převážilo nad přínosem antikoagulační léčby, by musel pacient spadnout zhruba 300krát za rok.
Na základě zkušeností z praxe (studie EuroHeart čítající 3 978 nemocných s fibrilací síní) bylo vyvinuto nové jednoduché skóre pro hodnocení rizika krvácení – skóre HAS-BLED. Název je odvozen opět od počátečních písmen rizikových faktorů krvácení [hypertenze, abnormální funkce ledvin/jater, mozková příhoda (stroke), krvácení (bleeding) v anamnéze nebo predispozice k němu, labilní INR, vyšší věk (elderly), tj. věk nad 65 let, užívání léků zvyšujících krvácení (drugs) a/nebo alkoholu současně s antikoagulační léčbou] (tab. 6).
Tab. 6. Stanovení rizika krvácení dle rizikové stratifikace HAS-BLED. 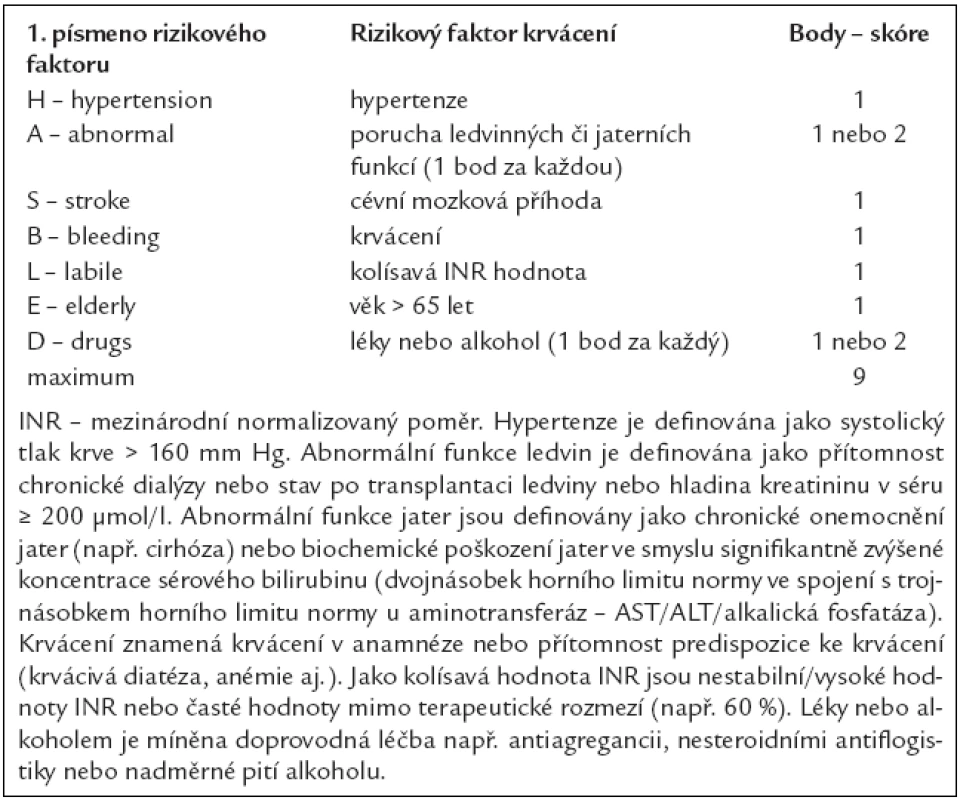
Skóre ≥ 3 poukazuje na vysoké riziko. V takovýchto případech je tedy třeba po zahájení antitrombotické léčby, ať už antagonisty vitaminu K, či kyselinou acetylsalicylovou, zvýšená opatrnost a pravidelná kontrola pacientova stavu. Neznamená to tedy, že antitrombotickou léčbu nemáme podávat. Perspektivně lze při vysokém riziku krvácení zvážit nová antitrombotika.
4.1.4. Optimální antikoagulační léčba
4.1.4.1. Antikoagulační léčba antagonisty vitaminu K vs kontrolní skupina
V letech 1989–1992 byly uveřejněny výsledky 5 velkých randomizovaných studií, které hodnotily účinnost antagonistů vitaminu K, zejména v primární prevenci tromboembolie u pacientů s nevalvulární fibrilací síní. Šestá studie byla zaměřena na sekundární prevenci u pacientů, kteří přežili neinvalidizující CMP či tranzitorní ischemickou ataku. Při metaanalýze bylo snížení relativního rizika užíváním antagonistů vitaminu K velmi významné, na úrovni 64 %, což odpovídá absolutnímu ročnímu snížení rizika všech typů cévních mozkových příhod o 2,7 % [9]. Pokud byly brány v úvahu pouze ischemické mozkové příhody, užívání antagonistů vitaminu K v kontrolovaném režimu vedlo k 67% snížení relativního rizika. Toto snížení bylo podobné u primární i sekundární prevence a u invalidizujících i neinvalidizujících mozkových příhod. Mnoho případů CMP, které se vyskytly u pacientů užívajících antagonisty vitaminu K, se přihodilo v době, kdy se nemocní neléčili nebo dostávali subterapeutické dávky antikoagulancií. Úmrtnost ze všech příčin se užíváním adjustovaných dávek antagonistů vitaminu K oproti kontrolní skupině významně snížila (o 26 %). Riziko mozkového krvácení bylo malé.
4.1.4.2. Protidestičková léčba
Ovlivnění rizika tromboembolie u nemocných s fibrilací síní podáváním protidestičkové léčby (převážně kyseliny acetylsalicylové) bylo ověřováno v 8 nezávislých randomizovaných kontrolovaných studiích, jichž se dohromady účastnilo 4 876 pacientů [9]. V 7 z nich, kdy bylo porovnáváno pouze užívání kyseliny acetylsalicylové a placebem, vykazovala léčba kyselinou acetylsalicylovou nevýznamné snížení výskytu cévních mozkových příhod. Snížení absolutního rizika v tomto případě bylo na úrovni 0,8 % za rok u studií primární prevence a 2,5 % za rok u studií prevence sekundární. Kyselina acetylsalicylová byla také spojována s 13% snížením výskytu invalidizujících mozkových příhod a s 29% redukcí výskytu mozkových příhod neinvalidizujících. Pokud byly zvažovány pouze ischemické mozkové příhody, vedlo užívání kyseliny acetylsalicylové k 21% snížení jejich výskytu. Teze o příznivých účincích kyseliny acetylsalicylové se z velké části opírá o výsledky jediné pozitivní studie SPAF-I, z níž vyplynulo 42% snížení rizika CMP při užívání 325 mg kyseliny acetylsalicylové ve srovnání s placebem. Význam této jedné studie je patrně nadhodnocován. Míra snížení rizika cévní mozkové příhody léčbou kyselinou acetylsalicylovou oproti použití placeba je při metaanalýze přibližně stejná jako v případech, kdy je kyselina acetylsalicylová podávána pacientům s cévním onemocněním.
Podávané dávky kyseliny acetylsalicylové se u jednotlivých studií podstatně lišily, pohybovaly se od 50 mg po 1 300 mg za den. Z farmakologického hlediska se dosáhne téměř úplné inhibice destiček již při dávce 75 mg. Nízké dávky (< 100 mg) jsou navíc bezpečnější než vyšší (> 300 mg), při nichž stoupá výskyt krvácení. Pokud je tedy pacient léčen kyselinou acetylsalicylovou, je rozumné používat dávky pohybující se při dolní hranici povoleného rozpětí (75–100 mg denně).
Vzhledem k mírnému či spornému účinku kyseliny acetylsalicylové na výskyt CMP, provázené určitým rizikem krvácivých komplikací podobným riziku při léčbě antagonisty vitaminu K, se dnes pacientům s nízkým rizikem tromboembolie spíše než užívání kyseliny acetylsalicylové doporučuje nepodávat žádnou léčbu. Postup je však jistě individuální.
4.1.4.3. Antikoagulační léčba antagonisty vitaminu K vs protidestičková léčba
Přímé srovnání účinků antagonistů vitaminu K a kyseliny acetylsalicylové bylo provedeno v 9 studiích bylo prokázáno, že antagonisté vitaminu K jsou podstatně účinnější a snižují relativní riziko o 39 %. Studie BAFTA u pacientů s fibrilací síní starších 75 let ukázala, že antagonisté vitaminu K (cílová hodnota INR 2–3) byly při snižování rizika primárního výsledného ukazatele, tj. fatální nebo invalidizující cévní mozkové příhody (ischemické nebo hemoragické), nitrolebního krvácení nebo klinicky významné tepenné embolie, o 52 % účinnější než podávání kyseliny acetylsalicylové v dávce 75 mg denně. Rizikem závažného krvácení se užívání kyseliny acetylsalicylové nelišilo od podávání warfarinu [10]. Podle studií provedených dříve bylo riziko nitrolebního krvácení při užívání warfarinu dvojnásobné oproti riziku spojenému s podáváním kyseliny acetylsalicylové, byť nárůst absolutního rizika byl malý (0,2 % ročně).
4.1.4.4. Kombinovaná antitrombotická léčba
Antikoagulační léčba je účinnější než duální antiagregační léčba (kyselina acetylsalicylová + clopidogrel). Ukázala to studie ACTIVE W. U nemocných se středním a vyšším rizikem (skóre CHADS2 ≥ 1) má oproti duální antiagregaci statisticky významně větší přínos antikoagulační léčba [38], výskyt krvácivých komplikací při této duální antiagregaci byl podobný.
Studie ACTIVE A ukázala, že duální antiagregační léčba je účinnější než užívání samotné kyseliny acetylsalicylové (relativní redukce CMP –28 %). Tato duální léčba oproti monoterapii kyselinou acetylsalicylovou ale také vede k signifikantnímu zvýšení velkých krvácivých komplikací (2 % vs 1,3 %) [39]. V evropských i amerických doporučeních se u pacientů, kteří z nějakých důvodů nemohou užívat warfarin a nemají vysoké riziko krvácivých komplikací, uvádí možnost kombinaci kyseliny acetylsalicylové a clopidogrelu podávat. V současné době, kdy začínají být k dispozici přímé inhibitory trombinu nebo inhibitory faktoru Xa, uvedenou duální antiagregaci nelze doporučit ani u této skupiny nemocných.
Kombinace antikoagulační léčby s léčbou antiagregační nepřináší snížení výskytu tromboembolií, ale naopak zvyšuje výskyt krvácivých komplikací. Proto v případě, když k tromboembolii dojde při účinné antikoagulační léčbě (INR 2,0–3,0), se nedoporučuje přidat antiagregační léčbu, nýbrž zvýšit účinnost antikoagulace (INR 3,0–3,5), jelikož riziko závažného krvácení se zvyšuje až od hodnoty INR > 3,5.
4.1.5. Alternativy antikoagulační léčby
4.1.5.1. Nová antitrombotika
V současné době se vyvíjí, nebo již postupně přichází na trh, několik nových antikoagulačních léků, které spadají převážně do 2 kategorií:
- perorální přímé inhibitory trombinu, tzv. „gatrany“ (např. dabigatran etexilát),
- perorální inhibitory faktoru Xa , tzv. „xabany“ (rivaroxaban, apixaban, edoxaban, betrixaban, YM150 atd.).
Doposud byly publikovány 3 srovnávací studie nových perorálních antitrombotik s warfarinem u pacientů s fibrilací síní (tab. 7).
Tab. 7. Základní srovnávací charakteristiky průkazných studií s novými perorálními antitrombotiky. 
Randomizovaná studie RE-LY [40] porovnávala dabigatran etexilát s warfarinem v prevenci tromboembolických příhod u nemocných s fibrilací síní a nejméně jedním rizikovým faktorem pro vznik cévní mozkové příhody. Studie se zúčastnilo přes 18 000 nemocných a ukázala, že ve skupině léčené warfarinem se CMP nebo systémové embolizace vyskytly u 1,71 % sledovaných/rok, zatímco ve skupině léčené dabigatranem v dávce 2krát 110 mg denně u 1,54 % a ve skupině léčené dabigatranem v dávce 2krát 150 mg denně u 1,11 % sledovaných/rok. Z výsledků vyplývá, že dabigatran v dávce 2krát 110 mg nebyl v prevenci cévních mozkových příhod a systémové tromboembolie horší než warfarin (p < 0,001) a dabigatran v dávce 2krát 150 mg byl účinnější než warfarin (p < 0,001). Výskyt krvácivých komplikací byl při dávce dabigatranu 2krát 150 mg srovnatelný, při dávce 2krát 110 mg nižší. Důležité je, že při použití obou dávek byl nižší výskyt závažných mozkových krvácení.
Studie ROCKET-AF [41] byla dvojitě zaslepená randomizovaná studie, která porovnávala rivaroxaban v dávce 20 mg 1krát denně s warfarinem v prevenci cévní mozkové příhody a tromboembolických příhod u nemocných s fibrilací síní ve zvýšeném riziku vzniku CMP. U více než 14 000 nemocných ukázala, že ve skupině léčených warfarinem byl zaznamenán výskyt cévní mozkové příhody nebo systémových embolizací u 2,2 % sledovaných/rok, zatímco ve skupině léčené rivaroxabanem u 1,7 % sledovaných/rok. Hodnocení výsledků závisí na způsobu analýzy. Rivaroxaban nebyl v prevenci cévní mozkové příhody a tromboembolizace horší než warfarin (analýza „intention-to treatment“), resp. byl účinnější (analýza „on treatment“). Výskyt krvácivých komplikací byl u 14,5 % sledovaných/rok ve skupině léčené warfarinem a u 14,9 % ve skupině léčené rivaroxabanem, tedy srovnatelný, výskyt závažných krvácivých komplikací (včetně krvácivých CMP) při podávání rivaroxabanu byl nižší. Naopak méně závažná krvácení a nutnost podávání transfuzí byla častější.
V srpnu roku 2011 byly prezentovány výsledky studie ARISTOTLE [42]. Ta porovnávala apixaban v dávce 5 mg 2krát denně s warfarinem v prevenci cévní mozkové příhody a systémových tromboembolických příhod u nemocných s fibrilací síní ve zvýšeném riziku vzniku CMP. Ve studii se u více než 18 000 pacientů prokázalo, že při podávání warfarinu byl výskyt CMP nebo systémových embolizací u 1,6 % sledovaných/rok, zatímco ve skupině léčené apixabanem u 1,27 % sledovaných//rok. Z výsledků vyplývá, že apixaban byl účinnější než warfarin. V této studii také poprvé dosáhl významnosti rozdíl v ovlivnění celkové mortality, která byla při apixabanu nižší. Výskyt velkých krvácivých komplikací byl zaznamenán u 3,09 % sledovaných/rok ve skupině léčené warfarinem a u 2,13 % ve skupině léčené apixabanem. Také výskyt závažných krvácivých komplikací byl nižší. Celkově tedy lze uzavřít, že v prevenci cévní mozkové příhody a systémové embolizace byl apixaban v dávce 2krát 5 mg účinnější než warfarin a byl spojen s nižším výskytem krvácivých komplikací.
4.1.5.2. Postavení nových antitrombotik v rámci doporučení
V současnosti jsou k dispozici data, která již u 3 nových antitrombotik prokazují srovnatelnou či vyšší účinnost proti warfarinu u pacientů s fibrilací síní, a to s nižším nebo srovnatelným výskytem krvácivých komplikací. Evropská guidelines však ještě k antikoagulační léčbě u pacientů s fibrilací síní uvádějí pouze warfarin. Je tedy zřejmé, že bude třeba (v závislosti na průběhu schvalovacích procesů) vydávání dodatků k doporučením.
Evropská guidelines pouze předpokládají použití dabigatranu jako alternativu k warfarinu a navrhují i způsob dávkování. Evropská agentura pro léčiva (European Medicines Agency –EMA) vydala v srpnu roku 2011 doporučení pro užívání dabigatranu v prevenci cévní mozkové příhody a tromboembolie u nemocných s fibrilací síní bez chlopenní vady. Doporučené dávky se zde od návrhu uvedeného v evropských guidelines liší. Doporučeno je dlouhodobé podávání dabigatranu v dávce 2krát 150 mg denně, nižší dávka 2krát 110 mg je nutná u osob ve věku ≥ 80 let a u pacientů užívajících současně verapamil. Nižší dávku je třeba zvážit také u nemocných ve věku 75–80 let, kteří mají vysoké riziko krvácení, u nemocných se středně závažnou poruchou funkce ledvin (clearance kreatininu 30–50 ml/min) a u osob s gastritidou, ezofagitidou nebo gastroezofageálním refluxem. U nemocných s těžkou poruchou funkce ledvin (clearence kreatininu < 30 ml/min) je dabigatran kontraindikován. Všichni nemocní se zvýšeným rizikem krvácivých komplikací by měli být důkladně sledováni a dávka dabigatranu by měla být snížena podle úvahy lékaře. V souladu s doporučeními Evropské agentury pro léčiva lze upřesnit podávání dabigatranu za dalších klinických situací (postup dle SPC).
Podávání dabigatranu může být rovněž zváženo u nemocných, kteří jsou indikovaní k antikoagulační léčbě, ale není pro ně z jakéhokoli důvodu vhodné užívání warfarinu. Doposud se v takovém případě jako alternativní léčba uváděla možnost podávání duální antiagregace (kyselina acetylsalicylová + clopidogrel).
Dabigatran jako prevence tromboembolie u pacientů s fibrilací síní byl schválen rovněž ve Spojených státech amerických, což vedlo k vydání dodatku ke guidelines. Proti evropským doporučením je v USA dávkování odlišné – byla schválena pouze dávka 2krát 150 mg, resp. u pacientů s renálním selháním dávka 2krát 75 mg (netestovaná ve studii RE-LY).
Další nová antitrombotika zatím (v době revize těchto doporučení) pro prevenci tromboembolizmu u pacientů s fibrilací síní FS nebyla schválena [v USA doporučil poradní výbor FDA v září roku 2011 schválení rivaroxabanu, pozitivní doporučující stanovisko je vydáno také pro Evropskou agenturu pro léčiva (EMA)]. Nová antitrombotika mají proti antagonistům vitaminu K z hlediska praktického užití řadu výhod. Dávkování je fixní, není třeba rutinního monitorování léčby, nevyskytují se závažné interakce s potravinami, mají nízký potenciál pro interakce s léky. Účinek rychle nastupuje i odeznívá. Na rozdíl od antagonistů vitaminu A však zatím není dostupné antidotum. Všechna antikoagulancia inhibují koagulaci blokováním tvorby trombinu, trombinové aktivity nebo blokací obojího.
Výsledky studií s dabigatranem, rivaroxabanem a apixabanem potvrzují antikoagulační funkci trombinu i faktoru Xa a zatím není žádný přesvědčivý důkaz, zda je lepší ovlivnění jednoho faktoru, či druhého. Bylo by třeba přímého vzájemného porovnání nových antikoagulancií, v nejbližší budoucnosti jsou však takové srovnávací studie nepravděpodobné. Nepřímé srovnání nových antitrombotik napříč jednotlivými studiemi je problematické, jelikož může být zkresleno různou závažností onemocnění jednotlivých sledovaných skupin nemocných, různými kombinacemi doprovodných onemocnění, různými typy intervencí i způsoby hodnocení účinku léčby. Z toho pramení rozpaky při porovnávání rozdílných výsledků jednotlivých studií.
4.1.6. Současná doporučení pro antitrombotickou léčbu
Schéma hodnocení rizika tromboembolie CHADS2 by mělo být používáno jako jednoduchý výchozí a snadno zapamatovatelný nástroj pro odhad rizika cévní mozkové příhody, zejména pro praktické lékaře. Pokud se nevyskytnou kontraindikace, doporučuje se u pacientů se skóre CHADS2 ≥ 2 dlouhodobá léčba antagonisty vitaminu K, při terapii warfarinem je doporučováno dosažení INR v rozmezí 2,0–3,0. U pacientů, kteří mají skóre CHADS2 v rozmezí 0–1, se doporučuje použít komplexnější bodovací systém – skóre CHA2DS2VASc.
Za účinnou a optimální antikoagulační léčbu v prevenci cévní mozkové příhody a tromboembolie dnes lze pokládat jednoznačné udržení hodnot INR v rozmezí 2,0–3,0. Celkový počet hodnot v terapeutickém rozmezí by měl být co nejvyšší. Studie ukázaly, že je velmi důležitá doba s hodnotami INR v terapeutickém rozmezí (time in therapeutic range – TTR). Ve studiích se pohybovala průměrně v rozmezí 57–65 %. Čím nižší je procento, tím nižší je terapeutický efekt. Při poklesu pod 60 % je preventivní efekt výrazně snížen.
U nemocných s umělou chlopenní náhradou by se hodnota INR měla držet minimálně na hodnotě INR ≥ 2,5 v mitrální pozici a minimálně na hodnotě INR ≥ 2,0 v aortální pozici. V případě, že dojde k tromboembolii při prokazatelně účinné antikoagulační léčbě (INR 2,0–3,0), je možné zvýšit účinnost antikoagulace na hodnoty INR 3,0–3,5.
U všech nemocných, kdy uvažujeme o použití perorálních antikoagulancií, je třeba výhody a nevýhody této léčby konzultovat s pacientem. Podstatné pro zahájení antikoagulační léčby je zhodnocení, nakolik je pacient schopen bezpečně snášet dlouhodobou antikoagulační léčbu s pravidelnými kontrolami protrombinového času.
4.1.6.1. Selfmonitoring INR u fibrilace síní
K optimalizaci antikoagulační léčby lze využít také monitorace INR pacientem (selfmonitoring). V tom případě je třeba, aby nemocný tuto metodu preferoval a přitom byl také schopen samostatně provádět testování INR (např. přístrojem CoaguCheck). Poučení a dobře spolupracující pacienti si v některých studiích na základě monitorace upravovali dávky warfarinu (selfmanagement). Zlepšení správné kontroly antikoagulace může pomoci také vyškolený pečovatel, např. v rámci péče „HomeCare“.
4.1.6.2. Riziko tromboembolizmu u paroxyzmální vs perzistující fibrilace síní
Antitrombotická léčba je indikována u fibrilace síní paroxyzmální, perzistující i permanentní. Riziko tromboembolizmu je u všech typů pravděpodobně podobné. Je však známo, že pacientů s paroxyzmální fibrilací síní bylo ve studiích s antitrombotickou léčbou méně. Přesné posouzení rizika krátkodobých atak fibrilace síní mohou přinést jen studie s kontinuální monitorací EKG u pacientů s implantovanými kardiostimulátory či defibrilátory s holterovskou funkcí. Tyto studie naznačují, že riziko tromboembolie u krátkých atak fibrilace síní FS (asi do 5 hod) by mohlo být nižší.
4.1.6.3. Riziko tromboembolizmu u flutteru síní
Riziko cévní mozkové příhody spojené s flutterem síní bylo zkoumáno retrospektivně u velkého množství starších pacientů a bylo podobné jako riziko spojené s fibrilací síní. Kromě toho je potřeba vzít do úvahy koincidenci obou uvedených síňových arytmií. Prevence tromboembolizmu u pacientů s prokázaným flutterem síní by se tedy měla řídit stejnými principy jako u pacientů s fibrilací síní.
4.1.7. Zvláštní klinické situace
4.1.7.1. Perioperační antikoagulační léčba – dočasné přerušení antikoagulace
Před krvácivým operačním zákrokem je u nemocných s fibrilací síní často nutné ukončit antikoagulační léčbu. Většina chirurgů vyžaduje, aby hodnota INR byla před zákrokem < 1,5 nebo zcela v normě. Riziko závažného krvácení by mělo být vždy porovnáváno s rizikem tromboembolie v průběhu změny antikoagulační léčby. Biologický poločas warfarinu je 36–42 hod, antikoagulační účinek po ukončení podávání přetrvává 4–5 dní. Naopak při opětovném podání je nutné počítat s dvoudenní až třídenní latencí nástupu účinku. Warfarin lze tedy vysadit 5 dnů před plánovanou operací a invazivní zákrok by měl být proveden v době poklesu INR do subterapeutických hodnot. Subterapeutická hodnota by měla trvat maximálně 48 hod, což je období nejnižšího rizika vzniku tromboembolické komplikace. Vyvstane-li potřeba operace či jiného zákroku v době, kdy je INR stále ještě zvýšeno (> 1,5), lze pro normalizaci zvážit perorální podání nízké dávky (1–2 mg) vitaminu K.
Řadu menších zákroků je dnes možné provádět za nepřerušené antikoagulace. Platí to např. pro implantace kardiostimulátorů a defibrilátorů, u nichž je riziko krvácivých komplikací během podávání warfarinu nižší než při užívání nízkomolekulárního heparinu. Záleží však na požadavcích konkrétního pracoviště.
Pokud se přerušuje antikoagulační léčba u nemocných s fibrilací síní a mechanickou srdeční chlopní nebo s vysokým rizikem tromboembolie, je třeba vysazení antagonistů vitaminu K překlenout podáváním nízkomolekulárního heparinu v preventivní dávce, a to den po vysazení antikoagulační léčby nebo při INR pod terapeutickým rozmezím. Po provedeném krvácivém zákroku, je-li stabilní hemostáza, je vhodné večer v den zákroku nebo následující den ráno podat udržovací dávku antikoagulancia (nikoli dávku nasycovací) a u nemocných se zvýšeným rizikem tromboembolie ještě překrýt periodu subterapeutické hodnoty INR nízkomolekulárním heparinem.
4.1.7.2. Perioperační antitrombotická léčba u nemocných indikovaných k duální či trojkombinační antitrombotické léčbě
U nemocných, u nichž je plánován chirurgický zákrok, hrozí po ukončení podávání duální či trojkombinační antitrombotické léčby vysoké riziko „in-stent“ trombózy s potenciálně fatálními důsledky (mortalita se pohybuje v rozmezí 2,5–21,4 %). Proto se u těchto vysoce rizikových nemocných s implantovaným stentem snažíme chirurgickému zákroku vyhnout (minimálně 1 měsíc u metalického stentu a 1 rok u potahovaných stentů – DES). Podobně by nemocným, u nichž je operace plánovaná v průběhu nejbližších 12 měsíců, neměl být implantován potahovaný stent [43].
U nemocných, kteří vyžadují provedení urgentního chirurgického zákroku, je třeba antitrombotickou léčbu individualizovat, a to na základě odhadu rizika krvácení provedeného chirurgem a rizika „in-stent“ trombózy. Při nízkém a středním riziku krvácení se u duální antitrombotické medikace doporučuje ponechat pouze podávání kyseliny acetylsalicylové a při vysokém riziku krvácení provést zákrok při úplném vysazení duální antiagregační léčby. Při vysokém riziku krvácení a při subakutní urgenci operace, kdy je třeba duální protidestičkovou léčbu zcela vysadit, se 7 dnů před operací ukončí podávání kyseliny acetylsalicylové, 5 dnů před operací clopidogrelu a 3 dny před operací se slábnoucí protidestičkový efekt nahradí inhibitorem glykoproteinu IIb/IIIa – integrilinem nitrožilně v dávce 2 µg/kg/min. Tato infuze se 6–8 hod před plánovanou subakutní operací zastaví [44]. Pooperačně se vrátí původní protidestičková léčba, a to co nejdříve.
U nemocného s trojkombinační antitrombotickou léčbou je třeba zvážit poměr rizika tromboembolizace a „in-stent“ trombózy. Pokud se zdá vyšší riziko „in-stent“ trombózy, přecházíme na stejnou strategii jako u duální protidestičkové léčby. Zdá-li se vyšší riziko tromboembolie, je doporučeno ukončit antitrombotickou léčbu týden před operací a po celou dobu tuto léčbu nahradit nízkomolekulárním heparinem v léčebných dávkách s posledním podáním ráno den před operací. Po operaci při nekrvácivém průběhu podáváme co nejdříve nízkomolekulární heparin se znovuzavedením trojkombinační antitrombotické léčby. Je-li operace urgentní a riziko krvácení převyšuje riziko „in-stent“ trombózy (život ohrožující traumata či vitální indikace), je jediným řešením podat destičkový koncentrát.
4.1.7.3. Stabilní tepenné onemocnění
U nemocných s fibrilací síní a stabilním tepenným onemocněním (aterosklerotické postižení mozkových, koronárních či periferních tepen), u nichž je indikovaná antikoagulační léčba, není vhodné přidávat léčbu antiagregační. Tato přídatná léčba již riziko cévní mozkové příhody nebo tromboembolie ani infarktu myokardu dále nesnižuje, ale naopak zvyšuje riziko krvácivých komplikací.
4.1.7.4. Akutní koronární syndrom a/nebo provedená perkutánní koronární intervence
Současná doporučení pro léčbu akutního koronárního syndromu a/nebo po provedené perkutánní koronární intervenci s implantací stentu pokládají za optimální duální antiagregační léčbu kyselinou acetylsalicylovou s clopidogrelem (4 týdny po implantaci kovového stentu a 6–12 měsíců po implantaci stentů potahovaných). Má-li nemocný fibrilaci síní se současně zvýšeným rizikem tromboembolie, je třeba, aby mu za těchto okolností byla podávána trojkombinační antitrombotická léčba (warfarin + kyselina acetylsalicylová + clopidogrel). Prevalence závažného krvácení při této trojkombinační léčbě je 2,6–4,6 % během prvních 30 dnů a při medikaci po dobu 12 měsíců se zvyšuje na 7,4–10,3 %.
Nejlepšího poměru prospěšnosti a rizika krvácení při trojkombinační léčbě je dosaženo při jejím krátkém trvání, nejlépe po dobu 1 měsíce. Potahovaným stentům bychom se měli u nemocných indikovaných k antikoagulační léčbě vyhnout a trojkombinační léčba by se měla podávat jen po krátkou dobu s následnou protrahovanou kombinovanou léčbou warfarinem a jedním antiagregačním preparátem ve formě kyseliny acetylsalicylové nebo clopidogrelu (tab. 7, 8).
Tab. 8. Strategie antitrombotické léčby po zavedení koronárního stentu u nemocných s FS s více než jedním rizikovým faktorem dle CHA<sub>2</sub>DS<sub>2</sub>-VASc stratifi kace (doporučená antikoagulační léčba) a současně s nízkým až středním rizikem krvácení dle HAS-BLED stratifi kace – skóre 0–2. 
Tab. 9. Strategie antitrombotické léčby po zavedení koronárního stentu u nemocných s FS s více než jedním rizikovým faktorem dle stratifikace CHA<sub>2</sub>DS<sub>2</sub>-VASc (doporučená antikoagulační léčba) a současně s vysokým rizikem krvácení dle stratifikace HAS-BLED – skóre ≥ 3. 
4.1.7.5. Plánovaná koronární intervence
Při plánovaní koronární intervenci (PCI) by používání lékových stentů mělo být omezeno na klinické nebo anatomické situace, jako jsou dlouhé léze, malé cévy, diabetes mellitus apod., kde se ve srovnání s běžnými kovovými stenty dá čekat významný přínos. Po 4 týdny by měla probíhat léčba trojkombinací (antagonisté vitaminu K, kyselina acetylsalicylová a clopidogrel). Po provedení plánované koronární intervence s použitím běžných kovových stentů by pacienti s fibrilací síní a stabilním onemocněním koronárních tepen měli podstoupit dlouhodobou (12měsíční) léčbu perorálními antikoagulancii a k tomu dostávat buď denní dávku 75 mg clopidogrelu, nebo alternativně denní dávku 75–100 mg kyseliny acetylsalicylové. Trojkombinační léčba (antagonisté vitaminu K, kyselina acetylsalicylová a clopidogrel) by se měla podávat minimálně 1 měsíc po zavedení běžného kovového stentu, ale při zavedení lékového stentu podstatně déle (více než 3 měsíce u stentu sirolimového, everolimového nebo tacrolimového a nejméně 6 měsíců u stentů vylučujících paclitaxel). Poté lze navázat léčbou antagonisty vitaminu K kombinovanou se 75 mg clopidogrelu denně, nebo s 75–100 mg kyseliny acetylsalicylové denně.
4.1.7.6. Infarkt myokardu
U nemocných s infarktem myokardu bez elevací ST úseků je doporučena duální antiagregační léčba kyselinou acetylsalicylovou s clopidogrelem, ale u nemocných s fibrilací síní se zvýšeným rizikem tromboembolie by měla být současně také podávána léčba antikoagulační. V akutním stadiu se v jejím rámci používá především nízkomolekulární heparin. Implantace potahovaných stentů by měla být limitována stejným způsobem, jako je tomu při plánované intervenci. V případě použití potahovaného stentu (vysoké klinické a/nebo anatomické riziko „in-stent“ trombózy) pro antitrombotickou léčbu platí stejná pravidla jako u plánované intervence.
Akutní infarkt myokardu s elevacemi ST segmentů je primárně indikován k perkutánní intervenci, před níž je indikováno okamžité podání kyseliny acetylsalicylové, clopidogrelu a heparinu. Pokud je při akutním infarktu myokardu zjištěna výrazná trombotizace infarktové tepny, je indikace odsátí trombu a/nebo podání inhibitoru glykoproteinu IIb/IIIa. U nemocných, kteří jsou v té době v antikoagulační léčbě s INR > 2,0, by inhibitory glykoproteinu IIb/IIIa neměly být podány, jelikož tato kombinace antitrombotické léčby by výrazně zvýšila riziko krvácení. Po implantaci stentu by měla být podávána trojkombinační antitrombotická léčba (warfarin + kyselina acetylsalicylová + clopidogrel) s inhibitory protonové pumpy nebo s antagonisty H2-receptorů po dobu nejméně 3–6 měsíců. U nemocných s nízkým rizikem krvácení (HAS-BLED skóre 0–2) by na tuto léčbu měla navázat duální léčba (warfarin + clopidogrel/kyselina acetylsalicylová do 12 měsíců od implantace stentu), u nemocných s vysokým rizikem krvácení (HAS-BLED skóre ≥ 3) se po 3–6 měsících trojkombinační antitrombotické léčby pokračuje v antikoagulační léčbě samotným warfarinem.
Studie REDEEM ukázala, že dabigatran v maximální dávce 2krát 150 mg společně s duální antiagregací vedl k absolutnímu zvýšení velkých krvácivých komplikací pouze do 1 % proti placebu při zachovaném klinickém efektu v prevenci tromboembolie, což dokládá vysokou bezpečnost této trojkombinační antitrombotické léčby nemocných po akutním infarktu myokardu.
4.1.7.7. Prevence gastrointestinálního krvácení při kombinované antitrombotické léčbě
Výskyt krvácivých komplikací při kombinované antitrombotické léčbě je vhodné omezit doprovodnou ochranou žaludeční stěny pomocí inhibitorů protonové pumpy (IPP), antagonistů H2-receptorů nebo antacid. Inhibitory protonové pumpy mají rozdílné vlastnosti a lékové interakce. Některé z nich (omeprazol, lansoprazol, rabeprazol) patří k mohutným inhibitorům izoenzymu CYP 2C19, který přetváří clopidogrel na aktivní metabolit, čímž dochází ke snížení jeho účinku. V případě pantoprazolu a esomeprazolu podobný účinek jednoznačně prokázán nebyl. U prasugrelu, nového přípravku z řady thienopyridinů, je riziko těchto komplikací malé.
4.1.7.8. Akutní cévní mozková příhoda
Nemocní s akutní cévní mozkovou příhodou mají největší riziko tromboembolie v prvních 2 týdnech, ale antikoagulační léčba podaná v této době může vést k intrakraniálnímu krvácení. Pokud tito pacienti trpí fibrilací síní, měli by mít před podáním antikoagulační terapie řádně korigovanou hypertenzi. Vyšetření výpočetní tomografií či magnetickou rezonancí by mělo u cévní mozkové příhody vyloučit krvácivou etiologii. Při vyloučení mozkového krvácení může být antikoagulační léčba zahájena po 2 týdnech od vzniku akutní příhody.
Naopak u nemocných s fibrilací síní a přechodnou mozkovou ischemií by po vyloučení mozkového krvácení měla být antikoagulační léčba zahájena co nejdříve.
4.1.7.9. Asymptomatická cévní mozková příhoda
Cévní mozková příhoda u pacientů s fibrilací síní je primárně embolického původu, zjištění přítomnosti asymptomatických vmetků v mozku by proto pomohlo určit pacienty s vysokým rizikem tromboembolie. Studie mozkového snímkování (CT/MRI) ukazují, že u pacientů s fibrilací síní je ve srovnání s kontrolní skupinou se sinusovým rytmem vyšší výskyt cévních mozkových příhod. U asymptomatických pacientů nebo pacientů s předchozí mozkovou příhodou, kteří jsou vystaveni vysokému riziku jejího opakování, lze ultrazvukovým transkraniálním dopplerovským vyšetřením zjistit aktivní zdroj embolického rizika.
4.1.8. Kardioverze
Před elektivní kardioverzí pro fibrilaci síní trvající déle než 48 hod nebo FS neznámého trvání je indikována antikoagulační léčba. Na základě výsledků observačních kohortových studií by se léčba warfarinem (INR 2,0–3,0) měla podávat nejméně 3 týdny před kardioverzí a ještě nejméně 4 týdny po kardioverzi. Důvodem je riziko tromboembolie spojené s dysfunkcí levé síně nebo jejího ouška (tzv. „omráčením“ levé síně). Tromboprofylaxe se doporučuje shodně u elektrické i farmakologické kardioverze fibrilace síní. U pacientů s rizikovými faktory tromboembolie je třeba pokračovat v léčbě warfarinem trvale – bez ohledu na to, zda se po kardioverzi sinusový rytmus obnovil.
U pacientů, u nichž je jasná doba vzniku fibrilace a její trvání nepřekračuje 48 hod, lze kardioverzi elektivně provést při nitrožilním podávání nefrakcionovaného heparinu, po němž následuje infuze nebo subkutánní podávání nízkomolekulárního heparinu. U pacientů s rizikovými faktory pro cévní mozkovou příhodu je třeba po kardioverzi začít s perorální antikoagulační terapií a pokračovat v ní doživotně. Podávání nefrakcionovaného nebo nízkomolekulárního heparinu by mělo pokračovat, dokud se INR nedostane na terapeutickou úroveň (2,0–3,0). U pacientů bez rizikových faktorů tromboembolie není perorální antikoagulace zapotřebí.
U pacientů s fibrilací síní trvající déle než 48 hod a hemodynamickou nestabilitou je třeba provést okamžitou kardioverzi a před ní podat nefrakcionovaný nebo nízkomolekulární heparin. Po kardioverzi by se mělo začít s perorální antikoagulací a heparin by měl být podáván, dokud se INR nedostane na terapeutickou úroveň (2,0–3,0). Trvání perorální antikoagulační léčby (4 týdny nebo celoživotně) bude záviset na přítomnosti nebo absenci rizikových faktorů mozkové příhody.
4.1.8.1. Kardioverze kontrolovaná jícnovou echokardiografií (TEE)
Obvykle 3týdenní perorální antikoagulační terapii před kardioverzí lze zkrátit, pokud se při jícnové echokardiografii nezjistí žádná sraženina v levé síni ani v oušku levé síně (viz studie ACUTE). Kromě přítomnosti sraženiny v oušku nebo jiné části levé síně srdeční toto vyšetření prokazuje také tzv. spontánní echokontrast nebo tzv. komplexní plát v průběhu aorty. Je-li k dispozici zkušený personál a náležité vybavení, doporučuje se kardioverze za pomoci jícnové echokardiografie jako alternativa k 3týdenní antikoagulační terapii před kardioverzí.
Pokud jícnová echokardiografie nezjistí žádnou sraženinu v levé síni, měl by být před kardioverzí podán nefrakcionovaný nebo nízkomolekulární heparin a po ní by se s jeho podáváním mělo pokračovat, dokud není s perorální antikoagulací dosaženo cílové hodnoty INR. Jestliže jícnová echokardiografie přítomnost sraženiny odhalí, je třeba zahájit léčbu warfarinem (INR 2,0–3,0) a po nejméně 3 týdnech této terapie echokardiografické vyšetření zopakovat. Pokud je zjevné, že se sraženina rozpustila, lze kardioverzi provést. Po ní je třeba doživotně pokračovat v perorální antikoagulační léčbě. Je-li sraženina stále patrná, lze namísto kontroly srdečního rytmu zvolit strategii kontroly srdeční frekvence.
4.2. Kontrola srdečního rytmu
4.2.1. Kontrola rytmu vs kontrola frekvence
Kontrola srdeční frekvence je indikována jako terapie první volby u všech nemocných vyšetřovaných pro nově vzniklou fibrilaci síní, a to nejméně do doby, než můžeme provést kardioverzi, popř. tam, kde je kardioverze neúspěšná nebo nevhodná. Při déletrvající fibrilaci je racionálním postupem učinit alespoň 1 pokus o nastolení sinusového rytmu, 2. možností je akceptovat fibrilaci síní jako permanentní s důrazem na antitrombotickou léčbu a kontrolu frekvence. Rozhodnutí učinit pokus o nastolení sinusového rytmu by mělo být založeno na tíži symptomů, na přítomnosti strukturálního onemocnění a na potenciálním riziku antiarytmické léčby. I v případě strategie kontroly rytmu je zapotřebí v medikaci kontrolující frekvenci pokračovat do nastolení stabilního sinusového rytmu (jako prevence vysoké tepové frekvence v případě rekurentní fibrilace).
Kontrola frekvence je dle posledních studií (AFFIRM 2002 [45], RACE 2002 [46] a AF-CHF 2008 [47]) minimálně srovnatelný postup s kontrolou rytmu. Díky jejich vstupním kritériím (průměrný věk 70 let, nižší ejekční frakce levé komory jen u 25 % nemocných) ale nelze tyto závěry přenést na všechny pacienty. Zejména mladší pacienti, významně symptomatičtí pacienti či pacienti se srdečním selháním mají výrazný prospěch ze sinusového rytmu. Antiarytmika u nich však většinou sinusový rytmus neudrží a je nutná nefarmakologická léčba. Naopak pro starší (> 70 let) a minimálně symptomatické pacienty je léčbou volby kontrola frekvence. Iniciálně zvolená strategie se však může ukázat jako neúspěšná, a pak je nutné přejít na alternativní přístup.
4.2.2. Akutní kontrola rytmu – konverze na sinusový rytmus
Ataky paroxyzmální fibrilace síní často končí spontánně, až v 50 % se tak stane do 24 hod. Na druhé straně časná léčba má vyšší pravděpodobnost úspěšnosti a nižší pravděpodobnost embolické komplikace. Pro zvládnutí akutní arytmie je důležitá léčba základního onemocnění, např. srdečního selhávání, hypertyreózy, bronchopulmonální infekce, digitalisové intoxikace apod.
Konverze na sinusový rytmus lze dosáhnout použitím antiarytmik či elektrickým výbojem. Výběr metody záleží na posouzení výhod a nevýhod obou postupů. Elektrická kardioverze je účinnější a působí okamžitě, ale vyžaduje celkovou anestezii. U farmakoverze nelze predikovat čas verze, může se objevit proarytmický či negativně inotropní efekt antiarytmik.
Před provedením kardioverze je nutné dodržovat zásady prevence tromboembolie (viz kapitola 4.1.8.).
4.2.2.1. Elektrická kardioverze
Elektrokardioverze v krátkodobé celkové anestezii je nejefektivnější a nejbezpečnější způsob restituce sinusového rytmu.
Indikace k výkonu lze rozdělit na akutní a elektivní:
- akutní: u pacientů s fibrilací síní, kdy rychlou komorovou odpověď nelze promptně potlačit farmakologicky, což vede k hemodynamické destabilizaci, tj. srdečnímu selhání, myokardiální ischemii, symptomatické hypotenzi; u pacientů s fibrilací síní a preexcitací;
- elektivní: u pacientů s fibrilací síní jako součást léčby ke kontrole rytmu.
Před výkonem je třeba zkontrolovat, zda pacient splňuje předpoklady k výkonu: musí být nalačno, musí být provedeno fyzikální vyšetření, musí dát informovaný souhlas, musí u něj platit důkazy účinné antikoagulace (účinné INR), musí mít normální koncentraci iontů (kalium), musí být k dispozici monitorované lůžko s vybavením ke kardiopulmonální resuscitaci a intravenózní linka a krátkodobá celková anestezie by měla být vedena nejlépe anesteziologem. Elektrickou kardioverzi lze provést ambulantně, pacient by měl být monitorován minimálně 3 hod.
Při provádění elektrické kardioverze preferujeme bifázický výboj o energii 100–150 J (2. výboj 200 J) před výbojem monofázickým (energie 200 J, 2. výboj 360 J) [48]. Nutná je dostatečná příprava kůže, těsný kontakt ke snížení nitrohrudní impedance, synchronizace defibrilátoru s vlnou R. Optimální velikost elektrod pro dospělé je 8–12 cm v průměru. Anteroposteriorní umístění elektrod (vpravo parasternálně – pod levou lopatkou) je účinnější než pozice anterolaterální (vpravo parasternálně – střední axilární čára) [49]. Mezi jednotlivými výboji by měl být dodržen interval alespoň 3 min. U pacientů, jimž byl implantován kardiostimulátor či kardioverter-defibrilátor (ICD), by elektrody měly být nejméně 8 cm od baterie přístroje, u kterého by po kardioverzi měla být zkontrolována správnost funkce. Elektrickou kardioverzi lze provést i speciální intrakardiální elektrodou, výkon se však dnes již provádí jen výjimečně.
Výskyt komplikací v souvislosti s výkonem je nízký. Riziko tromboembolie u adekvátně antikoagulovaných pacientů je 0–1 % [50]. Časté je popálení kůže. Maligní komorové arytmie (fibrilace komor, komorová tachykardie) se mohou vyskytnout obzvlášť při intoxikaci digitalisem, hypokalemii či nesprávné synchronizaci výboje. Bradykardie bývají zejména u pacientů se sick sinus syndromem, se sinusovou zástavou po výboji i s event. absencí náhradního rytmu.
Okamžitá úspěšnost se pohybuje mezi 85 a 95 %. K faktorům, které úspěšnost ovlivňují, patří délka trvání fibrilace před kardioverzí, věk pacienta, velikost levé síně a její dysfunkce, chlopenní vady. Rozlišujeme rekurenci fibrilace síní okamžitou (minuty po kardioverzi), časnou (během 5 dnů po kardioverzi) a pozdní.
Vyšší úspěšnosti lze dosáhnout premedikací antiarytmicky [51,52]. Tato premedikace také snižuje výskyt časných recidiv arytmie po úspěšné kardioverzi. Vhodná jsou stejná antiarytmika, jaká jsou indikována k farmakologické verzi (propafenon, flecainid, amiodaron, sotalol). U pacientů se závažnějším strukturálním onemocněním srdce má z bezpečnostních důvodů přednost podání amiodaronu. Vzhledem k riziku vzniku maligních komorových arytmií je elektrická kardioverze kontraindikována při intoxikaci digitalisem. Pokud je sérová koncentrace digoxinu v terapeutickém rozmezí, není nutné před elektivní kardioverzí terapii přerušovat.
4.2.2.2. Farmakologická kardioverze
Výhodou farmakologické verze proti elektroverzi je odpadnutí problému s anestezií. Farmakologická kardioverze by měla být prováděna za hospitalizace a při EKG monitorování. Úspěšnost záleží na délce trvání fibrilace síní – u nově vzniklé se úspěšnost verze pohybuje okolo 70 %, u perzistující formy okolo 35 %. Antiarytmika třídy IC účinkují rychleji, ale neměla by být podávána v případě srdečního selhání či akutní ischemie. Výhodou antiarytmik III. třídy je možnost podání i při přítomnosti strukturálního onemocnění a při oběhové nestabilitě.
Nově lze k verzi fibrilace síní trvající méně než 7 dnů použít nový lék vernakalant, který selektivně zpomaluje vedení a prodlužuje repolarizaci v srdečních síních. Po intravenózní aplikaci má eliminační poločas kolem 2 hod; po jeho podání nebyly zaznamenány komorové proarytmické účinky. V publikovaných studiích dosáhl akutní konverze na sinusový rytmus v asi 50 % oproti placebu či amiodaronu, medián do konverze byl 12 min, s nízkým procentem rekurence a minimálními nežádoucími účinky (nejčastěji poruchy chuti) [53,54]. Studie s perorálním vernakalantem probíhají. Antiarytmika doporučená pro farmakoverzi ukazuje tab. 10.
Tab. 10. Účinná léčiva k farmakologické verzi fibrilace síní. 
4.2.2.3. Jednorázové použití antiarytmika při obtížích (pilulka v kapse, „pill-in-the-pocket“)
U výrazně symptomatických nemocných, a přitom relativně málo častých obtížích (několikrát ročně až 1krát měsíčně), lze zkusit podávání antiarytmik jen při obtížích. Byl popsán příznivý účinek jedné dávky propafenonu (300–600 mg, zpočátku je vhodná spíše nižší dávka) a flecainidu (200–300 mg). Pacienti by neměli mít výraznější strukturální onemocnění srdce. Je nutné ověřit bezpečnost léčiva nejprve podáním ve zdravotnickém zařízení za monitorace EKG. Parenterální podání není predikcí bezpečnosti následného perorálního podání. Protože jsou popsány následné bradykardie, měl by být vyloučen syndrom chorého sinu.
4.2.3. Dlouhodobá kontrola rytmu
Hlavní motivací antiarytmické kontroly rytmu je snížení symptomů. Úspěšnost antiarytmik v udržení sinusového rytmu je ale nízká a klinicky úspěšnou terapií může být jen redukce obtíží (eliminace dosáhneme jen vzácně). Proarytmické a extrakardiální nežádoucí účinky jsou časté a spíše než úspěšnost je třeba mít na zřeteli bezpečnost léčby. Před podáním jakéhokoli antiarytmika je třeba zjistit přítomnost kardiovaskulárního či jiného onemocnění, které může být podkladem vzniku arytmie. Pokud je to možné, má být vyvolávající příčina upravena nebo léčena. Po první zjištěné epizodě fibrilace síní není obvykle nutná preventivní léčba. Podobně není prevence nutná u ojedinělých, málo symptomatických atak fibrilace síní. U těchto nemocných je také možné jednorázové podání antiarytmika (nejčastěji propafenonu) v případě vzniku obtíží.
K prevenci častých a symptomatických atak fibrilace síní využíváme, podobně jako u farmakoverze, antiarytmika tříd IC a III (tab. 11). U tachyarytmií se spolupodílem aktivace sympatiku podáváme beta-blokátory. K udržení sinusového rytmu u osob bez organického srdečního onemocnění je využíván propafenon, sotalol, nověji i dronedaron. U nemocných s dysfunkcí levé komory a při organickém srdečním onemocnění (zvláště ischemické chorobě srdeční) má své výhody používání amiodaronu. Antiarytmickou terapii k udržení sinusového rytmu u různých základních onemocnění ukazuje obr. 1. Amiodaron redukuje frekvenci recidiv fibrilace síní významněji než propafenon, sotalol a dronedaron, ale i tak se po 1. roce sledování daří udržet sinusový rytmus u maximálně 60 % nemocných a po 4 letech sledování u 30 % nemocných.
Tab. 11. Účinná léčiva k udržení sinusového rytmu. 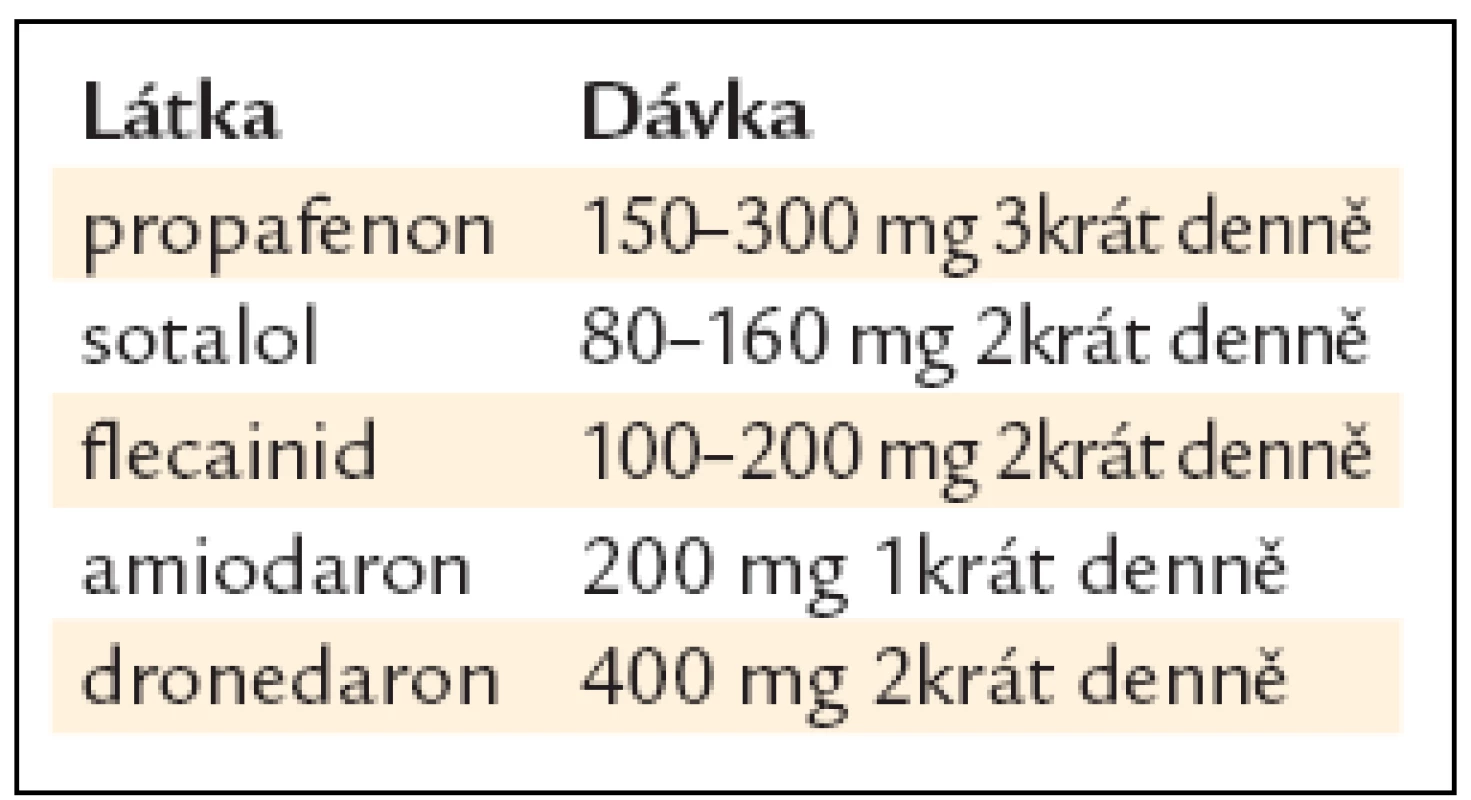
Obr. 1. Antiarytmická léčba k udržení sinusového rytmu u různých základních onemocnění. SOS – strukturální onemocnění srdce, AH – arteriální hypertenze, ICHS – ischemická choroba srdeční, SS – srdeční selhání, HLK – hypertrofie levé komory srdeční > 14 mm. *u vybraných nemocných, po zvážení alternativních způsobů léčby 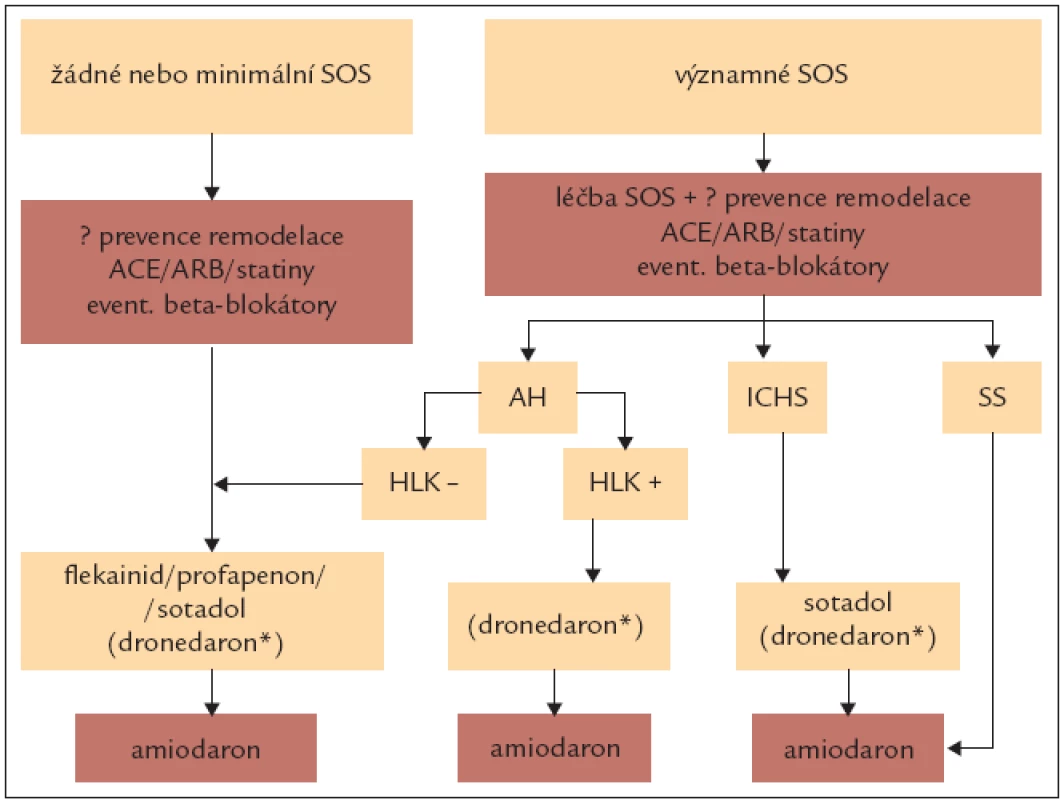
4.2.3.1. Nová antiarytmika
Na náš trh nově uvedený dronedaron (analog amiodaronu bez jodové skupiny) má dobrý bezpečnostní profil, jeho efektivita však nedosahuje amiodaronu a spíše se pohybuje na úrovni propafenonu a sotalolu. Byl testován v řadě klinických studií (tab. 12) a jako první antiarytmikum ve studii ATHENA [53] redukoval jako primární výsledný ukazatel i mortalitu a hospitalizace z kardiovaskulárních příčin. V následné analýze studie byl v dronedaronové větvi prokázán i pokles rizika vzniku mozkové příhody (o 34 %, za standardní antitrombotické léčby) [54].
Tab. 12. Klinické studie s dronedaronem. 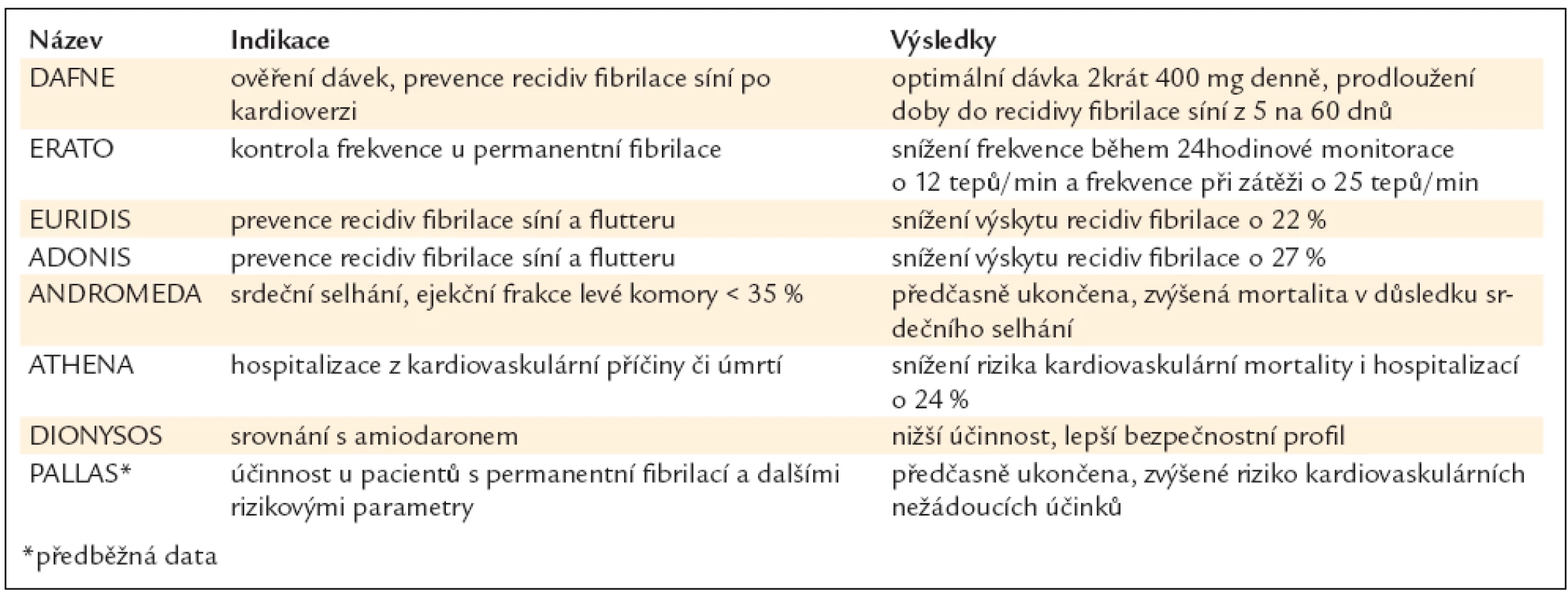
Nejčastější nežádoucí účinek léčby dronedaronem představují gastrointestinální problémy (průjem, nauzea, zvracení). Vzácně byla popsána plicní toxicita a případy akutního jaterního selhání vyžadující transplantaci.
Na základě provedených studií (hlavně studie ATHENA) byl dronedaron schválen americkou i evropskou lékovou agenturou k léčbě nepermanentní fibrilace síní u nemocných s ejekční frakcí levé komory > 35 % a v doporučeních Evropské kardiologické společnosti (ESC) pro léčbu fibrilací síní [2] získal dronedaron díky vynikajícímu bezpečnostnímu profilu dominantní postavení v jejich antiarytmické terapii (lék první volby, mimo nemocné s těžkým srdečním selháním).
Po úspěchu ve studii ATHENA byla zahájena i studie PALLAS [56], a to u pacientů s permanentní fibrilací a kardiovaskulárními rizikovými parametry. Tato studie byla však v červenci roku 2011 předčasně ukončena kvůli signifikantnímu nárůstu kardiovaskulárních příhod jak ve složených primárních ukazatelích (závažné kardiovaskulární příhody a kardiovaskulární hospitalizace nebo úmrtí), tak i ve výskytu srdečního selhání, mozkové příhody a kardiovaskulární hospitalizace.
Přínosy a rizika podávání dronedaronu byly v září roku 2011 Evropskou lékovou agenturou přehodnoceny a použití dronedaronu bylo omezeno na nemocné s paroxyzmální nebo perzistentní (po úspěšné kardioverzi) fibrilací síní, navíc po zvážení alternativních možností léčby (obr. 1). Nesmí být podáván nemocným se srdečním selháním či systolickou dysfunkcí levé komory, s permanentní fibrilací (trvající ≥ 6 měsíců) a u pacientů s projevy jaterní nebo plicní toxicity v souvislosti s event. dřívějším podáváním amiodaronu. Doporučuje se monitorovat stav pacienta, při recidivě fibrilací je doporučeno zvážit přerušení terapie. Je pravděpodobné, že po podrobnějších analýzách uvedených studií bude indikace k podávání dronedaronu dále upřesněna.
4.2.3.2. Volba antiarytmika
Volba léku je také závislá na riziku proarytmického vlivu a nežádoucích účinků antiarytmik (tab. 13). Závažný proarytmický vliv je vzácný u pacientů s normální funkcí komor, bez bradykardie a prodloužení intervalu QT. U antiarytmik třídy IA a III (hlavně sotalolu) je možné prodloužení intervalu QT se vznikem komorových arytmií typu torsade de pointes. Délka intervalu QTc by při léčbě těmito léky neměla překročit 500 ms. U antiarytmik třídy IC by prodloužení intervalu QRS nemělo přesáhnout 25 %. Při podávání antiarytmik I. třídy by mělo být zváženo současné podávání beta-blokátorů k prevenci rychlého atrioventrikulárního vedení při vzniku flutteru síní. Ve všech případech je nutné sledovat nežádoucí účinky léčby a pravidelně monitorovat hladiny minerálů a renální funkce (renální insuficience vede k akumulaci léku a predisponuje k proarytmii), v případě léčby amiodaronem také funkci štítné žlázy (po 3–6 měsících). Vzhledem k nově popsaným možným rizikům dronedaronu je doporučeno monitorovat srdeční, jaterní a plicní funkce. Jaterní testy (ALT) je vhodné provádět před nasazením dronedaronu a po něm a dále po měsíci, po 1/2 roce užívání každé 3 měsíce.
Tab. 13. Antiarytmika ke kontrole srdečního rytmu a jejich možné vedlejší účinky. 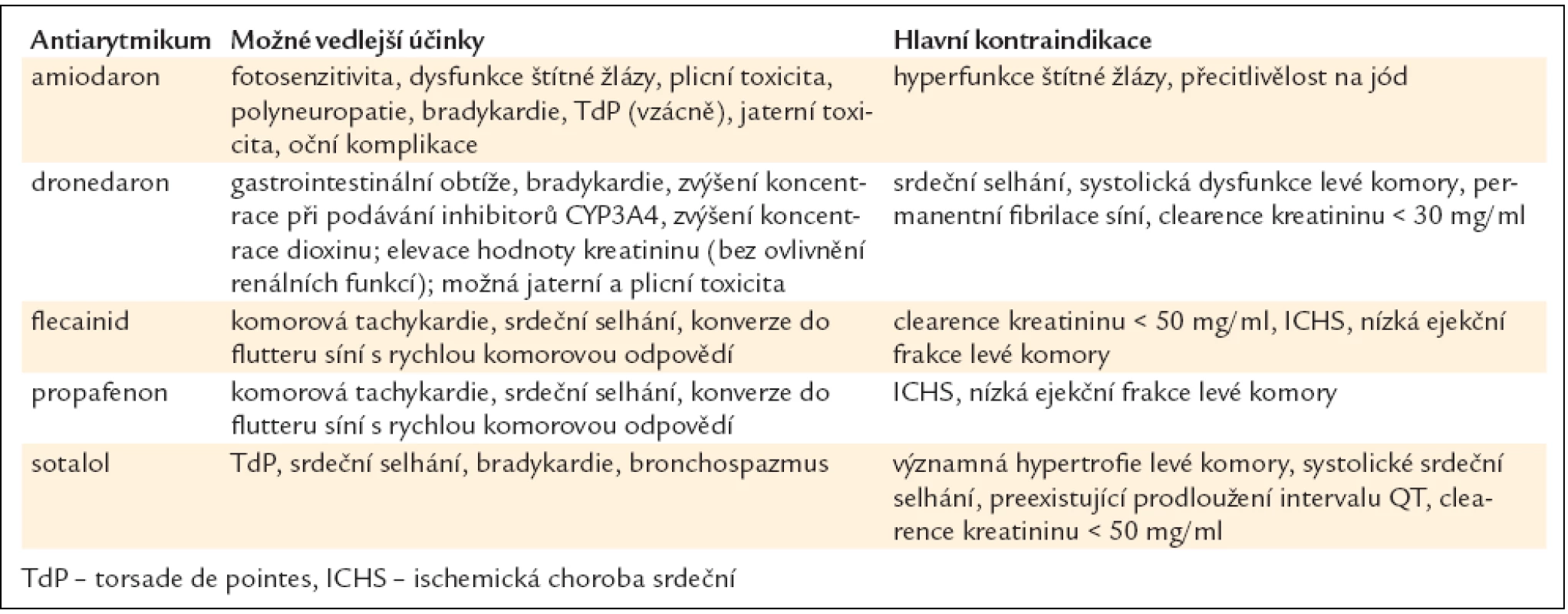
4.3. Kontrola frekvence
4.3.1. Akutní kontrola srdeční frekvence
Rychlá frekvence komor při fibrilaci síní může být příčinou obtíží či hemodynamické závažnosti arytmie. V těchto případech je vhodné rychlé zpomalení srdeční frekvence podáním bradykardizující medikace. V méně závažných případech lze podat beta-blokátory nebo verapamil perorálně a zpomalit srdeční frekvenci během několika hodin. Při výraznějších obtížích je vhodná intravenózní léčba. Cílem akutního zpomalení je obvykle dosažení klidové frekvence 80–100/min. Záleží na výchozí frekvenci, některým pacientům stačí i mírnější zpomalení, jiní zůstávají symptomatičtí i při popsaných hodnotách.
Při pravidelné akci komor a podezření na flutter síní s akcí komor 2 : 1 lze ke krátkodobému zpomalení podat adenosin (12–18 mg i.v. jako rychlý bolus). Dojde k rychlému zpomalení až zablokování atrioventrikulárního převodu na několik sekund, po tuto dobu jsou síňové vlny na záznamu EKG lépe patrné (tzv. „demaskování flutteru“). Ověření diagnózy je důležité před event. indikací nefarmakologické léčby (katetrizační ablace).
Pokud je naopak frekvence komor při fibrilaci síní příliš pomalá a pacient je symptomatický, lze dočasně podat atropin (0,5–2 mg i.v.). Za klidových podmínek však pacienti pomalejší akci většinou tolerují. Pří výrazné bradykardii, ať už se jedná o fibrilaci síní s pomalou akcí komor, či úplnou AV blokádou s náhradním junkčním rytmem, bývá pak nutné zavedení dočasné komorové kardiostimulace.
Intravenózní kontrola frekvence je vhodná, pokud neindikujeme kardioverzi či medikamentózní verzi. Důvodem může být nevhodnost kardioverze zapříčiněná chybějící nebo nedostatečnou předchozí antikoagulační léčbou při nejasném trvání fibrilace síní či trvání nad 48 hod. Lze také kombinovat nejprve zpomalení komorové frekvence a následné provedení kardioverze. Je pak třeba mít na paměti případné nežádoucí účinky kombinované antiarytmické medikace.
4.3.2. Dlouhodobá kontrola srdeční frekvence
4.3.2.1. Intenzita kontroly srdeční frekvence
Základem léčby fibrilace síní je kontrola frekvence spolu s prevencí tromboembolických příhod. Kontrolou frekvence léčbu začínáme. Používáme ji však i při kontrole rytmu, aby při recidivách fibrilací nebyla frekvence komor vysoká. Pokud pacient zůstává symptomatický i při méně intenzivní kontrole rytmu, máme zvážit kontrolu frekvence.
Stále není jasné, jaká frekvence komor by při fibrilaci síní měla být ta správná. Podle starších verzí guidelines byla doporučována klidová srdeční frekvence 60–80/min a při mírné zátěži 90–115/min [1,44]. Tato doporučení však byla jen arbitrární a neopírala se o závěry ze studií. Nebylo také jasné, zda se máme řídit jen hodnotami zjištěnými na jednorázové křivce EKG, nebo zda máme dosažení frekvence ověřovat holterovskou monitorací EKG či ergometrií. Data ze studií porovnávajících kontrolu rytmu a kontrolu frekvence neprokázaly jasně, že by intenzivnější kontrola frekvence byla spojena s nižší morbiditou. Studie RACE II [57] porovnávala intenzivní kontrolu frekvence (strict control) s cílem dosáhnout klidové frekvence < 80/min a mírnější kontrolu frekvence (lenient control), kde byla cílovou metou frekvence < 110/min. Primární kombinovaný výsledný ukazatel (úmrtí z kardiovaskulární příčiny, hospitalizace pro srdeční selhání, CMP, systémová embolizace, krvácení, život ohrožující arytmie) se při obou postupech významně nelišil (3letý výskyt 12,9 % při méně intenzivní vs 14,9 % při intenzivní kontrole). Dosažení intenzivní kontroly však bylo podstatně obtížnější a vyžadovalo daleko častější kontroly.
Na základě těchto nálezů evropská guidelines doporučují jako výchozí postup dosažení klidové frekvence < 110/min. Pokud obtíže nemocného přetrvávají, zejména s líčením stále rychlé akce, je vhodná intenzivnější kontrola. Ta je indikována také v případě, kdy dochází ke zhoršování funkce levé komory s možným podílem rychlé akce komor při fibrilaci síní. Při intenzivní kontrole frekvence je vhodné sledovat efekt léčby pomocí holterovské monitorace EKG, při trvajících obtížích během zátěže pak pomocí ergometrie.
V amerických dodatcích k doporučením [3] se uvádí, že výsledky studie RACE II u pouhých 614 pacientů s dosažením 81 příhod nemohou být dostatečné pro definitivní rozhodnutí. Na základě všech zatím dostupných dat se ukazuje, že dosažení hodnot klidové frekvence < 110/min není horším postupem než dosažení hodnot < 80/min. Hranice 110/min a 80/min je však poměrně široká. Existují případy vzniku dysfunkce levé komory i při srdečních frekvencích kolem 110/min. U pacientů, kteří na medikaci dobře reagují, je možné se snažit o dosažení frekvence mezi oběma hodnotami, spíše < 100/min.
4.3.2.2. Farmakologická kontrola frekvence
Pro kontrolu srdeční frekvence se využívají bradykardizující blokátory kalciových kanálů (verapamil, diltiazem), beta-blokátory, digoxin a při srdečním selhání také amiodaron. Nověji je možné využít i dronedaron, který však dosud není vhodný pro permanentní fibrilaci síní. Výběr konkrétního preparátu a formy jeho aplikace záleží hlavně na formě fibrilace, naléhavosti snížení frekvence, komorbiditách a přítomnosti strukturálního srdečního onemocnění (tab. 14). U paroxyzmální fibrilace síní lze využít antiarytmika, která umožňují kontrolu rytmu i frekvence (sotalol, dronedaron, amiodaron). U málo aktivních pacientů lze léčbu zahájit digoxinem. Ten však nekontroluje frekvenci při zátěži. Amiodaron je pro četné nežádoucí účinky možné použít ke kontrole frekvence jen u pacientů, u kterých není dostatečná jiná léčba. U permanentní fibrilace síní a selhání medikace digoxinu s beta-blokátory je třeba zvážit kontrolu frekvence nefarmakologickou [1].
Tab. 14. Antiarytmika ke kontrole srdeční frekvence při fibrilaci síní. 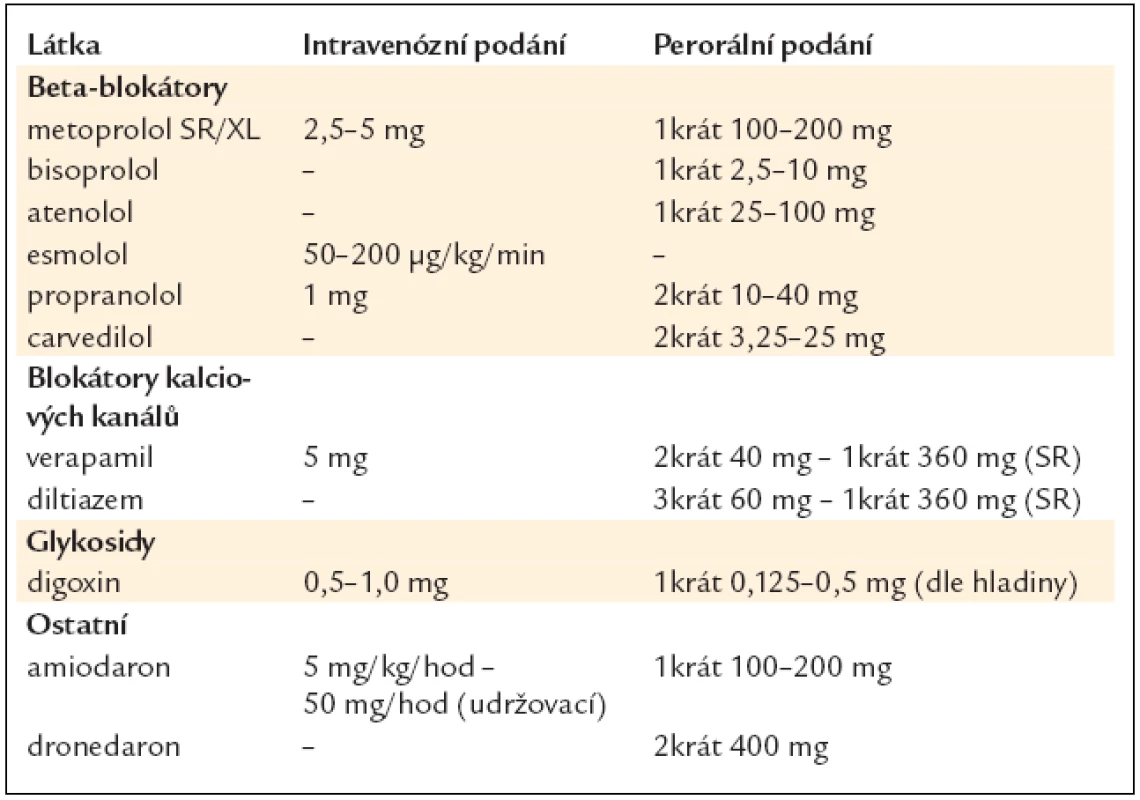
U části pacientů je frekvence komor při fibrilaci síní nevyrovnaná a střídá se rychlá a pomalá akce. V těchto případech bývá nezbytné doplnit antiarytmickou medikaci zavedením kardiostimulátoru. Pokud nedosáhneme účinné kontroly frekvence ani při kombinované léčbě, je zapotřebí zvážit nefarmakologickou léčbu (neselektivní katetrizační ablace AV junkce s následnou implantací kardiostimulátoru). Střídání rychlé a pomalé akce při fibrilaci síní je třeba odlišit od paroxyzmální formy fibrilace síní s rychlou akcí komor a pauzami po verzi na sinusový rytmus („posttachykardickými pauzami“). Zde je možné před implantací kardiostimulátoru zvážit selektivní katetrizační ablaci fibrilace síní.
4.4. Upstream léčba
4.4.1. Teoretické předpoklady
Ke vzniku fibrilace síní vede celá řada onemocnění a stavů, které jsou spojeny s tzv. remodelací síní, tedy jejich dilatací, strukturální přestavbou a změnou elektrofyziologických vlastností. Sama fibrilace tyto změny dále udržuje a prohlubuje. Terapie zaměřená na vyvolávající onemocnění a prevenci vzniku remodelačních změn se nazývá „upstream“léčba. Její primárně preventivní použití může zabránit vzniku fibrilace síní, sekundární prevencí pak rozumíme použití této léčby u pacientů s již dokumentovanou arytmií, cílem je předejít dalším recidivám fibrilace síní.
4.4.2. Inhibitory ACE a blokátory receptorů AT1 pro angiotenzin II
Nejvíce údajů je zatím pro přípravky zasahující do systému renin-angiotenzin-aldosteron, tedy inhibitory angiotenzin-konvertujícího enzymu (ACE-I) a blokátory receptorů AT1 pro angiotenzin II [58]. Jejich mechanizmem účinku je hlavně omezení vlivu angiotenzinu. Ten vede ke vzniku fibrózy, hypertrofie, poruše mezibuněčného spojení, chybné funkci iontových kanálů a také k progresi zánětlivých změn.
Studie u pacientů se srdečním selháním ukazují, že podávání inhibitorů ACE a blokátorů receptorů AT1 pro angiotenzin II vede ke snížení výskytu nově diagnostikované fibrilace síní až o 30–48 % [58]. Také u hypertenze tyto přípravky vedou k poklesu výskytu fibrilace síní o 25 %. Ve studii LIFE snížil losartan výskyt fibrilace síní více než atenolol. Mechanizmem účinku tedy není pravděpodobně jen kontrola tlaku. V sekundární prevenci není vliv inhibitorů ACE a blokátorů receptorů AT1 pro angiotenzin II tak jasný [59]. V několika malých studiích došlo ke snížení výskytu fibrilace síní. Tyto studie také naznačují synergistický účinek antiarytmik (např. amiodaronu) a blokátorů receptorů AT1 pro angiotenzin II. Významné snížení recidiv fibrilací síní ukazují také metaanalýzy studií. V prospektivních studiích se však pozitivní efekt nepotvrdil, ať už šlo konkrétně o hodnocení výskytu FS (studie GISSI AF, ANTIPAF) [59], nebo kardiovaskulárních příhod při FS (studie ACTIVE-I s irbesartanem) [60]. Vysvětlením je možné pozdní zahájení léčby u již vyjádřených remodelačních změn, kdy je k případnému účinku třeba delší doby, než byla doba sledování ve studiích.
Lze tedy shrnout, že časnou léčbou srdečního selhávání a hypertenze pomocí inhibitorů ACE a blokátory receptorů AT1 pro angiotenzin II lze výskyt fibrilací síní snížit. Uvedené přípravky jsou však v léčbě srdečního selhávání a hypertenze stejně indikovány. U pacientů bez strukturálního onemocnění srdce a také v sekundární prevenci FS jsou data méně průkazná.
4.4.3. Statiny
Mechanizmem působení je v tomto případě ovlivnění zánětlivých změn v myokardu, účinek je však patrně komplexní. Několik studií prokázalo příznivý vliv statinů na postoperační fibrilace síní. V ostatních případech existují jen malé studie nebo jejich metaanalýzy. Ty prokazují snížení výskytu FS, zejména u pacientů se srdečním selháním, částečně také u hypertenze a ischemické choroby srdeční. V těchto případech a u postoperační fibrilace síní lze preventivní použití statinů zvážit [61]. Upstream léčba s využitím inhibitorů ACE, blokátorů receptorů AT1 pro angiotenzin II či statinů není indikována v primární prevenci fibrilací síní u pacientů bez kardiovaskulárního onemocnění.
4.4.4. Ostatní látky v upstream léčbě
Studován byl rovněž vliv různých protizánětlivých léčiv, kortikosteroidů, vícenenasycených mastných kyselin a dalších látek, ovlivnění fibrilace síní však není konzistentněji prokázáno. Použití těchto látek v upstream léčbě fibrilace síní proto není indikováno [2].
Beta-blokátory se používají v léčbě hypertenze, srdečního selhání i ischemické choroby srdeční. Ovlivněním těchto onemocnění mohou snížit výskyt fibrilace síní, jsou také vhodné ke kontrole srdeční frekvence.
5. Nefarmakologická léčba pro fibrilací síní
K nefarmakologické léčbě samozřejmě patří i elektrokardioverze. Vzhledem k běžnému užívání byla uvedena společně s farmakoterapií. Dále jsou uvedeny postupy používané ve více či méně specializovaných centrech.
5.1. Kardiostimulace
U pacientů po neselektivní ablaci AV junkce dochází ke vzniku atrioventrikulární blokády. Potom je nutné zajištění akce komor stimulací. Při chronické fibrilaci síní je indikována stimulace VVI(R), u paroxyzmální formy pak stimulace DDD(R,P) [62,63]. V posledním případě se však často během několika let arytmie stává chronickou, což se vysvětluje nepříznivým vlivem stimulace komor na udržení sinusového rytmu. U pacientů s dysfunkcí levé komory je vhodné zvážit implantaci kardiostimulátoru nebo kardioverteru-defibrilátoru s možností resynchronizace funkce levé komory [64].
Implantace kardiostimulátoru je indikována rovněž při symptomatické fibrilaci síní s pomalou či nevyrovnanou akcí komor nebo při vzniku atrioventrikulární blokády z jiných příčin než při ablaci (podrobně viz doporučení pro implantace kardiostimulátorů – [44]). Při vagově podmíněné arytmii lze před kardiostimulací zkusit disopyramid. U pacientů se sick sinus syndromem, indikovaných k implantaci kardiostimulátoru, je vhodnější fyziologická stimulace (DDD/R či AAI/R), protože při komorové stimulaci (VVI/R) se fibrilace síní vyskytují častěji nebo dochází k progresi paroxyzmální formy do perzistující [62].
Kromě klasických způsobů stimulace se zkoušely novější způsoby, a to odlišná místa a odlišné algoritmy stimulace. V prvním případě lze ke zlepšení synchronizace aktivace síní použít 2 elektrody. Ty se zavádějí do pravé síně a k ostiu koronárního sinu, případně až do jeho větví, a to tak, aby bylo možné stimulovat také levou síň (tzv. biatriální stimulace). Pokud použijeme jen jednu elektrodu, lze synchronizaci síní zlepšit jejím zavedením do oblasti mezisíňového septa.
Z holterovských monitorací EKG se ukázalo, že vzniku fibrilace síní velmi často předchází zvýšená síňová ektopická aktivita či bradyarytmie. K potlačení těchto spouštěcích faktorů se používají specifické preventivní stimulační režimy. U některých přístrojů mohou být preventivní režimy doplněny o režimy terapeutické. Ty mají za cíl rychlou „overpace“ stimulací fibrilaci ukončit. To je možné za předpokladu zpomalení a stabilizace fibrilace síní v určitých fázích jejího průběhu, případně při střídání fibrilace s flutterem síní či síňovými tachykardiemi. Účinek uvedené léčby je možné ověřit opět holterovskými funkcemi přístroje, které evidují počet, trvání a distribuci atak arytmie.
I když některé studie prokázaly při použití stimulace s novými algoritmy snížení výskytu či zátěže („burden“) fibrilací, účinek preventivních režimů je celkově pouze malý. Uvedené postupy lze použít v případech indikace kardiostimulátoru z bradykardických příčin. Pro implantaci kardiostimulace jen z důvodů prevence fibrilací síní zatím chybějí dostatečná data.
5.2. Implantabilní síňové kardiovertery-defibrilátory
Úkolem síňových defibrilátorů byla detekce fibrilace síní a její verze nízkoenergetickým výbojem. Úspěšnost výbojů byla vysoká (90–95 %), ale i nízké energie kolem 1–3 J jsou vnímány bolestivě. Z těchto důvodů se (kromě ekonomické náročnosti) síňové defibrilátory nikdy nedočkaly většího rozšíření.
5.3. Katetrizační ablace AV uzlu a kardiostimulace
Katetrizační ablaci lze provést jako paliativní léčebnou metodu (ablaci AV uzlu spojenou s trvalou kardiostimulací) nebo kurativní metodu (selektivní ablaci fibrilace síní).
5.3.1. Principy výkonu, klinický přínos
Ablace AV uzlu s následnou kardiostimulací je paliativní metodou ke kontrole frekvence komor. Spočívá v přerušení vedení elektrického vzruchu ze síní na komory, jejichž rytmus je následně řízen kardiostimulátorem. Fibrilace síní zůstává nedotčena. Poškození AV převodu a závislost na kardiostimulátoru jsou nevratné. Účinnost ablace AV uzlu se blíží 100 %. Tzv. modifikace AV převodu v oblasti tzv. pomalé dráhy s cílem snížení frekvence komor při fibrilaci síní bez nutnosti implantace kardiostimulátoru je v současné době pro svou nespolehlivost opouštěna.
Při srovnání ablace AV uzlu proti antiarytmické léčbě bylo pozorováno symptomatické zlepšení [65,66] a zlepšení kvality života [66,67], ale žádná studie neprokázala nebo nehodnotila zlepšení přežívání, snížení výskytu cévní mozkové příhody, počtu hospitalizací nebo zlepšení funkční třídy, funkční kapacity a ani zlepšení ejekční frakce levé komory.
Při srovnání ablace AV uzlu s biventrikulární stimulací proti antiarytmické léčbě bylo pozorováno signifikantní zlepšení ejekční frakce levé komory pouze po ablaci [68]. Jiná studie ukázala, že při resynchronizační léčbě je mortalita pacientů s fibrilací síní stejná jako u pacientů se sinusovým rytmem [69]. Při srovnání ablace AV uzlu s pravokomorovou stimulací proti ablaci AV uzlu s biventrikulární stimulací byla sice zjištěna nadřazenost biventrikulární stimulace, ale nikoli zásadní absolutní zlepšení ejekční frakce levé komory [70–72]. V jedné studii resynchronizační léčba dokonce pouze zabránila zhoršení ejekční frakce levé komory, které bylo zaznamenáno při stimulaci pravé komory [73].
Při přímém srovnání selektivní ablace a ablace AV uzlu s biventrikulární stimulací celkem u 81 pacientů se srdečním selháním a fibrilací síní rezistentní na antiarytmika se za 6 měsíců po selektivní ablaci udržoval sinusový rytmus u 81 % pacientů (71 % pacientů bez antiarytmik), zatímco po ablaci AV uzlu nejenže fibrilace síní pokračovala u všech pacientů, ale většina jejich paroxyzmálních forem přešla ve formu perzistentní. Ejekční frakce levé komory se po selektivní ablaci zlepšila, zatímco po ablaci AV junkce s biventrikulární stimulací se zhoršila (rozdíl p < 0,001). U pacientů po selektivní ablaci se zlepšila i funkční kapacita a kvalita života [74].
5.3.2. Indikace ablace AV uzlu
Ablace AV uzlu vede k nevratnému poškození atrioventrikulárního převodu a závislosti na kardiostimulaci. Proto je třeba tuto indikaci důkladně zvážit. Kromě pacientů s fibrilací síní a rychlou frekvencí komor a již zavedenou biventrikulární stimulací by se měla ablace AV uzlu zvážit jen u symptomatických pacientů rezistentních na farmakologickou kontrolu rytmu či frekvence komor, u nichž nelze předpokládat užitek ze selektivní ablace, respektive proveditelnost selektivní ablace bez zvýšené zátěže a rizik, nebo kde tato léčba selhala nebo byla odmítnuta. Stratifikaci pacientů k ablaci AV junkce a implantaci kardiostimulátoru v těchto případech můžeme do značné míry považovat za doplněk primární stratifikace k selektivní ablaci.
Indikace k ablaci AV uzlu lze doporučit u symptomatických pacientů s farmakologicky nekontrolovatelnou rychlou frekvencí komor, kteří:
- již mají implantovaný biventrikulární stimulační systém a u nichž pro rychlý/nepravidelný převod na komory nelze dosáhnout převládající komorové stimulace;
- mají závažné primární strukturální postižení srdce s preexistující systolickou dysfunkcí levé komory bez vyhlídky na její úpravu i při konverzi na sinusový rytmus (současně je po ablaci obvykle indikována biventrikulární stimulace);
- jsou polymorbidní se závažnými mimosrdečními nemocemi a stavy;
- jsou starší 75–80 let (individuálně lze zvážit selektivní ablaci).
Ablace AV junkce není indikována u mladších pacientů s arytmií indukovanou/zhoršenou systolickou dysfunkcí levé komory (systolická dysfunkce se rozvinula až se vznikem fibrilace síní, její závažnost se v čase mění v závislosti na střídání sinusového rytmu a fibrilací síní apod.). U těchto pacientů se má primárně zvážit selektivní ablace, která může vést k uzdravení ad integrum.
5.4. Selektivní ablace pro fibrilaci síní
5.4.1. Princip účinku
Základem ablační strategie je izolace plicních žil, jejímž cílem je trvalé přerušení výstupu ektopické aktivity z plicních žil na volnou stěnu levé síně [75]. Ektopická aktivita z volné stěny síní se mapuje a eliminuje cíleně [76]. Vzácnější ektopická aktivita z koronárního sinu nebo Marshallova ligamenta může být řešena izolací koronárního sinu, aktivita z horní duté žíly její izolací [77–79]. Lokalizované reentry okruhy mohou být při běžící fibrilaci síní odstraněny tzv. na elektrogramu založenou ablací (cílenou na místa s frakcionovanou aktivitou, nejrychlejší aktivitou nebo lokálním aktivačním gradientem) [80], respektive cílenou ablací po organizaci do síňové tachykardie [81]. Velké makro-reentry okruhy se přerušují lineárními lézemi [82]. Jako přínosná se považuje současná ablace nervových ganglií a plexů, lokalizovaných blízko plicních žil, takže je často automaticky součástí obkružujících ablačních lézí [83].
5.4.2. Provedení výkonu a technologie
K ablaci se používají různé mapovací i ablační technologie. Přístup do levé srdeční síně se zjednává transseptálně. Ablace se nejčastěji provádí řiditelným katetrem pro mapování a aplikaci radiofrekvenční energie bod po bodu. Kromě aplikace energie bod po bodu se používají i cirkulární nebo polocirkulární katetry, umožňující aplikaci najednou kolem ústí plicní žíly. Dále se v praxi uplatňují balónové katetry s využitím mražení nebo laseru nebo cirkulární/síťové katetry s použitím radiofrekvenční energie s cílem dosáhnout izolace plicních žil jednou nebo několika málo aplikacemi ablační energie. Ablace bod po bodu je použitelná na všechny zdroje. Balónové a cirkulární katetry narážejí na anatomickou různorodost plicních žil, doposud nepřekonaly účinnost izolace plicních žil metodou bod po bodu a nelze je použít na zdroje fibrilace síní mimo plicní žíly. Ablace fibrilace síní lze provést s prostou skiaskopickou navigací nebo pomocí 3D mapovacích systémů, jejichž obrazy lze integrovat s 3D obrazy síní získanými z CT, MR, případně rotační angiografie. Provedení ablace může být facilitováno použitím intrakardiálního ultrazvuku. Katetr může být naváděn přímo rukou operatéra nebo pomocí dálkové navigace magnetickým polem nebo robotickou rukou s řiditelným pouzdrem na katetry.
5.4.3. Cílové momenty ablačního výkonu
Zatím neexistují technologie spolehlivě zobrazující vznik myokardiální léze v průběhu ablace. Individuální léze se v praxi hodnotí podle redukce nebo vymizení lokálního elektrického potenciálu. Izolace plicních žil se nejpřesněji hodnotí jejich mapováním uvnitř ústí plicních žil pomocí cirkulárního katetru [84]. Někteří autoři je nahrazují mapováním voltážovým [85]. Úplná izolace koronárního sinu se hodnotí multipolárním katetrem. Lineární léze přerušující velké makro-reentry okruhy (léze ve stropě levé síně, na laterálním mitrálním isthmu, respektive na kavo-trikuspidálním isthmu) se hodnotí podle změny aktivace síní a tzv. di-ferenční stimulace [82]. Dalšími cílovými momenty celého výkonu může být ukončení fibrilace síní a obnovení sinusového rytmu (zvláště u perzistentní formy fibrilace síní FS) [81,86] nebo dosažení nevyvolatelnosti arytmie rychlou stimulací síní, izoprenalinem nebo adenosinem.
5.4.4. Dlouhodobé udržení sinusového rytmu
Klinická účinnost ablace fibrilací síní je příznivá. Většina recidiv se projeví v průběhu prvních týdnů až měsíců, často v souvislosti s pozdějším vysazením antiarytmik. Pozdní recidivy jsou méně časté [87]. Je přirozený rozdíl mezi vysokou účinností referovanou renomovanými centry (> 90 %) a běžnou klinickou praxí [88]. Podle celosvětového registru je celková klinická úspěšnost ablace paroxyzmální, perzistentní a dlouhodobé perzistentní fibrilace síní 84 %, 75 %, a 71 %, respektive bez užívání antiarytmik 75 %, 65 % a 63 % [88]. Ačkoli je úspěšnost ablace perzistentní FS nižší, centra, která uplatňují komplexní ablační strategie, referují o úspěšnosti srovnatelné s ablací paroxyzmální FS. K takovému výsledku je nutná rozsáhlejší ablační strategie a častější opakované ablace pro reziduální zdroje fibrilací síní.
Příčinou recidiv fibrilace síní nebo síňové tachykardie je nedokončení izolace nebo zotavení izolační linie kolem arytmogenní plicní žíly, neodstranění//zotavení lokalizovaného zdroje mimo plicní žíly, nepřerušení/zotavení aktivního reentry okruhu, resp. vznik nového aktivního reentry okruhu nedokonalou ablační lézí (proarytmický efekt), a snad i přirozená progrese substrátu. Všechny zdroje časných nebo pozdních recidiv lze odstranit opakovanou ablací.
5.4.5. Klinický přínos ablace fibrilace síní
Účinnost ablace při udržení sinusového rytmu je signifikantně vyšší než při léčbě antiarytmiky [89–92]. Kvalita života se po ablaci fibrilace síní zvyšuje a její zlepšení je signifikantně vyšší než při léčbě antiarytmiky [91,92]. Toto zlepšení se jeví stabilní i dlouhodobě v závislosti na udržení sinusového rytmu [93]. Kvalita života se zlepšuje po úspěšné ablaci paroxyzmální i perzistentní fibrilace síní [94].
Velikost síní se po ablaci konzistentně zmenšuje v důsledku jizvení i reverzní remodelace. Na rozdíl od některých chirurgických ablací dochází po katetrizační ablaci k zachování nebo zlepšení funkce levé síně, a to i při použití extenzivní ablace [95].
Ablace fibrilace síní u pacientů se systolickou dysfunkcí je konzistentně spojena s jejím zlepšením nebo úplnou úpravou. Systolická dysfunkce se upravuje nejen u pacientů s rychlou, ale i tzv. přiměřenou frekvencí komor [96].
Některé recentní studie ukazují redukci incidence tromboembolických příhod po ablaci i po vysazení antikoagulace u většiny pacientů na méně než 0,5 %/rok, tedy na úroveň populace bez fibrilace síní [97–99]. Interpretace těchto výsledků musí být opatrná, neboť ablaci podstupují pacienti se všeobecně nižším než průměrným přirozeným rizikem tromboembolie. Jedna nedávná studie ukazuje, že pacienti léčení ablací mají dlouhodobě podobný stejný výskyt úmrtí, cévní mozkové příhody a demence jako pacienti bez fibrilace síní [100]. Zatím neexistují přímá data o vlivu ablace fibrilace síní na mortalitu. Výsledky prvních studií odpovídajících na tuto otázku lze očekávat nejdříve v roce 2015.
5.4.6. Komplikace výkonu
Komplikace výkonu se vyskytují asi v 5 %. Většinou jde o lokální cévní komplikace v místě vpichu. Jsou shrnuty v recentním celosvětovém registru [88]. Nejčastější závažnou komplikací je srdeční tamponáda a embolická cévní mozková příhoda nebo tranzitorní ischemická ataka (v naprosté většině s frustním průběhem bez rezidua), incidence obou je kolem 1,2 %. Nejzávažnější komplikací, jejíž průběh je většinou fatální, je vznik atrio-ezofageální píštěle. Její riziko je podle registru 0,04 %. Komplikace se projevuje v odstupu několika dnů po ablaci a začíná septickým stavem. Dříve častější stenózu plicních žil lze v současné době při použití širších periantrálních (místo ostiálních) lézí prakticky vyloučit. Paréza bráničního nervu se může vyskytnout zvláště při balónkové ablaci, konkrétně pravostranných plicních žil, naštěstí je většinou přechodná. Mortalita v souvislosti s ablací fibrilace síní je výrazně < 0,1 %. Za komplikaci ablace pro fibrilace síní se někdy považuje i vznik nových síňových tachykardií, které vyžadují další ablaci. Bez ohledu na jejich mechanizmus a příčinu (proarytmický účinek nebo odkrytí preexistujícího reziduálního zdroje) lze na tyto síňové tachykardie, místo jako na komplikaci, pohlížet i jako na určitý „mezistupeň“ k obnově sinusového rytmu.
5.4.7. Indikace selektivní ablace
Indikace selektivní ablace fibrilace síní jsou založeny na symptomech, účinnosti a toleranci antiarytmik, systolické funkci levé komory, pracovním zařazení, individuálních aktivitách a postoji pacienta (obr. 2). Ablace je sice účinnější než antiarytmická léčba, ale vzhledem k vysoké prevalenci fibrilace síní a také ekonomickým limitům není tento výkon dostupný pro všechny způsobilé pacienty. Existují jen omezená data, která by podle vstupních charakteristik předpovídala vyšší skupinovou rentabilitu ablace. A konečně, není znám přínos z úspěšné ablace v horizontu mnoha let až desetiletí ani vliv na mortalitu. U pacientů s perzistentní FS bývá nutná složitější ablační strategie zasahující i mimo plicní žíly a pacienti musí být připraveni na častější opakované ablace. Arbitrární rozdělení perzistentní FS na podskupinu dlouhodobě perzistentní FS podle nepřetržitého trvání fibrilace déle než 1 rok neodráží spolehlivě individuální arytmogenní substrát či nezbytný rozsah ablace [99].
Obr. 2. Postavení katetrizační ablace v léčbě fibrilace síní. Ablace je indikována u symptomatických nemocných, po selhání alespoň jednoho antiarytmika. U pacientů s paroxyzmální fibrilací síní lze v odůvodněných případech zvážit ablaci i jako metodu první volby, před podáním antiarytmika. SOS – strukturální onemocnění srdce, AH – arteriální hypertenze, ICHS – ischemická choroba srdeční, SS – srdeční selhání, HLK – hypertrofie levé komory srdeční > 14 mm. *u vybraných nemocných, po zvážení alternativních způsobů léčby 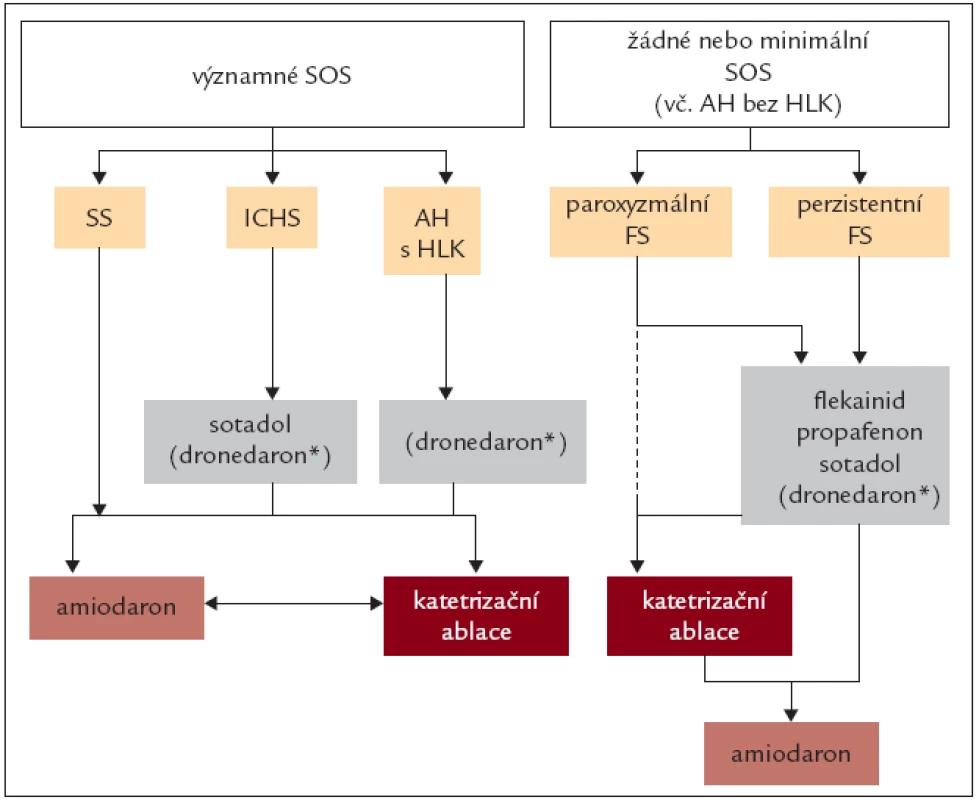
-
A) Ablace je indikována u pacientů, u nichž lze očekávat užitek z výkonu (obr. 3). Jde o:
- mladší pacienty (< 70–75 let, je vždy třeba individuální přístup) s paroxyzmální FS, symptomatické, bez významných komorbidit, bez významného primárního strukturálního postižení srdce, zvláště při neúčinné antiarytmické léčbě;
- mladší pacienty s perzistentní FS, symptomatické bez významných komorbidit, bez významného primárního strukturálního postižení srdce, zvláště při neúčinné antiarytmické léčbě; zkušenosti a úroveň důkazů je zde nižší než u paroxyzmální FS;
- pacienty se systolickou dysfunkcí levé komory, u kterých je předpoklad zlepšení funkce levé komory po obnově sinusového rytmu;
- mladší, aktivní pacienty, u nichž lze ablaci zvážit i před nasazením antiarytmik;
- pacienty, u nichž byl před ablací pro fibrilaci síní nebo během výkonu zachycen flutter síní I. typu, je indikována současná ablace kavo-trikuspidálního isthmu. Výkon lze provést i bez dokumentace flutteru síní I. typu.
- B) Naopak primárně rezervovaný postoj k selektivní ablaci je na místě u pacientů, u nichž lze očekávat minimální nebo žádný užitek z ablace a naopak horší toleranci a vyšší riziko výkonu. Individuální zvážení je možné, zvláště při rozhodování podle věku a v přítomnosti primárního strukturálního postižení srdce. Jedná se o pacienty:
- polymorbidní se závažnými mimosrdečními nemocemi;
- se závažným primárním strukturálním postižením srdce s preexistující systolickou dysfunkcí levé komory bez vyhlídky na její úpravu, respektive bez vyhlídky na zlepšení kvality života nebo vysazení warfarinu při sinusovém rytmu;
- starší (≥ 70–75 let, je vždy třeba individuální přístup);
- relativně starší s perzistentní fibrilací síní bez primárního strukturálního postižení srdce, ale asymptomatické, bez systolické dysfunkce levé komory, dobře tolerující antikoagulační léčbu a současně nemotivované k ablaci.
Obr. 3. Rozhodování o indikaci k selektivní katetrizační ablaci pro fibrilaci síní. 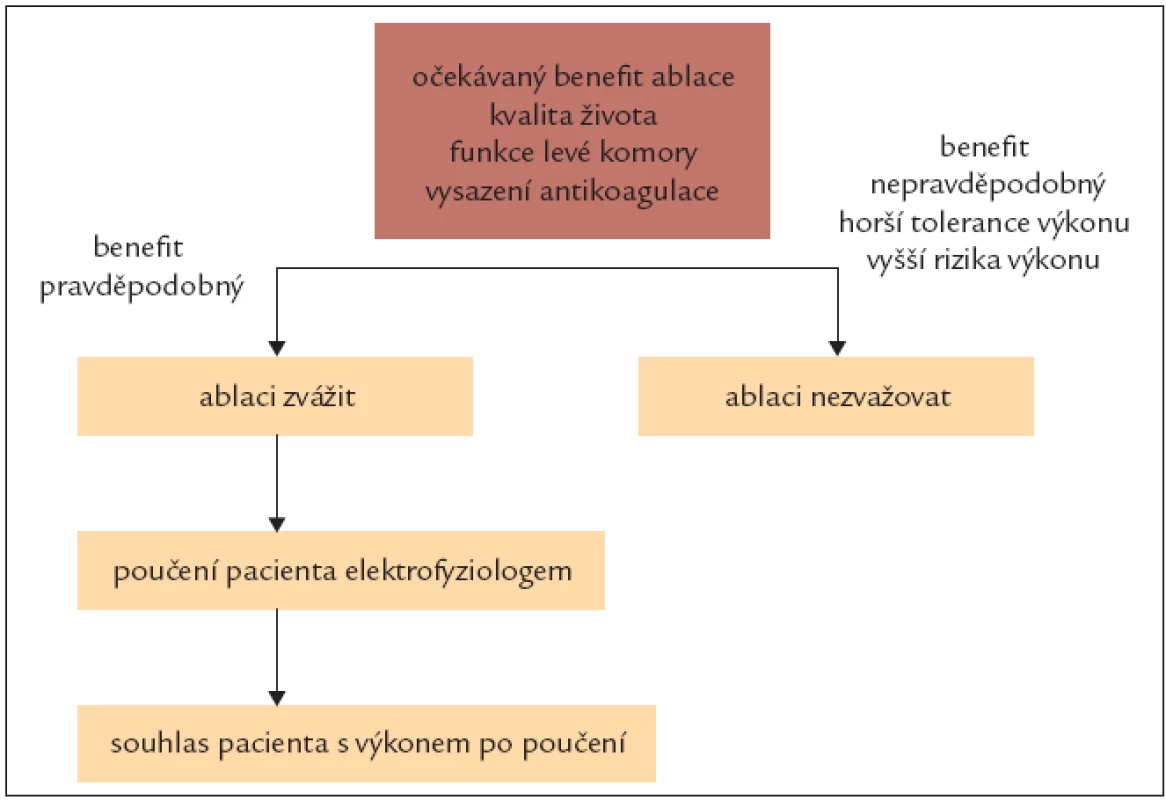
Pacient by o výkonu měl být podrobně poučen včetně rizik, obvyklých klinických výsledků a možného opakování výkonu, nejlépe v centru, které ablace provádí. Následné rozhodnutí o indikaci výkonu pak respektuje názor poučeného pacienta. Rozsah strukturálních změn, arytmogenního substrátu a nezbytný rozsah ablační strategie (od pouhé izolace plicních žil po lineární léze a ablaci dalších zdrojů FS) může být stanoven až v průběhu samotného výkonu.
5.4.8. Sledování po ablaci
Před výkonem se antagonisté vitaminu K většinou vysazují a nahrazují nízkomolekulárním heparinem (low molecular weight heparin – LMWH), i když některá centra při výkonu antikoagulaci nepřerušují. Při samotném výkonu se aplikuje nefrakcionovaný heparin intravenózně a ideálně se udržuje hodnota aktivovaného srážecího času kolem 300–400 s. Po ablaci je nutné pokračovat v antikoagulační léčbě minimálně 2–6 měsíců podle charakteru arytmie a typu výkonu. Potom záleží na rizikové stratifikaci tromboembolie. Zatím převládá názor, že u pacientů s CHADS2 skóre ≥ 2 se má trvalá antikoagulace spíše ponechat. Data o tomto postupu nejsou jednotná a v praxi ani všeobecně respektovaná (viz odstavec 5.4.6.), jedná se o příklon k bezpečnější variantě.
Antiarytmika mohou být vysazena, nebo mohou zůstat ponechána ke stabilizaci časného období hojení a reverzní remodelace. Případné recidivy arytmie, zvláště po ablaci perzistentní fibrilace síní, je vhodné co nejdříve ukončit např. elektrickou kardioverzí a proces reverzní remodelace takto podpořit. Období prvních 3 měsíců po ablaci se většinou v klinických studiích nehodnotí (tzv. blanking perioda). Případnou opakovanou ablaci je, až na výjimky, vhodné plánovat ne dříve než po uplynutí prvních 3–6 měsíců po předchozí ablaci.
5.5. Chirurgická léčba fibrilace síní
5.5.1. Úvod
Fibrilace síní je nezávislým rizikovým faktorem, který negativně ovlivňuje výsledek srdeční operace; je spojena s vyšší perioperační úmrtností, zejména u pacientů s ejekční frakcí levé komory EF LK ≥ 40 %. Ačkoli není jisté, nakolik fibrilace síní (nezávisle na dalších faktorech) ovlivňuje dlouhodobé přežití pacientů po operaci srdce, obnovení sinusového rytmu výsledky zlepšuje [101]. Ve srovnání s katetrizačními metodami lze chirurgickou ablací snadno dosáhnout úplné elektrické izolace s dostatečně transmurálními lézemi. V indikovaných případech, kde se nepředpokládá obnovení sinusového rytmu, lze snesením ouška levé síně ovlivnit riziko následné tromboembolie.
5.5.2. Operace pro fibrilaci síní
Počátky operací pro fibrilaci síní byly paliativní, podobně jako počátky ablací (ablace AV uzlu). Izolovala se fibrilující levá síň od zbytku srdce se sinusovým rytmem. Základem moderní kurativní léčby bylo však až zavedení tzv. „operace MAZE“ [102] (bludiště). Cílem bylo narušení mnohočetných reentry okruhů u fibrilace síní. Při výkonu se provádí izolace plicních žil metodou řezů a opětovného sešití („cut and sew“), postupuje se k mitrálnímu prstenci, oušku pravé a levé síně srdeční a koronárnímu sinu. Dlouhodobá efektivita takto provedené operace MAZE je velmi vysoká; až 75–95 % nemocných nemá po dobu 15 let klinicky ověřenou recidivu fibrilace síní. U pacientů s postižením mitrální chlopně nedokáže samotná operace chlopně snížit riziko fibrilace síní ani riziko mozkové tromboembolické příhody. Souběžné provedení operace MAZE vede k výsledkům srovnatelným s výsledky u pacientů, kteří podstoupí operaci mitrální chlopně a mají sinusový rytmus. Operace MAZE také příznivě ovlivňuje obnovení kontraktility levé síně.
Limitací výkonu MAZE je jeho náročnost a zatížení rizikem významných komplikací. Proto došlo k modifikaci operace s nahrazením nebo doplněním chirurgických řezů aplikací různých forem energie.
5.5.3. Technika výkonu a používané energie
Kromě samotné operace MAZE se dnes provádí spíše perioperační ablace, kde je vzniku lézí dosaženo vytvářením ablačních linií místo incizí. Jde o rychlejší a méně invazivní postup. Výkony jsou prováděny především ve spojení s dalším chirurgickým zákrokem (operace mitrální chlopně, aortální chlopně, aortokoronární bypass), kdy prodlouží vlastní operaci jen o 10–20 min. Výhodou je dobrý přístup k síním na otevřeném hrudníku a možnost vizuální kontroly lézí.
Pokud perioperační ablace není spojena s kardiochirurgickým zákrokem, lze výkon provádět na běžícím srdci a miniinvazivně (tj. torakoskopicky nebo s podporou robotizace). Podobně jako u endovazálních ablací, i u paroxyzmální fibrilace síní většinou postačuje izolace plicních žil, u perzistující fibrilace bývá třeba komplexnějšího výkonu.
K vytváření lézí lze použít různé energetické zdroje, nejčastěji kryoenergii, radiofrekvenci (unipolární, bipolární), ultrasonografii (HIFU, soustředěný ultrazvuk vysoké intenzity), mikrovlny nebo laser [103,104]. Použité energie lze kombinovat, při operaci MAZE III jsou incize doplňovány vytvářením linií kryoenergií. Aplikace lze provádět endokardiálně či epikardiálně, případně postupy také kombinovat. K vytváření lézí lze používat různé sondy, které často umožní docílit dlouhé léze jednou aplikací. Také tvar a počet ablačních linií se liší. Výkony mohou zahrnovat i pravou síň, základem jsou však linie v levé síni. Zatím prakticky neexistují studie, které by srovnávaly výsledky při použití jednotlivých technik. Transmuralita a kompletnost lézí je většinou nižší než při incizích a opětovném sešití.
Úspěšnost perioperačních ablací závisí na řadě faktorů. Kromě samotné techniky výkonu a zkušenostech centra je to hlavně délka trvání fibrilace a velikost levé síně. Negativní vliv na úspěšnost zákroku může mít také vyšší věk pacienta, arteriální hypertenze a spánková apnoe [105].
5.5.4. Indikace chirurgické léčby
Pokud je u pacienta s fibrilací síní indikován kardiochirurgický výkon, doplnění o perioperační ablaci lze provést většinou snadno. Proto by měla být perioperační ablace zvážena u naprosté většiny pacientů s paroxyzmální i perzistující fibrilací síní. Je však třeba vzít v úvahu doprovodná onemocnění, trvání fibrilace, velikost síní a další faktory, které ovlivňují úspěšnost výkonu [106]. Při výrazném zvětšení levé síně a mnohaleté anamnéze fibrilace bývá remodelace síní velmi pokročilá a úspěšnost perioperačních ablací je nízká.
Indikace k provádění zákroku pro fibrilace síní jako samostatného výkonu (minitorakotomie, torakoskopie) není zdaleka tak jasně přijímána. Záleží většinou na zkušenostech daného pracoviště, a to jak v oblasti chirurgického řešení fibrilace, tak v oblasti provádění endovazálních ablací. Záleží i na typu fibrilace síní. Obecně je pro ni ve světě zatím mnohem častěji prováděna endovazální ablace.
5.5.5. Sledování po chirurgické ablaci
Po chirurgické ablaci probíhá reverzní remodelace síní, která je často komplikována časnou rekurencí FS a výskytem i jiných arytmií. Postup by měl být obecně podobný jako po endovazálních katetrizačních ablacích. Nejméně po dobu 3 měsíců je nutné podávat současně antiarytmika a provádět účinnou antikoagulaci. Ukončení antikoagulační léčby u pacientů s vyšším rizikem tromboembolizmu (skóre CHADS2 ≥ 2) často není možné. Po 3 měsících je vhodné echokardiografické vyšetření s posouzením srdeční hemodynamiky.
Podobně jako komplexní endovazální ablace pro fibrilaci síní provází vznik síňových tachykardií, i perioperační ablace jsou zatíženy tímto rizikem. Nedostatečným sledováním lze výskyt pooperačních recidiv fibrilací síní i síňových tachykardií přehlédnout. Arytmie lze pak řešit kontrolou rytmu či frekvence antiarytmiky, někdy je však třeba spolupráce s pracovištěm se zkušenostmi v provádění endovazálních ablací.
5.6. Nefarmakologické metody prevence mozkových příhod
Nejčastějším místem vzniku sraženin při fibrilaci síní je ouško levé síně. Uzavření ouška tedy může u pacientů s FS omezit formování sraženin a snížit výskyt mozkových příhod. K uzávěru ouška se používají různé typy okluderů (Watchman, Amplatzer, Sentre Heart), které se zavádějí punkčně přes femorální žílu a následně transseptálně do ouška. Často je zatím uzávěr ouška nedokonalý. Dat o přínosu okluderů v porovnání s léčbou antitrombotiky je málo, výkony se zatím provádějí v rámci klinických studií. Nejvíce zkušeností je s okluderem Watchman. Studie PROTECT-AF [107,108] u 707 pacientů s fibrilací síní při jeho použití prokázala non-inferioritu účinku (parametrem byl kompozitní výskyt cévní mozkové příhody, úmrtí v důsledku kardiovaskulárního onemocnění a systémové embolie) v porovnání s warfarinem. Ve skupině, která podstoupila zákrok, byl iniciálně vyšší výskyt nežádoucích příhod. Kromě okluderů se zkouší také podvaz ouška (torakoskopicky nebo z minitorakotomie, případně i přes perikardiální punkci). Výhodou je možnost kombinace s ablací pro fibrilaci síní.
Žádný z uvedených postupů však nebyl dosud schválen pro rutinní klinické použití. K zavedení okluderu by měli být vhodní pacienti s vysokým rizikem tromboembolizmu i krvácivých komplikací, případně s intolerancí či kontraindikací antitrombotické léčby.
Pokud je indikován kardiochirurgický výkon, většina pracovišť současně provádí excizi levého ouška. Některá pracoviště provádí jen podvaz ouška, jiná nechávají ouško zcela intaktní, což odůvodňují významem mechanické funkce ouška. Pokud je podvaz ouška nekompletní, může být výskyt tromboembolických komplikací vyšší. Celkově však přínos chirurgických zákroků na oušku z hlediska ovlivnění tromboembolických příhod stále není spolehlivě zhodnocen.
MUDr. Robert Čihák, CSc.
www.ikem.cz
e-mail: robert.cihak@ikem.cz
Doručeno do redakce: 19. 1. 2012
Otištěno s laskavým svolením výboru České kardiologické společnosti a redakční rady časopisu Cor et Vasa. Originálně publikováno v Cor Vasa 2011; 53 (Suppl 1): 27–52.
Zdroje
1. Fuster V, Rydén LE, Cannom DS et al. American College of Cardiology; American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: full text. A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for practice guidelines (Writing Committee to Revise the 2001 guidelines for the management of patients with atrial fibrillation) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace 2006, 8 : 651–645.
2. Camm AJ, Kirchhof P, Lip GY et al. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
3. Wann LS, Curtis AB, January CT et al. 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123 : 104–123.
4. Wann LS, Curtis AB, Ellenbogen KA et al. 2011 ACCF/AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Updating on Dabigatran). J Am Coll Cardiol 2011; 57: 1330–1337.
5. Čihák R, Heinc P. Doporučení pro léčbu pacientů s fibrilací síní. Cor Vasa 2004; 46: K67–K77.
6. Kirchhof P, Auricchio A, Bax J et al Outcome parameters for trials in atrial fibrillation: executive summary. Eur Heart J 2007; 28 : 2803–2817.
7. Jahangir A, Lee V, Friedman PA et al. Long-term progression and outcomes with aging in patients with lone atrial fibrillation: a 30-year follow-up study. Circulation 2007; 115 : 3050–3056.
8. de Vos CB, Pisters R, Nieuwlaat R et al. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis. J Am Coll Cardiol 2010; 55 : 725–731.
9. Nieuwlaat R, Capucci A, Camm AJ et al. European Heart Survey Investigators. Atrial fibrillation management: a prospective survey in ESC member countries: the EuroHeart Survey on Atrial Fibrillation. Eur Heart J 2005; 26 : 2422–2434.
10. Nabauer M, Gerth A, Limbourg T et al. The Registry of the German Competence NETwork on Atrial Fibrillation: patient characteristics and initial management. Europace 2009; 11 : 423–434.
11. Kostin S, Klein G, Szalay Z et al. Structural correlate of atrial fibrillation in human patients. Cardiovasc Res 2002; 54 : 361–379.
12. Boldt A, Wetzel U, Lauschke J et al. Fibrosis in the left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004; 90 : 400–405.
13. Spach MS, Boineau JP. Microfibrosis produces electrical load variation due to loss of side-to-side cell connections: A major mechanism of structural heart disease arrhythmias. Pacing Clin Electrophysiol 1997; 20 : 397–413.
14. Li D, Fareh S, Leung TK et al. Promotion of atrial fibrillation by heart failure in dogs: Atrial remodeling of a different sort. Circulation 1999; 100 : 87–95.
15. Ausma J, Wijffels M, Thoné F et al. Structural changes of atrial myocardium due to sustained atrial fibrillation in the goat. Circulation 1997; 96 : 3157–3163.
16. Goette A, Staack T, Röcken C et al. Increased expression of extracellular signal-regulated kinase and angiotenzin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000; 35 : 1669–1677.
17. Li D, Shinagawa K, Pang L et al. Effects of angiotenzin-converting enzyme inhibition on the development of atrial fibrillation substrate in dogs with ventricular tachypacing-induced congestive heart failure. Circulation 2001; 104 : 2608–2614.
18. Kumagai K, Nakashima H, Urata H et al. Effects of angiotenzin II type 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation. J Am Coll Cardiol 2003; 41 : 2197–2204.
19. Boldt A, Scholl A, Garbade J et al. ACE-inhibitor treatment attenuates atrial structural remodeling in patients with lone chronic atrial fibrillation. Basic Res Cardiol 2006; 101 : 261–267.
20. Fiala M, Wichterle D, Chovančík J et al. Left atrial voltage during atrial fibrillation in paroxysmal and persistent atrial fibrillation patients. Pacing Clin Electrophysiol 2010; 33 : 541–548.
21. Kuppahally SS, Akoum N, Burgon NS et al. Left atrial strain and strain rate in patients with paroxysmal and persistent atrial fibrillation. Relationship to left atrial structural remodeling detected by delayed-enhancement MRI. Circ Cardiovasc Imaging 2010; 3 : 231–239.
22. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285 : 2370–2375.
23. Heeringa J, van der Kuip DA, Hofman A et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27 : 949–953.
24. Lloyd-Jones DM, Wang TJ, Leip EP et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004; 110 : 1042–1046.
25. Benjamin EJ, Wolf PA, D’Agostino RB et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 1998; 98 : 946–952.
26. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983–988.
27. Friberg L, Hammar N, Rosenqvist M. Stroke in paroxysmal atrial fibrillation: report from the Stockholm Cohort of Atrial Fibrillation. Eur Heart J 2010; 31 : 967–975.
28. Frost L, Engholm G, Johnsen S et al. Incident thromboembolism in the aorta and the renal, mesenteric, pelvic, and extremity arteries after discharge from the hospital with a diagnosis of atrial fibrillation. Arch Intern Med 2001; 161 : 272–276.
29. Knecht S, Oelschläger C, Duning T et al. Atrial fibrillation in stroke-free patients is associated with memory impairment and hippocampal atrophy. Eur Heart J 2008; 29 : 2125–2132.
30. Thrall G, Lane D, Carroll D et al. Quality of life in patients with atrial fibrillation: a systematic review. Am J Med 2006; 119; 448: e1–e19.
31. Bulková V, Fiala M, Chovančík J et al. Analýza nákladů na léčbu u pacientů s fibrilací síní v České republice. Cor Vasa 2008; 50 : 23–27.
32. Lip GY, Lim HS. Atrial fibrillation and stroke prevention. Lancet Neurol 2007; 6 : 981–993.
33. Hughes M, Lip GY. Guideline Development Group. National Clinical Guideline for Management of Atrial Fibrillation in Primary and Secondary Care, National Institute for Health and Clinical Excellence. Stroke and thromboembolism in atrial fibrillation: a systematic review of stroke risk factors, risk stratification schema and cost effectiveness data. Thromb Haemost 2008; 99 : 295–304.
34. Stroke in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69 : 546–554.
35. Lip GY, Nieuwlaat R, Pisters R et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010; 137 : 263–272.
36. Schmitt J, Duray G, Gersh BJ et al. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J 2009; 30 : 1038–1045.
37. Mant J, Hobbs FD, Fletcher K et al. BAFTA investigators; Midland Research Practices Network (MidReC). Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet 2007; 370 : 493–503.
38. Connolly S, Pogue J, Hart R et al. ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367 : 1903–1912.
39. ACTIVE Investigators. Connolly SJ, Pogue J, Hart RG et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med 2009; 360 : 2066–2078.
40. Connoly SJ, Ezekowitz MD, Yusuf S et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 : 1139–1151.
41. Patel MR, Mahafey KW, Garg J et al. ROCKET AF Investigators. Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. N Engl J Med 2011; 365 : 883–891.
42. Granger CB, Alexander JH, McMurray JJ et al. ARISTOTLE Committees and Investigators. Apixaban versus Warfarin in Patients with Atrial Fibrillation. Engl J Med 2011; 365 : 981–992.
43. Grines CL, Bonow RO, Casey DE Jr et al. American Heart Association; American College of Cardiology; Society for Cardiovascular Angiography and Interventions; American College of Surgeons; American Dental Association; American College of Physicians. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Coll Cardiol 2007; 49 : 734–739.
44. Brilakis ES, Banerjee S, Berger PB. Perioperative management of patients with coronary stents. J Am Coll Cardiol 2007; 49 : 2145–2150.
45. Wyse DG, Waldo AL, DiMarco JP et al. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347 : 1825–1833.
46. Van Gelder IC, Hagens VE, Bosker HA et al. Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent atrial fibrillation. N Engl J Med 2002; 347 : 1834–1840.
47. Roy D, Talajic M, Nattel S et al. Atrial Fibrillation and Congestive Heart Failure Investigators. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med 2008; 358 : 2667–2677.
48. Page RL, Kerber RE, Russell JK et al. BiCard Investigators. Biphasic versus monophasic shock waveform for conversion of atrial fibrillation: the results of an international randomized, double-blind multicenter trial. J Am Coll Cardiol 2002; 39 : 1956–1963.
49. Kirchhof P, Eckardt L, Loh P et al. Anterior-posterior versus anterior-lateral electrode positions for external cardioversion of atrial fibrillation: a randomised trial. Lancet 2002; 360 : 1275–1279.
50. Arnold AZ, Mick MJ, Mazurek RP et al. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol 1992; 19 : 851–855.
51. Manios EG, Mavrakis HE, Kanoupakis EM et al. Effects of amiodarone and diltiazem on persistent atrial fibrillation conversion and recurrence rates: a randomized controlled study. Cardiovasc Drugs Ther 2003; 17 : 31–39.
52. Bianconi L, Mennuni M, Lukic V et al. Effects of oral propafenone administration before electrical cardioversion of chronic atrial fibrillation: a placebo-controlled study. J Am Coll Cardiol 1996; 28 : 700–706.
53. Roy D, Pratt CM, Torp-Pedersen C et al. Atrial Arrhythmia Conversion Trial Investigators. Vernakalant hydrochloride for the rapid conversion of the atrial fibrillation: a phase 3, randomized, placebo-controlled trial. Circulation 2008; 117 : 1518–1525.
54. Camm AJ, Capucci A, Hohnloser SH et al. AVRO Investigators. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodaron in recent-onset atrial fibrillation. J Am Coll Cardiol 2011; 57 : 313–321.
55. Hohnloser SH, Crijns HJ, van Eickels M et al. ATHENA Investigators. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360 : 668–678.
56. Connoly SJ, Camm AJ, Halperin JL. PSALLAS Investigators. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med 2011; 365 : 2268–2276.
57. Van Gelder IC, Groenveld HF, Crijns HJ et al. RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362 : 1363–1373.
58. Zhang Y, Zhang P, MuY et al. The role of renin-angiotenzin blockade therapy in prevention of atrial fibrillation: a meta-analysis of randomized controlled trials. Clin Pharmacol Ther 2010; 88 : 521–531.
59. GISSI-AF Investigators, Disertori M, Latini R, Barlera S et al. Valsartan for prevention of recurrent atrial fibrillation. N Engl J Med 2009; 360 : 1606–1617.
60. ACTIVE I Investigators, Yusuf S, Healey JS, Pogue J et al. Irbesartan in patients with atrial fibrillation. N Engl J Med 2011; 364 : 928–938.
61. Savelieva I, Camm AJ. Statins and polyunsaturated fatty acids for treatment of atrial fibrillation. Nat Clin Pract Cardiovasc Med 2008; 5 : 30–41.
62. Epstein AE, DiMarco JP, Ellenbogen KA et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC//AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices); American Association for Thoracic Surgery; Society of Thoracic Surgeons. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices) developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 51: e1–e62.
63. Táborský M et al. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a systémů pro srdeční desynchronizační léčbu. Cor Vasa 2009; 51 : 602–618.
64. Dickstein K, Vardas PE, Auricchio A et al. Committee for Practice Guidelines of the European Society of Cardiology. 2010 focused update of ESC Guidelines on device therapy in heart failure: an update of the 2008 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure and the 2007 ESC Guidelines for cardiac and resynchronization therapy. Developed with the special contribution of the Heart Failure Association and the European Heart Rhythm Association. Eur J Heart Fail 2010; 12 : 1143–1153.
65. Brignole M, Gianfranchi L, Menozzi C et al. Influence of atrioventricular junction radiofrequency ablation in patients with chronic atrial fibrillation and flutter on quality of life and cardiac performance. J Am Coll Cardiol 1994; 74 : 242–246.
66. Marshall HJ, Harris ZI, Griffith MJ et al. Prospective randomized study of ablation and pacing versus medical therapy for paroxysmal atrial fibrillation: effects of pacing mode and mode-switch algorithm. Circulation 1999; 99 : 1587–1592.
67. Weerasooryia R, Davis M, Powel A et al. The Australian Intervention Randomized Control of Rate in Atrial Fibrillation Trial (AIRCRAFT). J Am Coll Cardiol 2003; 41 : 1697–1702.
68. Gasparini M, Auricchio A, Regoli F et al. Four-year efficacy of cardiac resynchronization therapy on exercise tolerance and disease progression: the importance of performing atrioventricular junction ablation in patients with atrial fibrillation. J Am Coll Cardiol 2006; 48 : 734–743.
69. Gasparini M, Auricchio A, Metra M et al. Multicentre Longitudinal Observational Study (MILOS) Group. Long-term survival in patients undergoing cardiac resynchronization therapy: the importance of performing atrio-ventricular junction ablation in patients with permanent atrial fibrillation. Eur Heart J 2008; 29 : 1644–1652.
70. Linde C, Leclercq C, Rex S et al. Long-term benefits of biventricular pacing in congestive heart failure: results from the Multisite Stimulation in Cardiomyopathy (MUSTIC) study. J Am Coll Cardiol 2002; 40 : 111–118.
71. Leclercq C, Walker S, Linde C et al. Comparative effects of permanent biventricular and right atrial pacing in heart failure patients with chronic atrial fibrillation. Eur Heart J 2002; 23 : 1780–1787.
72. Brignole M, Gammage M, Puggioni E et al. Optimal Pacing SITE (OPSITE) Study Investigators. Comparative assessment of right, left, and biventgricular pacing in patients with permanent atrial fibrillation. Eur Heart J 2005; 26 : 712–722.
73. Doshi RN, Daoud EG, Fellows C et al. Left ventricular-based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005; 16 : 1160–1165.
74. Khan MN, Jaïs P, Cummings JE et al. PABA-CHF Investigators. Pulmonary-Vein Isolation for atrial fibrillation with heart failure. N Engl J M 2008; 359 : 1778–1785.
75. Haïssaguerre M, Jaïs P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659–666.
76. Haïsssaguerre M, Hocini M, Sanders P et al. Localized sources maintaining atrial fibrillation organized by prior ablation. Circulation 2006; 113 : 616–625.
77. Sanders P, Jaïs P, Hocini M et al. Electrical disconnection of the coronary sinus by radiofrequency catheter ablation to isolate a trigger of atrial fibrillation. J Cardiovasc Electrophysiol 2004; 15 : 364–368.
78. Hwang C, Wu TJ, Doshi RN et al. Vein of Marshall cannulation for the analysis of electrical activity in patients with focal atrial fibrillation. Circulation 2000; 101 : 1503–1505.
79. Chen PS, Wu TS, Hwang C et al. Thoracic veins and the mechanism of nonparoxysmal atrial fibrillation. Cardiovasc Res 2002; 54 : 295–301.
80. Nademanee K, McKenzie J, Kosar E et al. A new approach for catheter ablation of atrial fibrillation: Mapping and the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044–2053.
81. Haïsssaguerre M, Sanders P, Hocini M et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. J Cardiovasc Electrophysiol 2005; 16 : 1125–1137.
82. Jaïs P, Hocini M, Hsu LI et al. Techniques and results of linear ablation at the mitral isthmus. Circulation 2004; 110 : 2996–3002.
83. Scherlag BJ, Yamanashi W, Patel U et al. Autonomically induced conversion of pulmonary vein focal firing into atrial fibrillation. J Am Coll Cardiol 2005; 45 : 1878–1886.
84. Haïssaguerre M, Jaïs P, Shah DC et al. Electrophysiological endpoint for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000; 101 : 1409–1417.
85. Pappone C, Rosanio S, Oreto G et al. Circumferential radiofrequency ablation of pulmonary vein ostia: a new anatomic approach for curing atrial fibrillation. Circulation 2000; 102 : 2619–2628.
86. Fiala M, Chovančík J, Nevřalová R et al. Termination of long-lasting persistent versus short-lasting persistent and paroxysmal atrial fibrillation by ablation. Pacing Clin Electrophysiol 2008; 31 : 985–997.
87. Tzou WS, Marchlinski FE, Zado ES et al. Long-term outcome after successful catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3 : 237–242.
88. Cappato R, Calkins H, Chen SA et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3 : 32–38.
89. Wazni OM, Marrouche NF, Martin DO et al. Radiofrequency ablation vs Antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005; 293 : 2634–2640.
90. Pappone C, Augello G, Sala S et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atril fibrillation. The APAF study. J Am Coll Cardiol 2006; 48 : 2340–2347.
91. Jaïs P, Cauchemez B, Macle L et al. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: the A4 study. Circulation 2008 : 118 : 2498–2505.
92. Wilber DJ, Pappone C, Neuzil P et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: A randomized controlled trial. JAMA 2010; 303 : 333–340.
93. Wokhlu A, Monahan KH, Hodge DO et al. Long-term quality of life after ablation of atrial fibrillation: the impact of recurrence symptom relief, and placebo effect. J Am Coll Cardiol 2010; 55 : 2308–2316.
94. Bulková V, Fiala M, Haman L et al. Zlepšení kvality života po ablaci dlouhodobě perzistentní versus paroxyzmální fibrilace síní: výsledky dvouletého sledování. Vnitř Lék 2011; 57 : 456–461.
95. Takahashi Y, O’Neill MD, Hocini M et al. Effects of stepwise ablation of chronic atrial fibrillation on atrial electrical and mechanical properties. J Am Coll Cardiol 2007; 49 : 1306–1314.
96. Hsu LF, Jaïs P, Sanders P et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004; 351 : 2373–2383.
97. Oral H, Chugh A, Özaydin M et al. Risk of thromboembolic events after percutaneous left atrial radiofrequency ablation of atrial fibrillation. Circulation 2006; 114 : 759–765.
98. Nademanee K, Schwab MC, Kosar EM et al. Clinical outcomes of catheter ablation for high-risk patients with atrial fibrillation. J Am Coll Cardiol 2008; 51 : 843–849.
99. Themistoclakis S, Corrado A, Marchlinski FE et al. The risk of thromboembolism and need for oral anticoagulation after successful atrial fibrillation ablation. J Am Coll Cardiol 2010; 55 : 735–743.
100. Bunch TJ, Crandall BG, Weiss P et al. Patients treated with catheter ablation for atrial fibrillation have long-term rates of death, stroke, and dementia similar to patients without atrial fibrillation. J Cardiovasc Electrophysiol 2011; 22 : 1–7.
101. Kernis SJ, Nkomo VT, Messika-Zeitoun D et al. Atrial fibrillation after surgical correction of mitral regurgitation in sinus rhythm: incidence, outcome and determinants. Circulation 2004; 110 : 2320–2325.
102. Cox JL, Boineau JP, Schusler RB et al. Five-year experience with the Maze procedure for atrial fibrillation. Ann Thorac Surg 1993; 56 : 814–824.
103. Melo J, Adragão P, Neves J et al. Endocardial and epicardial radiofrequency ablation in the treatment of atrial fibrillation with a new intra-operative device. Eur J Cardiothorac Surg 2000; 18 : 182–186.
104. Ghavidel AA, Javadpour H, Shafiee M et al. Cryoablation for surgical treatment of chronic atrial fibrillation combined with mitral valve surgery: a clinical observation. Eur J Cardiothorac Surg 2008; 33 : 1043–1048.
105. Calkins H, Brugada J, Packer DL et al. EHRA/ECAS Expert consensus statement on catheter and srugical ablation of atrial fibrillation: Recommendation for personnel, policy, procedures and follow up: a report of the HRS task force oncatheter and surgical ablation of atrial fibrillation developed in partnership with the EHRA and ECAS in collaboration with the ACC, AHA. Europace 2007; 9 : 335–379.
106. Pagé P, CCS Atrial Fibrillation Guidelines Committee. Canadian Cardiovascular Society Atrial Fibrillation Guidelines 2010: Surgical Therapy. Can J Cardiol 2011; 27 : 67–73.
107. Holmes DR, Reddy VY, Turi ZG et al. PROTECT AF Investigators. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised noninferiority trial. Lancet 2009; 374 : 534–542.
108. Reddy VY, Holmes D, Doshi SK et al. Safety of percutaneous left atrial appendage closure: results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the Continued Access Registry. Circulation 2011; 123 : 417–424.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo Suppl 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




