-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
Autoři: J. Špinar 1; J. Vítovec 2; J. Hradec 3; I. Málek 4; J. Meluzín 2; L. Špinarová 2; L. Hošková 4; M. Hegarová 4; O. Ludka 1; M. Táborský 5
Působiště autorů: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 1; I. interní kardio-angiologická klinika Lékařské fakulty MU a FN u sv. Anny v Brně, přednosta prof. MUDr. Jiří Vítovec, CSc., FESC 2; III. interní klinika 1. lékařské fakulty UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA 3; Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Jan Kautzner, CSc., FESC 4; I. interní klinika – kardiologická Lékařské fakulty UP a FN Olomouc, přednosta doc. MUDr. Miloš Táborský, CSc., FESC, MBA 5
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 1): 4-40
Kategorie: Doporučené postupy
Obsah
- Úvod
- Definice a klinická klasifikace
- Etiologie, epidemiologie a prognóza
3.1. Etiologie
3.2. Epidemiologie
3.3. Prognóza - Patofyziologie
- Základní diagnostické metody
5.1. Klinické příznaky a anamnéza
5.2. Laboratorní vyšetření
5.3. EKG
5.4. RTG srdce a plic
5.5. Echokardiografie
5.6. Další vyšetření
5.6.1. Zátěžové testy
5.6.1.1. Spiroergometrie
5.6.1.2. Zátěžová echokardiografie
5.6.2. Izotopové metody
5.6.3. Selektivní koronarografie, levostranná a pravostranná srdeční katetrizace
5.6.4. Magnetická rezonance
5.7. Úloha jednotlivých metod v diagnostice CHSS - Léčba chronického srdečního selhání
6.1. Prevence
6.2. Cíle a možnosti léčby
6.3. Vyvolávající faktory, specifické příčiny a souběžné choroby
6.4. Režimová opatření
6.4.1. Životní aktivita
6.4.2. Dieta
6.4.3. Cvičení
6.4.4. Cestování
6.4.5. Sexuální aktivita
6.4.6. Očkování proti chřipce
6.5. Farmakologická léčba
6.5.1. Inhibitory ACE (ACE-I)
6.5.2. Blokátory receptoru 1 pro angiotenzin II (angiotenzin receptor – blocker ARB)
6.5.3. Beta-blokátory (BB)
6.5.4. Diuretika
6.5.5. Blokátory aldosteronu (BRA)
6.5.6. Digoxin
6.5.7. Antiagregace, antikoagulace
6.5.8. Hypolipidemická léčba
6.5.9. Blokátory If kanálu – ivabradin
6.6. Doporučení pro farmakologickou léčbu systolického srdečního selhání
6.6.1. Asymptomatická dysfunkce LK
6.6.2. Symptomatická systolická dysfunkce LK (NYHA II–III)
6.6.3. Zhoršující se srdeční insuficience (NYHA III–IV)
6.6.4. Terminální srdeční insuficience
6.7. Doporučení pro farmakologickou léčbu diastolického srdečního selhání (srdečního selhání se zachovanou ejekční frakcí – HFPEF)
6.8. Léčba srdečního selhání vedená podle natriuretických peptidů
6.9. Eliminační metody
6.10. Doporučení pro srdeční resynchronizační léčbu u pacientů se srdečním selháním
6.10.1. Úvod k resynchronizační léčbě
6.10.2. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru (ICD) s BiV stimulací u pacientů se srdečním selháním funkční třídy III–IV dle NYHA
6.10.3. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru (ICD) s BiV stimulací u pacientů se srdečním selháním funkční třídy I–II dle NYHA
6.10.4. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru s BiV stimulací u pacientů se srdečním selháním a permanentní fibrilací síní (FS)
6.10.5. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru s BiV stimulací u pacientů se srdečním selháním a indikací ke konvenční kardiostimulaci6.11. Umělé srdce, mechanické podpory
6.12. Nechirurgická revaskularizace
6.13. Chirurgická léčba
6.13.1. Revaskularizace myokardu
6.13.2. Aneuryzmektomie
6.13.3. Plastika mitrální chlopně
6.13.4. Náhrada aortální chlopně
6.14. Transplantace srdce
6.15. Paliativní péče o nemocné v terminálních fázích srdečního selhání - Léčba CHSS podle přidružených onemocnění
7.1. Léčba CHSS a hypertenze
7.2. Léčba CHSS a diabetes mellitus
7.3. Léčba CHSS a renální insuficience
7.4. Léčba CHSS a chronická obstrukční plicní nemoc
7.5. Léčba CHSS a fibrilace síní
7.6. Léčba CHSS a komorové arytmie
7.7. Léčba CHSS a anémie
7.8. Léčba CHSS a tromboembolie
7.9. Léčba CHSS a onemocnění štítné žlázy
7.10. Léčba CHSS a deprese
7.11. Léčba CHSS a spánková apnoe
7.12. CHSS a těhotenství - Závěrečná opatření, organizační zabezpečení
- Literatura
Předmluva
Doporučení České kardiologické společnosti jsou vydávána v souladu s doporučeními Evropské kardiologické společnosti [1] a mají za cíl pomoci lékařům v každodenní praxi při diagnostické i terapeutické rozvaze. Doporučení vycházejí z posledních poznatků o dané problematice a jsou postavena, kdykoli je to možné, na medicíně založené na důkazech (Evidence Based Medicine – EBM).
Jsou použity 2 klasifikace pro doporučení a úroveň znalostí (tab. 1 a 2).
Cílem těchto doporučení je popsat diagnostiku a léčbu chronického srdečního selhání v dospělé populaci. Doporučení budou k dispozici v tištěné verzi, v elektronické verzi na stránkách České kardiologické společnosti www.kardio-cz.cz a v kapesní verzi a nahrazují doporučení z roku 2006 [2].
1. Úvod
Chronické srdeční selhání (CHSS) se v evropských zemích vyskytuje u 1–2 % populace s výrazným nárůstem ve vyšších věkových skupinách. Na základě výsledků průzkumu EUROHEART Survey je pro východní Evropu udávána prevalence 1,3 %. Zlepšená léčba akutních stavů (hlavně akutního infarktu myokardu) umožňuje, aby více nemocných dospělo do chronického srdečního selhání. Onemocnění má špatnou prognózu, diagnostika i léčba jsou náročné, a to nejen medicínsky, ale i ekonomicky.
Přístup k nemocnému se srdeční insuficiencí se během posledních desetiletí výrazně změnil. Současná terapie je zaměřena nejen na ovlivnění symptomů, ale především na ovlivnění výskytu a progrese srdečního selhání a na snížení úmrtnosti. Stejně jako v jiných oblastech kardiologie má zásadní význam stanovení pravidel pro diagnostiku a léčbu, která vycházejí ze současné úrovně vědomostí a která jsou vodítkem pro praktického lékaře a kardiologa či internistu. Většina léčebných postupů je dnes podložena výsledky velkých randomizovaných studií, které dokládají, že daný léčebný postup je pro nemocného prospěšný, a to buď ve formě prodloužení života a/nebo zlepšení jeho kvality. Kromě obrovského pokroku ve farmakoterapii prognózu nemocných významně ovlivnilo zavedení resynchronizační léčby a implantabilních defibrilátorů do klinické praxe, pokročil i výzkum umělých srdcí a levostranných podpor. Mnohem častěji jsou taktéž nemocní se srdečním selháním indikováni k revaskularizační léčbě.
2. Definice a klinická klasifikace
Neexistuje definice srdečního selhání, která by byla jednoznačně a všeobecně přijímána. Nejčastěji užívaná je definice hemodynamická doplněná poznatky o neurohumorální aktivaci. Pojem chronické srdeční selhání je tak označením pro řadu symptomů a známek, které jsou způsobeny narušením srdeční práce. Chronické srdeční selhání je syndrom postižení srdce, u kterého přes dostatečné plnění komor klesá minutový výdej a srdce není schopno krýt metabolické potřeby tkání. K projevům srdečního selhání bez poklesu srdečního výdeje může dojít při nepřiměřeném vzestupu plnicího tlaku komor.
Chronické srdeční selhání bývá někdy děleno na levostranné a pravostranné podle toho, zda převládá městnání v systémovém, či plicním řečišti. To však nemusí vždy ukazovat, která komora je více postižena. Dělení na chronické srdeční selhání s nízkým a vysokým srdečním výdejem, na selhání „dopředu“ a „dozadu“ nemají větší praktický význam.
Pro stanovení diagnózy chronického srdečního selhání musí být přítomny symptomy srdečního selhání + známky srdečního selhání + objektivně prokázaná porušená srdeční funkce (tab. 3).
Tab. 3. Diagnostická kritéria srdečního selhání. 
Srdeční dysfunkce může být:
- systolická, kdy klesá stažlivost, cožvede ke snížení ejekční frakce a srdečního výdeje,
- diastolická, kdy se srdeční komory špatně plní krví, nejčastěji při poklesu jejich poddajnosti (= vzestupu tuhosti) a zhoršené roztažitelnosti. Při postižení pouze diastolické funkce bývá srdeční selhání také nazýváno jako srdeční selhání se zachovanou ejekční frakcí (heart failure with preserved ejection fraction – HFPEF).
Obecně můžeme srdeční selhání klasifikovat na:
- nově vzniklé – první prezentace, akutní nebo plíživé,
- přechodné – opakující se (rekurentní)nebo epizodické,
- chronické – perzistentní, stabilní nebo zhoršující se.
Klinický pojem městnavé srdeční selhání označuje stav, při kterém se objevují známky srdeční insuficience spolu s příznaky venózní kongesce, ať již v plicním, nebo systémovém řečišti. Není to tedy synonymum pro pravostranné srdeční selhání nebo pro srdeční selhání s periferními otoky. Klinický pojem kompenzované srdeční selhání označuje stav, kdy vlivem kompenzačních mechanizmů nebo vlivem léčby došlo k vymizení (stabilizaci) klinických známek a projevů srdečního selhání. Jako asymptomatická dysfunkce je nazýván stav, kdy nalézáme sníženou systolickou a/nebo diastolickou funkci levé komory (LK), ale nemocný je i bez léčby bez obtíží; si tuace, kdy je nemocný bez obtíží pouze za současné léčby je srdeční selhání ve stadiu NYHA I.
3. Etiologie, epidemiologie a prognóza
3.1. Etiologie
Srdeční selhání se rozvíjí jako důsledek dysfunkce komorového myokardu, vznikající při řadě kardiovaskulárních chorob. Tato dysfunkce může být systolická a/nebo diastolická. Zdaleka
nejčastější příčinou chronického systolického srdečního selhání, přibližně u 70 % nemocných, je u nás ischemická choroba srdeční, obvykle stav po prodělaném infarktu myokardu. U asi 10 % nemocných jsou příčinou kardiomyopatie, zejména dilatační, a u dalších přibližně 10 % chlopenní vady [1].
Ostatní příčiny jsou méně časté. U srdečního selhání se zachovanou ejekční frakcí (HFPEF) je etiologie odlišná, naprosto dominující je hypertenze, obzvláště ve starším věku, kdy je porucha diastolické funkce levé komory ještě zhoršována myokardiální fibrózou. Významnou roli hraje také diabetes
mellitus.Srdeční selhání je syndrom a nikdy by nemělo být konečnou diagnózou. Vždy by měla být stanovena také diagnóza etiologická. Znalost základního vyvolávajícího onemocnění může podstatným způsobem ovlivnit volbu optimální léčby.
3.2. Epidemiologie
V rozvinutých zemích včetně České republiky významně klesá v posledních 20–30 letech kardiovaskulární i koronární mortalita. V kontrastu s tímto příznivým vývojem se výskyt srdečního selhání celosvětově neustále zvyšuje. Je to důsledek několika faktorů, především všeobecného stárnutí populace, zlepšení léčby akutních forem ICHS a v neposlední řadě také nových a účinnějších léků a léčebných postupů [3]. Prevalence symptomatického srdečního selhání v populaci je přibližně 2 % a prudce stoupá v závislosti na věku, takže v 7. deceniu dosahuje 10–20 %. Další přibližně 2 % populace mají asymptomatickou dysfunkci levé komory [4]. Znamená to, že v ČR trpí srdečním selháním více než 200 000 nemocných a přibližně stejné množství osob má asymptomatickou dysfunkci levé komory.
3.3. Prognóza
Prognóza srdečního selhání má zlepšující se tendenci, přesto je stále velmi špatná [1]. Polovina nemocných se systolickým srdečním selháním zemře do 4 let od stanovení diagnózy a více než 50 % nemocných s těžkým srdečním selháním (ve funkční třídě NYHA IV) zemře do 1 roku [5,6]. Z nemocných přijatých do nemocnice s diagnózou srdečního selhání jich během jednoho roku 40 % zemře nebo je rehospitalizovaných [7]. Nemocní se srdečním selháním se zachovanou ejekční frakcí (HFPEF) mají prognózu jen o málo lepší než nemocní se systolickým srdečním selháním [8]. Srdeční selhání je příčinou 5 % všech akutních hospitalizací, je přítomno u 10 % hospitalizovaných nemocných a spotřebovává přibližně 2 % nákladů na zdravotnictví [1]. Výsledky epidemiologických studií v řadě zemí naznačují, že musíme očekávat prudký celosvětový nárůst prevalence i incidence srdečního selhání, především u starších lidí.
4. Patofyziologie
Na počátku syndromu chronického srdečního selhání stojí nejčastěji porucha srdeční funkce se snížením srdečního výdeje. Při systolické dysfunkci levé komory (LK) dochází k nedostatečnému vyprazdňování komory v systole, tedy k poklesu ejekční frakce LK. Obvykle současně se na rozvoji CHSS podílí porucha relaxace a plnění LK – diastolická dysfunkce LK. Daleko vzácněji je spouštěcím mechanizmem CHSS pokles periferní rezistence, pak hovoříme o srdečním selhání se zvýšeným minutovým výdejem (např. při hypertyreóze).
Pokles srdečního výdeje vede k nedostatečné náplni arteriálního řečiště. Tento stav je identifikován systémem periferních receptorů. Signály z chemoreceptorů a mechanoreceptorů vedou k aktivaci sympatoadrenálního systému (SNS) a systému renin-angiotenzin-aldosteron (RAAS) a k neosmotickému uvolňování vazopresinu a vyplavování cytokinů. Změna autonomní rovnováhy způsobí vazokonstrikci, která má spolu s retencí sodíku a volné vody za cíl udržet perfuzi životně důležitých orgánů.
Kromě progredujícího postižení myokardu dochází u CHSS ke změnám v plicní tkáni, v játrech, ledvinách a periferním svalstvu. S pokročilými stadii CHSS je spojena svalová atrofie a kachexie, často provázená kardiální cirhózou, anémií a poruchou koagulace.
U srdečního selhání se zachovanou systolickou funkcí levé komory je patofyziologie méně jasná, s výjimkou menšiny nemocných se zjevnou výraznou restrikcí plnění levé komory (amyloidóza, extrémní hypertrofie levé komory, konstriktivní perikarditida apod.). Známky diastolické dysfunkce levé komory ve smyslu poruchy relaxace a/nebo snížené poddajnosti jsou zjistitelné ve většině případů, ale jsou často přítomny i u starších lidí bez srdečního selhání.
5. Základní diagnostické metody
5.1. Klinické příznaky a anamnéza
Klinické příznaky srdečního selhání – dušnost, únava a periferní otoky – vedou lékaře k podezření na srdeční selhání, ale u starých osob, obézních a u žen bývá někdy diagnostickým problémem tyto příznaky jednoduše interpretovat.
- dušnost, nejdříve námahová, později klidová, jejíž hlavní příčinou je zvýšení diastolického tlaku v levé komoře, levé síni, plicních kapilárách a následné městnání krve v plicích (plicní žilní kongesce) při dysfunkci levé komory, ať již systolické, nebo diastolické,
- kašel při námaze či psychickém stresu či rozčílení (pozor na kašel po ACE-I u léčených pacientů),
- únava a nevýkonnost, jejichž příčinou je nízký srdeční výdej, periferní hypoperfuze s neadekvátní dodávkou kyslíku a živin do kosterních svalů a metabolizujících tkání,
- periferní otoky, jejichž příčinou je jednak městnání krve ve venózním řečišti (systémová žilní kongesce) při dysfunkci pravé komory, ale také aktivace systému renin-angiotenzin-aldosteron s následnou retencí sodíku a vody a poklesem renálních funkcí při poklesu srdečního výdeje,
- stenokardie u ICHS.
Ke stanovení tíže nebo funkční závažnosti srdečního selhání se běžně používá klasifikace NYHA (New York Heart Association) na 4 funkční třídy (tab. 4). Kvantifikuje výkonnost a subjektivní potíže nemocného, především dušnost a palpitace. Tato klasifikace je koncepčně velmi jednoduchá, a proto se rozšířila a je běžně užívána po celém světě. Má ale velkou variabilitu mezi různými hodnotiteli a často se různí hodnocení funkčního stavu pacientem a jeho lékařem. V amerických doporučeních je upravena do stadií A–D, kde stadium A je charakterizováno pouze rizikovými stavy pro srdeční selhání (hypertenze, aterosklerotické cévní postižení, obezita a další) bez strukturálního postižení myokardu, stadium B zahrnuje asymptomatickou dysfunkci levé komory a třídu NYHA I, stadium C představuje symptomatické nemocné – NYHA II a III – a stadium D refrakterní srdeční selhání (NYHA IV) vyžadující speciální intervence [9].
Tab. 4. Funkční klasifikace srdečního selhání podle New York Heart Association (NYHA). Modifikace z roku 1994. 
Dominující příznaky a objektivní známky levostranného selhání jsou důsledkem plicní kongesce (často se také používá termín plicní venostáza). Je to především námahová dušnost, která narůstá s narůstající tíží selhání. Paroxyzmální noční dušnost (která se také nazývá asthma cardiale) vzniká za několik hodin po ulehnutí, nemocný se musí posadit (ortopnoe), což mu přináší subjektivní úlevu. Plicní edém je nejtěžším projevem buď akutního, nebo akutně zhoršeného chronického levostranného selhání [1,2].
Fyzikálními známkami plicního městnání jsou charakteristické chrůpky na plicích. Jsou obvykle bilaterální, inspirační, vlhké, nepřízvučné až polopřízvučné, nemizí ani nemění svůj charakter po zakašlání. Při těžších formách chronického levo stranného srdečního selhání se může vytvořit vzácněji jednostranný, častěji oboustranný pleurální výpotek.
Killipova klasifikace je založena na klinických projevech a RTG nálezu a má 4 stupně [16]:
- I. bez srdečního selhání, bez známek městnání;
- II. srdeční selhání s cvalem, chrůpky, známkami plicní hypertenze; vlhké chropy na plicích jsou v dolní polovině;
- III. těžké srdeční selhání s vlhkými chropy po celých plicích;
- IV. kardiogenní šok s hypotenzí < 90 mm Hg, periferní vazokonstrikcí, oligurií, cyanózou atd.
Objektivní známky selhání pravé komory jsou většinou důsledkem městnání krve před pravou komorou se vzestupem venózního tlaku. Mezi typické známky patří: zvýšení náplně krčních žil [10], hepatojugulární reflux, hepatomegalie a periferní otoky. Otoky začínají kolem kotníků, jsou bilaterální a plastické. V době, kdy se objeví, je retinováno již několik litrů (3–5 l) extracelulární tekutiny. Citlivým indikátorem asymptomatické retence tekutiny je přírůstek hmotnosti, rychlé snížení hmotnosti je také spolehlivou známkou vyplavování otoků při diuretické léčbě. Extrémní formou otoků je anasarka, která bývá pravidelně spojena s ascitem, hydrotoraxem a event. hydroperikardem [11].
Srdeční selhání většinou provází tachykardie jako projev aktivace sympatoadrenálního systému. Při snížení poddajnosti selhávajícího myokardu zjišťujeme výskyt III. nebo IV. diastolické ozvy nebo jejich sumace a nazýváme jej cvalovým (trojdobým) rytmem, hmatným nebo slyšitelným nejlépe na srdečním hrotu. Jde o znak důležitý pro prognózu a léčbu srdečního selhání. Pulsus alternans, tj. střídající se velká a malá amplituda pulzové vlny, je obvykle známkou těžkého levostranného srdečního selhání. Úder srdečního hrotu je při dilataci srdce posunut doleva a dolů, při hypertrofii levé komory je úder srdečního hrotu obvykle posunut pouze doleva a je zvedavý, při hypertrofii pravé komory je hmatná pulzace v prekordiu. Při plicní hypertenzi je akcentovaná II. ozva nad plicnicí [12].
Příznaky a objektivní známky primárního vyvolávajícího onemocnění mohou být velmi pestré. Jsou to např. stenokardie při ICHS nebo aortální stenóze, poruchy srdečního rytmu, hypertenze, poslechové nálezy při chlopenních vadách až po klinický obraz tyreotoxikózy.
Subjektivní potíže a objektivní známky, jimiž se srdeční selhání nejčastěji manifestuje, tj. námahová dušnost a únava, tachykardie a poslechový nález venostatických chrůpků na plicích mohou upozornit ošetřujícího lékaře na možnost existence srdečního selhání. Bohužel mají tyto příznaky a symptomy nízkou senzitivitu i specificitu. To má za následek, že u řady nemocných zůstává srdeční selhání, zejména lehčího stupně, nerozpoznáno, nebo zmíněné příznaky vedou naopak k chybné diagnóze srdečního selhání. K falešně pozitivní diagnóze srdečního selhání obvykle vede obezita, nerozpoznaná ischemie myokardu a chronická obstrukční plicní nemoc, anémie. Dušnost jako vedoucí příznak levostranného srdečního selhání je jen středně senzitivní (66 %) a má nízkou specificitu (52 %). Velmi cenná pro diagnózu je příznivá odpověď nemocného na léčbu, např. zmenšení nebo vymizení dušnosti po diuretikách [13].
Příznaky a symptomy chronického srdečního selhání shrnuje tab. 5.
Tab. 5. Příznaky a symptomy chronického srdečního selhání. 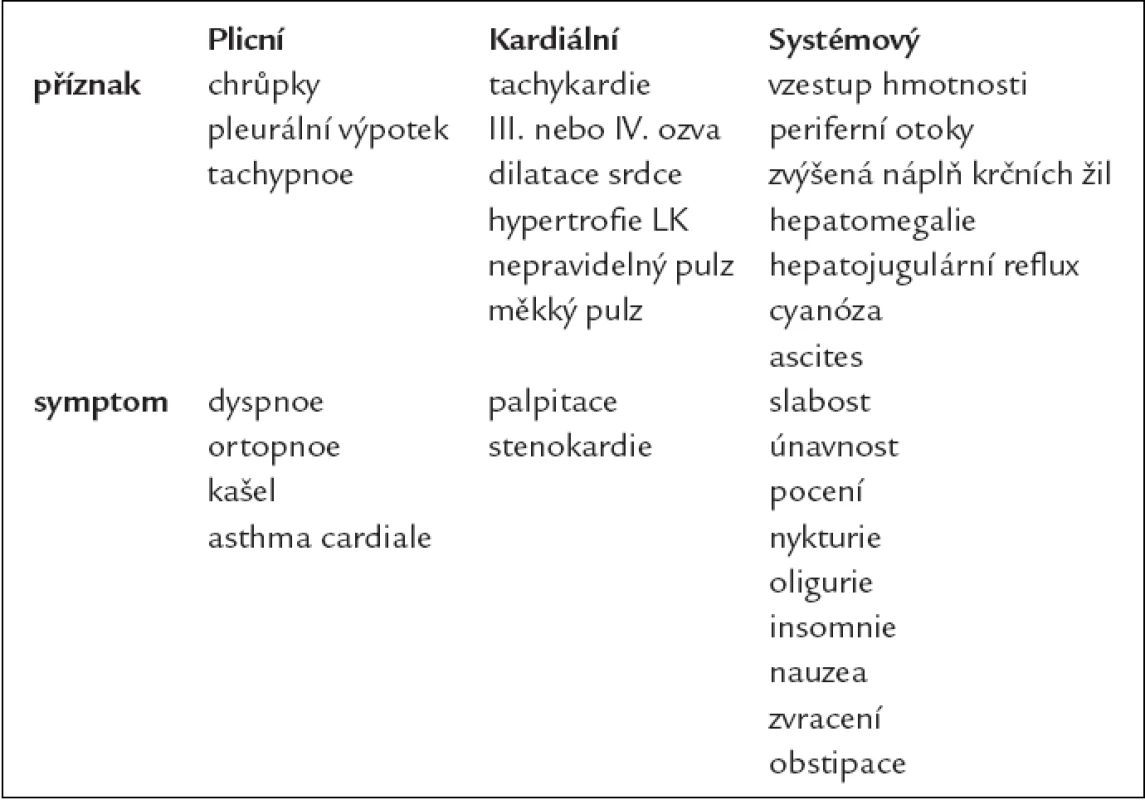
Stanovení diagnózy srdečního selhání jen na základě potíží a příznaků je velmi nespolehlivé. Pro zvýšení spolehlivosti je nutné prokázat objektivně také poruchu srdeční funkce, ať již systolickou, nebo diastolickou. K dispozici je několik metod – echokardiografie s dopplerovským vyšetřením, radioizotopová vyšetření a srdeční katetrizace umožňují zhodnotit systolickou (např. stanovením ejekční frakce) i diastolickou funkci levé komory.
5.2. Laboratorní vyšetření
U pacientů s chronickým srdečním selháním by mělo být provedeno vyšetření krevního obrazu, elektrolytů, krea tininu, glykemie, jaterních testů, kyseliny močové a vyšetření moči a sedimentu.
Zvýšený hematokrit u nemocného s dušností znamená spíše plicní původ tohoto symptomu, anémie naopak patří k obrazu těžšího srdečního selhání, především z důvodu nedostatečné tvorby erytropoetinu při postižení ledvin. Ve velkých klinických studiích způsobovaly mírné snížení hemoglobinu a hematokritu i blokátory renin-angiotenzinového systému. Zvýšení urey a kreatininu v plazmě nasvědčuje spíše renálnímu původu otoků (kromě nemocných s terminální srdeční insuficiencí), musíme však diferenciálně diagnosticky uvažovat i o prerenálním původu a katabolizmu u srdečního selhání. Vyšetření moče a sedimentu je užitečné pro zjištění proteinurie nebo glykosurie a upozornění na možné ledvinné problémy či diabetes mellitus, které mohou dále komplikovat srdeční selhání.
Léčba diuretiky ovlivňuje hladiny draslíku, hyponatremie je indikátorem špatné prognózy. Zvýšené jaterní enzymy svědčí pro jaterní hypoperfuzi.
Při fibrilaci síní s rychlou odpovědí komor je třeba vyloučit tyreotoxikózu a plicní embolizaci. Na druhé straně může průkaz hypotyreózy objasnit jednu z příčin srdečního selhání. Abnormality parciálních tlaků krevních plynů včetně zvýšeného arteriovenózního rozdílu saturace kyslíku se vyskytují až v těžších stadiích srdečního selhání.
Stanovení plazmatických koncentrací natriuretických peptidů či jejich fragmentů, zejména BNP a NT-proBNP, může být přínosem pro diagnostiku [14]. Hranice normy, která vylučuje srdeční selhání u neléčeného nemocného, je BNP < 100 pg/ml a NT-proBNP < 400 pg/ml. U nemocných, kteří již jsou léčeni, nevylučuje normální hladina BNP či NT-proBNP srdeční selhání. Doporučené použití natriuretických peptidů podle ESC guide lines ukazuje obr. 1.
Obr. 1. Diagnostika CHSS pomocí natriuretických peptidů. 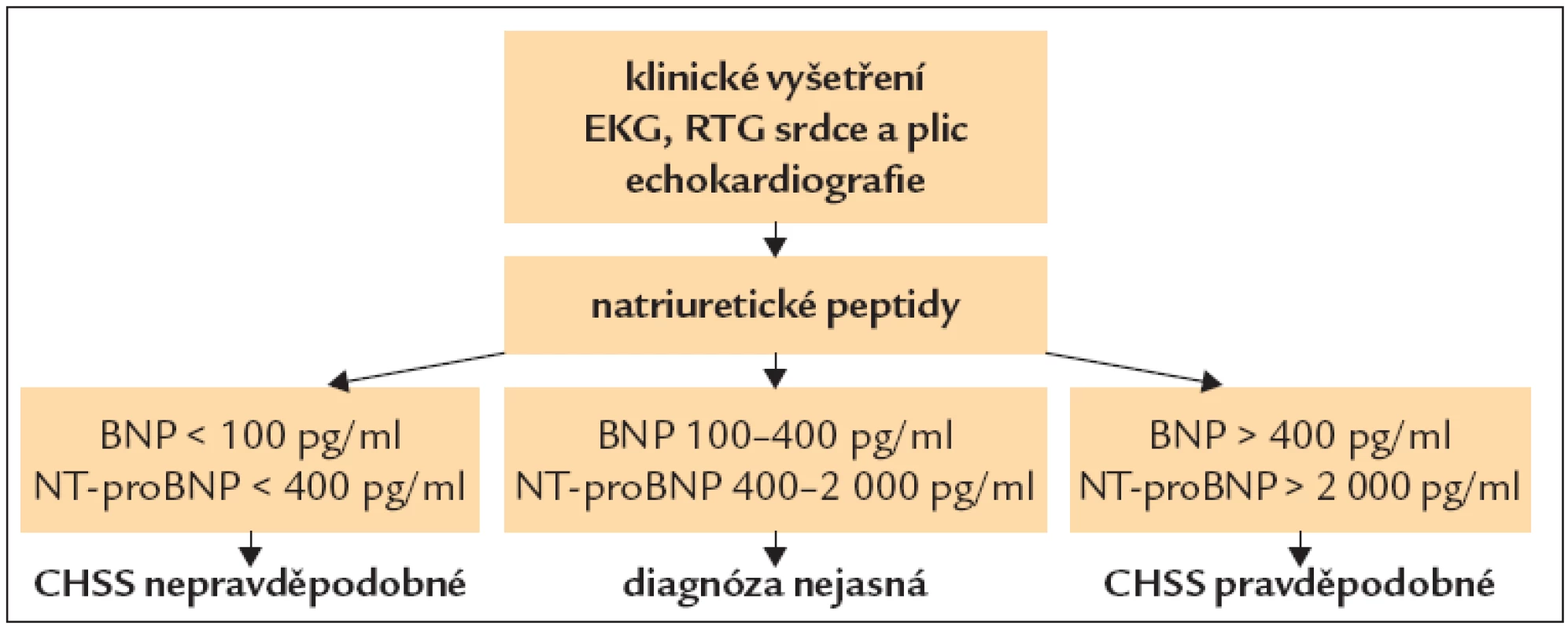
U akutního srdečního selhání (včetně dekompenzace chronického srdečního selhání) je jasně patologická hodnota BNP > 400 pg/ml, NT-proBNP > 2 000 pg/ml [1].
BNP a NT-pro BNP jsou prognostickými markery chronického srdečního selhání a jsou užitečné také pro monitoraci léčby [15]. Stanovení natriuretických peptidů je využíváno hlavně u pacientů se systolickou dysfunkcí. Bylo však prokázáno, že jejich hodnoty jsou zvýšené i u pacientů s diastolickou dysfunkcí. V méně častých případech může být za zvýšenou hladinou natriuretických peptidů ledvinné onemocnění. Vyšší hodnoty jsou rovněž přítomny u starších pacientů a u žen.
Pro klinickou praxi je důležité stanovení natriuretických peptidů k vyloučení srdečního selhání u neléčených nemocných. (Normální hladina BNP nevylučuje strukturální postižení např. konstriktivní perikarditidy či mitrální stenózy.) Stanovení BNP a NT-proBNP by mělo snížit užití echokardiografie a dalších speciálních vyšetřovacích metod.
Troponin I (případně troponin T) se stanovuje u srdečního selhání, kde je podezření na akutní koronární syndrom. Vzrůstá také u myokarditidy. Menší nárůst je patrný i u těžkého srdečního selhání nebo dekompenzace i bez myokardiální ischemie.
Plazmatické koncentrace noradrenalinu, reninu, angiotenzinu II, aldosteronu, endotelinu a cytokinů mohou pomoci k posouzení tíže a prognózy CHSS, v individuálních případech je však interpretace obtížná a jejich rutinní použití není doporučeno.
5.3. EKG
Fyziologické EKG u nemocných s CHSS je přítomno v menšině případů, prediktivní hodnota pro vyloučení systolické dysfunkce levé komory je přes 90 %. Vyskytují se rozličné supraventrikulární i komorové arytmie, blokády na všech úrovních, přetížení síní, hypertrofie a přetížení komor, změny úseku ST-T. Všechny tyto nálezy jsou ale velmi nespecifické. Kromě toho se mohou objevit známky základní choroby, jako např. patologické Q po překonaném srdečním infarktu.
5.4. RTG srdce a plic
Při chronickém srdečním selhání je často rozšířen srdeční stín, ale není tomu tak vždy ani u systolického srdečního selhání. Zvětšení srdečního stínu bývá spojeno i se změnami jeho kontury. Pro posouzení velikosti udáváme poměr šířky srdečního stínu k šířce hrudníku – kardiotorakální index (KTI). Za patologický se považuje KTI > 0,5.
Pacienti bez plicní hypertenze mívají fyziologickou plicní cévní kresbu (stupeň 0) [16]. Plicní hypertenze se projevuje zpočátku jen rozšířením plicních hilů, později dochází k redistribuci plicní kresby (stupeň 1). U zdravého jedince je ve vzpřímené poloze viditelná plicní vaskulární kresba jen v dolních a středních plicních polích. Se stoupajícím plicním žilním tlakem se objeví zmnožení cévní kresby i v horních plicních polích. Dalším stupněm plicního městnání je intersticiální plicní edém (stupeň 2). Alveolární edém je známkou akutního levostranného selhání či výrazného zhoršení selhání chronického (stupeň 3). Může být jednostranný i oboustranný.
5.5. Echokardiografie
Echokardiografie patří k základním vyšetřovacím metodám v diagnostice chronického srdečního selhání, neboť umožňuje prokázat a kvantifikovat poruchu funkce levé i pravé srdeční komory.
Pro diagnostiku systolického selhání levé komory (LK) je základem určení ejekční frakce (EF). Za poruchu funkce LK je považován pokles EF pod 50 %, významná systolická dysfunkce je vymezena hodnotami EF LK pod 40 %. Důležitým doplňujícím údajem, především pro posouzení prognózy srdeční slabosti, jsou i enddiastolický a endsystolický rozměr a objem (EDV, ESV) LK. Všechny uvedené parametry, stejně jako hodnocení hybnosti stěn LK, lze získat jednorozměrnou (M-mode) a dvourozměrnou (2-D) transtorakální echokardiografií, nověji se začíná uplatňovat i trojrozměrná (3-D) echokardiografie.
Pro hodnocení diastolické funkce LK se používá především pulzní dopplerovská analýza transmitrálního plnění LK a toků v plicních žílách a stanovení diastolických rychlostí pohybu myokardu a mitrálního anulu tkáňovou dopplerovskou echokardiografií. Pulzní dopplerovská echokardiografie transmitrálního plnění LK umožňuje získat následující základní klinicky využitelné parametry. Jsou to: vrcholná rychlost plnění LK v časné dia stole (E), vrcholná rychlost plnění LK při síňovém stahu (A) a decelerační čas časného diastolického plnění LK (DT). Při současném záznamu aortálního a časně diastolického transmitrálního toku lze změřit i izovolumický relaxační čas (IVRT). K vyšetření toků v plicních žílách se využívá pravá plicní žíla, vzorkovací objem se umísťuje asi 0,5 cm před jejím vyústěním do levé síně, kde se měří rychlosti dopředného toku v systole (S) a diastole (D) a doba trvání reverzního toku v době síňové kontrakce (Ard). Rozdíl Ard – Ad (Ad = doba trvání A vlny transmitrálního plnění LK) > 30 ms je citlivou známkou zhoršení distenzibility LK. Největšího rozšíření v hodnocení diastolické funkce LK a odhadu plnicího tlaku LK však dosáhla tkáňová dopplerovská echokardiografie, využívající především měření rychlosti pohybu mitrálního anulu v časné diastole (Ea) a při síňovém stahu (Aa) [17]. Tyto parametry jsou méně ovlivněny preloadem a afterloadem ve srovnání s parametry dopplerovského plnění LK. Měření analogických parametrů na trikuspidálním anulu umožňuje neinvazivně hodnotit a kvantifikovat i funkci pravé komory. Velmi vhodné je kombinovat měření Ea a Aa pohybu mitrálního anulu tkáňovou dopplerovskou echokardiografií s hodnocením E a A při pulzní dopplerovské echokardiografii transmitrálního plnění LK. Kombinace měření E a Ea umožňuje poměrně přesně neinvazivně odhadnout zvýšený plnicí tlak LK. Nagueh et al [18] prokázali dobrou korelaci mezi poměrem E/Ea a plicním kapilárním tlakem v zaklínění (r = 0,87). Hodnota E/Ea < 8 je známkou normálního středního dia stolického tlaku LK, poměr E/Ea > 15 svědčí pro zvýšený střední diastolický tlak [19].
Na základě výše uvedených parametrů se stanovují 3 stupně diastolické dysfunkce [20], které mají vztah k prognóze nemocných (vyšší stupeň znamená vyšší riziko úmrtí či závažných kardiovaskulárních komplikací). Při určování stupně diastolické dysfunkce má základní význam měření Ea na septálním (Ea sept) a laterálním (Ea lat) mitrálním anulu a určení indexu objemu levé síně (LAVi). Normální diastolická funkce je charakterizována Ea sept ≥ 8 cm/s, Ea lat ≥ 10 cm/s a LAVI < 34 ml/m2. Pro diastolickou dysfunkci svědčí Ea sept < 8 cm/s, Ea lat < 10 cm/s a LAVI ≥ 34 ml/m2. Jednotlivé stupně diastolické dysfunkce se potom liší v dalších parametrech, jako jsou E/A, DT, E/Ea, Ard-Ad a změna E/A poměru při Valsalvově manévru (Valv ΔE/A). Stupeň I diastolické dysfunkce je charakterizován poruchou relaxace LK bez významnějšího vzestupu plnicího tlaku LK s následujícími parametry: E/A < 0,8, DT > 200 ms, E/Ea ≤ 8 [Ea = (Ea sept + Ea lat)/2], Ard-Ad < 30 ms a Valv ΔE/A < 0,5. Stupeň 2 je charakterizován pokračující poruchou relaxace, ke které se však již přidružuje vzestup plnicího tlaku LK, jehož výsledkem je pseudonormalizace E/A, DT a dalších parametrů. Toto stadium definují E/A 0,8–1,5, DT 160–200 ms E/Ea 9–12, Ard-Ad ≥ 30 ms a Valv ΔE/A ≥ 0,5. Stupeň 3 se vyznačuje vysokým plnicím tlakem LK spolu s poruchou relaxace a restrikčním plněním LK: E/A je ≥ 2, DT < 160 ms, E/Ea ≥ 13, Ard-Ad ≥ 30 ms a Valv ΔE/A ≥ 0,5.
Tab. 6 ukazuje normální hodnoty nejčastěji užívaných echokardiografických parametrů diastolické funkce levé komory v různých věkových kategoriích [20].
Tab. 6. Normální hodnoty nejčastěji užívaných echokardiografických parametrů diastolické funkce levé komory v různých věkových kategoriích. 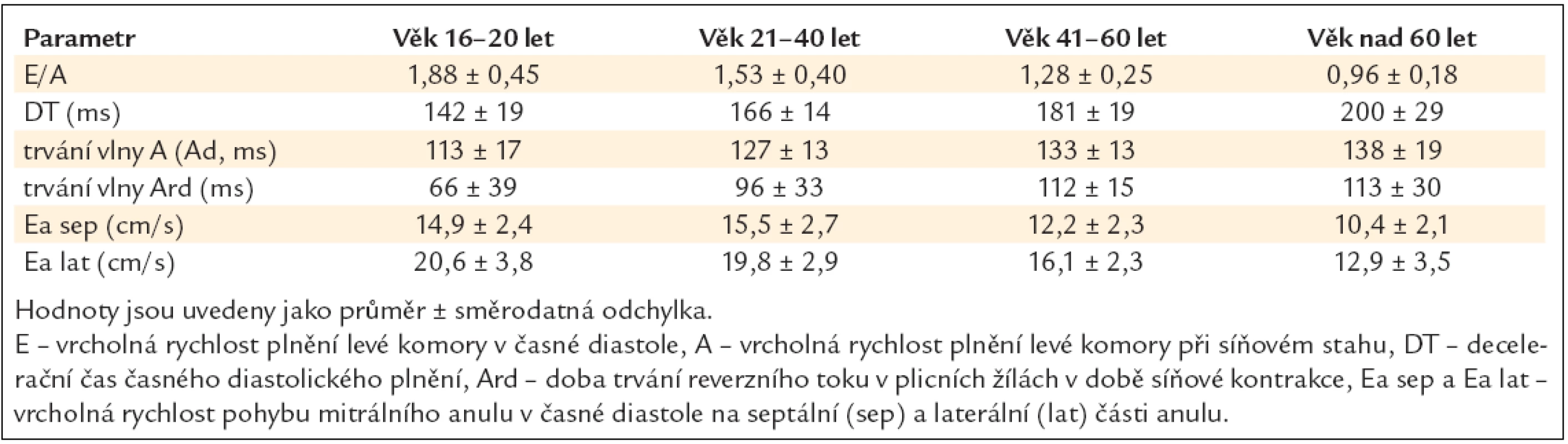
Měření většiny výše uvedených echokardiografických parametrů je rovněž zásadní součástí evropských doporučení pro neinvazivní diagnostiku primárního diastolického srdečního selhání, nověji častěji uváděného pod názvem srdeční selhání s normální ejekční frakcí LK (HFPEF) [21]. Pro HFPEF svědčí přítomnost klinických projevů srdeční slabosti + dobrá systolická funkce LK (EF > 50 %) při nepřítomnosti významnější dilatace LK (EDV < 97 ml/m2) + průkaz poruchy relaxace, plnění, distenzibility a tuhosti LK (tedy průkaz poruchy diastolické dysfunkce LK). Obr. 2 ukazuje schéma neinvazivní diagnostiky diastolické dysfunkce LK v rámci diagnostiky HFPEF modifikované podle doporučení Evropské kardiologické společnosti. Základním parametrem svědčícím pro diastolickou dysfunkci se vzestupem plnicího tlaku LK je E/Ea poměr > 15, který již spolu s přítomností symptomů, normální EF a nezvět šenou LK svědčí pro HFPEF [21]. Je-li E/Ea hraniční (15 > E/Ea > 8), svědčí pro HFPEF současná elevace krevních biomarkerů (NT-proBNP > 220 pg/ml nebo BNP > 200 pg/ml) či přítomnost alespoň 1 z následujících parametrů: E/A < 0,5 v kombinaci s DT > 280 ms u jedinců nad 50 let, Ard-Ad > 30 ms, LAVi > 40 ml/m2, index hmoty LK u žen > 122 g/m2, u mužů > 149 g/m2 nebo přítomnost fibrilace síní. Pokud jsou elevovány biomarkery, stačí pro průkaz HFPEF jeden z následujících nálezů: E/Ea > 8, E/A < 0,5 v kombinaci s DT > 280 ms u jedinců nad 50 let, Ard-Ad > 30 ms, LAVi > 40 ml/m2, index hmoty LK u žen > 122 g/m2, u mužů > 149 g/m2 nebo přítomnost fibrilace síní.
Obr. 2. Schéma neinvazivní diagnostiky diastolické dysfunkce LK [21]. A – vrcholná rychlost plnění levé komory při síňovém stahu, Ard-Ad – rozdíl mezi dobou trvání reverzního toku v plicních žílách a dobou vlny A, BNP – natriuretický peptid typu B, DT – decelerační čas časného diastolického plnění levé komory, E – vrcholná rychlost plnění levé komory v časné diastole, Ea – vrcholná rychlost pohybu mitrálního anulu v časné diastole (průměr rychlosti na septálním a laterálním anulu), LAVi – index objemu levé síně, LVMi – index hmotnosti levé komory, NT-pro BNP – N-terminální fragment natriuretického propeptidu typu B Pozn.: Normy pro natriuretické peptidy v této modifikaci jsou jiné než normy pro diagnostiku srdečního selhání v ESC guidelines. ![Schéma neinvazivní diagnostiky diastolické dysfunkce LK [21].
A – vrcholná rychlost plnění levé komory při síňovém stahu, Ard-Ad – rozdíl mezi dobou trvání reverzního toku v plicních žílách a dobou vlny A, BNP – natriuretický peptid typu B, DT – decelerační čas časného diastolického plnění levé komory, E – vrcholná rychlost plnění levé komory v časné diastole, Ea – vrcholná rychlost pohybu mitrálního anulu v časné diastole (průměr rychlosti na septálním a laterálním anulu), LAVi – index objemu levé síně, LVMi – index hmotnosti levé komory, NT-pro BNP – N-terminální fragment natriuretického propeptidu typu B
Pozn.: Normy pro natriuretické peptidy v této modifikaci jsou jiné než normy pro diagnostiku srdečního selhání v ESC guidelines.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ecca06c625cf494a7bcef3999c8a60c0.png)
Kromě výše zmíněných indikací umožňuje echokardiografie dále odhalit srdeční selhávání v důsledku srdeční tamponády při rozsáhlém perikardiálním výpotku, chronické srdeční selhávání v důsledku vrozených a získaných srdečních vad, aneuryzmatu LK, při těžké plicní hypertenzi atd. Měření Ea napomáhá rychle a neinvazivně odlišit restriktivní kardiomyopatii od konstriktivní perikarditidy (snížená hodnota Ea < 8 cm/s svědčí pro restriktivní kardiomyopatii) [17]. Opakované provádění echokardiografického vyšetření u stabilizovaných nemocných není doporučeno, je však indikováno vždy při změně klinického stavu nebo při titraci léčby. O významu zátěžové echokardiografie bude zmínka v kapitole Zátěžové testy. Transezofageální echokardiografie je indikována u nemocných špatně transtorakálně vyšetřitelných, při komplikovaném chlopenním postižení, při přítomnosti umělé chlopně a při nutnosti vyloučit trombus v oušku levé komory.
5.6. Další vyšetření
5.6.1. Zátěžové testy
Hlavní význam zátěžových testů u nemocných s chronickým srdečním selháváním spočívá v určení příčin srdečního selhávání, ve vyšetření viability myokardu u nemocných s ischemickou chorobou srdeční a v posouzení funkčního stavu a prognózy nemocných. K základním typům zátěžových testů patří spiroergometrie, zátěžová echokardiografie a zátěžové radioizotopové metody.
5.6.1.1. Spiroergometrie
Spiroergometrie je indikována k posouzení funkčního stavu a prognózy nemocných s chronickým srdečním selháním. Nejčastěji je zátěž prováděna na bicyklovém ergometru či běhátku. Zátěž je zvyšována postupně v nevelkých krocích a optimálně trvá 8–12 min. Nejužitečnějším parametrem ke stanovení tolerance zátěže a odhadu prognózy je určení spotřeby kyslíku. Nemocní s vrcholovou spotřebou kyslíku < 12 ml.kg–1min–1 mají vysoké riziko komplikací, naopak nízké riziko mají ti s vrcholovou spotřebou kyslíku nad 18 ml.kg–1min–1. Srdeční transplantace je doporučována pacientům s hodnotou pod 14 ml.kg–1min–1 [22]. O funkčním stavu nemocného vypovídá i 6minutový test chůzí (tzv. 6 min walk test), kdy měříme vzdálenost, kterou je nemocný schopen ujít během 6 min v rovném terénu (chodba). Známkou nepříznivé prognózy je též přítomnost hyperventilace při zátěži (VE/VCO2 slope > 35) [22a].
5.6.1.2. Zátěžová echokardiografie
Dobutaminová echokardiografie slouží k posouzení viability myokardu u klidově těžce dysfunkčních segmentů LK (těžká hypokineze, akineze a dyskineze) a ev. k průkazu ischemie navozené zátěží. Hlavním smyslem vyšetření je odpověď na otázku, zda revaskularizace tepny zásobující klidově chronicky dysfunkční myokard zlepší jeho kontraktilitu. Pokud při infuzi nízkých dávek dobutaminu dysfunkční myokard zlepší svoji kontraktilitu, je to známka zachovalé funkční rezervy myokardu, a tedy jeho viability. Pokud se s narůstající dávkou dobutaminu kontraktilita po přechodném zlepšení začne zhoršovat, značí to navození ischemie, a tedy přítomnost významné stenózy v povodí dysfunkčního, ale viabilního (hibernovaného) myokardu. Tato „bifazická“ odpověď na zátěž dobutaminem s vysokou senzitivitou a specificitou umožňuje předpovědět zlepšení funkce LK po případné revaskularizaci.
5.6.2. Izotopové metody
Perfuzní scintigrafie myokardu pomocí 201thalia nebo látek značených 99mtechneciem (99mTc – sestamibi) dovoluje posouzení relativního prokrvení jednotlivých oblastí myokardu v klidu a při zátěži. Nález reverzibilního defektu perfuze u nemocného s dysfunkcí komory znamená přítomnost ischemického viabilního myokardu a může přispět při úvaze o revaskularizační léčbě.
Radionuklidová ventrikulografie představuje alternativní metodu k neinvazivnímu posouzení funkce levé i pravé komory. Pokles EF při zátěži vypovídá o ischemii myokardu.
Pozitronová emisní počítačová tomografie představuje zlatý standard pro hodnocení viability myokardu. Pro průkaz hibernovaného myokardu svědčí tzv. „perfusion-metabolic mismatch“, tedy nesoulad mezi poruchou perfuze myokardu a relativně zvýšeným metabolizmem v hypoperfundované oblasti.
5.6.3. Selektivní koronarografie, levostranná a pravostranná srdeční katetrizace
U nemocných s chronickým srdečním selháním je koronarografie určena především k objasnění příčiny srdečního selhávání a k posouzení prognózy. Dušnost kardiální etiologie či nález dysfunkční komory jsou jasnou indikací k provedení koronarografie. Taktéž nález závažné chlopenní vady je indikací ke koronarografii. Do budoucna se jako slibná jeví CT angiografie, především u nemocných, kde očekáváme negativní nález na koronárním řečišti. Pokud v průkazu poruchy funkce levé komory selhávají neinvazivní metody, je možné provést levostrannou srdeční katetrizaci s posouzením systolických i diastolických parametrů funkce levé komory [21] či pravostrannou srdeční katetrizaci se změřením plicního kapilárního tlaku v zaklínění, který nás nepřímo informuje o plnicím tlaku levé komory. Během srdeční katetrizace (i nezávisle na ní) je možné při podezření na srdeční selhání v důsledku infiltrativní či střádací nemoci myokardu provést biopsii myokardu k objasnění etiologie srdečního selhávání.
5.6.4. Magnetická rezonance
Velkou perspektivu pro přesné kvantitativní hodnocení viability myokardu i funkce levé a pravé komory představuje nukleární magnetická rezonance. Pro přítomnost ireverzibilního poškození myokardu (vazivová přeměna tkáně, jizva) svědčí zvýšené hromadění gadolinia po jeho nitrožilním podání v neviabilní oblasti myokardu (pozitivní late enhancement). Nukleární magnetická rezonance umožňuje s vysokou přesností stanovit standardní (např. EF) i nové parametry funkce myokardu (např. analýza deformace myokardu – strain).
Magnetickou rezonanci indikujeme taktéž při podezření na infiltrativní postižení myokardu nebo při podezření na postižení myokardu při střádacích chorobách.
V současnosti se začíná testovat k hodnocení funkce a viability myokardu i CT vyšetření.
5.7. Úloha jednotlivých metod v diagnostice CHSS
Diagnostický postup ukazuje tab. 7 a obr. 3.
Obr. 3. Algoritmus diagnostiky CHSS. 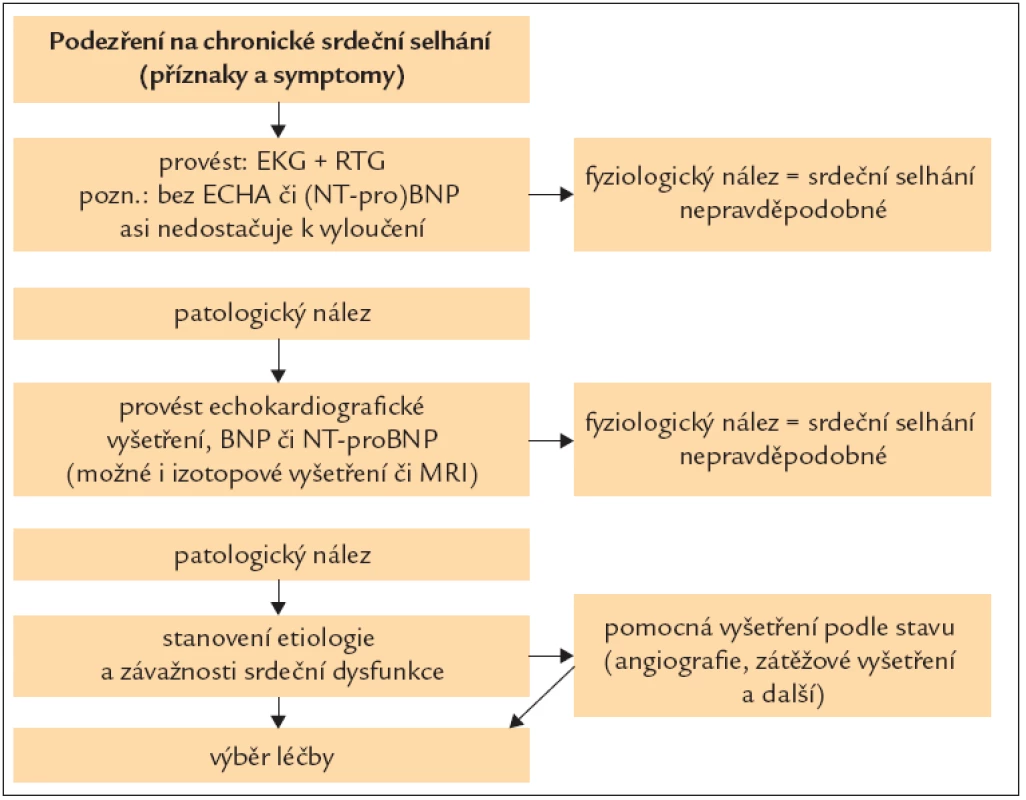
6. Léčba chronického srdečního selhání
6.1. Prevence
Primární prevenci srdečního selhání představuje prevence a důsledná léčba všech chorob, které mohou vést ke vzniku komorové dysfunkce. Patří sem léčba hypertenze, arytmií, akutních forem ICHS se snahou o co nejčasnější rekanalizaci infarktové tepny, optimální načasování chirurgické léčby chlopenních vad a prevence vzniku těch specifických onemocnění myokardu, u nichž je známá a odstranitelná příčina (alkohol, kardiotoxická cytostatika, některé endokrinopatie). V širším slova smyslu sem patří primární i sekundární prevence ICHS jako nejčastější příčiny vzniku srdečního selhání, která je předmětem samostatných společných doporučení několika českých odborných společností [23].
Sekundární prevencí srdečního selhání rozumíme zabránění progrese již existující komorové dysfunkce do manifestního srdečního selhání a progrese již existujícího srdečního selhání. Prostředky primární a sekundární prevence jsou mnohdy totožné. Progresi srdečního selhání lze zabránit, nebo ji lze alespoň významně zpomalit také některými léky, např. inhibitory ACE, sartany, beta-blokátory nebo blokátory receptorů pro aldosteron. Nezbytnou součástí sekundární prevence je také odstranění všech srdeční selhání zhoršujících stavů a faktorů, mezi které patří ischemie myokardu, hypertenze, arytmie, infekční onemocnění, anémie, hypertyreóza, metabolické poruchy a další.
Doporučení I, úroveň znalostí A6.2. Cíle a možnosti léčby
Cílem léčby srdečního selhání je zlepšit kvalitu života, tj. zmenšit nebo úplně odstranit symptomy, zvýšit toleranci zátěže, snížit mortalitu a prodloužit nemocným život [24]. Pro každého nemocného však mohou být pořadí a důležitost těchto cílů rozdílné. Pro málo symptomatické nemocné je prioritní snížení mortality a zpomalení progrese onemocnění. Pro těžce symptomatické nemocné je však důležitější, aby jim léčba především ulevila od jejich potíží a zlepšila kvalitu života. Současné léčebné možnosti, vždy individualizované pro každého nemocného, mohou přinést pozoruhodné výsledky (tab. 8). Kauzální léčení srdečního selhání může být realizováno jen u části nemocných, např. chirurgickou rekonstrukcí nebo nahrazením poškozených chlopní, účinným léčením těžké hypertenze, revaskularizačními výkony atd.
Tab. 8. Léčebné možnosti při srdečním selhání. 
Volba a kombinace optimálních postupů závisí na vyvolávající chorobě, stupni CHSS, přidružených chorobách, věku nemocného a řadě dalších faktorů. Nefarmakologické možnosti, jako režimová a dietní opatření, jsou nezbytnou součástí komplexní léčby.
6.3. Vyvolávající faktory, specifické příčiny a souběžné choroby
Zjistíme-li vyvolávající faktory CHSS, které jsou léčitelné, je vždy nutné intervenovat. Jejich odstranění někdy vede samo k rekompenzaci. Lze je rozdělit na:
- Objemové zatížení (zvýšené předtížení): nadměrná tělesná nebo emoční zátěž, horečka, infekce (bronchopulmonální, močová), mitrální a aortální insuficience, anémie, akutní příhoda břišní, tyreotoxikóza, léky způsobující retenci sodíku a vody (nesteroidní antirevmatika, kortikoidy), nadměrné solení, hypervolemie apod.
- Odporové zatížení (zvýšené dotížení): hypertenze, aortální stenóza, nadměrná tělesná zátěž s převahou izometrie apod.
- Poškození myokardu: vynechání léků, negativně inotropní látky (antiarytmika, alkohol), nesteroidní antirevmatika, nová ischemie či další infarkt, minerální, acidobazický a respirační rozvrat, toxické (předigitalizování, toxické infekce, kardiotoxické léky) a zánětlivé postižení myokardu, retence moče apod.
Nejčastější příčinou CHSS je ischemická choroba srdeční. Pokračují-li projevy srdečního selhání po akutním infarktu nebo vznikne-li srdeční selhání u pacienta s aktuální symptomatickou ischemií (angina pectoris) nebo němou ischemií, je nutné vždy myslet na možný hibernovaný myokard jako příčinu selhání. Zde je indikována revaskularizace (chirurgicky nebo katetrizačně) s následným rychlým zlepšením srdeční funkce a vymizením selhání. Hlavním předpokladem úspěchu je průkaz dostatečně velké oblasti hypofunkčního viabilního myokardu.
Spolupůsobícím faktorem systolického selhání levé komory je často neléčená hypertenze s hypertrofií levé komory. Léčba krevního tlaku se musí stát integrální součástí léčebného plánu s vědomím, že léčebná trojkombinace CHSS (ACE-I, diuretikum, beta-blokátor) je současně základní léčbou hypertenze. Není-li hypertenze kontrolována, je nutné především pátrat po adherenci pacienta k léčbě a po nevhodných lékových interakcích. Hypertenze s koncentrickou hypertrofií levé komory bývá často příčinou diastolického selhání (srdeční selhání se zachovalou ejekční frakcí) a zde je trvalé snížení tlaku hlavním léčebným přístupem.
Příčinou CHSS mohou být též chronické tachyarytmie, které vedou k tzv. tachyarytmické kardiomyopatii se zhroucením systolické funkce, která se po odstranění arytmie během měsíců upravuje. Podobně mohou přispívat k selhání bradyarytmie léčitelné trvalou kardiostimulací, nejlépe biventrikulární.
Nutno vždy myslet na tyreotoxikózu nebo myxedém jako na možné léčitelné příčiny CHSS.
Důležitá je včasná úprava strukturálních patologií, zejména regurgitačních chlopňových vad. U aortální stenózy se nízká ejekční frakce po úspěšném odstranění překážky může normalizovat.
CHSS trpí především staří lidé, u nichž je běžná polymorbidita. Berou řadu léků. Je nutné vyhnout se zbytečnému podávání léků stejných tříd, byť z různých indikací, a znát lékové nežádoucí účinky a interakce. Negativně inotropní účinek mají antiarytmika I. a IV. třídy, proto jsou kontraindikována. Agresivní cytostatická léčba poškozuje myokard, v těchto případech je nezbytné pravidelně kontrolovat srdeční funkci a ve spolupráci s onkologem upravovat terapii. Arytmogenní jsou fenothiaziny, tricyklická antidepresiva I. generace a lithium. Steroidy, dihydropyridiny a nesteroidní antirevmatika mohou zhoršovat otoky.
Všechny infekce je nutné léčit antibiotiky. V případě očekávaných epidemií chřipky je možné kardiakům doporučit očkování.
Mladým ženám s CHSS je vzhledem ke kontraindikaci těhotenství nutné doporučit hormonální kontracepci (je však kontraindikována u žilních tromboembolií, těžké hypertenze a jaterních onemocnění) nebo nitroděložní tělísko (kontraindikováno u chronické antikoagulace, např. u chlopňových protéz, fibrilace síní, embolizací).
6.4. Režimová opatření
6.4.1. Životní aktivita
V úpravě životního stylu hraje základní roli edukace pacienta: nemocný musí své chorobě a jejímu léčení rozumět, aby jeho adherence ke všem postupům byla co nejvyšší. Edukace i duševní podpora mu mají být poskytovány při každé příležitosti zdravotníky i příbuznými. Pacient se má každý den vážit ve stejnou dobu, nejlépe ráno po vyprázdnění. Přírůstek o 1,0 kg ze dne na den již svědčí pro retenci tekutin. Při náhlém vzestupu tělesné hmotnosti o > 2 kg/3 dny si může dobře spolupracující nemocný sám zvýšit dávku diuretika nebo kontaktovat svého ošetřujícího lékaře. Nemocný by měl být informován o tom, jaké léky užívá, proč a jaké mohou mít nežádoucí účinky. Měl by být také informován o lécích, které jsou pro něj nevhodné. Jsou to především:
- nesteroidní antirevmatika (pozor na volně prodejné jako ibalgin, brufen, voltaren, diclofenac, veral) včetně coxibů jsou u těžkého srdečního selhání pro dlouhodobé podání kontraindikována;
- některé blokátory vápníkových kanálů (verapamil, diltiazem, krátkodobě působící dihydropyridiny);
- tricyklická antidepresiva;
- kortikosteroidy.
Doporučení I, úroveň znalostí C
Nemocní ve funkční třídě NYHA I–III mohou bez omezení řídit motorová vozidla pro soukromé účely, profesionální řidiči musí být ve funkční třídě NYHA I nebo II, EF LK > 40 % a bez komorových tachykardií (opakované povinné vyšetření 1krát za rok). Nemocní ve funkční třídě NYHA IV nesmí řídit motorové vozidlo [25].
6.4.2. Dieta
Základem je racionální vyrovnaná dieta s dostatkem všech živin a s cílem udržení optimální hmotnosti. Strava se má podávat v menších dávkách 5–6krát denně, má mít dostatek vlákniny a ovoce (vitaminy B, C, E, minerály – hlavně draslík), nemá být nadýmavá a dráždivá. Černou kávu v množství 1–2 šálky denně je možné povolit. Při nadváze je nezbytná redukční dieta.
Spotřeba kuchyňské soli závisí na tíži onemocnění. I nemocní s mírnějším stupněm srdečního selhání by měli požívat méně než 5 g NaCl denně, a to dříve, než jsou jim ordinována diuretika. K tomu poslouží odstranění solničky ze stolu a vyloučení potravin, které obsahují velké množství soli (uzeniny, bílé pečivo, konzervy, minerálky). Ve stavech závažné městnavé slabosti je vhodné přechodně snížit příjem soli.
Alkohol je absolutně kontraindikován při postižení srdce alkoholem. U ostatních nemocných je povolena umírněná konzumace alkoholu s maximálním denním limitem 40 g pro muže a 30 g pro ženy (což zhruba odpovídá 1 pivu nebo 1–2 dl vína denně).
Kouření je striktně zakázáno.
Tekutiny by neměly být podstatně omezovány, příjem by měl činit 1,5–2 l denně. Omezení tekutin je nutné v pokročilých stadiích srdečního selhání s hyponatremií, ovšem při přísném sledování bilance tekutin a vnitřního prostředí.
Srdeční kachexie: Klinická nebo subklinická malnutrice je přítomna u přibližně 50 % nemocných s pokročilým srdečním selháním. Je důležitým prediktorem špatné prognózy. Podezření na srdeční kachexii by mělo vzniknout při:
- dokumentovaném nechtěném poklesu tělesné hmotnosti o ≥ 5 kg nebo ≥ 7,5 % z předchozí stabilní tělesné hmotnosti bez přítomnosti otoků;
- hodnotě BMI < 22 kg/m2.
Nemocný se srdeční kachexií by se měl pokoušet zvýšit svalovou hmotu pravidelným cvičením. Zvýšení tělesné hmotnosti retencí tekutin je jevem nežádoucím.
Doporučení I, úroveň znalostí C6.4.3. Cvičení
Úroveň fyzické aktivity závisí na aktuálním stavu nemocného. Pohybuje se od klidového režimu, nejlépe v křesle, u nemocných ve funkční třídě NYHA IV až k běžné každodenní zátěži s vyloučením těžké námahy u nemocných ve funkční třídě NYHA I–II. S ohledem na individuální situaci je u mnohých nemocných v třídě NYHA III–IV nutné uvažovat o invalidním důchodu. Je žádoucí, aby nemocní s menším až středním funkčním omezením pravidelně kondičně trénovali. Trénink je indikován u stabilizovaných nemocných ve funkční třídě NYHA I–III bez maligních komorových arytmií a jiných kontraindikací. Základem je 3–5krát týdně 20–30 min dynamické zátěže na úrovni individuální submaximální zátěže (např. jízda na kole nebo rychlá chůze), doplněné denní rytmickou rozcvičkou. Tělesný trénink je možné provádět v rehabilitačních centrech stejně dobře jako doma. Pro domácí cvičení, např. na rotopedu, je vhodné, aby byl nemocný zacvičen v rehabilitačním zařízení, kde je mu zátěžovým testem také stanovena intenzita tréninku. Izometrické, případně rezistenční cvičení (pohyb proti odporu – posilování) je doporučeno pouze pod lékařskou kontrolou. Nutností je naučit nemocného správně dýchat (neprovádět Valsalvův manévr!).
Doporučení I, úroveň znalostí C6.4.4. Cestování
Cestování do příliš horkých krajů a do oblastí s vysokou vlhkostí vzduchu se nedoporučuje. Stejně tak není vhodný pobyt ve vysoké nadmořské výšce. Nedoporučují se dlouhotrvající lety, při kterých hrozí dehydratace, otoky dolních končetin či vznik hluboké žilní trombózy. Naopak, před dlouhodobými cestami autobusem dáváme přednost letecké dopravě.
Doporučení I, úroveň znalostí C6.4.5 Sexuální aktivita
Není možné diktovat sexuální aktivitu. Důležité je uklidnění úzkostného nemocného a jeho často ještě úzkostnějšího partnera. Někdy je vhodné doporučit návštěvu u psychologa. Použití sublinguálního nitroglycerinu před sexuální aktivitou může být vhodné u vybraných nemocných. Použití inhibitorů PDE5 (sildenafil, tadalafil, vardenafil aj.) z důvodu sexuální aktivity je nežádoucí u nemocných s těžkým srdečním selháním (NYHA III–IV) a je absolutně kontraindikováno u nemocných používajících nitráty [26]. Inhibitory PDE5 lze (podle literárních údajů bezpečně) podávat u nemocných léčených antihypertenzivními léky (ACE-I, sartany, beta-blokátory, diuretika, blokátory kalciových kanálů), a to i kombinací několika antihypertenziv současně [26]. Pacienti ve funkční třídě NYHA II mají nízké riziko dekompenzace, pacienti NYHA III–IV vysoké riziko dekompenzace při sexuálním styku.
U žen ve fertilním věku s pokročilým srdečním selháním (závažná dysfunkce LK, NYHA III–IV) se doporučuje ochrana před otěhotněním.
Doporučení I, úroveň znalostí C6.4.6. Očkování proti chřipce
Očkování proti chřipce se v běžné populaci nesmírně podceňuje. Chřipka je ale velmi závažné onemocnění, na které i v 21. století umírá velké množství lidí, zejména pacientů s chronickým onemocněním. Doporučováno je především pro osoby starší 65 let nebo pro osoby s chronickým onemocněním. Data z randomizovaných klinických studií ukazují, že každoroční očkování proti chřipce vede ke snížení morbidity a mortality u nemocných s kardiovaskulárním onemocněním. American Heart Association a American College of Cardiology doporučují při očkování proti chřipce použití inaktivovaných vakcín podávaných intramuskulárně jako součást sekundární prevence u osob s ischemickou chorobou srdeční. Užití živých, oslabených vakcín, aplikovaných intranazálně, se zatím nedoporučuje [27].
Doporučení I, úroveň znalostí C6.5. Farmakologická léčba
6.5.1. Inhibitory ACE (ACE-I)
Inhibitory ACE nepochybně představují největší pokrok v léčbě chronického srdečního selhání na přelomu 20. a 21. století. Jsou dnes při chronickém srdečním selhání i při asymptomatické systolické dysfunkci levé komory léky první volby [1,2]. Pro málokterou skupinu léků existují tak jednoznačné a přesvědčivé důkazy prospěšnosti jako pro inhibitory ACE v léčbě srdečního selhání. Metaanalýza klinických studií ukázala, že průměrný pokles mortality je 23 % a součtu mortality a morbidity (vyjádřené počtem hospitalizací) dokonce 35 %. Vyjádříme-li to jinak, pak léčením 1 000 nemocných se srdečním selháním inhibitory ACE po dobu jednoho roku se zabrání 13 úmrtím, 65 hospitalizacím pro zhoršení srdečního selhání, 99 hospitalizacím z jakéhokoli důvodu.
Na našem trhu je k dispozici řada inhibitorů ACE, lišících se především farmakokinetickými vlastnostmi. Tak např. captopril má krátkodobý účinek a je ho třeba podávat 3krát denně, enalapril a quinapril se podávají 2krát denně, ostatní se podávají většinou 1krát denně. Rozdíly v jejich účincích a ve výskytu nežádoucích účinků jsou však nepodstatné [28,29]. Vzhledem k individuální hypotenzní odpovědi nemocných a možnému zhoršení renálních funkcí (zejména u starších nemocných s preexistující chronickou renální insuficiencí) je nutné léčbu zahajovat malou, tzv. testovací dávkou a dávku postupně zvyšovat až do maximální tolerované. Přehled inhibitorů ACE a jejich doporučené dávkování při chronickém srdečním selhání jsou uvedeny v tab. 9 (uvádíme jen ty inhibitory ACE, které mají prokázaný účinek v mortalitních studiích) [30–34].
Tab. 9. Doporučené denní dávky inhibitorů ACE při chronickém srdečním selhání. 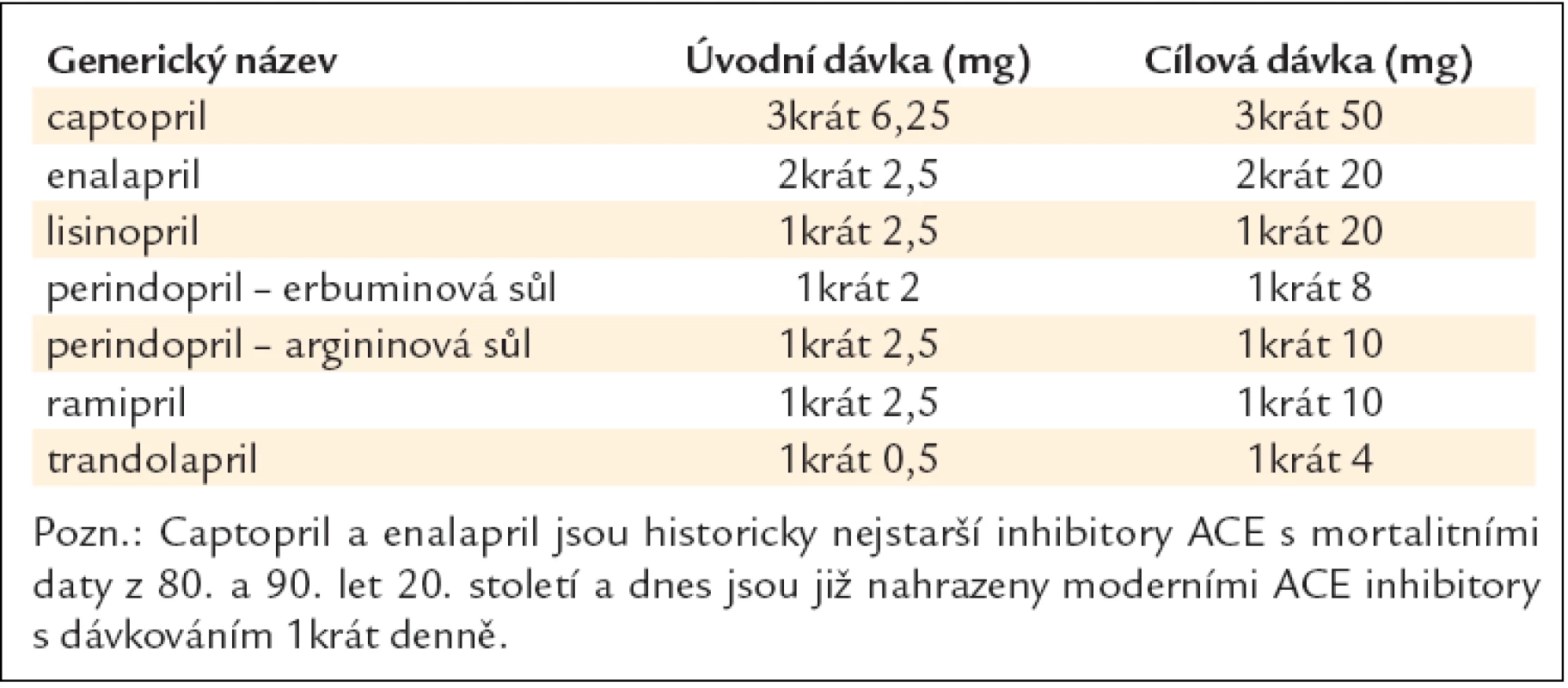
Doporučení I, úroveň znalostí A
U nemocných s diastolickým srdečním selháním (HFPEF) byly ACE-I zkoumány v několika menších klinických studiích, kde se ukázaly jako bezpečné, zlepšovaly některé echokardiografické parametry a zvyšovaly toleranci zátěže. První ukončená, randomizovaná, dvojitě slepá morbiditně-mortalitnístudie PEP CHF prokázala bezpečnost, zlepšení kvality života a snížení počtu hospitalizací [35]. Studie I Preserve prospěch irbesartanu neprokázala [36]. Na základě těchto výsledků považujeme ACE inhibitory za možný lék u dia stolického srdečního selhání (zvláště při hypertrofii levé komory).
Doporučení IIa, úroveň znalostí BInhibitory ACE jsou dobře snášeny. Nežádoucí účinky nejsou, s výjimkou hypotenze a dráždivého kašle, časté. Jsou to zhoršení renální insuficience, častější u starých lidí, kožní vyrážky, angioneurotický edém, poruchy chuti, vzácně leukopenie a glomerulopatie s proteinurií. Nebezpečná může být kombinace s kalium šetřícími diuretiky (vyjma malých dávek spironolactonu) nebo pokračující suplementace kalia při současné diuretické léčbě pro možný vznik hyperkalemie. Kontraindikací je těžká renální insuficience, přesná hodnota kreatininu či glomerulární filtrace však není stanovena a doporučuje se vždy alespoň malou dávku ACE-I vyzkoušet za kontroly renálních funkcí (ve většině klinických studií byla hladina kreatininu > 180 μmol/l vylučovacím kritériem). Další kontraindikace jsou hyponatremie a hypovolemie po předchozí masivní diuretické léčbě, absolutní kontraindikací pak oboustranná stenóza renálních tepen a výskyt angioneurotického edému v anamnéze a těhotenství (pro teratogenní účinky). Suchý dráždivý kašel se objevuje u 5–10 % nemocných a obvykle vede k nutnosti vysazení inhibitoru ACE. Výměna přípravku za jiný obvykle nepomůže, vzácně kašel vymizí po snížení dávky. Při suchém kašli je indikována záměna inhibitorů ACE za blokátor receptorů pro angiotenzin II (ARB, sartan).
Tab. 10 ukazuje postup při zahájení léčby inhibitory ACE.
Tab. 10. Postup při zahájení léčby inhibitory ACE. 
6.5.2. Blokátory receptoru 1 pro angiotenzin II (ARB – angiotenzin receptor blocker)
Blokáda renin-angiotenzinového systému inhibitory ACE má několik limitací. Především je to častý výskyt suchého dráždivého kašle jako důsledek zpomalené degradace bradykininu, který je v 5–10 % případů příčinou nutnosti ukončit léčbu inhibitory ACE. Další nevýhodou je možná aktivace non-ACE cest konverze angiotenzinu I na angiotenzin II (chymázová cesta a další), což může vést k poklesu účinku inhibitorů ACE. Tyto cesty jsou aktivovány především při dlouhodobém podávání ACE-I. Navíc některé inhibitory ACE blokují aktivitu především plazmatického ACE, mnohem méně již tkáňového ACE. V poslední době se dále zdůrazňuje význam jednotlivých receptorů pro angiotenzin II.
První klinické studie s ARB u chronického srdečního selhání prokázaly zlepšení hemodynamických parametrů a zlepšení tolerance zátěže. Další studie prokázaly srovnatelný efekt ARB na mortalitu a morbiditu nemocných jako ACE-I. Přidání ARB k ACE-I již k dalšímu snížení mortality nevedlo, ve studii VALIANT po infarktu myokardu vedlo dokonce ke zvýšení nežádoucích účinků, ve studii CHARM added na opak ke snížení hospitalizací [37].
Dosavadní poznatky o blokátorech receptoru 1 pro angiotenzin II u srdečního selhání a po infarktu myokardu můžeme shrnout:
- indikace ARB jsou shodné s indikacemi pro ACE-I, ARB jsou jednoznačně indikovány při intoleranci ACE-I;
Doporučení I, úroveň znalostí A
- nemáme důkaz o tom, že ARB jsou lepší než ACE-I, proto lékem volby u srdečního selhání jsou jen při intoleranci ACE-I;
- výhody kombinační léčby ACE-I a ARB vzhledem k úmrtnosti nebyly potvrzeny; vhodná je tato kombinace u nemocných s nedostatečně kontrolovanou hypertenzí nebo s výraznější proteinurií; kombinační léčba snižuje počet hospitalizací pro srdeční selhání a vyžaduje pečlivé kontroly.
Doporučení IIa, úroveň znalostí B
Doporučené úvodní a cílové dávky ARB (uvádíme pouze ARB, u nichž existují mortalitní studie u srdečního selhání) ukazuje tab. 11.
Tab. 11. Doporučené denní dávky AII antagonistů při chronickém srdečním selhání. 
Podobně jako u inhibitorů ACE zahajujeme léčbu dávkou rovnající se asi 1/4 cílové dávky a v týdenních až 14denních intervalech titrujeme dávky k cílovým hodnotám.
Studie HEAAL sledovala účinek nižší a vyšší dávky losartanu: 50 mg vs 150 mg. Prokázala snížení úmrtí nebo hospitalizace pro srdeční selhání u vyšší dávky. Dále došlo k častějšímu subjektivnímu zlepšení klinického stavu s malým rizikem nežádoucích účinků [38].
Doporučení I, úroveň znalostí BPoznámka: V III. fázi klinického zkoušení jsou přímé inhibitory reninu, konkrétně aliskiren. V klinické studii ALOFT (Aliskiren Observation of heart Failure Treatment) u nemocných se stabilním srdečním selháním snížil významně plazmatickou reninovou aktivitu a hladiny BNP. Mortalitní studie u nemocných se srdečním selháním s akronymem ATMOSPHERE a ASTRONAUT s tímto preparátem probíhají.
6.5.3. Beta-blokátory (BB)
Beta-blokátory jsou doporučeny všem symptomatickým nemocným se srdečním selháním (NYHA II–IV) ve stabilizovaném stavu jak ischemické, tak neischemické etiologie a sníženou EF, pokud nemají kontraindikace podávání. Jejich příznivý vliv na mortalitu, funkční zlepšení a oddálení progrese srdečního selhání byl pozorován bez rozdílu pohlaví, věku, funkční klasifikace a hodnoty ejekční frakce v klinických studiích.
Doporučení I, úroveň znalostí APo infarktu myokardu jsou BB indikovány vždy (vyjma KI) i u nemocných s asymptomatickou dysfunkcí levé komory (NYHA I) v kombinaci s ACE-I/sartany. To bylo prokázáno studií CAPRICORN [39].
Doporučení I, úroveň znalostí BVzhledem k různým klinickým účinkům beta-blokátorů u srdečního selhání jsou pro léčbu doporučeny pouze ty BB, které mají jednoznačná pozitivní mortalitní data z dvojitě slepých, multicentrických studií: bisoprolol, carvedilol, metoprolol sukcinát ZOK a nebivolol [40].
Doporučení I, úroveň znalostí AOvlivnění mortality beta-blokátory je aditivní k účinkům inhibitorů ACE (CARMEN). Nejde tedy o konkurenční skupiny léků, optimální je jejich kombinace. Příznivý účinek beta-blokátorů je vysvětlován především snížením aktivace sympatoadrenálního systému, snížením srdeční frekvence, prodloužením diastolické periody a účinkem anti arytmickým [41].
Jak ukázala studie CIBIS III, je možné zahájit léčbu srdečního selhání buď beta-blokátorem a přidat inhibitor ACE, nebo naopak. Nejvhodnější u lehčích forem selhání se známkami sympatikotonie je začít beta-blokátory a po skončení titrace přidat inhibitory ACE či sartany, u těžších forem stabilizovat nemocného ACE-I/ARB, event. s diuretiky, a poté zahájit titraci beta-blokátory. Důležité je podávat vždy obě lékové skupiny, pokud nejsou přítomny kontraindikace [42].
Léčba beta-blokátory by měla být u srdečního selhání zahájena a vedena pod dohledem zkušeného lékaře s kardiologickým zaměřením. Pouze nemocní s těžkými formami CHSS (NYHA III–IV), relativními kontraindikacemi (sklon k bradykardii, nízký krevní tlak), s podezřením na chronickou obstrukční plicní nemoc (CHOPN) musí být léčeni pod vedením kvalifikovaného kardiologa. Zhruba asi u 25 % nemocných totiž dochází v prvních týdnech k přechodnému hemodynamickému a symptomatickému zhoršení. Může se zhoršit dušnost, otoky, výkonnost nemocného apod. Na to je třeba reagovat úpravou medikace, např. zintenzivněním diuretické léčby, event. přidáním digoxinu. Léčba se musí zahajovat u klinicky stabilizovaného nemocného bez inotropní podpory, velmi nízkými dávkami a dávka se pak zvolna a opatrně titruje, obvykle tak, že se zdvojnásobuje každé 2 týdny až do dosažení cílové udržovací dávky. Doporučené postupy při zahájení a zhoršení při léčbě jsou uvedeny v tab. 12, doporučené dávky v tab. 13 (uvádíme pouze BB, u nichž existují mortalitní studie u srdečního selhání) [1].
Tab. 12. Doporučené postupy při zahájení léčby a postup při zhoršení při léčbě BB. 
Tab. 13. Doporučené denní dávky beta-blokátorů při chronickém srdečním selhání. 
Musíme respektovat absolutní kontraindikace beta-blokátorů: asthma bronchiale, těžké formy CHOPN, symptomatické bradykardie a hypotenze. U relativních kontraindikací vždy zvažujeme riziko vs prospěch: diabetes mellitus s možnými hypoglykemickými stavy, lehčí formy CHOPN (zde provést před nasazením spirometrické vyšetření s následným otestováním BB), ICHDK.
6.5.4. Diuretika
Diuretika představují symptomatický základ léčby nemocného s městnáním v plicním nebo systémovém oběhu, ovšem v kombinaci s inhibitorem ACE a beta-blokátorem. Diuretika nepodáváme u nemocných asymptomatických, bez otoků a bez dušnosti. Při mírném stupni selhání jsou lékem volby thiazidová diuretika, při těžším stupni diuretika kličková (u nás nejčastěji furosemid). Při nedostatečné odpovědi lze léky z těchto skupin kombinovat [43].
Doporučení I, úroveň znalostí CDiuretika jako léky u plicního městnání nebo periferních otoků s ústupem dušnosti a zvýšením tolerance zátěže jsou indikována jednoznačně.
Diuretika však nemají dvojitě slepou, mortalitní studii, jsou podávána ve většině případů v kombinaci s léky ovlivňujícími renin angiotenzinový systém a beta-blokátory [44].
Doporučení I, úroveň znalostí CU těžkých forem srdečního selhání, v případě špatné léčebné odpovědi na kličková diuretika je výhodná kombinace jak kličkových, tak thiazidových diuretik [45].
Dávkování diuretik je uvedeno v tab. 14.
Tab. 14. Doporučené denní dávky diuretik při chronickém srdečním selhání. 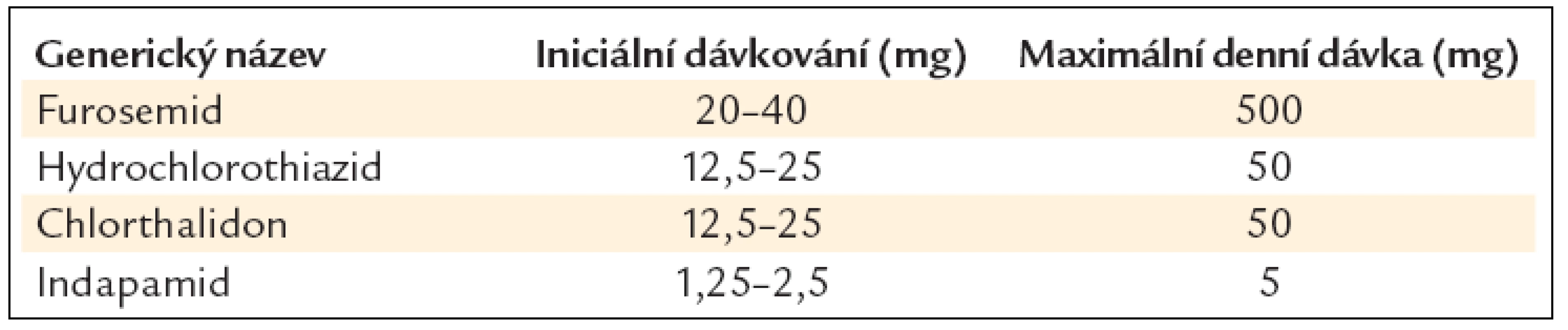
Základní zásadou pro dávkování diuretik je snaha, aby nemocný neměl příznaky městnání a retence tekutin a na druhé straně nebyl dehydratován. Nemocný, se kterým je dobrá spolupráce, může měnit dávku diuretik podle svého aktuálního stavu, např. podle denní hmotnosti. Léčbu zahajujeme nižšími dávkami spolu s ACE-I/sartany, při poklesu glomerulární filtrace (GF) pod 0,5 ml/s nedáváme thiazidová diuretika (jsou neúčinná), ale zaměníme je za diuretika kličková (furosemid).
Je nutné aktivně sledovat nežádoucí účinky diuretik: hypovolemii, zhoršení renálních funkcí, hypokalemii, hypomagnezemii, hyponatremii, hyperurikemii, poruchu glukózové tolerance, poruchy acidobazické rovnováhy, u amiloridu naopak hyperkalemii.
Při nedostatečné diuretické odpovědi: zvýšíme dávku na 2krát denně,kombinujeme kličková a thiazidová diuretika, pátráme, zda nemocný neužívá nesteroidní antifl ogistika či jiné léky snižující diurézu.
Nyní jsou v klinických studiích ověřována aquaretika – antagonisté vazopresinu (tolvaptan, conivaptan, lixivaptan), která se jeví velmi nadějnými u nemocných s hyponatremií a zhoršeným srdečním selháním, i když studie EVEREST zatím jejich prospěch oproti kličkovým diuretikům neprokázala [46].
6.5.5. Blokátory aldosteronu (BRA)
Hyperaldosteronizmus, který jako součást neuroendokrinní aktivace provází srdeční selhání, způsobuje depleci draslíku a hořčíku, v myokardu způsobuje fibrózu a blokuje zpětné vychytávání noradrenalinu. Zhoršuje tak funkci myokardu a zvyšuje sklon k arytmiím. V cévním řečišti zhoršuje funkci endotelu, zhoršuje poddajnost tepen zvýšením obsahu kolagenu a poškozuje mikrocirkulaci (změny až charakteru vaskulitidy). Zvýšená hladina aldosteronu je jen omezeně a dočasně ovlivněna podáním inhibitorů ACE nebo antagonistů angiotenzinových receptorů („aldosterone escape“).
Na základě výsledků studie RALES (Randomized Aldactone Evaluation Study), která prokázala příznivé ovlivnění prognózy (redukce mortality o 30 %) a symptomatologie, je indikována léčba nízkými dávkami spironolaktonu u nemocných s ejekční frakcí levé komory (EF LK) < 35 %, kteří jsou ve funkční třídě NYHA III–IV nebo měli recentně epizodu oběhové dekompenzace a jsou léčeni kličkovým diuretikem. Recentní studie EMPHASIS-HF s novým antagonistou aldosteronu eplerenonem ukázala jeho příznivý vliv i na lehčí formy srdečního selhání [47].
Základní dávkování obou přípravků je 25 mg denně. V případě tendence k hyperkalemii při této dávce má být dávka snížena na polovinu, případně má být upravena ostatní medikace, vysazení BRA je až poslední volbou. V případě refrakterního srdečního selhání bez hyperkalemie při základní dávce lze případně zvýšit dávku na 50 mg denně za pečlivé monitorace draslíku, neboť hrozí nebezpečí hyperkalemie (tab. 15 a 16) [48].
Tab. 15. Strategie podávání blokátorů receptorů pro aldosteron. 
Tab. 16. Doporučené denní dávky blokátorů receptorů pro aldosteron při chronickém srdečním selhání. 
Doporučení I, úroveň znalostí A
6.5.6. Digoxin
Z digitalisových glykosidů se v současnosti u nás používá výhradně digoxin. Byla s ním provedena jediná mortalitně/morbiditní studie, a to ještě předtím, než se v léčbě chronického srdečního selhání začaly rutinně používat beta-blokátory [49]. Podle výsledků studie DIG neovlivňuje digoxin při srdečním selhání celkovou mortalitu, ale snižuje počet hospitalizací pro zhoršení srdečního selhání a mortalitu na srdeční selhání. Naopak nevýznamně zvyšuje ostatní kardiovaskulární mortalitu. Dodatečné analýzy výsledků této studie ukázaly zvýšené riziko úmrtí při užívání digoxinu u žen, ale nikoli u mužů [52]. Digoxin tedy zlepšuje symptomatický stav nemocných se srdečním selháním, ale neovlivňuje jejich prognózu. Zmírnění symptomů nemocných se zdá být tím větší, čím těžší je systolická dysfunkce levé komory a čím jsou nemocní symptomatičtější. Výsledky studie DIG podporuje i metaanalýza menších studií [51].
Jednoznačnou indikací k chronickému podávání digoxinu je symptomatické chronické srdeční selhání při systolické dysfunkci levé komory při současné fibrilaci síní s rychlou odpovědí komor. Při asymptomatické systolické dysfunkci levé komory spojené s fibrilací síní může být digoxin použit ke kontrole srdeční frekvence. Digoxin ale kontroluje srdeční frekvenci pouze v klidu, nikoli při zátěži. Proto mají dnes v této indikaci přednost beta-blokátory, event. jejich kombinace s dioxinem.
Doporučení I, úroveň znalostí CRozporuplné zůstává podávání digoxinu při srdečním selhání a sinusovém rytmu. Digoxin si pro některé výhody stále zachovává širokou oblibu. Může být podáván jednou denně, má velmi dobrou krátkodobou i dlouhodobou snášenlivost, nevzniká při něm tachyfylaxe a je velmi levný. Současný konsenzus je, že digoxin může být při sinusovém rytmu symptomaticky prospěšný u nemocných s manifestním srdečním elháním a těžší systolickou dysfunkcí levé komory. U těchto nemocných by měl být vyzkoušen, a pokud vede ke klinickému zlepšení, měl by být podáván chronicky. Pokud ke klinickému zlepšení nevede, mělo by být jeho podávání ukončeno.
Doporučení IIa, úroveň znalostí BU srdečního selhání se zachovanou ejekční frakcí (HFPEF) je digoxin indikován pouze ke kontrole srdeční frekvence při současné fibrilaci síní s rychlou odpovědí komor. Při sinusovém rytmu nepřináší žádný prospěch.
Doporučení IIb, úroveň znalostí BDigoxin není vhodný u srdečního selhání při akutním infarktu myokardu a sinusovém rytmu, kdy je jeho účinek nevypočitatelný a může vyvolat závažné arytmie. Kontraindikován je při výrazné bradykardii, síňokomorových blokádách II.–III. stupně bez zajištění kardiostimulací, sick sinus syndromu, syndromu karotického sinu, WPW syndromu, obstrukční formě hypertrofické kardiomyopatie, hypokalemii, hyperkalcemii a při předchozí intoleranci digoxinu. Neúčinná je digitalizace při chronickém cor pulmonale, při mitrální stenóze se zachovaným sinusovým rytmem, perikardiální tamponádě a konstriktivní perikarditidě.
Doporučení I, úroveň znalostí BPřed zahájením léčby digoxinem je třeba stanovit renální funkce a kalemii. Obvyklá denní dávka je 0,125–0,25 mg per os, u starších lidí 0,0625–0,125 mg. Pro chronickou léčbu není třeba počáteční vysycovací dávka. Digoxin se vylučuje téměř úplně ledvinami, jeho clearence je podobná clearence kreatininu. Při renální insuficienci je proto nutné denní dávku redukovat, nejlépe s použitím nomogramů nebo různých vzorců. Některé léky interferují s farmakokinetikou digoxinu a mohou významně zvýšit jeho biologickou dostupnost až na dvojnásobek (chinidin, propafenon, amiodaron, verapamil aj.), proto je nutné denní dávku digoxinu příslušně upravit. Léčebné sérové koncentrace digoxinu jsou 0,55–0,9 ng/ml [52].
Toxicita: Protože digitalisové glykosidy mají malou terapeutickou šíři, může snadno dojít k intoxikaci, a to buď při předávkování, nebo v situacích, které zvyšují citlivost myokardu na digoxin (ischemie, hypokalemie, hyperkalcemie, hypotyreóza, vyšší věk). Intoxikace se projevuje únavou, závratěmi, anorexií, nauzeou a zvracením. Zvyšuje se elektrická dráždivost myokardu se vznikem arytmií. Typické jsou síňové tachykardie se síňokomorovým blokem 2 : 1, sinoatriální nebo síňokomorové blokády, bigeminicky vázané komorové extrasystoly. Mohou se objevit i život ohrožující komorové tachykardie typu „torsades de pointes“. V učebnicích popisované zrakové poruchy (např. žluté vidění) jsou velmi vzácné. Stanovení sérové hladiny digoxinu má pouze orientační význam, při hladinách vyšších než 2,5 ng/ml však lze toxické příznaky očekávat takřka vždy. Nemocní s digitalisovou intoxikací mají vysokou mortalitu, patří proto na koronární jednotku. Hlavní léčebná opatření jsou shrnuta v tab. 17.
Tab. 17. Léčebná opatření při digitalisové intoxikaci. 
6.5.7. Antiagregace, antikoagulace
Klinická data z observačních studií ukazují, že nemocní se srdečním selháním mají vyšší riziko cévního tromboembolizmu (hluboká žilní trombóza, plicní embolie, periferní arteriální embolizace a cévní mozková příhoda) [53].
Tromboembolické příhody jsou třetí nejčastější příčinou úmrtí u nemocných se srdečním selháním [54,55]. Příčinou je kromě velmi časté fibrilace síní také aktivace koagulace v důsledku porušené funkce destiček, endotelové dysfunkce a prozánětlivé aktivace nejen u nemocných s fibrilací síní, ale i u nemocných se sinusovým rytmem a tyto poruchy jsou úměrné stupni levokomorové dysfunkce a závažnosti příznaků [56].
Nemáme důkazy o tom, že by chronická antitrombotická léčba vedla k snížení mortality nebo počtu cévních příhod u nemocných se srdečním selháním, a všechna data jsou získána jen z retrospektivních sledování. V klinické praxi dosud neumíme dostatečně přesně vybrat nemocné ohrožené trombotickými komplikacemi. U srdečního selhání proběhly prospektivní studie srovnávající účinnost antiagregační léčby s kyselinou acetylsalicylovou (182 mg denně) nebo clopidogrelem (75 mg denně) s antikoagulační léčbou warfarinem – studie WASH (pilotní projekt) následovaný vlastní studií WATCH. Metaanalýza těchto studií ukázala mírný trend ve prospěch snížení mortality warfarinem ve srovnání s kyselinou acetylsalicylovou s clopidogrelem. V současné době probíhá studie WARCEF (Warfarin Aspirin Reduced Cardiac Ejection Fraction) srovnávající antikoagulační a antiagregační léčbu u nemocných s chronickým srdečním selháním a sinusovým rytmem.
O účinnosti antiagregační léčby u nemocných se srdečním selháním a sinusovým rytmem se vedou spory, protože kyselina acetylsalicylová (ASA) může oslabovat účinek inhibitorů ACE z důvodu snížení syntézy prostaglandinů v ledvinách a tato nepříznivá interakce může vést k vyšší četnosti zhoršení srdečního selhání [57].
Dnes doporučujeme léčbu kyselinou acetylsalicylovou všem nemocným, u kterých je příčinou srdečního selhání prokázaná ischemická choroba srdeční, a to v dávce mezi 75 mg a 160 mg/den, opatrnosti je třeba u osob s refrakterním srdečním selhá ním s častým opakováním dekompenzací, zde zvažujeme prospěch vs riziko.
Doporučení IIa, úroveň znalostí BSrovnání kyseliny acetylsalicylové a warfarinu u nemocných se srdečním selháním ischemické etiologie ve studii HELLAS neukázalo rozdíl mezi skupinami, obdobně nebyl nalezen rozdíl mezi warfarinem a placebem u nemocných s dilatační kardiomyopatií [58].
U nemocných s fibrilací síní je antikoagulační léčba plně indikována, neboť u těchto nemocných výrazně snižuje počet tromboembolických příhod oproti placebu i oproti ASA.
Antikoagulační léčba je indikována u nemocných s CHSS a:
- s anamnézou systémové nebo plicní embolizace,
- s fibrilací síní,
- s intrakardiálním trombem,
- po rozsáhlém Q infarktu myokardu
přední stěny s aneuryzmatem, - s výraznou dilatací levé komory neischemické
etiologie, - s ejekční frakcí pod 20 %.
Účinná antikoagulace je při INR 2,0–3,5, neúplná antikoagulační léčba s INR < 2,0 je neúčinná.
Heparin, nebo lépe nízkomolekulární hepariny jsou lékem volby při akutní dekompenzaci, plicní embolii, čerstvém intrakardiálním trombu, venózní trombóze, předoperační a pooperační přípravě.
Doporučení I, úroveň znalostí ADabigatran je indikován u nemocných s fibrilací síní se srdečním selháním i bez něj v prevenci cévní mozkové příhody při kontroindikaci warfarinu.
6.5.8. Hypolipidemická léčba
Příčinou srdečního selhání je přibližně u 2/3 nemocných ICHS a přibližně 1/2 nemocných prodělala infarkt myokardu. Na tyto nemocné se aplikovaly výsledky statinových studií a na jejich základě se jim podávaly statiny. Doklad o tom, že hypolipidemická léčba statiny zlepšuje prognózu nemocných s chronickým srdečním selháním, však chyběl, protože prakticky ze všech statinových studií byli nemocní s manifestním srdečním selháním vyloučeni.Teprve klinické studie CORONA [59] a GISSI-HF [60], které byly navrženy specificky k tomu, aby zhodnotily význam statinů u srdečního selhání, přinesly dosud chybějící odpovědi. Do studie CORONA byli zařazeni pouze nemocní se systolickým srdečním selháním ischemické etiologie, zatímco do studie GISSI-HF byli zařazeni nemocní s chronickým srdečním selháním bez ohledu na jeho etiologii i hodnotu EF. Výsledky obou studií však byly prakticky stejné. Rosuvastatin v nich sice snížil počet kardiovaskulárních hospitalizací, ale neovlivnil výskyt velkých kardiovaskulárních příhod ani kardiovaskulární mortalitu.
Výsledky podstudií ze studie CORONA však ukázaly, že u nemocných s chronickým systolickým srdečním selháním existují významné interakce mezi účinkem rosuvastatinu a jednak plazmatickou koncentrací natriuretických peptidů, jednak koncentrací hsCRP [60,61]. Rosuvastatin přináší klinický prospěch u nemocných s nízkou plazmatickou koncentrací natriuretických peptidů, tedy dobře kompenzovaných, zatímco u těch, kteří mají vysoké koncentrace natriuretických peptidů, je bez klinického efektu [62]. Podobně přináší rosuvastatin klinický prospěch u nemocných s vysokým hsCRP, zatímco u těch, kteří mají hsCRP normální (< 2 mg/l), je bez efektu [61].
Není důvod k tomu, aby se u nemocných s chronickým srdečním selháním, kteří statin již užívají, např. po prodělaném infarktu myokardu v rámci sekundární prevence, statin vysazoval. Na druhé straně neexistuje důvod, aby se nemocnému s chronickým srdečním selháním, který dosud statin neužívá, nově nasazoval [63]. Výsledky podstudií studie CORONA s natriuretickými peptidy a hsCRP naznačují, že u některých podskupin nemocných, např. s dobře kompenzovaným srdečním selháním, a tudíž relativně nízkou plazmatickou koncentrací BNP neboNT-proBNP a/nebo vysokou koncentrací hsCRP, může být léčba statinem pravděpodobně spojena s významným klinickým prospěchem. Tyto předpoklady je však nutné potvrdit dalším klinickým výzkumem.
Doporučení IIb, úroveň znalostí B6.5.9. Blokátory If kanálu – ivabradin
Klidová srdeční frekvence nad 70/min u nemocných se srdečním selháním a sinusovým rytmem je považována za nepříznivý prognostický ukazatel. Studie BEAUTIFUL a hlavně SHIFT prokázaly příznivý vliv ivabradinu, léku, který inhibuje If kanály v sinusovém uzlu, a zpomaluje tak srdeční frekvenci bez dalších negativních vlivů na myokard. Studie SHIFT srovnávala účinek ivabradinu s placebem u 6 558 nemocných se srdečním selháním ischemické i neischemické etiologie, funkční klasifikace NYHA II–III, s klidovou srdeční frekvencí nad 70/min, kteří měli optimální léčbu srdečního selhání, včetně maximálně tolerované dávky beta-blokátorů. Studie prokázala významný pokles výskytu rizika primárního cíle – kardiovaskulární úmrtnosti a hospitalizací pro srdeční selhání o 18 % ve skupině léčené ivabradinem. Také pokles rizika úmrtí pro srdeční selhání byl nižší o 26 % v aktivní léčené skupině. Ivabradin byl dobře snášen s minimálními vedlejšími účinky [64,65].
Ivabradin je indikován u nemocných s kompenzovaným srdečním selháním a sinusovým rytmem, kteří při maximálně tolerované dávce beta-blokátorů mají klidovou srdeční frekvenci nad 70/min (resp. nad 75/min). Je třeba odlišit, kdy je tachykardie kompenzačním mechanizmem u nemocných s nízkým srdečním výdejem. Doporučená úvodní dávka je 2krát 5 mg, maximální denní dávka 2krát 7,5 mg.
Doporučení I, úroveň znalostí B6.6. Doporučení pro farmakologickou léčbu systolického srdečního selhání
6.6.1. Asymptomatická dysfunkce LK
Při průkazu výrazné dysfunkce LK (EF < 35 %) je indikováno podávání inhibitorů ACE. Tento přístup prokazatelně snižuje úmrtnost, zvláště u nemocných po prodělaném srdečním infarktu. U komorové dysfunkce po srdečním infarktu jsou navíc indikovány beta-blokátory. Při fibrilaci síní je třeba se pokusit obnovit sinusový rytmus.
Doporučení I, úroveň znalostí C6.6.2. Symptomatická systolická dysfunkce LK (NYHA II–III)
U nemocných bez retence tekutin je indikováno podání inhibitorů ACE v kombinaci s beta-blokátory, u nemocných se známkami retence tekutin je vhodná kombinace inhibitorů ACE, beta-blokátorů a diuretik. Po ústupu známek městnání se pokračuje léčbou inhibitorem ACE, beta-blokátorem, případně s podáváním malé dávky diuretika a antagonistou aldosteronu. U nemocných s fibrilací síní, výraznou dilatací levé komory a/nebo s přítomností protodiastolického cvalu je indikováno podání digoxinu. Pacienti, kteří mají sinusový rytmus, dostávají digoxin, a zlepší-li se jejich stav, měli by v podávání pokračovat. U pacientů, kteří zůstávají symptomatičtí nebo jejichž stav se zhorší, lze zvážit podání blokátoru receptoru 1 pro angiotenzin II. U nemocných, u kterých je i přes léčbu cílovou nebo nejvyšší tolerovanou dávkou beta-blokátoru (event. v kombinaci s digoxinem) klidová frekvence sinusového uzlu větší než 70/min, je indikace k podávání ivabradinu [65].
Doporučení I, úroveň znalostí B6.6.3. Zhoršující se srdeční insuficience (NYHA III–IV)
Progrese srdeční insuficience může být způsobena nepatřičnou změnou léčby, špatnou spoluprací nemocného nebo jinými zhoršujícími faktory (ischemie myokardu, arytmie, infekce, plicní embolie, hypertenze). Prvním krokem je zjištění a léčba příslušného vyvolávajícího faktoru. Vlastní léčba zhoršeného srdečního selhání spočívá v úpravě diuretické léčby (zvýšení dávky, intravenózní podání, kombinace kličkového diuretika s thiazidy).
- a) Postupné zhoršování stavu (objektivizované snížením tolerance zátěže a vzestupem BNP) vyžaduje zvýšení dávky diuretika, podání blokátoru aldosteronu, popřípadě digoxinu. U nemocných dlouhodobě léčených inhibitorem ACE je vhodné zvážit kombinaci ACE-I a ARB.
- b) Rychlé zhoršení stavu klasifikujeme jako dekompenzaci srdečního selhání. Převažují-li známky retence tekutin, je nutná především intenzifikovaná diuretická léčba. Léčbu inhibitory ACE a beta-blokátory nepřerušujeme. Při známkách nízkého srdečního výdeje je nutné použít farmaka k inotropní podpoře (katecholaminy, levosimendan, inhibitory fosfodiesterázy III). Závažnější formy dekompenzace vyžadují hospitalizaci nemocného na dobu dostatečnou dlouhou k úpravě stavu a poklesu BNP.
Ve všech stadiích srdeční insuficience je nutné zvážit indikaci k nefarmakologickým léčebným postupům – resynchronizační léčbě, implantaci kardioverteru-defibrilátoru (viz 6.10.1 až 6.10.5), revaskularizaci myokardu (viz 6.13.1), event. zvážit operaci chlopní (viz 6.13.3 a 6.13.4)
Doporučení I, úroveň znalostí A–C6.6.4. Terminální srdeční insuficience
U nemocného v tomto stadiu se zvažuje transplantace srdce. Přechodné zhoršení lze zvládnout pomocí farmakologické podpory (katecholaminy, levosimendan, inhibitory fosfodiesterázy III), zavedením mechanické podpory nebo ultrafiltrace či dialýzy. Tyto postupy mají obvykle dočasný účinek a dovolují nám pouze překlenout dobu do provedení srdeční transplantace.
Paliativní léčba zahrnuje podání opiátů na odstranění symptomů.
Doporučení IIa, úroveň znalostí CZásady farmakologické léčby chronického systolického srdečního selhání shrnuje tab. 18.
Tab. 18. Zásady léčby chronického srdečního selhání. 
6.7. Doporučení pro farmakologickou léčbu diastolického srdečního selhání (srdečního selhání se zachovanou ejekční frakcí – HFPEF)
Na rozdíl od systolického srdečního selhání máme pro léčbu diastolického srdečního selhání (srdečního selhání se zachovanou ejekční frakcí – HFPEF) stále nedostatek důkazů z klinických studií. Situace je navíc komplikována také tím, že se stále používají různé termíny – diastolické srdeční selhání a srdeční selhání se zachovanou ejekční frakcí (systolickou funkcí). Nemusí jít vždy o identické stavy a ani jejich léčba nemusí být nezbytně totožná.
Nemocní se srdečním selháním se zachovanou ejekční frakcí byli studováni jen v několika málo mortalitně-morbiditních klinických studiích. Léčba candesartanem ve studii CHARM Preserved, perindoprilem ve studii PEP CHF nebo irbesartanem ve studii I Preserve nevedla k poklesu kardiovaskulární mortality [35,36].
Při absenci přesvědčivých důkazů je farmakologická léčba diastolického srdečního selhání převážně spekulativní a empirická, i když založená na dobrých teoretických předpokladech. Nejčastějšími příčinami diastolické dysfunkce jsou ischemie myokardu, hypertenze a hypertrofie myokardu. Tyto vyvolávající příčiny by vždy měly být správně identifikovány a adekvátně léčeny. To jsou nepochybně ta nejdůležitější a nejúčinnější preventivní i léčebná opatření. Také stavy, které zhoršují diastolickou dysfunkci, by měly být co nejdříve rozpoznány a odstraněny. Jedná se především o tachyarytmie a z nich nejčastěji o fibrilaci síní. Kdykoli to je možné, měl by být obnoven a udržen sinusový rytmus. Důležitá je také kontrola srdeční frekvence, protože při tachykardii se diastolická funkce obou komor zhoršuje.
Neexistují žádné léky, které by specificky zlepšovaly relaxaci myokardu (měly pozitivně lusitropní účinek) nebo přímo zlepšovaly diastolickou funkci komor. Některé léky ji ale mohou zlepšovat nepřímo, např. zpomalením srdeční frekvence a prodloužením diastolické periody nebo regresí hypertrofie myokardu. Máme k dispozici jen útržkovité a velmi nepřesvědčivé informace z klinických studií o prospěšnosti některých léků. Prozatím lze pro praxi formulovat pouze obecné cíle a zásady léčby diastolického srdečního selhání [3]:
- důsledně kontrolovat hypertenzi: všechna antihypertenziva, zejména pak inhibitory ACE a blokátory receptorů pro angiotenzin II (ARB), které mohou zlepšit relaxaci a navodit regresi hypertrofie a fibrózy myokardu;
- předcházet a léčit ischemii myokardu: co nejúplnější revaskularizace; z antiischemických léků jsou nejvhodnější beta-blokátory, které zlepšují diastolickou funkci také svým bradykardizujícím účinkem s prodloužením diastoly; inhibitory ACE pro zabránění nežádoucí remodelace;
- obnovit a udržet sinusový rytmus u vhodných nemocných, resp. koordinovanou kontrakci síní a komor: antiarytmika, elektrická kardioverze, katetrová ablace, dvoudutinová kardiostimulace; u nemocných, u kterých není reálné obnovení sinusového rytmu, je nutná kontrola srdeční frekvence;
- zabránit tachykardii a navodit bradykardii: beta-blokátory, bradykardizující blokátory vápníkových kanálů, event. jejich opatrná kombinace s digoxinem;
- diuretika mohou být při retenci tekutin nezbytná; je ale nutné je opatrně dávkovat, aby nevznikla hypovolemie, která by zhoršila plnění levé komory, a tím i diastolickou dysfunkci.
Doporučení IIa, úroveň znalostí C
6.8. Léčba srdečního selhání vedená podle natriuretických peptidů
Natriuretické peptidy, zejména BNP a NT-proBNP, se staly velmi užitečným nástrojem pro diagnostiku a odhad prognózy chronického srdečního selhání. Protože plazmatické koncentrace natriuretických peptidů kopírují změny klinického stavu, vznikla lákavá hypotéza, že léčba nemocných s chronickým srdečním selháním řízená plazmatickými koncentracemi BNP/NT-proBNP se snahou o jejich normalizaci by mohla mít lepší klinické výsledky než léčba řízená klinickým stavem (symptomy) nemocného. Tato hypotéza byla v posledních letech ověřována v několika menších randomizovaných kontrolovaných studiích (STARS-BNP, TIME-CHF, PRIMA, OPTIMA a další). Výsledky těchto studií jsou však velmi kontroverzní a řízení léčby chronického srdečního selhání podle plazmatických koncentrací natriuretických peptidů v klinické praxi zatím nelze doporučit [66]. V této oblasti je naprosto nezbytný další klinický výzkum.
Doporučení IIb, úroveň znalostí B6.9. Eliminační metody
Hemodialyzační metody se používají u závažného selhání ledvin a tam, kde je potřeba odstranit nadbytečnou tekutinu. Jejich základním principem je difuze a filtrace. Difuze je směna látek na základě koncentračního spádu na semipermeabilní membráně (SM) a při ultrafiltraci na základě tlakového gradientu přechází přes SM voda a látkyv ní rozpuštěné.
Pro nemocné, u kterých potřebujeme především odstranit pouze tekutinu bez nutnosti hemodialýzy, máme k dispozici kontinuální eliminační metody, kde hlavně využíváme ultrafiltraci.
Indikací je akutní plicní edém a městnavé srdeční selhání provázené nedostatečností ledvin v důsledku hypoperfuze, s neschopností vyloučit zadrženou tekutinu (subakutní až chronický edém plic, anasarka rezistentní a farmakologickou léčbu). Spolupodílet se může preexistující chronická nefropatie (ischemická choroba ledvin, diabetická nefropatie, chronická tubulointersticiální nefritida), lékové poškození (antibiotika, nesteroidní antirevmatika).
Doporučení I, úroveň znalostí BNejčastěji se dnes používají kontinuální venovenózní hemofiltrace (CVVH) a pomalá kontinuální ultrafiltrace (SCUF). Základním principem je hemofiltrace (HF) přes membránu s vysokou propustností pro vodu (40–80 ml h–1 mm Hg–1), která přebírá funkci přirozeného glomerulárního filtru. Rychlost filtrace je závislá na krevním průtoku, propustnosti membrány a filtračním tlaku na membráně [67,68].
K provedení CVVH potřebujeme: přístup do cévního řečiště kanylací velkých žil dvoucestnými katetry, přístroj, který má několik pump pro krevní složku a pro náhradní roztok. Náhradní roztok, s denní potřebou 10–20 l, jehož základem je fyziologický roztok s možností úpravy dle elektrolytů. Je nutná systémová antikoagulace běžným nebo nízkomolekulárním heparinem. Dále jsou vhodné postelové váhy ke sledování změn hmotnosti při hemofiltraci [69].
Ukazateli úspěšného postupu jsou plynulý pokles tělesné hmotnosti, centrálního žilního tlaku (CŽT) a tlaku v zaklínění plicnice (PWP), vzestup systémového tlaku a srdečního výdeje (SI) při poklesu systémové vaskulární rezistence (SVR) [70]. Indikace použití UF:
- rezistence na diuretika s hyponatremií,
- oligurie s postižením renálních funkcí při akutní dekompenzaci se zjevnými známkami převodnění bez reakce na medikamentózní léčbu.
Doporučení I, úroveň znalostí B
6.10. Doporučení pro srdeční resynchronizační léčbu u pacientů se srdečním selháním
6.10.1. Úvod k resynchronizační léčbě
Současná doporučení pro srdeční resynchronizační léčbu (SRL) u pacientů se srdečním selháním vycházejí ze Zásad pro implantaci kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a systémů pro srdeční resynchronizační léčbu České kardiologické společnosti [72] z roku 2009 a nově publikovaných Doporučení Evropské kardiologické společnosti pro přístrojovou léčbu u srdečního selhání z roku 2010 [73].
Na rozdíl od předchozích závazných doporučení se tato aktualizace více orientuje na klinický stav pacientů se srdečním selháním, analyzuje výsledky nově publikovaných významných klinických studií v této oblasti a nově uvádí indikace SRL u pacientů s funkční klasifikací NYHA II. Metaanalýza klinických studií s méně symptomatickými pacienty (NYHA I–II) i pacienty s pokročilým srdečním selháním (NYHA III–IV) jasně prokazuje, že SRL je u adekvátně indikovaných nemocných efektivní léčbou bez rozdílu funkční klasifikace NYHA [74].
Je nutné zdůraznit, že nadále neexistuje žádný jednoznačný prediktor dlouhodobého efektu SRL a definice tzv. non-responderů této léčby, a to i přes snahu používat sof istikované echokardiograf ické či jiné zobrazovací a elektrofyziologické metody [75].
Indikace k srdeční resynchronizační léčbě je nadále vysoce individuální, závisí na klinickém stavu, přidružených onemocněních a životní perspektivě pacienta, skutečném dosažení maximální farmakologické léčby srdečního selhání. Optimální je indikace SRL, která je konsenzem specializované ambulance srdečního selhání, arytmologa a echokardiografisty.
6.10.2. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverterudefibrilátoru (ICD) s BiV stimulací u pacientů se srdečním selháním funkční třídy III–IV dle NYHA
Klinický účinek dlouhodobé SRL hodnotila řada randomizovaných multicentrických studií a registrů [76–80], v nichž byly implantovány BIV KS nebo BiV ICD. Byly publikovány metaanalýzy [81], podle nichž představuje z hlediska mortality nejúčinnější možnost léčby pacientů se srdečním selháním a nízkou ejekční frakcí (EF) levé komory (LK) BiV ICD. Mezi obvyklá kritéria pro zařazení do studie patřila: funkční třída III nebo IV dle NYHA navzdory optimální farmakologické léčbě, EF LK ≤ 35 %, sinusový rytmus, různě definovaná dilatace levé komory a šíře QRS komplexu ≥ 120, resp. ≥ 130 ms [82]. Údaje ze studií podporují používání srdeční resynchronizační terapie na zlepšení morbidity (nikoli mortality) u chodících pacientů zařazených do funkční třídy NYHA IV. Výjimku tvoří pacienti zařazení do programu srdeční transplantace, kde primárním cílem je ovlivnění mortality před vlastním provedením výkonu.
Klíčové body:
- v doporučení již není požadována dilatace levé komory,
- pacienti třídy IV dle NYHA by měli být schopni chodit,
- přiměřené očekávání přežití pacientů po dobu delší než 1 rok pro použití BiV ICD,
- důkazy jsou nejpřesvědčivější u pacientů s typickým blokem levého Tawarova raménka,
- podobná míra důkazů je jak u BiV KS, tak i u BIV ICD u nemocných se srdečním selháním v primární prevenci bez evidence komorových arytmií.
Doporučení u pacientů se srdečním selháním třídy III–IV dle NYHA: pacienti ve funkční třídě III–IV dle NYHA, LV EF ≤ 35 %, QRS ≥ 120 ms, sinusový rytmus, optimální farmakoterapie (pacienti třídy IV dle NYHA by měli být schopni chodit). Ke snížení morbidity a mortality se doporučuje použití jak BiV KS, tak i BIV ICD.
Doporučení třídy I, úroveň znalostí A6.10.3. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru (ICD) s BiV stimulací u pacientů se srdečním selháním funkční třídy I–II dle NYHA
Úlohou, kterou hraje SRL u mírně symptomatických či asymptomatických pacientů se sníženou EF a širokým komplexem QRS, se zabývaly 4 studie – MIRACLE ICD II [83], MADIT-CRT [84], REVERSE [85] a RAFT [86].
V současné době neexistují přesvědčivé důkazy o tom, že by byla SRL indikována k léčbě asymptomatických pacientů a symptomatických nemocných s přechodnými a mírnými symptomy (NYHA I), a proto se doporučení k jejímu použití zatím omezuje pouze na pacienty třídy NYHA II.
Výběr systému pro resynchronizační léčbu: Je řada argumentů, které hovoří o tom, že u těchto pacientů s méně závažným srdečním selháním je vhodnější přistoupit k implantaci BiV ICD. Za prvé se v rámci randomizovaných studií implantovaly především přístroje BiV ICD místo přístrojů BiV KS. Za druhé, používání přístrojů BiV ICD může být podporováno tím, že se v případě pacientů třídy I nebo II jedná ve srovnání s pacienty třídy III nebo IV o podstatně mladší nemocné s menším výskytem doprovodných onemocnění a delší předpokládanou životní perspektivou. Nicméně existují i argumenty, podle nichž by nebylo vhodné používání přístrojů CRT-P zcela vylučovat. Za prvé vzhledem k tomu, že nebylo zjištěno příznivé působení léčby z hlediska prodloužení životnosti, klinický význam přístrojové terapie pacientů třídy I a II podle NYHA lze pravděpodobně přisoudit resynchronizaci srdce na základě reverzní remodelace levé komory. Tento příznivý účinek byl u pacientů třídy III a IV podle NYHA stejný jak v případě BiV KS, tak i v případě BiV ICD. Za druhé, vzhledem k procesu remodelace je u mnoha pacientů třídy I a II dle NYHA po 6–12 měsících srdeční resynchronizační léčby pozorováno zvýšení EF o více než 35 %. Za třetí se zdá, že se implantace BiV ICD pojí ve srovnání s BiV KS s vyšším rizikem komplikací spojených s daným přístrojem.
Klíčové body:
- snížení morbidity bylo zjištěno ve 3 nedávno provedených randomizovaných prospektivních multicentrických studií u pacientů s méně závažným srdečním selháním (MADIT-CRT, REVERSE a RAFT);
- zlepšení bylo pozorováno především u pacientů s komplexem QRS ≥ 150 ms a typickým blokem levého raménka Tawarova;
- ve studii MADIT-CRT reagovaly na léčbu obzvláště příznivě ženy s blokem levého raménka Tawarova;
- ve studii MADIT-CRT byl rozsah reverzní remodelace v souladu se zlepšením klinických výsledků a predikoval klinické zlepšení.
Doporučení u pacientů se srdečním selháním třídy II dle NYHA: pacienti ve funkční třídě II podle NYHA, LV EF ≤ 35 %, QRS ≥ 150 ms, sinusový rytmus a optimální farmakologická léčba. Ke snížení morbidity a prevenci progrese onemocnění doporučujeme SRL s použitím BiV-ICD. Indikace podle závazného doporučení se omezují na pacienty se srdečním selháním funkční třídy II dle NYHA a šířkou komplexu QRS ≥ 150 ms, což je populace pacientů, u kterých lze předpokládat velmi dobrou reakci na léčbu. Pacienti s indikací k ICD z důvodu sekundární prevence by měli dostat BiV ICD.
Doporučení třídy I, úroveň znalostí A6.10.4. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru s BiV stimulací u pacientů se srdečním selháním a permanentní fibrilací síní (FS)
Přibližně 1/5 pacientů léčených pomocí SRL v Evropě má permanentní síňovou fibrilaci [76]. Prevalence síňové fibrilace u pacientů se srdečním selháním se pojí se závažností této choroby: 5 % u pacientů třídy I podle NYHA ve srovnání s 25–50 % u pacientů třídy III a IV dle NYHA. U některých pacientů s permanentní fibrilací síní může vést dlouhodobá léčba a úspěšná katetrizační ablace FS k návratu k sinusovému rytmu.
Je nutné zdůraznit, že kritéria pro implantaci ICD mohou splňovat i pacienti se symptomatickým srdečním selháním, fibrilací síní a EF ≤ 35 %. Výskyt prodlouženého intervalu QRS podporuje u těchto pacientů možnost implantace BiV ICD. Vzhledem k tomu, že se důkazy omezují pouze na pacienty se síňovou fibrilací a většina pacientů zařazených do těchto studií měla velmi široký interval QRS, omezujeme doporučení k implantaci BiV KS/BiV ICD na komplex QRS ≥ 130 ms.
Klíčové body:
- přibližně 1/5 implantací systémů pro SRL se provádí v Evropě u pacientů s permanentní fibrilací síní;
- uznávanými indikacemi k implantaci ICD jsou symptomy třídy III–IV dle NYHA a EF LK ≤ 35 %;
- k zajištění efektivní SRL může být provedena ablace AV uzlu [87,88];
- důkazy jsou nejpřesvědčivější u pacientů s blokem levého Tawarova raménka;
- pro doporučení ohledně mortality neexistuje dostatek důkazů.
Doporučení u pacientů se srdečním selháním a permanentní fibrilací síní: pacienti ve funkční třídě III–IV dle NYHA, LV EF ≤ 35 %, QRS ≥ 130 ms a dependence na kardiostimulátoru indukovaná na základě ablace AV uzlu, doporučuje se BiV KS nebo BiV ICD s cílem redukce morbidity.
Doporučení třídy II, úroveň znalostí BPacienti ve funkční třídě III–IV dle NYHA, LV EF ≤ 35 %, QRS ≥ 130 ms. Doporučuje se BiV KS nebo BiV ICD s cílem redukce morbidity.
Doporučení třídy II, úroveň znalostí C6.10.5. Srdeční resynchronizační léčba (SRL) pomocí biventrikulárního (BiV) kardiostimulátoru (KS) nebo implantabilního kardioverteru-defibrilátoru s BiV stimulací u pacientů se srdečním selháním a indikací ke konvenční kardiostimulaci
Přestože v současnosti chybějí prospektivní randomizované kontrolované studie, které by se zabývaly konkrétně otázkou srdeční resynchronizační léčby u pacientů s úzkým komplexem QRS, existuje několik malých retrospektivních observačních nebo malých prospektivních studií, jejichž výsledky poukazují na klinický přínos přechodu na biventrikulární kardiostimulaci s dlouhodobou stimulací pravé komory, závažnou komorovou dysfunkcí, symptomatikou funkční třídy III dle NYHA, a to nehledě na šířku komplexu QRS [89,90]. To může nepřímo poukazovat na to, že při léčbě pomocí biventrikulární kardiostimulace je nutné se snažit o zachování, příp. obnovení komorové synchronie, která by se blížila normálu, a to bez ohledu na srdeční rytmus.
Klíčové body:
- léčba BiV KS, resp. BiV ICD, je indikována u pacientů s indikací ke konvenční kardiostimulaci, symptomy třídy III–IV dle NYHA, EF LK ≤ 35 % a šířkou komplexu QRS ≥ 120 ms;
- stimulace pravé komory z oblasti apexu vede ke vzniku dyssynchronie;
- je nutné vyhnout se chronické stimulaci pravé komory u pacientů s dysfunkcí levé komory;
- SRL může vést k možnosti vhodného zvýšení dávky beta-blokátorů.
Doporučení u pacientů se srdečním selháním a současnou indikací ke kardio stimulaci ukazuje tab. 19.
Tab. 19. Doporučení u pacientů se srdečním selháním a současnou indikací ke kardiostimulaci. 
Doporučení srdeční resynchronizační léčby a implantabilních defibrilátorů u srdečního selhání shrnuje tab. 20.
Tab. 20. Přehled současných indikací srdeční resynchronizační léčby. 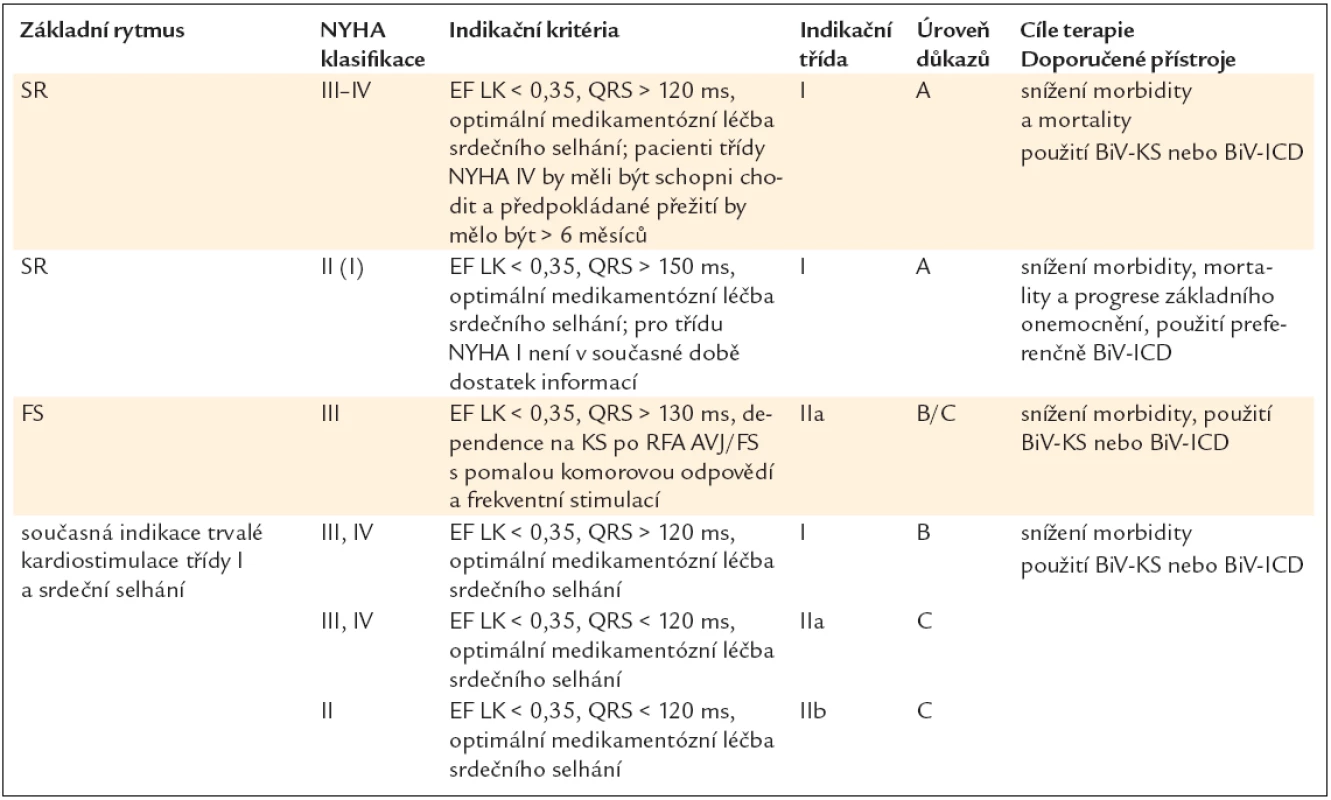
6.11. Umělé srdce, mechanické podpory
Mechanické srdeční podpory jsou čerpadla, která jsou schopna částečně převzít úlohu srdce s cílem obnovení dostatečného srdečního výdeje. Dnes je k dispozici řada systémů pro krátkodobou i dlouhodobou podporu srdeční činnosti [91–93]. U nemocných s pokročilým CHSS nejčastěji využíváme nepulzatilní implantabilní podporu LK (LVAD) [94]. Podporu využíváme jako „most“ k transplantaci srdce (OTS) u nemocných, kteří dospějí do fáze terminálního selhání, s progresivním zhoršováním stavu a předpokladem úmrtí v krátké době (tab. 21). Další indikací je těžká plicní hypertenze (PH) [95] a rozvoj kardiální kachexie v důsledku nízkého srdečního výdeje u kandidáta transplantace srdce. Kontraindikace pro zavedení podpory jsou uvedeny v tab. 22.
Tab. 21. Zařazující kritéria v indikaci LVAD v přemostění k transplantaci srdce. 
Péče o nemocné s implantovanou srdeční podporou vyžaduje komplexní přístup se součinností specializované sestry, lékařů a technika. Nejčastější komplikací jsou infekce, popřípadě krvácivé projevy při nutné antikoagulační léčbě. Nemocní s implantovanou podporou mohou pobývat mimo nemocnici, na čekací listině k OTS zůstávají zařazeni v urgentním pořadí.
Krátkodobé podpory se využívají v emergentních situacích, nejčastěji po kardiochirurgických výkonech, u OTS k podpoře PK u nemocných s PH.
Správně indikovaná mechanická podpora zásadně zlepšuje prognózu nemocných a u většiny z nich umožňuje úspěšné provedení OTS.
Doporučení I, úroveň znalostí A6.12. Nechirurgická revaskularizace
V současnosti chybí výsledky velkých randomizovaných studií, které by zhodnotily přínos perkutánních koronárních intervencí u nemocných s chronickým srdečním selháním. Menší studie však ukazují funkční a prognostický prospěch revaskularizace myokardu (ať již se jedná o aortokoronární přemostění, či koronární angioplastiku) v případě průkazu dysfunkčního, ale viabilního (hibernovaného) myokardu zásobeného významně stenotickou koronární tepnou. Pokud je srdeční selhání spojeno s anginou pectoris či zátěžovou ischemií, platí indikace pro revaskularizaci myokardu u chronické ICHS, přičemž na tyto nemocné je třeba pohlížet jako na zvýšeně rizikové.
Doporučení I, úroveň znalostí C6.13. Chirurgická léčba
Chirurgická léčba je indikována tehdy, je-li srdeční selhání důsledkem korigovatelné poruchy srdečních struktur. Předpokladem je přijatelné operační riziko.
6.13.1. Revaskularizace myokardu
U nemocného s ischemickou dysfunkcí levé komory je indikována koronarografie a při vhodném nálezu revaskularizace myokardu. Důležitým momentem v indikaci je průkaz větší masy viabilního myokardu v povodí zúžených nebo uzavřených koronárních tepen. K průkazu viability využíváme nejčastěji metodu dobutaminové echokardiografie, perfuzní scintigrafie myokardu nebo magnetické rezonance. Od správně indikovaného výkonu očekáváme zlepšení symptomů a funkce LK [96]. V randomizované studii STICH bylo doloženo snížení počtu hospitalizací a úmrtí z kardiovaskulárních příčin během 5 let po intervenci [97].
Doporučení I, úroveň znalostí BPři nálezu významné mitrální regurgitace doplňujeme revaskularizaci anulovalvuloplastikou chlopně. U nemocných s blokádou levého Tawarova raménka je indikována implantace elektrody na laterální stěnu LK k vy užití pro resynchronizační léčbu. U nemocných s fibrilací síní je operace doplněna ošetřením LS (MAZE a/nebo redukce síně).
Doporučení IIa, úroveň znalostí C6.13.2. Aneuryzmektomie
Aneuryzmektomie LK je indikována u symptomatické výdutě, nejčastěji v oblasti přední stěny a mezikomorového septa.
Doporučení IIb, úroveň znalostí BPři nálezu rozsáhlé akinezy přední stěny u nemocných indikovaných k revaskularizaci je možné zvážit provedení endoventrikulární plastiky LK. Předpoklady, že tento výkon zlepší prognózu nemocných, se však v randomizované studii nepotvrdily [98].
Doporučení IIb, úroveň znalostí B6.13.3. Plastika mitrální chlopně
U nemocných s ischemickou dysfunkcí LK s významnou mitrální regurgitací je indikován chirurgický zákrok na mitrální chlopni jako doplněk revaskularizace.
Doporučení I, úroveň znalostí CU nemocných s neischemickou dysfunkcí LK může chirurgická korekce (anulovalvuloplastika) mitrální chlopně vést k symptomatickému zlepšení.
Doporučení IIa, úroveň znalostí C6.13.4. Náhrada aortální chlopně
Významná stenóza aortální chlopně představuje indikaci k náhradě i u nemocných s dysfunkcí LK. Významná aortální insuficience může představovat indikaci k náhradě chlopně v období, než dojde k výrazné dilataci a remodelaci LK.
Doporučení I, úroveň znalostí C6.14. Transplantace srdce
Ortotopická transplantace srdce (OTS) je dnes zavedenou klinickou metodou pro léčení terminálních stadií srdečního selhání u nemocných, u kterých byly vyčerpány ostatní možnosti léčby [94,99]. K výkonu jsou indikováni nemocní ve IV. nebo pokročilé III. třídě NYHA klasifikace s doloženou závažnou poruchou systolické funkce levé komory (EF < 20 %) a špatnou prognózou. Nejčastější příčinou takto pokročilého srdečního selhání je ischemická choroba srdeční nebo dilatační kardiomyopatie. Nemocní jsou limitováni nejčastěji dušností a únavou, ve výjimečných případech se o indikaci k OTS uvažuje při těžké angině pectoris nebo závažných, jinak nezvládnutelných poruchách rytmu.
U nemocných ve III. třídě funkční klasifikace NYHA je rozhodující odhad dalšího vývoje a prognózy onemocnění. Toto posuzování je komplexní, nezbytným vyšetřením je spiroergometrie. Indikaci k OTS ukazuje tab. 23. Vrcholová spotřeba kyslíku pVO2 ≤ 10 ml/kg/min představuje jednoznačnou indikaci k OTS, při pVO2 nad 14 ml/kg/min není OTS obvykle ještě nutná. V „šedé zóně“ mezi 10 a 14 ml/kg/min přispívá k posouzení závažnosti stavu hodnocení stupně hyperventilace (VE/VCO2 slope > 35 představuje zhoršení rizika).
Tab. 23. Indikace transplantace srdce. 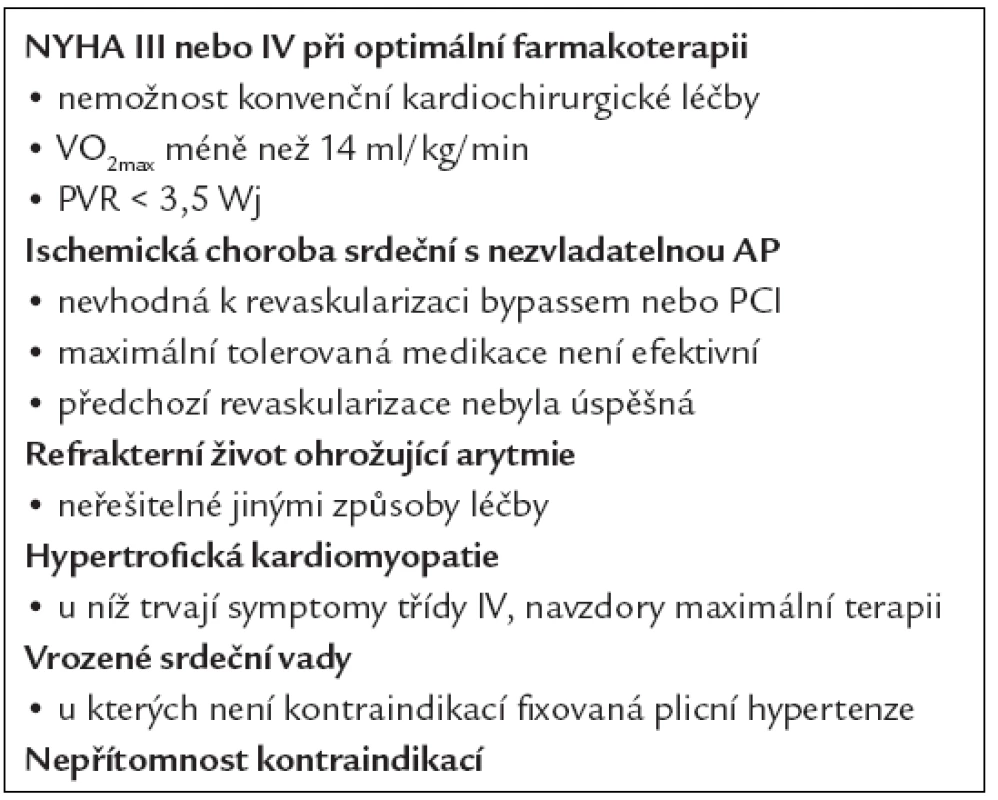
Indikace k OTS jsou uvedeny v tab. 23.
Kontraindikace pro OTS srdce jsou uvedeny v tab. 24.
Tab. 24. Kontraindikace transplantace srdce. 
Metodou volby je ortotopická transplantace provedena bikavální technikou, kdy z původního srdce příjemce zůstává pouze zadní strana levé síně s vyústěním plicních žil. Zachování integrity pravé síně je výhodné, neboť je zachována fyziologická tvorba a vedení vzruchu a také je menší trikuspidální regurgitace.
Nemocní po OTS potřebují trvalou péči, kterou zajišťuje příslušné kardiocentrum ve spolupráci s ambulantním kardiologem (internistou). V prvých měsících je nemocný nejvíce ohrožen odhojováním (rejekcí) štěpu a infekcemi, dalšími komplikacemi jsou hypertenze, obezita, hyperlipidemie, osteoporóza, selhávání ledvin, koronární nemoc štěpu a častější výskyt malignit.
Časná stadia rejekce štěpu lze zjistit pouze mikroskopickým vyšetřením vzorků srdečního svalu získaného endomyokardiální biopsií. Prevence rejekce spočívá v podávání kombinace imunosupresiv (obvykle cyklosporin A nebo tacrolimus, mykofenolátmofetil a prednizon). Akutní epizoda buněčné rejekce se léčí metylprednizolonem nebo antilymfocytárními globuliny. Humorální rejekce doprovázená dysfunkcí štěpu vyžaduje intenzivní léčbu včetně plazmaferézy či imunoabsorbce. Kromě imunosupresiv nemocní obvykle užívají kombinaci antihypertenziv a statiny.
Provedená OTS výrazně zlepšuje kvalitu života nemocného i jeho prognózu. Operační úmrtnost je < 10 %, 1 rok přežívá 85 % a 5 let 70 % nemocných. Program je omezen především nabídkou dárců, a tak je tato metoda řešením pouze pro malou část nemocných se srdeční insuficiencí.
Doporučení I, úroveň znalostí C6.15. Paliativní péče o nemocné v terminálních fázích srdečního selhání
Chronické srdeční selhání je postižení, které dříve nebo později skončí smrtí, a to buď náhlou na podkladě maligní arytmie či plicní embolie, nebo terminálním selháním srdce jako pumpy. Právě v druhém případě je spolupráce zdravotníků, nemocného a nejbližších příbuzných potřeba k tomu, aby umírání nebylo větším utrpením, než je nezbytně nutné.
V terminálním stavu musíme nemocného zbavit trýznivé bolesti a dušnosti a maximálně zmírnit úzkost z umírání. Má-li nemocný implantovaný ICD, nabídneme mu možnost inaktivace. Neváháme použít opiáty, inotropika a vysoké dávky diuretik k symptomatické úlevě.
Málo je známo o „nejlepších postupech“, jak učinit rozhodnutí o konci života u pacientů s CHSS. Ve studii s názvem SUPPORT pouze 25 % pacientů hospitalizovaných s CHSS žádalo o rozhovor s lékaři o resuscitačních preferencích. Studie odhalila, že nemocní byli špatně informováni o průběhu své choroby a její prognóze a nebyli dostatečně začleněni do procesu rozhodování. I přes nedostatek klinických studií lze odvodit doporučení ze studií v obecném lékařství, onkologii a z názorů odborníků. Omezení diskuze na „doufejme v nejlepší a přitom plánujme to nejhorší“ může pomoci pacientům s chronickou chorobou v postojích o jejich nadějích a obavách. Rozhovor o konci života v časné etapě péče umožňuje lékařům vystupovat čestně v tom, že i přes maximální poskytovanou péči pacienti na CHSS zemřou. Ačkoli si většina nemocných přeje rozhovor o své chorobě a její prognóze, asi 1 z 5 by raději neslyšel špatné zprávy nebo by dal přednost, aby jeho rodina udělala konečné rozhodnutí za něho. Je zapotřebí výzkum, který by definoval, jak nejlépe zjistit pacientovo přání, vědět a účastnit se rozhodování. Následná diskuze se musí zaměřit na to, jak nejlépe využít pacientovy preference. Měly by se vytvořit plány možností, pokud zvolená léčba nepřináší požadované výsledky. Tyto diskuze by měly mít časový průběh a měly by se opakovat v „rozhodujících okamžicích“ při léčbě (např. zhoršení dušnosti, renálních funkcí nebo tělesných funkcí i přes optimální lékařskou péči). Je třeba tyto informace předkládat v různých formách, protože někteří nemocní se raději informují z tištěných materiálů nebo obrázků, a proto by se měly začlenit do ostatních výukových materiálů pro pacienty a jejich rodinné příslušníky. Bude nutné stanovit způsoby, jak školit lékaře k vedení takových rozhovorů s nemocnými i jejich příbuznými [100–103].
7. Léčba CHSS podle přidružených onemocnění
7.1. Léčba CHSS a hypertenze
Zvýšený krevní tlak je jedním z hlavních rizik vzniku srdečního selhání (SS) a dlouhodobá dostatečná léčba hypertenze ukázala snížení výskytu rizika vzniku SS. Dosažení optimálního krevního tlaku snižuje relativní riziko vzniku SS o 50 % [104]. Zvláště významné je dosažení cílových hodnot systolického krevního tlaku [105]. Dodatečná analýza studie HOPE však ukázala, že TKd by neměl klesnout pod 65 mm Hg. U pacientů s ICHS a/nebo diabetes by TKd neměl klesnout pod 70 mm Hg [106]. Někdy doporučované snižování krevního tlaku pod 130/80 mm Hg není podloženo důkazy [107]. Nejvhodnější je léčba založená na lécích blokující renin-angiotenzinový systém (inhibitory ACE a ARB) a beta-blokátorech.
Optimální cílový krevní tlak pacientů se srdečním selháním není znám, epidemiologické studie ukazují, že jsou to pravděpodobně hodnoty 130–140/80–90 mm Hg (avšak při pokročilém srdečním selhání krevní tlak klesne většinou níže, zejména při standardní léčbě).
7.2. Léčba CHSS a diabetes mellitus
Diabetes mellitus (DM) patří mezi významné rizikové faktory rozvoje kardiovaskulárních onemocnění včetně CHSS. Prevalence DM dosahuje u pacientů s CHSS 20–30 % [108]. DM může mít nepříznivý vliv na přirozený průběh srdečního selhání, zejména u pacientů s ischemickou kardiomyopatií. DM a ICHS mohou společně urychlit zhoršení srdeční dysfunkce, progresi srdečního selhání, a nepříznivě tak ovlivnit i prognózu. Zatímco vztah mezi zvýšenou glykemií a rizikem vzniku srdečního selhání je u diabetiků znám, přímý benefit ze snížení glykemie v redukci rizika srdečního selhání ještě přesvědčivě prokázán nebyl [109].
Součástí léčby diabetiků se srdečním selháním jsou samozřejmě režimová opatření. U nemocných se srdečním selháním se mění dostupnost, ale i eliminace perorálních antidiabetik a inzulinu, což přináší riziko hyper - či hypoglykemií, proto by individualizovaná farmakoterapie měla vést k optimální kompenzaci diabetu. Metformin je vhodný jako lék první volby u obézních pacientů s DM 2. typu bez významné renální insucficience (GFR > 30 ml/min). Je však relativně kontraindikován při NYHA II s retencí tekutin a absolutní kontraindikací je funkční stadium NYHA III a IV pro riziko vzniku laktátové acidózy. Sulfonylureové přípravky nelze použít při renální insuficienci a při NYHA IV. Thiazolidinediony můžeme s opatrností použít u nemocných ve funkční třídě NYHA I a II bez retence tekutin a jsou kontraindikovány od NYHA III pro nebezpečí zhoršení retence tekutin, která je závislá na dávce a je reverzibilní po vysazení přípravku. Časné zahájení inzulinoterapie je vhodné u těch nemocných, u kterých nemůžeme dosáhnout cílových hodnot glykemie kombinací režimových opatření a perorální antidiabetické terapie.
ACE-I a ARB snižují úmrtnost i nemocnost diabetiků se srdečním selháním ještě více než u nemocných bez diabetu. Beta-blokátory ovlivňují příznivě prognózu i přes potenciálně negativní vliv na metabolizmus. Thiazidová diuretika ve vyšších dávkách mohou zhoršovat metabolické parametry, proto se nedoporučuje používat dávky nad 25 mg a je lepší zvolit diuretika kličková nebo kombinaci nižší dávky thiazidového a kličkového diuretika.
7.3. CHSS a renální insuficience
Téměř 1/3 nemocných s CHSS má snížené renální funkce [110]. Prevalence renální insuficience narůstá s tíží srdečního selhání, s věkem, s výskytem hypertenze a DM. Renální insuficience je u těchto nemocných spojena se zvýšenou morbiditou a mortalitou [111]. Spojení srdečního selhání a renální insuficience někteří autoři označují jako kardiorenální syndrom [112]. Skoro všechny známé klinické studie mají jako jedno z vylučovacích kritérií renální insuficienci nebo renální selhání. Proto se doporučení pro léčbu budou opírat více o empirické znalosti než o medicínu na základě důkazů. Postižení ledvin u CHSS je dáno jednak hypoperfuzí ledvin, jednak souběžným renálním onemocněním a v neposlední řadě i jako důsledek vedlejších účinků léků. Je proto potřeba pátrat po potenciálně reverzibilních příčinách renální insuficience, jako je hypotenze, dehydratace a deteriorace renálních funkcí v důsledku podávání ACE-I, ARB či jiných léků, jako např. NSAID.
Nemocní s CHSS s mírnou až středně závažnou renální insuficiencí (GFR 0,5–1,0 ml/s) mají jednoznačný prospěch z léčby ACE-I, zatímco důkazy o kardioprotektivním účinku ACE-I u pacientů s pokročilou renální insuficiencí (GFR < 0,5 ml/s) chybí [113]. Terapie ACE-I nebo ARB je obvykle spojena s mírným až středním zhoršením renálních funkcí. Změny jsou často jen přechodné a reverzibilní. Více jsou samozřejmě ohroženi nemocní s preexistující renální insuficiencí nebo se stenózou renální tepny.
Neexistuje absolutní hodnota kreatininu, která by nám zabraňovala v podání ACE-I nebo ARB. Nemocní s kreatininem nad 250 μmol/l by však měli být pod dozorem specialistů. Inhibitory ACE i ARB dávkujeme s ohledem na renální funkce, dávku volíme takovou, aby nedošlo k jejich dalšímu poklesu. O tom, zda má v případě renální insuficience smysl podávat ACE-I metabolizované z velké části v játrech (fosinopril, imidapril, spirapril, trandolapril), je často diskutováno, velká klinická srovnávací studie však dosud nebyla provedena. Blokátory aldosteronu při GFR pod 0,5 ml/s raději nepodáváme a u GFR > 0,5 ml/s volíme nízkou dávku 25 mg, event. 12,5 mg za pečlivé monitorace kalemie [114]. Kardioprotektivní účinek beta-blokátorů je zřejmě na stupni renálního poškození nezávislý. Beta-blokátory volíme spíše lipofilní s jaterním metabolizmem (carvedilol, metoprolol) a opět opatrně dávkujeme s ohledem na hypotenzi a renální funkce [113]. U digoxinu, který se vylučuje převážně ledvinami, redukujeme dávku tak, aby plazmatické koncentrace byly v rozmezí 0,55–0,9 ng/ml. V praxi to bude dávka 0,125 mg, spíše obden. Diuretika samozřejmě volíme kličková ve vyšších dávkách, v případě snížené účinnosti můžeme kombinovat kličková s thiazidovými diuretiky, která jsou však neúčinná při GFR pod 30 ml/min [113].
Terapie nemocných s kardiorenálním syndromem zahrnuje kromě léčby srdečního selhání specifické postupy léčby nemocných s renální insuficiencí, jako jsou např. léčba renální anémie, korekce metabolické acidózy, korekce poruch kalciofosfátového metabolizmu a další [115].
Úplně neznámou je situace nemocných s CHSS v chronickém dialyzačním programu, máme sice data o výskytu a o prognostických ukazatelích [116], ale jaká je vhodná léčebná strategie u těchto nemocných, kromě pečlivého sledování suché váhy, není jasně stanoveno. Vycházíme z doporučení pro srdeční selhání, a proto základem jistě budou ACE-I či ARB, beta-blokátory, kličková diuretika, bude-li zachována zbytková diuréza. Digoxin pouze v případě přetrvávání symptomů při léčbě ACE-I/ARB, BB a při event. fibrilaci síní. Dávky léků upravujeme dle jejich dialyzovatelnosti.
Tab. 25 uvádí dialyzovatelnost léků pro srdeční selhání.
Tab. 25. Dialyzovatelnost léků pro srdeční selhání. 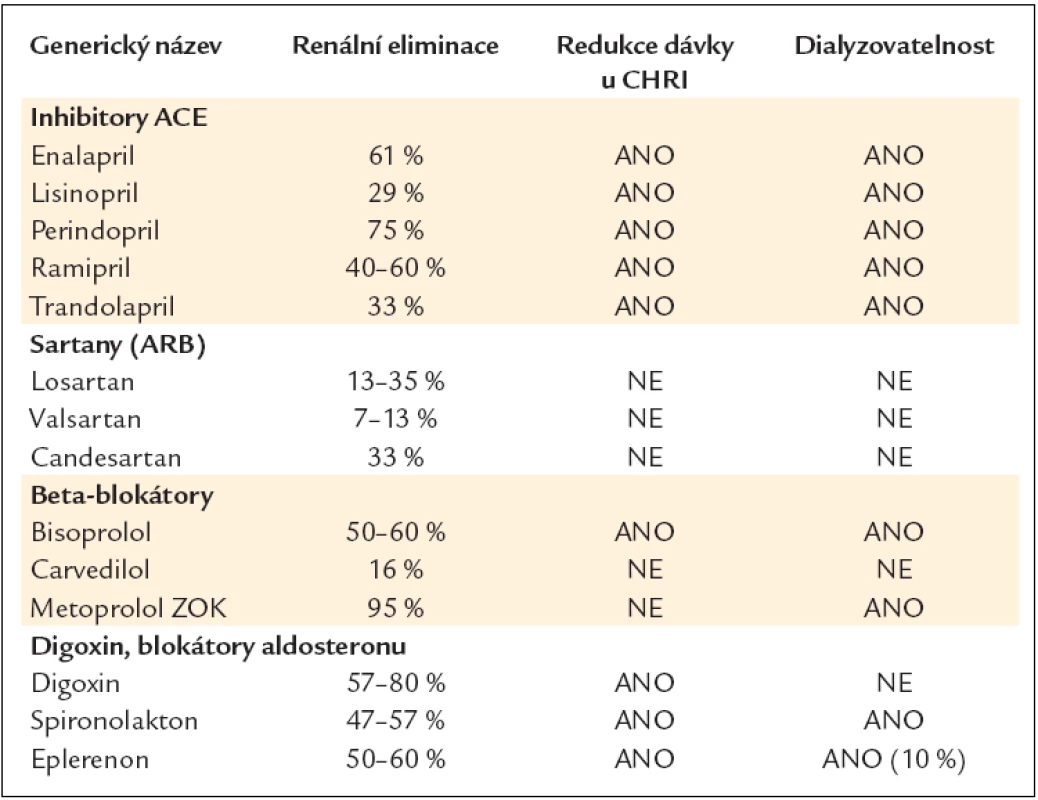
7.4. CHSS a chronická obstrukční plicní nemoc
Chronická obstrukční plicní nemoc (CHOPN) patří mezi časté komorbidity nemocných s chronickým srdečním selháním s prevalencí 20–30 % [117].
Pacienti s CHOPN mají výrazně vyšší riziko vzniku srdečního selhání. CHOPN patří mezi nezávislé rizikové faktory kardiovaskulární morbidity a mortality. Přítomnost CHOPN zhoršuje prognózu nemocných s CHSS [118]. Stanovení diagnózy srdečního selhání u pacientů s CHOPN je obtížné pro časté překrývaní příznaků a relativně nízkou senzitivitu diagnostických metod jako např. RTG hrudníku, EKG a spirometrie [119]. Stanovení plazmatické hladiny natriuretických peptidů (BNP, NT-proBNP) může být v těchto případech nápomocné, významná je především jejich negativní prediktivní hodnota. Nemocní s plicním postižením jak obstrukčním, tak restrikčním, byli ve všech studiích vyřazováni pro své plicní postižení, proto se léčebná doporučení budou opět opírat zejména o empirii. Mnohé léky užívané v léčbě srdečního selhání mohou zhoršit plicní symptomy. Inhibitory ACE vyvolávají u 5–10 % nemocných suchý, dráždivý kašel, což je jednoznačnou indikací k záměně za sartany (ARB). Většina nemocných se srdečním selháním a CHOPN toleruje terapii beta-blokátory. Vhodné je začínat terapii malými dávkami β1-selektivních beta-blokátorů (bisoprolol, metoprolol ZOK, nebivolol) a dávku dále zvyšovat dle tolerance. Mírné zhoršení symptomů a plicních funkcí nemusí vždy vést k vysazení beta-blokátorů, vhodná je redukce dávky, v případě pokračujícího zhoršování symptomů či plicních funkcí pak jejich vysazení [120].
Respektujeme absolutní kontraindikace podávání beta-blokátorů – asthma bronchiale. V úvahu musíme vzít také léky užívané k léčbě CHOPN: theofyliny, parasympatikomimetika, kortikoidy a β2-mimetika. Všechny tyto léky působí též na kardiovaskulární systém a mají kardiální vedlejší účinky.
7.5. Léčba CHSS a fibrilace síní
Fibrilace síní je nejčastější klinicky významnou arytmií. Její výskyt v dospělé populaci se dříve udával 0,4 %, dnes spíše 1,0 % [59]. Znamená to, že výskyt FS stále stoupá a v příštích 50 letech se očekává zvýšení počtu pacientů s FS 2,5–5krát [59]. „Epidemii“ FS nelze vysvětlit jen stárnutím populace, ale vyšší výskyt byl pozorován i po korekci na věk, pohlaví a přidružené choroby. U pacientů se srdečním selháním je výskyt FS závislý na jeho stupni: kolísá přibližně od 5 % při NYHA I až téměř k 50 % při NYHA IV.
Rychlá frekvence síní však sama o sobě zhoršuje funkci síní, rychlá frekvence komor pak může působit pokles funkce levé komory (tzv. „tachykardická kardiomyopatie“). Jak ukázaly studie po ablaci AV junkce u těchto pacientů, jsou změny funkce z velké míry reverzibilní. Častější než FS indukovaná dysfunkce je zhoršení funkce levé komory při vzniku arytmie. FS tedy může být následek i příčina srdečního selhání.
Základním opatřením je kontrola frekvence komor a prevence tromboembolických komplikací [121].
Lékem volby pro kontrolu frekvence komor v klidu a při zátěži jsou beta-blokátory, při nedostatečném efektu je vhodná kombinace s digoxinem, popřípadě s amiodaronem. Dronedaron je u nemocných se srdečním selháním kontraindikován [59]. Antiarytmika skupiny I u pacientů se srdečním selháním nepodáváme. Pokud nejsme schopni kontrolovat frekvenci komor medikamentózně, přichází do úvahy ablace AV junkce a implantace kardio stimulátoru přednostně s možností biventrikulární stimulace.
Doporučení I, úroveň znalostí CU nemocných s recentně vzniklou fibrilací síní je indikováno provedení elektrické kardioverze, nejúčinnějším lékem pro udržení sinusového rytmu po kardioverzi je amiodaron [59].
Doporučení I, úroveň znalostí CLékem volby pro prevenci tromboembolických komplikací je warfarin v dávce, kterou dosáhneme INR 2,0–3,5. Alternativou při intoleranci warfarinu nebo ve speciálních situacích (pacient na čekací listině k OTS) je nízkomolekulární heparin v antikoagulačních dávkách. V brzké budoucnosti můžeme očekávat nové léky, které by mohly nahradit warfarin [122]. Od 1. 8. 2011 je v České republice k léčbě fibrilace síní registrován dabigatran (Pradaxa), a pokud má pacient srdeční selhání NYHA II a více a/nebo ejekční frakci < 40 %, pak je indikován k této léčbě. Doporučená dávka je 2krát 150 mg, dávku redukujeme při snížených renálních funkcích.
Doporučení I, úroveň znalostí CChirurgická léčba fibrilace síní je nejvhodnější u pacientů vyžadujících chirurgickou operaci z jiné indikace.
Doporučení IIa, úroveň znalostí CKatetrizační ablace lze použít jako paliativní i jako kurativní výkon. Jako paliativní se provádí neselektivní ablace AV junkce se vznikem AV blokády. V síních trvá fibrilace, komory jsou většinou spouštěny náhradním junkčním rytmem o frekvenci přibližně 40/min, méně často není náhradní rytmus přítomen. Proto je výkon nutné doplnit implantací kardiostimulátoru. Hlavní výhodou neselektivní ablace je jednoduchost a prakticky 100% úspěšnost. Dochází ke zlepšení kvality života a zlepšení funkce levé komory. Výkon je indikován u pacientů s rychlou či nevyrovnanou akcí komor, rezistentní na medikaci. Je nutné pokračovat v prevenci tromboembolických příhod.
K elektivní izolaci plicních žil jsou zatím indikováni jen vysoce symptomatičtí nemocní, rezistentní na dostupnou farmakologickou léčbu.
Katetrizační léčba FS je jednou z nejdynamičtěji se rozvíjejících oblastí léčby srdečních arytmií vůbec. Vzhledem k velmi rychlému rozvoji technologií lze očekávat podstatné zjednodušení výkonu, zlepšení výsledků, a tedy i rozšíření indikací.
Doporučení IIa, úroveň znalostí C7.6. Léčba CHSS a komorové arytmie
Komorové arytmie je možné ovlivnit kombinací beta-blokátoru a amiodaronu [123–125]. Nejúčinnějším způsobem je implantace ICD. U pacientů s blokádou levého raménka Tawarova, splňujících kritéria pro implantaci ICD, se výkon kombinuje s biventrikulární stimulací.
Doporučení I, úroveň znalostí A7.7. Léčba CHSS a anémie
Anémie je u pacientů s CHSS poměrně častá, její výskyt narůstá s progresí srdečního selhání a má nepříznivý dopad na přežívání nemocných. Etiologie je multifaktoriální [126].
Při zjištění anémie u nemocného s CHSS je prvním krokem zhodnocení možných příčin, vyloučení krevních ztrát, zánětu, nádorového onemocnění, hemolýzy a nutričních příčin (sideropenie, deficitu vitaminu B12 a kyseliny listové), případně onemocnění kostní dřeně.
Randomizovaná studie u pacientů s CHSS potvrdila, že léčba anémie pomocí erytropoetinu a intravenózně podávaného železa je bezpečná a má příznivý hemodynamický dopad, zlepšuje toleranci zátěže a snižuje počet hospitalizací [127].
Doporučení IIa, úroveň znalostí BV dalších studiích bude potřeba ověřit vliv léčby anémie na prognózu nemocných s CHSS, očekávají se výsledky právě probíhající studie RED-HF s rekombinantním erytropoetinem [128]. Erytropoézu stimulující léky (erytropoetin, darbopoetin) je doporučeno podávat nemocným, u nichž poklesla koncentrace hemoglobinu na méně než 100–110 g/l a kde je předpoklad zlepšení touto léčbou (renální příčina, myelodysplastický syndrom apod.) Studie FAIR-HF ukázala, že korekce deficitu železa má význam i u nemocných, kteří nemají anémii. Intravenózní podávání železa po dobu 24 týdnů vedlo u těchto nemocných ke zlepšení kvality života, snížení třídy NYHA a zlepšení renálních funkcí [129].
Doporučení IIa, úroveň znalostí B7.8. CHSS a tromboembolie
Nemocní se srdečním selháním mají vyšší riziko tromboembolických komplikací dané přítomností všech 3 podmínek vzniku trombózy podle Virchowovy triády. Mezi rizikové faktory tromboembolické příhody patří nízký minutový výdej, poruchy kinetiky levé komory, těžká systolická dysfunkce levé komory, fibrilace síní a vyšší věk. Výskyt cévní mozkové příhody, plicní a periferní embolie se odhaduje na 2 % ročně, incidence však může být podhodnocena pro jejich často klinicky němý průběh [130]. Riziko vzniku tromboembolických příhod samozřejmě významně zvyšuje přítomnost fibrilace síní. Roční riziko kardioembolizační příhody u nemocných s fibrilací síní kolísá od 10 do 17 %. Četnost výskytu trombů v levé komoře se u pacientů s CHSS odhaduje na méně než 10 %. Riziko embolizace je největší u pohyblivých intrakardiálních trombů, přisedlé tromby jsou méně nebezpečné [131]. Cílem perorální antikoagulační terapie je u nemocných se srdečním selháním především snížení rizika embolizace do velkého oběhu. Antikoagulační léčba s INR 2,0–3,5 je nutná u všech nemocných s fibrilací síní a dále u nemocných po systémové nebo plicní embolizaci. Tato léčba je taktéž vhodná u nemocných s chronickým srdečním selháním a intrakardiálním trombem např. po rozsáhlém infarktu myokardu přední stěny s aneu ryzmatem, u nemocných s výraznou dilatací levé komory neischemické etiologie, u nemocných s ejekční frakcí levé komory nižší než 20 % a u nemocných s anamnézou hluboké žilní trombózy. Podle studie WATCH nevedlo podávání warfarinu s cílovou hodnotou INR 2,5–3,0 u pacientů se srdečním selháním s EF LK < 35 % a se sinusovým rytmem ke zlepšení prognózy ve srovnání s aspirinem či clopidogrelem.
Doporučení IIa, úroveň znalostí B7.9. Léčba CHSS a onemocnění štítné žlázy
Tyreotoxikóza je spojena s hyperkinetickou cirkulací a zvýšené metabolické nároky myokardu při ní mohou vést až ke vzniku srdečního selhání s vysokým srdečním výdejem.
Léčba je zaměřena na rychlé zmírnění symptomů a snížení nároků na srdce. Hlavním léčebným opatřením je zábrana syntézy a uvolňování tyreoidálních hormonů pomocí tyreostatik. Normalizace tyreoidální funkce je však dosaženo až za několik týdnů. K rychlému zmírnění symptomů se podávají beta-blokátory. Zpomalení srdeční frekvence převáží nad jejich negativně inotropním účinkem. Přednost se dává neselektivním přípravkům, protože zabraňují periferní konverzi tyroxinu (T4) na trijodotyronin (T3). Ostatní léčba je stejná jako u srdečního selhání jiné etio logie. Léčba fibrilace síní je omezena pouze na kontrolu srdeční frekvence, protože dokud je nemocný hypertyreózní, pokusy o kardioverzi obvykle selhávají. Po normalizaci funkce štítnice nemocný většinou spontánně vertuje na sinusový rytmus [132]. Po celou dobu trvání fibrilace síní musí být nemocný na antikoagulační léčbě.
Kardiovaskulární postižení při hypotyreóze je opakem změn při hypertyreóze. Je snížený tepový i minutový srdeční objem, snižuje se kontraktilita myokardu. Srdeční selhání se však rozvine jen zřídka, protože snížený srdeční výdej je kompenzován sníženými metabolickými nároky a sníženou spotřebou kyslíku. Naopak, vznik srdečního selhání hrozí při příliš rychlé substituci tyreoidálními hormony, kdy může dojít k rychlému a velkému vzestupu metabolických nároků myokardu [132].
Doporučení I, úroveň znalostí C7.10. CHSS a deprese
Kvalita života nemocných s pokročilým CHSS je velmi nízká, zejména pro přítomnost obtíží, snížení tolerance fyzické zátěže a pro opakované hospitalizace pro dekompenzaci srdečního selhání. Důsledkem těchto obtíží může být vznik deprese. Výskyt deprese je u nemocných s CHSS častější, než je tomu v běžné populaci. Prevalence středně těžké a těžké formy deprese je u pacientů s CHSS 20–40 % [133]. Deprese je však u těchto nemocných nedostatečně diagnostikována, a tudíž i léčena. Diagnóza deprese bývá u nemocných s CHSS obtížná, protože některé příznaky jsou u obou syndromů podobné, např. únavnost. Správně léčena je méně než 1/2 z diagnostikovaných depresí. Deprese je významným rizikovým faktorem rozvoje kardiovaskulárních onemocnění, zhoršuje nejen průběh onemocnění, ale i prognózu nemocných s CHSS [134]. Kardiovaskulární onemocnění je ale naopak rizikovým faktorem pro rozvoj deprese. Odhalení deprese má pro pacienta velký význam, dosud však chybí důkazy pro to, že by psychoterapie či farmakoterapie zlepšily prognózu u těchto nemocných. Antidepresiva SSRI (fl uoxetin, paroxetin, escitalopram, citalopram) jsou lékem volby při léčbě deprese u nemocných s kardiálním onemocněním, toto je dáno jejich bezpečností a cíleným ovlivněním serotoninového metabolizmu, což má příznivý vliv na některé procesy provázející kardiovaskulární onemocnění. V některých studiích bylo dokonce podání selektivních inhibitorů zpětného vychytávání serotoninu provázeno nižším výskytem srdečního selhání [135]. Tricyklická antidepresiva nejsou pro jejich možné nežádoucí účinky v léčbě pacientů s CHSS vhodná.
7.11. CHSS a spánková apnoe
Poruchy dýchání ve spánku (sleep disordered breathing – SDB) jsou u pacientů s CHSS mnohem častější než v běžné populaci a jejich přítomnost má nepříznivý vliv na prognózu těchto nemocných. Spánková apnoe se vyskytuje u 50–60 % nemocných s CHSS. U pacientů s CHSS se může objevit jak obstrukční spánková apnoe (OSA), tak centrální spánková apnoe (CSA) [136]. Obstrukční spánková apnoe představuje nezávislý rizikový faktor vzniku srdečního selhání s relativním rizikem 2,38 [137]. Na negativních kardiovaskulárních důsledcích spánkové apnoe se u pacientů s CHSS podílí především hypoxemie, zvýšený tonus sympatického nervového systému, aktivace renin-angiotenzin aldosteronového systému a výrazně negativní nitrohrudní tlak v průběhu obstrukce horních cest dýchacích. Kromě negativního ovlivnění funkce selhávajícího myokardu mají nemocní s CHSS a spánkovou apnoí vyšší riziko výskytu komorových arytmií, a v konečném důsledku i zvýšené riziko náhlé srdeční smrti.
Léčba SDB je u pacientů s CHSS komplexní. U pacientů s OSA zahrnuje léčbu obezity, abstinenci alkoholu a sedativ, oxygenoterapii a použití neinvazivní ventilace s kontinuálním přetlakem (CPAP). U pacientů s CSA zahrnuje optimální farmakoterapii srdečního selhání (ACE-I, BB, diuretika), léčbu poruch srdečního rytmu, zejména bradyarytmií, srdeční resynchronizační léčbu a CPAP.
7.12. CHSS a těhotenství
Etiologie srdečního selhání vyskytujícího se v souvislosti s těhotenstvím je různorodá, patří sem: peripartální kardiomyopatie (PPKM), hypertrofická kardiomyopatie (HKM), dilatační kardiomyopatie (DKM), získané či vrozené srdeční vady a vzácně ischemická choroba srdeční [138].
Riziko pro matku a potomka: Ženy se srdečním selháním by měly být informovány o riziku zhoršení stavu během těhotenství a v peripartálním období. Měly by být poučeny ohledně rozložení jednotlivých rizik. Pokud dojde k těhotenství, je ejekční frakce levé komory (LV EF) pod 40 % silným ukazatelem vysokého rizika a mělo by být doporučeno pečlivé sledování v centru, kde je kardiologické pracoviště. Pokud je LV EF pod 20 %, je úmrtnost matek velmi vysoká a mělo by se důkladně zvážit ukončení těhotenství.
Peripartální kardiomyopatie: Výskyt se liší od 1 : 300 do 1 : 4 000 těhotenství s důrazem na genetické a kulturní faktory. Zdá se, že predisponujícími faktory jsou multiparita a vícečetné porody, rodinná anamnéza, kouření, diabetes, hypertenze, preeklampsie, podvýživa, pokročilý věk matek nebo těhotenství dospívajících a dlouhodobé užívání beta-agonistů. Etiologie PPKM není přesně známa, svou roli zde hrají: infekce, zánět a autoimunitní procesy. Podle současných definicí je PPKM idiopatická kardiomyo patie, která se projevuje srdečním selháním ke konci těhotenství nebo v měsících po porodu. Je to diagnóza na základě vyloučení jiné příčiny srdečního selhání. Levá komora nemusí být rozšířená, ale LV EF je téměř vždy snížena pod 45 %.
Symptomy a projevy jsou často typické pro srdeční selhání, ale v důsledku mimořádného fyziologického stavu v těhotenství a po porodu bylo u PPKM pacientek zaznamenáno široké spektrum symptomů. Často se projevuje akutní srdeční selhání. Byly popsány i komplexní komorové arytmie a náhlá srdeční zástava. V některých případech nejsou striktně splněna všechna diagnostická kritéria. Echokardiografi e je metoda, které se dává při hodnocení LV funkce přednost.
Léčebná terapie: Při předepisování léků je třeba vzít v úvahu možné nežádoucí účinky na plod. Urgentní porod, bez ohledu na vývoj těhotenství, lze očekávat u žen, u kterých se projevilo nebo přetrvává pokročilé srdeční selhání s hemodynamickou nestabilitou. Jakmile žena dítě porodí a je hemodynamicky stabilní, lze přikročit ke standardní terapii srdečního selhání.
Ve fázi bezprostředně po porodu by měla být zvážena antikoagulační terapie, jakmile se zastaví krvácení. U pacientek s velmi nízkou EF je častá plicní a periferní embolizace včetně do CNS. Toto je částečně důsledkem zvýšené prokoagulační aktivity v peripartální fázi.
Srdeční selhání by mělo být léčeno dle doporučení pro akutní a chronické srdeční selhání. Během těhotenství jsou kontraindikovány ACE inhibitory, sartany i přímé inhibitory reninu z důvodu toxicity pro plod. Když jsou během kojení zapotřebí ACE inhibitory, měla by se dávat přednost benazeprilu, captoprilu nebo enalaprilu. Dopamin a levosimendan lze použít, pokud je zapotřebí zvýšit stažlivost. Léčba pomocí beta-blokátorů je indikována u všech pacientek se srdečním selháním, pokud ji snášejí. Přednost by měl mít β1-selektivní metoprolol ZOK nebo bisoprolol. Novorozenci by měli být pod dohledem po 24–48 hod po porodu, aby se vyloučila hypoglykemie, bradykardie a respirační deprese. Diuretika by se měla používat pouze v případě plicního městnání, poněvadž mohou snižovat průtok krve placentou. Furosemid a hydrochlorotiazid jsou nejběžněji používaná léčiva. Antagonisté aldosteronu by se neměly používat. Spironolakton může být spojován s antiandrogenními účinky v prvním trimestru. Údaje týkající se eplerenonu nejsou dostupné.
Koagulační aktivita se v těhotenství zvyšuje. V souvislosti se sníženou LV EF u PPKM je třeba zvážit léčbu s LMWH. Antikoagulace se doporučuje u pacientek s intrakardiálním trombem nebo při průkazu systémové embolie a rovněž u pacientek se srdečním selháním a paroxyzmální nebo perzistentní fibrilací síní. Když se použije LMWH, měly by se monitorovat hladiny anti-Xa.
Intervence: Pokud je pacientka i přes optimální léčbu závislá na pozitivně inotropních lécích, měla by být transportována na kardiologické pracoviště, kde mají k dispozici intraaortální balónkovou kontrapulzaci nebo mechanickou podporu; o jejich indikacích musí rozhodnout kardiologický a kardiochirurgický tým. Je důležité poznamenat, že prognóza PPKM se liší od prognózy dilatační kardiomyopatie, s výrazným podílem zlepšení nebo normalizace funkce LK v průběhu prvních 6 měsíců po stanovení diagnózy. Při rozhodování je nutné vzít v úvahu poměrně vysokou míru (kolem 50 %) spontánního zotavení.
Srdeční transplantace: Srdeční transplantace by měla být vyhrazena pacientkám, u nichž není možná oběhová podpora nebo není z individuálních důvodů vhodná, nebo těm, které se nezotavily po 6–12 měsících na mechanické oběhové podpoře.
Porod: Vaginální porod má vždy přednost, pokud je pacientka hemodynamicky stabilní a neexistují žádné indikace pro porod císařským řezem. Vyžaduje se pečlivé hemodynamické monitorování. Dává se přednost epidurální analgezii. Porod před termínem byl zaznamenán u 17 % pacientek bez jakýchkoli výrazných negativních účinků na dítě. Urgentní porod bez ohledu na délku těhotenství by měl být brán v úvahu u žen s pokročilým srdečním selháním a hemodynamickou nestabilitou, která trvá i přes léčbu. Doporučuje se císařský řez v kombinaci se spinální a epidurální anestezií. Je zapotřebí zkušený mezioborový tým.
Kojení: Některé ACE inhibitory (benazepril, captopril, enalapril) byly dostatečně testovány u kojících žen, a pokud je matka použije, je to pro dítě bezpečné. Váha dítěte, monitorovaná během prvních 4 týdnů, je zásadní při sledování funkce ledvin. Pilotní studie podporuje hypotézu, že přidání bromokriptinu ke standardní terapii srdečního selhání má příznivé účinky pro zlepšení LV EF a klinického stavu u žen s akutním selhání PPKM. Kromě toho je třeba, z důvodu vysokých metabolických nároků při laktaci a kojení zvážit možnost zabránění laktace.
Prognóza a poradenství pro opakované těhotenství: Systematické studie z evropských zemí nejsou dosud k dispozici. Zhoršení funkce LK je zaznamenáno až u 50 % případů, i přes optimální lékařskou péči.
Další těhotenství s sebou nese 30–50% riziko opakovaného výskytu PPKM. Pokud není EF normalizována, nemělo by být další těhotenství doporučováno. I v případě, že je EF normalizována, je stále zapotřebí poradenství kvůli riziku opakovaného výskytu při novém těhotenství.
Dilatační kardiomyopatie (DKM) a jiné příčiny CHSS v těhotenství: Odlišení od PPKM je dáno dobou projevu choroby. Pokud není choroba známa před početím, je většinou zjištěna během I. nebo II. trimestru, kdy se zvyšuje hemodynamická zátěž. Rodinná anamnéza hovoří ve prospěch diagnózy DKM. Sekundární kardiomyopatie, jako např. infiltrativní nebo toxické kardiomyopatie nebo metabolické poruchy a jiné vzácné formy, se rovněž mohou v těhotenství projevit. Hypertenze nebo ischemická srdeční choroba mohou rovněž vytvářet obdobný klinický obraz, i když jsou vzácnější.
Riziko pro matku a potomka: Ženy s DKM by měly být informovány o riziku zhoršení stavu během těhotenství a v peripartálním období (viz výše pro PPKM).
Léčba: Nemocné s DKM se léčí v souladu se současnými doporučeními pro srdeční selhání (s úpravou během těhotenství), která byla výše popsána pro PPKM.
Těhotné ženy s CHSS by měly být léčeny stejně jako netěhotné s respektováním kontraindikací některých léků.
Doporučení I, úroveň znalostí CŽeny s DKM by měly být informovány o riziku zhoršení během těhotenství.
Doporučení I, úroveň znalostí CRizika léků v graviditě dle FDA (tab. 26):
- Kategorie B: Studie na zvířatech neprokázaly riziko pro plod a kontrolované studie těhotných žen nebyly provedeny; nebo studie na zvířatech prokázaly nežádoucí účinek na plod, ale dobře kontrolované studie u těhotných žen žádné riziko pro plod neprokázaly.
- Kategorie C: Studie prokázaly, že lék má teratogenní nebo embryocidní účinky u zvířat, ale nebyly provedeny žádné kontrolované studie u žen; nebo nejsou dostupné studie u zvířat ani u žen.
- Kategorie D: Existují doklady rizika pro lidský plod, ale z důvodu prospěšnosti za určitých okolností (např. život ohrožující situace nebo závažná onemocnění, při nichž nelze použít bezpečnější léky nebo jsou tyto léky neúčinné) může být použití léku přijatelné navzdory rizikům, která jsou s ním spojena.
Tab. 26. Rizika léků v graviditě. 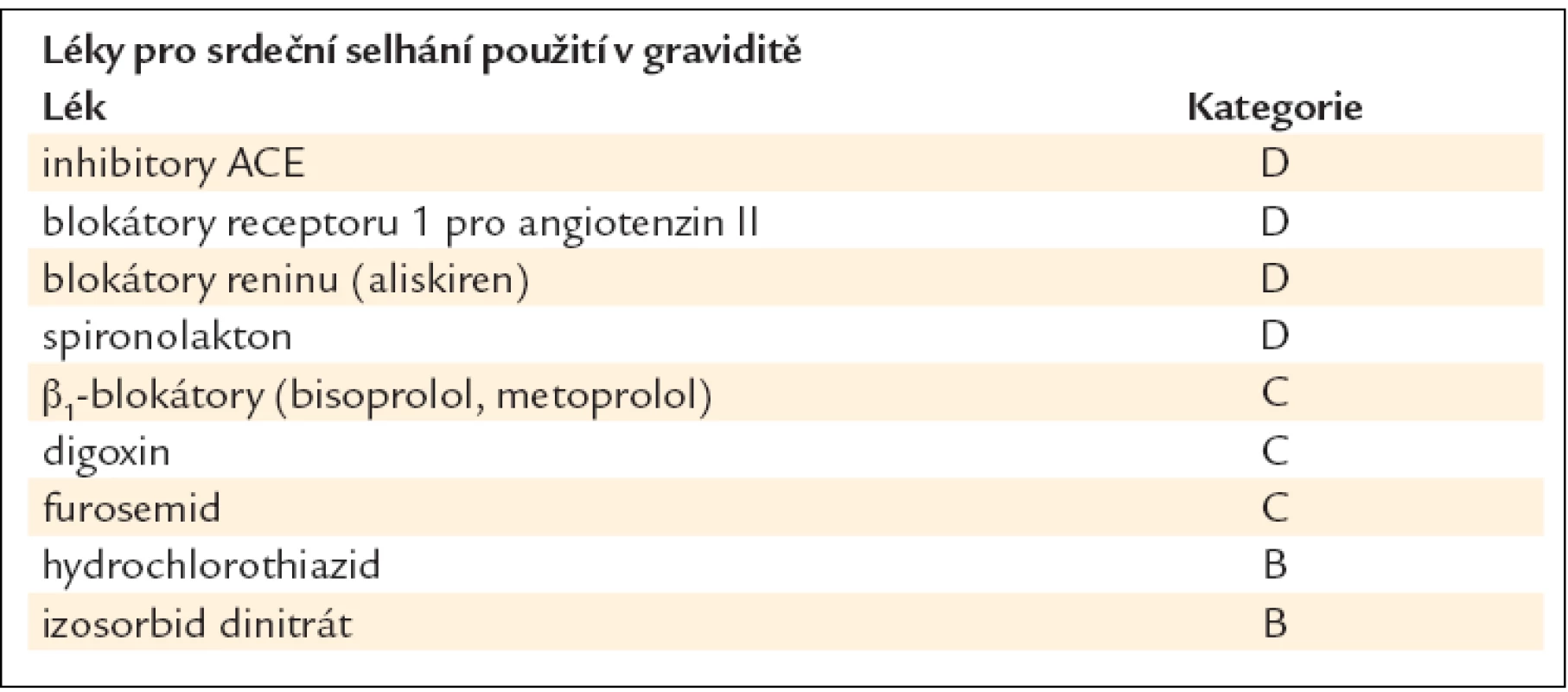
8. Závěrečná opatření, organizační zabezpečení
Každý lékař bez ohledu na obor musí rozpoznat akutní srdeční selhání, zajistit základní péči a odeslat nemocného na jednotku intenzivní péče interního oddělení nebo na koronární jednotku. Většina rychlých záchranných služeb je vybavena 12svodovým EKG, mnohdy napojeným na nejbližší koronární jednotku či angiolinku, a v případě akutního koronárního syndromu se srdečním selháním odváží nemocné přímo do těchto specializovaných center.
Pokud je prvním diagnostikujícím lékařem praktický lékař nebo internista, měl by nemocného vyšetřit klinicky, elektrokardiograficky, zajistit základní hematologické a biochemické vyšetření, EKG a RTG hrudníku a odeslat ho ke kardiologovi. Kardiolog provede nebo zajistí echokardiografické vyšetření, případně BNP či NT-pro BNP, a zváží další specializovaná vyšetření.
O nemocného s chronickým srdečním selháním by pak měl pečovat kardiolog ve spolupráci s praktickým lékařem. Problematika srdečního selhání se dnes stala natolik závažnou, že považujeme za žádoucí zřizovat specializované ambulance a specializovaná oddělení srdečního selhání, nejlépe na úrovni kardiocenter. V případě, že se jedná o nemocné se závažnou komorovou dysfunkcí, případně i s pokročilým až terminálním srdečním selháním, je nutné kontaktovat centra, která provádějí transplantace srdce.
U nemocných s blokem levého Tawarova raménka ve stadiu NYHA III a IV by mělo být kontaktováno specializované centrum indikující a provádějící resynchronizační léčbu, obdobně u nemocných (NYHA I–III) s prokázanou maligní arytmií, či alespoň s podezřením na tuto komplikaci musí být kontaktováno centrum implantující kardiovertery-defibrilátory. Pokud tito nemocní mají velmi pokročilé selhání s vyhlídkou indikace k transplantaci srdce, je žádoucí kontaktovat přímo kardiocentrum s programem transplantace srdce, kde resynchronizace a/nebo implantace ICD může být provedena jako přemostění („bridge“) k transplantaci.
O nemocného se stabilizovaným srdečním selháním by měl pečovat praktický lékař, včetně preskripce léků. Praktický lékař rozhoduje o nutnosti kontrolních vyšetření, která by měl indikovat vždy při zhoršení zdravotního stavu. Při každé kontrole se doplní anamnéza, provede klinické vyšetření se změřením krevního tlaku a pulzu, minimálně 1krát za rok EKG vyšetření, RTG vyšetření a základní laboratoř. Kontrola u kardiologa by měla být alespoň 1krát za 1/2 roku. Echokardiografické vyšetření a další specializovaná vyšetření indikuje kardiolog.
Zdravotní stav nemocných se srdečním selháním často vyžaduje hospitalizaci. Nemocní by měli být hospitalizováni na kardiologických lůžcích příslušné spádové nemocnice. Podle průzkumu EURO HEART SURVEY v České republice má 25 % nemocných hospitalizovaných na interním oddělení chronické srdeční selhání a nemocniční mortalita je 7 %.
Nemocní, kteří dospěli do stadia vyšetření a přípravy na případnou transplantaci srdce, musí být vyšetřováni za hospitalizace v centrech, která transplantace provádějí. V současnosti to jsou Klinika kardiologie IKEM Praha a I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně. Vlastní výkon provádějí Klinika kardiovaskulární chirurgie IKEM Praha a Centrum kardiovaskulární a transplantační chirurgie Brno. Resynchronizační léčbu a implantaci defibrilátorů provádí většina velkých nemocnic (Fakultní nemocnice, Nemocnice Na Homolce, IKEM Praha atd.).
Seznam zkratek
ACE – angiotenzin konvertující enzym
ACE-I – inhibitor angiotenzin konvertujícího enzymu
AIM – akutní infarkt myokardu
AP – angina pectoris
ARB – blokátory receptoru 1 pro angiotenzin II
ASA – kyselina acetylsalicylová
ATP – adenosintrifosfát
AV – atrioventrikulární
BB – beta-blokátory
BiV (BiV-KS) – biventrikulární kardiostimulátor
BiV-ICD – implantabilní kardioverter-defibrilátor s biventrikulární stimulací
BMI – body mass index
BNP – brain natriuretický peptid
BRA – blokátory receptoru pro aldosteron
BSA – body surface area
CABG – aorto-koronární bypass
CMP – cévní mozková příhoda
CNS – centrální nervová soustava
CPAP (continuous positive airway pressure) – neinvazivní ventilace s kontinuálním přetlakem
CRP – C-reaktivní protein
CRT – resynchronizační léčba (viz taktéž SRL)
CSA – centrální spánková apnoe
CT – computerová tomografie
CVVH – kontinuální venovenózní hemofiltrace
CŽT – centrální žilní tlak
ČKS – Česká kardiologická společnost
ČR – Česká republika
DKM – dilatační kardiomyopatie
DM – diabetes mellitus
DSMB (data safety monitoring board) – bezpečnostní komise
DT – decelerační čas
EBM – Evidence Based Medicine
EDD – enddiastolický diameter
EDV – enddiastolický objem
EF – ejekční frakce
ECHO – echokardiografie
EKG – elektrokardiogram
ESC – Evropská kardiologická společnost
ESV – endsystolický objem
FDA – Food and Drug Administration
FN – fakultní nemocnice
FS – fibrilace síní
GF – glomerulární filtrace
GFR – glomerulární filtrace
GIT – gastrointestinální trakt
HD – hemodalýza
HF – hemofiltrace
HFPEF (heart failure with preserved ejection fraction) – srdeční selhání se zachovalou ejekční frakcí
HKM – hypertrofická kardiomyopatie
hsCRP – high sensitivity CRP
CHOPN – chronická obstrukční plicní nemoc
CHSS – chronické srdeční selhání
ICD – implantabilní kardioverter-defibrilátor
ICHDK – ischemická choroba dolních končetin
ICHS – ischemická choroba srdeční
IKEM – Institut klinické a experimentální medicíny
INR – international normalised ratio
IVRT – izovolumický relaxační čas
KI – kontraindikace
KS – kardiostimulátor
KT – komorová tachykardie
KTI – kardiotorakální index
KV – kardiovaskulární
LAVi – index objemu levé síně
LMWH – nízkomolekulární heparin
LK – levá komora
LS – levá síň
LVAD (left ventricular assist devices) – srdeční podpory
LV EF – ejekční frakce levé komory
LVMi – index hmoty levé komory
MRI – magnetická rezonance
NAP – nestabilní angina pectoris
NSS – náhlá srdeční smrt
NTG – nitroglycerin
NT-pro BNP – N-terminální fragment natriuretického propeptidu typu B
NYHA – New York Heart Association
OSA – obstrukční spánková apnoe
OTS – ortotopická transplantace srdce
PAD – perorální antidiabetika
PCI – perkutánní koronární intervence – angioplastika
PDE – fosfodiesteráza
PH – plicní hypertenze
PK – pravá komora
PPKM – peripartální kardiomyopatie
PSK – programovaná stimulace komor
PWP – tlak v zaklínění
RAAS – renin-angiotenzin-aldosteronový systém
RFA AVJ – radiofrekvenční ablace atrioventrikulární junkce
RTG – rentgen
SCUF – pomalá kontinuální ultrafiltrace
SDB (sleep disordered breathing) – poruchy dýchání ve spánku
SI – srdeční index
SKG – selektivní koronarografie
SM – semipermeabilní membrána
SNS – sympatoadrenální systém
SR – sinusový rytmus
SRL – srdeční resynchronizační léčba (viz taktéž CRT)
SSRI (selective serotonin reuptake inhibitors) – selektivní inhibitory zpětného vychytávání serotoninu
SVR – systémová vaskulární rezistence
TF – tepová frekvence
TK – krevní tlak
dTK – diastolický krevní tlak
sTK – systolický krevní tlak
UF – ultrafiltrace
UZIS – Ústav zdravotnických informací a statistiky
VO2 max – maximální (vrcholová) spotřeba kyslíku
Wj – Woodovy jednotky
WPW – Wolwův Parkinsonův Whiteův syndrom
ZOK (zero order kinetik) – kinetika nultého řáduOtištěno s laskavým svolením výboru České kardiologické společnosti a redakční rady časopisu Cor et Vasa. Originálně publikováno ve zkrácené verzi v Cor Vasa 2012; 54(3–4): 161–182.
prof. MUDr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
e-mail: jspinar@fnbrno.cz
Doručeno do redakce: 27. 12. 2011
Zdroje
1. Dickstein K, Cohen-Solal A, Fillippatos G et al. ESC Committee for Practice Guidelines (CPG). ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur Heart J Fail 2008; 10 : 933–989.
2. Špinar J, Hradec J, Meluzín J et al. Doporučení pro diagnostiku a léčbu srdečního selhání ČKS 2006. Cor et Vasa 2007; 49: K5–K33.
3. Hradec J. Diastolické srdeční selhání. In: Habilitační a inaugurační přednášky na 1. lékařské fakultě UK v Praze 2004. Praha: Galen 2005 : 148–154.
4. Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007; 93 : 1137–1146.
5. Stewart S, MacIntyre K, Hole DJ et al. More “malignant” than cancer? Five-year survival following a first admission for heart failure. Eur J Heart Fail 2001; 3 : 315–322.
6. Rosolová H, Čech J, Simon J et al. Short to long term mortality of patients hospitalised in the Czech Republic – report from the Euro-Heart Failure Survey. Eur J Heart Fail 2005; 7 : 780–783.
7. Cowie MR, Wood DA, Coats AJ et al. Survival of patients with a new diagnosis of heart failure: a population based study. Heart 2000; 3:
505–510.
8. Bhatia RS, Tu JV, Lee DS et al. Outcome of heart failure with preserved ejection fraction in a population-based study. N Engl J Med 2006; 355 : 260–269.
9. Hunt SA, Abraham WT, Chin MH et al. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): Developed in Collaboration With the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: Endorsed by the Heart Rhythm Society. Circulation 2005; 112 : 1825–1852.
10. Leier CV. Examining the Jugular Vein Is Never in Vain. Circ Heart Fail 2010; 3 : 175–177.
11. Cleland JG, Swedberg K, Follath F et al. Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. The Euro Heart Failure Survey Programme – a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur Heart J 2003; 24 : 442–463.
12. Rame JE, Dries DL, Drazner MH. The prognostic value of the physical examination in patients with chronic heart failure. Congest Heart
Fail 2003; 9 : 170–178.
13. Hasselblad V, Gattis Stough W, Shah MR et al. Relation between dose of loop diuretics and outcomes in a heart failure population: results of the ESCAPE trial. Eur J Heart Fail 2007; 9 : 1064–1069.
14. Maisel AS, Krishnaswamy P, Nowak RM et al. Breathing Not Properly Multinational Study Investigators. Rapid measurement of Btype
natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002; 347 : 161–167.
15. Jourdain P, Jondeau G, Funck F et al. Plasma brain natriuretic peptide-guided therapy to improve outcome in heart failure: the STARS-BNP Multicenter Study. J Am Coll Cardiol 2007 : 49 : 1733–1739.
16. Špinar J, Vítovec J, Blaha M et al. Radiologic changes in chronic heart failure. Cor Vasa 1992; 34 : 88–99.
17. Garcia MJ, Thomas JD, Klein AL. New Doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol 1998; 32 : 865–875.
18. Nagueh SF, Middleton KJ, Kopelen HA et al. Doppler tissue imaging: A noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol 1997; 30 : 1527–1533.
19. Ommen SR, Nishimura RA, Appleton CP et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures: A comparative simultaneous Doppler-catheterization study. Circulation 2000; 102 : 788–1794.
20. Nagueh SF, Appleton CP, Gillebert TC et al. Recommendations for the evaluation of left ventricular diastolic function by chocardiography. Eur J Echocardiogr 2009; 10 : 165–193.
21. Paulus WJ, Tschöpe C, Sanderson JE et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J 2007; 28 : 2539–2550.
22. Mehra MR, Kobashigawa J, Starling R et al. Listing criteria for heart transplantation: International Society for Heart and Lung transplantation guidelines for the care of cardiac transplant candidates – 2006. J Heart Lung Transplant 2006; 25 : 1024–1042.
22a. Arena R, Myers J, Abella J et al. Development of a ventilatory classification system in patients with heart failure. Circulation 2007; 115 : 2410–2417.
23. Cífková R, Býma S, Češka R et al. Prevence kardiovaskulárních onemocnění v dospělém věku. Společné doporučení českých odborných společností. Cor Vasa 2005; 47 : 3–14.
24. Lewis EF, Johnson PA, Johnson W et al. Preferences for quality of life or survival expressed by patients with heart failure. J Heart Lung
Transplant 2001; 20 : 1016–1024.
25. Hradec J, Berka L, Táborský M. Posuzování způsobilosti kardiologických nemocných k řízení motorových vozidel. Cor et Vasa 2006; 48: K47–K51.
26. Kloner RA, Brown M, Prisant LM et al. Effect of sildenafil in patients with erectile dysfunction taking antihypertensive therapy. Sildenafil Study Group. Am J Hypertens 2001; 14 : 70–73.
27. Davis MM, Taubert K, Benin AL et al. American Heart Association; American College of Cardiology; American Association of Cardiovascular and Pulmonary Rehabilitation; American Association of Critical Care Nurses; American Association of Heart Failure Nurses; American Diabetes Association; Association of Black Cardiologists, Inc; Heart Failure Society of America; Preventive Cardiovascular Nurses Association; American Academy of Nurse Practitioners; Centers for Disease Control and Prevention and the Advisory Committee on Immunization. Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association/American College of Cardiology. J Am Coll Cardiol 2006; 48 : 2610.
28. Pilote L, Abrahamowitz M, Rodrigues E et al. Mortality rates in elderly patients who take different angiotenzin enzyme converting inhibitors after acute myocardial infarction: a class effect? Ann Intern Med 2004; 141 : 102–112.
29. Hansen ML, Gislason GH, Køber L et al. Different angiotenzin converting enzyme inhibitors have similar clinical efficacy after myocardial infarction. Br J Clin Pharmacol 2008; 65 : 217–223.
30. Packer M, Poole-Wilson PA, Armstrong PW et al. Comparative effects of low and high doses of the angiotenzin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. ATLAS Study Group. Circulation 1999; 100 : 2312–2318.
31. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316 : 1429–1435.
32. EUropean trial on Reduction Of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomized, double-blind, placebo controlled,
multicentre trial (the EUROPA study). Lancet 2003; 362 : 782–788.
33. Yusuf S, Sleight P, Pogue J et al. Effects of an angiotenzin-converting enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342 : 145–153.
34. McMurray J, Cohen-Solal A, Dietz R et al. Practical recommendations for the use of ACE inhibitors, beta-blockers, aldosterone antagonists and angiotenzin receptor blockers in heart failure: putting guidelines into practice. Eur J Heart Fail 2005; 7 : 710–721.
35. Cleland J, Tendera M, Adamus J et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27 : 2338–2345.
36. Massie BM, Carson PE, McMurray JJ et al. I-PRESERVE Investigators. Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359 : 2456–2467.
37. Yusuf S, Pfeffer MA, Swedberg K et al. CHARM Investigators and Committees. Effects of candesartan in patients with CHF and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362 : 777–781.
38. Konstam MA, Neaton JD, Drexler H et al. HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial. Lancet 2009 : 374 : 1840–1848.
39. Dargie HJ. The Capricorn Investigators: Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular
dysfunction: the CAPRICORN randomised trial. Lancet 2001; 357 : 1385–1390.
40. Vitovec J, Špinar J. Beta-blokátory v léčbě chronického srdečního selhání. Vnitř Lék 2000; 46 : 161–165.
41. Remme WJ. Should ACE inhibitors Always be First-Line Therapy in Heart Failure? Lessons implanfrom the CARMEN Study. Cardiovasc Drugs Ther 2003; 17 : 107–109.
42. Willenheimer R, van Veldhuisen DJ, Silke B et al. CIBIS III Investigators. Effect on Survival and Hospitalization of Initiating Treatment for
Chronic Heart Failure With Bisoprolol Followed by Enalapril, as Compared With the Opposite Sequence Results of the Randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005; 112 : 2426–2435.
43. Anand IS, Florea VG. Diuretics in chronic heart failure – benefits and hazards. Europ Heart J 2001; 3 (Suppl G): G8–G18.
44. Haller C. Diuretics in congestive heart failure: new evidence for old problems. Nephrol Dial Transplant 1999; 14 : 1358–1360.
45. Reyes AJ, Taylor SH. Diuretics in Cardiovascular Therapy: The new Clinicopharmacological Bases That Matter. Cardiovasc Drug Ther 1999; 13 : 371–398.
46. Konstam MA, Gheorghiade M, Burnett JC Jr et al. Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study With Tolvaptan
(EVEREST) Investigators. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA
2007; 297 : 1319–1331.
47. Zannad F, McMurray JJ, V Krum H et al. EMPHASIS-HF Study Group. Eplerenone in Patients with Systolic Heart Failure and Mild symptoms. N Engl J Med 2011; 364 : 11–21.
48. Berry C, McMurray JJ. Serious adverse events experienced by patients with chronic heart failure taking spironolactone. Heart 2001; 85: E8.
49. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336:
525–533.
50. Rathore SS, Wang Y, Krumholz HM. Sex-based differences in the effect of digoxin for the treatment of heart failure. N Engl J Med 2002;
347 : 1403–1411.
51. Hood WB Jr, Dans AL, Guyatt GH et al. Digitalis for treatment of congestive heart failure in patients in sinus rhythm: a systematic review and meta-analysis. J Card Fail 2004; 10 : 155–164.
52. Rathore SS, Curtis JP, Wang Y et al. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA 2003; 289 : 871–878.
53. Beemath A, Stein PD, Skaf E et al. Risk of venous thromboembolism in patients hospitalized with heart failure. Am J Cardiol 2006; 98:
793–795.
54. Witt BJ, Gami AS, Ballman KV et al. The incidence of ischemic stroke in chronic heart failure: a meta-analysis. J Card Fail 2007; 13 : 489–496.
55. de Peuter OR, Kok WE, Torp-Pedersen C et al. Systolic heart failure: a prothrombotic state. Semin Thromb Hemost 2009; 35 : 497–504.
56. Gibbs CR, Blann AD, Watson RD et al. Abnormalities of Hemorheological, Endothelial, and Platelet Function in Patients With Chronic
Heart Failure in Sinus Rhythm: effects of angiotenzin-converting enzyme inhibitor and beta-blocker therapy. Circulation 2001; 103 : 1746–1751.
57. Bettari L, Fiuzat M, Becker R et al. Thromboembolism and Antithrombotic Therapy in Patients With Heart Failure in Sinus Rhythm Current Status and Future Directions. Circ Heart Fail 2011; 4 : 361–368.
58. Cokkinos DV, Harabalopoulos GC, Kostis JB et al. HELLAS Investigators. Efficacy of antithrombotic therapy in chronic heart failure. Eur
J Heart Fail 2006; 8 : 428–432.
59. Camm AJ, Kirchhof P, Lip GY et al. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369–2429.
60. Kjekshus J, Apetrei E, Barrios V et al. CORONA Group. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007;
357 : 2248–2261.
61. GISSI-HF Investigators. Tavazzi L, Maggioni AP, Marchioli R et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebocontrolled trial. Lancet 2008; 372 : 1231–1239.
62. McMurray JJ, Kjekshus J, Gullestad L et al. CORONA Study Group. Effects of statin therapy according to plasma high sensitivity C-reactive protein concentration in the Controlled Rosuvastatin Multinational Trial in Heart Failure trial (CORONA): a retrospective analysis. Circulation 2009; 120 : 2188–2196.
63. Cleland JG, McMurray JJ, Kjekshus J et al. CORONA Study Group. Plasma concentration of amino-terminal pro-brain natriuretic peptide in chronic heart failure: Prediction of cardiovascular events and interaction with the effects of rosuvastatin: A report from CORONA (Controlled Rosuvastatin Multinational trial in Heart Failure). J Am Coll Cardiol 2009; 54 : 1850–1859.
64. Hradec J. Má význam podávání statinů u nemocných se srdečním selháním? Interní Med 2008; 10 : 216–218.
65. Fox K, Ford I, Steg PG et al. BEAUTIFUL Investigators. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372 : 807–816.
66. Swedberg K, Komajda M, Böhm M et al. SHIFT Investigators. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised
placebo-controlled study. Lancet 2010; 376 : 886–894.
67. Hradec J, Krupička J, Janota T. Budeme léčit srdeční selhání podle plazmatické koncentrace natriuretických peptidů? Čas Lék čes 2009; 148 : 383–388.
68. Dormans TP, Huige RM, Gerlag PG. Chronic intermittent hemofiltration and hemodialysis in end stage chronic heart failure with oedema refractory to high dose frusemide. Heart 1996; 75 : 349–351.
69. Giglioli C, Landi D, Cecchi E et al. Effects of ULTRAfiltration vs DiureticS on clinical, biohumoral and haemodynamic variables in patients with deCOmpensated heart failure: the ULTRADISCO study. Eur J Heart Fail 2011; 13 : 337–346.
70. Jaski BE, Ha J, Denys BG et al. Peripherally inserted veno-venous ultrafiltration for rapid treatment of volume overloaded patients. J Card Fail 2003; 9 : 227–231.
71. Lachmanová J. Očištovací metody krve. Praha: Grada 1999.
72. Táborský M, Kautzner J, Bytešník J et al. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a systémů pro srdeční resynchronizační léčbu 2009. Cor Vasa 2009; 51 : 602–614.
73. Dickstein K, Vardas PE, Auricchio A et al. 2010 Focussed update of ESC guidelines on device therapy in heart failure. Eur Heart J 2010; do:10.1093/eurhearj/ehq337.
74. Al Majed NS, McAlister FA, Bakal JA et al. Meta-analysis: Cardiac resynchronization therapy for patients with less symptomatic heart
failure. Ann Intern Med 2011; 154 : 401–412.
75. Auricchio A, Prinzen FW. Non-responders to cardiac resynchronization therapy – the magnitude of the problem and the issues. Circ J 2011; 75 : 521–527.
76. Dickstein K, Bogale N, Priori S et al. National Coordinators. The European cardiac resynchronization therapy survey. Eur Heart J 2009;
30 : 2450–2460.
77. Auricchio A, Stellbrink C, Sack S et al. Pacing Therapies in Congestive Heart Failure (PATH-CHF) Study Group. Long-term clinical effect of hemodynamically optimized cardiac resynchronization therapy in patients with heart failure and ventricular conduction delay. J Am Coll Cardiol 2002; 39 : 2026–2033.
78. Bristow MR, Saxon LA, Boehmer J et al. Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION)
Investigators. Cardiac-resynchronization therapy with or without an implantable defibrilator in advanced chronic heart failure. N Engl J Med
2004; 350 : 2140–2150.
79. Feldman AM, de Lissovoy G, Bristow MR et al. Cost effectiveness of cardiac resynchronization therapy in the Comparison of Medical
Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) trial. J Am Coll Cardiol 2005; 46 : 2311–2321.
80. Cleland JG, Daubert JC, Erdmann E et al. Cardiac Resynchronization-Heart Failure (CARE - HF) Study Investigators. The effect of cardiac resynchronization on morbidity and heart failure. N Engl J Med 2005; 352 : 1539–1549.
81. Rivero-Ayerza M, Theuns DA, Garcia-Garcia HM et al. Effects of cardiac resynchronization therapy on overall mortality and mode of death: a meta-analysis of randomized controlled trials. Eur Heart J 2006; 27 : 2682–2688.
82. Chung ES, Leon AR, Tavazzi L et al. Results of the Predictors of Response to CRT (PROSPECT) trial. Circulation 2008; 117 : 2608–2616.
83. Abraham WT, Fisher WG, Smith AL et al. MIRACLE Study Group; Multicenter Insync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart failure. N Engl Med 2002; 346 : 1845–1853.
84. Moss AJ, Hall WJ, Cannon DS et al. MADIT-CRT Trial Investigators. Cardiac-resynchronization therapy for the prevention of heart-failure events (MADIT-CRT). N Engl J Med 2009; 361 : 1329–1338.
85. Linde C, Gold M, Abraham WT et al. REVERSE Study Group. Rationale and design of a randomized controlled trial to assess the safety and efficacy of cardiac resynchronization therapy in patients with asymptomatic left ventricular dysfunction with previous symptoms or mild heart failure – the REsynchronization reVErses Remodeling in Systolic left vEntricular dysfunction (REVERSE) study. Am Heart J 2006; 151 : 288–294.
86. Daubert C, Gold MR, Abraham WT et al. REVERSE Study Group. Prevention of disease progression by cardiac resynchronization therapy in patients with asymptomatic or mildly symptomatic left ventricular dysfunction: insights from the European cohort of the REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction) trial. J Am Coll Cardiol 2009; 54 : 1837–1846.
87. Gasparini M, Auricchio A, Metra M et al. Multicentre Longitudinal Observational Study (MILOS) Group. Long-term survival in patients
undergoing cardiac resynchronization therapy: the importance of performing atrioventricular junction ablation in patients with permanent atrial fibrillation. Eur Heart J 2008; 29 : 1644–1652.
88. Gasparini M, Steinberg JS, Arshad A et al. Resumption of sinus rhythm in patients with heart failure and permanent atrial fibrillation
undergoing cardiac resynchronization therapy: a longitudinal observational study. Eur Heart J 2010; 31 : 976–983.
89. Kindermann M, Hennen B, Jung J et al. Biventricular versus conventional right ventricular stimulation for patients with standard
pacing indication and left ventricular dysfunction: the Homburg Biventricular Pacing Evaluation (HOBIPACE). J Am Coll Cardiol 2006; 47 : 1927–1937.
90. Yu CM, Chan JY, Zhang Q et al. Biventricular pacing in patients with bradycardia and normal ejection fraction. N Engl J Med 2009; 361 : 2123–2134.
91. Deng MC, Edwards LB, Hertz MI. et al. International Society for Heart and Lung Transplantation. Mechanical circulatory support device
database of the International Society for Heart and Lung Transplantation: third annual report – 2005. J Heart Lung Transplant 2005; 24 : 1182–1187.
92. Kettner J. Mechanické podpory krevního oběhu. Cor Vasa 2003; 45 : 437–443.
93. Pirk J, Málek I et al. Transplantace srdce. 1. vyd. Praha: Karolinum 2008.
94. Kirklin JK, Naftel DC, Kormos RL et al. Second INTERMACS annual report: More than 1,000 primary left ventricular assist device implants. J Heart Lung Transplant 2010; 29 : 1–10.
95. Zimpfer D, Zrunek P, Sandner S et al. Posttransplant survival after lowering fixed pulmonary hypertension using left ventricular devices.
Eur J Cardiothorac Surg 2007; 31 : 698–702.
96. Florian M, Málek I, Pirk J et al. Výsledky chirurgické revaskularizace myokardu u pacientů s významnou předoperační systolickou dysfunkcí levé komory. Cor Vasa 2001; 43 : 85–88.
97. Velazquez EJ, Kerry LL, Deja MA et al. STICH Investigators. Coronary-artery bypass surgery in patients with left ventricular dysfunction. N Engl J Med 2011; 364 : 1607–1616.
98. Jones RH, Velazques EJ, Michler RE et al. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med 2009; 360 : 1–13.
99. Mehra MR, Kobashigawa J, Starlig R et al. Listing criteria for Heart Transplantation: International Society for Heart and Lung Transplantation Guidelines for the Care of Cardiac transplant candidates – 2006. J Heart Lung Transpl 2006; 25 : 1024–1042.
100. Goodlin SJ, Hauptman PJ, Arnold R et al. Consensus Statement: Palliative and Supportive Care in Advanced Heart Failure. J Card Fail 2004; 10 : 200–209.
101. Hershberger RE, Nauman D, Walker TL et al. Care Processes and Clinical Outcomes of Continuous Outpatient Support with Inotropes (COSI) in Patients with Refractory Endstage Heart Failure. J Card Fail 2003; 9 : 180–187.
102. Stevenson LW. The Cul-de-Sac at the End of the Road. J Cardiac Failure 2003; 9 : 188–191.
103. Jaarsma T, Beattie JM, Ryder M et al. Advanced Heart Failure Study Group of the HFA of the ESC. Palliative care in heart failure: a position statement from the palliative care workshop of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2009 : 11 : 433–443.
104. Baker DW. Prevention of heart failure. J Card Fail 2002; 8 : 333–346.
105. Staessen JA, Wang JG, Thijs L. Cardiovascular protection and blood pressure reduction: a meta-analysis. Lancet 2001; 358 : 1305–1315.
106. Špinar J, Vítovec J. Kontrola krevního tlaku u diabetiků s ischemickou chorobou srdeční. Kardiol Rev 2010; 12 : 128–130.
107. Mancia G, Laurent S, Agabiti-Rosei L et al. European Society of Hypertension. Reappraisal of European guidelines on hypertension management: a European Society of hypertension Task Force document. J Hypertens 2009; 27 : 2121–2158.
108. MacDonald MR, Petrie MC, Hawkins NM et al. Diabetes, left ventricular systolic dysfunction, and chronic heart failure. Eur Heart J 2008; 29 : 1224–1240.
109. Rydén L, Standl E, Bartnik M et al. Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC); European Association for the Study of Diabetes (EASD). Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD). Eur Heart J 2007; 28 : 88–136.
110. McAlister FA, Ezekowitz J, Tonelli M et al. Renal insufficiency and heart failure: prognostic and terapeutic implications from prospective
cohort study. Circulation 2004; 109 : 1004–1009.
111. Smith GL, Lichtman JH, Bracken MB et al. Renal impairment and outcomes in heart failure: systematic review and meta-analysis. J Am
Coll Cardiol 2006; 47 : 1987–1996.
112. Shlipak MG, Massie BM. The clinical challenge of cardorenal syndrom. Circulation 2004; 110 : 1514–1517.
113. Shlipak MG. Pharmacotherapy for Heart Failure in Patients with Renal Insuficiency. Ann Int Med 2003; 138 : 917–924.
114. Hillege HL, Nitsch D, Pfeffer MA. Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) Investigators. Renal function as a Predictor of Outcome in a Broad Spectrum of Patients with Heart Failure. Circulation 2006; 113 : 671–678.
115. Málek F, Havrda M, Frühaufová Z et al. Multidisciplinární přístup v péči o nemocné s kardiorenálním syndromem – první zkušenosti.
Cor Vasa 2006; 48: K185.
116. Spinar J, Ludka O, Dusek L et al. Neurohumoral Activity, Heart Failure and Prognosis in Patients with End-Stage Renal Disease Treated by Hemodialysis. Kidney Blood Press Res 2007; 30 : 347–357.
117. Rutten FH, Cramer MJ, Lammers JW et al. Heart failure and chronic obstructive pulmonary disease: an ignored combination? Eur J Heart Fail 2006; 8 : 706–711.
118. Macchia A, Monte S, Romero M et al. The prognostic infl uence of chronic obstructive pulmonary disease in patients hospitalised for chronic heart failure. Eur J Heart Fail 2007; 9 : 942–948.
119. Rutten FH, Cramer MJ, Grobbee DE et al. Unrecognized heart failure in elderly patients with stable chronic obstructive pulmonary disease. Eur Heart J 2005; 26 : 1887–1894.
120. Hawkins NM, Petrie MC, MacDonald MR et al. Heart Failure and Chronic Obstructive Pulmonary Disease The Quandary of Beta-Blockers and Beta-Agonists. J Am Coll Cardiol 2011; 57 : 2127–2138.
121. The Stroke Prevention in Atrial Fibrilation Investigators. Predictors in thromboembolism in atrial fibrillation. I. Clinical features of pa tients at risk. Ann Intern Medicine 1992; 116 : 1–5.
122. Conolly SJ, Ezekowitz MD, Yusuf S et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 : 1139–1151.
123. Amiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in
congestive heart failure: meta-analysis of individual data from 6 500 patients in randomised trials. Lancet 1997; 350 : 1417–1424.
124. Bytešník J. Doporučené postupy pro diagnostiku a léčbu komorových arytmií. Cor Vasa 2005; 47 : 41–58.
125. Grimm W, Christ M, Bach J et al. Noninvasive arrhythmia risk stratification in idiopathic dilated cardiomyopathy: results of the Marburg Cardiomyopathy Study. Circulation 2003; 108 : 2883–2891.
126. Lupínek P. Význam s léčba anémie u chronického srdečního selhání. Cor Vasa 2004; 46 : 281–284.
127. Silveberg DS, Wexler D, Sheps D et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneuous erythropoetin and intravenous iron: a randomized controlled study. J Am Coll Cardiol 2001; 37 : 1775–1780.
128. McMurray JJ, Anand IS, Diaz R et al. RED-HF Committees and Investigators. Design of reduction of events with darbopoetin alfa in
heart failure (RD-HF): a phase III, anaemia correction, morbidity-mortality trial. Eur J Heart Fail 2009; 11 : 795–801.
129. Pöss J, Jacobshagen C, Ukena C et al. Hotlines and clinical updates presented at he German Cardiac Society Meeting 2010: FAIR-HF, CIPAMI, LIPSIA, Handheld-BNP , PEPCAD III, remote ischaemic conditioning, CERTIFY, PreSCD-II, German Myocardial Infarction Registry, DiaRegis. Clin Res Cardiol 2010; 99 : 411–417.
130. Cleland JG. Anticoagulant and antiplatelet therapy in heart failure. Curr Opin Cardiol 1997; 12 : 276–287.
131. Dries DL, Rosenberg YD, Waclawiw A et al. Ejection fraction and risk of tromboembolitic events in patients with systolic dysfunction and sinus rhythm: evidence for gender differences in the studies of left ventricular dysfunction trials. J Am Coll Cardiol 1997; 29 : 1074–1080.
132. Hradec J. Srdce a endokrinní onemocnění. In: Aschermann M, Widimský P, Veselka J (eds). Kardiologie. 2. díl. Praha: Galén 2004:
1369–1382.
133. Rutlege T, Reis VA, Linke SE et al. Depression in heart failure a meta-analytic review of prevalence, intervention effects, and associations with clinical outcomes. J Am Coll Cardiol 2006; 48 : 1527–1537.
134. Sherwood A, Blumenthal JA, Trivedi R et al. Relationship of depression to death or hospitalization in patients with heart failure. Arch Intern Med 2007; 167 : 367–373.
135. Swenson JR, O’Connor CM, Barton D et al. Sertraline Antidepressant Heart Attack Randomized Trial (SADHART) Group. Infl uence of depression and effect to treatment with sertraline on quality of life after hospitalization for acute coronary syndrome. Am J Cardiol 2003; 92 : 1271–1276.
136. Lanfranchi PA, Somers VK, Braghiroli A et al. Central sleep apnea in left ventricular dysfunction: prevalence and implications for arrhytmic risk. Circulation 2003; 107 : 727–732.
137. Shahar E, Whitney CW, Redline S et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep
Heart Health Study. Am J Respir Crit Care Med 2001; 163 : 19–25.
138. The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC).
ESC Guidelines on the management of cardiovascular diseases during pregnancy. Eur Heart J 2011; 32: doi:10.1093/eurheartj/ehr218.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo Suppl 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení pro diagnostiku a léčbu chronického srdečního selhání – ČKS 2011
-
Fibrilace síní
Doporučený diagnostický a léčebný postup České kardiologické společnosti vypracovaný Pracovní skupinou arytmie a trvalé kardiostimulace - Příprava kardiaka k nekardiální operaci
- Revaskularizace myokardu. Perkutánní koronární intervence a aortokoronární bypass
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání