-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úspěšná léčba Erdheimovy-Chesterovy nemoci chemoterapií obsahující 2-chlorodeoxyadenozin. Popis dvou případů a přehled literatury
Treatment of Erdheim-Chester disease with 2-chlorodeoxyadenozine, cyclophosphamide a dexamethasone led to partial remission in one patient. Two case studies and literature review
Introduction:
Erdheim-Chester disease is an extremely rarely occuring condition and thus an optimal treatment is not known. Two new cases have been diagnosed in our centre in 2008 and 2009. Both patients had diabetes insipidus, B symptoms (subfebrile to febrile states) and pain in long bones of lower limbs.Case studies:
Imaging showed high accumulation of fluorodeoxyglucose as well as Tc-pyrophosphate in long bones of lower as well as upper limbs, aortic wall thickening with periaortic fibrosis and perirenal fibrosis. In addition, one of the patients had multiple lesions in the brain. 2-chlorodeoxyadenozine 5 mg/m2 s.c. and cyclophosphamide 150 mg/m2 administered on days 1 to 5 in 28-day cycles were selected for the treatment of both patients. Dexamethasone 24 mg/day for 5 days was added to this treatment in the second patient. Six cycles of the treatment were planned. Both patients were prescribed bisphosphonates – zoledronate and clodronate, respectively. Treatment effect was assessed with PET-CT and MR. Following treatment completion, brain infiltrates were reduced to a small residuum in the first patient whot did not anymore complain of leg pain. However, there was no reduction in fluorodeoxyglucose accumulation in bone lesions and thus treatment response was assessed as partial remission. This patient is currently receiving a second line treatment and treatment follow-up is 26 months from the diagnosis. Repeated PET-CTs in the second patient showed a significant reduction in accumulation of fluorodeoxyglucose in all pathological lesions. Febrile states and pain in long bones as well as pathological fatigue ceased after the treatment. Increased CPR and fibrinogen gradually returned to their normal levels. This response is assessed as complete remission. This patient’s follow-up is 16 months from the diagnosis.Conclusion:
Administration of 2-chlorodeoxyadenozine (5 mg/m2 s.c.) + cyclophosphamide (150 mg/m2 intravenously) and dexamethasone (24 mg/day) led to partial remission in one patient; nearly complete remission of CNS infiltrates but persistent elevation of fluorodeoxyglucose accumulation in bone lesions. Complete remission with a significant reduction in accumulation of fluorodeoxyglucose in all disease lesions with normalization of originally increased inflammatory markers and disappearance of all symptoms of the disease was achieved in the second patient.Key words:
Erdheim-Chester disease – juvenile xanthogranuloma – PET-CT imagination – bone scan – 2-chlorodeoxadenosine – cladribine – cyclophosphamide – dexamethasone – fewer of unknown origin – osteosclerosis – hyperostosis – osteoporosis – retroperitoneal fibrosis – Ormonds disease
Autoři: Z. Adam 1; R. Koukalová 2; A. Šprláková 3; Z. Řehák 2; L. Červinek 1; P. Szturz 1; M. Krejčí 1; L. Pour 1; L. Zahradová 1; M. Moulis 4; J. Prášek 5; R. Chaloupka 6; R. Hájek 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení PET-CT Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák 2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc., MBA 3; Ústav patologie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Josef Feit, CSc. 4; Klinika nukleární medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Jiří Prášek, CSc. 5; Klinika ortopedie Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Richard Chaloupka, CSc. 6
Vyšlo v časopise: Vnitř Lék 2011; 57(6): 576-589
Kategorie: Kazuistiky
Souhrn
Úvod:
Erdheimova-Chesterova nemoc je velmi vzácná, a proto není optimální léčba této nemoci známa. Na našem pracovišti byly v letech 2008 a 2009 nově diagnostikovány 2 případy. Oba pacienti měli diabetes insipidus, B symptomy (subfebrilie až febrilie) a bolesti v dlouhých kostech dolních končetin.Popisy případů:
Zobrazovací vyšetření prokázala vysokou akumulaci fluorodeoxyglukózy, ale i Tc-pyrofosfátu v dlouhých kostech dolních, ale i horních končetin, zesílení stěny aorty s periaortální fibrózou a perirenální fibrózu. U jednoho z pacientů byla navíc zjištěna vícečetná ložiska choroby v mozku. Pro léčbu obou pacientů jsme zvolili 2-chlorodeoxyadenozin 5 mg/m2 s.c. a cyklofosfamid 150 mg/m2, aplikované 1.–5. den ve 28denních cyklech. U 2. pacienta jsme přidali k této léčbě ještě dexametazon 24 mg/den po dobu 5 dnů. Celkem jsme plánovali 6 cyklů této léčby. Oba pacienti dostávají bisfosfonáty, jeden zoledronat, druhý klodronat. Léčebný účinek jsme vyhodnocovali na základě PET-CT a MR vyšetření. U 1. pacienta se po ukončení výše uvedené chemoterapie infiltráty v mozku výrazně zmenšily na malé reziduum a pacienta přestaly bolet dolní končetiny. Nedošlo však k poklesu akumulace fluorodeoxyglukózy v kostních ložiscích nemoci, a proto léčebnou odpověď hodnotíme jako parciální remisi. Tento pacient podstupuje léčbu další linie, doba sledování je 26 měsíců od stanovení diagnózy. U 2. pacienta prokázala opakovaná PET-CT vyšetření signifikantní pokles akumulace fluorodeoxyglukózy ve všech patologických ložiscích. Po léčbě zmizely vysoké teploty, bolesti dlouhých kostí i patologická únava (fatigue). Normalizovala se vstupně zvýšená hodnota CPR i fibrinogenu. Stav hodnotíme jako kompletní remisi nemoci. Doba sledování tohoto pacienta od stanovení diagnózy je 16 měsíců.Závěr:
Aplikace 2-chlorodeoxyadenozinu (5 mg/m2 s.c.) + cyklofosfamidu (150 mg/m2 nitrožilně) a dexametazonu (24 mg/den) vedla v 1. případě k parciální remisi, k téměř úplnému vymizení infiltrátů v CNS, ale přetrvávala zvýšená akumulace fluorodeoxyglukózy v kostních ložiscích. V 2. případě byla dosažena kompletní remise s výrazným poklesem akumulace fluorodeoxyglukózy ve všech ložiscích nemoci, s normalizací původně zvýšených markerů zánětu a s vymizením všech symptomů nemoci.Klíčová slova:
Erdheimova-Chesterova nemoc – juvenilní xantogranulom – PET-CT vyšetření – scintigrafie skeletu – 2-chlorodeoxyadenozin – kladribin – cyklofosfamid – dexametazon – horečka nejasného původu – osteoskleróza – hyperostóza – osteoporóza – retroperitoneální fibróza – Ormondova choroba.Úvod
Všechny choroby, které se odvíjejí od buněk histiocytární řady (do níž patří i dendritické buňky), se vyskytují vzácně. Jejich přehled uvádí tab. 1. Nemoci patřící do skupiny diseminovaného juvenilního xantogranulomu jsou charakterizovány přítomností proliferujících histiocytů, podobných histiocytům v kožních xantogranulomech. Histiocyty v těchto ložiscích mají pěnitou (xantomatózní) komponentu a kolem nich se v různém množství vyskytují obrovské buňky Toutonova typu. V některých případech se podařilo prokázat klonalitu těchto histiocytů [1].
Tab. 1. Přehled všech histiocytárních forem a dále přehled forem onemocnění, které mohou způsobovat pěnité histiocyty, jejichž ložiska histologickým popisem odpovídají juvenilnímu xantogranulomu. 
Nejčastější z této skupiny nemocí je solitární kožní xantogranulom, který obvykle nepřechází do agresivnější formy. Většina takzvaných „hlubokých forem“ juvenilního xantogranulomu, které postihují viscerální orgány a pojivové tkáně, se vyskytuje u mladých osob ve věku do 10 let, nejčastěji však v průběhu prvního roku života. Výjimkou je Erdheimova-Chesterova nemoc, která postihuje osoby dospělého věku.
Xantogranulomatózní ložiska velmi často postihují kůži a někdy se mohou objevit i na sliznicích dýchacího traktu. Kožní ložiska tvoří papulózní formy o průměru 1–2 mm a jsou obvykle mnohočetná. V některých případech mohou splývat. Ložiska v měkkých tkáních jsou obvykle větších rozměrů. Ložiska juvenilního xantogranulomu mohou také postihnout CNS. Pokud postihnou CNS, objevují se nejčastěji ve stopce hypofýzy a podobně jako Langerhansova histiocytóza způsobují diabetes insipidus. Méně často infiltrují další části mozku či mozkové obaly. Postižení optického nervu juvenilním xantogranulomem může způsobit glaukom. Pokud juvenilní xantogranulom postihne játra, tak, na rozdíl od histiocytózy z Langerhansových buněk, nezpůsobuje sklerotizující cholangoitidu.
Erdheimova-Chesterova nemoc je zvláštní formou juvenilního xantogranulomu s typickou kumulací patologických buněk v kostní dřeni končetin. Důsledkem infiltrace kostní dřeně končetin dlouhých kostí je zvýšená tvorba hydroxyapatitu v těchto kostech, vedoucí k zesílení jejich struktury (k osteoskleróze), což může být paradoxně provázeno úbytkem hydroxyapatitové struktury v obratlích nezasažených touto chorobou. Nemoc dále postihuje aortu a způsobuje zesílení její stěny a vznik periaortální fibrózy. Fibróza v okolí ledvin a v retroperitoneu může oblenit tok uretery, a připomínat tak idiopatickou retroperitoneální fibrózu (Ormondovu chorobu). Masivní infiltrace kostní dřeně dlouhých kostí nezpůsobuje anémii ani cytopenii obecně, protože v dospělém věku je již v těchto dlouhých kostech krvetvorná kostní dřen fyziologicky nahrazena tukovou. Krvetvorná kostní dřen zůstává v plochých kostech a obratlích, které nebývají infiltrovány těmito patologickými histiocyty.
Nemoc se může přihlásit B symptomy (subfebrilie či febrilie, úbytek hmotnosti, noční pocení). Erdheimova-Chesterova byla již v české i slovenské odborné literatuře popsána, byť počet publikací věnovaných této diagnóze není velký [2–10].
Podrobněji pojednává o patologii non Langerhans cell histiocytóz článek prof. Planka [11] a obecný popis této nemoci je uveden v 2. supplementu časopisu Vnitřní lékařství, ročník 2010, které je celé věnováno histiocytárním chorobám [12]. Jiné formy juvenilního xantogranulomu, difuzní kožní non hyperlipidemická xantomatóza a nekrobiotický xantogranulom, jsou popsány v předchozích číslech časopisu Vnitřní lékařství [13].
Osud nemocných s Erdheimovou--Chesterovou chorobou je velmi individuální a odpovídá stupni poškození organizmu, nezřídka byl popsán fatální průběh. Údajů o prognóze je málo, největší soubor zveřejnil Veyssier Belot, který uvádí, že z 37 nemocných 22 zemřelo v průběhu 2,7letého sledování [14]. Plicní fibróza s dušností a srdeční selhání jsou nejčastější příčiny úmrtí. Neurologické postižení může způsobovat ataxii či parézy nebo poruchu kognitivních funkcí a vést k postupnému zhoršování funkce CNS [15].
Popisy případů
První případ (muž nar. 1965) s Erdheimovou-Chesterovou nemocí, diagnostikovanou v prosinci roku 2008
Popis tohoto případu s bohatou obrazovou dokumentací byl zveřejněn [16], takže zde pouze stručně připomeneme nejdůležitější údaje a podrobněji se budeme věnovat léčbě a jejímu výsledku.
První příznak – diabetes insipidus – byl diagnostikován v roce 2004. Od zavedení substituce adiuretinem neměl tento muž až do roku 2006 žádné další zdravotní problémy. Na kontrolním MR v červnu roku 2006 bylo poprvé popsáno patologické zesílení stopky hypofýzy na 4–5 mm. Ošetřující lékaři se pokusili získat vzorek tkáně ze stopky hypofýzy pro histologické vyšetření. V červenci roku 2006 byla provedena endoskopická, stereotakticky navigovaná ventrikulocisternoanastomóza s parciální resekcí (elektrokoagulací) stopky hypofýzy a byl odebrán drobný vzorek k histologickému vyšetření.
Ve vyšetřeném vzorku byla nalezena glioneuronální tkáň s mírnou proliferací gliové komponenty, ložisková lymfocytární celulizace tvořená smíšenou populací T a B lymfocytů, s mírnou převahou T lymfocytů a perivaskulární akcentací. Nález byl z hlediska patomorfologie zcela nespecifický, nevedl k žádné diagnóze.
Po neurochirurgickém zákroku vznikl kompletní panhypopituitarizmus. Při dalších MR zobrazeních mozku postupně přibývala ložiska v mozkové tkáni. Od ledna roku 2008 se u pacienta začala objevovat porucha řeči charakteru dysartrie, zprvu velmi mírná, a proto pacientem přehlížená, postupně však porucha získávala na závažnosti. V objektivním neurologickém nálezu byla kromě dysartrie středního stupně zjištěna reflexologická převaha na pravé dolní končetině a porucha alternujících pohybů levé ruky, později až pravostranná hemiparéza. Subjektivně pacient popisoval ještě parestesie pravostranných končetin a zvýšenou únavu.
V rámci hledání případného tumoru v těle nemocného bylo v listopadu roku 2008 provedeno PET vyšetření i scintigrafie skeletu celého těla. V dlouhých kostech byla patrná patologická akumulace obou radiofarmak (fluorodeoxyglukózy i techneciumpyrofosfátu).
Vzhledem k tomu, že PET vyšetření a scintigrafie skeletu byla typická pro Erdheimovu-Chesterovu chorobu, byla provedena necílená trepanobiopsie lopaty kosti kyčelní. Při provádění tohoto zákroku jsme si byli vědomi, že nemoc nepostihuje kostní dřeň difuzně a že při nediagnostickém výsledku bude zapotřebí cíleného odběru z ložiska s nejvýraznějšími patologickými změnami dle zobrazovacích vyšetření. Náhodně jsme se však trefili do ložiska nemoci v pánvi, a proto již další cílený odběr nebyl nutný.
Při histologickém hodnocení byla zjištěna ložiskovitá infiltrace kostní dřeně shluky histiocytů s abundantní pěnitou cytoplazmou na pozadí osteosklerózy a sekundární myelofibrózy. Ložiska zaujímala 40–60% délky trepanobioptického válečku. Imunohistochemicky byly pěnité histiocyty CD68+ a CD1a–, vyšetření proteinu S-100 nebylo hodnotitelé.
Měření kostní hustoty metodou DEXA v oblasti 4 bederních obratlů (L1–L4) prokázalo osteoporózu, T skóre mělo hodnotu –2,7 SD (standard deviation) a stejně tak Z skóre bylo –2,7 SD, nejnižší kostní hustota byla naměřena v oblasti 3. bederního obratle, a to –3,1 SD. Přístroj nebyl nastaven na měření kostní hustoty v dlouhých kostech, takže RTG zřetelnou hyperostózu v dlouhých kostech nemůžeme metodou DEXA kvantifikovat.
Jedinou zřetelnou odchylkou od normy v oblasti hrudníku při CT vyšetření bylo zesílení dorzální stěny sestupné aorty až na 6 mm. Nález na abdominálních orgánech, vyjma difuzního zesílení stěny sestupné aorty, byl normální. V oblasti retroperitonea však byla popsána zvýšená denzita tuku a fibrózní změny retroperitoneálně perirenálně oboustranně a také kolem aorty.
Laboratorní vyšetření před zahájením léčby vykázalo: leukocyty 14,9 × 109/l, erytrocyty 4,67 × 1012/l, hemoglobin 125g/l, trombocyty 524 × 109/l, v diferenciálním krevním rozpočtu převládala neutrofilie, patologické krvinky nebyly zachyceny. Dále byla zvýšena koncentrace fibrinogenu na 5,9g/l. Základní biochemické vyšetření bylo zcela normální, pouze hodnota CRP byla zvýšena na 72 mg/l, aniž by byla přítomna infekce.
Léčba
Léčbu jsme zahájili 22. 1. 2009 stimulační chemoterapií s cílem provést sběr kmenových krvetvorných buněk pro autologní transplantaci. S tímto cílem byl podán etoposid v dávce 200 mg/m2 ve formě infuze 1., 2. a 3. den a cyklofosfamid v dávce 2 g/m2 pouze 1. den. Následně byl podáván filgrastim (Neupogenu) 2krát 480 μg denně až do ukončení sběru kmenových buněk krvetvorby z periferní krve. Sběr kmenových buněk byl úspěšný, celková výtěžnost byla 37,07 × 106 CD34 pozitivních buněk/kg.
Dne 9. března 2009 byla zahájena monoterapie 2-chlorodeoxyadenozin (Litac) 5 mg/m2 s.c. 5 dní po sobě ve 28denních intervalech.
Po 3 cyklech bylo provedeno kontrolní MR mozku, kde nebylo prokázáno zřetelné zlepšení, proto jsme k uvedené dávce 2-chlorodeoxyadenozinu (5 mg/m2 s.c. 5 dní po sobě) přidali cyklofosfamid v dávce 150 mg/m2 i.v. ve formě infuze 5 dní po sobě. Zvažovali jsme také podání vysokých dávek dexametazonu. Pacient byl za pobytu na neurologické klinice opakovaně léčen vysokými dávkami dexametazonu – bez zřetelného efektu, a proto jsme jej do kombinace nepřidali.
Ve 4.–6. cyklu léčby byla aplikována výše uvedená kombinace 2-chlorodeoxyadenozinu a cyklofosfamidu.
Vzhledem k bolestem dlouhých kostí a osteoporóze prokázané kostní denzitometrií v oblasti páteře a pánve, tedy v oblastech bez infiltrace pěnitými histiocyty, jsme podávali zoledronat (Zometa) v dávce 4 mg 1krát měsíčně.
Poslední aplikace 2-chlorodeoxyadenozinu a cyklofosfamidu v rámci 6. (posledního) cyklu léčby proběhla 5. srpna 2009.
Hodnocení účinnosti léčby 2-chlorodeoxyadenozinem
Po ukončení této léčby pacient udával, že dříve měl bolesti v oblasti tibií a femurů a že lýtková kost byla na dotek velmi citlivá. Tyto potíže vymizely.
PET-CT hodnocení
U pacienta jsme prováděli opakovaná PET-CT vyšetření (tab. 2). PET-CT měření bylo realizováno po 1. cyklu chemoterapie v dubnu roku 2009 a následně v říjnu roku 2009. Z tab. 2 je zřejmé, že nedošlo k poklesu akumulace fluorodeoxyglukózy v žádné z měřených lokalizací a že při dalším sledování docházelo k nárůstu akumulace fluorodeoxyglukózy v ložiscích v dlouhých kostech.
Tab. 2. Výsledky vyšetření PET-CT vyjádřené jako hodnotou SUVmax, tak indexem SUVmax ložiska/SUVmax hepar. Pro srovnání jednotlivých vyšetření mezi sebou je vhodnější uvedený poměrný index. 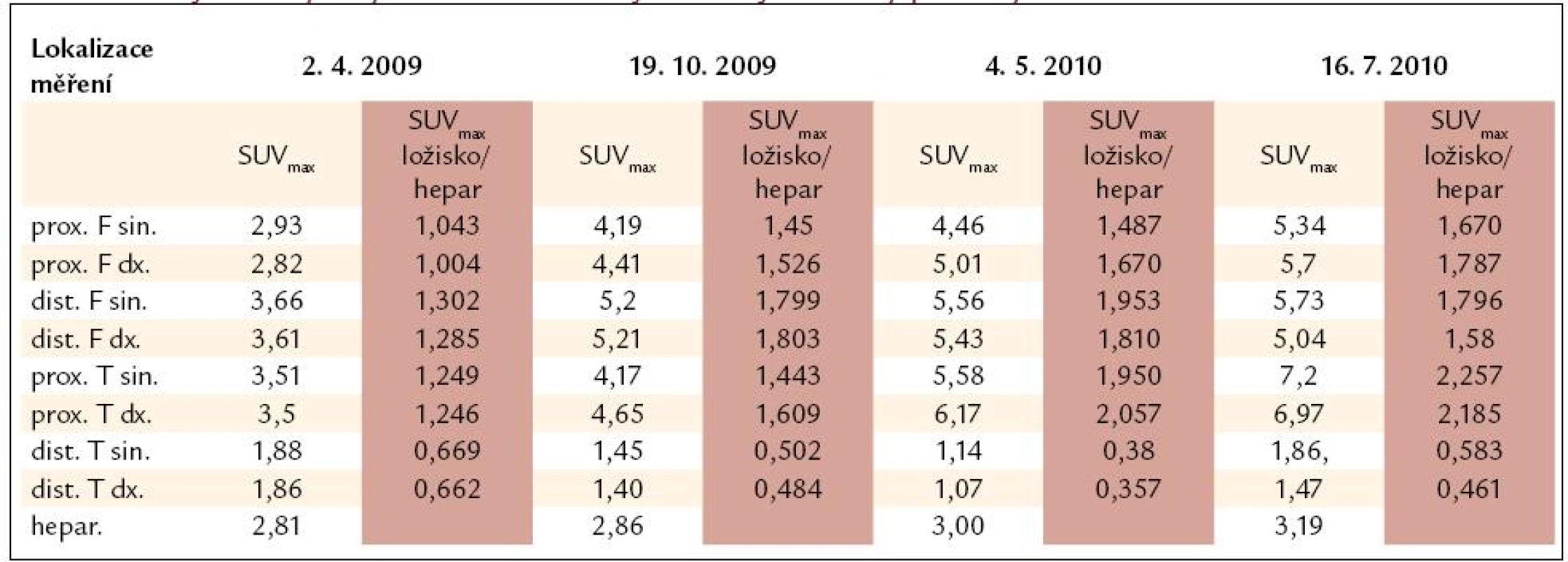
prox. F sin. – proximální část femuru vlevo, dist. F sin. – distální část femuru vlevo, prox. T sin. – proximální tibie vlevo, dist. T sin. – distální část tibie vlevo MR mozku
- Vyšetření 22. 1. 2009 považujeme za referenční vyšetření před léčbou (obr. 1). První kontrola byla provedena v průběhu 3. cyklu 2-chlorodeoxyadenozinu (28. 5. 2009) a při ní se obraz nijak neměnil – velikost i sycení ložisek infra - i supratentoriálně zůstalo stejné (obr. 2).
- Další vyšetření bylo provedeno při posledním cyklu 2-chlorodeoxyadenozinového režimu. V červenci roku 2009 (9. 7. 2009) byla již patrná regrese velikosti ložiska vlevo při postranní komoře, z původních 7 mm na 4 mm, sytost po aplikaci kontrastní látky byla rovněž méně nápadná.
- Při první kontrole po ukončení léčby 2-chlorodeoxyadenozinovým režimem (21. 9. 2009) byla regrese všech ložisek na první pohled významná, ložiska v kmeni se již téměř nesytila a největší ložisko supratentoriálně vlevo se sytilo jen tečkovitě. Ložiska nicméně po ukončené léčbě stále přetrvávala, byť ve zmenšeném rozměru (obr. 3).
Obr. 1. MR zobrazení mozku z 22. 1. 2009, tedy před léčbou. Na MR je viditelné postižení kmene, mozečku a bílé hmoty supratentoriálně, ložiska T1 hypo, T2 hyperintenzní, postkontrastně se sytící, restrikce difuse na DWI, bez korelace na ADC. 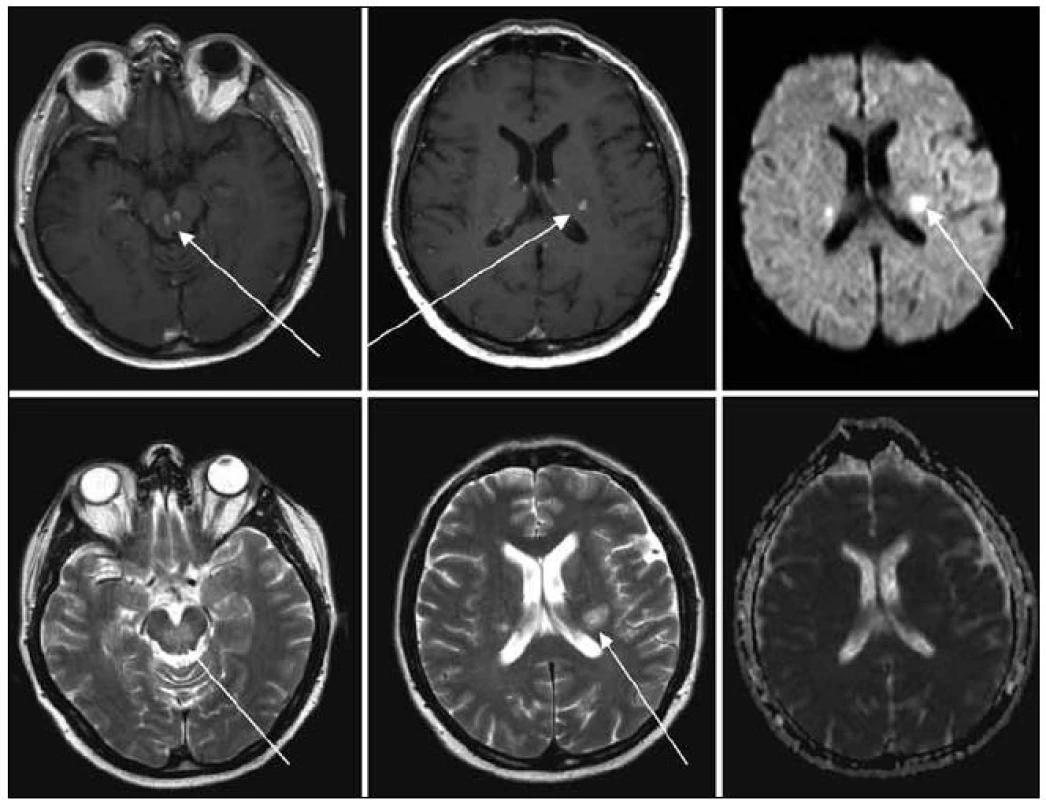
Obr. 2. MR zobrazení mozku z 28. 5. 2009. Pokud považujeme 1. vyšetření (22. 1. 2009) jako vyšetření referenční před léčbou, pak se na 1. kontrole v průběhu léčby (28. 5. 2009) obraz nijak nemění, velikost i sycení ložisek infrai supratentoriálně je stejné. 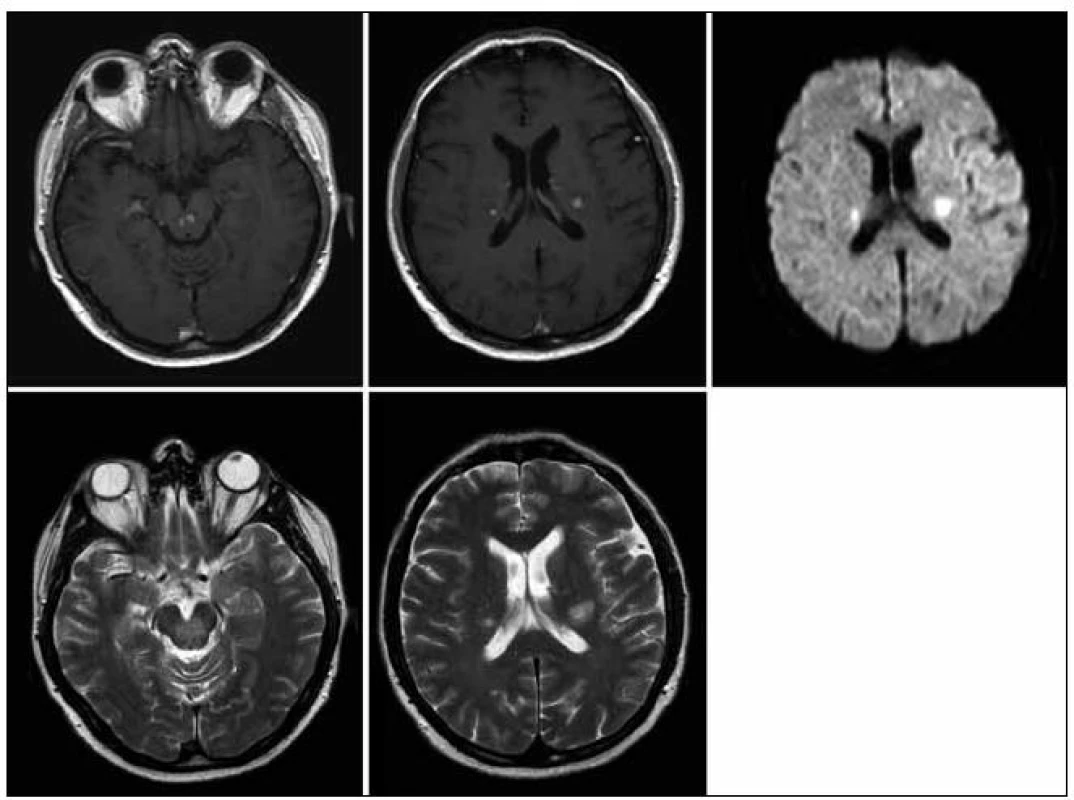
Obr. 3. MR zobrazení mozku z 9. 7. 2009 a dále pak ze 21. 9. 2009 a 25. 10. 2010. Na vyšetření v době aplikace posledního cyklu 2-chlorodeoxyadenozinu je patrná již regrese velikosti ložiska vlevo při postranní komoře, z původních 7 mm na 4 mm, sytost po aplikaci kontrastní látky je rovněž méně nápadná (zde je nutno vzít v úvahu, že byla aplikována stejná kontrastní látky, Gadovist, ve stejném množství, tedy hodnocení sytosti je při dodržení standardního protokolu možné, jeho přesná kvantifikace se však při MR vyšetření neprovádí, subjektivní chyba je vyvážena hodnocením dvou nezávislých lékařů). Na dalším vyšetření 21. 9. 2009 (po ukončení 2-chlorodeoxyadenozinu) je již regrese všech ložisek na první pohled významná, ložiska v kmeni se již téměř nesytí a největší ložisko supratentoriálně vlevo se sytí jen tečkovitě. Na vyšetření 28. 5. 2010 (při léčbě lenalidomidem) se původně parciální regrese proměnila v regresi kompletní. Bez znalosti předcházejících vyšetření zde již nelze dohledat přesné umístění patologických ložisek. Tedy normalizace obrazu. 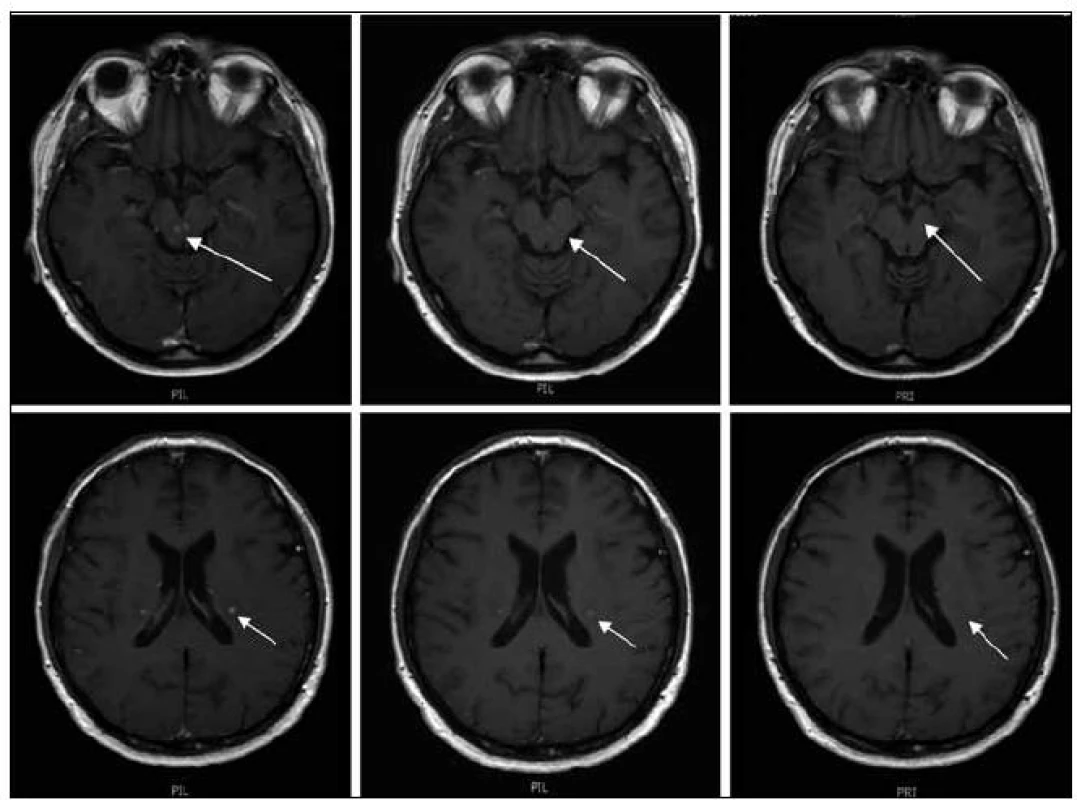
Na základě klinického stavu a PET-CT vyšetření lze tedy vývoj onemocnění shrnout jako „parciální remisi choroby“, téměř kompletní regresi v oblasti mozku, zatímco v ložiscích v dlouhých kostech nedochází k poklesu akumulace fluorodeoxyglukózy. Toto hodnocení vyplývá jak ze srovnání SUVmax měřených opakovaně ve stejných lokalizacích, tak z poměru SUVmax ložisko/SUVmax hepar. Toto poměrné číslo lépe koreluje s vývojem choroby, protože eliminuje rozdíl způsobený odlišností v aplikované dávce radioaktivní látky vzhledem k odlišnostem v aplikované dávce a její biodistribuce ve snímané části těla. Obojí hodnoty uvádí tab. 2.
Při poslední kontrole 8. 2. 2010 byl pacient stabilní se známkami aktivity nemoci. Doba sledování od stanovení diagnózy a zahájení léčby je 26 měsíců.
Tolerance léčby byla dobrá, pacient nebyl ani jednou hospitalizován pro infekční či jinou komplikaci, v průběhu léčby ani po ní, po ukončení léčby nedošlo, na rozdíl od druhého pacienta, k signifikantní cytopenii.
Druhý případ (muž nar. 1953) s Erdheimovou-Chesterovou nemocí diagnostikovanou v říjnu 2009
Anamnéza a výsledky laboratorních vyšetření
Muž, narozený 1953, se až do roku 2000 těšil ze svého života při plném zdraví, bez vážnějších chorob. V roce 2001 jej začala trápit polyurie. Endokrinologové v roce 2001 potvrdili diabetes insipidus a podali odpovídající substituční léčbu. V roce 2004 jej začaly trápit horečky s třesavkou a pocit zimnice. Pacient měl horečku kolem 38 °C, trvající vždy několik dní, pak se teplota spontánně normalizovala a po určitém intervalu, jehož délka se pohybovala řádově ve dnech, opět došlo k recidivě horečky.
Na naše pracoviště byl poslán poprvé v roce 2005 s podezřením na maligní lymfom. Byla provedena následující vyšetření: CT mediastina a plic – bez patologie; CT břicha – bez lymfadenopatie; trepanobiopsie lopaty kosti kyčelní – bez patologie; PET celého těla – difuzně vyšší akumulace fluorodeoxyglukózy v obou femurech. Dále podstoupil pacient endoskopická vyšetření, gastroskopii, kolonoskopii, echokardiografii – vše bez patologického nálezu.
Pacient měl normální hodnoty krevního obrazu a normální biochemické vyšetření, vyjma zvýšené hodnoty CRP (63 mg/l) a zvýšené hodnoty LD na 6,9 μkat/l (norma do 3,75 μkat/l). Také hodnota sedimentace byla zvýšená (52/72). Závěr vyšetření v roce 2005 zněl, že pacient nemá maligní lymfom a nemocný byl předán do péče svého endokrinologa. Jinými slovy – příznaky nemoci, ač jasně přítomné, nebyly správně interpretovány.
Tento muž se znovu na našem pracovišti objevil v roce 2009. Pořád jej trápily intermitentní horečky kolem 38 °C, které trvaly vždy několik dní a pak spontánně ustaly. Oproti roku 2005 však v roce 2009 přibyly neurčité bolesti v bércích, kolenech, kotnících a kyčlích. Bolesti postihovaly obě končetiny stejně, na vizuální analogové škále intenzity bolesti byly pacientem hodnoty vyjádřeny jako 4/10. Byly lokalizované, tupého charakteru, nejevily žádnou návaznost na tělesnou námahu a objevovaly se v záchvatech 1–2krát denně. Objektivní nález u pacienta byl zcela normální. V roce 2009 však měl již podstatně vyšší hodnotu CRP než v roce 2005, opakovaně se pohybovala kolem 80–116 mg/l. V laboratoři nebylo jinak nic nápadného.
V roce 2005 ponechali vyšetřující lékaři bez interpretace a dalšího pátrání vyšší akumulaci fluorodeoxyglukózy v oblasti femurů na PET-CT vyšetření. Pro vysvětlení připomeneme, že při klasickém PET vyšetření je člověk snímán od lební báze do půli stehen. Pouze pokud lékař, posílající nemocného na vyšetření, požádá o vyšetření celé postavy, snímají se i bérce. První PET nemohl přinést typický obraz zvýšení aktivity v dolních končetinách právě kvůli tomu, že nebyly snímány celé dolní končetiny.
Zobrazení skeletu pomocí PET-CT, scintigrafie skeletu a MR skeletu celého těla
Vzhledem k nejasným potížím a neobjasněné zvýšené aktivitě v oblasti femurů dle PET-CT vyšetření z roku 2005 jsme v srpnu roku 2009 provedli další zobrazení celého skeletu, již včetně bérců a chodidel (PET-CT vyšetření, scintigrafii skeletu Tc pyrofosfátem, MR zobrazení skeletu celého těla). Stručně shrneme výsledky těchto 3 zobrazení skeletu.
Scintigrafie skeletu ze 7. 7. 2009
Radioaktivní techneciumpyrofosfát byl zvýšeně vychytáván v oblasti pravého zygomatického oblouku, v pravé frontální oblasti, v mandibule mediálně, ve střední části levého humeru, v obou radiích proximálně, v obou femurech v proximální třetině a v distální polovině (vynechána prostřední třetina femurů), v obou tibiích a dále v talu a kalkaneu vlevo. Místa zvýšeného vychytávání techneciumpyrofosfátu se shodují s místy maximální akumulace fluorodeoxyglukózy.
Výsledky vstupního vyšetření dokumentují obr. 4 a 5.
Obr. 4. Scintigrafie skeletu Tc pyrofosfátem. Zvýšená akumulace radiofarmaka v dolních končetinách je typickou známkou Erheimovy-Chesterovy nemoci. 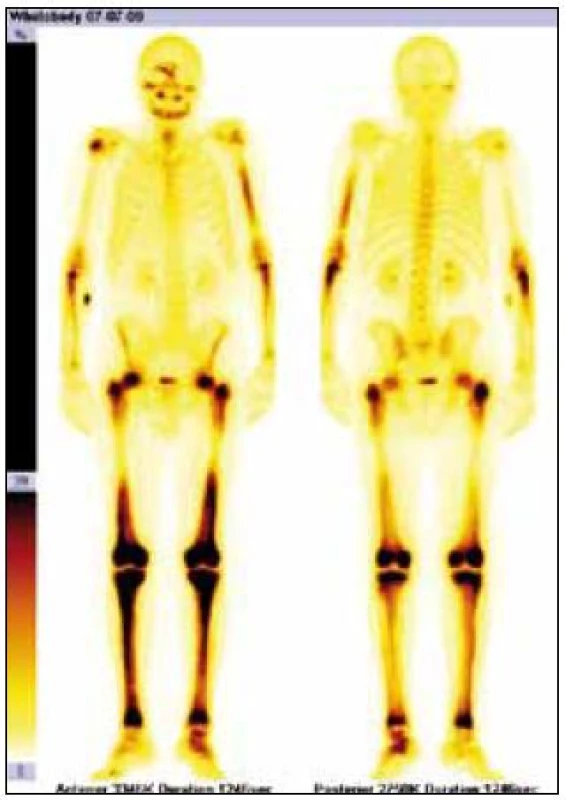
Obr. 5. Scintigrafie skeletu Tc pyrofosfátem. Výrazná akumulace radiofarmaka je zřetelná v proximálních částech femurů a ložiska zvýšené aktivity jsou vidět i v některých dalších oblastech. 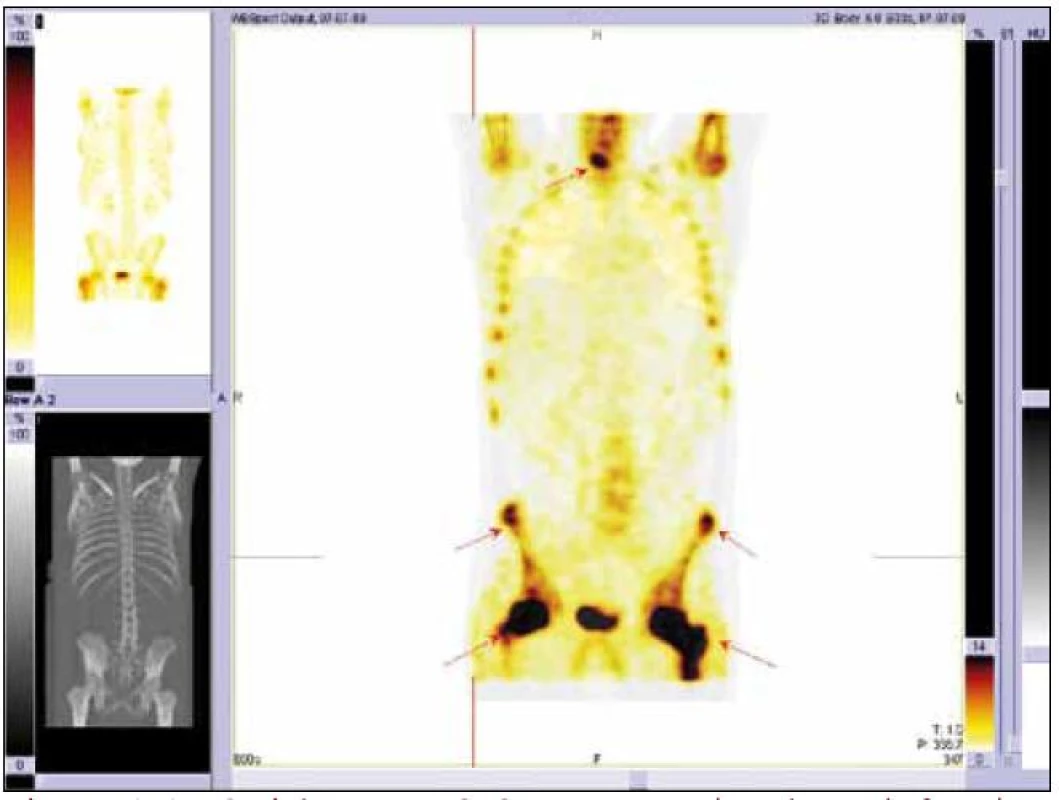
PET-CT vyšetření z 11. 8. 2009
Při CT zobrazení byl v oblasti hrudníku vyhodnocen normální nález vyjma zesílené stěny aorty s maximem v oblouku aorty a odstupu velkých cév, kde dosahovala šíře stěny aorty 5 mm. Zesílená stěna hrudní aorty nevykazovala hypermetabolizmus. V břišní dutině nebyla popsána žádná patologická struktura, pouze kontury ledviny byly neostré a denzita mezenteriálního tuku byla zvýšená. V břišní dutině bylo patrné také zesílení stěny aorty, místy s hypermetabolizmem v cévní stěně. Zevní kontury aorty byly neostré.
Změněná byla struktura dlouhých kostí dolních, ale i horních končetin. Výrazně sklerotická struktura těchto kostí byla prostoupena osteolytickými okrsky. V úseku diafýz femurů bylo patrné zesílení kompakty a byla nalezena patologická struktura dřeňové dutiny se zvýšenou denzitou. Patologické změny byly patrné v obou femurech s vynecháním střední třetiny diafýz. Stejné změny byly patrné v celých tibiích, inkompletně v obou fibulách. Vlevo postihly změny i kost patní. Stejné patologické změny byly zřetelné v oblasti humerů.
Při hodnocení akumulace fluorodeoxyglukózy bylo konstatováno, že nejvyšší akumulace fluorodeoxyglukózy je v oblasti obou femurů proximálně, s SUVmax 9,5 a 9,8, a také v distálních částech femurů, s SUVmax 9,7 a 11,52. Střední části diafýz femurů nevykazovaly zvýšenou akumulaci. Zvýšená akumulace byla také v kostech bérců (SUVmax 5,4) a v obou humerech distálně (SUVmax 6,46 a 7,58).
Výsledek vstupního vyšetření dokumentují obr. 6–11.
Obr. 6. PET-CT zobrazení břicha. Zvýšení denzity perirenálního tuku, zneostření kontury pravé ledviny – diskrétní známky vznikajících fibrózních změn (označeno šipkou). Aktivní moč v dutém systému ledvin, perirenálně evidentní hypermetabolizmus glukózy nedetekujeme. 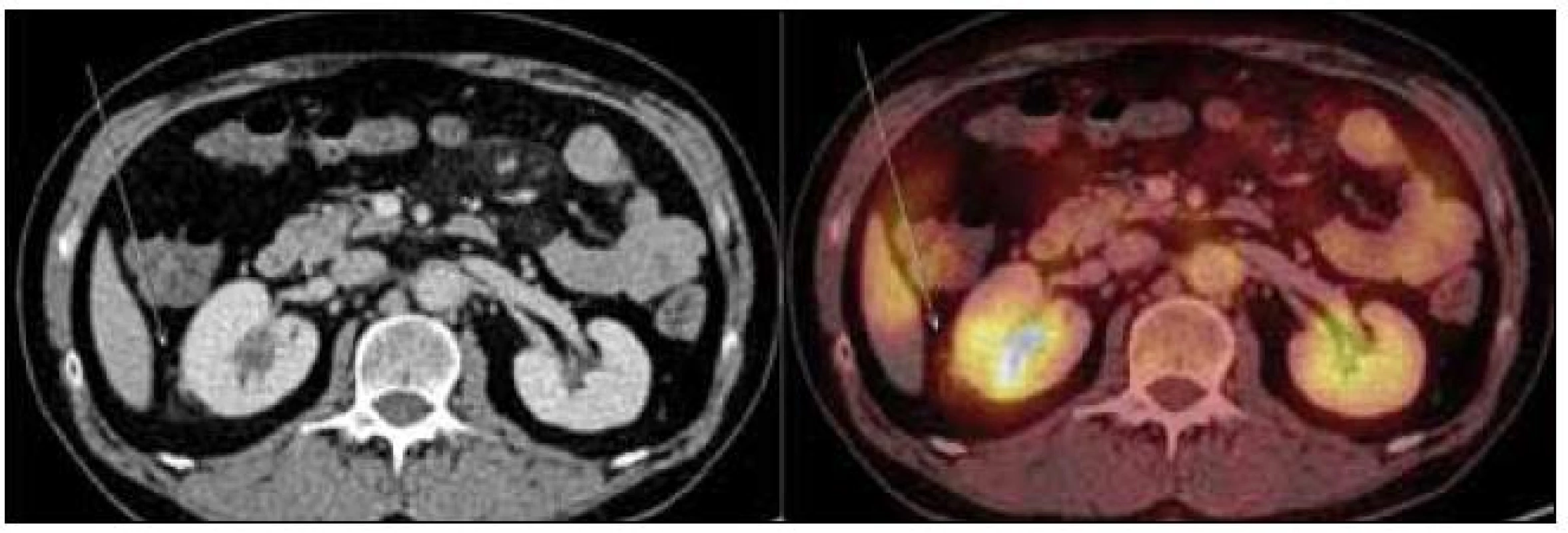
Obr. 7. PET-CT zobrazení hrudníku. Zesílení stěny hrudní aorty v úrovni jejího oblouku na šíři 5 mm (označeno šipkami). Evidentní hypermetabolizmus glukózy neprokázán. 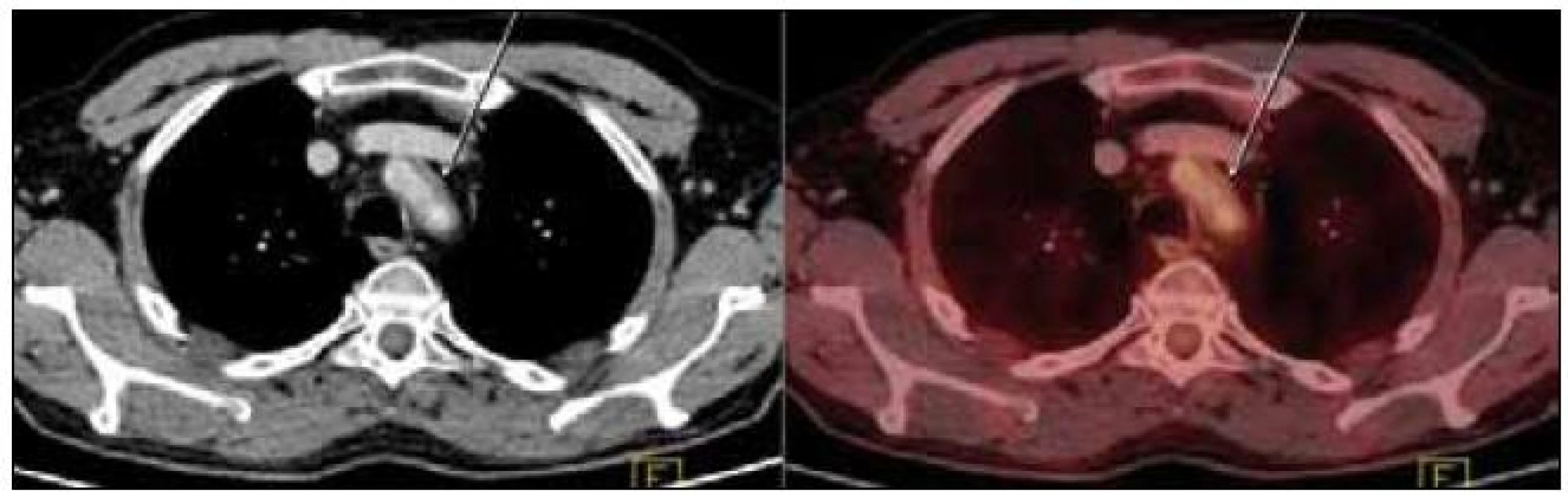
Obr. 8. PET-CT zobrazení břicha. Zneostření zevních kontur břišní aorty a nepravidelné zesílení stěny místy až na 9 mm v průměru s lehce zvýšeným metabolizmem glukózy (označeno šipkami). Lehce vyšší aktivita ve vzestupném tračníku je variantou fyziologického zobrazení. 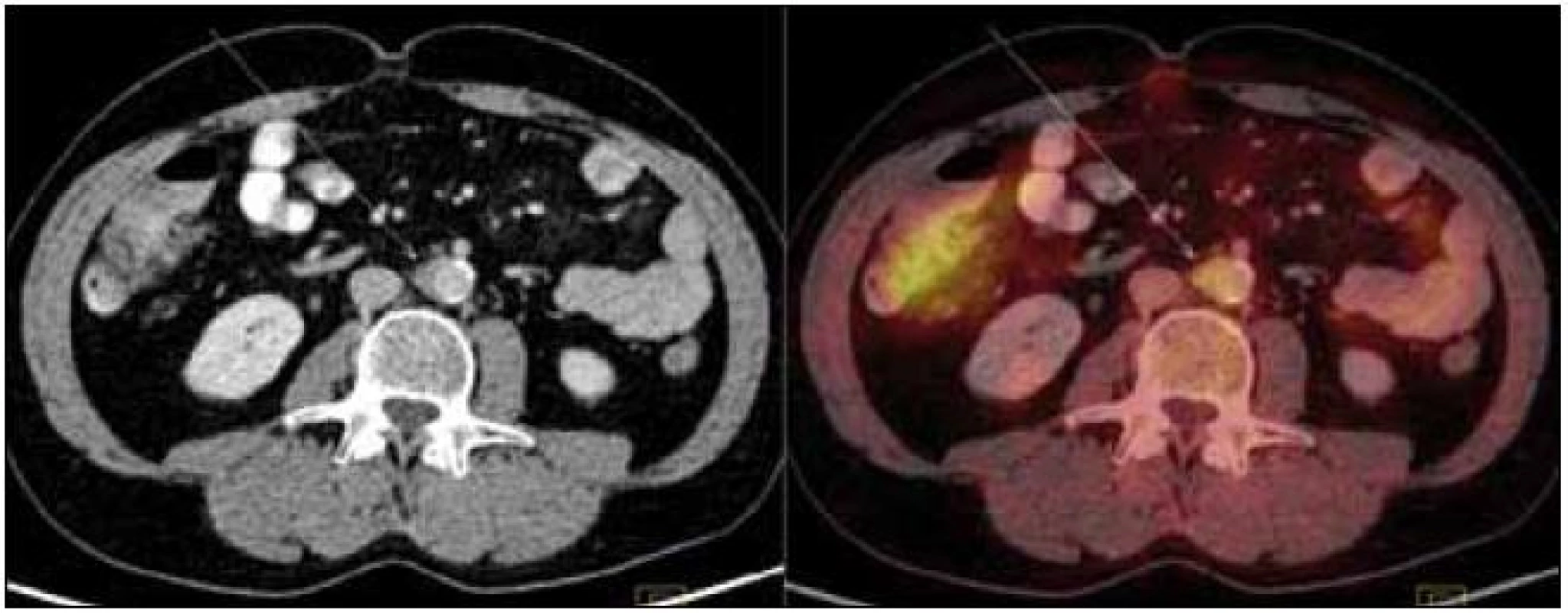
Obr. 9. PET-CT zobrazení femuru, transversální řez. Oba femury mají nepravidelnou, převážně sklerotickou strukturu spongiózy s osteolytickými okrsky, v těchto místech je i jasný hypermetabolizmus glukózy. 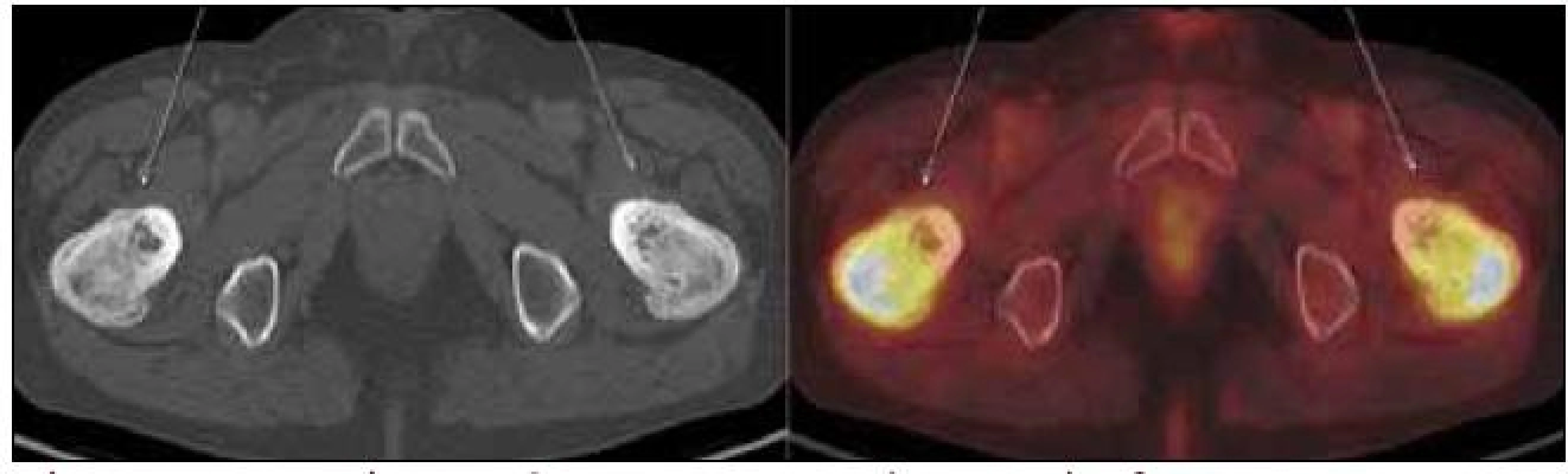
Obr. 10. PET-CT zobrazení kyčle a femurů. Oba femury mají nepravidelnou, převážně sklerotickou strukturu spongiózy s osteolytickými okrsky, v těchto místech i jasný hypermetabolizmus glukózy (označeno šipkami). Aktivita v močovém měchýři fyziologická při vylučování radiofarmaka. 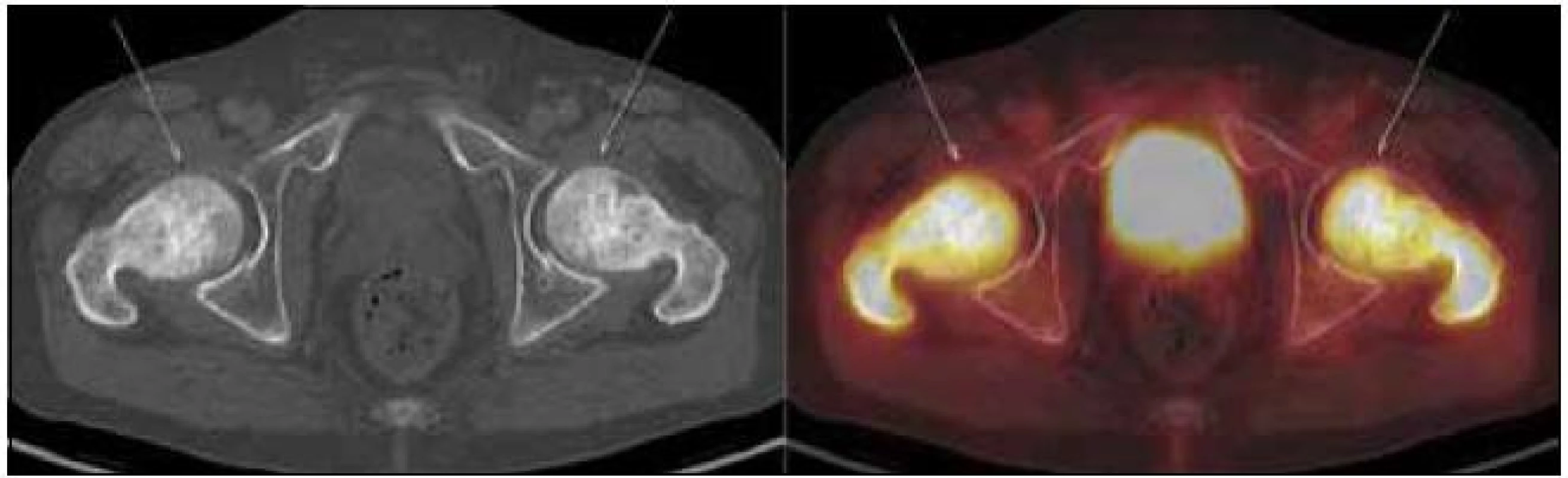
Obr. 11. PET-CT zobrazení dolní končetiny. Při CT zobrazení je zřetelné zesílení kortikalis v oblasti tibie i femuru a při fúzi PET-CT pak patologicky zvýšená akumulace fluorodeoxyglukózy v těchto oblastech. 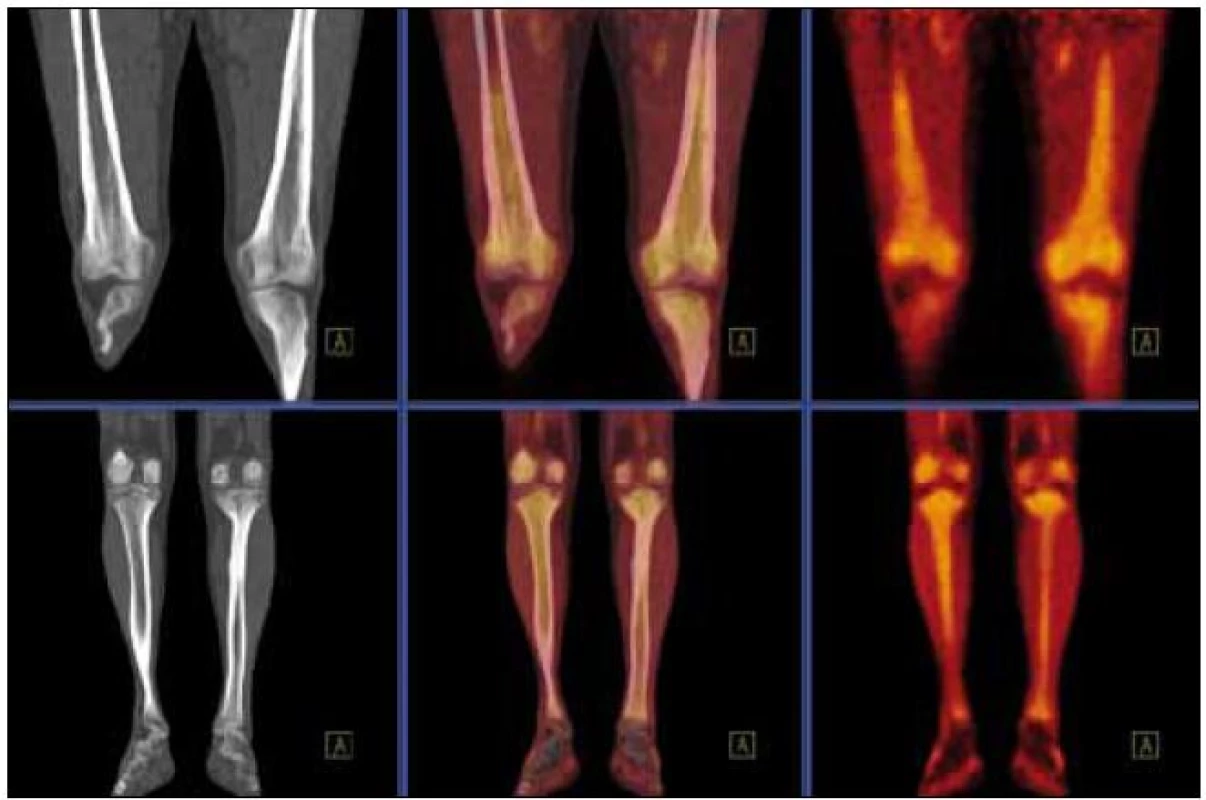
MR vyšetření
Při MR zobrazení skeletu celého těla se prokázala rozsáhlá infiltrace kostní dřeně s převahou v oblasti dolních končetin.
Vstupní denzitometrické vyšetření skeletu
Vstupní denzitometrické vyšetření (DEXA) proběhlo v klasicky měřených oblastech, bederní páteři a krčku femuru. Hustota bederních obratlů byla v pásmu osteoporózy, tedy se Z skóre výrazně pod hodnotou –2,0, zatímco hodnota Z skóre v oblasti krčku femuru se pohybovala v pozitivních hodnotách. Výsledky kostní denzitometrie přináší tab. 3. Naměřená vysoká denzita krčku femuru odpovídá zesílené kostní struktuře zřetelné při RTG a CT zobrazení.
Tab. 3. Výsledky měření kostní hustoty před léčbou. T skóre udává, o kolik směrodatných odchylek se liší naměřená hodnota od normy pro mladé osoby, Z skóre udává, o kolik směrodatných odchylek se liší naměřená hodnota od průměrné hodnoty pro daný věk a pohlaví. Zřetelně je zvýšená hustota kostní struktury krčku femuru a naopak snížená kostní hustota bederních obratlů. 
Histologické stanovení diagnózy
Uvedená scintigrafická zobrazení vysvětlují, proč trepanobiopsie lopaty kosti pánevní neprokázala v roce 2005 žádnou patologii. Lopaty kosti pánevní nebyly u tohoto pacienta postiženy. Proto jsme v roce 2009 již neopakovali necílenou biopsii lopaty kosti pánevní a místo toho jsme požádali ortopedy o odběr materiálu z oblasti femuru, kde byla dle MR skeletu celého těla i PET vyšetření značná patologická infiltrace. V celkové narkóze byl na operačním sále ortopedy odebrán vzorek kostní dřeně z té části femuru, kde bylo dle zobrazovacích vyšetření maximum patologického nálezu.
Částečka spongiózní kosti byla prostoupena agregáty pěnitých makrofágů s fibrózou. Místy se objevily i nečetné lymfoidní a plazmatické buňky. Imunohistochemie vyšla následovně: CD68+, CD1a–, S-100 fokálně pozitivní, α1-antitrypsin pozitivní, lysozym pozitivní.
Histologický obraz a imunofenotyp korelují s Erdheimovou-Chesterovou nemocí.
Léčebné schéma
Léčba byla zahájena 13. 10. 2009 kombinací 2-chlorodeoxyadenozin (Litac) 5 mg/m2 s.c., 5 dní po sobě + cyklofosfamid 150 mg/m2 i.v. ve formě infuze 5 dní po sobě + Dexametazon 24 mg 5 dní po sobě. Opakování těchto cyklů bylo plánováno v měsíčních intervalech.
Chemoterapii jsme podali 4krát ve výše uvedeném složení a 3krát redukovanou na aplikaci pouze 1.–3. den. Důvodem pro redukci byla cytopenie.
Chemoterapie byla ukončena v červnu roku 2010. Vzhledem k redukci dávek Litacu v průběhu chemoterapie jsme místo původních 6 cyklů podali celkem 7 cyklů, ve snaze aplikovat celkovou plánovanou dávku.
Pro kombinaci osteolytických a osteosklerotických změn skeletu byl podáván klodronat (Bonefos).
Vyhodnocení účinku léčby první linie
Pacient již v průběhu léčby udával úplné vymizení bolestí v dolních končetinách a vymizely také teploty. Při opakovaném laboratorním vyšetření bylo zřetelné klesání hodnot markerů zánětu. Zároveň však postupně docházelo ke snižování hodnot neutrofilů a lymfocytů, což byl nežádoucí důsledek této chemoterapie. Biochemické a hematologické parametry před léčbou, v průběhu léčby a po léčbě uvádíme v tab. 4.
Tab. 4. Vybrané laboratorní parametry dokumentující účinnost léčby i její nežádoucí účinky. 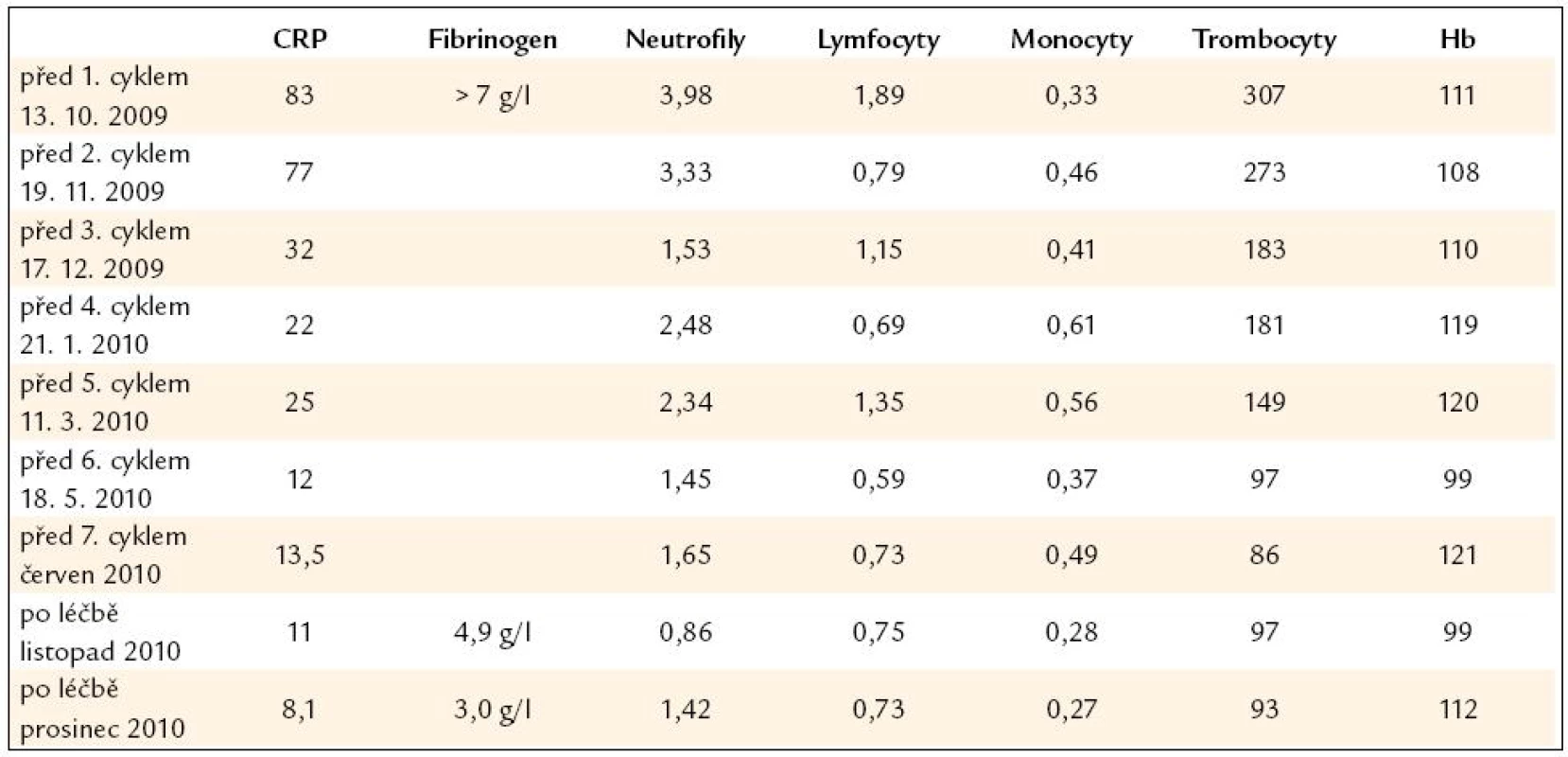
Základem pro hodnocení léčebné odpovědi jsou však změny při opakovaně prováděných zobrazovacích vyšetřeních.
MR skeletu celého těla provedené po ukončení léčby dne 11. 11. 2010
Na MR zobrazení po ukončení léčby byla stále zřetelná infiltrace kostní dřeně dolních končetin přibližně stejného rozsahu, ale na rozdíl od posledního vyšetření s výrazně menší restrikcí difuze těchto infiltrovaných oblastí.
PET-CT zobrazení
U pacienta bylo provedeno PET-CT vyšetření před léčbou, v průběhu léčby a po jejím ukončení. Při každém vyšetření byla měřena hodnota SUV vždy ve stejných bodech se zvýšenou akumulací fluorodeoxyglukózy. Aby bylo možné srovnání, byla míra aktivity v měřených místech vyjádřena jak hodnotou SUVmax, tak poměrnou hodnotou SUVmax v ložisku ku SUVmax v játrech, jak znázorňuje obr. 12. Tento poměr je vhodnější pro srovnávání jednotlivých vyšetření mezi sebou, neboť eliminuje vlivy odchylek množství podané radioaktivity při jednotlivých vyšetřeních. Číselné hodnoty z těchto vyšetření přináší tab. 5 a obrazově dokumentující pokles akumulace fluorodeoxyglukózy po léčbě pak obr. 13 a 14.
Tab. 5. Výsledky vyšetření PET-CT vyjádřené jako hodnotou SUVmax, tak indexem SUVmax ložisko/SUVmax hepar. Pro srovnání jednotlivých vyšetření mezi sebou je vhodnější uvedený poměrný index. 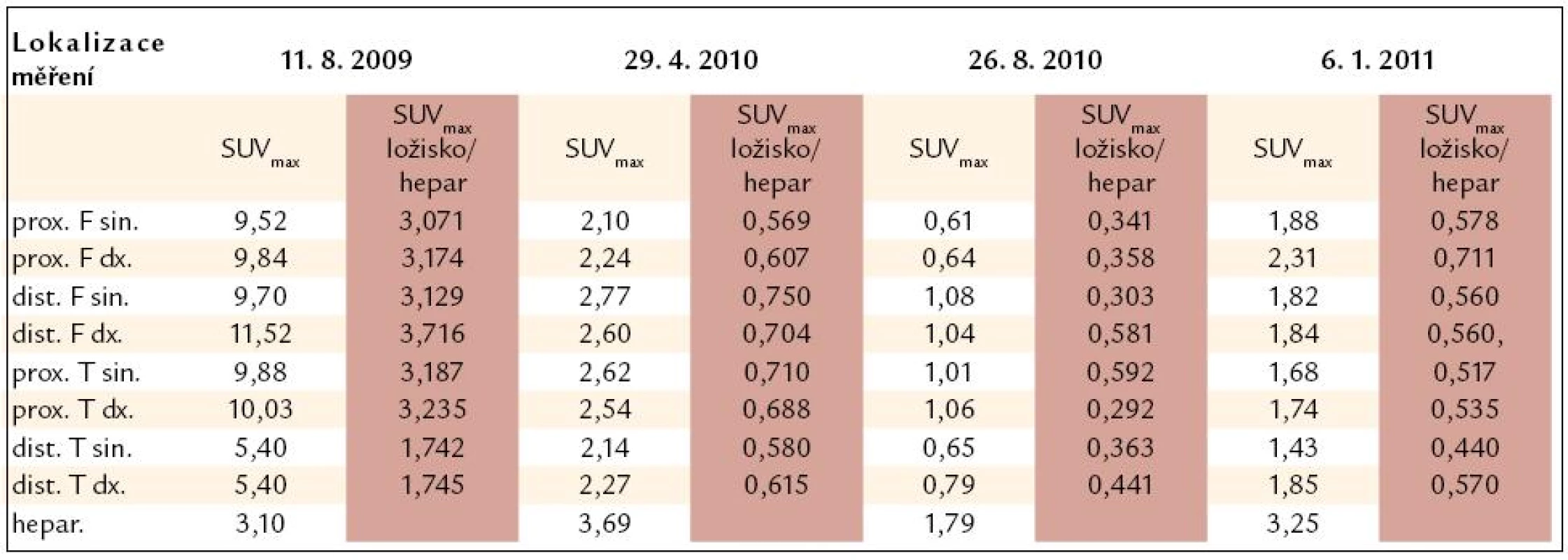
prox. F. sin. – proximální část femuru vlevo, dist. F sin. – distální část femuru vlevo, prox. T sin. – proximální tibie vlevo, dist. T sin. – distální část tibie vlevo Obr. 12. Metodika měření metabolické aktivity ve stanovených místech skeletu a referenčním parenchymu jater: index metabolické aktivity SUV<sub>max</sub> stanovujeme u všech studií v proximálních femurech, distálních femurech, proximálních i distálních tibích oboustranně a v játrech (referenční oblast), na rozdíl od obrázku ne ve 2D, ale ve 3D analýze. 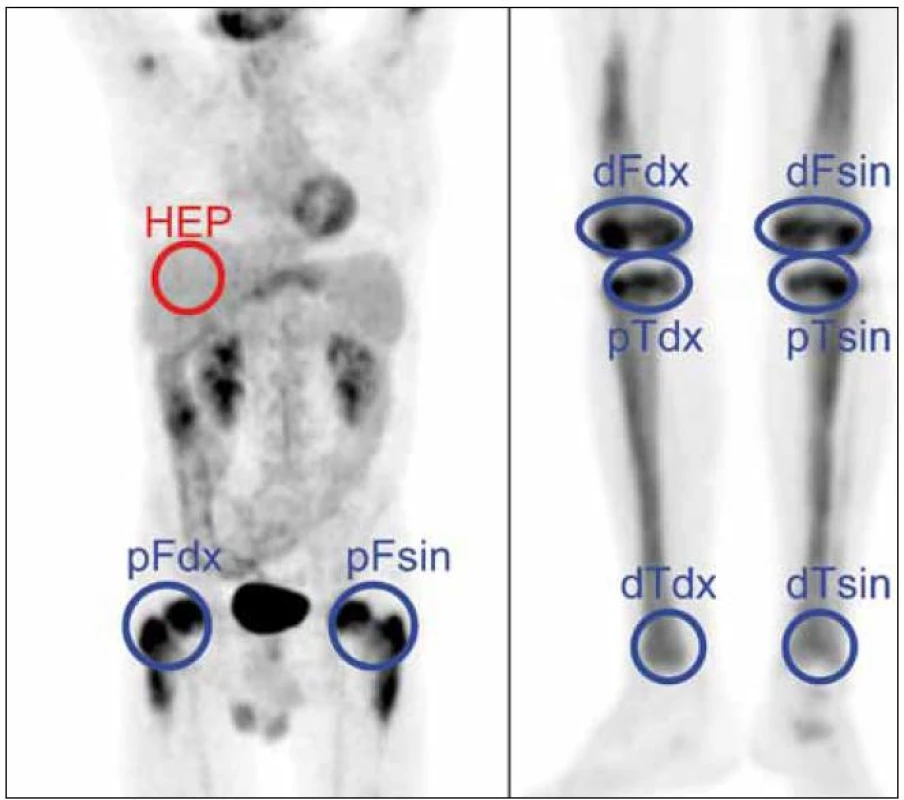
Obr. 13. Srovnání PET-CT akumulace fluorodeoxyglukózy při PET-CT vyšetření před léčbou, v průběhu léčby a po ukončení léčby. PET-MIP (maximum intensity projection – MIP) v barevné škále „Hot Body“. Studie 8/2009 vlevo, 4/2010 uprostřed, 8/2010 vpravo. Je patrný pokles metabolické aktivity ve skeletu dolních končetin, nicméně i u poslední studie je výrazně vyšší než bývá obvyklé u fyziologických nálezů. 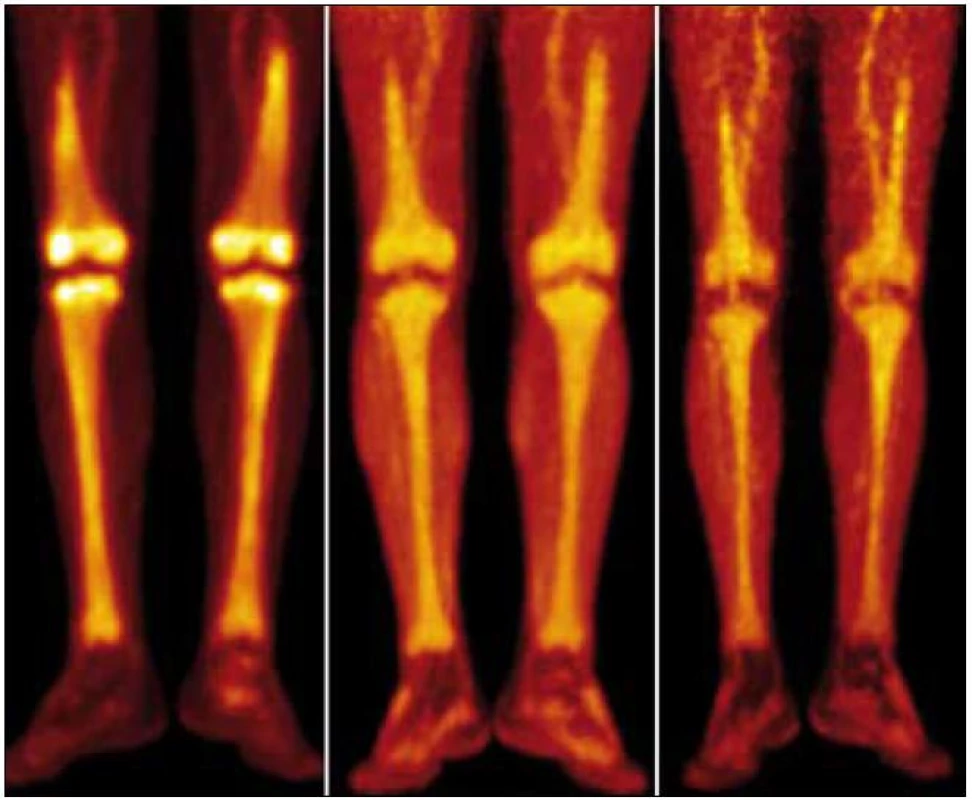
Obr. 14. Srovnání akumulace fluorodeoxyglukózy při PET-CT vyšetření před léčbou, v průběhu léčby a po ukončení léčby. PET-CT dolních končetin opět u studií 8/2009, 4/2010, 8/2010. CT v režimu „low dose CT, kostní okno“, PET v barevné škále „Hot Body“, koronální řezy. Opět i zde je pokles metabolické aktivity ve skeletu dolních končetin. 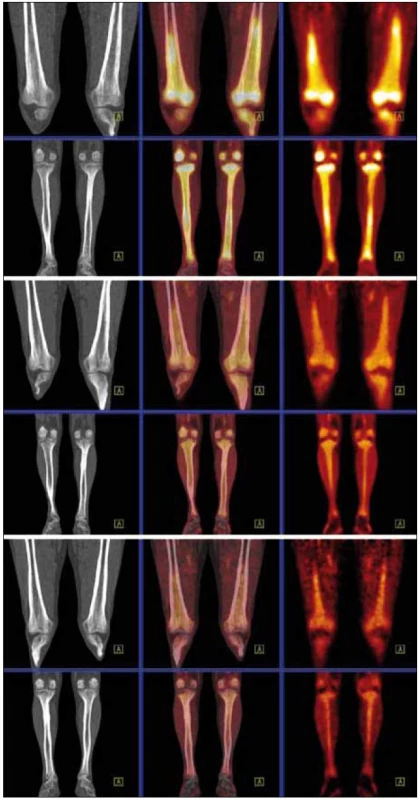
Při kontrolním PET-CT vyšetření bylo použito takzvané „low dose CT zobrazení“ (neboli zobrazení s menší dávkou záření), a tím se mírně zmenšila rozlišitelnost. Ale i tak bylo zřejmé, že v dutině břišní došlo k postupné regresi fibrózních změn paraortálně, maximální postižení bylo původně při mediální kontuře aorty přibližně v úrovni pupku. Při vstupním vyšetření byla šíře aorty včetně fibrózních změn 26 mm v průměru, při posledním vyšetření 24 mm v průměru. Ke zlepšení došlo nenápadně, postupně od první kontroly. Podobný vývoj byl patrný i vpravo perirenálně, kde byla při posledním CT z ledna roku 2011 patrná jen diskrétní, nespecifická rezidua původně velmi jasně zřetelných fibrotických změn. Doba sledování od stanovení diagnózy je 16 měsíců.
Nežádoucí účinky léčby
Subjektivní tolerance léčby byla po celou dobu dobrá, nenastala žádná alopecie ani žádné gastrointestinální potíže. V průběhu léčby klesal absolutní počet lymfocytů i neutrofilů a závažný imunodeficit, navozený touto léčbou, se projevil až po ukončení léčby pásovým oparem, který pro přerušení léčby recidivoval, proto v současnosti podáváme dlouhodobě nízkou dávku acykloviru. V průběhu léčby nebyla však nutná ani jedna hospitalizace pro infekční komplikace, přijetí si vynutil až recidivující herpes zoster, který vznikl 2. měsíc po ukončení léčby.
Diskuze
Základní informace o 2-chlorodeoxyadenozinu
Základní charakteristicky této nemoci jsme opakovaně popsali [12,16]. Předcházející publikace obsahuje i podrobný přehled publikovaných léčebných postupů [16], proto je v této diskuzi už nebudeme opakovat. Neboť jsme se po prostudování dostupné literatury rozhodli pro léčbu kladribinem, připomeneme fakta, která nás k tomu vedla.
Kladribin, synonymem 2-chlorodeoxyadenozin, je derivát adenozinu, u něhož byl na 2. uhlíku purinového kruhu vodík substituován chlórem. Tato změna stačí k tomu, aby zabránila deaminaci 2-chlorodeoxyadenozinu. Kladribin je v buňce metabolizován a fosforylován až na 2-chloroadenozintrifosfát, který je vlastní účinnou formou léku. Akumulace deoxyadenozintrifosfátu je největší v buňkách, jejichž aktivační (fosforylační) enzym, deoxycytidinkináza, má největší aktivitu, zatímco inaktivační (defosforylační) enzym, cytoplazmatická 5-nukleotidáza, má nejmenší aktivitu. Velmi příznivý poměr uvedených dvou enzymů pro účinnost kladribinu je v klidových a proliferujících lymfocytech, v monocytech, v histiocytech a také v Langerhansových buňkách. V nich dosahují nitrobuněčné koncentrace 2-chloroadenozintrifosfátů několiksetkrát vyšší hladiny, než je jeho plazmatická koncentrace. Díky této vlastnosti je kladribin vysoce selektivním cytostatikem, má intenzivní cytotoxický účinek na pomalu progredující maligní lymfatické a histiocytární buňky. V buňkách ostatních tkání je akumulace 2-deoxyadenozintrifosfátu malá, takže na ně cytotoxicky nepůsobí. Kladribin proniká v účinné dávce do CNS, intratekální koncentrace kladribinu dosahuje 25% plazmatické koncentrace, což je dostačující hladina pro tumoricidní efekt na granulomy z lymfoidních či histiocytárních buněk. Biologická dostupnost podkožní aplikace je 100%, takže je možné jak nitrožilní, tak podkožní podání. Farmakologické vlastnosti kladribinu (100% resorpce z podkoží, několikasetnásobná akumulace v cílových senzitivních buňkách a 15–30hodinový intracelulární poločas) umožňují aplikaci formou podkožních injekcí.
Výše uvedená farmakokinetická data zdůvodňují, proč jsme zvolili 2-chlorodeoxyadenozin pro léčbu první linie.
Publikované zkušenosti s aplikací 2-chlorodeoxyadenozinu u Erdheimovy-Chesterovy nemoci a dále u juvenilního xantogranulomu
Kladribin se osvědčil u dětí s juvenilním xantogranulomem a u 2 případů s Erdheimovou-Chesterovou nemocí. První popsal podání kladribinu v této indikaci Sheidow v roce 2000 [17]. Na tuto zkušenost navázali Myra et al, kteří v rámci iniciální léčby svého pacienta podali etoposid, při absenci léčebné odpovědi pak cyklofosfamid a cyklosporin. Když uvedené 3 testované léčebné alternativy nebyly dostatečně účinné, tak podávali jako 4. léčebnou linii pacientovi kladribin v dávce 0,14 mg/kg/den 5 dní po sobě kontinuální infuzí Hickmanovým katetrem. Po 2 cyklech byla zřetelná léčebná odpověď. Celkem aplikovali 6 cyklů a uvádí, že při hodnocení po 2 letech stále trvala léčebná odpověď [18]. Pozitivní zkušeností s kladribinem v této indikaci uvádí také Aouba [19].
Blouin et al popisují podání 2-chlorodeoxyadenozinu a cytosinarabinozidu po selhání předchozí léčby kombinací etopozidu, kortikoidu a vinblastinu. Tato léčba vedla u pacienta s juvenilním xantogranulomem ke kompletní remisi [20].
Podobně byla léčba u dalšího dítěte s postižením CNS juvenilním xantogranulomem zahájena prednisonem a vinblastinem. Byla bez efektu a teprve až aplikace kladribinu v monoterapii navodila léčebnou odpověď [21]. Popsán je ale i případ, kdy byly buňky juvenilního xantogranulomu k této léčbě zcela rezistentní [22].
Vlastní zkušenosti
Na našem pracovišti jsme se setkali s touto diagnózou za posledních 20 let pouze 2krát a oba pacienti přišli v posledních letech, 2008 a 2009. Uvedené farmakologické vlastnosti 2-chlorodeoxyadenozinu a výše citované publikace, které hodnotí účinnost 2-chlorodeoxyadenozinu při Erdheimově-Chesterově nemoci u dospělých a juvenilního xantogranulomu u dětí, nás vedly k volbě 2-chlorodeoxyadenozinu pro léčbu první linie.
U 1. pacienta s regresí mnohočetných ložisek v CNS hodnotíme léčebnou odpověď jako parciální remisi. Nemáme vysvětlení pro skutečnost, že v mozku v průběhu léčby některá ložiska zcela vymizela a jiná se signifikantně zmenšila, zatímco akumulace fluorodeoxyglukózy v ložiscích v dlouhých kostech vůbec nepoklesla. Vymizení bolestí v dolních končetinách přičítáme vlivu bisfosfonátů. Při poslední kontrole 26 měsíců od zahájení léčby vykazoval pacient známky aktivity nemoci.
U 2. pacienta jsme po léčbě dosáhli vymizení příznaků nemoci, horečky a patologické únavy (fatigue), normalizace hodnot CRP a fibrinogenu a výrazného poklesu akumulace fluorodeoxyglukózy ve všech měřených lokalizacích (tab. 5 a obr. 13 a 14).
Dle MR zobrazení celého těla je však rozsah ložisek s patologickým signálem ze skeletu stejný, zatímco při PET zobrazení výrazně ubyla intenzita akumulace fluorodeoxyglukózy. Jak tyto diskrepance MR a PET zobrazení interpretovat?
Domníváme se, že zde můžeme použít analogii s mnohočetným myelomem, u kterého zůstávají, i po dosažení léčebné odpovědi a vymizení aktivity při PET zobrazení a vymizení monoklonálního imunoglobulinu ze séra, patologické signály při MR zobrazení skeletu. Proto se v případě mnohočetného myelomu doporučuje MR ke stanovení rozsahu nemoci před zahájením léčby, ale již ne k vyhodnocování léčebné odpovědi v kostní dřeni. Domníváme se, že podobné závěry platí i pro infiltraci skeletu tímto histiocytárním onemocněním. Literatura uvádí PET-CT jako optimální metodu pro vyhodnocování léčebné odpovědi u této nemoci [23,24]. Chemoterapií jsme sice nedosáhli úplné normalizace akumulace fluorodeoxyglukózy v původních patologických ložiscích, nicméně zmenšení akumulace fluorodeoxyglukózy je velmi výrazné a odpovídá klinicky zřetelnému vymizení aktivy nemoci.
Závěr pro praxi
- V případech horečky nejasného původu (která je dle mezinárodního konsenzu definována jako horečka nad 38 °C bez jasné etiologie trvající déle než 3 týdny nebo zvýšená teplota provázená zvýšením zánětlivých parametrů při laboratorním vyšetřením) může PET-CT vyšetření prokázat její příčinu. V případě, že cílem vyšetření je podchytit možnou Erdheimovu-Chesterovu chorobu, je vhodné požádat o zobrazení celé postavy včetně dolních končetin.
- Pokud je difuzně zvýšená aktivita v atypickém místě, jako jsou kosti dlouhých končetin, je nutné provést histologické vyšetření z ložiska nejvyšší aktivity fluorodeoxyglukózy ve spolupráci s ortopedy, kteří mohou provést cílený odběr.
- V případě diabetes insipidus a infiltrace stopky infundibula doporučujeme nedělat biopsii stopky infundibula, která přináší více komplikací než prospěchu, ale raději provést PET-CT vyšetření celého těla. To může odhalit extrakraniální projevy nemoci, která vedla k zesílení stopky hypofýzy a k diabetes insipidus.
- Kladribin (2-chlorodeoxyadenozin) v monoterapii nebo v kombinaci s cyklofosfamidem a dexametazonem představuje léčebnou alternativu pro pacienty s Erdheimovou-Chesterovou nemocí a juvenilním xantogranulomem. Tato léčba však nemusí být účinná ve všech případech a ve všech lokalizacích stejně, jak potvrzují naše zkušenosti. V případě, že se nedostaví léčebná odpověď na 2-chlorodeoxyadenozin, je možné vyzkoušet některý z dříve publikovaných léčebných postupů. Jejich přehled uvádíme v tabulce v předchozí publikaci [16]. Mezi nové testované postupy patří podávání imatinibu [25,26] anebo preparátu anakinra [27].
- Do léčebné strategie však patří také podávání bisfosfonátů, pozitivní účinek na tuto nemoc popisují 3 publikace [28–30].
Tato publikace byla připravena v rámci projektu MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“ za podpory projektu FUNDIN MZ0MOU2005 a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Zdroje
1. Sverdlow SH, Campo E, Harris NL et al (eds). WHO Classification of tumours of haematopoietic and lymphoid tissues. 4th ed. WHO Press Lyon 2008; 439.
2. Kinkor Z, Koudela K, Koudela K et al. Warfarinem vyvolaná hemorhagická pseudocysta malé pánve u ženy s vrozeným genetickým defektem koagulace komplikovaná usuračním pseudoxanthomem pánevní kosti napodobující Erdheimovu Chesterovu nemoc. Acta Chir Ortop Traum Čechoslov 2007; 74 : 114–117.
3. Kinkor Z. Severe pulmonary involvement in Erdheim-Chester disease (case report). Cesk Patol 2001; 37 : 114–117.
4. Kinkor Z. Závažné plicní postižení u Erdheimovy-Chesterovy nemoci. Čes Slov Patol 2001; 37 : 114–117.
5. Kolar J, Kucera V, Povysil C et al. Erdheim--Chester disease. Rofo 1984; 141 : 698–701.
6. Mergancová J, Kubes L, Elleder M. Xanthogranulomatous processes in the area of the large vessels. Česk Patol 1986; 22 : 145–150.
7. Mergancová J, Kubeš L, Elleder M. A xantogranulomatous process encircling large blood vessels (Erdheim-Chester disease). Czech Med 1988; 11 : 57–64.
8. Kučera V, Čáp V, Kužel J et al. Vzácná příčina osteosklerózy: Erdheimův-Chesterův syndrom. ČS Radiol 1984; 38 : 393–402.
9. Janková H, Říhová E. Juvenilní xantogranulom. Oftalmologie v kasuistikách 2007 : 214–218.
10. Vašáková M. Co je to Erdheimova nemoc? Kazuist Alergol Pneumol ORL 2006; 3 : 22–28.
11. Plank L. Diagnostická patológia non--Langerhans cell histiocytóz. Vnitř Lék 2010; 56 (Suppl 2): 2S39–2S63.
12. Szturz P, Adam Z, Koukalová R et al. Erdheimova-Chesterova nemoc v obrazech. Vnitř Lék 2010; 56 (Suppl 2): 2S170–2S178.
13. Adam Z, Zahradová L, Krejčí M et al. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET-CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury. Vnitř Lék 2010; 56 : 1159–1168.
14. Veyssier-Belot C, Cacoub P, Caparros--Lefebvre B et al. Erdheim-Chester disease: Clinical and radiological characteristics of 59 cases. Medicine (Baltimore) 1996; 75 : 157–169.
15. Lachenal F, Cotton F, Desmurs-Clavel H et al. Neurological manifestations and neuroradiological presentation of Erdheim-Chester disease: report of 6 cases and systematic review of the literature. J Neurol 2006; 253 : 1267–1277.
16. Adam Z, Balšíková K, Pour L et al. Diabetes insipidus, následovaný po 4 letech dysartrií a lehkou pravostrannou hemiparézou – první klinické příznaky Erdheimovy-Chesterovy nemoci. Popis a zobrazení případu s přehledem informací o této nemoci. Vnitř Lék 2009; 55 : 1173–1188.
17. Sheidow TG, Nicolle DA, Heathcote JG. Erdheim-Chester disease: two cases of orbital involvement. Eye (Lond) 2000; 14 : 606–612.
18. Myra C, Sloper L, Tighe PJ et al. Treatment of Erdheim-Chester disease with cladribine: a rational approach. Br J Ophthalmol 2004; 88 : 844–847.
19. Aouba A, Larousserie F, Le Guern V et al. Spumous histiocytic oligoarthritis coexisting with systemic Langerhans’ cell histiocytosis: case report and literature review. Joint Bone Spine 2009; 76 : 701–704.
20. Blouin P, Yvert M, Arbion F et al. Juvenile xanthogranuloma with hematological dysfunction treated with 2CDA-AraC. Pediatr Blood Cancer 2010; 55 : 757–760.
21. Rajendra B, Duncan A, Parslew R et al. Successful treatment of central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52 : 413–415.
22. Orsey A, Paessler M, Lange BJ et al. Central nervous system juvenile xanthogranuloma with malignant transformation. Pediatr Blood Cancer 2008; 50 : 927–930.
23. Arnaud L, Malek Z, Archambaud F et al. 18F-fluorodeoxyglucose-positron emission tomography scanning is more useful in followup than in the initial assessment of patients with Erdheim-Chester disease. Arthritis Rheum 2009; 60 : 3128–3138.
24. Tan IB, Padhy AK, Thng CH et al. Intensely hypermetabolic extra-axial brainstem tumor in Erdheim-Chester disease. Clin Nucl Med 2009; 34 : 604–607.
25. Janku F, Amin HM, Yang D et al. Response of histiocytoses to imatinib mesylate: fire to ashes. J Clin Oncol 2010; 28 : 633–636.
26. Haroche J, Amoura Z, Charlotte F. Imatinib mesylate for platelet-derived growth factor receptor-beta-positive Erdheim-Chester histiocytosis. Blood 2008; 111 : 5413–5415.
27. Aouba A, Georgin-Lavialle S, Pagnoux Ch et al. Rationale for efficacy of interleukin-1 targeting in Erdheim-Chester disease. Blood 2010; 116 : 4070–4076.
28. Srikulmontree T, Massey HD, Roberts WN et al. Treatment of skeletal Erdheim-Chester disease with zoledronic acid: case report and proposed mechanisms of action. Rheumatol Int 2007; 27 : 303–307.
29. Eyigör S, Kirazli Y, Memis A et al. Erdheim-Chester disease: the effect of bisphosphonate treatment – a case report. Arch Phys Med Rehabil 2005; 86 : 1053–1057.
30. Mossetti G, Rendina D, Numis FG et al. Biochemical markers of bone turnover, serum levels of interleukin-6/interleukin-6 soluble receptor and bisphosphonate treatment in Erdheim-Chester disease. Clin Exp Rheumatol 2003; 21 : 232–236.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Brugada syndromČlánek Primární jaterní karcinoid
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Změna spektra supraventrikulárních tachyarytmií indikovaných ke katetrové ablaci – editorial
- Brugada syndrom: syndrom vzácný, ale zákeřný – editorial
- Primární jaterní karcinoid – editorial
- Vplyv dlhodobej glykemickej kompenzácie na zmeny v lipidovom profile detí a adolescentov s diabetes mellitus 1. typu
- Účinnost a bezpečnost podávání moxonidinu u pacientů s metabolickým syndromem (klinické hodnocení O.B.E.Z.I.T.A.)
- Dlouhodobé výsledky katetrizační ablační léčby u supraventrikulárních tachyarytmií
- Brugada syndrom
- Senioři a kardiovaskulární medikace
- Infekční endokarditida – klíčová včasná diagnóza
- Úspěšná léčba Erdheimovy-Chesterovy nemoci chemoterapií obsahující 2-chlorodeoxyadenozin. Popis dvou případů a přehled literatury
- Primární jaterní karcinoid
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Brugada syndrom
- Primární jaterní karcinoid
- Senioři a kardiovaskulární medikace
- Dlouhodobé výsledky katetrizační ablační léčby u supraventrikulárních tachyarytmií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



