-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
proLékaře.cz / Odborné časopisy / Urologické listy / 2012 - EAU Guidelines pro léčbu symptomů dolních močových cest u mužů4. Medikamentózní léčba
Autoři: M. Oelke; A. Bachmann; A. Descazeaud; M. Emberton; S. Gravas; M. C. Michel; J. N’dow; J. Nordling; J. J. De La Rosette
Působiště autorů: European Association of Urology 2012
Vyšlo v časopise: Urol List 2012; 10(EAU Guidelines pro léčbu symptomů dolních močových cest u mužů): 9-27
4.1 Antagonisté alfa-1 adrenergních receptorů (alfa-1 blokátory)
4.1.1 Mechanizmus účinku
Dříve se předpokládalo, že alfa-1 blokátory inhibují účinek endogenně uvolňovaného noradrenalinu na buňky hladkého svalstva prostaty, a tím snižují tonus prostaty a obstrukci výtoku z močového měchýře. Kontrakce prostaty u člověka je převážně, ne-li výlučně, vyvolávána alfa-1A adrenergními receptory [1]. Ukázalo se však, že alfa-1 blokátory mají malý účinek na rezistenci výtoku z močového měchýře stanovenou urodynamickým vyšetřením [2] a že mezi zlepšením symptomů LUTS v důsledku léčby a obstrukcí existuje jen malá spojitost [3]. Proto probíhala rozsáhlá diskuze o úloze alfa-1 adrenergních receptorů lokalizovaných mimo prostatu (např. v močovém měchýři a/nebo míše) a jiných subtypů alfa-adrenergních receptorů (alfa-1B nebo alfa-1D adrenergních receptorů) jakožto mediátorů příznivých účinků alfa-1 blokátorů. Alfa-1 adrenergní receptory v cévách, jiných buňkách hladkého svalstva mimo prostatu a v centrálním nervovém systému se považují za mediátory vedlejších účinků během léčby alfablokátory a pravděpodobně jsou zapojeny všechny tři subtypy receptorů. Tento koncept podpořil používání selektivních antagonistů alfa-1A adrenergních receptorů. Je však stále třeba stanovit, zda je selektivita k alfa-1A jediným a hlavním faktorem určujícím dobrou snášenlivost.
4.1.2 Dostupná léčiva
Zatímco zpočátku se pro léčbu symptomů LUTS vyvolaných BPH používaly fenoxybenzamin a prazosin, v současné době se používají zejména tyto čtyři alfa-1 blokátory:
- alfuzosin HCL (alfuzosin)
- doxazosin mesylát (doxazosin)
- tamsulosin HCL (tamsulosin)
- terazosin HCL (terazosin)
V Evropě je již nějakou dobu klinicky dostupný alfuzosin ve třech lékových formách, doxazosin a tamsulosin každý ve dvou lékových formách a terazosin v jedné lékové formě (tab. 2). Ačkoli různé lékové formy mají za následek různé farmakokinetické chování a snad i různé profily snášenlivosti, celkový klinický dopad těchto různých lékových forem není příliš velký. Ačkoli v některých zemích jsou k dispozici rovněž indoramin, naftopidil a v poslední době také silodosin, k těmto látkám byly v době vyhledávání literatury k dispozici pouze omezené klinické údaje, a proto nebudou v těchto guidelines uvažovány.
Tab. 1. Klíčové farmakokinetické vlastnosti a standardní dávkování alfa-1 blokátorů povolených v Evropě pro léčbu symptomů BPH. 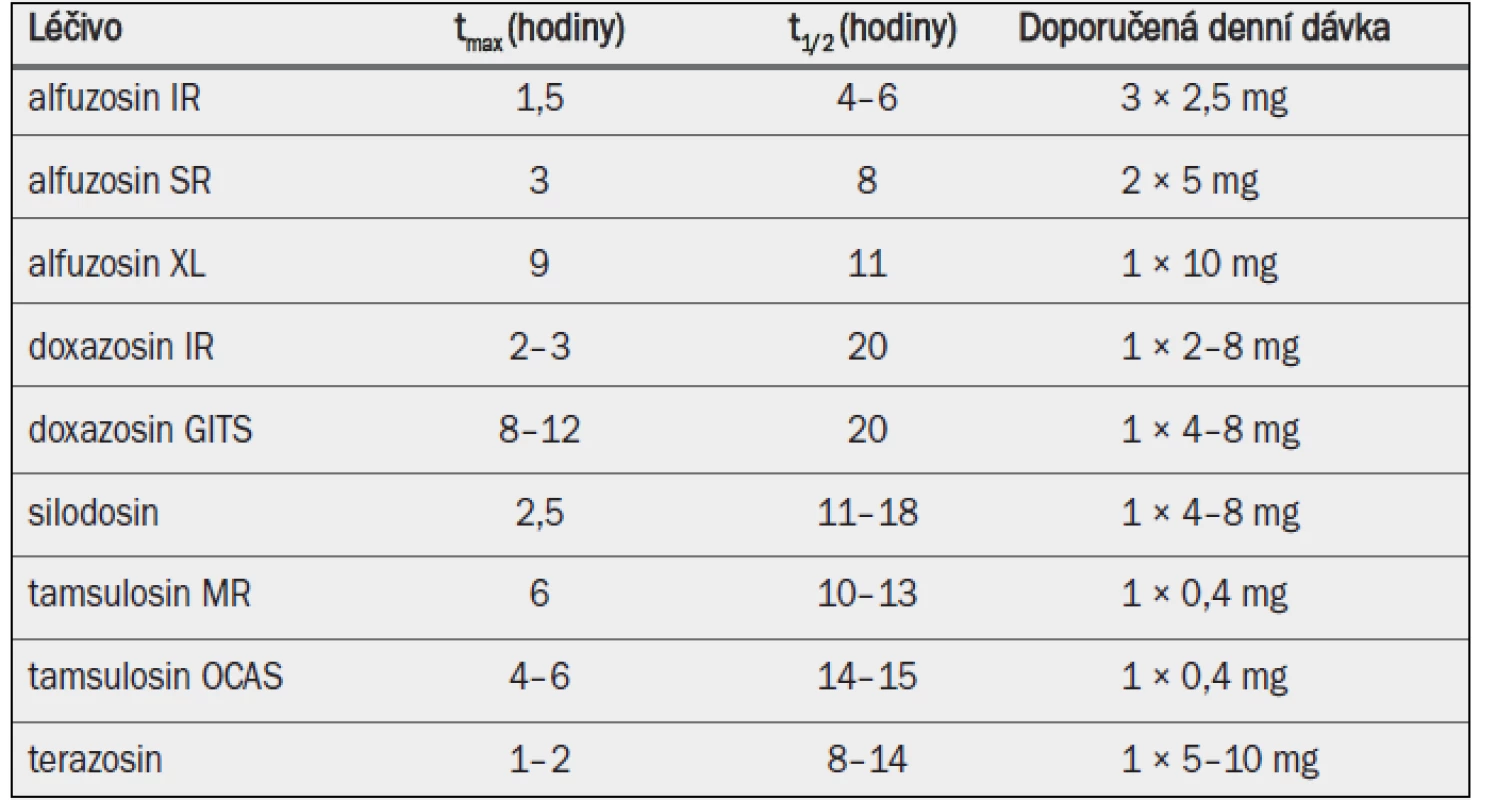
tmax = doba do dosažení maximální koncentrace v plazmě; t1/2 = poločas rozpadu; IR = s okamžitým uvolňováním; SR = s postupným uvolňováním; GITS = gastrointestinální terapeutický systém; MR = s modifikovaným uvolňováním; OCAS = systém řízené perorální absorpce. 4.1.3 Účinnost
Nepřímá srovnání mezi alfa-1 blokátory a omezená přímá srovnání ukazují, že všechny alfa-1 blokátory mají v odpovídajícím dávkování podobnou účinnost [4]. Kontrolované studie ukázaly, že alfa-1 blokátory obvykle snižují mezinárodní skóre prostatických symptomů (IPSS) po zaváděcím období o přibližně 35–40 % a zvyšují maximální rychlost průtoku moči (Qmax) o přibližně 20–25 % (tab. 3). K významnému zlepšení však došlo také u příslušných placebo skupin [4,5]. V otevřených studiích (bez zaváděcího období) bylo zaznamenáno zlepšení IPSS až o 50 % a zvýšení Qmax až o 40 % [4,6].
Tab. 2. Randomizované placebem kontrolované studie testující účinnost alfa-1 blokátorů u mužů se symptomy LUTS (léčiva v chronologickém pořadí; výběr studií). 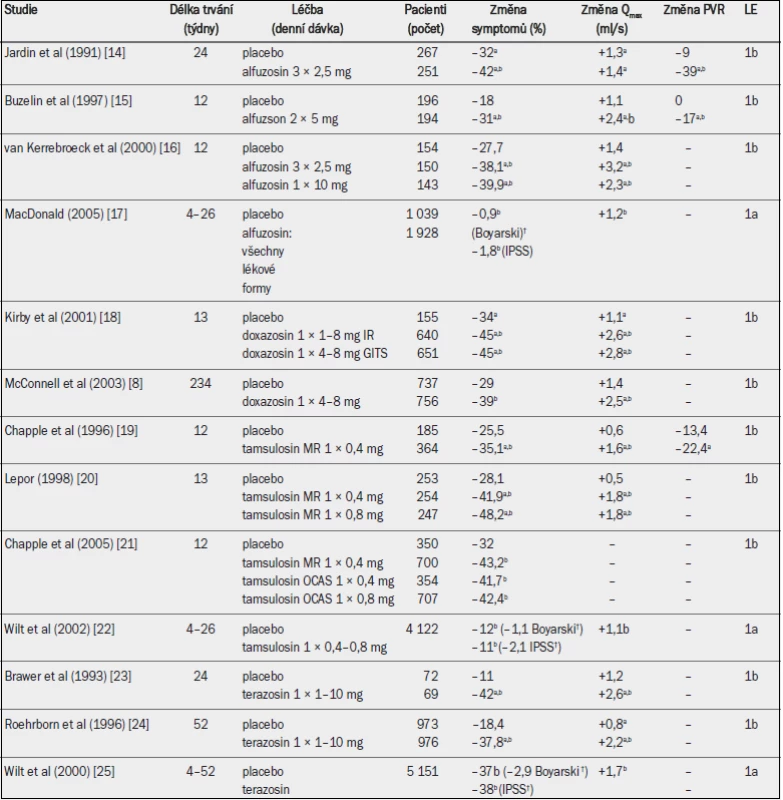
Qmax = maximální rychlost průtoku moči (volná uroflowmetrie); PVR = postmikční reziduum; a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významná v porovnání s placebem; † = absolutní hodnota. Ačkoli trvá několik týdnů, než se tato zlepšení v plném rozsahu projeví, statisticky významná účinnost v porovnání s placebem byla prokázána v řádu hodin až dnů. Alfa-1 blokátory dosahují zřejmě obdobné účinnosti, vyjádřeno v procentuelním zlepšením IPSS, u pacientů s mírnými, středně závažnými a závažnými symptomy [6]. Velikost prostaty neovlivňuje účinnost alfa-1 blokátorů ve studiích s následným sledováním po dobu < 1 roku, ale u pacientů s menší prostatou (< 40 ml) se v dlouhodobém horizontu účinnost v porovnání s většími žlázami zdála být lepší a je obdobná u všech věkových skupin [6]. V dlouhodobých studiích nebylo prokázáno, že by alfa-1 blokátory vedly ke zmenšení velikosti prostaty nebo prevenci akutní retence moči [8], takže někteří pacienti budou nakonec muset podstoupit operaci. Nicméně se zdá, že účinnost alfa-1 blokátorů přetrvává po dobu nejméně čtyř let.
4.1.4 Snášenlivost a bezpečnost
Ačkoli jsou alfuzosin, doxazosin a terazosin z hlediska molekulární struktury a absence selektivity k subtypu alfa-1 adrenergního receptoru podobné, vedlejší účinky alfuzosinu se spíše podobají vedlejším účinkům tamsulosinu než doxazosinu a terazosinu. Mechanizmy, které jsou zodpovědné za takto rozdílnou snášenlivost, nejsou zcela jasné, ale mohou zahrnovat lepší distribuci alfuzosinu a tamsulosinu do tkání dolních cest močových. Profil snášenlivosti konkrétních léčiv mohou ovlivňovat i jiné faktory, jako jsou například selektivita k subtypu a farmakokinetické profily určitých lékových forem.
Nejčastějšími vedlejšími účinky alfa-1 blokátorů jsou astenie, závratě a (ortostatická) hypotenze. Ačkoli snížení krevního tlaku může být benefitem pro pacienty s hypertenzí, alespoň v některých případech lze pozorovanou astenii a závratě přisuzovat poklesu krevního tlaku. Vazodilatační účinky jsou nejvýraznější u doxazosinu a terazosinu a jsou mnohem méně běžné u alfuzosinu a tamsulosinu (odds ratio (OR) pro nežádoucí příhody vaskulárního charakteru: 3,3 u doxazosinu / 3,7 u terazosinu / 1,7 u alfuzosinu / 1,4 u tamsulosinu, přičemž poslední dvě nedosahují statistické významnosti [5]). Zejména pacienti s kardiovaskulární komorbiditou a/nebo vazoaktivní medikací mohou být náchylní k vazodilataci vyvolávané alfablokátory [9]. Patří sem antihypertenziva, jako jsou antagonisté alfa-adrenergních receptorů, diuretika, blokátory Ca2+ kanálů, inhibitory angiotenzin-konvertujícího enzymu a antagonisté receptoru pro angiotenzin, ale také inhibitory fosfodiesterázy (PDE) indikované pro erektilní dysfunkci nebo symptomy LUTS u mužů [9].
Navzdory dlouholetému a rozšířenému používání alfa-1 blokátorů byl teprve nedávno v souvislosti s operací katarakty pozorován nežádoucí fenomén označovaný jako syndrom vlající duhovky (IFIS) [10]. Ačkoli byl syndrom IFIS pozorován u všech alfa-1 blokátorů, většina případů byla spojena s tamsulosinem. Není jasné, zda je to způsobeno větším rizikem tamsulosinu v porovnání s ostatními alfa-1 blokátory nebo spíše jeho rozšířenějším používáním, zvláště z toho důvodu, že poměr mezi dávkami, které mají vliv na oko, a dávkami, které účinkují na dolní cesty močové, je obdobný pro všechny alfa-1 blokátory [11]. Zdá se tedy rozumné nezahajovat léčbu alfa-1 blokátory před operací katarakty, přičemž probíhající léčba alfa-1 blokátory by měla být přerušena, i když není jasné, jak dlouho před operací. Je třeba poznamenat, že výskyt syndromu IFIS komplikuje operaci katarakty a činí ji technicky náročnější, ale neexistují žádné záznamy o zvýšených zdravotních rizicích těchto pacientů.
Jelikož symptomy LUTS a erektilní dysfunkce se často vyskytují souběžně, neměla by léčba BPH dále narušovat sexuální funkci. Systematický přehled článků uvádí, že alfa-1 blokátory nemají nepříznivý vliv na libido, mají nepatrný příznivý účinek na erektilní funkci, ale někdy způsobují abnormální ejakulaci [12]. Původně byla abnormální ejakulace považována za retrográdní, avšak údaje z poslední doby ukazují, že je způsobena (relativní) anejakulací, přičemž nízký věk je zjevným rizikovým faktorem. Ačkoli byla abnormální ejakulace pozorována častěji u tamsulosinu než u ostatních alfa-1 blokátorů, tento rozdíl nedosahoval v přímých srovnávacích studiích s alfuzosinem statistické významnosti a není spojen s celkovým snížením celkové sexuální funkce [12]. Zjevně vyšší riziko abnormální ejakulace u tamsulosinu přitahuje pozornost, neboť stále více alfa-1A selektivních léčiv, jako je silodosin, znamená větší riziko [13], avšak všechny alfa-1 blokátory jsou dávkovány tak, aby efektivně blokovaly alfa-1A adrenergní receptory. Proto musí být mechanizmus, který je příčinou abnormální ejakulace, teprve objasněn.
4.1.5 Praktické úvahy
Alfa-1 blokátory se často považují za medikamentózní léčbu první volby středně závažných až závažných symptomů LUTS u mužů. Všechny alfa-1 blokátory jsou dostupné v lékových formách vhodných k podávání jednou denně. Pro minimalizaci nežádoucích příhod se doporučuje, aby byla pro zahájení léčby doxazosinem a terazosinem použita titrace dávky; to však není nutné u alfuzosinu a tamsulosinu. Vzhledem k rychlému nástupu jejich účinku lze alfa-1 blokátory zvážit pro občasné podávání u pacientů s měnící se intenzitou symptomů, kteří nevyžadují dlouhodobou léčbu.
4.1.6 Doporučení
Alfa-1 blokátory by měly být nabízeny mužům se středně závažnými až závažnými symptomy dolních cest močových (úroveň důkazu / stupeň doporučení: 1a/A).
4.1.7 Literatura
- Michel MC, Vrydag W. a1-, a2 - and b-adrenoceptors in the urinary bladder, urethra and prostate. Br J Pharmacol 2006; 147 (Suppl 2): S88–S119.
- Kortmann BBM, Floratos DL, Kiemeney LA et al. Urodynamic effects of alpha-adrenoceptor blockers: a review of clinical trials. Urology 2003; 62(1): 1–9.
- Barendrecht MM, Abrams P, Schumacher H et al. Do a1-adrenoceptor antagonists improve lower urinary tract symptoms by reducing bladder outlet resistance? Neurourol Urodyn 2008; 27(3): 226–230.
- Djavan B, Chapple C, Milani S et al. State of the art on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Urology 2004; 64(6): 1081–1088.
- Nickel JC, Sander S, Moon TD. A meta-analysis of the vascular-related safety profile and efficacy of a-adrenergic blockers for symptoms related to benign prostatic hyperplasia. Int J Clin Pract 2008; 62(10): 1547–1559.
- Michel MC, Mehlburger L, Bressel HU et al. Comparison of tamsulosin efficacy in subgroups of patients with lower urinary tract symptoms. Prostate Cancer Prost Dis 1998; 1(6): 332–335.
- Roehrborn CG. Three months’ treatment with the a1-blocker alfuzosin does not affect total or transition zone volume of the prostate. Prostate Cancer Prostatic Dis 2006; 9(2): 121–125.
- McConnell JD, Roehrborn CG, Bautista O et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
- Barendrecht MM, Koopmans RP, de la Rosette JJ et al. Treatment for lower urinary tract symptoms suggestive of benign prostatic hyperplasia: the cardiovascular system. BJU Int 2005; 95 (Suppl 4): 19–28.
- Chang DF, Campbell JR. Intraoperative floppy iris syndrome associated with tamsulosin. J Cataract Refract Surg 2005; 31(4): 664–673.
- Michel MC, Okutsu H, Noguchi Y et al. In vivo studies on the effects of a1-adrenoceptor antagonists on pupil diameter and urethral tone in rabbits. Naunyn-Schmiedeberg’s Arch Pharmacol 2006; 372(5): 346–353.
- van Dijk MM, de la Rosette JJ, Michel MC. Effects of a1-adrenoceptor antagonists on male sexual function. Drugs 2006; 66(3): 287–301.
- Kawabe K, Yoshida M, Homma Y; Silodosin Clinical Study Group. Silodosin, a new a1 Aadrenoceptorselective antagonist for treating benign prostatic hyperplasia: a results of a phase III randomised, placebo-controlled, double-blind study in Japanese men. BJU Int 2006; 98(5): 1019–1024.
- Jardin A, Bensadoun H, Delauche-Cavallier MC et al. Alfuzosin for treatment of benign prostatic hypertrophy. The BPH-ALF Group. Lancet 1991 Jun; 337(8755):1457-61.
- Buzelin JM, Roth S, Geffriaud-Ricouard C et al. Efficacy and safety of sustained-release alfuzosin 5 mg in patients with benign prostatic hyperplasia. ALGEBI Study Group. Eur Urol 1997; 31(2): 190–198.
- van Kerrebroeck P, Jardin A, Laval KU et al. Efficacy and safety of a new prolonged release formulation of alfuzosin 10 mg once daily versus afluzosin 2.5 mg thrice daily and placebo in patients with symptomatic benign prostatic hyperplasia. ALFORTI Study Group. Eur Urol 2000; 37(3): 306–313.
- MacDonald R, Wilt TJ. Alfuzosin for treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia: a systematic review of efficacy and adverse effects. Urology 2005; 66(4): 780–788.
- Kirby RS, Andersen M, Gratzke P et al. A combined analysis of double-blind trials of the efficacy and tolerability of doxazosin-gastrointestinal therapeutic system, doxazosin standard and placebo in patients with benign prostatic hyperplasia. BJU Int 2001; 87(3): 192–200.
- Chapple CR, Wyndaele JJ, Nordling J et al. Tamsulosin, the first prostate-selective alpha 1A-adrenoceptor antagonist. A meta-analysis of two randomised, placebo-controlled, multicentre studies in patients with benign prostatic obstruction (symptomatic BPH). European Tamsulosin Study Group. Eur Urol 1996; 29(2): 155–167.
- Lepor H. Phase III multicenter placebo-controlled study of tamsulosin in benign prostatic hyperplasia. Tamsulosin Investigator Group. Urology 1998; 51(6): 892–900.
- Chapple CR, Al-Shukri SH, Gattegno B et al. Tamsulosin oral controlled absorption system (OCAS) in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia (LUTS/BPH): Efficacy and tolerability in a placebo and active comparator controlled phase 3a study. Eur Urol Suppl 2005; 4 : 33–44.
- Wilt TJ, Mac Donold R, Rutks I. Tamsulosin for benign prostatic hyperplasia. Cochrane Database Syst Rev 2003; (1): CD002081.
- Brawer MK, Adams G, Epstein H. Terazosin in the treatment of benign prostatic hyperplasia. Terazosin Benign Prostatic Hyperplasia Study Group. Arch Fam Med 1993; 2(9): 929–935.
- Roehrborn CG, Oesterling JE, Auerbach S et al. The Hytrin Community Assessment Trial study: a one-year study of terazosin versus placebo in the treatment of men with symptomatic benign prostatic hyperplasia. HYCAT Investigator Group. Urology 1996; 47(2): 159–168.
- Wilt TJ, Howe RW, Rutks I et al. Terazosin for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002;(4):CD003851.
4.2 Inhibitory 5-alfa-reduktázy
4.2.1 Mechanizmus účinku
Mediátorem androgenních účinků na prostatu je dihydrotestosteron (DHT), který vzniká ve stromálních buňkách prostaty konverzí testosteronu pomocí steroidní 5-alfa-reduktázy, enzymu vázaného v buněčném jádře [1]. Existují dvě izoformy tohoto enzymu:
- 5-alfa-reduktáza typu 1 s menší expresí a aktivitou v prostatě, ale predominantní aktivitou v extraprostatických tkáních, jako jsou kůže a játra
- 5-alfa-reduktáza typu 2 s predominantní expresí a aktivitou v prostatě
Finasterid inhibuje pouze 5-alfa-reduktázu typu 2, zatímco dutasterid inhibuje 5-alfa-reduktázu typu 1 a typu 2 s obdobnou potencí (duální inhibitor 5-alfa-reduktázy). Klinický význam duální inhibice však zůstává nejasný. Inhibitory 5-alfa-reduktázy indukují apoptózu epiteliálních buněk prostaty [2], čímž dochází k redukci velikosti prostaty o přibližně 18–28 % a ke snížení hladiny cirkulujícího PSA o přibližně 50 % po 6–12 měsících léčby [3]. Průměrné snížení objemu prostaty může být při dlouhodobé léčbě i výraznější.
4.2.2 Dostupná léčiva
Pro klinické využití jsou dostupné dva inhibitory 5-alfa-reduktázy: dutasterid a finasterid (tab. 4). Poločas rozpadu je delší u dutasteridu (3–5 týdnů). Oba inhibitory 5-alfa-reduktázy jsou metabolizovány v játrech a vylučovány stolicí. Dlouhodobá léčba snižuje koncentraci DHT v séru přibližně o 70 % v případě finasteridu a o 95 % v případě dutasteridu. Koncentraci DHT v prostatě však snižují oba inhibitory 5-alfa-reduktázy obdobnou měrou (85–90 %).
Tab. 3. Inhibitory 5-alfa-reduktázy schválené v Evropě pro léčbu benigního zvětšení prostaty (BPE) na podkladě benigní prostatické hyperplazie (BPH); klíčové farmakokinetické vlastnosti a standardní dávkování. 
tmax = doba do dosažení maximální koncentrace v plazmě; t1/2 = poločas rozpadu. 4.2.3 Účinnost
Klinický efekt v porovnání s placebem je pozorován při trvání léčby minimálně 6–12 měsíců. Po 2–4 letech léčby inhibitory 5-alfa-reduktázy zmírňují symptomy LUTS (IPSS) o přibližně 15–30 %, zmenšují objem prostaty o přibližně 18–28 % a zvyšují hodnotu Qmax zjišťovanou metodou volné uroflowmetrie o přibližně 1,5–2,0 ml/s u pacientů se symptomy LUTS v důsledku zvětšení prostaty (tab. 5) [4–13].
Tab. 4. Randomizované studie s inhibitory 5-alfa-reduktázy u mužů se symptomy LUTS a benigním zvětšením prostaty v důsledku BPH. 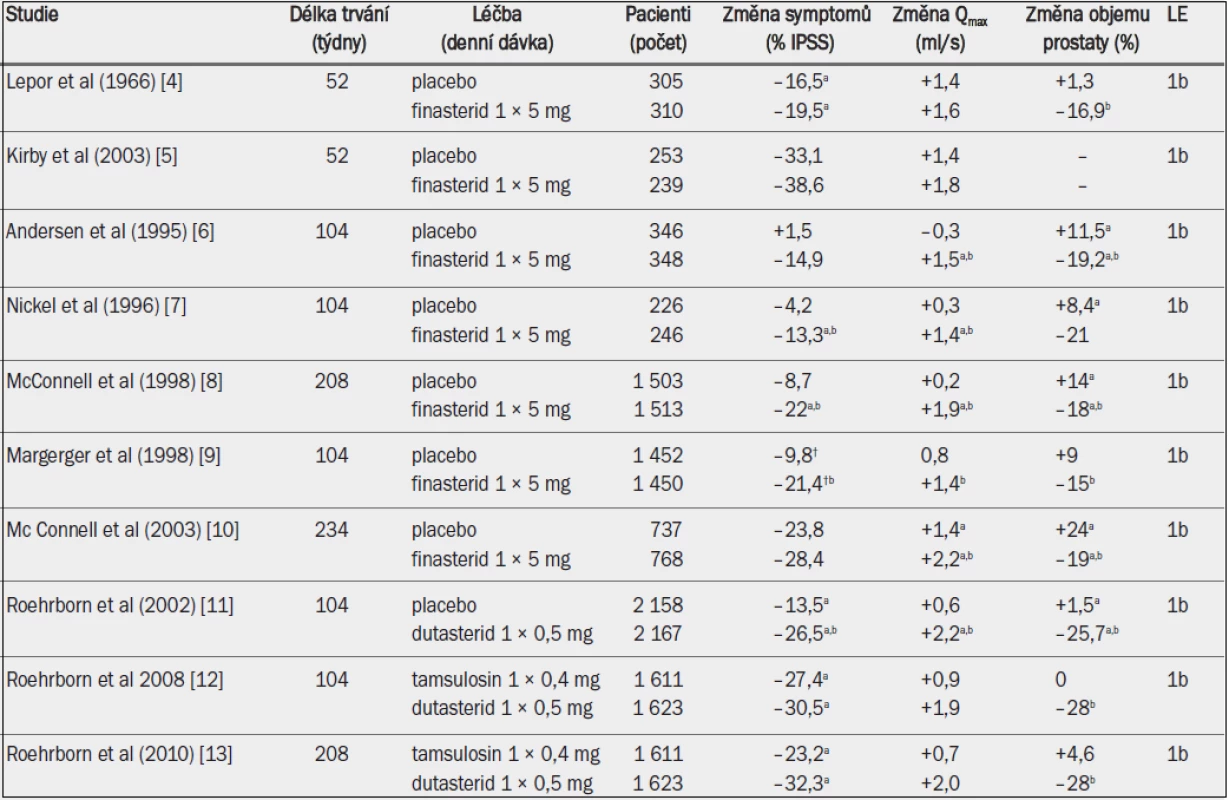
Qmax = maximální rychlost průtoku moči (volná uroflowmetrie); IPSS = mezinárodní skóre prostatických symptomů; † = Boyarsky skóre; a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významná v porovnání s placebem / aktivní kontrolou. Zmírnění symptomů při léčbě finasteridem závisí na počáteční velikosti prostaty. U pacientů s prostatou menší než 40 ml nemusí být finasterid účinnější než placebo [14]. Dutasterid podle všeho snižuje IPSS, zmenšuje objem prostaty a snižuje riziko akutní retence moči. Zvyšuje také Qmax, dokonce i u pacientů s výchozím obje-mem prostaty v rozmezí 30–40 ml [15,16]. Nepřímé srovnání mezi jednotlivými studiemi a jedna nezveřejněná přímá srovnávací studie ukazují, že dutasterid a finasterid mají při léčbě symptomů LUTS rovnocennou účinnost [3]. Srovnávací studie s alfa-1 blokátory prokázaly, že inhibitory 5-alfa-reduktázy zmírňují symptomy pomaleji a v případě finasteridu s menší účinností [5,10,17,18]. Dlouhodobá studie testující účinnost dutasteridu u symptomatických mužů s objemem prostaty větším než 30 ml (průměrný objem prostaty ve studii CombAT činil přibližně 55 ml) ukázala, že inhibitor 5-alfa-reduktázy zmírňuje symptomy LUTS u těchto pacientů alespoň stejně účinně, nebo dokonce účinněji než tamsulosin [11,12]. Čím větší je výchozí objem prostaty (koncentrace PSA v séru), tím rychlejší a výraznější je efekt dutasteridu na zmírnění symptomů [19]. Snížení IPSS bylo daleko významnější u mužů s objemem prostaty 58 ml nebo větším (PSA > 4,4) v porovnání s muži s menším výchozím objemem prostaty (koncentrace PSA) po 15 a více měsících léčby.
Inhibitory 5-alfa-reduktázy, nikoli však alfa-1 blokátory, snižují dlouhodobé (> 1 rok) riziko akutní retence moči nebo nutnost operace [8,10,19,20]. Prevence progrese onemocnění pomocí inhibitorů 5-alfa--reduktázy je již znatelná u prostat o velikosti výrazně menší než 40 ml [12,13,20]. Přesný mechanizmus účinku inhibitorů 5-alfa-reduktázy při omezování progrese onemocnění bude muset být teprve stanoven, ale s nejvyšší pravděpodobností jej lze přisuzovat snižování rezistence výtoku z močového měchýře. Otevřené studie prokázaly při opakovaném vyhodnocení urodynamického vyšetření významné zlepšení mikčních parametrů u mužů, kteří byli léčeni alespoň tři roky finasteridem [21,22].
4.2.4 Snášenlivost a bezpečnost
Nejvýznamnější nežádoucí účinky inhibitorů 5-alfa-reduktázy souvisejí se sexuální funkcí a patří mezi ně snížené libido, erektilní dysfunkce a méně často poruchy ejakulace, jako jsou retrográdní ejakulace, selhání ejakulace nebo snížený objem ejakulátu [3,10,13]. Incidence sexuální dysfunkce a jiných nežádoucích příhod je malá a s přibývající dobou léčby se ještě snižuje. Gynekomastie (zvětšení prsní žlázy s citlivostí prsní žlázy nebo bradavky) se rozvine u přibližně 1–2 % pacientů.
4.2.5 Praktické úvahy
Léčba inhibitory 5-alfa-reduktázy by měla být uvažována pouze u mužů se středně závažnými až závažnými symptomy LUTS a zvětšenou prostatou (> 40 ml) nebo zvýšenými koncentracemi PSA (> 1,4–1,6 µg/l). Z důvodu pomalého nástupu účinku jsou inhibitory 5-alfa-reduktázy vhodné pouze pro dlouhodobou léčbu (v řádu mnoha let). Pro screening karcinomu prostaty je třeba zohlednit jejich účinek na koncentraci PSA v séru. Je zajímavé, že inhibitory 5-alfa--reduktázy (finasterid) by mohly snižovat krevní ztráty během transuretrální operace prostaty, pravděpodobně díky svým účinkům na vaskularizaci prostaty [23].
4.2.6 Doporučení
Inhibitory 5-alfa-reduktázy by měly být nabízeny mužům, kteří mají středně závažné až závažné symptomy dolních cest močových a zvětšenou prostatu (> 40 ml) nebo zvýšené koncentrace prostatického specifického antigenu (> 1,4–1,6–µg/l). Inhibitory 5-alfa-reduktázy mohou zabraňovat progresi onemocnění, pokud jde o akutní močovou retenci a nutnost operace (úroveň důkazu / stupeň doporučení: 1b/A).
4.2.7 Literatura
- Andriole G, Bruchovsky N, Chung LW et al. Dihydrotestosterone and the prostate: the scientific rationale for 5a-reductase inhibitors in the treatment of benign prostatic hyperplasia. J Urol 2004; 172 (4 Pt 1): 1399–1403.
- Rittmaster RS, Norman RW, Thomas LN et al. Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab 1996; 81(2): 814–819.
- Naslund MJ, Miner M. A review of the clinical efficacy and safety of 5a-reductase inhibitors for the enlarged prostate. Clin Ther 2007; 29(1): 17–25.
- Lepor H, Williford WO, Barry MJ et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. N Engl J Med 1996; 335(8): 533–539.
- Kirby R, Roehrborn CG, Boyle P et al. Prospective European Doxazosin and Combination Therapy Study Investigators. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: the Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology 2003; 61(1): 119–126.
- Andersen JT, Ekman P, Wolf H et al. Can finasteride reverse the progress of benign prostatic hyperplasia? A two-year placebo-controlled study. The Scandinavian BPH Study Group. Urology 1995; 46(5): 631–637.
- Nickel JC, Fradet Y, Boake RC et al. Efficacy and safety of finasteride therapy for benign prostatic hyperplasia: results of a 2-year randomised controlled trial (the PROSPECT study). PROscar Safety Plus Efficacy Canadian Two year Study. CMAJ 1996; 155(9): 1251–1259.
- McConnell JD, Bruskewitz R, Walsh P et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med 1998; 338(9): 557–563.
- Marberger MJ, on behalf of the PROWESS Study Group. Long-term effects of finasteride in patients with benign prostatic hyperplasia: a double-blind, placebo--controlled, multicenter study. Urology 1998; 51(5): 677–686.
- McConnell JD, Roehrborn CG, Bautista O et al; Medical Therapy of Prostatic Symptoms (MTOPS) Research Group. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
- Roehrborn CG, Boyle P, Nickel JC et al; ARIA3001 ARIA3002 and ARIA3003 Study Investigators. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002; 60(3): 434–441.
- Roehrborn CG, Siami P, Barkin J et al; CombAT Study Group. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the CombAT study. J Urol 2008; 179(2): 616–621.
- Roehrborn CG, Siami P, Barkin J et al; CombAT Study Group. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombATstudy. Eur Urol 2010; 57(1): 123–131.
- Boyle P, Gould AL, Roehrborn CG. Prostate volume predicts outcome of treatment of benign prostatic hyperplasia with finasteride: meta-analysis of randomised clinical trials. Urology 1996; 48(3): 398–405.
- Roehrborn CG, Lukkarinen O, Mark S et al. Long-term sustained improvement in symptoms of benign protatic hyperplasia with the dual 5a-reductase inhibitor dutasteride: results of 4-year studies. BJU Int 2005; 96(4): 572–577.
- Gittelman M, Ramsdell J, Young J et al. Dutasteride improves objective and subjective disease measures in men with benign prostatic hyperplasia and modest or severe prostateenlargement. J Urol 2006; 176(3): 1045–1050.
- Lepor H, Williford WO, Barry MJ et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. N Engl J Med 1996; 335(8): 533–539.
- Debruyne FM, Jardin A, Colloi D et al; on behalf of the European ALFIN Study Group. Sustainedrelease alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. Eur Urol 1998; 34(3): 169–175.
- Roehrborn CG, Siami P, Barkin J et al; CombAT Study Group. The influence of baseline parameters on changes in International Prostate Symptom Score with dutasteride, tamsulosin, and combination therapy among men with symptomatic benign prostatic hyperplasia and enlarged prostate: 2-year data from the CombAT Study. Eur Urol 2009; 55(2): 461–471.
- Roehrborn CG. BPH progression: concept and key learning from MTOPS, ALTESS, COMBAT, and ALF-ONE. BJU Int 2008; 101 (Suppl 3): 17-21.
- Kirby RS, Vale J, Bryan J et al. Long-term urodynamic effects of finasteride in benign prostatic hyperplasia: a pilot study. Eur Urol 1993; 24(1): 20–26.
- Tammela TLJ, Kontturi MJ. Long-term effects of finasteride on invasive urodynamics and symptoms in the treatment of patients with bladder outflow obstruction due to benign prostatic hyperplasia. J Urol 1995; 154(4): 1466–1469.
- Donohue JF, Sharma H, Abraham R et al. Transurethral prostate resection and bleeding: a randomised, placebo controlled trial of the role of finasteride for decreasing operative blood loss. J Urol 2002; 168(5): 2024–2026.
4.3 Antagonisté muskarinových receptorů
4.3.1 Mechanizmus účinku
Predominantním neurotransmiterem močového měchýře je acetylcholin, který je schopen stimulovat muskarinové receptory (m-cholinergní receptory) na povrchu buněk hladkého svalstva detruzoru. Mus-karinové receptory jsou však exprimovány ve velkém množství nejen na buňkách hladkého svalstva, ale také na jiných typech buněk, například na epiteliálních buňkách slinných žláz, uroteliálních buňkách močového měchýře nebo nervových buňkách periferního nebo centrálního nervového systému. U lidí je popsáno pět subtypů muskarinových receptorů (M1–M5), přičemž subtypy M2 a M3 jsou převážně přítomny v detruzoru. Ačkoli přibližně 80 % těchto muskarinových receptorů tvoří subtyp M2 a 20 % subtyp M3, je u zdravého člověka do kontrakcí močového měchýře zřejmě zapojen pouze subtyp M3 [1,2]. Úloha subtypu M2 zůstává nejasná. Avšak u mužů s neurogenní dysfunkcí močového měchýře a na experimentálním zvířecím modelu s neurogenním močovým měchýřem nebo obstrukcí výtoku z močového měchýře jsou do kontrakcí hladkého svalstva zřejmě zapojeny i receptory M2 [3].
Detruzor je inervován parasympatickými nervy, které mají původ v laterálních provazcích sakrální míchy na úrovni S2–S4, která je sama o sobě modulována supraspinálními mikčními centry. Sakrální mikční centrum je spojeno s močovým měchýřem pánevními nervy, které uvolňují acetylcholin po depolarizaci. Acetylcholin stimuluje postsynaptické muskarinové receptory, což vede k uvolňování vápníku v sarkoplazmatickém retikulu prostřednictvím G proteinu a otevření vápníkových kanálů buněčné membrány a konečně ke kontrakci hladkého svalstva. Inhibice muskarinových receptorů antagonisty muskarinových receptorů snižuje jejich stimulaci, a tím i kontrakce buněk hladkého svalstva močového měchýře. Antimuskarinové účinky může indukovat nebo modulovat také urotel močového měchýře a/nebo centrální nervový systém [4,5].
4.3.2 Dostupná léčiva
Následující antagonisté muskarinových receptorů jsou schváleny pro léčbu symptomů hyperaktivního močového měchýře/ /jímacích symptomů u mužů a žen (tab. 6):
- darifenacin-hydrobromid (darifenacin)
- fesoterodin-fumarát (fesoterodin)
- oxybutynin HCL (oxybutynin)
- propiverin HCL (propiverin)
- solifenacin sukcinát (solifenacin)
- tolterodin tartrát (tolterodin)
- trospium chlorid
Tab. 5. Antimuskarinika schválená v Evropě pro léčbu symptomů hyperaktivního močového měchýře / jímacích symptomů; klíčové farmakokinetické vlastnosti a standardní dávkování. 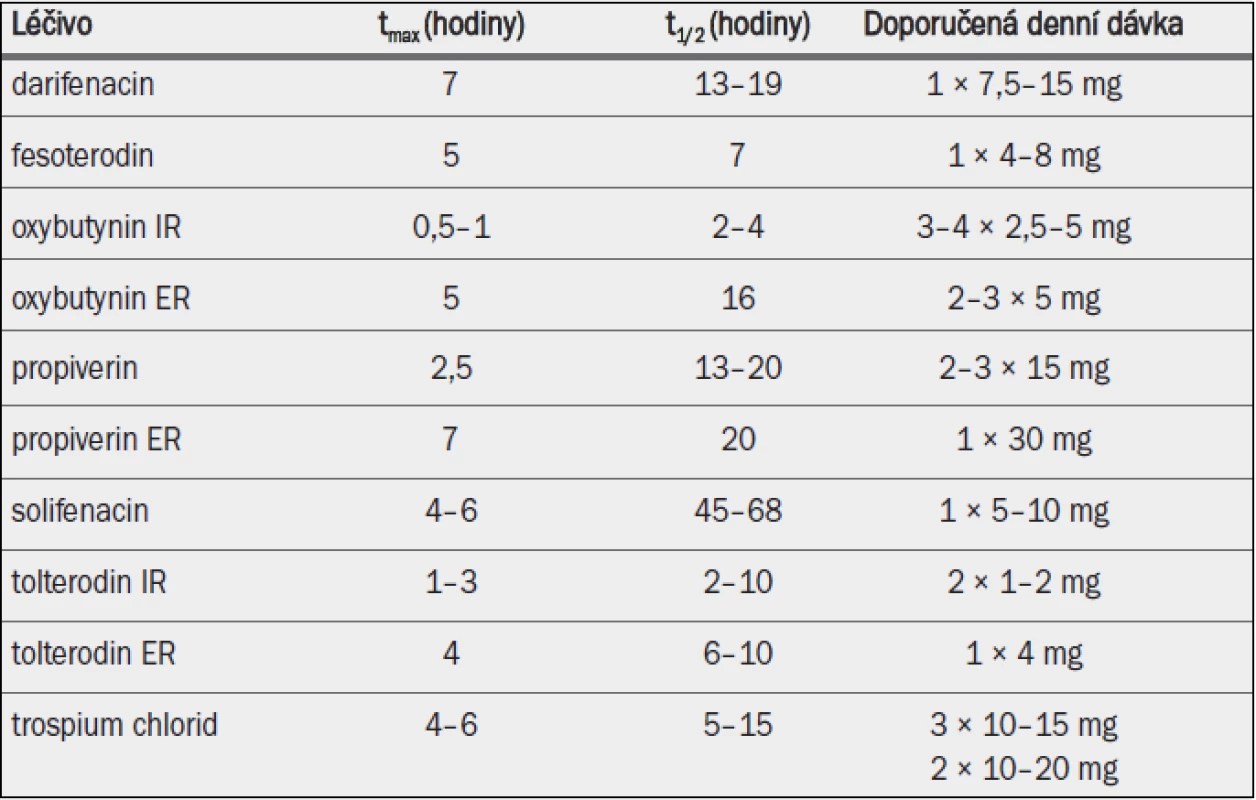
IR = s okamžitým uvolňováním; ER = s prodlouženým uvolňováním; tmax = doba do dosažení maximální koncentrace v plazmě; t1/2 = poločas rozpadu. *Orální biodostupnost mateřské sloučeniny zvýšena o přibližně 50 %, zatímco orální biodostupnost účinného metabolitu snížena o přibližně 30 %; † absolutní biodostupnost závislá na genotypu pro CPY 2D6 v rozmezí od 17 % u extenzivních metabolizérů do 65 % u slabých metabolizérů.
Tato třída léčiv je stále oficiálně kontraindikována u mužů s BPH/BOO z důvodu možného neúplného vyprazdňování močového měchýře nebo rozvoje retence moči.
4.3.3 Účinnost
Antagonisté muskarinových receptorů byly v minulosti testovány převážně na ženách, neboť panoval názor, že u žen jsou symptomy LUTS způsobovány močovým měchýřem, a proto musí být léčeny preparáty specifickými pro močový měchýř. Naproti tomu se mělo za to, že u mužů jsou symptomy LUTS způsobovány prostatou a je třeba je léčit preparáty specifickými pro prostatu. Tento předpoklad však není podložen žádnými vědeckými údaji [6]. Subanalýza otevřené studie, do které bylo zařazeno 2 250 mužů a žen se symptomy hyperaktivního močového měchýře léčených tolterodinem, ukázala, že významný dopad na urgenci, frekvenci močení nebo urgentní inkontinenci má věk, nikoli však pohlaví [7].
Účinnost anticholinergika tolterodinu a později také fesoterodinu byla testována v rámci monoterapie u dospělých mužů s jímacími symptomy (symptomy hyperaktivního močového měchýře), avšak bez obstrukce výtoku z močového měchýře (tab. 7). Maximální doba trvání studie činila 25 týdnů, většina studií však trvala pouze 12 týdnů. V otevřených studiích s tolterodinem byly frekvence močení přes den, nykturie, urgentní inkontinence a IPSS v porovnání s výchozími hodnotami všechny výrazně nižší po 12–25 týdnech [8,9]. V otevřené studii s pacienty, kteří neodpovídali na léčbu alfa-1 blokátory, se všechny položky IPSS během léčby tolterodinem zlepšily bez ohledu na jímací nebo mikční symptomy [8]. Randomizované, placebem kontrolované studie prokázaly, že tolterodin může v porovnání s placebem významně snížit urgentní inkontinenci a frekvenci močení přes den nebo močení přes den i v noci. Bylo rovněž prokázáno, že tolterodin významně omezuje močení spojené s urgencí [10–12]. Ačkoli u většiny pacientů došlo ke zmírnění nykturie, urgence nebo IPSS, tyto parametry ve většině studií nedosáhly statistické významnosti. Pokud by se však výsledek léčby stratifikoval na základě koncentrace PSA (objem prostaty), tolterodin významně snižoval frekvenci močení přes den, frekvenci močení přes den i v noci a jímací symptomy podle IPSS u mužů s koncentrací PSA nižší než 1,3 ng/ml, na rozdíl od mužů s koncentrací PSA 1,3 ng/ml nebo vyšší, což ukazuje, že z léčby antimuskariniky mohou více profitovat muži s menší prostatou [13].
Tab. 6. Studie testující účinnost antimuskarinik zahrnující pouze starší muže se symptomy LUTS, převážně se symptomy hyperaktivního močového měchýře (studie v chronologickém pořadí). 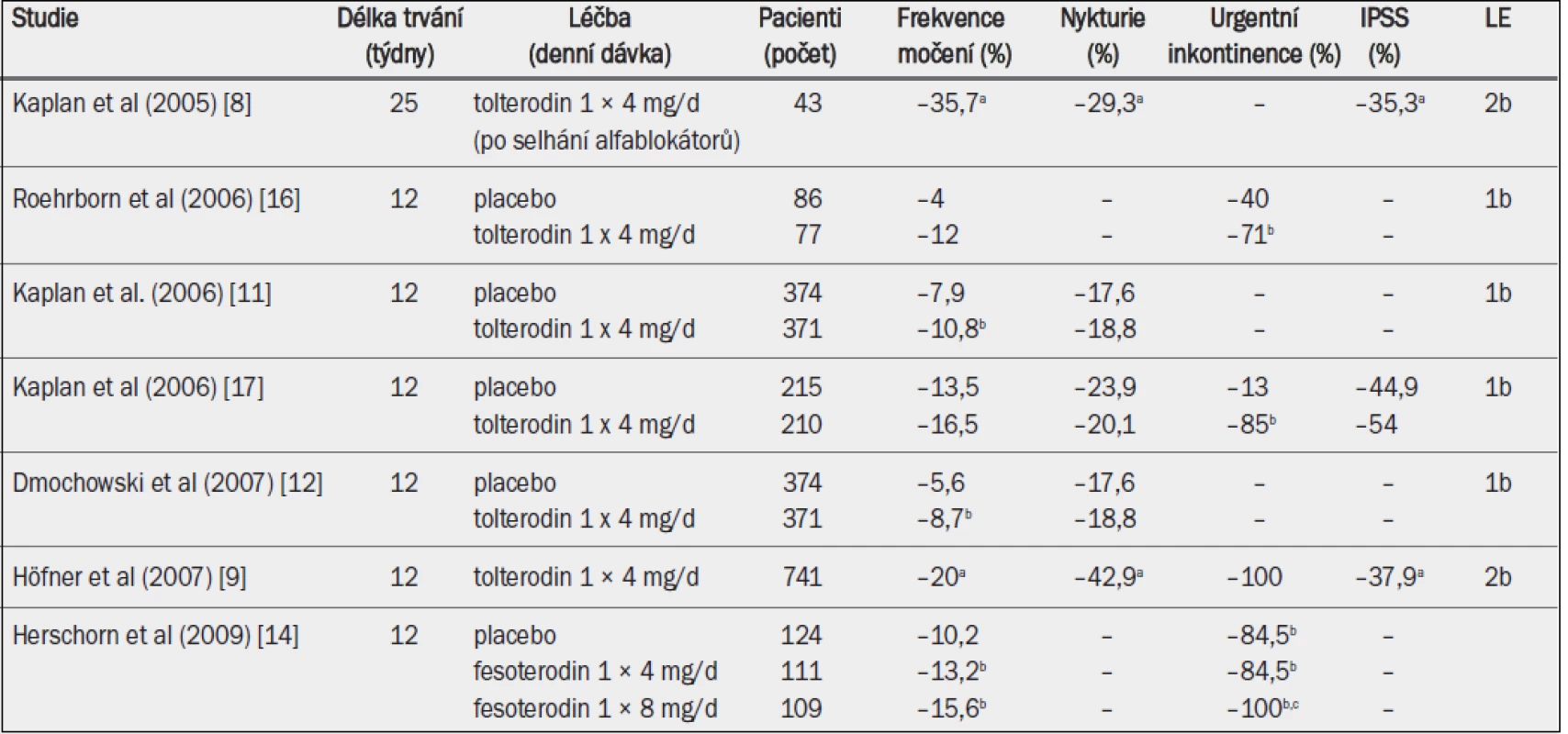
IPSS = mezinárodní skóre prostatických symptomů; a = významná v porovnání s výchozím stavem (p < 0,01; jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významná v porovnání s placebem (p < 0,05); c = významná v porovnání s fesoterodinem 4 mg (p < 0,05).
4.3.4 Snášenlivost a bezpečnost
Antagonisté muskarinových receptorů jsou obecně dobře snášeni a jejich podíl na subjektech vyřazených ze studie činí přibližně 3–10 %, což ve většině studií v porovnání s placebem nepředstavovalo významný rozdíl. V porovnání s placebem se častěji vyskytují nežádoucí účinky spojené s léčivými přípravky, jako je sucho v ústech (až 16 %), zácpa (až 4 %), mikční obtíže (až 2 %), nazofaryngitida (až 3 %) a závratě (až 5 %).
Zvýšení objemu postmikčního rezidua u mužů bez obstrukce výtoku z močového měchýře je minimální a v porovnání s placebem se významně neliší (0–5 ml vs –3,6–0 ml). Nicméně léčba fesoterodinem 8 mg vykazovala vyšší objem postmikčního rezidua (+20,2 ml) v porovnání s placebem (–0,6 ml) nebo fesoterodinem 4 mg (+9,6 ml) [14]. Výskyt retence moči u mužů bez obstrukce výtoku z močového měchýře byl ve studiích s tolterodinem srovnatelný s placebem (0–1,3 vs 0–1,4 %). U 5,3 % mužů léčených fesoterodinem 8 mg se objevily symptomy ukazující na retenci moči, což bylo více v porovnání s placebem nebo fesoterodinem 4 mg (0,8 % v obou případech). Tyto symptomy se objevily během prvních dvou týdnů léčby a postihovaly muže ve věku 66 let nebo starší.
U mužů s obstrukcí výtoku z močového měchýře se antimuskarinika nedoporu-čují z důvodu teoretického oslabení močového měchýře, které může být spojeno s postmikčním reziduem nebo retencí moči. Placebem kontrolovaná studie v délce 12 týdnů zaměřená na muže, kteří trpěli mírnou až středně závažnou obstrukcí výtoku z močového měchýře (medián indexu obstrukce výtoku z močového měchýře, BOOI, v placebo skupině 43 cm H2O a ve skupině léčené tolterodinem 49 cm H2O), ukázala, že tolterodin významně zvyšuje objem postmikčního rezidua (49 vs 16 ml), ale není spojen se zvýšenou incidencí akutní retence moči (3 % v obou skupinách studie) [15]. Urodynamické účinky tolterodinu zahrnovaly signifikantně větší objemy močového měchýře do nástupu první kontrakce detruzoru, vyšší maximální cystometrickou kapacitu močového měchýře a snížený index kontraktility močového měchýře. Maximální rychlost průtoku moči zůstala stejná ve skupině léčené tolterodinem i v placebo skupině. Tato studie ukázala, že krátkodobá léčba antimuskariniky u mužů s ob-strukcí výtoku z močového měchýře je bezpečná.
4.3.5 Praktické úvahy
Ačkoli byly studie u starších mužů se symptomy LUTS a symptomy hyperaktivního močového měchýře provedeny výlučně s tolterodinem nebo fesoterodinem, je pravděpodobné, že obdobná účinnost a nežádoucí účinky se objeví také u ostatních antimuskarinik. Dlouhodobé studie účinnosti antagonistů muskarinových receptorů u mužů se symptomy LUTS stále chybí, a proto by tato léčiva měla být předepisována velmi opatrně. Zároveň se doporučuje pravidelné přehodnocování IPSS a postmikčního rezidua.
4.3.6 Doporučení
Aplikaci antagonistů muskarinových receptorů lze zvážit u mužů se středně závažnými až závažnými symptomy dolních cest močových, kteří vykazují převážně jímací symptomy (úroveň důkazu / stupeň doporučení: 1b/B).
U mužů s obstrukcí výtoku z močového měchýře se doporučuje postupovat s opatrností (úroveň důkazu / stupeň doporučení: 4/C).
4.3.7 Literatura
- Chess-Williams R, Chapple CR, Yamanishi T et al. The minor population of M3-receptors mediate contraction of human detrusor muscle in vitro. J Auton Pharmacol 2001; 21(5–6): 243–248.
- Matsui M, Motomura D, Karasawa H et al. Multiple functional defects in peripherial autonomic organs in mice lacking muscarinic acetylcholine receptor gene for the M3 subtype. Proc Natl Acad Sci USA 2000; 97(17): 9579–9584.
- Braverman AS, Doumanian LR, Ruggieri MR Sr. M2 and M3 muscarinic receptor activation of urinary bladder contractile signal transduction. II. Denervated rat bladder. J Pharmacol Exp Ther 2006; 316(2): 875–880.
- Wuest M, Kaden S, Hakenberg OW et al. Effect of rilmakalim on detrusor contraction in the presence and absence of urothelium. Naunyn-Schiedeberg’s Arch Pharmacol 2005; 372(3): 203–212.
- Kono M, Nakamura Y, Ishiura Y et al. Central muscarinic receptor subtypes regulating voiding in rats. J Urol 2006; 175(1): 353–357.
- Chapple CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: focus on the bladder. Eur Urol 2006; 49(4): 651–658.
- Michel MC, Schneider T, Krege S et al. Does gender or age affect the efficacy and safety oftolterodine? J Urol 2002; 168(3): 1027–1031.
- Kaplan SA, Walmsley K, Te AE. Tolterodine extended release attenuates lower urinary tract symptoms in men with benign prostatic hyperplasia. J Urol 2005; 174(6): 2273–2275.
- Höfner K, Burkart M, Jacob G et al. Safety and efficacy of tolertodine extended release in men with-overactive bladder symptoms and presumed non-obstructive benign prostatic hyperplasia. World J Urol 2007; 25(6): 627–633.
- Kaplan SA, Roehrborn CG, Chancellor M et al. Extended-release tolterodine with or without tamsulosin in men with lower urinary tract symptoms and overactive bladder: effects on urinary symptoms assessed by the International Prostate Symptom Score. BJU Int 2008; 102(9): 1133–1139.
- Kaplan SA, Roehrborn CG, Dmochowski R et al. Tolterodine extended release improves overactive bladder symptoms in men with overactive bladder and nocturia. Urology 2006; 68(2): 328–332.
- Dmochowski R, Abrams P, Marschall-Kehrel D et al. Efficacy and tolerability of tolterodine extended release in male and female patients with overactive bladder. Eur Urol 2007; 51(4): 1054–1064.
- Roehrborn CG, Kaplan SA, Kraus SR et al. Effects of serum PSA on efficacy of tolterodine extended release with or without tamsulosin in men with LUTS, including OAB. Urology 2008; 72(5): 1061–1067.
- Herschorn S, Jones JS, Oelke M et al. Efficacy and tolerability of fesoterodine in men with overactive bladder: a pooled analysis of 2 phase III studies. Urology 2010; 75(5): 1149–1155.
- Abrams P, Kaplan S, De Koning Gans HJ et al. Safety and tolerability of tolterodine for the treatment of overactive bladder in men with bladder outlet obstruction. J Urol 2006; 175(5): 999–1004.
- Roehrborn CG, Abrams P, Rovner ES et al. Efficacy and tolerability of tolterodine extended-release in men with overactive bladder and urgency incontinence. BJU Int 2006; 97(5): 1003–1006.
- Kaplan SA, Roehrborn CG, Rovner ES et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder. JAMA 2006; 296(19): 2319–2328.
4.4 Rostlinné extrakty – fytoterapie
4.4.1 Mechanizmus účinku
Fytoterapie zahrnuje lékařské využití různých extraktů z nejrůznějších rostlin. Je však i nadále sporné, které složky extraktů způsobují úlevu od symptomů LUTS u mužů. Má se za to, že nejdůležitějšími sloučeninami jsou fytosteroly, betasitosteroly, mastné kyseliny a lektiny [1]. Studie in vitro ukázaly, že rostlinné extrakty:
- mají protizánětlivé, antiandrogenní nebo estrogenní účinky
- snižují hladinu globulinu vázajícího pohlavní hormony (SHBG)
- inhibují aromatázu, lipoxygenázu, proliferaci prostatických buněk stimulovanou růstovými faktory, alfaadrenergní receptory, 5-alfa-reduktázu, muskarinové cholinergní receptory, dihydropyridinové receptory nebo vaniloidní receptory
- zlepšují funkci detruzoru
- neutralizují volné radikály [1–3]
Většina účinků in vitro však nebyla potvrzena in vivo a přesné mechanizmy účinku rostlinných extraktů zůstávají nejasné.
4.4.2 Dostupná léčiva
Rostlinné léčivé přípravky se vyrábějí z kořenů, semen, pylu, kůry nebo plodů jedné rostliny (monopreparáty) nebo se do jedné tablety kombinují extrakty ze dvou nebo více rostlin (kombinované preparáty). Pro přípravu extraktů se používá řada různých rostlin. Mezi nejběžněji používané rostliny patří:
- Cucurbita pepo (semena dýně)
- Hypoxis rooperi (jihoafrická hvězdicová tráva)
- Pygeum africanum (kůra slivoně africké)
- Secale cereale (pyl žita setého)
- Serenoa repens (syn. Sabal serrulata; bobule americké trpasličí palmy, zvané též pilovitá palma)
- Urtica dioica (kořeny kopřivy dvoudomé)
Různí výrobci používají různé extrakční techniky, distribuují účinné látky různých kvalitativních a kvantitativních vlastností nebo kombinují dvě nebo více rostlinných sloučenin do jedné tablety. Extrakty z téže rostliny vyrobené různými společnostmi nemusí nezbytně mít tytéž biologické nebo klinické účinky, takže účinky jedné značky nelze vztahovat na účinky jiných [4]. Aby to bylo ještě složitější, dokonce dvě různé šarže téhož výrobce mohou obsahovat různé koncentrace účinných látek a mít různé biologické účinky [5]. Farmakokinetické vlastnosti různých rostlinných extraktů se tedy mohou významně lišit.
4.4.3 Účinnost
Každá třída rostlinných extraktů je z výše uvedených důvodů popisována zvlášť (tab. 8). Je-li to možné, je uveden název značky s cílem ukázat možné rozdíly mezi výrobky. Obecně se neukázalo, že by některé fytoterapeutické agens významně redukovalo velikost prostaty, a žádná ze studií neprokázala snížení obstrukce výtoku z močového měchýře nebo zpomalení progrese onemocnění.
Tab. 7. Studie testující rostlinné extrakty u pacientů s BPH-LUTS (výběr; v abecedním pořadí). 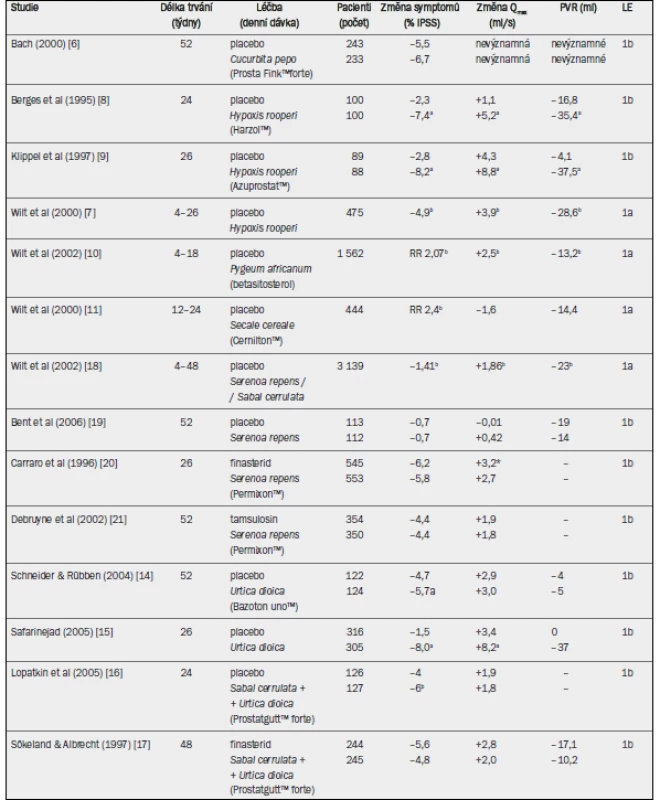
IPSS = mezinárodní skóre prostatických symptomů; Qmax = maximální rychlost průtoku moči (volná uroflowmetrie); PVR = postmikční reziduum; RR = relativní riziko; † absolutní hodnoty; a = významné snížení v porovnání s placebem / srovnávacím ramenem léčby (p < 0,05); b = ve prospěch rostlinného extraktu. - Cucurbita pepo: Pouze jedna studie hodnotila účinnost extraktů ze semen dýně (Prosta Fink™ forte) u pacientů s BPH-LUTS [6]. Do placebo skupiny a do skupiny, které byl podáván přípravek Prostat Fink™ forte, bylo randomizováno celkem 476 pacientů. Po 12 měsících sledování se IPSS a frekvence močení přes den významně snížily ve skupině, které byl podáván extrakt semen dýně. Uroflowmetrické parametry (Qmax), postmikční reziduum, objem prostaty, koncentrace PSA, nykturie nebo skóre kvality života (QoL) se však v uvedených dvou skupinách statisticky nelišily.
- Hypoxis rooperi: Tyto fytofarmakologické extrakty obsahují směs fytosterolů vázaných na glykosidy, z nichž nejdůležitější sloučeninou je betasitosterol (Harzol™, Azuprostat™). Byly zveřejněny čtyři randomizované, placebem kontrolované studie v délce trvání 4–26 týdnů, které jsou shrnuty v Cochranově zprávě [7]. Denní dávky rostlinných extraktů se pohybovaly v rozmezí 60–195 mg. Dvě studie hodnotily symptomy [8,9] a všechny čtyři studie zkoumaly Qmax a postmikční reziduum. Pomocí metaanalýzy byly vypočteny vážené průměrné rozdíly –4,9 bodů pro IPSS, +3,9 ml/s pro Qmax a –28,6 ml pro postmikční reziduum ve prospěch betasitosterolu. Velikost prostaty zůstala ve všech studiích nezměněná. Od zveřejnění Cochranovy zprávy v roce 2000 nebyly žádné další studie provedeny.
- Pygeum africanum: Cochranova zpráva zabývající se klinickými výsledky extraktů z Pygeum africanum (monopreparáty nebo kombinované preparáty) shrnula výsledky 18 randomizovaných, placebem kontrolovaných studií [10]. Ve většině studií byl použit extrakt z Pygeum africanum, Tadenan™. Metaanalýza zahrnovala 1 562 mužů, ale jednotlivé studie byly malé a trvaly pouze 30–122 dnů. Většina studií byla provedena v 70. a 80. letech 20. století a nebyly použity validované dotazníky jako například IPSS. Muži, kterým byl podáván extrakt z Pygeum africanum, uváděli zlepšení symptomů v porovnání s placebo skupinou s dvakrát vyšší pravděpodobností (relativní riziko (RR) 2,07). Vážený průměrný rozdíl Qmax činil +2,5 ml/s a postmikčního reziduálního objemu –13,2 ml ve prospěch extraktuz Pygeum africanum. Od zveřejnění Cochranovy zprávy v roce 2002 nebyly žádné další studie zveřejněny.
- Secale cereale: Cochranova zpráva se zabývala klinickými výsledky hlavního produktu extrahovaného ze Secale cereale, Cernilton™ a zahrnovala 444 mužů, kteří byli zařazeni do dvou placebem kontrolovaných studií a dvou srovnávacích studií (Tadenan™, Paraprost™) v délce trvání 12–24 týdnů [11]. Muži, kterým byl podáván přípravek Cernilton™, uváděli v porovnání s placebo skupinou dvakrát vyšší pravděpodobnost benefitu terapie (RR 2,4). Neexistovaly však žádné významné rozdíly mezi přípravkem Cernilton™ a placebem, pokud jde o Qmax, postmikční reziduum nebo objem prostaty. Od zveřejnění Cochranovy zprávy v roce 2000 nebyla zveřejněna žádná další placebem kontrolovaná studie s monopreparátem extrahovaným ze Secale cereale.
- Sabal serrulata / Serenoa repens: Nedávno aktualizovaná Cochranova zpráva shrnula klinické výsledky 30 randomizovaných studií zahrnujících 5 222 mužů [12]. Extrakt ze Serenoa repens (především Permixon™ nebo Prostaserene™) byl porovnáván jako monopreparát nebo jako kombinovaný preparát s placebem, jinými rostlinnými extrakty (Pygeum africanum, Utica dioica), inhibitorem 5-alfa-reduktázy finasterid nebo alfa-1 blokátorem tamsulosin. Průměrná doba sledování u těchto studií činila 4–60 týdnů. Cochranova zpráva dospěla k závěru, že Serenoa repens není lepší než placebo, finasterid nebo tamsulosin, pokud jde o zlepšení IPSS, Qmax nebo redukci velikosti prostaty. Obdobné úrovně zlepšení IPSS nebo Qmax ve studiích s finasteridem nebo tamsulosinem mohou být interpretovány jako terapeutická ekvivalence [13]. V případě nykturie byl extrakt ze Serenoa repens významně lepší než placebo (vážený průměrný rozdíl –0,78).
- Urtica diocia: Dvě studie zkoumaly účinnost monopreparátů extrahovaných z kopřivy dvoudomé v porovnání s placebem [14,15]. Jedna studie zkoumala 246 mužů s BPH-LUTS po dobu 52 týdnů [14]; v této fytoterapeutické skupině se významně snížilo pouze skóre IPSS (Bazoton™ uno), zatímco Qmax a postmikční reziduum se v jednotlivých skupinách na konci studie statisticky nelišily. Druhá studie zkoumala 620 pacientů s BPH-LUTS po dobu 26 týdnů [15]; skóre IPSS, Qmax a postmikční reziduum se v porovnání s placebem významně zlepšily.
- Kombinované přípravky: Byly provedeny studie zejména s kombinací extraktů ze Sabal serrulata a Utica dioica (PRO 160/120, Prostatgutt™ forte). Placebem kontrolovaná studie v délce 24 týdnů prokázala významné zlepšení skóre IPSS ve fytoterapeutické větvi (rozdíl skóre IPSS –2 body) [16]; snížení Qmax bylo u obou skupin obdobné. Otevřená nadstavbová studie v délce trvání 24 týdnů zahrnující tytéž pacienty, v níž byl všem pacientům podáván přípravek PRO 160/120, ukázala u obou skupin obdobná zlepšení IPSS v týdnu 48 (skóre IPSS –7 bodů). Druhá studie, v níž byli pacienti randomizováni k aplikaci PRO 160/120 a finasteridu, ukázala v obou skupinách obdobné výsledky pro IPSS i Qmax [17].
4.4.4 Snášenlivost a bezpečnost
Pokud jde o závažnost a četnost, jsou vedlejší účinky fytoterapie obvykle mírné a srovnatelné s placebem. S aplikací studovaných preparátů nebyly spojeny závažné nežádoucí účinky. Nejčastěji uváděnými vedlejšími účinky byly gastrointestinální potíže. V případě přípravků extrahovaných z Hypoxis rooperi se u 0,5 % pacientů objevila erektilní dysfunkce. Podíl na vyřazení subjektů ze studie byl téměř stejný u placebo skupiny i u skupiny, která byla podrobena fytoterapii.
4.4.5 Praktické úvahy
Fytoterapeutická agens jsou heterogenní skupinou rostlinných extraktů používaných ke zlepšení BPH-LUTS. Použití fytoterapie zůstává problematické z důvodu různých koncentrací účinných látek produktech různých značek obsahujících stejná fytoterapeutická agens. Metaanalýzy extraktů téže rostliny se zdají být nepodložené a výsledky těchto analýz musí být interpretovány s opatrností.
4.4.6 Doporučení
Členové komise pro tvorbu guidelines nejsou schopni poskytnout konkrétní doporučení týkající se fytoterapie při léčbě symptomů dolních cest močových u mužů z důvodu různorodosti výrobků a metodologických problémů spojených s metaanalýzami.
4.4.7 Literatura
- Madersbacher S, Berger I, Ponholzer A et al. Plant extracts: sense or nonsense? Current Opin Urol 2008; 18(1): 16–20.
- Levin RM, Das AK. A scientific basis for the therapeutic effects of Pygeum africanum and Serenoa repens. Urol Res 2000; 28(3): 201–209.
- Buck AC. Is there a scientific basis for the therapeutic effects of serenoa repens in benign prostatic hyperplasia? Mechanisms of action. J Urol 2004; 172 (5 Pt 1): 1792–1799.
- Habib FK, Wyllie MG. Not all brands are created equal: a comparison of selected compounds of different brands of Serenoa repens extract. Prostate Cancer Prostatic Dis 2004; 7 : 195–200.
- Scaglione F, Lucini V, Pannacci M et al. Comparison of the potency of different brands of Sereonoa repens extract on 5alpha-reductase types I and II in prostatic co-cultured epithelial and fibroblast cells. Pharmacology 2008; 82(4): 270–275.
- Bach D. Placebokontrollierte Langzeittherapiestudie mit Kürbissamenextrakt bei BPH-bedingten Miktionsbeschwerden. Urologe B 2000; 40 : 437–443.
- Wilt T, Ishani A, Mac Donald R et al. Beta-sitosterols for benign prostatic hyperplasia. Cochrane Database of Syst Rev 2000; (2): CD001043.
- Berges RR, Windeler J, Trampisch HJ et al. Randomised, placebo-controlled, double-blind clinical trial of beta-sitosterol in patients with benign prostatic hyperplasia. Beta-sitosterol study group. Lancet 1995; 345(8964): 1529–1532.
- Klippel KF, Hiltl DM, Schipp B. A multicentric, placebo--controlled, double-blind clinical trial of betasitosterol (phytosterol) for the treatment of benign prostatic hyperplasia. Br J Urol 1997; 80(3): 427–432.
- Wilt T, Ishani A, Mac Donald R et al. Pygeum africanum for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; (1): CD001044.
- Wilt T, Mac Donald R, Ishani A et al. Cernilton for benign prostatic hyperplasia. Cochrane Database Syst Rev 2000; (2): CD001042.
- Tacklind J, Mac Donald R, Rutks I et al. Serenoa repens for benign prostatic hyperplasia. Cochrane Database Syst Rev 2009; (2): CD001423.
- Wilt T, MacDonold R, Rutks I. Tamsulosin for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; (4): CD002081.
- Schneider T, Rübben H. Bennesseltrockenextrakt (Bazoton®-uno) in der Langzeittherapie des benignen Prostatasyndroms (BPS). Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Multicenterstudie über 12 Monate. Urologe A 2004; 43(3): 302–306.
- Safarinejad MR. Urtica dioica for treatment of benign prostatic hyperplasia: a prospective, randomised, double-blind, placebo-controlled, crossover study. J Herb Pharmacother 2005; 5(4): 1–11.
- Lopatkin N, Sivkov A, Walther C et al. Long-term efficacy and safety of a combination of sabal and urtica extract for lower urinary tract symptoms – a placebo-controlled, double-blind, multicenter trial. World J Urol 2005; 23(2): 139–146.
- Sökeland J, Albrecht J. Kombination aus Saba-lund Urticaextrakt vs. Finasterid bei BPH (Stad. I bis II nach Alken). Urologe A 1997; 36(4): 327–333.
- Wilt T, Ishani A, Mac Donald R. Serenoa repens for benign prostatic hyperplasia. Cochrane Database of Syst Rev 2002; (3): CD001423.
- Bent S, Kane C, Shinohara K et al. Saw palmetto for benign prostatic hyperplasia. N Engl J Med 2006; 354(6): 557–566.
- Carraro JC, Raynaud JP, Koch G et al. Comparison of phytotherapy (Permixon®) with finasteride in the treatment of benign prostate hyperplasia: A randomised international study of 1,098 patients. Prostate 1996; 29(4): 231–240.
- Debruyne F, Koch G, Boyle P et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha--blocker (Tamsulosin) in the treatment of benign prostatic hyperplasia: A 1-year randomised international study. Eur Urol 2002; 41(5): 497–506.
4.5 Analog vazopresinu – desmopresin
4.5.1 Mechanizmus účinku
Antidiuretický hormon arginin vazopresin (AVP) hraje klíčovou úlohu v homeostáze tělesné vody a při kontrole produkce moči tím, že se váže na receptor V2 ve sběrných kanálcích ledvin. Hormon AVP zvyšuje zpětné vstřebávání vody a rovněž osmolalitu moči a snižuje vylučování vody i celkový objem moči. Hormon AVP by mohl být terapeuticky využíván k úpravě množství vylučované moči, avšak díky vazbě na receptor V1 má hormon AVP také vazokonstriktivní/hypertenzní účinky a dále pak velmi krátký poločas rozpadu v séru, a proto je nevhodný pro léčbu nykturie/ /noční polyurie.
4.5.2 Dostupná léčiva
Desmopresin acetát (desmopresin) je syntetický analog hormonu AVP s vysokou afinitou k receptoru V2 a antidiuretickými vlastnostmi. Je to jediné registrované léčivo pro antidiuretickou léčbu (tab. 9). Na rozdíl od AVP nevykazuje desmopresin žádnou významnou afinitu k receptoru V1 a nemá hypertenzní účinky. Desmopresin lze podávat ve formě intravenózní infuze, nosního spreje, tablet nebo perorálního lyofilizátu (MELT). Nazálně nebo perorálně podávaný desmopresin se rychle vstřebává a 55 % desmopresinu ledviny později vyloučí v nezměněné podobě [1]. Desmopresin se používá více než 30 let v léčbě diabetes insipidus nebo primární noční enurézy a nedávno byl schválen ve většině evropských zemí pro léčbu nykturie/ /polyurie u dospělých mužů a žen. Pokud se desmopresin podá před spaním, vylučování moči během noci se omezí, čímž se odloží nucení na močení a sníží počet příhod nočního močení [2,3]. Klinický efekt – pokud jde o snížení objemu moči a zvýšení osmolality moči – trvá po dobu přibližně 8–12 hodin [2].
Tab. 8. Antidiuretika povolená v Evropě pro léčbu nykturie způsobené noční polyurií; klíčové farmakokinetické vlastnosti a standardní dávkování. 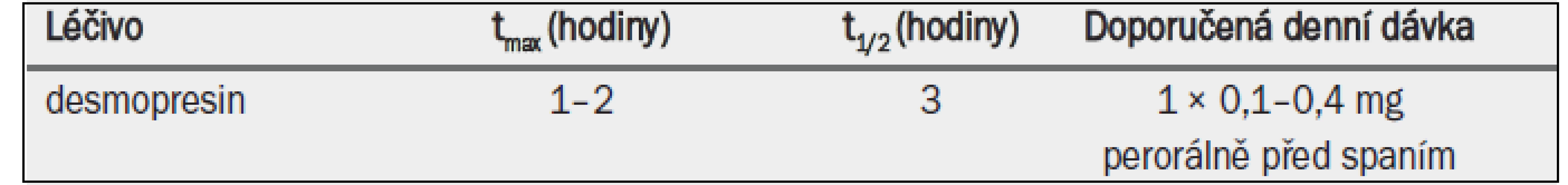
tmax = doba do dosažení maximální koncentrace v plazmě; t1/2 = poločas rozpadu.
4.5.3 Účinnost
Ve většině klinických studií byl desmopresin podáván perorálně. Studie, jejímž cílem bylo stanovit dávkování, ukázala, že perorální desmopresin podávaný v dávce 0,2 mg snižuje noční objem moči / noční diurézu výrazněji než desmopresin podávaný v dávce 0,1 mg; tato studie však také ukázala, že jednorázové podání dávky 0,4 mg před spaním nemá v porovnání s dávkou 0,2 mg na noční diurézu žádné další účinky [4]. V klíčových klinických studiích bylo léčivo titrováno v množství 0,1–0,4 mg podle individuální klinické reakce. Desmopresin významně snížil noční diurézu o přibližně 0,6–0,8 ml/min (–40 %), snížil počet příhod nočního močení o přibližně 0,8–1,3 (–40 %) (–2 v dlouhodobé otevřené studii) a prodloužil dobu do prvního nočního močení o přibližně 1,6 hodin (–2,3 v dlouhodobé otevřené studii) (tab. 10). Desmopresin dále významně snížil noční objem moči a rovněž procento objemu moči vyloučené v noci [5,8].
Tab. 9. Klinické studie testující účinnost desmopressinu u dospělých mužů s noční polyurií. 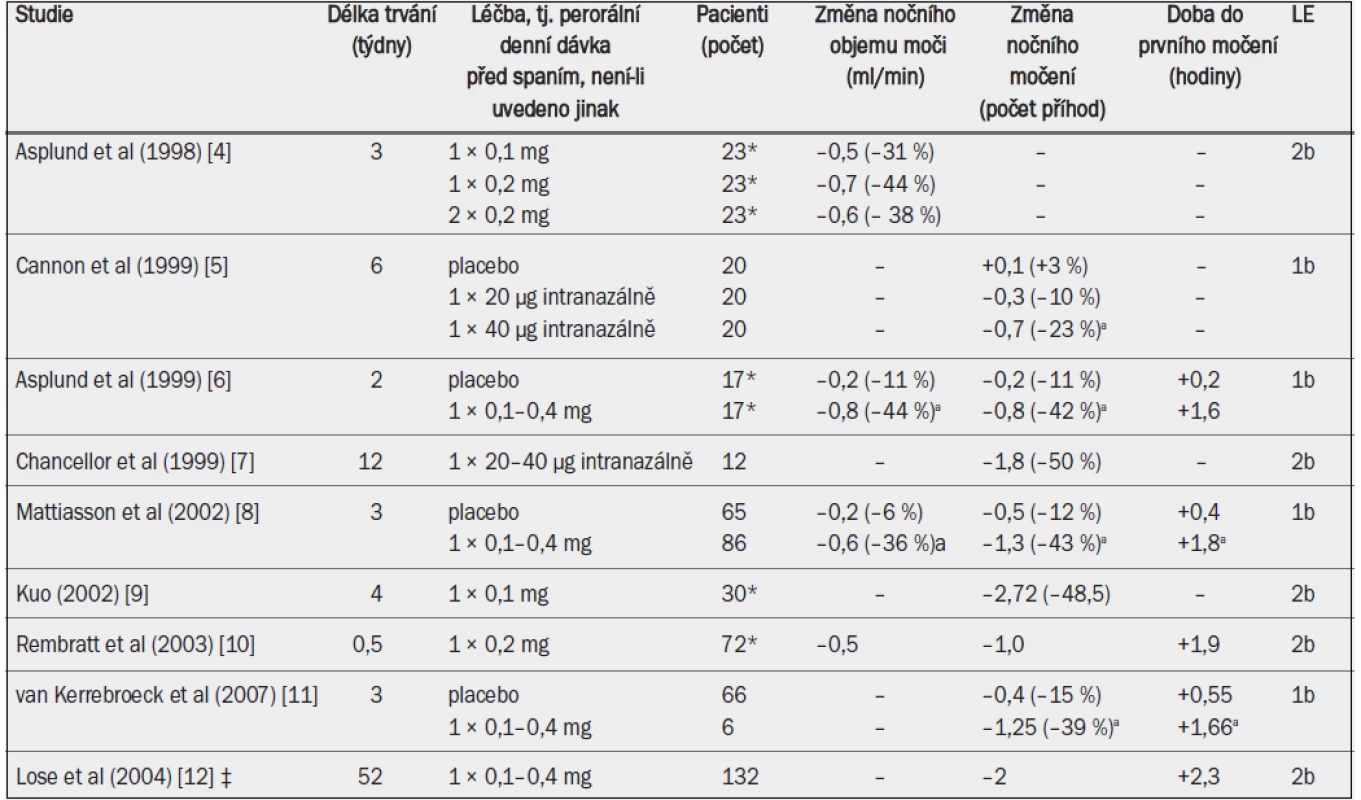
*Většina účastníků studie byli muži; ‡ údaje týkající se pouze mužů; a = významná v porovnání s placebem. Klinický efekt desmopresinu byl výraznější u pacientů se závažnější noční polyurií a s výchozí kapacitou močového měchýře v normálním rozmezí. 24hodinová diuréza se během léčby desmopresinem nezměnila. Klinický efekt byl po dobu sledování v délce 10–12 měsíců stabilní a po přerušení studie se hodnoty vrátily na výchozí úroveň [12]. Významně vyšší podíl pacientů se po podání desmopresinu cítil ráno svěží (odds ratio 2,71) [11].
4.5.4 Snášenlivost
Absolutní počet příhod výskytu nežádoucích účinků spojených s léčbou desmopresinem byl v porovnání s placebem vyšší, ale svou povahou byly tyto nežádoucí účinky obvykle mírné. Nejčastějšími nežádoucími účinky v krátkodobých studiích (do 3 týdnů) a v dlouhodobých studiích (12 měsíců) byly bolest hlavy, nevolnost, bolest břicha, závratě, sucho v ústech a hyponatremie. Tyto účinky byly srovnatelné s prokázaným bezpečnostním profilem desmopresinu při léčbě polyurie způsobené jinými stavy. V dlouhodobé studii byly uváděny periferní edém (2 %) a hypertenze (5 %) [12].
Hyponatremie (koncentrace sodíku v séru < 130 mmol/l) byla pozorována zejména u pacientů ve věku 65 let nebo starších a podle všeho se méně často objevovala u mužů než u žen téhož věku [3]. Hyponatremie všech stupňů, která není nezbytně spojena se symptomy, se objevuje přibližně u 5 % [13] až 7,6 % pacientů [14] brzy po zahájení léčby. Riziko vzniku hyponatremie se významně zvyšuje s věkem (odds ratio 1,16 na každý rok věku), nižší výchozí koncentrací sodíku v séru (odds ratio 0,76) a vyšším základním 24hodinovým objemem moči na tělesnou hmotnost (odds ratio 1,09) [13]. Pravděpodobnost vzniku hyponatremie u pacientů mladších 65 let je méně než 1 %, zatímco riziko u starších pacientů se zvyšuje na 8 % při normální koncentraci sodíku a až na 75 % u pacientů s nízkou výchozí koncentrací sodíku [13].
Léčba mužů ve věku 65 let nebo starších by proto neměla být zahájena bez sledování koncentrace sodíku v séru. V okamžiku zahájení léčby nebo změny dávkování by u starších mužů s normálními hodnotami sodíku v séru mělo být provedeno měření Na+, a to třetí a sedmý den od zahájení léčby a rovněž po uplynutí jednoho měsíce. Pokud zůstane koncentrace sodíku v séru normální a není plánována žádná změna dávkování, hodnoty Na+ by poté měly být sledovány každých 3–6 měsíců [15]. Dále by pak pacienti měli být informováni o prodromálních symptomech hyponatremie, jako jsou bolest hlavy, nevolnost nebo nespavost.
4.5.5 Praktické úvahy
Desmopresin by měl být aplikován jednou denně před spaním. Jelikož se optimální dávka u různých pacientů liší, léčba desmopresinem by měla být zahájena aplikací nízké dávky (0,1 mg/den), kterou lze postupně každý týden zvyšovat až do dosažení maximální účinnosti. Maximální doporučená dávka je 0,4 mg/den. Pacienti by neměli pít alespoň hodinu před podáním desmopresinu a osm hodin poté. Mužům ve věku 65 let nebo starším by desmopresin neměl být aplikován, pokud je koncentrace sodíku v séru nižší, než je normální hodnota. U všech ostatních mužů ve věku 65 let nebo starších by koncentrace sodíku v séru měla být změřena třetí a sedmý den a rovněž po uplynutí jednoho měsíce a pokud zůstane koncentrace sodíku v séru normální, následně každých 3–6 měsíců.
4.5.6 Doporučení
Desmopresin lze podávat při léčbě nykturie, která je sekundárním projevem noční polyurie (úroveň důkazu / stupeň doporučení: 1b/A).
4.5.7 Literatura
- Fjellestad-Paulsen A, Höglund P, Lundin S et al. Pharmacokinetics of 1-deamino-8-D-arginine vasopressin after various routes of administration in healthy volunteers. Clin Endocrinol 1993; 38(2): 177–182.
- Rembratt A, Graugaard-Jensen C, Senderovitz T et al. Pharmacokinetics and pharmacodynamics of desmopressin administered orally versus intravenously at daytime versus night-time in healthy men aged 55-70 years. Eur J Clin Pharmacol 2004; 60(6): 397–402.
- Hvistendahl GM, Riis A, Norgaard JP et al. The pharmacokinetics of 400 μg of oral desmopressin in elderly patients with nocturia, and the correlation between the absorption of desmopressin and clinical effect. BJU Int 2005; 95(6): 804–809.
- Asplund R, Sundberg B, Bengtsson P. Desmopressin for the treatment of nocturnal polyuria in the elderly: a dose titration study. Br J Urol 1998; 82(5): 642–646.
- Cannon A, Carter PG, McConnell AA et al. Desmopressin in the treatment of nocturnal polyuria in the male. BJU Int 1999; 84 : 20–24.
- Asplund R, Sundberg B, Bengtsson P. Oral desmopressin for nocturnal polyuria in elderly subjects: a double-blind, placebo-controlled randomised exploratory study. BJU Int 1999; 83 : 591–595.
- Chancellor MB, Atan A, Rivas DA et al. Beneficial effect of intranasal desmopressin for men with benign prostatic hyperplasia and nocturia: preliminary results. Tech Urol 1999; 5(4): 191–194.
- Mattiasson A, Abrams P, Van Kerrebroeck P et al. Efficacy of desmopressin in the treatment of nocturia: a double-blind placebo-controlled study in men. BJU Int 2002; 89(9): 855–862.
- Kuo HC. Efficacy of desmopressin in treatment of refractory nocturia in patients older than 65 years. Urology 2002; 59 : 485–489.
- Rembratt A, Norgaard JP, Andersson KE. Desmopressin in elderly patients with nocturia: short-term safety and effects on urine output, sleep and voiding patterns. BJU Int 2003; 91(7): 642–646.
- Van Kerrebroeck P, Rezapour M, Cortesse A et al. Desmopressin in the treatment of nocturia: a double blind placebo-controlled study. Eur Urol 2007; 52(1): 221–229.
- Lose G, Mattiasson A, Walter S et al. Clinical experiences with desmopressin for long-term treatment of nocturia. J Urol 2004; 172(3): 1021–1025.
- Rembratt A, Riis A, Norgaard JP. Desmopressin treatment in nocturia; an analysis of risk factors for hyponatremia. Neurourol Urodyn 2006; 25(2): 105–109.
- Weatherall M. The risk of hyponatremia in older adults using desmopressin for nocturia: a systematic review and meta-analysis. Neurourol Urodyn 2004; 23(4): 302–305.
- Bae JH, Oh MM, Shim KS et al. The effects of long-term administration of oral desmopressin on the baseline secretion of antidiuretic hormone and serum sodium concentration for the treatment of nocturia: a circadian study. J Urol 2007; 178(1): 200–203.
4.6 Kombinované terapie
4.6.1 Alfa-1 blokátory + inhibitory 5-alfa-reduktázy
4.6.1.1 Mechanizmus účinku
Cílem kombinované terapie alfa-1 blokátory a inhibitory 5-alfa-reduktázy je spojení různých účinků těchto dvou tříd léčiv a dosažení synergistické účinnosti při zlepšování symptomů a v rámci prevence progrese onemocnění.
4.6.1.2 Dostupná léčiva
Kombinovaná terapie zahrnuje alfa-1 blokátor (alfuzosin, doxazosin, tamsulosin nebo terazosin; farmakokinetické vlastnosti viz kapitola 3.1.2) společně s inhibitorem 5-alfa-reduktázy (dutasterid nebo finasterid; farmakokinetické vlastnosti viz kapitola 3.2.2). Alfa-1 blokátor vykazuje klinický efekt v řádech hodin nebo dnů, zatímco inhibitor 5-alfa-reduktázy potřebuje na to, aby se projevila signifikantní klinická účinnost, několik měsíců. Ze všech možných kombinací léčiv byly doposud v klinických studiích testovány finasterid v kombinaci s alfuzosinem, doxazosinem nebo terazosinem a dutasterid v kombinaci s tamsulosinem. Obě kombinace vykazují obdobnou účinnost a nežádoucí účinky („class effects“). Nejsou uváděny žádné rozdíly ve farmakokinetických nebo farmakodynamických vlastnostech kombinované aplikace obou léčiv v porovnání s aplikací pouze jediného léčiva.
4.6.1.3 Účinnost
Několik studií zkoumalo účinnost kombinované terapie oproti účinnosti samostatně podávaného alfa-1 blokátoru, inhibitoru 5-alfa-reduktázy nebo placeba (tab. 11). Počáteční studie s dobou sledování v rozmezí 6–12 měsíců použily jako svůj primární výsledný parametr změnu symptomů (IPSS) [1–3]. Tyto studie jednotně prokázaly, že alfa-1 blokátor zmírňuje symptomy účinněji než finasterid, zatímco kombinovaná léčba nebyla v porovnání s aplikací samostatného alfa-1 blokátoru účinnější. Ve studiích, které zahrnovaly placebo skupinu, byl alfa-1 blokátor vždy účinnější než placebo, zatímco finasterid nebyl v porovnání s placebem nikdy účinnější. Údaje po prvním roce studie MTOPS (Medical Therapy of Prostatic Symptoms), které byly zveřejněny, ale nebyly pro tento časový úsek specificky analyzovány, ukázaly obdobné výsledky [4].
Tab. 10. Randomizované studie testující alfa-1 blokátor, inhibitor 5-alfa-reduktázy a kombinaci obou léčiv u mužů se symptomy LUTS a benigním zvětšením prostaty v důsledku benigní hyperplazie prostaty (pozn.: odkazy 5 a 6 odrážejí různé časové okamžiky téže studie). 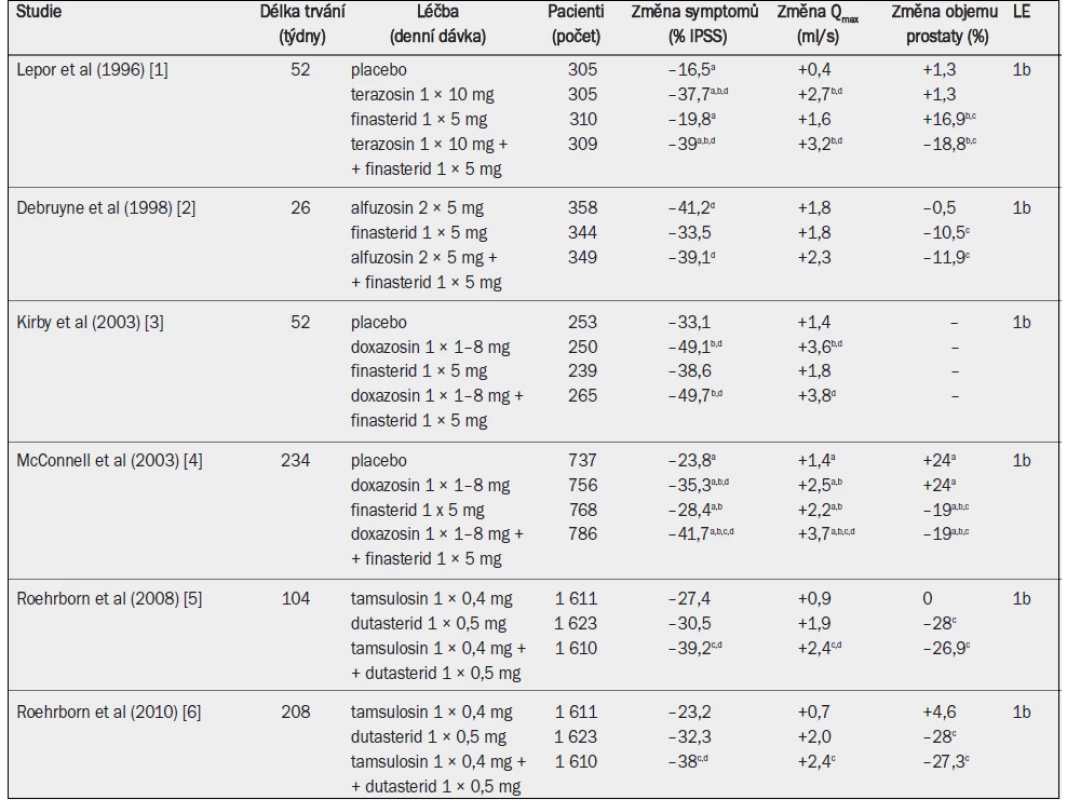
Qmax = maximální rychlost průtoku moči (volná uroflowmetrie); IPSS = mezinárodní skóre prostatických symptomů; a = významná v porovnání s výchozím stavem (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významná v porovnání s placebem; c = významná v porovnání s monoterapií alfa-1 blokátorem; d = významná v porovnání s monoterapií inhibitorem 5-alfa-reduktázy. Nedávno byla zveřejněna analýza údajů po čtyřech letech studie MTOPS a rovněž výsledky po dvou a čtyřech letech studie CombAT (Combination of Avodart® and Tamsulosin) [4–6]. Studie CombAT zahrnovala starší muže s větší prostatou a vyššími koncentracemi PSA v séru, a proto by mohla reprezentovat muže, u nichž existuje větší riziko progrese onemocnění. Na rozdíl od předchozích studií, které zahrnovaly sledování v délce pouze 6–12 měsíců, dlouhodobé údaje prokázaly, že kombinovaná léčba je účinnější než monoterapie, pokud jde o snížení symptomů a zlepšení Qmax, a účinnější než alfa-1 blokátor při snižování rizika akutní retence moči a nutnosti operace [4–6]. Studie CombAT prokázala, že kombinovaná léčba je účinnější než monoterapie, pokud jde o zlepšení symptomů a Qmax, počínaje devátým měsícem, a účinnější než alfa-1 blokátor, pokud jde o snížení rizika akutní retence moči a nutnosti operace, po osmi měsících [6]. Různé výsledky studií CombAT a MTOPS jsou zřejmě důsledkem různých zařazovacích a vyřazovacích kritérií spíše než typů alfa-1 blokátorů nebo inhibitorů 5-alfa-reduktázy. Samostatně aplikovaný dutasterid nebo finasterid redukoval objem prostaty stejně účinně jako kombinovaná léčba (–20 až –27 %).
Otázkou vysazení léčby alfa-1 blokátorem se zabývaly tři studie [7–9]. Jedna studie hodnotila kombinaci tamsulosinu s dutasteridem a dopad vysazení tamsulosinu po šesti měsících [7]. Po vysazení alfa-1 blokátoru téměř tři čtvrtiny pacientů uváděli, že u nich nedošlo k žádnému zhoršení symptomů. Avšak pro pacienty, kteří před zahájením léčby trpí závažnými symptomy (IPSS > 20), může být dlouhodobější kombinovaná terapie přínosem. Nedávno zveřejněná studie hodnotila dopad monoterapie finasteridem na symptomy tři a devět měsíců po vysazení devítiměsíční kombinované terapie (finasterid plus alfa-1 blokátor) [8]. Zlepšení symptomů LUTS po kombinované terapii zůstalo patrné i po třech (rozdíl IPPS 1,24) a devíti měsících (rozdíl IPPS -0,44).
V retrospektivní studii byla pravděpodobnost vysazení alfa-1 blokátoru, které vycházelo z individuálního rozhodnutí pacienta, hodnocena za období 12 měsíců u mužů starších 65 let, kterým byly podávány alfa-1 blokátory v kombinaci s dutasteridem nebo finasteridem [9]. Pacienti, kterým byl aplikován dutasterid, vysazovali léčbu alfa-1 blokátory o 64 % rychleji než pacienti, kterým byl aplikován finasterid, a to v kterémkoli okamžiku. Dvanáctý měsíc bylo 62 % pacientů léčeno pouze dutasteridem, zatímco 43,7 % mužů bylo léčeno pouze finasteridem.
Kombinovaná terapie se ukázala jako účinnější než monoterapie ve studiích MTOPS i CombAT, pokud jde o prevenci celkové klinické progrese, která je definována jako zvýšení IPSS alespoň o čtyři body, akutní retenci moči, infekci močových cest, inkontinenci nebo zvýšení kreatininu v séru o více než 50 % v porovnání s výchozím stavem. Pokud jde o kombinovanou terapii ve studiích MTOPS vs CombAT, byla zaznamenána tato snížení:
- celkové riziko progrese onemocnění: 66 vs 44 %
- progrese symptomů: 64 vs 41 %
- akutní retence moči: 81 vs 68 %
- močová inkontinence: 65 vs 26 %
- operace související s BPH: 67 vs 71 %
Monoterapie inhibitorem 5-alfa-reduktázy podle všeho snižovala rizika akutní retence moči a operace související s prostatou stejně účinně jako kombinovaná léčba (nevýznamné rozdíly), ačkoli výraznější vliv na prevenci měla kombinovaná terapie [4,6]. Výsledky studie MTOPS naznačily, že samostatně aplikovaný alfa-1 blokátor by mohl rovněž snižovat riziko progrese symptomů.
4.6.1.4 Snášenlivost a bezpečnost
Ve studiích CombAT i MTOPS byly celkové nežádoucí účinky spojené s léčivy významně častější během kombinované léčby než během jakékoli z monoterapií. Nežádoucí účinky pozorované během kombinované léčby byly příznačné pro alfa-1 blokátor a inhibitor 5-alfa-reduktázy. Frekvence výskytu nežádoucích účinků byla ve většině případů významně vyšší u kombinované terapie.
4.6.1.5 Praktické úvahy
V porovnání s monoterapií alfa-1 blokátory nebo inhibitory 5-alfa-reduktázy vede kombinovaná terapie k výraznějšímu zlepšení symptomů LUTS a zvýšení Qmax a je účinnější v rámci prevence progrese onemocnění. Kombinovaná terapie je však také spojena s více nežádoucími účinky. Kombinovaná terapie by proto měla být primárně používána u mužů, kteří vykazují středně závažné až závažné symptomy LUTS a u nichž hrozí riziko progrese onemocnění (větší objem prostaty, vyšší koncentrace PSA, pokročilý věk atd.). Kombinovaná terapie by měla být používána pouze v případě, je-li plánována dlouhodobá léčba (více než 12 měsíců); tato otázka by měla být s pacientem před zahájením léčby prodiskutována. Vysazení alfa-1 blokátoru po šesti měsících lze zvážit u mužů se středně závažnými symptomy LUTS.
4.6.1.6 Doporučení
Kombinovaná léčba alfa-1 blokátorem společně s inhibitorem 5-alfa-reduktázy by měla být nabízena mužům se středně závažnými až závažnými symptomy dolních cest močových, zvětšenou prostatou (> 40 ml) a sníženým Qmax (muži, u nichž je pravděpodobná progrese onemocnění). Kombinovaná léčba se nedoporučuje pro krátkodobou terapii (< 1 rok) (úroveň důkazu / stupeň doporučení: 1b/A).
4.6.1.7 Literatura
- Lepor H, Williford WO, Barry MJ et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. N Engl J Med 1996; 335(8): 533–539.
- Debruyne FM, Jardin A, Colloi D et al; on behalf of the European ALFIN Study Group. Sustainedrelease alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. Eur Urol 1998; 34(3): 169–175.
- Kirby R, Roehrborn CG, Boyle P et al; Prospective European Doxazosin and Combination Therapy Study Investigators. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: the Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology 2003; 61(1): 119–126.
- McConnell JD, Roehrborn CG, Bautista O et al; Medical Therapy of Prostatic Symptoms (MTOPS) Research Group. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
- Roehrborn CG, Siami P, Barkin J et al; CombAT Study Group. The effects of dutasteride, tamsulosin and combination therapy on lower urinary tract symptoms in men with benign prostatic hyperplasia and prostatic enlargement: 2-year results from the ComAT study. J Urol 2008; 179(2): 616–621.
- Roehrborn CG, Siami P, Barkin J, et al; CombAT Study Group. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol 2010; 57(1): 123–131.
- Barkin J, Guimarães M, Jacobi G et al. Alpha-blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5alpha--reductase inhibitor dutasteride. Eur Urol 2003; 44(4): 461–466.
- Nickel JC, Barkin J, Koch C et al. Finasteride monotherapy maintains stable lower urinary tract symptoms in men with benign prostatic hyperplasia following cessation of alpha blockers. Can Urol Assoc J 2008; 2(1): 16–21.
- Issa MM, Lin PJ, Eaddy MT et al. Comparative analysis of alpha-blocker utilization in combination with 5-alpha reductase inhibitors for enlarged prostate in a managed care setting among Medicareaged men. Am J Manag Care 2008;14 (5 Suppl 2): S160–166.
4.6.2 Alfa-1 blokátory + antagonisté muskarinových receptorů
4.6.2.1 Mechanizmus účinku
Cílem kombinované terapie alfa-1 blokátorem společně s antagonistou muskarinových receptorů je antagonizovat jak alfa-1 adrenergní receptory, tak muskarinové cholinergní receptory (M2 a M3) v dolních cestách močových, a tím využít účinnosti obou tříd léčiv k dosažení synergistických účinků.
4.6.2.2 Dostupná léčiva
Kombinovaná léčba zahrnuje alfa-1 blokátor (alfuzosin, doxazosin, tamsulosin nebo terazosin; farmakokinetické vlastnosti viz kapitola 3.1.2) společně s antagonistou muskarinových receptorů (darifenacin, fesoterodin, oxybutynin, propiverin, solifenacin, tolterodin nebo trospium chlorid; farmakokinetické vlastnosti viz kapitola 3.3.2). V klinických studiích však byly doposud testovány pouze kombinace alfa-1 blokátoru doxazosin, tamsulosin nebo terazosin a antagonisty muskarinových receptorů oxybutynin, propiverin, solifenacin nebo tolterodin. Doposud byly obě třídy léčiv podávány jako samostatné tablety, neboť žádná kombinovaná tableta zatím není dostupná. Nejsou popsány žádné rozdíly z hlediska farmakokinetických nebo farmakodynamických vlastností kombinované aplikace obou léčiv v porovnání s aplikací pouze jediného léčiva.
4.6.2.3 Účinnost
Bylo zveřejněno alespoň devět studií zkoumajících účinnost kombinované léčby alfa-1 blokátory a antagonisty muskarinových receptorů u dospělých mužů se symptomy LUTS [1–8]. Dále byla zveřejněna jedna studie, v níž byl použit alfa-1 blokátor naftopidil (ve většině evropských zemí neregistrovaný) s anticholinergními agens, či bez nich [9]. Pouze jedna z těchto studií zahrnovala placebo skupinu (úroveň důkazu: 1b) a testovala kombinaci léčiv oproti alfa-1 blokátoru a zároveň oproti antagonistovi muskarinových receptorů [4]; všechny ostatní studie porovnávaly účinnost kombinované terapie s účinností samostatně aplikovaného alfa-1 blokátoru (tab. 12) (úroveň důkazu: 2b). Maximální doba trvání studie činila 25 týdnů, většina studií však trvala pouze 4–12 týdnů.
Tab. 11. Účinnost antagonistů muskarinových receptorů v kombinaci s alfa-1 blokátory. 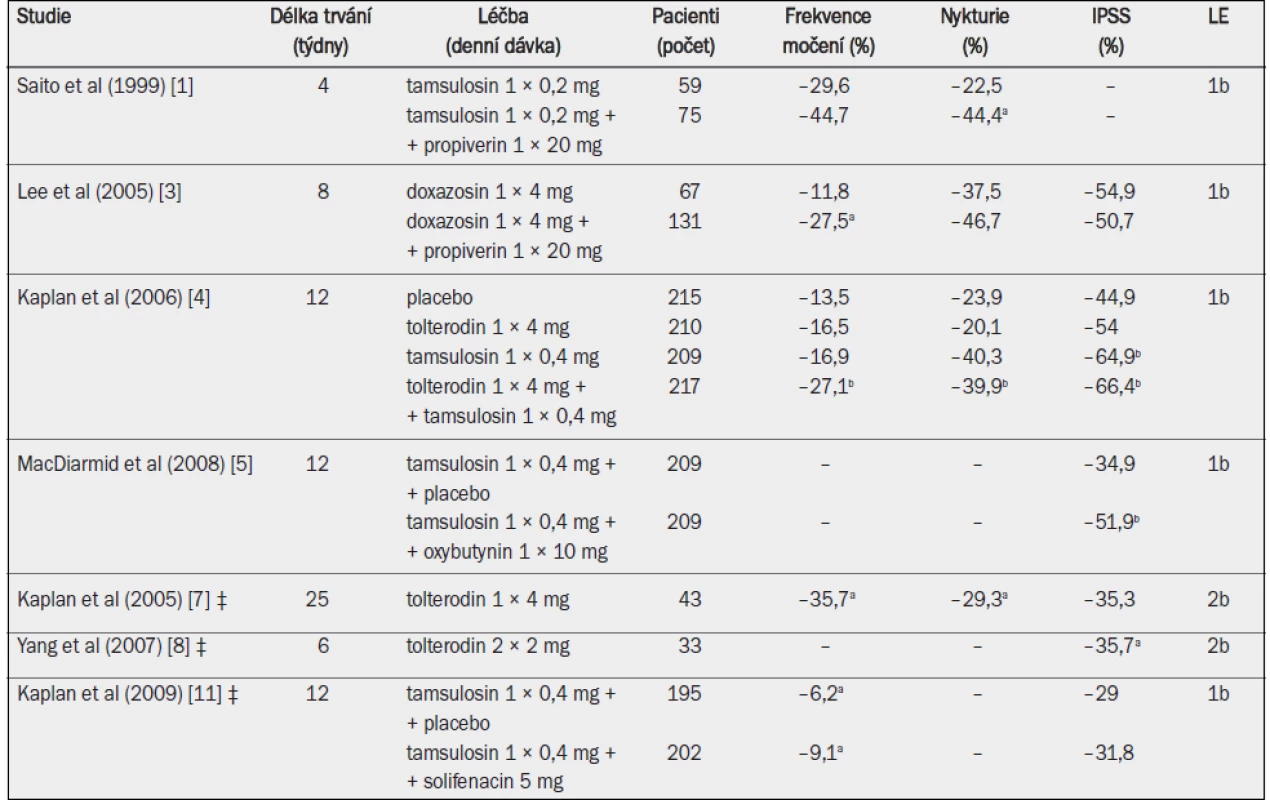
IPSS = mezinárodní skóre prostatických symptomů; ‡ přetrvávající symptomy LUTS během léčby alfa-1 blokátory (přídatná terapie); a = významná v porovnání s výchozím stavem (p ≤ 0,05, jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení); b = významné snížení v porovnání s placebem (p < 0,05). Kombinace léčiv byla v porovnání se samostatným podáváním alfa-1 blokátorů nebo pouze placeba obecně účinnější při snižování frekvence močení, nykturie nebo IPSS. Kombinovaná léčba dále významně snížila počet příhod urgentní močové inkontinence i urgenci a významně zvýšila kvalitu života [4].
Celkové zlepšení symptomů ve skupině, která byla podrobena kombinované terapii, bylo v porovnání s placebem významně vyšší bez ohledu na koncentrace PSA v séru, zatímco samostatné podávání tolterodinu významně zlepšovalo symptomy převážně u mužů s koncentrací PSA v séru nižší než 1,3 ng/ml [10]. Tři studie zkoumaly účinnost kombinované léčby u pacientů s přetrvávajícími symptomy LUTS během léčby alfa-1 blokátory, kdy byla stávající terapie alfa-1 blokátory rozšířena o aplikaci antagonisty muskarinových receptorů (přídatná terapie) [6–8]. Tyto studie prokázaly, že přetrvávající symptomy LUTS lze významně zmírnit přidáním antagonistů muskarinových receptorů tolterodin), zejména pokud byla prokázána hyperaktivita detruzoru (tab. 12). Ve skupině, která byla podrobena kombinované léčbě, uváděli pacienti významné zlepšení kvality života, benefitu léčby, obtěžování symptomy nebo vnímání stavu močového měchýře pacientem.
4.6.2.4 Snášenlivost a bezpečnost
Během kombinované léčby alfa-1 blokátory a antagonisty muskarinových receptorů se vyskytují nežádoucí účinky obou tříd léčiv. Nejčastěji uváděným vedlejším účinkem ve všech studiích byla xerostomie. Některé vedlejší účinky (např. xerostomie nebo selhání ejakulace) se vyskytují s větší četností a nelze je jednoduše vysvětlit kumulací s nežádoucími účinky druhého léčiva. Ve většině studií bylo zaznamenáno zvýšení postmikčního rezidua. Ačkoli bylo prů-měrné zvýšení objemu postmikčního rezidua nízké (6–24 ml), u některých mužů se objevily i vyšší hodnoty postmikčního rezidua nebo dokonce retence moči (0,9–3,3 %). Zůstává nejasné, u kterých mužů hrozí během kombinované léčby riziko výskytu postmikčního rezidua nebo retence moči.
4.6.2.5 Praktické úvahy
Zvýšená účinnost a lepší kvalita života u pacientů léčených alfa-1 blokátorem a antagonistou muskarinových receptorů je pravděpodobně způsobena jejich obdobnými účinky („class effects“). Bě-hem kombinované léčby se doporučuje měření postmikčního rezidua s cílem detekovat jeho zvýšení nebo vznik retence moči.
4.6.2.6 Doporučení
Kombinovanou léčbu alfa-1 blokátorem a antagonistou muskarinových receptorů lze zvážit u pacientů se středně závažnými až závažnými symptomy dolních cest močových, pokud nebylo dostatečné úlevy od symptomů dosaženo monoterapií jedním z uvedených léčiv (úroveň důkazu / / stupeň doporučení: 1b/B).
Kombinovaná léčba by měla být předepisována s opatrností u mužů, u kterých existuje podezření na obstrukci výtoku z močového měchýře (úroveň důkazu / / stupeň doporučení: 2b/B).
4.6.2.7 Literatura
- Saito H, Yamada T, Oshima H et al. A comparative study of the efficacy and safety of tamsulosin hydrochloride (Harnal capsules) alone and in combination with propiverine hydrochloride (BUP-4 tablets) in patients with prostatic hypertrophy associated with pollakisuria and/or urinary incontinence. Jpn J Urol Surg 1999; 12 : 525–536.
- Lee JY, Kim HW, Lee SJ et al. Comparison of doxazosin with or without tolterodine in men with symptomatic bladder outlet obstruction and an overactive detrusor. BJU Int 2004; 94(6): 817–820.
- Lee KS, Choo MS, Kim DY et al. Combination treatment with propiverine hydrochloride plus doxazosin controlled release gastrointestinal therapeutic system formulation for overactive bladder coexisting benign prostatic obstruction: a prospective, randomised, controlled multicenter study. J Urol 2005; 174 (4 Pt 1): 1334–1338.
- Kaplan SA, Roehrborn CG, Rovner ES et al. Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder. JAMA 2006; 296(19): 2319–2328.
- MacDiarmid SA, Peters KM, Chen A et al. Efficacy and safety of extended-release Oxybutynin in combination with tamsulosin for treatment of lower urinary tract symptoms in men: randomised, double-blind, placebo-controlled study. Mayo Clin Proc 2008; 83(9): 1002–1010.
- Athanasopoulols A, Gyftopoulos K, Giannitsas K et al. Combination treatment with an a-blocker plus an anticholinergic for bladder outlet obstruction: a prospective, randomised, controlled study. J Urol 2003; 169(6): 2253–2256.
- Kaplan SA, Walmsley K, Te AE. Tolterodine extended release attenuates lower urinary tract symptoms in men with benign prostatic hyperplasia. J Urol 2005; 174(6): 2273–2275.
- Yang Y, Zhao SF, Li HZ, et al. Efficacy and safety of combined therapy with terazosin and tolterodine for patients with lower urinary tract symptoms associated with benign prostatic hyperplasia: a prospective study. Chin Med J 2007; 120(5): 370–374.
- Maruyama O, Kawachi Y, Hanazawa K et al. Naftopidil monotherapy vs naftopidil and an anticholinergic agent combined therapy for storage symptoms associated with benign prostatic hyperplasia: A prospective randomised controlled study. Int J Urol 2006; 13(10): 1280–1285.
- Roehrborn CG, Kaplan SA, Kraus SR et al. Effects of serum PSA on efficacy of tolterodine extended release with or without tamsulosin in men with LUTS, including OAB. Urology 2008; 72(5): 1061–1067.
- Kaplan SA, McCammon K, Fincher R et al. Safety and tolerability of solifenacin add-on therapy to alpha--blocker treated men with residual urgency and frequency. J Urol 2009; 182(6): 2825–2823.
4.7 Nově vznikající léčiva
4.7.1 Inhibitory 5-fosfodiesterázy (PDE) (s alfa-1 blokátory, nebo bez nich)
4.7.2 Mechanizmus účinku
Oxid dusnatý (NO) představuje v lidském těle důležitý neadrenergní, necholinergní neurotransmiter, který se podílí na přenosu signálů v močových cestách. NO je syntetizován z aminokyseliny L-argininu syntázami oxidu dusnatého (NOS), které se dělí podle tkáňového původu na neuronální (nNOS), endotelové (eNOS) a indukované (iNOS) – imunitní buňky. Jakmile je NO syntetizován, difunduje se do buněk a stimuluje syntézu cyklického guanosin-monofosfátu (cGMP) zprostředkovanou enzymem guanylátcykláza. cGMP je schopen aktivovat proteinové kinázy, iontové kanály a cGMP fosfodiesterázy (PDE), čímž dochází k relaxaci buněk hladkého svalstva, a to deplecí intracelulárního Ca2+ a desenzibilizací kontraktilních proteinů [1]. Účinky cGMP ukončují izoenzymy PDE, které katalyzují hydrolýzu cGMP na inaktivní formu. Inhibitory PDE zvyšují koncentraci a prodlužují aktivitu intracelulárního cGMP, čímž snižují tonus hladkého svalstva detruzoru, prostaty a uretry. Doposud bylo izolováno 11 různých enzymů PDE, z nichž PDE 4 a 5 převažují v přechodové zóně lidské prostaty, močovém měchýři a močové trubici [2,3]. NO by se také mohl podílet na mikčním cyklu inhibicí míšních reflexních drah a neurotransmise v uretře, prostatě nebo močovém měchýři [4].
4.7.3 Dostupná léčiva
V Evropě jsou schváleny tři selektivní perorální inhibitory PDE5 (sildenafil citrát (sildenafil), tadalafil a vardenafil hcl (vardenafil)) pro léčbu erektilní dysfunkce nebo pulmonární arteriální hypertenze (sildenafil a tadalafil). Tato léčiva však nebyla dosud oficiálně registrována pro léčbu symptomů LUTS u mužů (tab. 13). Dostupné inhibitory PDE5 se liší převážně svými farmakokinetickými profily [5]. Všechny inhibitory PDE5 jsou rychle resorbovány z gastrointestinálního traktu, mají silnou vazbu na proteiny v plazmě a jsou metabolizovány převážně v játrech a vylučovány především ve stolici. Jejich poločas rozpadu se však významně liší. Inhibitory PDE5 jsou dle potřeby užívány pacienty s erektilní dysfunkcí, avšak tadalafil je registrován i pro každodenní použití v dávkách nižších (5 mg), než jsou stanoveny pro užívání dle potřeby.
Tab. 12. Inhibitory PDE5 schválené v Evropě pro léčbu erektilní dysfunkce; klíčové farmakokinetické vlastnosti a dávkování užité v klinických studiích. 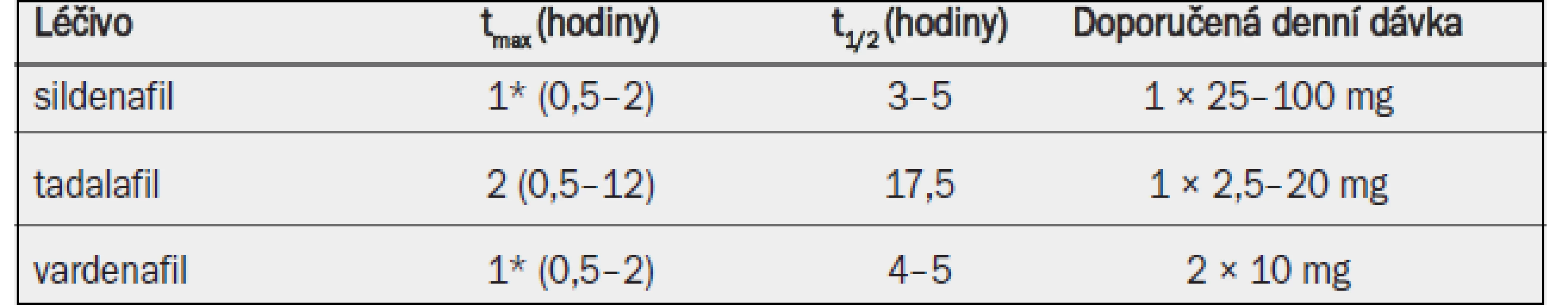
tmax = doba do dosažení maximální koncentrace v plazmě; t1/2 = poločas rozpadu; *závisí na příjmu potravy (tj. pomalejší resorpce léčiva a zvýšení tmax o přibližně 1 hodinu po tučném jídle).
4.7.4 Účinnost
Post-hoc analýza pacientů s erektilní dysfunkcí na počátku léčených sildenafilem ukázala, že inhibitor PDE5 je schopen významně snižovat průvodní symptomy LUTS a zvyšovat kvalitu života související se symptomy močového měchýře, jak jsou hodnoceny dotazníkem IPSS [6,7]. Bylo zjištěno, že zlepšení symptomů LUTS je nezávislé na zlepšení erektilní funkce. V posledních letech byly zveřejněny randomizované, placebem kontrolované studie účinnosti všech tří dostupných perorálních inhibitorů PDE5, které zkoumaly změny symptomů (IPSS), uroflowmetrické parametry (Qmax) a postmikční reziduum [6–16]. Maximální doba trvání studie byla 12 týdnů. Tyto studie prokázaly, že všechny inhibitory PDE5 významně a konzistentně snižují IPSS o přibližně 17–35 % (tab. 14). Během léčby inhibitory PDE5 se jímací i mikční symptomy snížily stejnou měrou. Postmikční reziduum zůstalo ve většině studií nezměněné. Qmax se při volné uroflowmetrii zvýšilo v závislosti na dávkování (tadalafil [16]), ale významně se nelišilo od placeba (sildenafil, tadalafil a vardenafil). Na rozdíl od studií splňujících požadavky EBM (medicíny založené na důkazech), úroveň důkazů 1b, uvedených v tab. 14, zdokumentovaly dvě uroflowmetrické studie provedené v jednom centru zlepšení Qmax a Qave po perorálním podání sildenafilu 50 nebo 100 mg až u 76 % mužů (průměrné zvýšení Qmax 3,7–4,3 ml/s nebo 24–38 %) [17,18]. V porovnání s pacienty léčenými placebem inhibitory PDE5 významně zlepšovaly kvalitu života.
Tab. 13. Účinnost inhibitorů PDE5 u dospělých mužů se symptomy LUTS, kteří se zúčastnili klinických studií splňujících požadavky EBM. 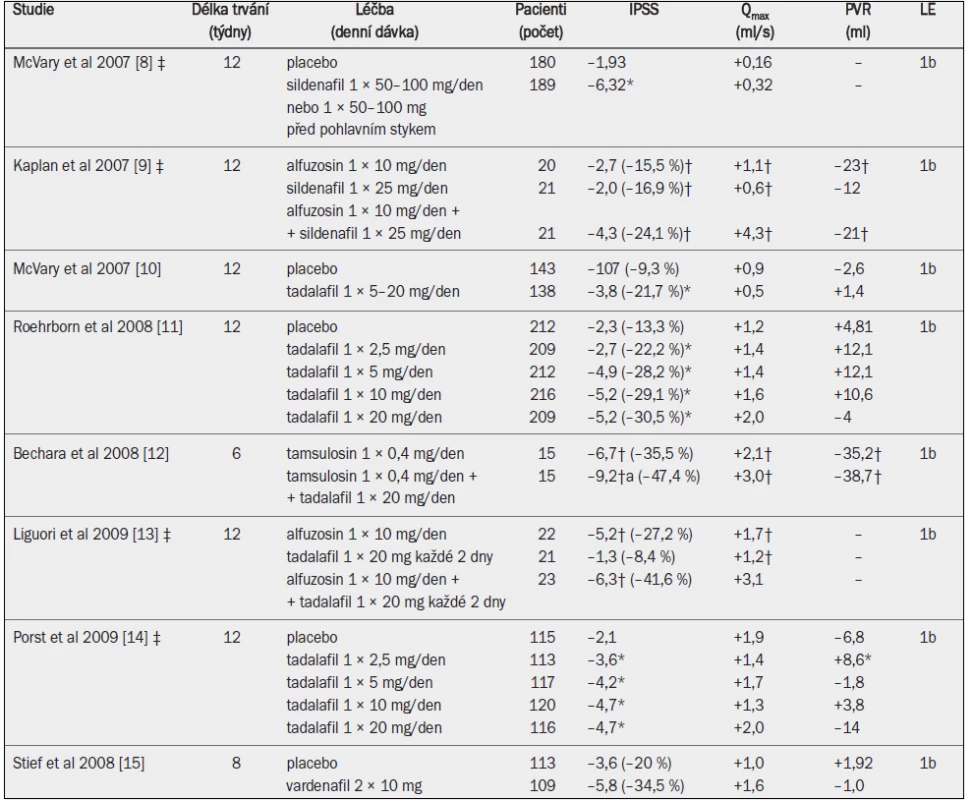
IPSS = mezinárodní skóre prostatických symptomů; Qmax = maximální rychlost průtoku moči během volné uroflowmetrie; PVR = postmikční reziduum; ‡ studie zahrnovala pacienty s erektilní dysfunkcí i symptomy LUTS; *významná v porovnání s placebem (p ≥ 0,05); † významná v porovnání s výchozím stavem (p < 0,05 (jako horní index uvedeno ve všech případech, kdy proběhlo hodnocení)); a = významná v porovnání s alfa-1 blokátorem (tamsulosin, p ≥ 0,05). Tři studie porovnávaly účinnost inhibitorů PDE5 (sildenafil nebo tadalafil) s alfa-1 blokátory, nebo bez nich (alfuzosin nebo tamsulosin) [9,12,13]. Tyto studie byly provedeny na malém počtu pacientů a s omezenou dobou sledování 6–12 týdnů. Kombinace léčiv zlepšovala IPSS, Qmax a postmikční reziduum větší měrou než samostatně podávaná léčiva každé třídy (tab. 14), ačkoli rozdíl v porovnání s inhibitorem PDE5 nebo samostatně aplikovaným alfa-1 blokátorem byl statisticky významný pouze v jedné ze tří studií [12].
4.7.5 Snášenlivost a bezpečnost
Inhibitory PDE5 mohou obecně způsobovat bolesti hlavy, návaly, závratě, dyspepsii, ucpaný nos, myalgii, hypotenzi, synkopu, tinitus, zánět spojivek nebo poruchy vidění (rozmazané vidění, vliv na barevné vidění). Frekvence vedlejších účinků se však u jednotlivých inhibitorů PDE5 liší. Pravděpodobnost vzniku priapismu nebo akutní retence moči je minimální.
Inhibitory PDE5 jsou kontraindikovány u pacientů užívajících nitráty nebo otvírač draslíkových kanálů nicorandil z důvodu další vazodilatace, která by mohla způsobit hypotenzi, ischemii myokardu u pacientů s onemocněním koronárních tepen nebo cévní mozkové příhody [5]. Dále by žádný z inhibitorů PDE5 neměl být podáván pacientům, kteří užívají alfa-1 blokátory doxazosin nebo terazosin, trpí nestabilní anginou pectoris, nedávno prodělali infarkt myokardu (v posledních třech měsících) nebo mozkovou příhodu (v posledních šesti měsících), trpí insuficiencí myokardu (NYHA > 2), hypotenzí, výkyvy krevního tlaku, významnou hepatickou nebo renální insuficiencí nebo pokud je známa nebo se po předchozím podání inhibitorů PDE5 objevila nearteriální přední ischemická neuropatie optického nervu (NAION) s náhlou ztrátou vidění. Sildenafil a vardenafil jsou také kontraindikovány u pacientů s retinitis pigmentosa. Je třeba dbát opatrnosti, pokud jsou inhibitory PDE5 podávány společně s jinými léčivy, která jsou rovněž metabolizována játry (cestou CYP3A4), což je spojeno se zvý-šenou koncentrací inhibitoru PDE5 v séru.
4.7.6 Praktické úvahy
Inhibitory PDE5 byly doposud oficiálně schváleny pouze pro léčbu erektilní dysfunkce a pulmonární arteriální hypertenze. Léčba nad rámec této indikace (např. symptomy LUTS u mužů) je zatím pouze experimentální a neměla by být v klinickém prostředí rutinně používána. Dlouhodobé zkušenosti u pacientů se symptomy LUTS stále chybí. Roli inhibitorů PDE5 v kontextu dalších dostupných účinných léčiv (např. alfa-1 blokátorů, inhibitorů 5-alfa-reduktázy nebo antagonistů muskarinových receptorů) bude teprve nutné stanovit. O kombinacích inhibitorů PDE5 a jiných léčiv pro léčbu symptomů LUTS nejsou k dispozici dostatečné informace.
4.7.7 Doporučení
Inhibitory PDE5 zmírňují středně závažné až závažné symptomy dolních cest močových u mužů (úroveň důkazu: 1b).
Inhibitory PDE5 jsou v současné době vyhrazeny mužům s erektilní dysfunkcí, pulmonární arteriální hypertenzí nebo mužům, kteří trpí symptomy dolních cest močových a účastní se klinických studií (stupeň doporučení: A).
4.7.8 Literatura
- Kedia GT, Ückert S, Jonas U et al. The nitric oxide pathway in the human prostate: clinical implications in men with lower urinary tract symptoms. World J Urol 2008; 26(6): 603–609.
- Ückert S, Küthe A, Jonas U et al. Characterization and functional relevance of cyclic nucleotide phosphodiesterase isoenzymes of the human prostate. J Urol 2001; 166(6): 2484–2490.
- Ückert S, Oelke M, Stief CG et al. Immunohistochemical distribution of cAMP - and cGMPphosphodiesterase (PDE) isoenzymes in the human prostate. Eur Urol 2006; 49(4): 740–745.
- Andersson KE, Persson K. Nitric oxide synthase and the lower urinary tract: possible implications for physiology and pathophysiology. Scand J Urol Nephrol Suppl 1995; 175 : 43–53.
- Wright PJ. Comparison of phosphodiesterase type 5 (PDE5) inhibitors. Int J Clin Pract 2006; 60(8): 967–975.
- Sairam K, Kulinskaya E, McNicholas TA, et al. Sildenafil influences lower urinary tract symptoms. BJU Int 2002; 90(9): 836–839.
- Mulhall JP, Guhring P, Parker M et al. Assessment of the impact of sildenafil citrate on lower urinary tract symptoms in men with erectile dysfunction. J Sex Med 2006; 3(4): 662–667.
- McVary KT, Monnig W, Camps JL Jr. et al. Sildenafil citrate improves erectile function and urinary symptoms in men with erectile dysfunction and lower urinary tract symptoms associated with benign prostatic hyperplasia: a randomised, double-blind trial. J Urol 2007; 177(3): 1071–1077.
- Kaplan SA, Gonzalez RR, Te AE. Combination of alfuzosin and sildenafil is superior to monotherapy in treating lower urinary tract symptoms and erectile dysfunction. Eur Urol 2007; 51(6): 1717–1723.
- McVary KT, Roehrborn CG, Kaminetsky JC, et al. Tadalafil relieves lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol 2007; 177(4): 1401–1407.
- Roehrborn CG, McVary KT, Elion-Mboussa A et al. Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a dose finding study. J Urol 2008; 180(4): 1228–1234.
- Bechara A, Romano S, Casabé A et al. Comparative efficacy assessment of tamsulosin vs. tamsulosin plus tadalafil in the treatment of LUTS/BPH. Pilot study. J Sex Med 2008; 5(9): 2170–2478.
- Liquori G, Trombetta C, De Giorgi G et al. Efficacy and safety of combined oral therapy with tadalafil and alfuzosin: an integrated approach to the management of patients with lower urinary tract symptoms and erectile dysfunction. Preliminary report. J Sex Med 2009; 6(2): 544–552.
- Porst H, McVary KT, Montorsi F et al. Effects of once-daily tadalafil on erectile function in men with erectile dysfunction and sign and symptoms of benign prostatic hyperplasia. Eur Urol 2009; 56(4): 727–735.
- Stief CG, Porst H, Neuser D et al. A randomised, placebo-controlled study to assess the efficacy of twice-daily vardenafil in the treatment of lower urinary tract symptoms secondary to benign prostatic hyperplasia. Eur Urol 2008; 53(6): 1236–1244.
- Roehrborn CG, Kaminetsky JC, Auerbach SM et al. Changes in peak urinary flow and voiding efficiency in men with signs and symptoms of benign prostatic hyperplasia during once daily tadalafil treatment. BJU Int 2010; 105(4): 502–507.
- Güler C, Tüzel E, Dogantekin E et al. Does sildenafil affect uroflowmetry values in men with lower urinary tract symptoms suggestive of benign prostatic enlargement? Urol Int 2008; 80(2): 181–185.
- Guven EO, Balbay MD, Mete K et al. Uroflowmetric assessment of acute effects of sildenafil on the voiding of men with erectile dysfunction and sympotomatic benign prostatic hyperplasia. Int Urol Nephrol 2009; 41(2): 287–292.
4.8 Další nová léčiva
V současné době je v rámci klinických studií zkoumáno (studie fáze II–III) několik nových léčiv, z nichž žádné zatím nebylo schváleno pro léčbu symptomů LUTS u mužů. Tato nová léčiva se zaměřují na:
- Prostatu, např. antagonisté hormonu uvolňujícího gonadotropin, antagonisté estrogenních receptorů, agens indukující apoptózu, vakcíny, agonisté receptoru vitaminu D nebo terapie nahrazující androgen.
- Močový měchýř, např. agonisté beta-3 adrenergních receptorů.
- Nervový systém, např. neuromuskulární blokátory, antagonisté tachykininových receptorů. Zveřejněné výsledky těchto léčiv jsou předběžné a nedostačující. Tato nová léčiva proto byla z dalších analýz vyloučena, ale budou znovu zhodnocena při přípravě další verze guidelines zaměřených na symptomy LUTS u mužů.
Štítky
Dětská urologie Urologie
Článek 1. ÚvodČlánek 2. HodnoceníČlánek 3. Konzervativní léčbaČlánek 5. Operační léčbaČlánek 6. Následné sledováníČlánek 7. Zkratky použité v textu
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo EAU Guidelines pro léčbu symptomů dolních močových cest u mužů- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
Nejčtenější v tomto čísle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



