-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kryoterapie – současný stav
Autoři: T. Page; D. Greene
Působiště autorů: Sunderland Royal Hospital, Sunderland, UK
Vyšlo v časopise: Urol List 2009; 7(3): 24-29
V současné době máme k dispozici několik možností léčby lokalizovaného karcinomu prostaty, mezi něž patří otevřená, laparoskopická a robotická operace, terapie založené na ozařování jako jsou například ozařování zevním paprskem a brachyterapie, léčba pomocí fokusovaného ultrazvuku o vysoké intenzitě a kryoterapie. Cílem všech těchto postupů je vyléčit karcinom prostaty při minimální morbiditě. Kryoterapie představuje zavedenou techniku užívanou při primární i záchranné léčbě karcinomu prostaty. Autoři tohoto článku uvádějí přehled vývoje kryoterapie, popisují princip účinku a uvádějí účinnost této techniky. Dále prezentují své metody a výsledky jimi dosažené.
MINULOST A VÝVOJ
O kryoterapii se poprvé zmiňuje James Arnott již v devatenáctém století, kdy zaznamenal jistý úspěch při léčbě karcinomu dělohy pomocí teploty –24 °C, jíž dosáhl kombinací fyziologického roztoku a ledové tříště [1]. V šedesátých letech minulého století se ke zmrazení požadované oblasti (bazální ganglia) začaly užívat sondy s tekutým dusíkem, tato metoda umožňovala dostatečné zmrazení, ovšem bez adekvátní přesnosti a kontroly [2].
Léčba prostaty pomocí kryoterapie, s užitím jediné transuretrální sondy, byla poprvé popsána v roce 1968 [3]. První generace přístrojů měla omezenou schopnost monitorování teploty v tkáni, a jak jistě nikoho nepřekvapí, zákrok byl spojen s vysokou mírou morbidity zejména v důsledku poranění močové trubice. První studie popisují rovněž zavedení kryosondy do prostaty pomocí perineální incize (při otevřené operaci). V roce 1974 bylo popsáno první zavedení sondy perkutánním perineálním přístupem pomocí rektální palpace [4].
Transrektální ultrazvukové vyšetření vyvinuté v osmdesátých letech minulého století umožnilo přesné zavádění sondy a kontrolu nad kryoablativním procesem. Ultrazvukové zobrazení v reálném čase umožnilo operatérovi přesné zavedení kryosondy a monitorování tvorby a expanze mražené oblasti (ice-ball). Zdokonalení techniky tak vedlo ke snížení incidence poranění rekta a díky tomu, že operační pole pokrylo celou prostatickou žlázu, také ke zlepšení kontroly onemocnění [5]. V poslední době byly pro monitorování kryoperace prostaty v reálném čase užity počítačová tomografie (CT) a magnetická rezonance (MRI). Teplotu lze provázat se signálem MR, což přidává MRI další benefit. Žádná z těchto modalit se však v současnosti v běžné praxi neužívá.
Design kryosondy prodělal v uplynulých dvaceti letech řadu změn. Za nejvýznamnější zdokonalení lze považovat nahrazení sondy s tekutým dusíkem ochlazované pomocí tekutiny (druhá generace) mnohem jemnější sondou chlazenou pomocí plynu (přístroje třetí generace). Aplikace plynu tenkou tryskou a jeho rozšíření do oblasti nižšího tlaku způsobuje rychlou změnu teploty okolních tkání – tento jev je znám jako Joule-Thompsonův efekt. Kromě výhody v podobě menší velikosti sondy je tento systém snazší a kryosonda vyžaduje jednodušší údržbu. Moderní kryoablační přístroje využívají k chlazení argon, který rychle dosahuje teploty –186 °C, a to předvídatelným způsobem. Pokud nahradíme argon heliem, lze pomocí stejné kryosondy okolní tkáň rovněž zahřát. Zatímco první přístroje disponovaly pouze jedinou sondou, kterou bylo nutné přemisťovat tak dlouho, dokud nedošlo k zmrazení celé prostaty, dnešní zařízení obsahují větší počet sond, které lze ovládat samostatně, a tak dosáhnout přesnější navigace ice-ball. Sondy mohou tkáň jak mrazit, tak i zahřívat.
Nejmodernější kryosondy (IceRods, Galil Medical, Yokneam, Izrael) o velikosti 17G jsou díky zdokonalenému výměníku tepla schopny produkovat zmrazení o rozsahu, jehož dříve dosahovala sonda o velikosti 30G. IceRods užívané při léčbě normální prostaty vytvářejí ice-ball o průměru 6 cm, bez nutnosti přemisťování sondy během výkonu. Pro srovnání, běžná 17G sonda vytváří ice-ball o průměru 3,5 cm [6]. Díky IceRods lze tedy délku výkonu zkrátit, protože jakmile je jednou sonda vhodně umístěna, vyžaduje pouze minimální relokaci. Nejnovější kryoblační systém Presice (Galil Medical) umožnil další zdokonalení plánování zákroku i snímání teploty.
Od sedmdesátých let minulého století se užívají termočlánky, které umožňují přesně monitorovat teplotu v prostatě a okolních tkáních, zejména rektu a močové trubici. V současné praxi je do močové trubice zaveden zahřívací katétr a teplota je monitorována pomocí termočlánku umístěného vedle močové trubice. Nejnovější technologické poznatky umožnily vyvinout moderní termočlánky schopné snímat teplotu na čtyřech různých místech vzdálených od sebe pouze 5 mm podél každé jehly senzoru (systém Presice). Autoři tohoto článku postupují v běžné praxi následujícím způsobem. Termočlánky jsou umístěny do prostaty v anteriorním aspektu, nedaleko od posteriorního aspektu v periferní zóně, v blízkosti svěrače močové trubice a ve střední čáře rekta, kde snímají rektální teplotu. Toto rozmístění umožňuje operatérovi kontrolovat každou sondu samostatně tak, aby prostata byla po dobu deseti minut ochlazena na teplotu –40 °C, aniž by teplota v uretrálním neurovaskulárním svazku a rektu klesla pod 5 °C.
Zahřátí močové trubice představuje v dnešní době nedílnou součást kryoterapeutické léčby prostaty a provádí se pomocí katétru, v němž v uzavřeném systému cirkuluje tekutina o teplotě 40 °C. Pomocí tohoto katétru probíhá zahřívání ještě přibližně 30–45 min po výkonu. Současná evropská i americká guidelines uvádějí, že zahřátí močové trubice představuje povinnou součást výkonu. Tímto postupem předejdeme odlučování uretry a snížíme incidenci obtížných symptomů dolních cest močových.
PRINCIP ÚČINKU
K destrukci tkáně během kryoablace dochází díky rozdílným bodům mrazu jednotlivých složek tkáně. Díky tomu, že extracelulární tekutina mrzne dříve než intracelulární tekutina, vzniká v buněčných membránách osmotický gradient, který vhání vodu ven z buněk do extracelulární matrix. Během tohoto procesu se objem extracelulární matrix zvětšuje vlivem buněčného objemu a vzhledem ke skutečnosti, že led má větší objem než voda. Rozšiřující se matrix pak utlačuje dehydratované buňky a poškozuje buněčnou strukturu. Dále dochází ke krystalizaci intracelulárního materiálu a zastavení buněčného metabolismu. Destrukce je tím větší, čím rychlejší je proces mrazení. Další fáze destrukce nastává během tání, kdy se extracelulární matrix rozmrazuje dříve než intracelulární materiál. To má za následek změnu osmotického gradientu a rychlé proudění tekutiny do buněk, které nabývají a explodují [7]. Nová generace kryosond naplněných plynem je schopna kontrolovat aktivní tání i aktivní ochlazování, díky čemuž se maximalizuje rychlost teplotní změny v prostatě.
Díky vaskulární stáze, kdy ledové krystaly vznikající v mikrocirkulaci blokují přítok teplé krve a rozpínají endoteliální buňky, dochází k dalšímu poškození. Během fáze tání je poškození endoteliálních buněk patrné a spouští kaskádu procesu hemokoagulace a vzniku trombu. Přesné načasování vaskulárního poškození nebylo doposud prokázáno, pravděpodobně nastává 2–24 hod po zmrazení tkáně. Tkáňová ischemie účinkuje synergisticky s lokálním účinkem – způsobuje nekrózu a buněčnou smrt [7]. Kryoablace dále spouští programový zánik buněk (apoptózu). Tato forma poškození buněk začíná v jádru a mitochondriích během cyklu zmrazení/tání [8].
Pro histologické vyšetření se obvykle užívá vzorek získaný pomocí biopsie spíše než vyšetřením celé prostatické žlázy. Biopsie po kryoterapii prokáže fibrózu stromatu, depozici hemosiderinu, hyperplazii bazálních buněk, hyalinizaci, může vykazovat dokonce známky normální prostatické tkáně. Vzorky biopsie odebrané v různých obdobích krátce po kryoablaci prokázaly přetrvávající přítomnost karcinomu, příznivé výsledky biopsie odebrané o několik let později a hladina PSA (prostatického specifického antigenu) však nasvědčují tomu, že účinek kryoterapie může přetrvat i mnoho let po výkonu (podobně jako tomu je u radioterapie) [9].
Účinek jiných terapií jako je například hormonální ablace nebo radioterapie při destrukci tkáně není znám. Doposud také nebylo prokázáno, zda je karcinomatózní prostatická tkáň více či méně náchylná k poškození zmrazením než normální tkáň prostaty nebo tkáň hypertrofovaná. Vzhledem k tomu, že řada apoptických drah je v buňkách tumoru deaktivována, lze předpokládat, že tyto buňky jsou ke kryoterapii rezistentnější než normální buňky.
ÚČINNOST
Abychom mohli posoudit účinnost léčby prostaty pomocí kryoterapie, je nutné údaje týkající se primární léčby onemocnění ohraničeného na orgán a výsledky týkající se kryoablace jako záchranné léčby po ozařování zevním paprskem, brachyterapii, otevřené operaci nebo selhání hormonální léčby, hodnotit samostatně.
PRIMÁRNÍ LÉČBA
V současné době trvá sledování pacientů, kteří podstoupili kryoterapii jako primární léčbu (s použitím nejnovějších zařízení), pouze několik let, což znesnadňuje srovnávání těchto údajů s výsledky dosaženými pomocí zavedených modalit – tj. radioterapie a operační léčby [10]. Stejně jako tomu je v jiných studiích zabývajících se léčbou karcinomu prostaty, představují výsledné parametry ve studiích zkoumajících kryoterapii proměnné spojené s onemocněním – měření hladiny PSA v séru nebo negativní výsledek biopsie. U biopsie však hrozí riziko chybného zaměření odběru vzorku, definice úspěšné léčby a selhání na základě měření hladiny PSA se navíc mohou lišit. Kupříkladu ASTRO (American Society for Therapeutic Radiology and Oncology) definuje selhání radioterapie jako tři po sobě se vyskytující zvýšení hladiny PSA nad nadir, zatímco RTOG (Radiation Therapy Oncology Group) definice selhání uvádí zvýšení PSA ≥ 2 ng/ml nad nadir. Otázkou také zůstává, zda lze tyto definice pro selhání léčby ozařováním aplikovat také na léčbu pomocí kryoterapie. Srovnání dále komplikuje skutečnost, že radioterapie je často kombinována s hormonální léčbou. Při srovnávání výsledků těchto terapií je tedy nutné uvážit dlouhodobý nepříznivý vliv hormonální ablace na kvalitu života pacienta.
Výsledky kryoterapie využívající technologie druhé generace v rámci primární léčby karcinomu prostaty prokazují 89% míru přežití specifickou pro karcinom a 99% míru negativního výsledku biopsie (u pacientů sledovaných po dobu pěti let) [11]. Největší doposud provedená studie byla prezentována na kongresu Americké urologické asociace v roce 2007 a zahrnovala celkem 1 198 pacientů, kteří podstoupili kryoterapii využívající technologie druhé a třetí generace [12]. Průměrná doba sledování byla 24,4±25,9 měsíců. Na základě ASTRO definice bylo prokázáno, že 77,1±2,1 % pacientů po pěti letech přežívalo bez známek onemocnění, s pozitivním výsledkem biopsie u pouze 6,8 % z celkové populace této studie [12]. Donly et al ve své randomizované studii zahrnující 240 pacientů srovnávali účinnost kryoterapie a radioterapie při primární léčbě karcinomu prostaty [13]. Zjistili, že kryoterapie nedosahuje horších výsledků než radioterapie. Dále prokázali, že u pacientů podstupujících kryoterapii byl po 36 ±12 měsících sledování významně menší počet pozitivních biopsií. Doposud nejpřesvědčivější výsledky pocházejí ze studie Bahna et al (2002), která uvádí, že na základě ASTRO kritérií přežilo 92 % z celkem 590 pacientů podstupujících kryoterapii 7 let bez známek recidivy [14].
Míra výskytu komplikací při primární kryoterapii s využitím zařízení třetí generace a multisensorického snímání teploty je srovnatelná s výsledky radioterapie i otevřené operace, s výjimkou incidence erektilní dysfunkce (tab. 1) [10,14,23].
Tab. 1. Míra výskytu komplikací při kryoterapii jako primární léčbě adenokarcinomu prostaty (s užitím systému třetí generace). 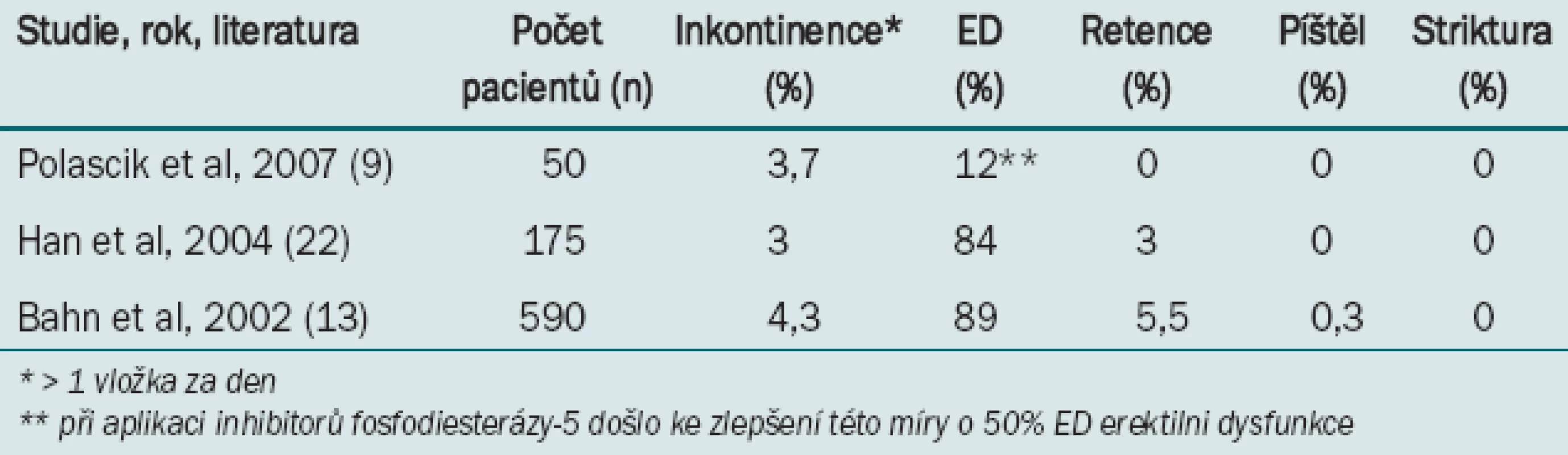
ZÁCHRANNÁ TERAPIE
Záchranná kryoablace prováděná po radioterapii či radikální operaci představuje dobře popsanou techniku. U této skupiny pacientů nepředstavuje vysoká míra vzniku ED spojená s kryoterapií takovou komplikaci vzhledem k tomu, že řada pacientů již touto dysfunkcí trpí v důsledku předchozí terapie, a v případě nutnosti lze po čase kryoterapii opakovat s cílem kontroly lokálního onemocnění. Míry komplikací spojených s kryoterapií v záchranném režimu jsou uvedeny v tab. 2 [16,22-24].
Tab. 2. Míra výskytu komplikací při kryoterapii jako záchranné léčbě po radioterapii. 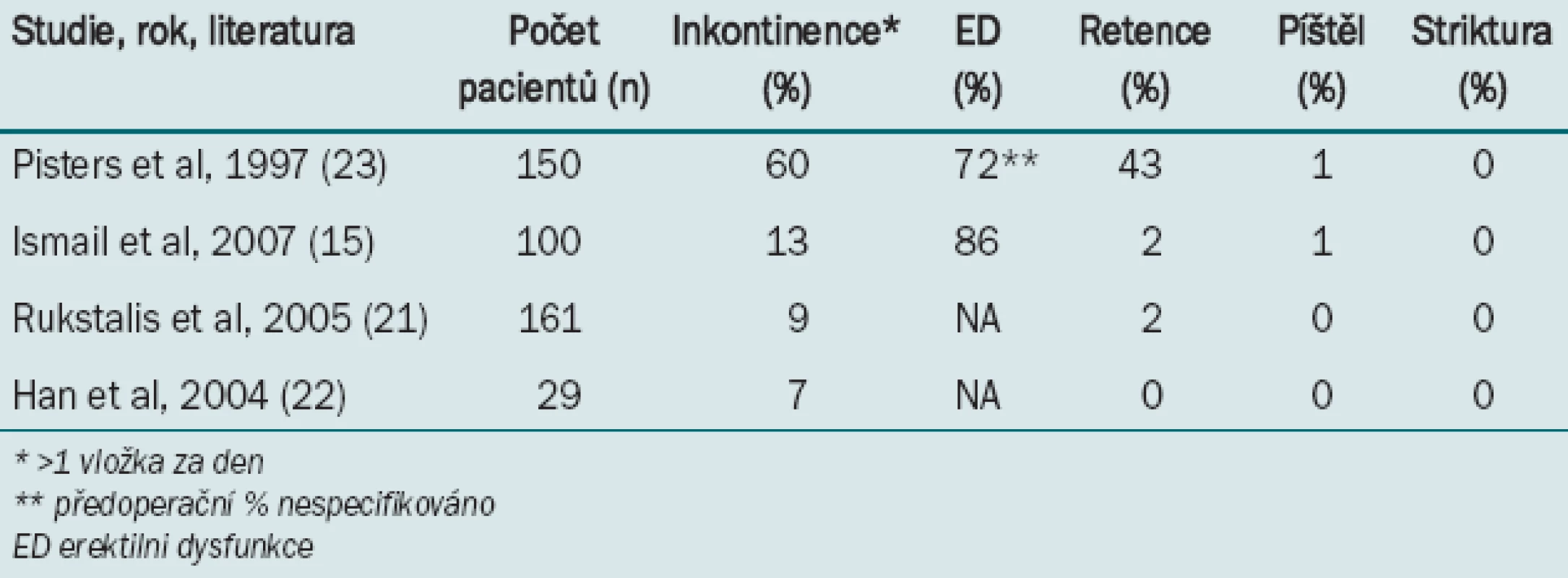
Výsledky kryoterapie u pacientů, u nichž došlo k selhání operační léčby RRP (radikální retropubické prostatektomie), jsou povzbudivé. Jedna ze studií uvádí 40% míru biochemické úspěšnosti léčby (selhání bylo definováno jako zvýšení hladiny PSA > 0,1 ng/ml nad nadir). Pouze u 20 % pacientů bylo v průběhu dvacetiměsíčního sledování (rozmezí 4–32 měsíců) zaznamenáno zhoršení močové inkontinence (po RRP) [15]. U všech pacientů, u nichž byly zaznamenány příznivé výsledky, byla před kryoterapií přítomna malá recidivující léze o velikosti < 1 cm (Gleasonovo skóre ≤ 6).
Záchranná terapie po selhání radioterapie představuje běžnou indikaci pro kryoablaci zejména díky snadné aplikaci léčby (ve srovnání s otevřenou záchrannou operací). Výsledky kryoterapie jako záchranné léčby jsou uvedeny v tab. 3. Nízká morbidita spojená s kryoterapií (ve srovnání s otevřenou záchrannou operací) představuje pro řadu pacientů, u nichž selhala léčba pomocí ozařování, lákavou možnost. Kryoterapie navíc umožňuje pacientům, u nichž došlo k selhání RRP nebo laparoskopické prostatektomie, vyhnout se ozařování [15]. Tato technika je užitečná zejména při léčbě lokálně pokročilého onemocnění zasahujícího semenné váčky, které lze přesně zaměřit pomocí transrektálního ultrazvuku. Kryoterapie má oproti ozařování zevním paprskem obrovskou výhodu, protože ani u pacientů s vysokým rizikem není nutná hormonální léčba.
Tab. 3. Výsledky (doba přežití bez chemické recidivy) záchranné kryoterapie u pacientů, u nichž došlo k selhání radioterapie. Stratifikováno podle stupně rizika. 
Je zřejmé, že zdokonalení technologie s sebou přineslo i zlepšení výsledků záchranné kryoterapie. Kromě kryoterapie a fokusovaného ultrazvuku o vysoké intenzitě mají pacienti s karcinomem prostaty, u nichž selhala operační léčba či radioterapie, pouze omezené možnosti léčby. Míra výskytu inkontinence a závažných komplikací je po kryoterapii nízká s výjimkou ED, kterou však pacient často trpí již před zahájením kryoablace [19].
VLASTNÍ ZKUŠENOSTI A METODY
V naší instituci – Sunderland Royal Hospital (Sunderland, Velká Británie) – se léčbou karcinomu prostaty pomocí kryoablace zabýváme již od roku 2003. Tuto techniku provádíme jak v rámci primární léčby, tak jako záchrannou terapii u pacientů s onemocněním ve stadiu T1–T3 (včetně pacientů s vysokým rizikem, na základě definice ASTRO, Gleasonovo skóre 8–10, PSA > 20 ng/ml nebo obojí). Používáme přístroje třetí generace – Presice a SeedNet (Galil Medical) – které užívají k mrazení argon. V současné době upřednostňujeme užívání kryosond IceRods vzhledem k jejich malé velikosti a schopnosti vytvořit ice-ball o velkém průměru. Výběr kryosondy však závisí na velikosti prostaty (která je stanovena během operace pomocí ultrazvuku). Při léčbě prostaty s podélnou délkou ≥ 27 mm užíváme IceRods, zatímco při léčbě menší prostaty upřednostňujeme systém SeedNet. Výkon obvykle vyžaduje zavedení 6–8 sond, skutečný počet se však určuje na základě velikosti prostaty.
Schéma 1 zobrazuje kryoterapeutický výkon. Jednoduché i vícečetné termočlánky monitorují teplotu v prostatě a přilehlých tkáních jako je uretrální sfinkter a rektum (Denonvilliersova fascie). Operační tým sestává z anesteziologa, operatéra, instrumentářky a ostatního zdravotnického personálu („obíhajícího“ personálu). Operatér ovládá kryoblační systém přes sterilní roušku. Po zavedení kryojehly v celkové anestezii před zahájením vlastního výkonu provedeme flexibilní cystoskopii, čímž se ujistíme o tom, že žádné jehly nejsou viditelné. Následně zavedeme přes drátěný vodič uretrální zahřívací katetr. Monitorování pacienta provádí operatér a speciálně vyškolená sestra.
Schéma 1. Snímek zachycuje kryoablační výkon při užití systému Presice (Galil Medical, Yokneam, Izrael). Pacient je umístěn v litotomické poloze, in situ rektálně je zavedena bi-planární ultrazvuková sonda (Hitachi Medical Systems America, Inc, Twinsburg, OH, USA) a zahřívací uretrální katetr. Zobrazené jehly jsou IceRods (Galil Medical) a multisensorické jehly snímající teplotu. 
Po dvou cyklech mrazení/tání je minimálně na 30 min zaveden zahřívací uretrální kater, který posléze nahradíme 16Ch dvojcestným Foleyho katerem. Při odstraňování kryosond a tepelných senzorů stlačíme oblast perinea po dobu 5 minut. Všichni pacienti noc před výkonem podstoupí přípravu střeva, čímž optimalizujeme kvalitu zobrazení transrektálním ultrazvukem. V naší běžné praxi ponecháváme katetr zavedený po dobu dvou týdnů, obvykle močovou trubicí. V některých centrech je katetr ponechán po dobu čtyř dnů, zatímco jiná centra preferují zavedení suprapubického katétru. Nemáme však k dispozici žádné důkazy, které by prokazovaly speciální benefit kteréhokoliv z přístupů. Po ukončení hospitalizace pacienti užívají po dobu jednoho týdne ciprofloxacin (500 mg dvakrát denně) a tamsulosin XL (400 µg jednou denně) po dobu jednoho měsíce. Během prvního týdne po výkonu pacienti obvykle udávají pouze mírný dyskomfort v oblasti perinea. V průběhu prvních 12 měsíců provádíme měření hladiny PSA a symptom skóre jednou za tři měsíce, následně v půlročních intervalech. V případě zvýšení hladiny PSA je indikována opakovaná biopsie prostaty a ve vhodných případech další kryoterapie.
V naší první publikované studii týkající se kryoterapie s využitím systému třetí generace (celkem 51 pacientů) podstoupilo 31 pacientů primární kryoterapii, 17 pacientů záchrannou kryoterapii po ozařování zevním paprskem (n = 14) nebo brachyterapii (n = 3) a 3 po selhání hormonální léčby [20]. U pacientů podstupujících primární léčbu byla střední hodnota PSA 9 ng/ml, střední věk 64 let, u pacientů podstupujících záchrannou léčbu byla střední hodnota PSA 7ng/ml, střední věk 66 let. Biochemická recidiva byla definována na základě ASTRO kritérií – 3 po sobě jdoucí zvýšení koncentrace PSA. V obou skupinách pacientů podstupujících primární léčbu (s nízkým a vysokým rizikem) byla zaznamenána 60% míra přežití 1 rok bez biochemické recidivy. Ve skupině pacientů podstupujících záchrannou léčbu nebyla v 17 % případů pozorována žádná odpověď, u 67 % pacientů nedošlo po jednom roce k biochemické recidivě. Co se týče výskytu komplikací, u 7 % pacientů došlo ke vzniku močové retence, která vyžadovala katetrizaci, u 4 % byla zaznamenána inkontinence vyžadující užití vložek. Erektilní dysfunkce byla přítomna u 55 % (před terapií) a 70 % (po terapii) pacientů podstupujících primární léčbu a 94 % (před terapií) a 100 % (po terapii) pacientů podstupujících záchrannou terapii.
Do naší druhé publikované studie bylo zařazeno 49 případů primární kryoterapie a 42 případů záchranné kryoterapie [21]. Průměrný věk pacientů byl 63,7 let, průměrná hladina PSA 14,6 ng/ml (rozmezí 2,2–48,7 ng/ml). Po šesti měsících byla u 64 % pacientů, kteří podstoupili primární léčbu, zaznamenána hladina PSA < 0,5 ng/ml, po roce se hladina stabilizovala u 59 %. 56 % pacientů (z těch, u nichž máme k dispozici údaje dlouhodobého sledování) mělo po třech letech hladinu PSA < 2 ng/ml. 59 % pacientů, kteří podstoupili záchrannou léčbu, dosáhli po šesti měsících PSA < 0,5 ng/ml, zatímco 61 % pacientů dosáhlo této hodnoty po jednom roce. 70 % pacientů (u nichž máme údaje dvouletého sledování) mělo hladinu PSA < 2 ng/ml. Hormonální terapie nebyla po výkonu indikována u žádného z pacientů, před výkonem pouze u několika vybraných případů vyžadujících záchrannou terapii. Je třeba zdůraznit, že u řady pacientů podstupujících primární kryoterapii bylo na základě Gleasonova skóre, stadia tumoru a hladiny PSA detekováno onemocnění s vysokým rizikem [21].
Uvedené případy selhání mohly být zapříčiněny podhodnocením stadia onemocnění při MRI nebo kostním skenu a přítomností mikrometastazujícího onemocnění v době léčby. Nejnáročnější úkol týkající se kryoablační léčby spočívá v přesném určení stadia onemocnění, zejména u pacientů po radioterapii. Omezená specifita a senzitivita kostního skenu a MRI znesnadňuje správný výběr terapie. Před volbou přístupu, jakým je například kryoterapie, u pacientů s vysokým rizikem se doporučuje provedení lymfadenektomie s cílem přesného určení stadia onemocnění. Rozšířená aplikace hormonální léčby spolu s radioterapií znesnadňují u pacientů, u nichž dojde po léčbě ozářením ke zvýšení hladiny PSA, rozlišit lokální recidivu od onemocnění, které se vymklo hormonální kontrole. Při léčbě onemocnění, které se vymklo hormonální kontrole, je lokální léčba zcela nevhodná, tato skutečnost je však patrná teprve po ukončení hormonální léčby.
KAM SMĚŘOVAT V BUDOUCNOSTI
Spolu se zdokonalováním technologií jsou vyvíjeny nové strategie, jako je například fokální kryoterapie. Princip fokální terapie spočívá v léčbě samotného karcinomu bez zasažení benigní tkáně, a tedy minimalizaci výskytu vedlejších účinků. Fokální léčba nabízí nové možnosti pro léčbu karcinomu prostaty při menším poškození tkáně. Účinnost tohoto přístupu je však nutné potvrdit v klinických studiích. Pokud se fokální terapie prokáže jako efektivní, může se z kryoterapie stát léčba preferovanější před radioterapií a operační léčbou.
ZÁVĚR
Kryoablace je stále se ještě vyvíjející technikou. Nejnovější poznatky umožnily přesné zavádění sondy a monitorování procesu mrazení. V rámci primární léčby lze kryoterapii provést rychle, při minimálním poškození pacienta. Míra výskytu vedlejších účinků je srovnatelná s údaji uváděnými při radioterapii a otevřené operaci (s výjimkou ED). V současné době se začíná prokazovat také dlouhodobá účinnost této léčby.
V rámci záchranné léčby činí nízká míra morbidity (ve srovnání se záchrannou operací po selhání radioterapie) z kryoterapie pro řadu pacientů lákavou alternativu. Pacientům, u nichž došlo k selhání otevřené operace, navíc umožňuje vyhnout se léčbě ozařováním. Nejnáročnějším úkolem však nadále zůstává přesné určení stadia, zejména u pacientů po radioterapii.
Kryoablace představuje účinnou terapeutickou modalitu pro léčbu lokalizovaného a lokálně pokročilého karcinomu prostaty. Dále se začíná užívat jako léčba volby pro pacienty, u nichž dojde po radioterapii k recidivě tumoru.
Toby Page, BSc, MBBS, MRCS, PhD,
Damien Greene, MB, BCh, BAO, FRCSI, FRCS(urol)
Sunderland Royal Hospital,
Sunderland, UK
Zdroje
1. Arnott J. Practical illustrations of the remedial efficacy of a very low or anaesthetic temperature. I. In cancer. Lancet 1850; 2 : 257–259.
2. Cooper IS, Lee AS. Cryostatic congelation: a system for producing a limited controlled region of cooling or freezing of biological tissue. J Nerv Ment Dis 1961; 133 : 259–260.
3. Soanes WA, Gonder MJ. Use of cryosurgery in prostate cancer. J Urol 1968; 99 : 793–797.
4. Megalli MR, Gursel EO, Veenema RJ. Closed perineal cryosurgery in prostatic cancer. New probe and technique. Urology 1974; 4 : 220–222.
5. Onik GM, Cohen JK, Reyes GD et al. Trans rectal ultrasound guided percutaneous radical cryosurgical ablation of the prostate. Cancer 1993; 72 : 1291–1299.
6. Gowardhan B, Greene D. Cryotherapy for the prostate: an in vitro and clinical study of two new developments; advanced cryoneedles and a temperature monitoring system. BJU Int 2007 : 100; 295–303.
7. Whittaker D. Mechanisms of tissue destruction following cryosurgery. Ann R Coll Surg Engl 1984; 66 : 313–318.
8. Nagle WA, Soloff BL, Moss AJ Jr et al. Cultured Chinese hamster cells undergo apoptosis after exposure to cold but nonfreezing temperatures. Cryobiology 1990; 4 : 439–451.
9. Escudero Barrillero A, Arias Funez F, Rodriguez-Patron Rodriguez R et al. Cryotherapy III, bibliographic review. Our experience(II). Arch Esp Urol 2005; 58 : 1003–1029.
10. Polascik TJ , Nosnik I, Mayes JM et al. Short-term cancer kontrol after primary cryosurgical ablation for clinically localized prostate cancer using third-generation cryotechnology. Urology 2007; 70 : 117–121.
11. Donnelly BJ, Saliken JC, Ernst DS et al. Prospective trial of cryosurgical ablation of the prostate: five year results. Urology 2002; 60 : 645–649.
12. Jones JS, Donelly BJ, Pisters LL et al. Primary prostate cryoablation: results from 1198 patients tracked with the cold registry. AUA Annual Meeting 2007; Abstr 1773.
13. Donelly BJ, Saliken J. A randomized controlled trial comparing external beam radiation and cryoablation in localized prostate cancer. AUA Annual Meeting 2007; Abstr 1141.
14. Bahn DK, Lee F, Badalament R et al. Targeted cryoablation of the prostate: 7-year outcomes in primary treatment of prostate cancer. Urology 2002; 60(2 Suppl 1): 3–11.
15. Siddiqui SA, Mynderse LA, Zincke H et al. Treatment of prostate cancer local recurrence after radical retropubic prostatectomy with 17-gauge interstitial transperineal cryoablation: initial experience. Urology 2007; 70 : 80–85.
16. Ismail M, Ahmed S Kastner C et al. Salvage cryotherapy for recurrent prostate cancer after radiation failure: a prospective case series of the first 100 patients. BJU Int 2007; 100 : 760–764.
17. Pisters LL, Perrotte P, Scott SM et al. Patient selection for salvage cryotherapy for locally recurrent prostate cancer after radiation therapy. J Clin Oncol 1999; 17 : 2514–20.
18. Lee F, Bahn DK, McHugh TA et al. Cryosurgery of prostate cancer. Use of adjuvant hormonal therapy and temperature monitoring a one year follow up. Anticancer Res 1997; 17 : 1511–1515.
19. Perrotte P, Litwin MS, McGuire EJ et al. Quality of life after salvage cryotherapy: the impact of treatment parameters. J Urol 1999; 162 : 398–402.
20. Cresswell J, Asterling S, Chaudhary M et al. Third-generation cryotherapy for prostate cancer in the UK: a prospective study of the early outcomes in primary and recurrent disease. BJU Int 2006; 97 : 969–974.
21. Gowardhan B, Thomas B, Asterling S et al. Cryosurgery for prostate cancer, experience with third-generation cryosurgery and novel developments in the field. Eur Urol Suppl 2007; 6 : 516–20.
22. Rukstalis DB, Katz AE, editors. Handbook of Urologic Cryoablation. London, UK: Informa Ltd, 2007.
23. Han KR, Belldegrum A. Third-generation cryosurgery for primary and recurrent prostate cancer. BJU Int 2004; 93 : 14–18.
24. Pisters LL, Von Eschenbach AC, Scott SM et al. The efficacy and complications of salvage cryotherapy of the prostate. J Urol 1997; 157 : 921–925.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2009 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Terapeutické možnosti pro léčbu pokročilého karcinomu prostaty. Řešení lokálně pokročilého na androgenech dependentního karcinomu prostaty
- Kryoterapie – současný stav
- Záchranná kryoterapie
- Stanovení stadia a grade BPH u pacientů se symptomy dolních cest močových (LUTS): patofyziologická klasifikace pro další postup
- Úvodní slovo
- Využití holmium laseru při léčbě benigního zvětšení prostaty
- Fotoselektivní vaporizace prostaty (PVP) pomocí laseru GreenLight. Přístup, operační technika a výsledky dosažené v Mayo Clinic
- Postavení radikální prostatektomie v léčbě karcinomu prostaty lokalizovaného na prostatickou žlázu. Realita a mýty, pravda a fikce o roboticky asistované radikální prostatektomii
- Ze zahraničních periodik
- GUIDELINES EAU PRO BENIGNÍ HYPERPLAZII PROSTATY
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití holmium laseru při léčbě benigního zvětšení prostaty
- Fotoselektivní vaporizace prostaty (PVP) pomocí laseru GreenLight. Přístup, operační technika a výsledky dosažené v Mayo Clinic
- GUIDELINES EAU PRO BENIGNÍ HYPERPLAZII PROSTATY
- Kryoterapie – současný stav
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



