-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Novinky v léčbě periferních T-buněčných lymfomů v podmínkách České republiky
What is new in the treatment of peripheral T-cell lymphomas in the Czech Republic
Peripheral T-cell lymphomas (PTCL) belong to the group of non-Hodgkin’s lymphomas, characterized by considerable heterogeneity and, compared to B-lymphomas, by poorer treatment response, limited treatment options, and high mortality. Statistical data concerning patients with PTCL, including those collected in the Czech Republic, clearly point to the necessity of searching for new strategies to improve the prognosis of patients with PTCL. The heterogeneity of T-lymphomas and the lack of understanding of their pathogenesis have led to inaccurate and imperfect diagnoses and insufficient development of targeted and effective treatments. The spectrum of newly identified genomic defects affecting the correct function of T-cell signalization, which plays a key role in the pathogenesis of PTCL, is broadening. Thus, there is hope for the potential discovery of new therapeutic agents and the development of new targeted treatment strategies, which are currently intensively tested on preclinical models and in clinical studies. New therapeutic agents, their use in routine clinical practice, and their combination with already-established therapeutic strategies could represent key factors in improving the outcomes of patients with PTCL.
Keywords:
peripheral T-lymphomas – brentuximab vedotin – HDAC inhibitors – ALK inhibitors
Autoři: M. Filipová; A. Janíková
Působiště autorů: Interní hematologická a onkologická klinika FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 4, p. 227-239.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2023prolekare.cz18Souhrn
Periferní T-lymfomy (PTCL) jsou skupinou non-Hodgkinových lymfomů, vyznačující se značnou heterogenitou a ve srovnání s B-lymfomy horší léčebnou odpovědí, limitovanou léčebnými možnostmi a vysokou mortalitou. Statistické údaje týkající se pacientů s PTCL, vč. těch shromážděných na území České republiky, jednoznačně poukazují na nezbytnost pátrání po nových strategiích směrujících ke zlepšení prognózy pacientů s PTCL. Heterogenita T-lymfomů a nedostatečné porozumění jejich patogenezi dosud podmiňují jak jejich nepřesnou a nedokonalou diagnostiku, tak i nedostatečný rozvoj cílených účinných léčebných postupů. V současnosti se významně rozšiřuje spektrum nově identifikovaných genomických defektů ovlivňujících správné fungování T-buněčných signálních drah, které mají klíčovou roli v patogenezi PTCL. Tato skutečnost představuje naději v objevování nových potenciálních léčebných cílů a pro rozvoj nových cílených léčebných strategií, které jsou v současnosti intenzivně testovány na preklinických modelech a v klinických studiích. Nová cílená léčiva, jejich zařazení do standardní klinické praxe a kombinování s již existujícími léčebnými postupy mohou být klíčovým prostředkem ke zlepšení léčebných výsledků u pacientů s PTCL.
Klíčová slova:
periferní T-lymfomy – brentuximab vedotin – HDAC inhibitory – ALK inhibitory
ÚVOD
Periferní T-buněčné lymfomy (peripheral T-cell lymphomas – PTCL) představují extrémně heterogenní skupinu lymfoproliferativních onemocnění s různým morfologickým obrazem a klinickým chováním. Čtvrtá revize klasifikace hematologických a lymfoidních novotvarů WHO z roku 2016 rozeznává přes 30 definitivních a provizorních podtypů zralých T-buněčných non-Hodgkinových lymfomů (tab. 1) a recentně publikovaná 5. revize jich obsahuje ještě o šest více [1]. Z praktického pohledu lze na základě dominující klinické manifestace PTCL zjednodušeně rozdělit na formy kožní (např. mycosis fungoides, Sézaryho syndrom), extranodální (např. extranodální NK/ /T-lymfom, nazální typ, hepatosplenický T-lymfom, enteropatický T-lymfom), nodální (např. periferní T-lymfom blíže neurčený (peripheral T-cell lymphoma not otherwise specified – PTCL-NOS), anaplastický velkobuněčný lymfom (anaplastic large cell lymphoma – ALCL), angioimunoblastický T-buněčný lymfom (AITL) a leukemické formy (např. adultní T-leukemie/lymfom) [2]. Na rozdíl od B-non-Hodgkinových lymfomů jsou PTCL poměrně vzácné a jejich incidence se mění v závislosti na geografické poloze a etnickém pozadí. V České republice představují PTCL ročně asi kolem 7 % ze všech de novo diagnostikovaných systémových non-Hodgkinových lymfomů [3].
V Evropě a USA nejčastější histologické subtypy PTCL představují PTCL-NOS, který je diagnostikován asi v 32–45 % případech, ALCL představující 24–30 % případů a AITL odpovídající 7–19 % případům ze všech PTCL [4–6]. Pro srovnání v ČR je zastoupení hlavních typů lymfomů 36 % pro PTCL-NOS, cca 30 % pro ALCL a 7 % pro AITL [3].
Dosud neexistuje zlatý standard léčby u pacientů s nově diagnostikovaným PTCL. Úvodní léčba (léčba první linie) je obvykle založena na léčebných režimech odvozených od kombinací používaných u agresivních B-lymfomů, a to i přes odlišnou biologii a průběh onemocnění. Tzv. CHOP-like chemoterapeutické režimy (cyklofosfamid, doxorubicin, vinkristin, prednison) jsou celosvětově nejčastější volbou první linie léčby [7–9]. U mladších nemocných (< 60 let) lze indukční léčbu intenzifikovat doplněním o etoposid (CHOEP) s příznivým efektem na celkové přežití (overall survival – OS) [3,10]. U pacientů v remisi také může být podána vysokodávkovaná konsolidace s autologní transplantací periferních kmenových buněk. Reálný přínos je stále předmětem diskuzí, navíc se této léčby dle retrospektivních dat v ČR reálně dočká pouze 10–20 % pacientů s PTCL. Celková léčebná odpověď na léčbu první linie se pohybuje mezi 66 až 74 % [3]. Pětileté OS je pro celou skupinu PTCL zhruba 30–40 % a přežití bez progrese (progression free survival – PFS) 2–30 % [5,11–13]. Pro srovnání je 5leté OS u pacientů s difuzním velkobuněčným lymfomem (DLBCL) po standardní léčbě v první linii kolem 60–70 % a PFS v rozmezí 50–85 % v závislosti na stádiu nemoci [14,15]. Jedinou podskupinou s výrazně lepší prognózou se jeví ALK-pozitivní ALCL (5leté OS cca 70–80 %), nicméně i u tohoto podtypu bylo pětileté celkové přežití pacientů ve věku nad 40 let, případně u pacientů s nepříznivými prognostickými faktory (mezinárodní prognostické skóre, tj. international prognostic score – IPI, nad 2) nižší než 50 % [11]. Většina pacientů nedosáhne remise ani po několika liniích léčby, asi u 70 % pacientů s PTCL dochází k relapsu nemoci po první linii léčby, nebo je nemoc na léčbu primárně refrakterní. U těchto pacientů lze očekávat další nepříznivý vývoj s přežitím v řádu několika málo měsíců [16,17].
Medián věku v době diagnózy PTCL je cca 60 let a zhruba 30 % pacientů je starších 70 let, což znamená, že pro velkou část pacientů není v důsledku věku a s tím souvisejících komorbidit únosné podání intenzivní léčby na bázi chemoterapie [18]. Vysoká heterogenita a celkově mnohem nižší incidence T-lymfomů ve srovnání s B-lymfomy vede k horší dostupnosti nově testovaných léčiv v rámci klinických studií. Dle údajů aktuálních k 1. 7. 2022 na stránkách www.clinicaltrial.gov bylo zahájeno cca 2 800 klinických studií u B-lymfomů (cca 1 100 ukončeno) a asi 1 100 klinických studií u T-lymfomů (cca 590 ukončeno). Snaha testovat nová léčiva je tedy značná, bohužel až dosud s nepatrným posunem. Přehled dosud proběhlých studií III. fáze u pacientů s PTCL je dostupný v tab. 2.
V tomto článku se budeme zabývat především přehledem nových léčebných možností vč. látek v pokročilých fázích klinických studií u nejčastějších subtypů systémových PTCL, a sice PTCL-NOS, AITL a ALCL, které v ČR dohromady tvoří asi 75 % všech nově diagnostikovaných systémových T-lymfomů.
Neboť v průběhu tvorby rukopisu došlo k publikaci 5. revize WHO klasifikace tumorů hematopoetického a lymfoidního systému, jsou na relevantních místech textu uvedeny komentáře k oběma klasifikacím.
Tab. 1. Srovnání 4. a 5. WHO klasifi kace T-lymfoidních malignit [1]. ![Srovnání 4. a 5. WHO klasifi kace T-lymfoidních malignit [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/17482157c6da4fce678c6e1bda349d43.png)
Tab. 2. Přehled proběhlých studií III. fáze u pacientů s PTCL. 
PATOGENEZE A KLASIFIKACE T-LYMFOMŮ
Periferní T-lymfomy, v literatuře též často označované jako zralé T-buněčné lymfomy (mature T-cell lymphomas – MTCL), vznikají ze zralých post-thymických lymfocytů, přičemž většina z nich se vyvíjí z ab T-lymfocytů. Lymfomy pocházející z gd T-buněk jsou extrémně vzácné a vyskytují se převážně v extranodálních lokalitách [2]. Normální T-lymfocyty jsou schopny pružné modulace svého fenotypu na základě různých podnětů z prostředí. Analogicky i PTCL mohou získat jedinečný fenotyp jak na základě získaných somatických mutací modulujících aktivitu některých transkripčních faktorů, tak i na podkladě cytokiny zprostředkované plasticity a vlivu dalších signálů z mikroprostředí tumoru [19].
Morfologická diagnostika T-lymfomů je i v současnosti považována za jednu z nejobtížnějších v hematopatologii. Aktuální klasifikace T-lymfomů je založena na klinicko-patologických známkách, imunohistochemii a známých genetických znacích. Nové technologie výzkumu genových expresních profilů (GEP) a celogenomového sekvenování umožnily hlubší analýzu transkriptomu jednotlivých podtypů PTCL. Tyto metody umožňují rozlišování mezi jednotlivými podtypy PTCL, doplňují morfologickou klasifikaci a napomáhají porozumět patogenezi PTCL. I když je zatím využití metod typu GEP a sekvenování nové generace (next generation sequencing – NGS) v klinické praxi limitované, lze tyto poznatky využít při definování diagnostických a prognostických skupin a cílené léčebné strategie [20].
Angioimunoblastický T-lymfom (AITL) / nodální T-lymfom z folikulárních pomocných buněk
Úprava WHO klasifikace z roku 2016 (tab. 1) vytvořila novou provizorní podjednotku – „nodální PTCL s fenotypem folikulárních pomocných T-buněk (TFH) “, která obsahuje AITL, spolu s dvěma novými podjednotkami – folikulární T-buněčný lymfom (FTCL) a PTCL s T-folikulárním fenotypem. V recentní 5. revizi WHO klasifikace je definována jako jednotka nodální T-lymfom z folikulárních pomocných buněk, která nyní obsahuje tři typy: 1. angioimunoblastický, 2. folikulární a 3. typ NOS (not otherwise specified; blíže nespecifikovaný).
Podobnost TFH buněk s maligními buňkami AITL byla prokázána pomocí genových expresních profilů a je zřejmá i na základě imunofenotypových charakteristik. Tzv. TFH fenotyp je definován expresí alespoň dvou (lépe však tří) typických znaků. Mezi nejčastěji využívané patří CD10, Bcl6, CXCL13, PD1 a ICOS. Analýza genových expresních profilů prokázala nejen souvislost buněk AITL s TFH buňkami, ale odhalila i přítomnost rekurentních mutací TET2, IDH2, DNMT3A a RHOA, které se podílejí na epigenetické regulaci a patogenezi rodiny TFH-lymfomů, a představují tak potenciální terapeutické cíle [21]. Mutace vedoucí ke ztrátě funkce v genech podílejících se na epigenetické regulaci DNA a metylaci histonů (zejména TET2 a/nebo DNMT3A) jsou přítomny u ~80 %, respektive ~30 % případů, přičemž přibývá důkazů, které ukazují, že AITL/TFH se vyvíjejí na pozadí myelopoézy [2,21].
Anaplastický velkobuněčný lymfom
Anaplastický velkobuněčný lymfom (anaplastic large cell lymphoma – ALCL) se již tradičně dělí na základě přítomnosti nebo chybění kinázy anaplastického lymfomu (anaplastic lymphoma kinase – ALK) – receptorové tyrozinkinázy na ALK+ a ALK – ALCL. ALK se jeví především jako molekulární marker odlišné patogeneze ALCL, avšak patrně nenese sám o sobě žádný prognostický význam [22]. Z ALK – ALCL se vydělují ALK – ALCL asociované s prsními implantáty (breast implant associated-ALCL – BIA-ALCL [1]), čtvrtou podjednotkou je potom exkluzivně kožní ALCL. Metody GEP umožnily další stratifikaci systémového ALK – ALCL např. na základě aberantní exprese ERBB4 nebo cílových genů STAT3. Rekurentní chromozomální přestavby zahrnující DUSP22-IRF4 byly asociovány s příznivější prognózou ALK – ALCL, zatímco změny zahrnující TP63 byly asociovány s agresivním klinickým chováním lymfomu a špatnými léčebnými výsledky [2,21].
Periferní T-lymfom jinak nespecifikovaný (peripheral T-cell lymphoma not otherwise specified – PTCL-NOS)
Početná skupina PTCL-NOS vzniká po vyloučení jiných typů T-lymfomů. V diferenciální diagnóze stojí nejblíže nodální T-lymfom z folikulárních pomocných buněk, který byl z PTCL-NOS vyňat na základě rozdílů v imunofenotypu a mutačním profilu. Pomocí GEP lze v rámci PTCL-NOS identifikovat dvě prognosticky odlišné skupiny charakterizované transkripčním programem Th1 a Th2 buněk. První skupina je typická vysokou mírou exprese transkripčního faktoru GATA3 a jeho dalších cílových genů (CCR4, IL18RA, CXCR7, IK). Tyto změny jsou nalézány přibližně u 33 % případů PTCL-NOS [20]. GATA3 je hlavním regulátorem Th2 diferenciace, komplexní genotyp u pacientů s nadměrnou expresí GATA3 navíc bývá spojen také se ztrátou tumor supresorových genů, které jsou součástí signálních drah CDKN2A/B-TP3 a PTEN-PI3K. U této podskupiny je častým nálezem i amplifikace STAT3 a MYC. Klinicky jsou tyto rysy asociovány s agresivní povahou nemoci a nepříznivou prognózou [23,24]. Pro druhou skupinu je typická zvýšená exprese transkripčních faktorů TBX21, EOMES a jejich cílů. TBX21 je hlavním regulátorem diferenciace Th1 lymfocytů a cytotoxických T-lymfocytů, přičemž tato skupina je spojená s lepší prognózou a mírnějším biologickým chováním. Podobně jako u AITL byly také u PTCL-NOS pozorovány mutace epigenetických regulátorů, a to u obou výše uvedených podskupin. Mutace regulátoru metylace se vyskytuje ve skupině GATA3 i TBX21 s přibližně stejnou frekvencí, ve druhé z uvedených podskupin však byly navíc častěji pozorovány mutace TET1, TET3 a DNMT3A [13].
NOVÁ POTENCIÁLNÍ LÉČIVA
Neuspokojivé léčebné výsledky u pacientů s T-lymfomy, zejména u těch, kteří nedosáhli dostatečné léčebné odpovědi nebo zrelabovali, motivují hledání nových léků. Látky jako např. anti-CD30 imunokonjugáty, antifoláty a určité inhibitory histonových deacetyláz (HDACi) jsou již registrovány v některých zemích v různých indikacích PTCL. V následující kapitole přinášíme přehled potenciálně efektivních léčiv použitelných v léčbě PTCL (tab. 3, obr. 1).
Léky cílené na povrchové receptory buňky
Anti-CD30 konjugovaná monoklonální protilátka
CD30 je transmembránový protein patřící do rodiny TNFR (tumor necrosis factor receptor; receptor tumor nekrotického faktoru), který byl původně identifikován jako povrchový znak Reedové-Sternbergových a Hodgkinových buněk u klasického Hodgkinova lymfomu [25]. CD30 má široké spektrum funkcí, lze jej identifikovat na aktivovaných B, T-
lymfocytech i NK buňkách a zúčastňuje se procesu imunitní odpovědi T-lymfocytů vč. stimulace T-buněčného receptoru (T-cell receptor – TCR;). Mezi T-lymfomy je CD30 pravidelně a silně exprimován u ALCL, v menší míře a méně pravidelně i u jiných T-lymfomů, vč. AITL a PTCL-NOS [26]. CD30 exprimuje i část difúzních velkobuněčných B-lymfomů [27]. Samotná exprese CD30 na povrchu nádorových buněk se nezdá mít žádný prognostický význam [22].
Zatímco samotná anti-CD30 protilátka (analogicky k anti-CD20) neměla u CD30+ T-lymfomů žádnou významnou účinnost, imunokonjugát brentuximab vedotin (BV) s monomethylauristatinem E (MMAE) měl účinnost velmi dobrou. MMAE je v podstatě látka fungující podobně jako vinkristin. Rozrušuje mikrotubulární aparát buněk a tím interferuje s buněčným cyklem a indukuje apoptózu [28,29]. Na základě výsledků studie fáze II (SGN-35) byl brentuximab vedotin schválen k použití u relabovaných nebo refrakterních ALCL (i v České republice). Kombinace BV s chemoterapií (CHP – cyklofosfamid, doxorubicin, prednison), zkoušená v rámci studie fáze III v první linii léčby CD30+ T-lymfomů přinesla poprvé v historii lepší výsledky (PFS, OS) než standardní CHOP. Medián PFS byl 48,2 měsíce ve skupině léčené kombinací BV-CHP, ve skupině, která dostávala standardní CHOP jen 20,8 měsíce. Nežádoucí účinky vč. incidence febrilní neutropenie a periferní neuropatie byli mezi skupinami srovnatelné, fatální nežádoucí účinky byly zaznamenány u 3 % pacientů léčených BV-CHP a 4 % ve skupině léčené CHOP [30]. Na základě výsledků této studie (ECHELON-2) je schváleno podání BV-CHP v první linii léčby u CD30 pozitivních T-lymfomů [30]. Je nutné poznamenat, že studie ECHELON-2 má své limitace v interpretaci výsledků. Ve studii byla signifikantní převaha pacientů s ALCL (70 %) vč. neobvykle vysokého zastoupení prognosticky příznivějšího podtypu ALK+ ALCL (22 % pacientů), což neodpovídá zastoupení těchto podskupin v běžné populaci (ALCL 30 %; ALK+ ALCL 5–8 % u dospělé populace systémových T-lymfomů), studie také selektovala pacienty v celkově lepším klinickém stavu (78 % pacientů ECOG 0–1) [22,30].
Několik recentních studií na menších skupinách pacientů analyzuje BV v kombinaci s jinou chemoterapií, např. BV-CHEP (cyklofosfamid, doxorubicin, etoposid, prednison), BV-ICE (ifosfamid, karboplatina, etoposid) nebo BV-DHAP (cisplatina, cytosinarabinosid, dexamethason). Jejich výsledky se jeví po stránce bezpečnosti i účinnosti jako slibné [31–34]. V ČR je aktuálně dostupná takováto akademická studie pro dospělé pacienty s nově diagnostikovaným CD30 pozitivním PTCL zaměřená na efektivitu kombinace BV-CHEP v první linii (NCT05006664).
Tab. 3. Souhrn vybraných léků uváděných v textu, jejich indikace u PTCL a dostupnost v ČR. 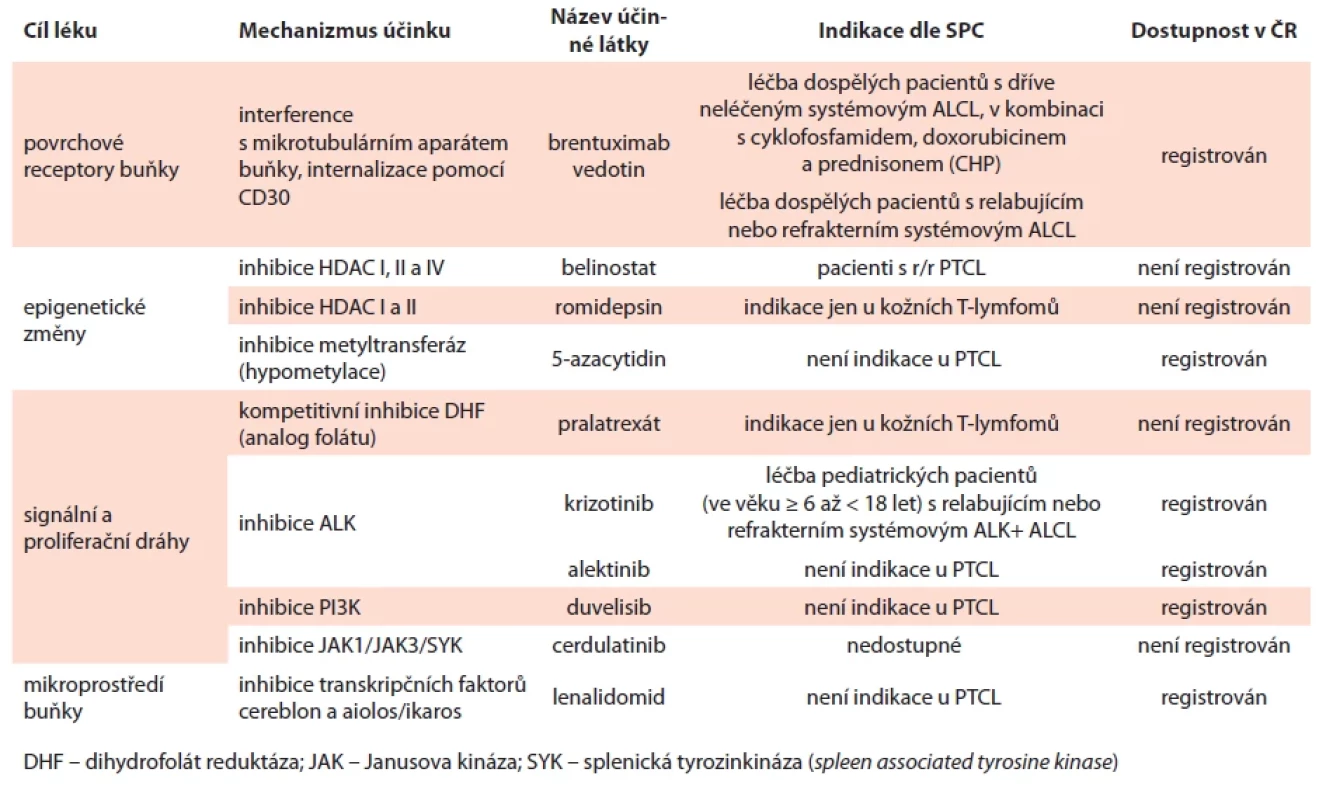
Obr. 1. Cíle moderních léků a mechanizmus jejich účinku v buňce [21]. ![Cíle moderních léků a mechanizmus jejich účinku v buňce [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6ac777a9a3f674f843b3f9844eb8e898.png)
AKT – proteinkináza B; DNMT – DNA metyltransferáza; ICOS – indukovatelný T buněčný kostimulátor (inducible T-cell costimulator); JAK – Janusova kináza; mTOR – savčí cíl rapamycinu – serin/threoninová kináza (mammalian target of rapamycin); STAT – protein s duální rolí přenašeče signálu a transkripčního faktoru (signal transducer and activator of transcription); SYK – splenická tyrozinkináza (spleen associated tyrosine kinase) Léky cílené na epigenetické změny/cíle
Vzhledem k pozorovaným aberantním epigenetickým změnám u různých T-lymfomů se ve výzkumu nových léčiv prosazují inhibitory epigenetických modifikátorů. Epigenetické modifikace zahrnují zejména změny metylace DNA a modifikace histonů [35]. Modifikace histonů potom zahrnuje procesy acetylace, metylace, fosforylace a ubikvitinace, z nichž nejčastějším je právě acetylace.
Inhibitory histonových deacetyláz (HDACi)
Stav acetylace histonů reguluje interakci transkripčních faktorů s DNA a určuje tak míru genové exprese. Deacetylované DNA-histonové komplexy jsou kompaktnější, a tím je blokován proces transkripce. U řady lymfomů vč. PTCL tak často dochází k utlumení tumor-supresních genů a zvýšení exprese proto-onkogenů. Acetylace histonů je synchronizována dvěma antagonistickými procesy, které zajišťují histonové acetyltransferázy a deacetylázy. Lidské HDAC (histon deacetylázy) se dělí do čtyř tříd (HDAC I–IV), které sdílejí stejnou buněčnou lokalizaci a funkci [36]. HDACi vykazují různou míru schopnosti blokovat třídy I, II a IV. V současné době jsou nejvýznamnějšími zástupci HDACi romidepsin a belinostat. Romidepsin působí zejména jako inhibitor histon deacetylázy I. třídy, méně potom i HDAC II. třídy. Belinostat je pan-inhibitorem HDAC (HDAC I., II. i IV. třídy) i přes to, že pořád není úplně jasné, která HDAC a její inhibice jsou přímo odpovědné za účinnost v léčbě PTCL. Obecně se předpokládá, že čím větší je spektrum inhibice, tím větší je i efektivita. Klinická data také naznačují vysokou účinnost pan-inhibitorů u vysoce předléčených pacientů s PTCL [36,37]. Monoterapie romidepsinem u relabovaných PTCL dosahovala celkové léčebné odpovědi (overall response rate – ORR) mezi 25 až 38 % [38–40]. Na základě těchto výsledků byl romidepsin registrován ve Spojených státech amerických pro relabující pacienty s PTCL [38]. Velká randomizovaná studie srovnávající romidepsin v kombinaci s CHOP vs. CHOP u nepředléčených PTCL však neprokázala jakýkoli přínos romidepsinu ve zlepšení PFS, léčebné odpovědi nebo OS. Naopak bylo pozorováno významné zvýšení toxicity léčby grade ≥ 3 [41]. Belinostat v monoterapii relabovaného nebo refrakterního PTCL dosahoval asi 25 % léčebných odpovědí s velmi dobrým profilem nežádoucích účinků. Na základě těchto výsledků byl v roce 2014 belinostat schválen v této indikaci v USA [37]. Na základě dat ze studií s monoterapií se belinostat jeví také jako atraktivní kandidát kombinované léčby [37,42,43].
Hypometylační látky
Proces DNA (hyper) metylace cytosin-fosfát-guaninových ostrůvků DNA-metyltransferázami (DNMT), které jsou součástí promotorových oblastí genů, obecně vede k tzv. utlumení transkripce (transcript silencing) genů spojených především s regulací buněčného cyklu a tumor supresorových genů CDKNA2 a CDKN2B kódujících proteiny p14, p15 a p16 [35]. DNMT inhibitory (hypometylační látky) jsou skupinou léků původně schválených k použití při léčbě akutní myeloidní leukemie. Mutace v genech kódujících proteiny účastnící se procesů DNA metylace, např. TET2, DNMT3A a IDH2, byly identifikovány také u pacientů s periferními T-lymfomy s TFH fenotypem [44]. Efekt metyltransferázového inhibitoru 5-azacytidinu prokázala např. menší studie na pacientech s AITL. Zde byla na skupině 12 pacientů dosažena ORR 75 %, přičemž 6 pacientů dosáhlo celkové remise (complete remission – CR) a 3 pacienti parciální remise (partial remission – PR). TET2 mutace byla detekována u všech pacientů, 58 % mělo dvě mutace TET2, 33 % pacientů mělo rovněž mutaci DNMT3A, 41 % mutaci RHOA a jeden pacient IDH2. Korelace mezi počtem nebo druhem mutací a léčebnou odpovědí však nebyla prokázána. Zajímavou informací je konkomitantní diagnóza CMML (chronická myelomonocytární leukemie) u 4 pacientů v této kohortě [45].
Multicentrická studie fáze 2 s 25 dosud neléčenými nebo R/R (relabovaní/refrakterní) pacienty s PTCL prokázala synergizmus azacytidinu s inhibitorem HDAC romidepsinem. Tato studie poukázala na vysokou efektivitu a bezpečnost této kombinace s ORR 61 %, CR 48 %, u pacientů s prokázaným TFH fenotypem byla ORR až 80 % a celkové remise dosáhlo 67 % [46]. Uvedené výsledy mohou být základem pro nové léčebné strategie u specifických podskupin PTCL.
Léky cílené na signální a proliferační dráhy
Antifoláty
Pralatrexát je analog folátu podobně jako metotrexát. Toto léčivo je efektivně internalizováno do nitra buňky za pomocí RFC (reduced folate carrier), tedy onkofetálního proteinu, který je exprimován jak v embryonálních strukturách, tak v maligních buňkách. Úkolem RFC je regulace vstupu folátu, který je nezbytný pro syntézu purinových a pyrimidinových nukleotidů, do buňky. Vzhledem k vysoké afinitě pralatrexátu k RFC je u tohoto léčiva prokázána vysoká selektivní akumulace v nádorových buňkách [47]. Na základě přechozích zkušeností s léčebným efektem metotrexátu pozorovaného u různých non-Hodgkinových lymfomů byl ve studiích testován také pralatrexát [48]. Jeho efektivita u R/R PTCL byla předmětem prospektivní multicentrické studie fáze II (PROPEL) s dosažením léčebné odpovědi u 29 % pacientů s mediánem PFS 3,5 měsíce a OS 14,5 měsíce [47]. Novější retrospektivní multicentrická studie na 71 pacientech publikována v roce 2019 dokonce pozorovala ORR až 52 % [49]. Retrospektivní studie, zahrnující 31 pacientů s R/R PTCL (medián věku 69 let) ukázala srovnatelné výsledky s dosažením ORR 35,5 %, vč. 4 kompletních odpovědí. Předpokládaný medián OS byl 10 měsíců s PFS 9 měsíců [50]. Na základě výsledků studie PROPEL byl pralatrexát schválen americkou FDA (Food and Drug Administration) v indikaci refrakterních a relabujících PTCL [47]. V Evropské unii byla registrace tohoto léku zamítnuta.
ALK inhibitory
Léčebné strategie založené na podávání chemoterapie s antracykliny v první linii ALK+ ALCL jsou spojené s dlouhodobým přežitím bez události (EFS) u přibližně 60–70 % pacientů, při podání kombinace s etoposidem (CHOEP) se zdají být výsledky ještě lepší (5letý OS cca 80 %) [51]. Nicméně standard pro léčbu relapsu nebo refrakterního ALK+ ALCL dosud nebyl stanoven [8]. ALK je klasická tyrozinkináza, jež patří do rodiny inzulinových receptorů a je vysoce exprimovaná během embryonálního vývoje v nervovém systému. Aberace ALK je typická pro různé druhy tumorů a může být způsobena různými mechanizmy. Většina ALK+ ALCL má translokaci t (2; 5) (p23; q35), která zahrnuje ALK gen na chromozomu 2 a NPM1 (nukleofosmin) na chromozomu 5. Fúzní gen NPM-ALK je odpovědný za aktivaci proliferačních a anti-apoptotických signálních drah, např. RAS/RAF/MEK/ERK1/2, JAK/STAT, PI3K/AKT a PLC - g, a udržování stability genomu [22].
Inhibitory ALK tyrozinkinázy jsou využívány zejména v léčbě nemalobuněčného karcinomu plic (NSCLC) [52]. Crizotinib, orální ALK-ROS1-MET inhibitor, prokázal vysokou efektivitu zejména u pediatrických pacientů. Ve skupině 26 pacientů s R/R ALK+ ALCL byla celková odpověď až 90 % [53]. Tyto výsledky vedly ke schválení crizotinibu v léčbě R/R ALK+ ALCL u dětí a mladých dospělých ve Spojených státech v roce 2021 [53]. Autoři několika menších studií, jako např. Fukano et al., v roce 2020 pozorovali efektivitu také dalších ALK inhibitorů, konkrétně ALK inhibitoru druhé generace alectinibu. U pediatrických pacientů ve věku 6–7 let dosáhlo 6/10 celkové remise s dosažením ORR 80 % [54]. Přestože se inhibice ALK jeví jako velmi smysluplná a její účinnost byla prokázána (i když na relativně malých skupinách pacientů), využití ALK inhibitorů v klinické praxi je dosud zcela mizivé.
Inhibitory PI3 kinázy
Fosfatidylinositol-3-kináza (phosphoinositide 3-kinase – PI3K) je lipidová kináza, jejíž čtyři izoformy – a, b, g a d – se uplatňují v buňkách člověka a vykazují tkáňový tropismus. Izoforma delta je nejvíce exprimována ve tkáních hematopoetického, zejména lymfoidního původu. Izoforma gama vykazuje podobnou diferenciální expresi v leukocytech myeloidního původu. Malé molekuly cílené na PI3K mohou být pan-, izoforma-specifické a duální PI3K/mTOR inhibitory. Aktuálně je FDA schváleno celkem pět různých PI3K inhibitorů (copanlisib, idelalisib, umbralisib, duvelisib a alpelisib) [55]. První a nejvíce studovaný PI3Ki, idelalisib, má uplatnění v léčbě chronické lymfocytární leukemie a folikulárního lymfomu [56].
Duvelisib, bispecifický inhibitor podtypů delta/gama je předmětem výzkumu u řady hematologických malignit vč. T-lymfomů. Studie fáze I na 33 pacientech s relabovaným/refrakterním PTCL a kožním T-lymfomem (cutaneous T-cell lymphoma – CTCL) po minimálně 4 předchozích liniích léčby ukázala celkovou odpověď u 42 % pacientů, přičemž 2 pacienti dosáhli celkové remise s přijatelnou toxicitou [57]. Další duální g/d inhibitor – tenalisib byl testován v rámci studie fáze I u 35 pacientů s R/R PTCL (1 ≥ předchozích liniích léčby), ORR dosáhlo 45,7 %, CR byla pozorována u 3 pacientů [58]. Příznivý bezpečnostní profil a klinická aktivita PI3Ki poukazují na jejich potenciální terapeutické využití v léčbě PTCL v monoterapii i v kombinacích. Aktuálně probíhají i studie zkoumající PI3K inhibitory v kombinaci např. s imunomodulační léčbou nebo s romidepsinem [2,57,58].
JAK/STAT a SYK inhibitory
Signální dráha JAK/STAT je evolučně konzervovaným mechanizmem umožňujícím regulaci genové exprese na základě signálů z extracelulárního prostředí. Tato dráha je aktivována vazbou cytokinů a růstových faktorů na povrchové receptory buňky. Změny JAK/STAT signální dráhy byly popsány u většiny T buněčných lymfoproliferací [59]. JAK/STAT se tedy jeví jako další možný terapeutický cíl. Efektivita ruxolitinibu, JAK1/2 inhibitoru byla recentně zkoumaná ve studii fáze II u R/R PTCL (n = 45) a mycosis fungoides (n = 7), přičemž pacienti byli rozděleni do 3 kohort na základě přítomnosti specifických biomarkerů. Primárním cílem této studie byla míra klinického benefitu (clinical benefit rate – CBR), který byl definován jako kombinace kompletní, parciální odpovědi a stabilní choroby po dobu alespoň 6 měsíců. CBR byla u pacientů s PTCL v kohortě s přítomnou aktivující mutací JAK nebo STAT 53 % [60].
Cerdulatinib, inhibitor JAK1/JAK3/SYK kinázy taktéž prokázal aktivitu u PTCL. Předběžné výsledky studie fáze IIA na pacientech s R/R PTCL dokládají jeho efektivitu s ORR 43 % a 50 % v podskupině pacientů s AITL [61].
Léky cílené na mikroprostředí buňky
Imunomodulační látky
Imunomodulační látky prokazují svoji efektivitu v léčbě mnohočetného myelomu a B-non-Hodgkinových lymfomů. Lenalidomid je imunomodulační látka, která cílí na transkripční faktory cereblon (CRBN) a aiolos/ikaros a je dobře známa svým antiangiogenním a antineoplastickým efektem. V monoterapii byla zkoušena v řadě menších klinických studií s příznivými výsledky např. u ATLL (adultní T-leukemie/lymfom) nebo kožních forem PTCL [62]. Účinek lenalidomidu v monoterapii u předléčených pacientů s PTCL poprvé prokázali Zinzani et al. ve studii na 10 pacientech s ORR 33 % [63]. Větší multicentrická studie fáze 2 (EXPECT) pozorovala efekt monoterapie lenalidomidem u 54 pacientů s R/R PTCL s dosažením ORR ve 22 %, CR dosáhlo 11 % pacientů, přičemž o něco lepší efekt byl dosažen u pacientů s AITL (CR 13 % pacientů) [64]. Podobné výsledky byly potvrzeny další studií fáze 2 na skupině 39 pacientů, která zahrnovala jak pacienty dosud neléčené, tak pacienty R/R PTCL; ORR zde byla 26 % [65]. Recentně byly publikovány výsledky studie kombinující lenalidomid s R-CHOP u nově diagnostikovaných pacientů s AITL (60–80 let), 78 hodnotitelných pacientů bylo hodnoceno z pohledu účinnosti a bezpečnosti. Kompletní metabolická odpověď (CMR) byla dosažena u 32 (41 %) pacientů, což ale bylo pod predikovanou minimální účinností pro studii (CMR 55 %). Přežití ve 2 letech bez progrese bylo 42,1 % (95 % CI, 30,9–52,8 %) a celkové přežití 59,2 %. Součástí studie byla i analýza biologických markerů TET2, RHOA, DNMT3A a IDH2 mutací, které byly přítomny u 78 %, 54 %, 32 % a 22 % pacientů. IDH2 mutace byly spojeny s odlišným patologickým a klinickým obrazem, zatímco DNMT3A byla sdružena s kratším PFS [66].
Terapie využívající zdravé T-lymfocyty
Imunoterapie využívající aktivitu vlastních T-lymfocytů pacienta, tzv. „T-cell engaging therapy“, jako např. T-buňky s chimerickým antigenním receptorem (chimeric antigen receptor T-cells – CAR-T) a bispecifické protilátky, fungují na základě využívání schopnosti zdravých T-lymfocytů zabíjet nádorové buňky, které exprimují určitý cílový antigen. Terapie zacílená na B-buněčný antigen CD19 prokazuje výborné výsledky u mnoha B-buněčných malignit, jako např. DLBCL, mantle cell lymfomu, folikulárního lymfomu či akutní lymfoblastické leukemie [67,68].
Využití CAR-T v léčbě T-lymfomů je problematické. Jejich cílení proti běžným T-buněčným antigenům jako CD3, CD4 nebo CD8 má mnoho úskalí. Aplázie T-buněčné řady s sebou nese riziko permanentní imunosuprese a predispozici pro život ohrožující infekce. Dalším problémem je i takzvaná „bratrovražda“, tedy jev, kdy CAR-T napadají další CAR-T-lymfocyty, které exprimují cílový antigen, což brání jejich expanzi. V neposlední řadě hrozí riziko kontaminace CAR-T nádorovými buňkami [69]. Většina studií s CAR-T u T-lymfomů je zatím ve fázích preklinických experimentů. Jako možný cíl CAR-T lze uvažovat opět antigen CD30, který je běžně exprimován u Hodgkinova lymfomu, ale i u přibližně 50 % PTCL [70]. Preklinická data prokazují značnou efektivitu CD30 CAR-T v in vitro i in vivo modelech a jeví se jako slibný kandidát v léčbě PTCL [71]. Předmětem výzkumu jsou také antigeny CD7, CD5, CD4 nebo TCR. Beta řetězec TCR je jedinečný pro každou klonální expanzi T-buněk. Atakování této podjednotky pomocí CAR-T by mělo zabezpečit to, že zdravá populace T-lymfocytů by neměla být efektem CAR-T postižena [72]. V roce 2022 byly prezentovány první výsledky podání CAR-T cílených na TRBC1 doménu beta řetězce TCR. Tento preparát byl podán 10 pacientům s dobrou tolerancí, verifikace efektu této terapie ale bude vyžadovat ještě delší sledování a studie na větších kohortách pacientů [73].
Další potenciální léčebnou možností je i využití bispecifických protilátek v léčbě PTCL, většina z nich využívá opět strukturu CD30. Efekt těchto bispecifických protilátek byl zkoušen zejména u Hodgkinova lymfomu, objevují se však i nové studie zkoumající jejich efekt u CD30 pozitivních PTCL [74]. Např. AMF13 je bispecifická protilátka, která se specificky váže na CD30 antigen nádorových buněk a CD16a antigen NK buněk a jejíž efektivita je předmětem aktuálně probíhající II. fáze studie REDIRECT na pacientech s R/R CD30 pozitivním PTCL (NCT04101331). Je nutné konstatovat, že využití T-cell engaging terapie zatím není u T-lymfomů podloženo dostatkem relevantních klinických dat, a v nejbližší době tedy nelze předpokládat zásadní uplatnění v klinické praxi.
Další potenciálně účinné léky
Několik menších studii zkoumá účinnost dalších terapeutických látek využívaných např. u jiných hematologických malignit, případně účinnost léčiv efektivních u kožních forem periferních lymfomů. Např. inhibitor aurora kinázy A – alisertib prokázal svou efektivitu ve dvou studiích, do kterých byli zahrnuti i pacienti s PTCL a transformovanou mycosis fungoides. Obě studie prokázaly podobnou léčebnou odpověď, ORR se pohybovala kolem 30 % [75,76]. Na základě preklinických dat byl testován možný synergizmus alisertibu s romidepsinem, tento efekt nicméně nebyl v klinickém zkoušení potvrzen [77].
V rámci již zmíněné skupiny léku interferujících s nádorovým mikroprostředím buněk lymfomu stojí za zmínku tzv. „check-point“ inhibitory. U mnoha podskupin PTCL byla opakovaně popsána exprese PD-1 a PDL-1 [2]. Logicky tedy byly protilátky anti PD-1 jako nivolumab a pembrolizumab rovněž zkoušeny v několika klinických studiích. Signifikantního účinku bylo dosaženo převážně u NKTCL nebo u kožních forem T-lymfomů [78,79]. V rozporu s příznivým efektem anti PD-1 u některých pacientů byl popsán také paradoxní jev „hyperprogrese“, např. po podání nivolumabu u ATLL [80,81].
Vysoká aktivita Bcl-2 inhibitoru venetoklaxu pozorovaná u některých lymfoidních, a dokonce i myeloidních hematologických malignit podnítila i výzkum potenciální účinnosti také u PTCL [82,83]. Studie fáze 2 zkoušející efektivitu venetoklaxu v léčbě R/R PTCL však prokázala jen poměrně nízkou účinnost, z malé skupiny 17 pacientů pouze jeden dosáhl CR, dva další stabilizace nemoci [84]. Z dalších potenciálně efektivních léčebných strategií stojí za zmínku terapie inhibitory mTOR/AKT, použití anti-CD38 monoklonálních protilátek i mnoha dalších. Účinnost a klinické využití těchto i ostatních výše uvedených preparátů je u PTCL ještě potřeba ověřit na větších skupinách pacientů a vyžadují si další, extenzivnější klinické zkoušení [8].
ZÁVĚR
Diagnostika, klasifikace a management pacientů s periferními T-lymfomy nadále představují jeden z největších problémů v hematoonkologii. Malá četnost onemocnění a ruku v ruce jdoucí značná heterogenita pacientů brání v rozvoji efektivního výzkumu biologických charakteristik relevantních pro léčbu a rovněž organizování smysluplných klinických studií je velmi problematické.
Standardní chemoterapie stále představuje základ léčby naprosté většiny pacientů, jako lék s vyšší efektivitou u T-lymfomů se jeví etoposid, který by měl být patrně standardní součástí léčebných kombinací. Průlomovým lékem za několik dekád je, zdá se, brentuximab vedotin. Cílené léky, kterých je na medicínském trhu poměrně dostatek, však vykazují účinnost zpravidla pouze u části pacientů s PTCL. Pravděpodobnou příčinou je biologická heterogenita v rámci jednotlivých nozologických jednotek, kterou bude třeba i v rámci rutinní praxe rozkrýt a léčbu více individualizovat. V nové klasifikaci hematopoetických a lymfoidních malignit je toto směřování již evidentní (tab. 1).
Vyhledávání, správná diagnostika a zapojování co největšího počtu pacientů do globálních klinických studií testujících nové léčebné strategie hrají rozhodující roli v dalším zlepšování léčebných možností u pacientů s vzácnými chorobami. Předpokládáme, že výzkum nových léčebných kombinací se bude zaměřovat na více molekulárních cílů současně. Dále je pravděpodobné, že léčba cílenými léky bude indikována spíše na podkladě individuální exprese nebo identifikace konkrétního biologického markeru než na základě příslušnosti k morfologické nozologické jednotce.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
FM – příprava rukopisu
JA – revize, korekce rukopisu
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 10. 1. 2023.
Přijato po recenzi dne: 11. 7. 2023.MUDr. Martina Filipová
Interní hematologická a onkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: filipova.martina@fnbrno.cz
Zdroje
1. Alaggio R, Amador C, Anagnostopoulos I, et al. The 5th edition of the World Health Organization classification of haematolymphoid tumours: lymphoid neoplasms. Leukemia. 2022; 36 (7): 1720–1748. doi: 10.1038/s41375 - 022-01620-2.
2. Fiore D, Cappelli LV, Broccoli A, Zinzani PL, Chan WC, Inghirami G. Peripheral T cell lymphomas: from the bench to the clinic. Nat Rev Cancer. 2020; 20 (6): 323–342. doi: 10.1038/s415 68-020-0247-0.
3. Janikova A, Chloupkova R, Campr V, et al. First-line therapy for T cell lymphomas: a retrospective population-based analysis of 906 T cell lymphoma patients. Ann Hematol. 2019; 98 (8): 1961–1972. doi: 10.1007/s00277-019-03694-y.
4. Petrich AM, Helenowski IB, Bryan LJ, Rozell SA, Galamaga R, Nabhan C. Factors predicting survival in peripheral T-cell lymphoma in the USA: a population-based analysis of 8802 patients in the modern era. Br J Haematol. 2015; 168 (5): 708–718. doi: 10.1111/bjh.13202
5. Ellin F, Landström J, Jerkeman M, Relander T. Real-world data on prognostic factors and treatment in peripheral T-cell lymphomas: a study from the Swedish Lymphoma Registry. Blood. 2014; 124 (10): 1570–1577. doi: 10.1182/blood - 2014-04-573089.
6. Pedersen MB, Hamilton-Dutoit SJ, Bendix K, et al. Evaluation of clinical trial eligibility and prognostic indices in a population-based cohort of systemic peripheral T-cell lymphomas from the Danish Lymphoma Registry: Clinical trials and prognostic indices in PTCL. Hematol Oncol. 2015; 33 (4): 120–128. doi: 10.1002/hon.2153.
7. Wudhikarn K, Bennani NN. How to sequence therapies in peripheral T cell lymphoma. Curr Treat Options Oncol. 2021; 22 (9): 74. doi: 10.1007/s11864-021-00873-w.
8. Saleh K, Michot JM, Ribrag V. Updates in the treatment of peripheral T-cell lymphomas. J Exp Pharmacol. 2021; 13 : 577–591. doi: 10.2147/JEP.S262344.
9. Gleeson M, Peckitt C, Cunningham D, et al. Outcomes following front-line chemotherapy in peripheral T-cell lymphoma: 10-year experience at The Royal Marsden and The Christie Hospital. Leuk Lymphoma. 2018; 59 (7): 1586–1595. doi: 10.1080/10428194.2017.1393671.
10. Schmitz N, Trümper L, Ziepert M, et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: an analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group. Blood. 2010; 116 (18): 3418–3425. doi: 10.1182/blood-2010-02-270785.
11. Savage KJ, Chhanabhai M, Gascoyne RD, Connors JM. Characterization of peripheral T-cell lymphomas in a single North American institution by the WHO classification. Ann Oncol. 2004; 15 (10): 1467–1475. doi: 10.1093/annonc/ mdh392.
12. Simon A, Peoch M, Casassus P, et al. Upfront VIP-reinforced-ABVD (VIP-rABVD) is not superior to CHOP/21 in newly diagnosed peripheral T cell lymphoma. Results of the randomized phase III trial GOELAMS-LTP95: VIP-rABVD versus CHOP/21 in Newly Diagnosed PTCL. Br J Haematol. 2010; 151 (2): 159–166. doi: 10.1111/j.1365-2141.2010.08329.x.
13. Heavican TB, Bouska A, Yu J, et al. Genetic drivers of oncogenic pathways in molecular subgroups of peripheral T-cell lymphoma. Blood. 2019; 133 (15): 1664–1676. doi: 10.1182/blood - 2018-09-872549.
14. Li S, Young KH, Medeiros LJ. Diffuse large B-cell lymphoma. Pathology (Phila). 2018; 50 (1): 74–87. doi: 10.1016/j.pathol.2017.09.006.
15. Martelli M, Ferreri AJM, Agostinelli C, Di Rocco A, Pfreundschuh M, Pileri SA. Diffuse large B-cell lymphoma. Crit Rev Oncol Hematol. 2013; 87 (2): 146–171. doi: 10.1016/j.critrevonc. 2012.12.009.
16. Luminari S, Skrypets T. What’s new in peripheral T‐cell lymphomas. Hematol Oncol. 2021; 39 (S1): 52–60. doi: 10.1002/hon.2846.
17. Foster C, Kuruvilla J. Treatment approaches in relapsed or refractory peripheral T-cell lymphomas. F1000Research. 2020; 9 : 1091. doi: 10.12688/f1000research.22257.1
18. Escalón MP, Liu NS, Yang Y, et al. Prognostic factors and treatment of patients with T-cell non-Hodgkin lymphoma: The M. D. Anderson Cancer Center experience. Cancer. 2005; 103 (10): 2091–2098. doi: 10.1002/cncr.20999.
19. DuPage M, Bluestone JA. Harnessing the plasticity of CD4+ T cells to treat immune-mediated disease. Nat Rev Immunol. 2016; 16 (3): 149–163. doi: 10.1038/nri.2015.18.
20. Zain JM. Aggressive T‐cell lymphomas: 2019 updates on diagnosis, risk stratification, and management. Am J Hematol. 2019; 94 (8): 929–946. doi: 10.1002/ajh.25513.
21. Mulvey E, Ruan J. Biomarker-driven management strategies for peripheral T cell lymphoma. J Hematol Oncol. 2020; 13 (1): 59. doi: 10.1186/s13045-020-00889-z.
22. Janikova A, Michalka J, Chloupkova R, et al. Clinical value of ALK and CD30 expression in mature systemic T cell lymphomas: analysis from the Czech Lymphoma Study Group database (NIHIL). Ann Hematol. 2022; 101 (4): 789–798. doi: 10.1007/s00277-022-04759-1.
23. Wang T, Feldman AL, Wada DA, et al. GATA-3 expression identifies a high-risk subset of PTCL, NOS with distinct molecular and clinical features. Blood. 2014; 123 (19): 3007–3015. doi: 10.1182/blood-2013-12-544809.
24. Zhang Y, Lee D, Brimer T, Hussaini M, Sokol L. Genomics of peripheral T-cell lymphoma and its implications for personalized medicine. Front Oncol. 2020; 10 : 898. doi: 10.3389/fonc. 2020.00898.
25. Dürkop H, Foss HD, Eitelbach F, et al. Expression of the CD30 antigen in non-lymphoid tissues and cells. J Pathol. 2000; 190 (5): 613–618. doi: 10.1002/ (SICI) 1096-9896 (2000 04) 190 : 5<613:: AID-PATH559>3.0.CO; 2-0.
26. van der Weyden CA, Pileri SA, Feldman AL, Whisstock J, Prince HM. Understanding CD30 biology and therapeutic targeting: a historical perspective providing insight into future directions. Blood Cancer J. 2017; 7 (9): e603–e603. doi: 10.1038/bcj.2017.85.
27. Salas MQ, Climent F, Tapia G, et al. Clinicopathologic features and prognostic significance of CD30 expression in de novo diffuse large B-cell lymphoma (DLBCL): results in a homogeneous series from a single institution. Biomarkers. 2020; 25 (1): 69–75. doi: 10.1080/1354750X.2019.1691656.
28. Pro B, Advani R, Brice P, et al. Brentuximab vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: results of ap II study. J Clin Oncol. 2012; 30 (18): 2190–2196. doi: 10.1200/JCO. 2011.38.0402.
29. Francisco JA, Cerveny CG, Meyer DL, et al. cAC10-vcMMAE, an anti-CD30–monomethyl auristatin E conjugate with potent and selective antitumor activity. Blood. 2003; 102 (4): 1458–1465. doi: 10.1182/blood-2003-01-0039.
30. Horwitz S, O’Connor OA, Pro B, et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. The Lancet. 2019; 393 (10168): 229–240. doi: 10.1016/S0140-6736 (18) 32984-2.
31. Shea L, Mehta-Shah N. Brentuximab vedotin in the treatment of peripheral T cell lymphoma and cutaneous T cell lymphoma. Curr Hematol Malig Rep. 2020; 15 (1): 9–19. doi: 10.1007/s11899-020-00561-w.
32. Oberic L, Delzor F, Protin C, et al. Brentuximab vedotin in real life, a seven year experience in patients with refractory/relapsed CD30+ T cell lymphoma. J Oncol Pharm Pract. 2021; 27 (7): 1730–1735. doi: 10.1177/1078155220968615.
33. Van de Wyngaert Z, Coppo P, Cervera P, et al. Combination of brentuximab‐vedotin and ifosfamide, carboplatin, etoposide in relapsed/refractory peripheral T‐cell lymphoma. Eur J Haematol. 2021; 106 (4): 467–472. doi: 10.1111/ejh.13568.
34. Herrera AF, Zain J, Savage KJ, et al. Brentuximab vedotin plus cyclophosphamide, doxorubicin, etoposide, and prednisone (CHEP-BV) followed by BV consolidation in patients with CD30-expressing peripheral T-cell lymphomas. Blood. 2021; 138 (Suppl 1): 133–133. doi: 10.1182/blood-2021-151105.
35. Zhang P, Zhang M. Epigenetic alterations and advancement of treatment in peripheral T-cell lymphoma. Clin Epigenetics. 2020; 12 (1): 169. doi: 10.1186/s13148-020-00962-x
36. Lane AA, Chabner BA. Histone deacetylase inhibitors in cancer therapy. J Clin Oncol. 2009; 27 (32): 5459–5468. doi: 10.1200/JCO. 2009.22.1291.
37. O’Connor OA, Horwitz S, Masszi T, et al. Belinostat in patients with relapsed or refractory peripheral T-cell lymphoma: results of the pivotal phase II BELIEF (CLN-19) study. J Clin Oncol. 2015; 33 (23): 2492–2499. doi: 10.1200/ JCO.2014.59.2782.
38. Coiffier B, Pro B, Prince HM, et al. Romidepsin for the treatment of relapsed/refractory peripheral T-cell lymphoma: pivotal study update demonstrates durable responses. J Hematol Oncol. 2014; 7 (1): 11. doi: 10.1186/1756-8722-7-11.
39. Coiffier B, Pro B, Prince HM, et al. Results from a pivotal, open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy. J Clin Oncol. 2012; 30 (6): 631–636. doi: 10.1200/JCO.2011.37.4223.
40. Piekarz RL, Frye R, Prince HM, et al. Phase 2 trial of romidepsin in patients with peripheral T-cell lymphoma. Blood. 2011; 117 (22): 5827–5834. doi: 10.1182/blood-2010-10-312603.
41. Bachy E, Camus V, Thieblemont C, et al. Romidepsin plus CHOP versus CHOP in patients with previously untreated peripheral T-cell lymphoma: results of the Ro-CHOP phase III study (conducted by LYSA). J Clin Oncol. 2022; 40 (3): 242–251. doi: 10.1200/JCO.21.01815.
42. Foss F, Advani R, Duvic M, et al. A Phase II trial of Belinostat (PXD101) in patients with relapsed or refractory peripheral or cutaneous T-cell lymphoma. Br J Haematol. 2015; 168 (6): 811–819. doi: 10.1111/bjh.13222.
43. Gisselbrecht C, Sibon D. New perspectives in the therapeutic approach of peripheral T-cell lymphoma. Curr Opin Oncol. 2018; 30 (5): 285–291. doi: 10.1097/CCO.0000000000000469.
44. Marchi E, O’Connor OA. The rapidly changing landscape in mature T‐cell lymphoma (MTCL) biology and management. CA Cancer J Clin. 2020; 70 (1): 47–70. doi: 10.3322/caac.21589.
45. Lemonnier F, Dupuis J, Sujobert P, et al. Treatment with 5-azacytidine induces a sustain - ed response in patients with angioimmunoblastic T-cell lymphoma. Blood. 2018; 132 (21): 2305–2309. doi: 10.1182/blood-2018-04-840538.
46. Falchi L, Ma H, Klein S, et al. Combined oral 5-azacytidine and romidepsin are highly effective in patients with PTCL: a multicenter phase 2 study. Blood. 2021; 137 (16): 2161–2170. doi: 10.1182/blood.2020009004.
47. O’Connor OA, Pro B, Pinter-Brown L, et al. Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: results from the pivotal PROPEL Study. J Clin Oncol. 2011; 29 (9): 1182–1189. doi: 10.1200/JCO. 2010.29.9024.
48. Ng SY, Jacobsen ED. Peripheral T-cell lymphoma. Hematol Oncol Clin North Am. 2019; 33 (4): 657–668. doi: 10.1016/j.hoc.2019.04. 002.
49. Amengual JE, Lichtenstein R, Lue J, et al. A phase 1 study of romidepsin and pralatrexate reveals marked activity in relapsed and refractory T-cell lymphoma. Blood. 2018; 131 (4): 397–407. doi: 10.1182/blood-2017-09-806737.
50. Bhurani M, Admojo L, Van Der Weyden C, et al. Pralatrexate in relapsed/refractory T-cell lymphoma: a retrospective multicenter study. Leuk Lymphoma. 2021; 62 (2): 330–336. doi: 10.1080/10428194.2020.1827241.
51. Cederleuf H, Bjerregård Pedersen M, Jerkeman M, Relander T, d’Amore F, Ellin F. The addition of etoposide to CHOP is associated with improved outcome in ALK+ adult anaplastic large cell lymphoma: A Nordic Lymphoma Group study. Br J Haematol. 2017; 178 (5): 739–746. doi: 10.1111/bjh.14740.
52. Lin JJ, Riely GJ, Shaw AT. Targeting ALK: Precision medicine takes on drug resistance. Cancer Discov. 2017; 7 (2): 137–155. doi: 10.1158/2159-8290.CD-16-1123.
53. Mossé YP, Lim MS, Voss SD, et al. Safety and activity of crizotinib for paediatric patients with refractory solid tumours or anaplastic large-cell lymphoma: a Children’s Oncology Group phase 1 consortium study. Lancet Oncol. 2013; 14 (6): 472–480. doi: 10.1016/ S1470-2045 (13) 70095-0.
54. Fukano R, Mori T, Sekimizu M, et al. Alectinib for relapsed or refractory anaplastic lymphoma kinase‐positive anaplastic large cell lymphoma: An open‐label phase II trial. Cancer Sci. 2020; 111 (12): 4540–4547. doi: 10.1111/cas.14671.
55. Mishra R, Patel H, Alanazi S, Kilroy MK, Garrett JT. PI3K Inhibitors in cancer: clinical implications and adverse effects. Int J Mol Sci. 2021; 22 (7): 3464. doi: 10.3390/ijms22073 464.
56. Seiler T, Hutter G, Dreyling M. The emerging role of PI3K inhibitors in the treatment of hematological malignancies: preclinical data and clinical progress to date. Drugs. 2016; 76 (6): 639–646. doi: 10.1007/s40265-016-0565-4.
57. Horwitz SM, Koch R, Porcu P, et al. Activity of the PI3K-d, g inhibitor duvelisib in a phase 1 trial and preclinical models of T-cell lymphoma. Blood. 2018; 131 (8): 888–898. doi: 10.1182/blood-2017-08-802470.
58. Huen A, Haverkos BM, Zain J, et al. Phase I/Ib study of tenalisib (RP6530), a dual PI3K d/g inhibitor in patients with relapsed/refractory T-cell Llmphoma. Cancers. 2020; 12 (8): 2293. doi: 10.3390/cancers12082293.
59. Shouse G, Nikolaenko L. Targeting the JAK/STAT pathway in T cell lymphoproliferative disorders. Curr Hematol Malig Rep. 2019; 14 (6): 570–576. doi: 10.1007/s11899-019-00 545-5.
60. Moskowitz AJ, Ghione P, Jacobsen E, et al. A phase 2 biomarker-driven study of ruxolitinib demonstrates effectiveness of JAK/STAT targeting in T-cell lymphomas. Blood. 2021; 138 (26): 2828–2837. doi: 10.1182/blood.20210 13379.
61. Hamlin PA, Cheson BD, Farber CM, et al. The dual SYK/JAK inhibitor cerdulatinib demonstrates rapid tumor responses in a phase 2 study in patients with relapsed/refractory B - and T-cell non-Hodgkin lymphoma (NHL). J Clin Oncol. 2018; 36 (15Suppl): 7511–7511. doi: 10.1200/JCO.2018.36.15suppl.7511.
62. Cencini E, Fabbri A, Mecacci B, Bocchia M. Role of lenalidomide in the treatment of peripheral T-cell non-Hodgkin lymphomas. World J Clin Oncol. 2021; 12 (10): 882–896. doi: 10.5306/wjco.v12.i10.882.
63. Zinzani PL, Pellegrini C, Broccoli A, et al. Lenalidomide monotherapy for relapsed/refractory peripheral T-cell lymphoma not otherwise specified. Leuk Lymphoma. 2011; 52 (8): 1585–1588. doi: 10.3109/10428194.2011.573 031.
64. Morschhauser F, Fitoussi O, Haioun C, et al. A phase 2, multicentre, single-arm, open-label study to evaluate the safety and efficacy of single-agent lenalidomide (Revlimid®) in subjects with relapsed or refractory peripheral T-cell non-Hodgkin lymphoma: The EXPECT trial. Eur J Cancer. 2013; 49 (13): 2869–2876. doi: 10.1016/ j.ejca.2013.04.029.
65. Toumishey E, Prasad A, Dueck G, et al. Final report of a phase 2 clinical trial of lenalidomide monotherapy for patients with T-cell lymphoma: lenalidomide therapy for T-cell lymphoma. Cancer. 2015; 121 (5): 716–723. doi: 10.1002/cncr.29103.
66. Lemonnier F, Safar V, Beldi-Ferchiou A, et al. Integrative analysis of a phase 2 trial combining lenalidomide with CHOP in angioimmunoblastic T-cell lymphoma. Blood Adv. 2021; 5 (2): 539–548. doi: 10.1182/bloodadvances.2020003 081.
67. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med. 2017; 377 (26): 2531–2544. doi: 10.1056/NEJM oa1707447.
68. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med. 2019; 380 (1): 45–56. doi: 10.1056/NEJMoa 1804980.
69. Rogers AM, Brammer JE. Hematopoietic cell transplantation and adoptive cell therapy in peripheral T cell lymphoma. Curr Hematol Malig Rep. 2020; 15 (4): 316–332. doi: 10.1007/s118 99-020-00590-5.
70. Went P, Agostinelli C, Gallamini A, et al. Marker expression in peripheral T-cell lymphoma: a proposed clinical-pathologic prognostic score. J Clin Oncol. 2006; 24 (16): 2472–2479. doi: 10.1200/JCO.2005.03.6327.
71. Wu Y, Chen D, Lu Y, et al. A new immunotherapy strategy targeted CD30 in peripheral T-cell lymphomas: CAR-modified T-cell therapy based on CD30 mAb. Cancer Gene Ther. 2022; 29 (2): 167–177. doi: 10.1038/s41417-021-00295-8.
72. Maciocia PM, Wawrzyniecka PA, Philip B, et al. Targeting the T cell receptor b-chain constant region for immunotherapy of T cell malignancies. Nat Med. 2017; 23 (12): 1416–1423. doi: 10.1038/nm.4444.
73. Cwynarski K, Iacoboni G, Tholouli E, et al. First in human study of AUTO4, a TRBC1-targeting CAR T-cell therapy in relapsed/refractory TRBC1-positive peripheral T-cell lymphoma. Blood. 2022; 140 (Suppl 1): 10316–10317. doi: 10.1182/blood-2022-165971.
74. Prince HM, Hutchings M, Domingo-Domenech E, Eichenauer DA, Advani R. Anti-CD30 antibody–drug conjugate therapy in lymphoma: current knowledge, remaining controversies, and future perspectives. Ann Hematol. 2023; 102 (1): 13–29. doi: 10.1007/ s00277-022-05054-9.
75. Barr PM, Li H, Spier C, et al. Phase II intergroup trial of alisertib in relapsed and refractory peripheral T-cell lymphoma and transformed mycosis fungoides: SWOG 1108. J Clin Oncol. 2015; 33 (21): 2399–2404. doi: 10.1200/JCO. 2014.60.6327.
76. O’Connor OA, Özcan M, Jacobsen ED, et al. Randomized phase III study of alisertib or investigator’s choice (selected single agent) in patients with relapsed or refractory peripheral T-cell lymphoma. J Clin Oncol. 2019; 37 (8): 613–623. doi: 10.1200/JCO.18.00899.
77. Strati P, Nastoupil LJ, Davis RE, et al. A phase 1 trial of alisertib and romidepsin for relapsed/refractory aggressive B-cell and T-cell lymphomas. Haematologica. 2020; 105 (1): e26–e28. doi: 10.3324/haematol.2019.220012.
78. Khodadoust MS, Rook AH, Porcu P, et al. Pembrolizumab in relapsed and refractory mycosis fungoides and Sézary syndrome: a multicenter phase II study. J Clin Oncol. 2020; 38 (1): 20–28. doi: 10.1200/JCO.19.01056.
79. Kwong YL, Chan TSY, Tan D, et al. PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase. Blood. 2017; 129 (17): 2437–2442. doi: 10.1182/blood-2016-12-756 841.
80. Ratner L, Waldmann TA, Janakiram M, Brammer JE. Rapid progression of adult T-cell leukemia–lymphoma after PD-1 inhibitor therapy. N Engl J Med. 2018; 378 (20): 1947–1948. doi: 10.1056/NEJMc1803181.
81. Rauch DA, Conlon KC, Janakiram M, et al. Rapid progression of adult T-cell leukemia/lymphoma as tumor-infiltrating Tregs after PD-1 blockade. Blood. 2019; 134 (17): 1406–1414. doi: 10.1182/blood.2019002038.
82. Molica S. Venetoclax: a real game changer in treatment of chronic lymphocytic leukemia. Int J Hematol Oncol. 2020; 9 (4): IJH31. doi: 10.2217/ijh-2020-0010.
83. Gangat N, Tefferi A. Venetoclax-based chemotherapy in acute and chronic myeloid neoplasms: literature survey and practice points. Blood Cancer J. 2020; 10 (11): 122. doi: 10.1038/s41408-020-00388-x.
84. Ballotta L, Zinzani PL, Pileri S, et al. Venetoclax shows low therapeutic activity in BCL2-positive relapsed/refractory peripheral T-cell lymphoma: a phase 2 study of the Fondazione Italiana Linfomi. Front Oncol. 2021; 11 : 789891. doi: 10.3389/fonc.2021.789891.
85. Adcetris souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: //prehledy.sukl.cz/prehled_leciv.html#/detail-reg/0193 650.
86. Beleodaq highlights of prescribing information [online]. [cit. 2023-06-11]. Dostupné z: https: //www.accessdata.fda.gov/drugsatfda_docs/label/2014/206256lbl.pdf.
87. Istodax highlights of prescribing information [online]. [cit. 2023-06-11]. Dostupné z: https: //www.accessdata.fda.gov/drugsatfda_docs/label/2009/022393lbl.pdf.
88. Vidaza souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: //prehledy.sukl.cz/prehled_leciv.html#/detail-reg/0500947.
89. Folotyn highlights of prescribing information [online]. [cit. 2023-06-11]. Dostupné z: https: //www.clinicaltrials.gov/.
90. Xalkori souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: //prehledy.sukl.cz/prehled_leciv.html#/detail-reg/0193646.
91. Alecensa souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: // prehledy.sukl.cz/prehled_leciv.html#/detail - reg/0219362.
92. Copiktra souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: // prehledy.sukl.cz/prehled_leciv.html#/detail - reg/0255061.
93. Revlimid souhrn údajů o přípravku [online]. [cit. 2023-06-11]. Dostupné z: https: //pre - hledy.sukl.cz/prehled_leciv.html#/detail-reg/ 0028937.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Jubileum MUDr. Evy Tesařové
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Význam receptorů NK buněk u alogenních transplantací krvetvorných buněk u pacientů s akutní myeloidní leukemií
- Novinky v léčbě periferních T-buněčných lymfomů v podmínkách České republiky
- Potřebujeme systém sdílení volných transfuzních přípravků?
- Dostupnost erytrocytových transfuzních přípravků v České republice v letech 2019–2021 – vyhodnocení dotazníkové akce v zařízeních transfuzní služby
- Porovnání GIT toxicity přípravných režimů BEAM a TEAM před autologní transplantací u pacientů s lymfomy
- XXXIII. Celostátní pracovní konference laborantů a sester 2023: 14.–16. 5. 2023 Dvůr Pecínov
- Jubileum MUDr. Evy Tesařové
- Avatrombopag v léčbě trombocytopenií – lékový profi l přípravku Doptelet
- Avatrombopag v léčbě trombocytopenií – lékový profi l přípravku Doptelet
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Novinky v léčbě periferních T-buněčných lymfomů v podmínkách České republiky
- Avatrombopag v léčbě trombocytopenií – lékový profi l přípravku Doptelet
- Význam receptorů NK buněk u alogenních transplantací krvetvorných buněk u pacientů s akutní myeloidní leukemií
- Dostupnost erytrocytových transfuzních přípravků v České republice v letech 2019–2021 – vyhodnocení dotazníkové akce v zařízeních transfuzní služby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




