-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
Complex mechanisms of action of „BCR signalling“ inhibitors and development of resistance to this targeted therapy in chronic lymphocytic leukaemia
The emergence of the BTK inhibitor ibrutinib and PI3K inhibitor idelalisib represented a revolution in the therapy of B cell malignancies. In some of these malignancies, they became the primary therapeutic strategy. However „BCR inhibitors“ function by a more complex mechanism than anticipated. The evolution of point mutations, chromosomal aberrations and changes in the physiology of malignant B cells leads to resistance in some patients treated with „BCR inhibitors“. The most commonly described aberration is the mutation in PLCγ bypassing BCR signalosome or the mutation in BTK preventing the covalent binding of ibrutinib. However, additional mutations leading to resistance are still being described. Furthermore, relative resistance to „BCR inhibitors“ can be caused by non-genetic adaptive mechanisms leading to activation of alternative pathways and „compensation“ of kinase inhibition. For instance, PI3K-Akt and NFκB activation or BCL2 upregulation lead to B cell survival even after BTK inhibition. This suggests some potentially effective therapeutic combinations of BTK/PI3K inhibitors together with other targeted inhibitors for clinical trials. Alternatively, drugs mimicking the BTK/PI3K inhibition effect can be used to prevent adhesion and migration of malignant B cells (chemokine and integrin pathway inhibition) or to block the pro-proliferative signals from the microenvironment such as IL4 (STAT inhibitors).
Keywords:
resistance – ibrutinib – idelalisib – CLL – BCR – inhibition – microenvironment
Autoři: Ľ. Košťálová 1,2; V. Šeda 1,2; M. Mráz 1,2
Působiště autorů: CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno 1; Interní hematologická a onkologická klinika FN Brno a LF MU, Masarykova univerzita, Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 4, p. 301-308.
Kategorie: Souhrnné/edukační práce
Souhrn
Nedávné zavedení inhibitoru BTK ibrutinibu a inhibitoru PI3K idelalisibu představovalo revoluci v terapii malignit vznikajících z maturovaných B lymfocytů a u některých z nich se stalo primární léčebnou strategií. K všeobecnému překvapení však bylo zjištěno, že tyto inhibitory cílící na utlumení BCR dráhy fungují komplexnějším mechanismem, než se předpokládalo. Zároveň u pacientů léčených „BCR inhibitory“ vznikají bodové i chromozomální aberace a změny ve fyziologii maligních B buněk, které jim poskytují rezistenci k této léčbě. Nejdéle popsanými aberacemi je mutace PLCγ obcházející BCR komplex a mutace BTK bránící kovalentní vazbě ibrutinibu, ale stále jsou popisovány další mutace zodpovědné za rezistenci. Navíc relativní rezistence k léčbě BCR inhibitory může nastat i negenetickým adaptivním mechanismem spočívajícím v aktivaci alternativních drah a “kompenzaci“ inhibice kináz. Příkladem těchto kompenzačních mechanismů je aktivace PI3K-Akt a alternativní NFκB dráhy, či zvýšení hladiny BCL2, které dovolují přežití buněk s inhibovanou BTK. Zde se tak nabízí potenciálně účinné terapeutické kombinace BTK/PI3K inhibitorů s dalšími cílenými inhibitory pro klinické testovaní. Alternativně lze využít léčiva, která by napodobovala klinický efekt BTK/PI3K inhibice například tím, že brání adhezi či migraci maligních B buněk (inhibice chemokinové dráhy či integrinů) či blokují odpověď na podpůrné signály od T lymfocytů v mikroprostředí jako je IL4 (inhibitory STAT signalizace).
Klíčová slova:
CLL – BCR – inhibice – ibrutinib – idelalisib – rezistence – mikroprostředí
ÚVOD
V posledních pěti letech byla do léčby B buněčných malignit vznikajících z maturovaných B lymfocytů zavedena léčiva cílící na BCR-asociované kinázy. Prohlubováním poznatků o patogenezi těchto onemocnění se ukázalo, že signalizace z B-buněčného receptoru (BCR) úzce souvisí se vznikem a progresí onemocnění, jako je chronická lymfocytární leukemie (CLL), lymfom z plášťových buněk (MCL), difuzní velkobuněčný B lymfom (DLBCL), folikulární lymfom (FL) a Waldenströmova makroglobulinemie. Zavedení inhibitoru Brutonovy tyrosinkinázy (BTK), ibrutinibu a inhibitoru fosfatidylinositol 3-kinázy (PI3K) idelalisibu představovalo revoluci v terapii B buněčných malignit a u některých z nich se stalo standardní léčbou první linie, resp. relapsu choroby [1, 2]. Ke všeobecnému překvapení však bylo zjištěno, že „BCR inhibitory“ fungují komplexnějším mechanismem, než se iniciálně předpokládalo, který zahrnuje účinky na jiné dráhy než BCR. Zároveň také část pacientů na léčbu nereaguje nebo u nich dochází k vzniku rezistence. V následujícím textu se věnujeme popisu molekulárního mechanismu účinku „BCR inhibitorů“ se zaměřením na CLL a komplexním mechanismům adaptace a rezistence maligních B buněk na tuto léčbu. Pro poskytnutí účinnější terapie je nutné bližší porozumění těmto kompenzačním mechanismům a návrh nových terapeutických kombinací tak, aby bylo možné u pacientů např. s CLL dosáhnout trvalé kontroly choroby, či případně její úplné eliminace pomocí režimů neobsahujících chemoterapii.
Komplexní provázanost BCR signalizace a interakcí v mikroprostředí u CLL
Pro vývoj, zrání a funkci B lymfocytů je důležitá správná funkce B buněčného receptoru (BCR), který je fyziologicky aktivován vazbou antigenu. Vazba antigenu generuje signál, který se kaskádou reakcí dostane až do jádra buňky, kde vyvolá produkci proteinů zodpovědných za přežívání, či případně podporuje klonální expanzi dané buňky. Do této reakce je zahrnut kromě transmembránového imunoglobulinu i systém proteinkináz, adaptorových molekul, ale též fosfatáz představujících negativní regulátory aktivace (obr. 1).
Obr. 1. Schematické znázornění interakcí v mikroprostředí maligních B buněk a léčiv cílících na tyto dráhy
Červené symboly (horní index) označují proteiny, které jsou u jednotlivých chorob v případě rezistence na BCR inhibitor ibrutinib mutovány nebo kompenzatorně aktivovány (označeny ↑).
*rezistence u CLL, #rezistence u MCL, Δrezistence u DLBCL, ↑aktivace/zvýšení exprese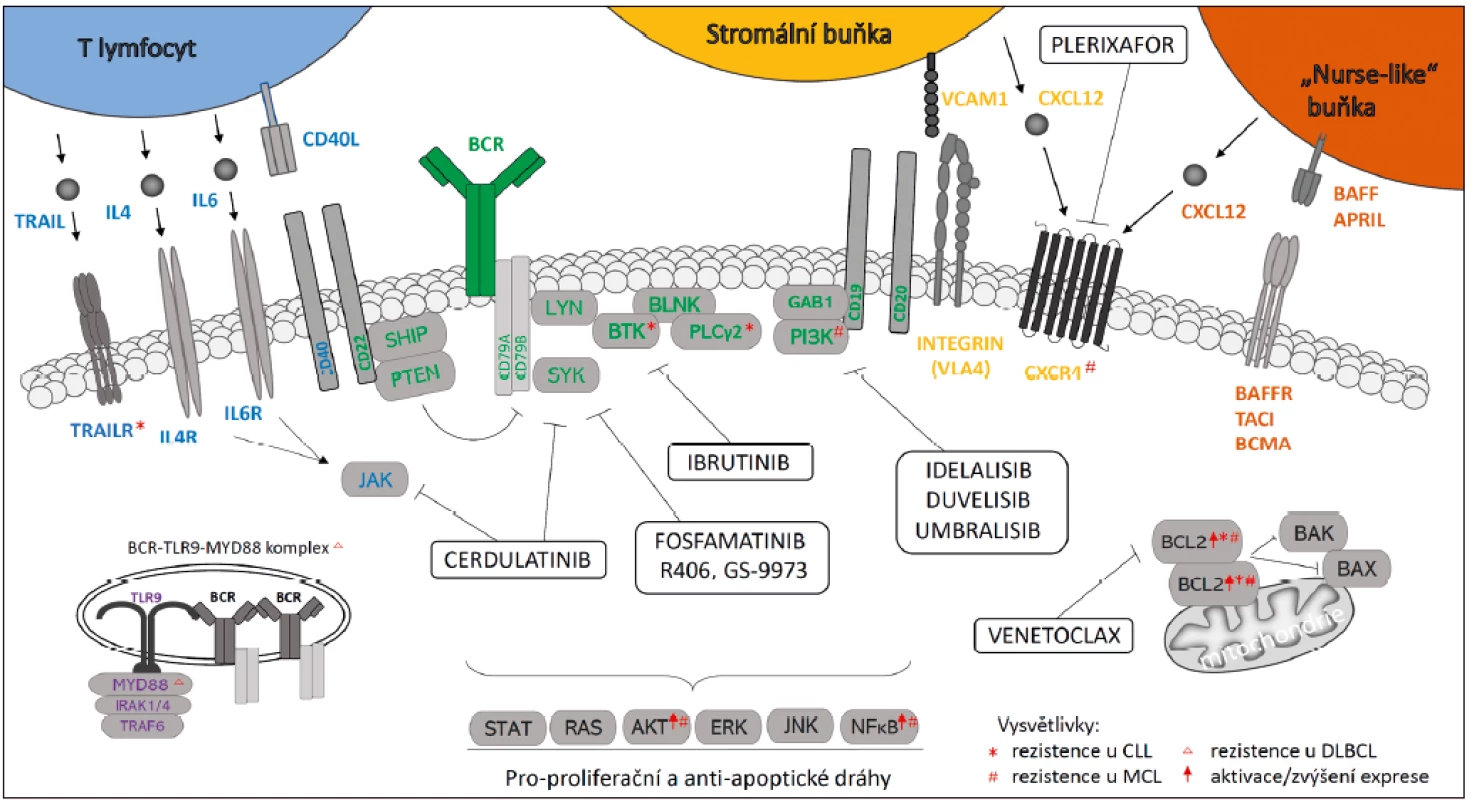
Transmembránový BCR na povrchu B lymfocytů je složen podobně jako jiné imunoglobuliny ze dvou těžkých a dvou lehkých imunoglobulinových řetězců. Imunoglobulinové komponety BCR postrádají kinázovou aktivitu a přenos signálu hlouběji do buňky je tak zajištěn jejich vazbou na dva heterodimery Igα a Igβ (CD79a/b), jejichž součástí jsou funkčně důležité tyroziny (ITAM). Při vazbě antigenu na BCR dochází k fosforylaci těchto tyrozinů pomocí kinázy LYN, což následně umožní aktivaci kinázy SYK (obr. 1). Za zmínku jistě stojí, že pro správnou aktivaci SYK je potřeba fosforylace jak Igα, tak i Igβ. Absence, případně zamezení fosforylace jedné z těchto molekul, vede k neschopnosti buněk navázat a fosforylovat SYK [3]. V další fázi signální dráhy je pomocí SYK fosforylována adaptorová molekula BLNK, která je důležitá pro spojení BCR s Brutonovou tyrozinkinázou a dalšími molekulami (viz obr. 1). Brutonova tyrozinkináza (BTK) je klíčovou molekulou signalizace a její defekty vedou k nesprávnému vývoji B lymfocytů a imunodeficitu (imunodeficit vázaný na chromozom X) [3]. Dalšími zúčastněnými kinázami jsou fosfatidylinositol 3-kináza (PI3K) a fosfolipáza C-γ (PLCγ), spouštějící signalizaci tzv. sekundárních poslů (inositol trifosfát, diacylglycerol a ionty Ca2+), které signál amplifikují a přenáší ho z cytoplazmatické membrány k transkripčním faktorům v jádře. Společně s aktivací těchto signálních mechanismů dochází fyziologicky k aktivaci drah zodpovědných za utlumení právě probíhající signalizace. Kinázou zodpovědnou za tuto negativní regulaci je opět kináza LYN, která tak v biologii B lymfocytů zaujímá jedinečnou dvojí roli. Hlavním mechanismem jejího účinku je fosforylace molekul FCγRIIB a CD22 s následnou aktivací fosfatáz (např. SHIP1 či PTEN) inhibujících BCR dráhu (viz obr. 1).
Aktivita BCR dráhy se u jednotlivých CLL pacientů liší, obecně však platí, že schopnost snazší a silnější aktivace BCR signalizace je spojena s horší prognózou [4, 5]. Tyto poznatky přispěly ke snahám o identifikaci mutací způsobujících konstitutivní aktivaci BCR signalizace. Přestože jsou podobné aktivační mutace dobře popsány u B lymfomů (DLBCL a FL), a to s frekvencí až 30 %, u chronické lymfocytární leukemie se takovéto mutace nevyskytují s výjimkou rezistence na „BCR inhibitory“ [6, 7]. Historicky je však dobře známo, že důležitým prognostickým markerem u CLL je samotná struktura BCR, a to jak na úrovni využití specifických variabilních segmentů pro lehké a těžké řetězce imunoglobulinu, tak přítomnost tzv. somatických hypermutací v těžkém řetězci pro imunoglobuliny v oblasti determinující vazbu antigenu, tzv. CDR3 oblast [8, 9, 10]. U pacientů s těžkým řetězcem imunoglobulinu (IGHV), kde nedošlo k jeho somatickým hypermutacím, nacházíme typicky výraznější aktivaci BCR dráhy.
U části pacientů je v CLL buňkách exprimovaná také kináza ZAP-70, která je T-lymfocytární obdobou SYK s funkcí v aktivaci signalizace od T buněčného receptoru. U CLL je její exprese častější v případě nemutovaného IGVH a je spojena s horší prognózou. Ukazuje se, že tato kináza obecně napomáhá v CLL buňkách silnější aktivaci BCR signalizace [11, 12], ale také podporuje adhezi CLL buněk ke stromálním buňkám a může modulovat i jejich odpověď na cytokiny [13]. Komplexní mechanismus působení ZAP-70 u CLL je stále předmětem zájmu, nicméně již bylo popsáno, že jeho fosforylovaná forma asociuje s CD79b, což vyvolává zvýšení aktivace SYK, a tím i posílení BCR signalizace [11].
Aktivace BCR signalizace reprezentuje důležitý pro-proliferační a anti-apoptický signál, ale sama o sobě není u většiny CLL buněk dostatečná k spuštění proliferace. CLL buňky zůstávají (podobně jako normální B lymfocyty) závislé na kostimulačních a podpůrných signálech poskytovaných mikroprostředím imunitních orgánů (především lymfatických uzlin), kde oproti periferní krvi CLL buňky prokazatelně aktivně proliferují [14, 15]. Mezi základní složky mikroprostředí jsou řazeny především Th lymfocyty [16], dendritické, „nurse-like“ buňky [17, 18] a stromální buňky mezenchymálního původu (viz obr. 1). Tyto buňky produkují solubilní či membránově vázané proteiny, které u zdravých B lymfocytů indukují proliferaci a procesy spjaté s reakcí na antigen, kdežto u maligních B buněk podporují především přežívání a expanzi. Esenciální je pro CLL buňky interakce s Th lymfocyty, které poskytují maligním B lymfocytům stimulaci prostřednictvím produkce IL4 a CD40 ligandu. Sekrece IL4 vede u CLL buněk jednak k nárůstu produkce anti-apoptotického proteinu BCL2, jednak ke zvýšení produkce BCR a s tím spjaté vnitrobuněčné signalizace [19]. Vazba B lymfocytu na CD40 ligand silně podporuje proliferaci, což lze napodobit in vitro přidáním CD40L k CLL buňkám. Analogické procesy probíhají také u příbuzných malignit, jako je DLBCL, FL či MCL [6].
Další důležitou komponentou mikroprostředí jsou stromální buňky, které jsou zdrojem několika chemokinů a také produkují základní komponenty extracelulární matrix. Adhezi CLL buněk k extracelulární matrix a buňkám zajišťují integriny a tato adheze je zásadním způsobem potencována BCR signalizací [3]. Terapeutická inhibice BCR signalizace tak přispívá k vzniku lymfocytózy a zmenšení lymfatických uzlin u pacientů právě inhibicí schopnosti CLL buněk adherovat. Pro CLL je pravděpodobně nejvýznamnějším integrinem VLA4 (CD49d) zprostředkovávající interakci se stromálními buňkami vazbou na VCAM1 a k extracelulární matrix vazbou na fibronektin (viz obr. 1). VLA4 je důležitým prognostickým markerem a jeho vyšší hladiny jsou asociované s horší prognózou CLL [20]. Tento integrin hraje také klíčovou úlohu v tzv. adhezí zprostředkované rezistenci na chemo-imunoterapii [21]. Mezi molekuly produkované stromálními buňkami a dalším podpůrným typem buněk tzv. „nurse--like cells“ patří také cytokiny BAFF a APRIL (viz obr. 1). Navázáním těchto ligandů z rodiny tumor nekrotizujícího faktoru (TNF) dochází k aktivaci NFκB dráhy a ochraně před spontánní i indukovanou apoptózou. Ibrutinib a idelalisib minimálně částečně inhibují signální dráhy adheze, CD40L, IL4, BAFF, APRIL a tyto jsou zároveň možným terapeutickým cílem nezávisle nebo společně s inhibicí BCR signalizace.
Velmi zajímavou vlastností CLL buněk je jejich opakující se re-cirkulace mezi periferní krví a lymfatickými orgány [22]. V krevním řečišti dochází u CLL buněk ke zvýšení exprese membránového receptoru CXCR4. Ten následně CLL buňky “navádí“ ke svému ligandu, kterým je SDF1 produkovaný myeloidními či stromálními buňkami v kostní dřeni. Vazba SDF1 (též označený CXCL12) na CXCR4 indukuje mobilizaci vápenatých iontů, aktivuje kinázy PI3K, MAPK a protein STAT3 a napomáhá reorganizaci cytoskeletu, což je základní předpoklad pro migraci [23]. Po vstupu buňky do mikroprostředí dochází v důsledku interakcí ke snížení CXCR4, což umožní buňce opustit uzlinu/kostní dřeň. Takováto CLL buňka pak vykazuje charakteristický imunofenotyp CXCR4dim/CD5bright, což je možné využít pro rozlišení buněk, které právě vycestovaly z mikroprostředí [22]. Dalším receptorem, který pomáhá B lymfocytům vcestovat do mikroprostředí je CXCR5 a CXCR7 [24, 25]. Bylo ukázáno, že BTK se účastní nejen signalizace vedoucí z BCR, ale také signalizace z chemokinových receptorů. Použití ibrutinibu, jakožto látky inhibující BTK, tak interferuje nejen s aktivitou BCR, ale také s migrací CLL buněk a jejich retencí v uzlinách.
Principy terapeutického účinku „BCR inhibitorů“ a rezistence
Propojení signálních drah vedoucích z BCR, cytokinových receptorů a adheze je klíčové pro pochopení mechanismu účinku klinicky podávaných „inhibitorů BCR signalizace“. Přestože léčba ibrutinibem vede ve většině případů CLL iniciálně k dobré klinické odpovědi, tak postupně dochází u některých pacientů k relapsu a nezřídka i k Richterově transformaci. Selhání terapie bylo později dáno do souvislosti se vznikem mutací v BTK, čímž se výrazně sníží afinita ibrutinibu. Nejčastěji se jedná o substituci C481S, ale detekovány byly i varianty C481F, C481R, C481Y nebo T474I a T474S (26). Vlivem toho dochází k „prostupu“ signálů z BCR a přežití maligních B buněk [27]. Mutace C481S sama o sobě stačí k získání relativní rezistence, ale pravděpodobně ne úplné rezistence. Vznik úplné rezistence je dáván do souvislosti s mutací v genu pro fosfolipázu C-γ (PLCγ2; především R665W, S707Y a L845F) [28]. Mutace PLCγ v pozici 665 byly detekovány u ibrutinib rezistentních pacientů samostatně nebo společně s mutacemi v BTK [29]. Funkčním důsledkem této mutace je konformační změna PLCγ, a s tím související aktivace B lymfocytů, která je již nezávislá na BTK [27].
Nejen bodové mutace, ale i chromozomové změny přispívají u CLL pacientů k rezistenci. Delece krátkého raménka chromozomu 8 s lokusem kódujícím receptor pro TRAIL způsobuje rezistenci k TRAIL indukované apoptóze [30]. Naopak zisk genetického materiálu na krátkém raménku chromozomu 2 (v lokusu 2p16.1–15) vede ke zvýšené expresi XPO1, který reguluje transport nádorových supresorů p53 a FOXO1 mezi buněčným jádrem a cytoplazmou, což pravděpodobně ovlivňuje přežití maligních B buněk [31,32].
Zajímavé mechanismy rezistence byly popsány i u DLBCL, kde je patogeneze ABC subtypu charakterizována chronickou aktivací BCR signalizace díky mutacím v CD79 [33] a mutacemi v MYD88, který v signální dráze Toll-like receptoru (TLR) reguluje NFκB transkripční faktor. Bylo popsáno, že v případě DLBCL tyto genetické změny specificky regulují odpověď na léčbu BCR-inhibitory. Například buňky ABC-DLBCL nesoucí mutaci v MYD88, ale nikoliv v CD79, jsou rezistentní k ibrutinibu. Kdežto případy s mutací pouze v CD79 nebo s mutací jak v CD79, tak v MYD88 na léčbu reagují. Mechanismus, díky kterému jsou rezistentní buňky s mutací pouze v MYD88, není prozatím zcela znám, ale může to souviset s nově objevenou funkcí MYD88 v multi-proteinovém komplexu BCR společně s TLR9-MYD88 [34, 35]. MYD88L265P mutace se nachází i u Waldenströmovy makroglobulinemie (~ 90 % pacientů), ale u těchto pacientů je ibrutinib při léčbě efektivní [36]. Naopak mutace v chemokinovém receptoru CXCR4 vedou k rezistenci na ibrutinib u ~30 % pacientů s Waldenströmovou makroglobulinemií. Zde dochází k narušení internalizace CXCR4 receptoru, nepřetržité aktivaci ERK a AKT kinázy a vysoké životaschopnosti buňky. Signalizaci přes mutovaný CXCR4 receptor je možné inhibovat plerixaforem (CXCR4 inhibitor), který senzitivizuje buňky k ibrutinibu [37].
Kromě mutací v genomu buněk se u CLL a B buněčných malignit uplatňují negenetické mechanismy adaptace či rezistence, spočívající v zapojení alternativních signálních drah a interakcích v mikroprostředí (viz obr. 1). Bylo popsáno, že u MCL buněk rezistentních k ibrutinibu bez mutací v BTK dochází k využití alternativních mechanismů, mezi které patří aktivace PI3K-AKT molekul a alternativní NFκB signální dráhy. Buněčné linie MCL využívající klasickou NFκB signální dráhu jsou senzitivní k léčbě ibrutinibem, rezistenci naopak vykazují buňky využívající alternativní NFκB dráhu [38]. Obecně je překvapivé, že CLL buňky na inhibici BTK reagují jen velmi pomalou apoptózou projevující se mimo jiné měsíce přetrvávající lymfocytózou u pacientů. Toto by naznačovalo, že buňky využívají kompenzatorní mechanismy podporující jejich přežití, jako je aktivace PI3K/Akt dráhy, a předpokládá se tedy, že kombinace inhibitorů BTK a PI3K-AKT by mohla vykazovat synergický terapeutický efekt.
Terapeutické strategie překonání rezistence na „BCR inhibitory“
Cílená inhibice proteinkináz je efektivní léčebnou strategií, ale podobně jako u chemoimunoterapie část pacientů na léčbu nereaguje nebo u nich postupem času dojde ke vzniku rezistence. Jak bylo popsáno výše, ke vzniku rezistence k ibrutinibu vede nejčastěji mutace C481S v BTK či mutace R665W v PLCγ. Přestože inhibitor BTK nové generace, acalabrutinib, vykazuje vyšší aktivitu a užší specifitu než ibrutinib, jsou pacienti s mutací C481S k této léčbě podobně rezistentní. Důvodem je stejný mechanismus účinku acalabrutinibu, který se podobně jako ibrutinib váže na BTK v místě C481S. Řešením může být vývoj nekovalentních inhibitorů nezávislých na C481S, které dokáží překonat rezistenci a inhibovat BCR signalizaci. Vysoce selektivní nekovalentní inhibitory BMS-986142 a GDC-0853 jsou již v raných fázích klinického testování [39, 40]. Mutace R665W v PLCγ vede ke zvýšené aktivaci této molekuly proteinem Rac2, a zdá se, že aktivace mutované PLCγ stále do určité míry vyžaduje aktivitu kináz LYN a SYK. Jednou z možných strategií překonání rezistence způsobené touto mutací je proto kombinace ibrutinibu s inhibitorem Rac2 (EHT 1864) [28] či inhibice proximálních kináz LYN/SYK inhibitory R406 nebo GS-9973 (inhibice SYK) či dasatinibem (inhibice LYN) [29].
Jak již bylo naznačeno dříve, negenetické mechanismy rezistence nejčastěji zahrnují aberantní aktivaci dalších molekul BCR signální dráhy např. PI3K/AKT. Molekula PI3K se jako součást signálních drah účastní mnoha buněčných procesů a její inhibice je v kombinaci s ibrutinibem potenciálním terapeutickým cílem. V případě idelalisibu a daších PI3K inhibitorů jako umbralisib je tato léčebná kombinace již v relativně pokročilé fázi klinického testování u MCL a CLL. Navíc bylo zjištěno, že další inhibitory PI3K duvelisib a PR6530 inhibují fosforylaci AKT a přežití maligních B buněk i u pacientů s BTK mutací C481S či kompenzatorní aktivací Akt [41, 42]. Naproti tomu ani idelalisib či duvelisib nedokáží inhibovat signalizaci přes mutovanou PLCγ, a není tak asi zcela vhodné jejich použití u pacientů v případě rezistence na ibrutinib způsobené specificky touto mutací [29]. Zdá se tedy, že je racionální primární kombinace BTK a PI3K inhibitoru nebo aplikace PI3K inhibitoru při vzniku rezistence na ibrutinib díky BTK mutaci. Podobně racionální strategií je pravděpodobně přidání inhibitorů molekul AKT, MEK1/2 nebo MAPK k ibrutinibu (shrnuto v tabulce 1).
Tab. 1. Shrnutí možných strategií překonání rezistence/adaptace při léčbě „BCR inhibitory“ 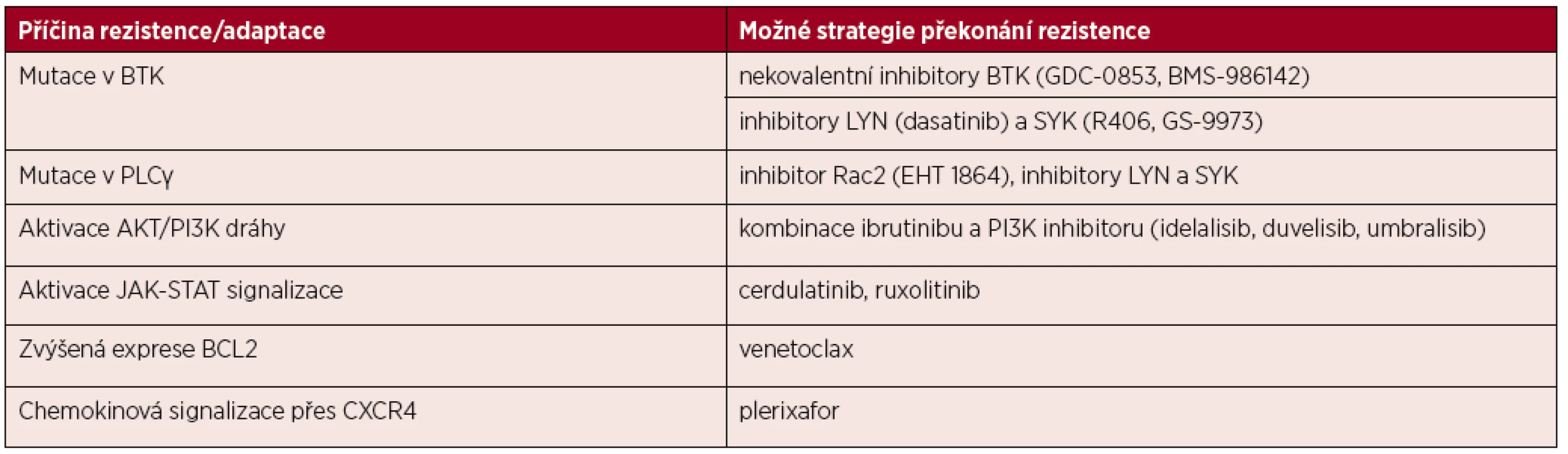
Kromě kombinace dvou různých inhibitorů je další možností vývoj jednoho léčiva inhibujícího dva rozdílné cíle. V současnosti tak vznikají molekuly inhibující současně BTK a PI3K [43], případně SYK a JAK-STAT (cerdulatinib). JAK-STAT signální dráha zprostředkovává signalizaci spouštěnou interleukiny IL4 a IL6, které přes JAK kinázy aktivují proteiny STAT3/6 (viz obr. 1). Ty regulují produkci anti-apoptických proteinů MCL1 and BCLXL a buňky po navýšení jejich množství snáze unikají apoptóze [44]. Cerdulatinib byl popsán jako potentní inhibitor blokující proliferaci primárních CLL buněk a oproti ibrutinibu je schopný snáze indukovat apoptózu blokací signálů pro přežití vyvolaných IL4, anti-IgM (aktivuje BCR) a CD40L [45]. Význam JAK-STAT signální dráhy pro přežívání buněk naznačuje také klinická studie kombinujicí ibrutinib s inhibitorem JAK ruxolitinibem [46].
Jedním ze slibných přístupů je také inhibice anti-apoptických molekul z rodiny BCL2, jejichž součástí jsou pro-apoptické proteiny BAX, BAK, BAD, BIM a PUMA a anti-apoptické proteiny BCL2, BCLXL, BCLW, MCL1 a BFL1. Bylo popsáno, že u CLL a MCL pacientů léčených ibrutinibem dochází k mírnému zvýšení exprese BCL2 a naopak poklesu MCL1 [22]. Není zcela jasné, jakým mechanismem k tomu dochází a zda se jedná o selekci buněk rezistentnějších k buněčné smrti či o adaptační mechanismus. Důsledkem snížení exprese MCL1 je zvýšení „závislosti“ CLL buněk na expresi BCL2, neboť tyto dvě antiapoptické molekuly hrají u této choroby klíčovou roli. Venetoclax je malou molekulou inhibující antiapoptický protein BCL2, jehož úkolem je sekvestrace proteinů BAX a BAK (viz obr. 1). Uvolněné BAX a BAK proteiny způsobují apoptózu buněk permeabilizací mitochondriální membrány. Venetoclax vykazuje skvělý klinický efekt při podání samostatně či v kombinaci s monoklonálními protilátkami proti CD20 a uvedená pozorování naznačují, že jeho kombinace s ibrutinibem by mohla být z biologického pohledu přirozeně synergická. Je třeba připomenout, že kombinace BTK inhibice s rituximabem nepřináší klinický benefit, neboť inhibice BTK vede k snížení hladin CD20 [22].
Jak již bylo zmíněno, migrace CLL buněk do mikroprostředí je důležitá pro přežívání nádorových buněk. Cílená léčba se tedy zaměřuje i na chemokinové signální dráhy, které řídí tento proces. Antagonisté CXCR4 původně vyvinutí pro léčbu HIV, slouží CXCR4 viru jako koreceptor při vstupu do T lymfocytů. Nicméně záhy se ukázalo, že antagonista CXCR4 plerixafor nebo analog T140 významně narušují migraci a adhezi CLL buněk k stromálním buňkám [23] a u CLL pacientů vedou k vyplavení CLL buněk z lymfatických tkání do krve, kde jsou přístupnější konvenčním léčivům (monoklonální protilátky, chemoterapie).
V neposlední řadě se kromě signálních drah zaměřuje pozornost i na inhibici ostatních buněčných procesů asociovaných s BCR. Jednou z možných strategií překonání rezistence je inhibice autofagie či chaperonu Hsp90, který stabilizuje proteiny, brání ubikvitinaci a proteosomální degradaci [47]. Inhibice Hsp90 vede k degradaci BTK a IκB kinázy a inhibuje MAPK a alternativní NFκB signální dráhu [48]. Navíc Hsp90 inhibitor AUY922 dokáže obejít rezistenci k ibrutinibu u MCL. Podobně selinexor, inhibitor jaderného přenašeče Exportinu-1 (XPO1), snižuje aktivaci AKT, ERK a potlačuje expresi genu pro BTK, což vykazuje efektivitu i u rezistentních buněk s BTK mutací C481S [49, 50]. Výzkum těchto inhibitorů cílící na kompenzační mechanismy buněk je nicméně v raných stadiích klinického testování a bude nutné bližší porozumění alternativním mechanismům rezistence maligních B buněk.
ZÁVĚR
Cílená terapeutická inhibice BCR signální dráhy je klíčová pro léčbu pacientů s B buněčnými malignitami pocházejícími z maturovaných B lymfocytů. Prvními zavedenými a relativně velmi uspěšnými „BCR inhibitory“ jsou léčiva cílící na kinázy BTK a PI3K. Pro část pacientů však není léčba BCR inhibitory účinná a/nebo u nich dochází ke vzniku rezistence vznikem bodových i chromozomových aberací a změnami ve fyziologii maligních B buněk. Nejdéle popsanou aberací způsobující rezistenci na ibrutinib je mutace PLCγ obcházející BCR komplex či mutace BTK bránící kovalentní vazbě léčiva. Zároveň je třeba říci, že velmi málo rozumíme mechanismům rezistence na PI3K inhibitory. Je zajímavé, že relativní rezistence k léčbě inhibitory může nastat i negenetickým adaptivním mechanismem díky aktivaci alternativních drah signalizace a “kompenzaci“ inhibice kináz (shrnuto v tabulce 1). Příkladem těchto kompenzačních mechanismů je aktivace PI3K-AKT a alternativní NFκB dráhy, které obchází inhibovanou BTK a působí anti-apopticky. Zde se nabízí terapeutický potenciál kombinace inhibice PI3K a BTK, což dobře ilustruje existence témeř desítky probíhajících klinických studií cílených na souběžnou inhibici BTK ibrutinibem a PI3K idelalisibem a několika dalších studií využívajících jiné PI3K inhibitory.
Vzhledem ke zvyšujícímu se počtu pacientů se získanou rezistencí u CLL či primární rezistencí u B lymfomů jsou v současnosti vyvíjeny nové léčebné strategie. Zejména se jedná o testování dalších inhibitorů molekul BCR signalizace, jako jsou LYN, SYK, PI3K (jiné než delta podjednotky), AKT, inhibitorů chemokinových receptorů a anti-apoptických proteinů. Možným přístupem je také použití multikinázových inhibitorů (např. SYK + STAT). V budoucnu lze, doufejme, očekávat, že kombinace BTK inhibitoru s jedním až dvěma dalšími inhibitory povede ke kombinacím, které budou schopny alespoň u některých CLL pacientů dosáhnout hluboké molekulární odpovědi bez nutnosti aplikace chemoterapie.
Podíl autorů na přípravě rukopisu
Všichni autoři sepsali manuskript a přispěli k diskusi nad relevancí publikovaných studií.
LK a VŠ – přispěli stejným dílem k manuskriptu (sdílené první autorství).
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NV18-03-00054. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce doručeno dne 3. 4. 2019.
Přijato po recenzi dne 31. 5. 2019.
doc. MUDr. Mgr. Marek Mráz, Ph.D.
CEITEC Masarykova univerzita a IHOK FN Brno
Kamenice 5
625 00 Brno
e-mail: marek.mraz@email.cz
Zdroje
1. Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013;369(1):32–42.
2. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370(11):997–1007.
3. Seda V, Mraz M. B-cell receptor signalling and its crosstalk with other pathways in normal and malignant cells. Eur J Haematol 2015;94(3):193–205.
4. D‘Avola A, Drennan S, Tracy I, et al. Surface IgM expression and function are associated with clinical behavior, genetic abnormalities, and DNA methylation in CLL. Blood 2016;128(6):816–826.
5. Mraz M, Chen L, Rassenti LZ, et al. miR-150 influences B-cell receptor signaling in chronic lymphocytic leukemia by regulating expression of GAB1 and FOXP1. Blood 2014;124(1):84–95.
6. Devan J, Janikova A, Mraz M. New concepts in follicular lymphoma biology: From BCL2 to epigenetic regulators and non-coding RNAs. Semin Oncol 2018;45(5-6):291–302.
7. Mraz M, Trbusek M, Dolezalova D, et al. Identifikace patogeneticky vyznamnych mutaci u chronicke lymfocytarni leukemie pomoci „sekvenovani nove generace“. Transfuze Hematologie dnes 2012;18(2):72–75.
8. Stamatopoulos B, Smith T, Crompot E, et al. The light chain IgLV3-21 defines a new poor prognostic subgroup in chronic lymphocytic leukemia: results of a multicenter study. Clin Cancer Res 2018;24(20):5048–5057.
9. Stamatopoulos K, Agathangelidis A, Rosenquist R, Ghia P. Antigen receptor stereotypy in chronic lymphocytic leukemia. Leukemia 2017;31(2):282–291.
10. Mráz M, Pavlová Š, Malčíková J, Malinová K, Mayer J, Pospíšilová, Š. Molekulární patogeneze chronické lymfocytární leukemie. Transfuze Hematol dnes 2010;16(1):16–20.
11. Chen L, Apgar J, Huynh L, et al. ZAP-70 directly enhances IgM signaling in chronic lymphocytic leukemia. Blood 2005;105(5):2036–2041.
12. Rassenti LZ, Huynh L, Toy TL, et al. ZAP-70 compared with immunoglobulin heavy-chain gene mutation status as a predictor of disease progression in chronic lymphocytic leukemia. N Engl J Med 2004;351(9):893–901.
13. Lafarge ST, Li H, Pauls SD, et al. ZAP70 expression directly promotes chronic lymphocytic leukaemia cell adhesion to bone marrow stromal cells. Br J Haematol 2015;168(1):139–142.
14. Pavlasova G, Borsky M, Svobodova V, et al. Rituximab primarily targets an intra-clonal BCR signaling proficient CLL subpopulation characterized by high CD20 levels. Leukemia 2018;32(9):2028–2031.
15. Herishanu Y, Pérez-Galán P, Liu D, et al. The lymph node microenvironment promotes B-cell receptor signaling, NF-kappaB activation, and tumor proliferation in chronic lymphocytic leukemia. Blood 2011;117(2):563–574.
16. Kneitz C, Goller M, Wilhelm M, et al. Inhibition of T cell/B cell interaction by B-CLL cells. Leukemia 1999;13(1):98–104.
17. Ten Hacken E, Burger JA. Microenvironment interactions and B-cell receptor signaling in chronic lymphocytic leukemia: implications for disease pathogenesis and treatment. Biochim Biophys Acta 2016;1863(3):401–413.
18. Burger JA, Tsukada N, Burger M, Zvaifler NJ, Dell‘Aquila M, Kipps TJ. Blood-derived nurse-like cells protect chronic lymphocytic leukemia B cells from spontaneous apoptosis through stromal cell-derived factor-1. Blood 2000;96(8):2655–2663.
19. Aguilar-Hernandez MM, Blunt MD, Dobson R, et al. IL-4 enhances expression and function of surface IgM in CLL cells. Blood 2016;127(24):3015–3025.
20. Shanafelt TD, Geyer SM, Bone ND, et al. CD49d expression is an independent predictor of overall survival in patients with chronic lymphocytic leukaemia: a prognostic parameter with therapeutic potential. Br J Haematol 2008;140(5):537–546.
21. Mraz M, Zent CS, Church AK, et al. Bone marrow stromal cells protect lymphoma B-cells from rituximab-induced apoptosis and targeting integrin α-4-β-1 (VLA-4) with natalizumab can overcome this resistance. Br J Haematol 2011;155(1):53–64.
22. Pavlasova G, Borsky M, Seda V, et al. Ibrutinib inhibits CD20 upregulation on CLL B cells mediated by the CXCR4/SDF-1 axis. Blood 2016;128(12):1609–1613.
23. Burger M, Hartmann T, Krome M, et al. Small peptide inhibitors of the CXCR4 chemokine receptor (CD184) antagonize the activation, migration, and antiapoptotic responses of CXCL12 in chronic lymphocytic leukemia B cells. Blood 2005;106(5):1824–1830.
24. Bürkle A, Niedermeier M, Schmitt-Gräff A, Wierda WG, Keating MJ, Burger JA. Overexpression of the CXCR5 chemokine receptor, and its ligand, CXCL13 in B-cell chronic lymphocytic leukemia. Blood 2007;110(9):3316–3325.
25. Till KJ, Lin K, Zuzel M, Cawley JC. The chemokine receptor CCR7 and alpha4 integrin are important for migration of chronic lymphocytic leukemia cells into lymph nodes. Blood 2002;99(8):2977–2984.
26. Maddocks KJ, Ruppert AS, Lozanski G, et al. Etiology of ibrutinib therapy discontinuation and outcomes in patients with chronic lymphocytic leukemia. JAMA Oncol 2015;1(1):80–87.
27. Woyach JA, Furman RR, Liu TM, et al. Resistance mechanisms for the Bruton‘s tyrosine kinase inhibitor ibrutinib. N Engl J Med 2014;370(24):2286–2294.
28. Walliser C, Hermkes E, Schade A, et al. The Phospholipase Cγ2 mutants R665W and L845F identified in ibrutinib-resistant chronic lymphocytic leukemia patients are hypersensitive to the Rho GTPase Rac2 protein. J Biol Chem 2016;291(42):22136–22148.
29. Liu TM, Woyach JA, Zhong Y, et al. Hypermorphic mutation of phospholipase C, γ2 acquired in ibrutinib-resistant CLL confers BTK independency upon B-cell receptor activation. Blood 2015;126(1):61–68.
30. Rubio-Moscardo F, Blesa D, Mestre C, et al. Characterization of 8p21.3 chromosomal deletions in B-cell lymphoma: TRAIL-R1 and TRAIL-R2 as candidate dosage-dependent tumor suppressor genes. Blood 2005;106(9):3214–3222.
31. Cosson A, Chapiro E, Bougacha N, et al. Gain in the short arm of chromosome 2 (2p+) induces gene overexpression and drug resistance in chronic lymphocytic leukemia: analysis of the central role of XPO1. Leukemia 2017;31(7):1625–1629.
32. Burger JA, Landau DA, Taylor-Weiner A, et al. Clonal evolution in patients with chronic lymphocytic leukaemia developing resistance to BTK inhibition. Nat Commun 2016;7 : 11589.
33. Davis RE, Ngo VN, Lenz G, et al. Chronic active B-cell-receptor signal-ling in diffuse large B-cell lymphoma. Nature 2010;463(7277):88–92.
34. Wilson WH, Gerecitano JF, Goy A, et al. The Brutons tyrosine kinase (BTK) inhibitor, ibrutinib (PCI-32765), has preferential activity in the ABC subtype of relapsed/refractory de novo diffuse large B-cell lymphoma (DLBCL): interim results of a multicenter, open-label, phase 2 study. Blood 2012;120 (21): 686 LP-686.
35. Phelan JD, Young RM, Webster DE, et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature 2018;560(7718):387–391.
36. Yang G, Zhou Y, Liu X, et al. A mutation in MYD88 (L265P) sup-ports the survival of lymphoplasmacytic cells by activation of Bruton tyrosine kinase in Waldenström macroglobulinemia. Blood 2013;122(7):1222–1232.
37. Cao Y, Hunter ZR, Liu X, et al. The WHIM-like CXCR4(S338X) somatic mutation activates AKT and ERK, and promotes resistance to ibrutinib and other agents used in the treatment of Waldenstrom‘s macroglobulinemia. Leukemia 2015;29(1):169–176.
38. Rahal R, Frick M, Romero R, et al. Pharmacological and genomic profiling identifies NF-κB-targeted treatment strategies for mantle cell lymphoma. Nat Med 2014;20(1):87–92.
39. Byrd JC, Smith S, Wagner-Johnston N, et al. First-in-human phase 1 study of the BTK inhibitor GDC-0853 in relapsed or refractory B-cell NHL and CLL. Oncotarget 2018;9(16):13023–13035.
40. Lee SK, Xing J, Catlett IM, et al. Safety, pharmacokinetics, and pharmacodynamics of BMS-986142, a novel reversible BTK inhibitor, in healthy participants. Eur J Clin Pharmacol 2017;73(6):689–698.
41. Dong S, Guinn D, Dubovsky JA, et al. IPI-145 antagonizes intrinsic and extrinsic survival signals in chronic lymphocytic leukemia cells. Blood 2014;124(24):3583–3586.
42. Vakkalanka S, Nyayapathy S, Viswanadha S. Addition of RP6530, a dual PI3K delta/gamma inhibitor, overcomes ibrutinib resistance in DLBCL cells in vitro. Blood 2014;124(21):4497.
43. Pujala B, Agarwal AK, Middya S, et al. Discovery of pyrazolopyrimidine derivatives as novel dual inhibitors of BTK and PI3Kδ. ACS Med Chem Lett 2016;7(12):1161–1166.
44. Steele AJ, Prentice AG, Cwynarski K, et al. The JAK3-selective inhibitor PF-956980 reverses the resistance to cytotoxic agents induced by interleukin-4 treatment of chronic lymphocytic leukemia cells: potential for reversal of cytoprotection by the microenvironment. Blood 2010;116(22):4569–4577.
45. Guo A, Lu P, Coffey G, Conley P, Pandey A, Wang YL. Dual SYK/JAK inhibition overcomes ibrutinib resistance in chronic lymphocytic leukemia: Cerdulatinib, but not ibrutinib, induces apoptosis of tumor cells protected by the microenvironment. Oncotarget 2017;8(8):12953–12967.
46. Spaner DE, McCaw L, Wang G, Tsui H, Shi Y. Persistent janus kinase-signaling in chronic lymphocytic leukemia patients on ibrutinib: Results of a phase I trial. Cancer Med 2019;8(4):21540–21550.
47. Zuehlke A, Johnson JL. Hsp90 and co-chaperones twist the functions of diverse client proteins. Biopolymers 2010;93(3):211–217.
48. Jacobson C, Kopp N, Layer JV, et al. HSP90 inhibition overcomes ibrutinib resistance in mantle cell lymphoma. Blood 2016;128(21):2517–2526.
49. Zhong Y, El-Gamal D, Dubovsky JA, et al. Selinexor suppresses downstream effectors of B-cell activation, proliferation and migration in chronic lymphocytic leukemia cells. Leukemia 2014;28(5):1158–1163.
50. Hing ZA, Mantel R, Beckwith KA, et al. Selinexor is effective in acquired resistance to ibrutinib and synergizes with ibrutinib in chronic lymphocytic leukemia. Blood 2015;125(20):3128–3132.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Úloha signální dráhy transformačního růstového faktoru β v hemopoéze a studie nových inhibitorů této dráhy pro léčbu nízkorizikového myelodysplastického syndromu
- Denosumab a bisfosfonáty u mnohočetného myelomu v roce 2019
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Odběry kostní dřeně pro alogenní transplantaci – zhodnocení desetileté zkušenosti se zaměřením na využití autotransfuzí u dárců
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



