-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
Characteristics and results of the treatment of patients with acute myeloid leukaemia ≥ 60 years – data from the CELL DATOOL AML database
Background: The DATOOL AML database was founded on Jan 1, 2017. Its purpose is to collect data of patients with AML from diagnosis and throughout treatment and follow up. The objective of this study is to describe the epidemiologic, clinical and laboratory data and the analyse overall survival in relation to negative risk factors and selected therapy. The analysis was performed on a group of patients over 60 years of age diagnosed with AML who were added to the database in the period from Jan 1, 2007 to Dec 31, 2017.
Patients and Methods: A total of 1008 patients with AML ≥ 60 years of age were analysed. The group was further divided into two age subgroups (60–69 years, ≥ 70 years) in order to determine possible differences in the incidence of negative prognostic factors, the therapeutic approach chosen and overall survival.
Results: The median of age at diagnosis was 68 years. The most common negative prognostic factors were poor performance status (ECOG 2–4) in 42 %, secondary AML in 32 % and unfavourable cytogenetics in 30 % of patients. Only performance status showed correlation with patient age. 33% of patients received curative, 34 % palliative and 32 % symptomatic treatment. Only 18 % patients undergoing curative therapy received allogeneic stem cell transplantation in first CR. The median overall survival for the entire group was 3.5 months. In the age group 60–69 years the median was 4.5 months and in the age group above 70 the median was 2.4 months (p < 0.0001). The negative factors impacting the overall survival were identified as ECOG 2–4, non-curative therapeutic approach and poor cytogenetic risk. There was a negative correlation between the median overall survival and ECOG (4.7 months for ECOG 0–1; 2.4 months for ECOG 2 and 0.8 months for ECOG 3–4, p < 0.0001). The median overall survival also decreased with higher cytogenetic risk (12.2; 5.8 and 2.9 months for favourable, intermediate and poor risk respectively, p < 0.0001). Compared to palliative therapy, curative therapy significantly prolonged overall survival in both age subgroups (median 8.9 and 3.7 months respectively, p < 0.0001 in the age group 60–69 years; 7.7 and 3.9 months, p = 0.029 in the age group ≥ 70 years). Patients from the age group 60–69 with poor cytogenetic risk receiving curative therapy who underwent allogeneic stem cell transplantation showed a higher survival rate (median OS 10.4 months). Patients who did not receive allogeneic stem cell transplantation showed a similar survival rate as patients with high cytogenetic risk in the age group 60–69 receiving palliative treatment (3.3 and 3.6 months respectively, p = 0.884).
Keywords:
acute myeloid leukaemia – elderly patients – DATOOL database
Autoři: Z. Šustková 1; L. Semerád 1; J. Procházková 1; P. Cetkovský 2; P. Žák 3; J. Novák 4; T. Szotkowski 5; Z. Kořístek 6; L. Burešová 7; J. Mayer 1; Z. Ráčil 1
Působiště autorů: Interní hematologická a onkologická klinika FN Brno 1; Ústav hematologie a krevní transfuze 2; IV. interní hematologická klinika FN Hradec Králové 3; Interní hematologická klinika FN Královské Vinohrady 4; Hemato-onkologická klinika FN Olomouc 5; Klinika hematoonkologie FN Ostrava 6; DSC Services, s. r. o., Tišnov 7
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 4, p. 340-348.
Kategorie: Původní práce
Souhrn
Úvod: Databáze DATOOL AML vznikla k 1. 1. 2007 a shromažďuje podrobná data pacientů s AML z období stanovení diagnózy, průběhu terapie a sledování po léčbě. Cílem práce je deskripce epidemiologických, klinických a laboratorních dat a analýza celkového přežití v závislosti na vstupním riziku a zvoleném typu terapie u pacientů s AML ≥ 60 let, kteří byli do databáze zadáni v období od 1. 1. 2007 do 31. 12. 2017.
Pacienti a metodika: Analýza byla provedena na základě dat 1008 pacientů s AML ≥ 60 let. Hodnocení bylo provedeno u celého sledovaného souboru pacientů ≥ 60 let a v rámci dvou věkových podskupin (60–69 let, ≥ 70 let) s cílem určení případných rozdílů v četnosti výskytu vstupních prognosticky nepříznivých faktorů, v terapeutickém přístupu a celkovém přežití.
Výsledky: Medián věku byl v rámci celého souboru 68 let. Z prognosticky nepříznivých faktorů byly nejčastěji zastoupeny nízký performance status (ECOG 2–4) u 42 %, sekundární AML u 32 % a vysoké cytogenetické riziko u 30 % pacientů. S výjimkou ECOG se jejich četnost s věkem nezvyšovala. Kurativně léčeno bylo 33 %, paliativně 34 % a symptomaticky 32 % pacientů. Pouze 18 % z kurativně léčených pacientů podstoupilo alogenní transplantaci krvetvorby v první kompletní remisi. Medián celkového přežití byl v rámci celého souboru 3,5 měsíce, ve skupině pacientů 60–69 let 4,5 měsíce, u pacientů ≥ 70 let 2,4 měsíce (p < 0,0001). Jako negativní faktory ovlivňující přežívání nemocných byly identifikovány ECOG 2–4, nekurativní terapeutický přístup a vysoké cytogenetické riziko. Medián celkového přežití se zkracoval se zvyšujícím se ECOG (4,7 měsíců u ECOG 0–1 vs. 2,4 měsíců u ECOG 2 vs. 0,8 měsíců u ECOG 3–4, p < 0,0001) a u pacientů od nízkého, přes střední a vysoké cytogenetické riziko (12,2 vs. 5,8 vs. 2,9 měsíců, p < 0,0001). Kurativní terapie významně prodlužovala celkové přežití v porovnání s terapií paliativní v obou věkových skupinách (medián 8,9 vs. 3,7 měsíců, p < 0,0001 ve skupině 60–69 let a 7,7 vs. 3,9 měsíců, p = 0,029 ve skupině ≥ 70 let). U kurativně léčených pacientů s nepříznivým cytogenetickým rizikem ve věku 60–69 let zlepšovala celkové přežívání alogenní transplantace krvetvorby (medián 10,4 měsíců), netransplantovaní pacienti měli srovnatelné celkové přežití s pacienty s vysokým cytogenetickým rizikem ve věku 60–69 let, kteří byli léčeni paliativně (3,3 vs. 3,6 měsíců, p = 0,884).
Klíčová slova:
akutní myeloidní leukemie – starší pacienti – databáze DATOOL
ÚVOD
Akutní myeloidní leukemie (AML) patří mezi maligní hematologická onemocnění, jejichž výskyt stoupá s věkem [1, 2]. Podle dat amerického Surveillance, Epidemiology and End Results (SEER) se incidence v roce 2018 v USA pohybovala okolo 19,5 nových případů na 100 tisíc obyvatel za rok s mediánem věku při stanovení diagnózy 68 let a maximem případů diagnostikovaných mezi 65. až 74. rokem života [3]. Podle údajů Národního onkologického registru Ústavu zdravotnických informací a statistiky ČR (NOR ÚZIS ČR) se incidence v naší zemi pohybuje okolo 16 nových případů na 100 000 obyvatel ročně a pro rok 2018 byla predikce incidence 367 nových případů AML [4]. Informace o epidemiologii, prognostických rizikových faktorech a přežívání pacientů byly na základě analýzy dat z národních onkologických registrů a databází v různých zemích již publikovány a staly se podkladem pro rizikovou stratifikaci pacientů a optimalizaci péče o nemocné s touto diagnózou [1, 2, 5–9, 10]. Detailní databáze AML pacientů – DATOOL AML České leukemické skupiny – pro život (The Czech Leukemia Study Group – for life, CELL) vznikla k 1.1.2007 a jedná se o databázi shromažďující podrobná data z období stanovení diagnózy, průběhu terapie a „follow-up“ po ukončení léčby. V současné době se na zadávání informací do databáze podílí šest hematologických center v České republice (tab. 1). Cílem této práce je deskripce epidemiologických, klinických a laboratorních dat a analýza celkového přežití v závislosti na vstupním riziku a zvoleném typu terapie u pacientů s AML ve věku šedesáti let a starších, kteří byli zadáni v období od 1.1.2007 do 31.12.2017 do databáze DATOOL AML.
Tab. 1. Hematologická centra participující na databázi DATOOL AML 
PACIENTI A METODIKA
Ve sledovaném období bylo do databáze DATOOL AML zadáno celkem 2171 nově diagnostikovaných AML pacientů, kteří byli léčeni či konzultováni na území České republiky v jednom z šesti participujících hematologických center. Z těchto pacientů bylo 61 % (n = 1332) ve věku 60 let a starších. Do předkládané analýzy byli zařazeni pouze pacienti ≥ 60 let, u nichž byly k dispozici všechny údaje o klinickém stavu v období stanovení diagnózy, typu AML (primární vs. sekundární), subtypu podle klasifikace Světové zdravotnické organizace (World Health Organization, WHO) a informace o tom, zda bylo provedeno vstupně cytogenetické vyšetření (n = 1 008). Celkem 62 (5 %) pacientů s akutní promyelocytární leukemií bylo vzhledem ke zcela odlišné prognóze onemocnění vyřazeno. Analýza byla provedena u celého sledovaného souboru pacientů ≥ 60 let a současně i v rámci dvou věkových podskupin (60–69 let, ≥ 70 let) s cílem určení případných rozdílů v četnosti výskytu vstupních prognosticky nepříznivých faktorů, v terapeutickém přístupu a celkovém přežití.
Diagnóza AML byla stanovena na základě WHO kritérií z roku 2002 [11]. Vstupní cytogenetické vyšetření zahrnovalo stanovení karyotypu G-pruhováním a interfázovou FISH s provedením cíleného panelu vyšetření. Onemocnění bylo vstupně u všech pacientů kategorizováno na základě WHO klasifikace z roku 2008 [12]. Cytogenetické riziko bylo stanoveno na základě kritérií dle The Medical Research Council z roku 2010 [13].
Kurativně léčení pacienti obdrželi indukční chemoterapii 3 + 7 (3 dny daunorubicin 45–90 mg/m2, 7 dní cytosinarabinosid 100 mg/m2) nebo obdobný režim a dva až čtyři cykly konsolidační chemoterapie s cytosinarabinosidem (500–3 000 mg/m2). V případě provedení alogenní transplantace krvetvorby byl použit u všech pacientů nemyeloablativní přípravný režim. Terapeutická odpověď byla hodnocena podle revidovaných IWG (International working group) kritérií z roku 2003 [14].
Analýza celkového přežití (OS) byla provedena pomocí Kaplan-Meierovy metody a log rank testu. Celkové přežití bylo hodnoceno ode dne stanovení diagnózy do dne úmrtí z jakékoliv příčiny, u cenzorovaných pacientů do posledního známého data, kdy byli naživu. Působení různých prediktorů na OS bylo hodnoceno Coxovým modelem proporcionálních rizik. Pro všechny analýzy byla použita hladina statistické významnosti p < 0,05. Evaluace dat byla prováděna v programu R Core Team (2012).
VÝSLEDKY
Základní charakteristika souboru AML pacientů ≥ 60 let
Základní klinická, cytogenetická a laboratorní data jsou uvedena v tabulce 2. Medián věku byl v rámci celého hodnoceného souboru 68 let (rozmezí 60–92 let). Z celkového počtu 1008 pacientů bylo 557 (55 %) pacientů ve věku 60–69 let a 451 (45 %) pacientů ve věku 70 let a starší (medián 74 let).
Tab. 2. Základní charakteristika souboru 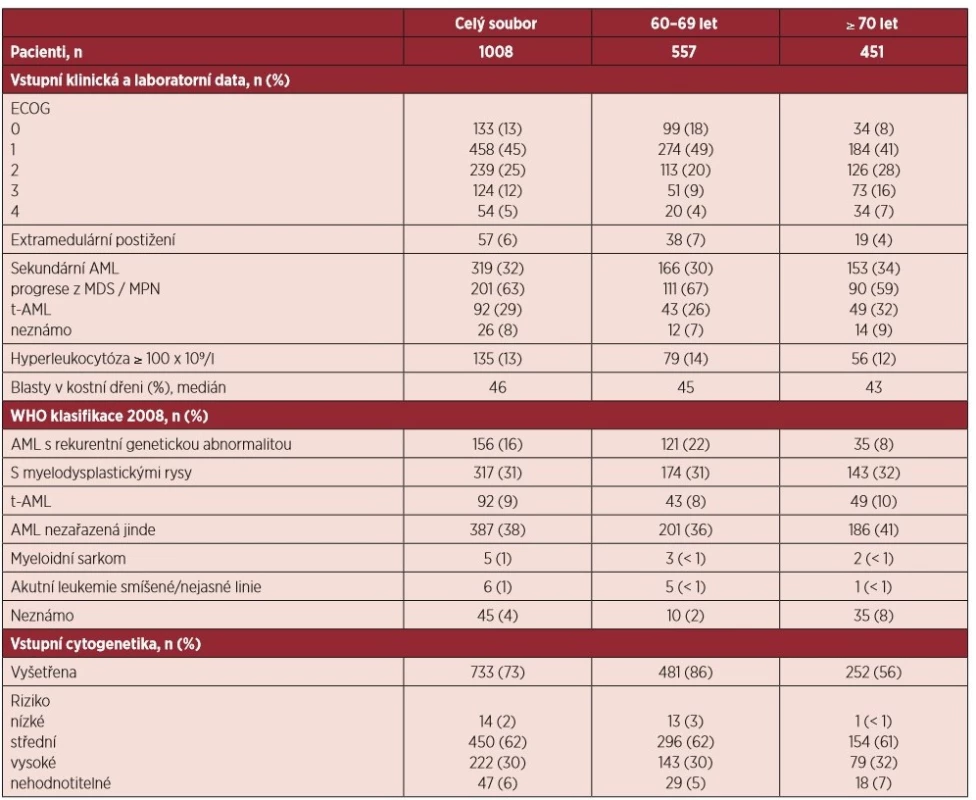
ECOG – Eastern Cooperative Oncology Group performance status, AML – akutní myeloidní leukemie, MDS – myelodysplastický syndrom, MPN – chronické myeloproliferativní onemocnění, t-AML – „therapy related“ AML Z celého souboru bylo 58 % (n = 591) nemocných diagnostikováno ve velmi dobrém klinickém stavu ECOG (Eastern Cooperative Oncology Group) 0 a 1. S narůstajícím věkem nemocných procento pacientů s ECOG 0 a 1 významně klesalo z 67 % ve věkové skupině 60–69 let na 49 % u pacientů ≥ 70 let (p < 0,0001). Současně se s věkem zvyšoval počet pacientů, kteří měli v období stanovení diagnózy nízký performance status ECOG 3 a 4 (13 % vs. 23 %, p < 0,0001).
V 68 % (n = 689) byla AML diagnostikována de novo, sekundární onemocnění se vyskytovalo u 32 % (n = 319) případů. V případě sekundárních AML se v 63 % (n = 201) jednalo o progresi z myelodysplastického syndromu (MDS) nebo chronických myeloproliferativních chorob (MPN),29 % (n = 92) AML vzniklo v důsledku předchozí chemoterapie či radioterapie a u 8 % (n = 26) případů nebyla sekundární příčina do databáze zaznamenána. V rámci obou hodnocených podskupin se poměr de novo a sekundární AML nelišil.
Nejčastěji zastoupeným typem AML podle WHO 2008 v rámci celého souboru i v obou věkových podskupinách byla AML nezařazená jinde („not otherwise specified”, NOS). S výjimkou AML s rekurentní cytogenetickou abnormalitou, která byla významně častěji zastoupena u pacientů ve věku 60–69 let (p < 0,0001), se ostatní typy AML podle WHO vyskytovaly v obou věkových podskupinách se stejnou četností.
Klinické a cytogenetické rizikové faktory
Hyperleukocytóza ≥ 100 x 109/l byla vstupně přítomna u 13 % (n = 135) pacientů. Extramedulární postižení bylo vzácné a vyskytovalo se pouze u 6 % (n = 57). Výskyt obou se s věkem nelišil.
Vstupní cytogenetické vyšetření bylo provedeno celkem v 73 % (n = 733) případů. Ve skupině pacientů ve věku 60–69 let bylo vyšetření karyotypu prováděno významně častěji (86 % vs. 56 %, p < 0,0001). Pacienti s nízkým cytogenetickým rizikem tvořili pouze 2 % (n = 14) ze všech pacientů se známým výsledkem cytogenetiky a téměř všichni (93 %, n = 13) byli ve věku 60–69 let, pouze 1 pacient starší 70 let měl příznivý cytogenetický nález (p = 0,042). Oproti tomu zastoupení středního a vysokého cytogenetickéhorizika bylo v obou sledovaných podskupinách srovnatelné.
Terapie
Údaje o zvoleném terapeutickém přístupu byly k dispozici u 995 (99 %) pacientů (tab. 3). Rozdíl mezi jednotlivými terapeutickými přístupy se v rámci obou hodnocených podskupin významně lišil. Zatímco 91 % (n = 303) ze všech kurativně léčených pacientů bylo ve věku 60–69 let (p < 0,0001), ve skupině pacientů starších 70 let převládal paliativní a symptomatický terapeutický přístup, který byl volen v 93 % (n = 412) případů (p < 0,0001).
Tab. 3. Přehled terapie 
CR – kompletní remise, PR – parciální remise, RD – rezistentní onemocnění, LDaraC – nízce dávkovaný cytosinarabinosid - Kurativní terapie
Kurativní terapie byla v rámci celého souboru volena u jedné třetiny nemocných. Celkem 52 % (n = 174) pacientů dosáhlo po indukční chemoterapii kompletní (CR) či parciální remise (PR) onemocnění. I přesto, že počet kurativně léčených pacientů ve věku ≥ 70 let je v porovnání s pacienty ve věku 60–69 let významně nižší, tak tito pacienti dosahovali CR/PR ve stejném procentu jako intenzivně léčení v mladší věkové skupině 60–69 let. S narůstajícím věkem se rovněž ani nenavyšovalo procento úmrtí v průběhu indukce (6 % v obou podskupinách). Rezistentní onemocnění bylo častěji zastoupeno v mladší podskupině (31 % vs. 13 %, p = 0,038).
Léčebnou odpověď na základě vstupního cytogenetického rizika znázorňuje tabulka 4. Mezi pacienty s nízkým a středním cytogenetickým rizikem nebyl zaznamenán signifikantní rozdíl v procentu dosažených CR/PR po indukční chemoterapii (77 % vs. 58 %, p = 0,247). Ve skupině pacientů s vysokým cytogenetickým rizikem bylo zastoupení CR/PR po indukční chemoterapii významně nižší než u pacientů se středním rizikem (39 % vs. 58 %, p = 0,0079) a nízkým rizikem (39 % vs. 77 %, p = 0,015). Stejně tak ve skupině s vysokým cytogenetickým rizikem bylo významně častěji zastoupeno rezistentní onemocnění v porovnání jak se středním (25 % vs. 46 %, p = 0,0021), tak i nízkým cytogenetickým rizikem (25 % vs. 8 %, p = 0,0117)
Tab. 4. Přehled terapeutické odpovědi u jednotlivých cytogenetických prognostických skupin 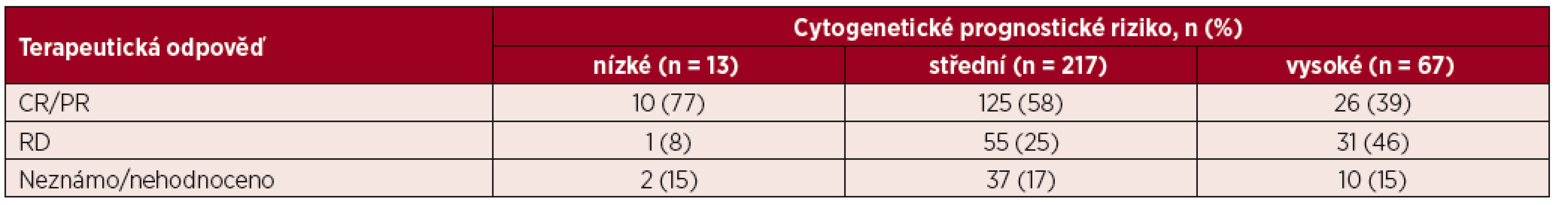
CR – kompletní remise, PR – parciální remise, RD – rezistentní onemocnění Alogenní transplantaci krvetvorné tkáně v rámci první léčebné linie podstoupilo 18 % z kurativně léčených pacientů n = 61), přičemž 87 % těchto pacientů (n = 53) bylo věku 60–69 let. Příbuzného dárce mělo 34 % (n = 21), nepříbuzného dárce 66 % (n = 40) pacientů. V rámci prvního přešetření stavu choroby po transplantaci byla u 59 % (n = 36) pacientů hodnocena CR, ve skupině pacientů 60–69 ve 49 % (n = 30) a u pacientů ≥ 70 let v 75 % (n = 6) případů.
- Nekurativní terapie
Paliativní terapie byla volena v rámci celého sledovaného souboru u 34 % (n = 339) pacientů. Nejčastější paliativní léčbou byla terapie nízce dávkovaným cytosinarabinosidem (LDaraC), kterou bylo léčeno 70 % z paliativně léčených pacientů. Léčba hypometylačními látkami byla volena pouze u 12 % pacientů a 11 % nemocných bylo léčeno v rámci klinické studie.
Symptomaticky léčeno bylo v rámci celého sledovaného souboru 32 % (n = 332) pacientů. V 70 % případů symptomaticky léčených se jednalo o pacienty ve věku ≥ 70 let, u kterých byla symptomatická léčba volena v polovině případů.
Celkové přežití
Křivky celkového přežití (overall survival, OS) jsou znázorněny na obrázku 1.
Obr. 1. Celkové přežití
a) OS celého souboru pacientů, b) OS celého souboru podle ECOG, c) OS u pacientů ve věku 60–69 let podle terapie, d) OS u pacientů ve věku ≥ 70 let podle terapie, e) OS u pacientů ve věku 60–69 let podle cytogenetického rizika, f) OS u pacientů ve věku ≥ 70 let podle cytogenetického rizika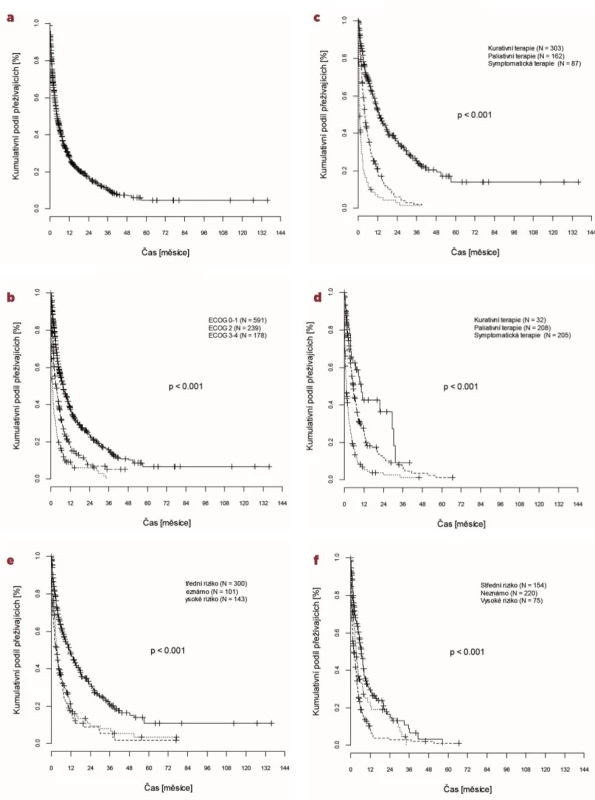
Medián celkového přežití byl v rámci celého souboru 3,5 měsíce, ve skupině pacientů 60–69 let 4,5 měsíce, u pacientů ≥ 70 let 2,4 měsíce (p < 0,0001).
Délka OS se významně odlišovala v závislosti na klinickém stavu nemocných v období stanovení diagnózy. Se zhoršujícím se performance statusem se OS zkracoval. Pacienti diagnostikováni s ECOG 0 a 1 měli téměř dvojnásobný medián OS v porovnání s pacienty s ECOG 2 (4,7 vs. 2,4 měsíců, p < 0,0001) a téměř šestinásobný medián OS v porovnání s pacienty s ECOG 3 a 4 (4,7 vs. 0,8 měsíců, p < 0,0001). Statisticky významný rozdíl byl rovněž mezi pacienty s ECOG 2 a ECOG 3–4 (medián 2,4 vs. 0,8 měsíců, p = 0,0006).
Přežívání nemocných se odlišovalo také v závislosti na vstupním cytogenetickém riziku. V rámci celého souboru postupně klesal medián OS od nízkého, přes střední a vysoké riziko až k pacientům, u kterých nebylo vstupně cytogenetické riziko určeno (12,2 vs. 5,8 vs. 2,9 vs. 1,8 měsíců). S ohledem na velmi nízký počet pacientů s příznivým cytogenetickým rizikem, byl statisticky významně horší OS prokázán mezi nemocnými s vysokým a středním cytogenetickým rizikem (2,9 vs. 5,8 měsíců, p < 0,0001) a vysokým a neznámým cytogenetickým rizikem (2,9 vs. 1,8 měsíců, p = 0,0146).
Při srovnání obou sledovaných věkových podskupin byl nejvíce patrný rozdíl v OS v závislosti na cytogenetickém riziku u nemocných ve věku 60–69 let. V této skupině měli pacienti se středním cytogenetickým rizikem více než dvojnásobný medián OS v porovnání s pacienty s vysokým cytogenetickým rizikem (6,8 vs. 3,1 měsíců, p < 0,0001). Celkové přežití u nemocných ve věku ≥ 70 let se u středního a vysokého cytogenetického rizika významně nelišilo (medián 4,8 a 2,4 měsíců, p = 0,2).
Při srovnání OS pacientů se středním rizikem podle věku byl patrný významný rozdíl mezi nemocnými ve skupině 60–69 let a ≥ 70 let (medián 6,8 vs. 2,4 měsíců, p < 0,0001). Oproti tomu pacienti s vysokým rizikem měli srovnatelně nízké přežití ve skupině 60–69 let i ≥ 70 let (3,1 vs. 2,4 měsíců, p = 0,915).
Přežívání nemocných na základě zvoleného terapeutického přístupu se zásadně v obou skupinách nelišilo. Medián OS byl srovnatelný ve skupině pacientů 60–69 let a ≥ 70 let jak u kurativně (8,9 měsíců vs. 7,7 měsíců, p = 0,215), tak i u paliativně (3,7 měsíců vs. 3,9 měsíců, p = 0,208) a symptomaticky léčených (0,9 měsíců vs. 1,1 měsíců, p = 0,491). A rovněž v obou věkových skupinách kurativní léčba významně zvyšovala OS v porovnání s paliativní léčbou (medián 8,9 vs. 3,7 měsíců, p < 0,0001 ve skupině 60–69 let a 7,7 vs. 3,9 měsíců, p = 0,029 ve skupině ≥ 70 let). Podobně pak také paliativní terapie zlepšovala OS oproti léčbě symptomatické (medián 3,7 vs. 0,9 měsíců, p < 0,0001 ve skupině 60–69 let a 3,9 vs. 1,1 měsíců, p < 0,0001 ve skupině ≥ 70 let).
V multivariantní analýze celkového přežití byly jako statisticky významně zvyšující riziko úmrtí pacienta vyhodnoceny ECOG 2–4, nekurativní terapeutický přístup a vysoké cytogenetické riziko (tab. 5). Při podrobnější analýze skupiny pacientů s kurativním záměrem léčby ve věku 60–69 let ve vysokém cytogenetickém riziku je ale patrné, že kratší OS mají i pacienti, u kterých v rámci první léčebné linie neproběhla alogenní transplantace krvetvorby. Kurativně léčených bylo celkem 41 % (n = 59) pacientů s nepříznivým cytogenetickým nálezem ve věku 60–69 let, z nich 25 % (n = 15) podstoupilo alogenní transplantaci a 75 % (n = 44) bylo po remisi léčeno 2–4 cykly chemoterapie bez transplantace krvetvorby. Transplantovaní pacienti měli výrazně delší OS oproti pacientům, kteří byli konsolidováni pouze chemoterapií (10,4 vs. 3,3 měsíce, p = 0,008) a OS této netransplantované skupiny nemocných byl srovnatelný s OS pacientů s vysokým cytogenetickým rizikem, kteří byli léčení pouze paliativně (3,3 vs. 3,6 měsíců, p = 0,884).
Tab. 5. Multivariantní analýza celkového přežití 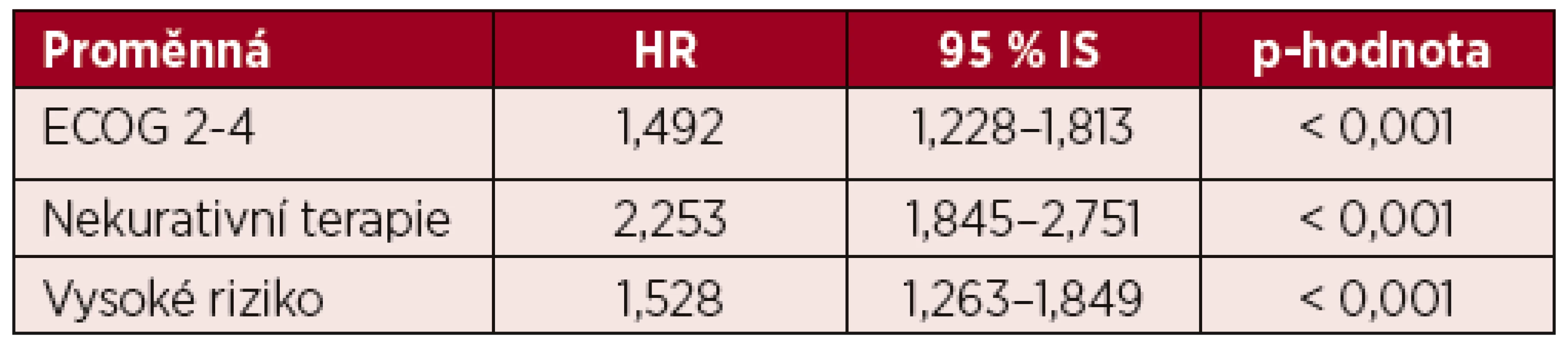
ECOG – Eastern Cooperative Oncology Group performance status, HR – hazard ratio, IS – interval spolehlivosti DISKUSE
Medián celkového přežívání AML pacientů ≥ 60 let se u námi sledovaného souboru neodlišuje od dostupných mezinárodních dat a v porovnání s mladšími pacienty je neuspokojivý [1, 7, 16, 17]. Jedním z hlavních důvodů horších terapeutických výsledků a kratšího OS jsou nepříznivé prognostické faktory, které se u starších nemocných vyskytují s vyšší četností. Jedná se především o nižší performance status v období stanovení diagnózy, který je často způsoben řadou komorbidit, vyšší podíl sekundárního onemocnění oproti mladší populaci pacientů a nepříznivý cytogenetický nález [1, 5, 6, 9, 15, 16, 20].
V souladu s ostatními publikacemi v našem souboru klesá s narůstajícím věkem zastoupení těch, kteří byli diagnostikováni v dobrém klinickém stavu ECOG 0–1 a navyšuje se počet pacientů, jejichž performance status je nízký. Neuspokojivý klinický stav v období stanovení diagnózy zhoršuje toleranci pacientů vůči cytotoxické terapii, zvyšuje riziko komplikací a je prediktorem horšího přežívání nemocných [1, 5, 9, 15].
Výskyt sekundárního onemocnění téměř u jedné třetiny pacientů ≥ 60 let je rovněž vyšší než v mladších věkových kategoriích. Na rozdíl od ECOG ale nedochází k nárůstu sekundárních AML spolu s dalším zvyšováním věku [1, 5, 6, 16].
Jedním z nejsilnějších prognosticky nepříznivých faktorů je vysoké cytogenetické riziko. Jeho incidence rovněž narůstá s věkem a u pacientů starších 60 let se v různých analýzách vyskytuje podobně jako u našeho souboru téměř v jedné třetině případů [1, 6, 9, 15, 18, 20]. V literatuře se pohybuje přežívání pacientů ≥ 60 let s vysokým cytogenetickým rizikem v závislosti na zvolené terapii od 2 do 6 měsíců [8, 15]. Jak se ukázalo při podrobnější analýze naší skupiny nemocných s vysokým cytogenetickým rizikem, OS zlepšuje pouze provedení alogenní transplantace krvetvorby. Ti nemocní, kteří nemají dostupného dárce, anebo u nich transplantaci nelze provést z jiného důvodu, by měli být léčeni paliativně v ambulantním režimu, neboť jinak viditelný benefit intenzivní terapie zde chybí. Krátký OS nemocných, u kterých nebylo vstupně známo cytogenetické riziko, vysvětlujeme tím, že u části těchto pacientů nedovoloval klinický stav či komorbidity zahájení jakékoliv onkologické léčby a vyšetření cytogenetiky tedy u těchto nemocných z prognostického hlediska pozbývá významu. Celkem 66 % pacientů v této skupině mělo vstupně ECOG ≥ 2 a u 55 % (n = 151) pacientů byl volen symptomatický terapeutický postup.
V hodnoceném souboru bylo pouhých 7 % ze všech pacientů ve věku ≥ 70 let léčeno kurativně. Oproti zahraničním pracím se jedná o významně nižší procento nemocných v této věkové kategorii [1, 7, 21]. I přes nízký počet těchto intenzivně léčených pacientů, je u nich v souladu s publikovanými studiemi patrný benefit z kurativní terapie i v rámci našeho souboru. OS byl u intenzivně léčených pacientů dvojnásobný oproti pacientům, kteří byli léčeni paliativně (7,7 měsíců vs. 3,9 měsíců, p = 0,029). Na základě těchto výsledků je zřejmé, že v případě pečlivě uvážené indikace má kurativní terapie včetně případné alogenní transplantace krvetvorby význam i u nemocných v pokročilejším věku. Naše výsledky jsou limitovány nízkým počtem pacientů, a to zejména ve skupině nemocných starších 70 let. V této podskupině bylo velmi nízké zastoupení kurativně léčených pacientů a alogenní transplantace byla provedena pouze v minimu případů. Z tohoto důvodu je pravděpodobně i námi pozorovaný výskyt RD vyšší u pacientů ve věku 60–69 let než u starších nemocných. Téměř u poloviny pacientů starších 70 let nebyl vstupně znám karyotyp, vzhledem k tomuto mohou být zkresleny rozdíly v zastoupení cytogenetických rizikových skupin mezi oběma sledovanými věkovými kategoriemi. Nicméně databáze DATOOL AML reflektuje reálnou klinickou praxi, a je tedy zřejmé, že intenzivní diagnostický a léčebný přístup není u pacientů v pokročilejším věku běžným postupem v ČR.
ZÁVĚR
Tato práce představuje podrobnou analýzu rozsáhlého souboru nemocných s AML ve věku nad 60 let v České republice. U starších nemocných jsme prokázali oproti mladší populaci pacientů nárůst s AML asociovaných prognosticky nepříznivých faktorů, jako je nízký PS, sekundární AML a nepříznivý cytogenetický nález, které mají za následek horší přežívání této skupiny nemocných. Jednoznačně jsme prokázali zlepšení přežívání nemocných s AML ≥ 60 let při použití kurativní strategie, která na rozdíl od ostatních evropských zemí není v rámci České republiky u populace starších AML pacientů běžně užívaným terapeutickým postupem. Vzhledem k tomu, že jednoznačně zlepšuje přežívání této skupiny nemocných, by měla ale být v maximální možné míře zvažována, především u nemocných s ECOG 0 a 1, nízkým a středním cytogenetickým rizikem. Pacienti s vysokým cytogenetickým rizikem by měli být zvažováni k provedení alogenní transplantace krvetvorby vždy, protože bez ní nepřevyšuje benefit samotné intenzivní léčby benefit přístupu čistě paliativního. Potenciál zlepšení přežívání této velké skupiny nemocných mají především nové léky, které se dostávají do klinické praxe v rámci klinických studií [22].
Podíl autorů na přípravě rukopisu
ZS – sepsání rukopisu, příprava analýz, statistické zpracování; ZR – revize rukopisu, design analýzy; LB – statistické zpracování dat; JP – analýza pacientů z databáze; LS, PC, ZK, JN, TS, PŽ, JM – revize rukopisu
Čestné prohlášení
JM – podpora výzkumných projektů od Bristol-Myers Squibb, Novartis, Janssen, Roche, Pfizer.
Ostatní autoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů. Vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Tato práce byla podpořena grantem MUNI/A/1105/2018 a grantem MZ ČR AZV 15-25809A, všechna práva vyhrazena.
Rukopis doručen do redakce dne 7. 3. 2019.
Rukopis přijat po recenzi dne 17. 4. 2019.
MUDr. Zuzana Šustková
Interní hematologická a onkologická klinika LF MU
Jihlavská 20
625 00 Brno
e-mail:Sustkova.Zuzana@fnbrno.cz
Zdroje
1. Juliusson G, Antunovic P, Derolf A, et al. Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute leukemia Registry. Blood 2009;113 : 4179–4187.
2. Bower H, Andersson TM, Björkholm M, Dickman PW, Lambert PC, Derolf AR. Continued improvement in survival of acute myeloid leukemia patients: an application of the loss in expectation of life. Blood Cancer J 2016;6:e390.
3. SEER Dostupné na www: https://seer.cancer.gov/statfacts/html/amyl.html
4. Dušek L, Krejčí D, Mužík J, et al. Hematologické malignity v České populaci: aktuální epidemiologické trendy, predikce vývoje a jejich dopad do úhrad zdravotní péče. Transfuze Hematol dnes 2018;24 : 5–8.
5. Alibhai SM, Leach M, Minden MD, Branwein J. Outcomes and quality of care in acute myeloid leukemia over 40 years. Cancer 2009;115 : 2903–2911.
6. Gantharan SA, Grove CS, P’ng S, et al. Acute myeloid leukemia in Western Australia 1991–2005: a retrospective population-based study of 898 patients regarding epidemiology, cytogenetics, treatment and outcome. Intern Med J 2013;43 : 903–911.
7. Madeiros BC, Satram-Hoang S, Hurst D, Hoang KQ, Momin F, Reyes C. Big data analysis of treatment patterns and outcomes among elderly acute myeloid leukemia patients in the United States. Ann Hematol 2015;94 : 1127–1138.
8. McGregor AK, Moulton D, Bown N, et al. Incidence and outcomes for adults diagnosed with acute myeloid leukemia in the north of England: a real world data study. Leuk Lymphoma 2016;57 : 1575–1584.
9. Nagel G, Weber D, Fromm E, et al. Epidemiological, genetic, and clinical characterization by age of newly diagnosed acute myeloid leukemia based on an academic population-based registry study (AMLSGBiO). Ann Hematol 2017;96 : 1993–2003.
10. Indrák K, Hubáček J, Mayer J, et al. Srovnání účinnosti idarubicinu (Zavedos) a mitoxantronu (Refador) v indukční léčbě akutní myeloidní leukémie nemocných seniorského věku (55 – 75 let) (prospektivní multicentrická randomizovaná studie 1998 – 2000). Vnitřní Lék 2001;47 : 48–56.
11. Vardiman JW, Harris NL, Brunning RD. The world health organization (WHO) classification of the myeloid neoplasm. Blood 2002;100 : 2292–2302.
12. Vardiman JW, Thiele J, Arber DA, at el. The 2008 revision of the world health organization (WHO) classification of myeloid neoplasm and acute leukemia: rationale and important changes. Blood 2009;114 : 937–951.
13. Grimwade D, Hills RK, Moorman AV, et al. Refinement of cytogenetic classification in acute myeloid leukemia: determination of prognostic significance of rare recurring chromosomal abnormalities among 5876 younger adult patients treated in the United Kingdom Medical Research Council trials. Blood 2010;116 : 354–365.
14. Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommenda-tions of the International Working Group for Diagnosis, Standardization of Response Criteria, Treatment Outcomes, and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia. J Clin Oncol 2003;21 : 4642–4649.
15. Grimwade D, Walker H, Oliver F, et al. The importance of diagnostic cytogenetics on outcome in AML: Analysis of 1612 patients entered into the MRC AML 10 trial. Blood 1998;92 : 2322–2333.
16. Menzin J, Lang K, Earle CC, Kerney D, Mallick R. The outcomes and costs of acute myeloid leukemia among the elderly. Arch Intern Med 2001;162 : 1597–1603.
17. Appelbaum FR, Gundacker H, Head DR, et al. Age and acute myeloid leukemia. Blood 2006;107 : 3481–3485.
18. Grimwade D, Walker H, Harrison G, et al. The predictive value of hierarchical cytogenetic classification in older adults with acute myeloid leukemia (AML): analysis of 1065 patients entered into the United Kingdom Medical Research Council AML 11 trial. Blood 2001;98 : 1312–1320.
19. Farag SS, Archer KJ, Mrózek K, et al. Pretreatment cytogenetics add to other prognostic factors predicting complete remission and long-term outcome in patients 60 years of age or older with acute myeloid leukemia: results from Cancer and Leukemia Group B 8461. Blood 2006;108 : 63–73.
20. Bacher U, Kern W, Schnittger S, Hiddemann W, Haferlach T, Schoch C. Population-based age-specific incidences subgroups of acute myeloid leukemia. Haematologica 2005;90 : 1502–1510.
21. Juliusson G. Older patients with acute myeloid leukemia benefit from intensive chemotherapy: an update from the Swedish Acute Leukemia Registry. Clin Lymphoma Myeloma Leuk 2011;11:S54–S59.
22. Čerňan M., Szotkowski T. Moderní léčba akutní myeloidní leukemie. Transfuze Hematol dnes 2017;23 : 16–28.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Úloha signální dráhy transformačního růstového faktoru β v hemopoéze a studie nových inhibitorů této dráhy pro léčbu nízkorizikového myelodysplastického syndromu
- Denosumab a bisfosfonáty u mnohočetného myelomu v roce 2019
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Odběry kostní dřeně pro alogenní transplantaci – zhodnocení desetileté zkušenosti se zaměřením na využití autotransfuzí u dárců
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



