-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Denosumab a bisfosfonáty u mnohočetného myelomu v roce 2019
Denosumab and bisphosphonates in multiple myeloma in 2019
More than 80% of patients with multiple myeloma display evidence of myeloma bone disease (MBD) characterised by the formation of osteolytic lesions throughout the axial and appendicular skeleton. MBD significantly increases the risk of skeletal-related events such as pathological fractures, spinal cord compression and hypercalcaemia. MBD is the result of MM plasma cell-mediated activation of osteoclast activity and suppression of osteoblast activity. The activity of osteoclasts can be suppressed using bisphosphonates (BP) or denosumab. Although generally safe, frequent high doses of BP are associated with adverse events such as renal toxicity and osteonecrosis of the jaw and atypical fractures. As such, optimal duration and dosing of BP therapy is required in order to minimise BP-associated adverse events. The following review provides currently available evidence for the adoption of a tailored approach when using BP for the management of MBD.
Keywords:
bisphosphonates – medication related osteonecrosis of the jaw – atypical fractures – Multiple myeloma
Autoři: Z. Král; Z. Adam; M. Krejčí; L. Pour; V. Sandecká; M. Štork
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 4, p. 320-329.
Kategorie: Souhrnné/edukační práce
Souhrn
Více než 80 % pacientů s mnohočetným myelomem má při stanovení diagnózy nemoci prokázánu osteolytickou aktivitu, charakteristickou tvorbou osteolytických ložisek v axiálním skeletu ale i v dlouhých kostech. Osteolytická ložiska zvyšují riziko kostních komplikací, mezi něž patří patologické fraktury, komprese obratlů s případným útlakem spinálních struktur a hyperkalcemie. Osteolýza vzniká v důsledku aktivace osteoklastů a suprese osteoblastů zprostředkované myelomovými buňkami. Aktivita osteoklastů je potlačitelná bisfosfonáty anebo denosumabem. Ačkoliv tyto léky jsou obecně bezpečné, přesto může dlouhodobá léčba vést k nežádoucím účinkům, mezi něž patří poškození ledvin, osteonekróza čelisti a atypické kostní fraktury. Tyto řídké, ale závažné nežádoucí účinky vedly k modifikaci pravidel pro indikace a délku léčby těmito preparáty s cílem minimalizovat uvedené nežádoucí účinky. Následující text přináší přehled současných názorů na optimalizaci této léčby.
Klíčová slova:
bisfosfonáty – léky indukovaná osteonekróza čelisti – atypické fraktury kostí – mnohočetný myelom
1 ÚVOD
Bisfosfonáty jsou již po třicet let trvalou součástí léčby mnohočetného myelomu (MM), protože více než 80 % nemocných má typická osteolytická ložiska. Kontinuálně však zrají a mění se názory na to, kdy začít s podáváním těchto léků, jak dlouho je podávat a jak se liší jednotlivé léky ve své účinnosti [1].
Po více než jednom desetiletí používání těchto léků byly teprve popsány dvě pozdní, naštěstí řídce se vyskytující, komplikace této léčby. A toto poznání pak modifikovalo dříve platné názory na to, jak dlouho tyto léky podávat.
Jde o osteonekrózu čelisti, obvykle následující po extrakci zubu nebo při tlaku zubní protézy na dáseň, a pak o zvýšenou křehkost kostí, zcela výjimečně se projevující atypickými (únavovými frakturami), neboli zlomeninami bez odpovídajícího násilí. Osteonekróza čelisti v souvislosti s dlouhodobým užíváním bisfosfonátů byla poprvé popsána až v roce 2003 a 2004 (stomatochirurgy Marxem a Ruggierem) [2, 3], ačkoliv léčebný efekt pamidronatu byl popsán již v roce 1991. Takže až po 12 letech používání pamidronatu dali právě stomatologové do souvislosti vyšší četnost osteonekrózy čelisti s užíváním bisfosfonátů. Po prvním popisu této komplikace ke konci roku 2003 pak následovala exploze článků s touto tematikou. Dnes víme, že postihuje 6–9 % pacientů s MM, kteří dostávají bisfosfonáty!
Osteonekróza čelisti nejčastěji vzniká jako důsledek extrakce zubu, ale tento proces může i nastartovat výkon spojený se zakotvením zubního implantátu [5–7], anebo tlakem zubní protézy na měkké tkáně nad čelistí.
V roce 2019 však již je známo, že osteonekrózu čelisti mohou způsobit nejen bisfosfonáty, ale i četné další léky [8].
Vznik atypických únavových fraktur je ještě vzácnější komplikací než osteonekróza čelisti.
Podávání bisfosfonátů zvyšuje kostní hustotu (denzitu), ale se zvyšováním hustoty se však nezvyšuje lineárně pevnost kosti. Ta odvisí od optimální architektury kostních trámců a mimo jiné bisfosfonáty remodelaci brzdí. Tato komplikace byla popsána ještě později než osteonekróza čelisti, až v roce 2008, tedy po 18 letech používání těchto léků. Nejčastěji to bylo v oblasti femuru [9, 10].
K atypické zlomenině může dojít i v oblasti metatarzálních kůstek (obdoba pochodových fraktur). Vzácnost této komplikace signalizuje, že tato komplikace postihuje pouze některé osoby, ale jejich identifikace v průběhu léčby není žádnými dostupnými metodami možná.
Tyto pozdní nežádoucí účinky, rozpoznané až po více než 10 letech podávání bisfosfonátů pacientům s maligní osteolýzou ale i s osteoporózou, vedly ke snaze definovat indikace, kdy přínos této léčby jednoznačně převáží nad nežádoucími účinky. A tak renomované pracovní skupiny publikovaly svá doporučení, která sice nezní identicky, ale není mezi nimi zásadní rozdíl.
Cílem textu je informovat o současných názorech na to, kdy podávat léčbu inhibující resorpci kosti a informovat o doporučení renomovaných odborných společností.
2 KLINICKÉ STUDIE POTVRZUJÍCÍ PŘÍNOS BISFOSFONÁTŮ A DENOSUMABU PRO PACIENTY S MNOHOČETNÝM MYELOMEM
2. 1 Bisfosfonáty
Bolesti kostí, hyperkalcemie a patologické fraktury jsou hlavní příčinou morbidity a mortality této skupiny pacientů. V prospektivních randomizovaných stu-diích byl prokázán statisticky významný přínos klodronatu [11–13], pamidronatu [14, 15], zoledronatu [16]. Podrobnosti z těchto prací byly rozvedeny i v českých publikacích [17]. U ibandronatu je situace složitější. Ve formě článku byla zveřejněna pouze jedna randomizovaná studie, která u pacientů s mnohočetným myelomem srovnávala ibandronat s placebem. A právě v této studii byl ibandronat silně poddávkován, pacienti dostávali ibandronat 1krát měsíčně i. v. pouze v dávce 2 mg, zatímco dnešní běžná dávka je trojnásobná, 6 mg v nitrožilní infuzi 1krát za 4 týdny. A tak není překvapením, že ibandronat v této studii nebyl dostatečně účinný. Ve studii byla testována pouze třetina dávky, která se dnes běžně podává [18]. Ibandronat v dávce 6 mg/měsíc má prokázanou klinickou účinnost u pacientů s kostními metastázami solidních tumorů, srovnatelnou se zoledronatem [19–22]. Formou abstraktu byly publikované závěry německé studie, v rámci níž byl srovnáván ibandronat 6 mg jedenkrát měsíčně se zoledronatem 4 mg 1x měsíčně v souboru pacientů s mnohočetným myelomem. Léčebný efekt byl po všech stránkách lepší u ibandronatu, než u zoledronatu [23]. Vzhledem k prokázané účinnosti ibandronatu u solidních tumorů se předpokládal analogický účinek u mnohočetného myelomu (názor expertů), pro což svědčilo i srovnání Knaufa [23]. Účinnost ibandronatu u mnohočetného myelomu potvrdila i nejnovější metaanalýza [24].
Další dva preparáty ze skupiny bisfosfonátů, alendronat a risedronat, jsou registrované a indikované pouze pro léčbu osteoporózy, jejíž příčinou není maligní onemocnění, stejně tak jako preparát Bonviva, který obsahuje nižší dávku. Bonviva = předplněná injekční stříkačka obsahující Acidum ibandronicum 3 mg ve 3 ml roztoku.
2. 2 Denosumab
K dispozici je metaanalýza randomizovaných klinických studií, do jejichž souborů byli zařazeni pacienti jak s kostními metastázami, tak i mnohočetným myelomem. V této metaanalýze byl srovnáván zoledronat s denosumabem. Autoři této metaanalýzy uvádějí, že denosumab byl o něco účinnější než zoledronat v oddálení vzniku kostních komplikací (skeletal releated events). Ale v délce celkového přežití nebyl rozdíl mezi pacienty léčenými denosumabem či zoledronatem [25].
V březnu 2017 byla poprvé přednesena na 16. myelomovém workshopu a zveřejněna ve formě abstraktu data z první velké klinické studie srovnávající denosumab a zoledronat u nově diagnostikovaných pacientů s mnohočetným myelomem, písemně pak výsledky byly publikovány v roce 2018.
Pacienti byli randomizováni do skupin dostávající podkožní injekce denosumabu 120 mg 1krát měsíčně anebo do skupiny dostávající 4 mg zoledronátu 1krát měsíčně. Celkem bylo randomizováno 1718 pacientů, takže v každé skupině bylo 859 osob. Studie prokázala, že mezi denosumabem a zoledronatem nebyl signifikantní rozdíl v mediánu intervalu do první kostní příhody. Medián do první kostní komplikace (skeletal releated event) byl ve skupině léčené denosumabem 22,8 měsíce a ve skupině léčené zoledronatem 24,0 měsíce. Mezi mediány intervalu do první kostní komplikace nebyl statisticky významný rozdíl.
Stejně tak nebyl signifikantní rozdíl v délce přežití pacientů dostávajících denosumab nebo zoledronat, medián celkového přežití byl 49,5 měsíců. Celkem 1702 pacientů dostalo alespoň jednu dávku studiové léčby a bylo zařazeno do analýzy nežádoucích účinků (850 pacientů dostávajících denosumab a 852 dostávajících zoledronat). Renální toxicita byla popsána u 85 (10 %) pacientů dostávajících denosumab oproti 146 (17 %) dostávajících zoledronat; hypokalcemie byla zaznamenána u 144 (17 %) pacientů dostávajících denosumab versus 106 (12 %) dostávajících zoledronat.
Incidence osteonekrózy čelisti se signifikantně nelišila, ve skupině s denosumabem to bylo 35 (4 %) pacientů, ve skupině se zoledronatem 24 (3 %) pacientů (p = 0,147).
Autoři svoje výsledky zhodnotili slovy: denosumab neměl horší výsledky než zoledronat v parametru časového intervalu do první kostní komplikace. Takže denosumab může být považován za rovnocennou alternativu léčbě zoledronatem u pacientů s mnohočetným myelomem a s kostním postižením [26–28].
I když denosumab v této studii neprokázal větší léčebný přínos než zoledronat, tak jedna přednost se mu upřít nedá: podkožní způsob podání a nezávislost dávky na funkci ledvin při srovnatelné účinnosti se zoledronatem, který vyžaduje sledování kreatininu, redukci při vyšším kreatininu a infuzní aplikaci [27, 28]. Do počátku roku 2019 byla publikována pouze jedna studie srovnávající denosumab s dalšími bisfosfonáty [27, 28].
K závěrům této klinické studie se pak vyjadřují další četní autoři. Někteří z citovaných autorů docházejí k závěru, že možnost podkožního podání a absence vlivu denosumabu na funkci ledvin plně zdůvodní, proč by se měl používat u mnohočetného myelomu místo bisfosfonátů. Současnou cenu v únoru 2019 ukazuje tabulka 1.
Tab. 1. Ceny s daní u přípravků Xgeva a Zoledronic Acid Accord k datu 22. 2. 2019 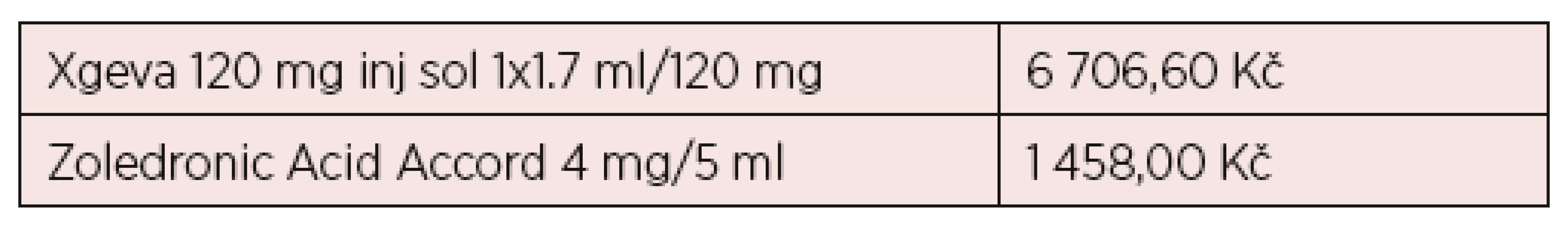
Pokud můžeme sdělit vlastní názor – kdybychom mohli odhlédnout od ekonomiky, tak bychom denosumab rádi používali, protože podkožní forma aplikace by ulevila přeplněným stacionářům, kde se aplikuje infuzní léčba.
Pokud jej ale použijeme, je třeba dávat pozor na popisovanou hypokalcemii či hypomagnesemii u pacientů s poškozenou funkcí ledvin [35, 36].
2. 3 Jak rychle nastupuje účinek bisfosfonátů?
Tuto otázku analyzovala rozsáhlá metaanalýza všech publikovaných klinických studií, které srovnávaly bisfosfonát s placebem. Rozdíly v počtu pozorovaných kostních příhod, mezi něž řadí nevertebrální fraktury, ortopedické výkony pro nové kostní komplikace, analgetická radioterapie na bolestivá ložiska ve skeletu, mezi skupinou dostávající bisfosfonáty a skupinou dostávající placebo, začaly být zřetelné nejdříve po 6 měsících léčby. Míru snížení rizika jednotlivých kostních příhod v čase, jak je uvádí citovaná metaanalýza, zobrazuje tabulka 1. Skutečnost, že rozdíly mezi skupinou s placebem a skupinou s bisfosfonáty začaly být zřetelné až po 6 měsících léčby, lze interpretovat také tak, že v pokročilé fázi nemoci, kdy odhadovaná dálka života není ani 6 měsíců, není nutné tyto léky podávat [37, 38].
A stejně tak zahájení jejich aplikace není nutné ihned v prvních dnech léčby, pokud činí problémy zajistit a uskutečnit komplexní stomatologické ošetření. Výjimkou je léčba hyperkalcemie. V této indikaci je nutné je podat ihned po zjištěné této komplikace [37, 38].
Tab. 2. Dynamika léčebného účinku bisfosfonátů ve srovnání s pacienty dostávajícími placebo* 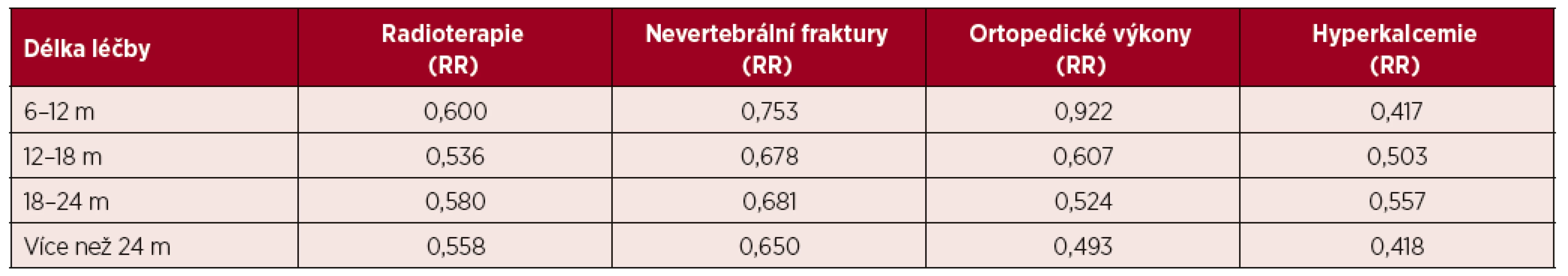
*Tabulka uvádí relativní riziko (RR) ve srovnání s pacienty, kteří bisfosfonáty neměli [37, 38].
m = měsíc; RR = relativní riziko2. 4 Volba léku
Volba preparátů se klasicky děje na základě srovnávacích studií. V posledních dvou desetiletích proběhly sice velmi četné studie, srovnávající jednotlivé preparáty ze skupiny bisfosfonátů s placebem, ale v uvedeném období byly zveřejněny pouze 3 velké randomizované studie, které srovnávaly dva rozdílné preparáty nebo alespoň dvě rozdílné dávky. Bylo prokázáno, že zoledronat byl stejně účinný jako pamidronat z hlediska vlivu na bolesti, na interval do první skeletální komplikace a na incidenci skeletálních komplikací [39]. Druhá randomizovaná klinická studie srovnávala účinek dvou odlišných dávek pamidronatu 90 mg versus 30 mg 1krát za měsíc. V hodnoceném souboru 504 pacientů po třech letech nenašli rozdíl v počtu skeletálních komplikací [40]. Třetí randomizovaná studie srovnávala nitrožilní podávání zoledronatu s perorální léčbou klodronatem 1 600 mg denně v souboru 2 000 pacientů. Tato studie prokázala signifikantně nižší počet kostních komplikací ve skupině s infuzemi zoledronatu oproti pacientům s perorálně podávaným klodronatem. A zatím v této studii jako jediné bylo popsáno prodloužení délky celkového přežití (overal survival = OS) ve skupině léčebné zoledronatem ve srovnání se skupinou léčenou klodronatem [41–43]. Toto je jediná studie, které prokázala výraznější účinek zoledronatu oproti klodronatu. Klodronat je nejstarší z této skupiny, není další klinická studie, které by srovnávala jeho účinek s jinými bisfosfonáty.
Otázce, zda některý z preparátů bisfosfonátů má potenciál prodloužit celkové přežití, se pak věnovala metaanalýza dat obsažených v Cochrane databázi. Metaanalýza 2012 však nepotvrdila prodloužení přežití vlivem podávání zoledronatu oproti léčbě dalšími dnes používanými bisfosfonáty [44].
Metaanalýza z roku 2017 potvrdila závěry předchozí, a uvádí, cituji: We found no evidence of superiority of any specific aminobisphosphonate (zoledronate, pamidronate or ibandronate) or non-aminobisphosphonate (etidronate or clodronate) for any outcome. Nepotvrdili signifikantní rozdíly účinků mezi jednotlivými léky ze skupiny bisfosfonátů [45].
Závěry těchto dvou metaanalýz neopravňují k upřednostnění některého z dostupných bisfosfonátů. U pacientů s mnohočetným myelomem považujeme za indikované a vhodné všechny preparáty bisfosfonátů (klodronat, pamidronat, zoledronat, ibandronat) při odpovídajícím dávkování. Každý u uvedených preparátů se mírně liší spektrem nežádoucích účinků. Domníváme se proto, že optimální je individuální volba bisfosfonátů pro konkrétního pacienta.
2. 5 Indikace a délka podávání bisfosfonátů u pacientů s mnohočetným myelomem
Indikací pro zahájení podávání bisfosfonátů je „symptomatický mnohočetný myelom“. Toto jednoznačné doporučení nevyžaduje průkaz osteoporózy či osteolytických ložisek u osob s prokázaným mnohočetným myelomem, protože je pravděpodobné, že i kdyby osteolytická ložiska nebyla v počátku onemocnění patrná, tak se časem vyvinou. Nicméně u pacientů se symptomatickým mnohočetným myelomem s osteolytickými ložisky je jistě větší imperativ pro indikování bisfosfonátů než u pacientů se symptomatickým myelomem, u nichž výjimečně není žádné osteolytické poškození skeletu detekovatelné a symptomem myelomu, neboli důvodem, proč je pacient léčen, je anémie způsobená myelomem či poškození ledvin mnohočetným myelomem. Velmi ojedinělé jsou případy mnohočetného myelomu bez kostního postižení a přínos bisfosfonátů pro tuto malou skupinu nebyl žádnou studií analyzován.
Indikace pro zahájení podávání bisfosfonátů u mnohočetného myelomu, platná již více než jedno desetiletí, se v podstatě nemění. Ale mění se názory na otázku, jak dlouho je podávat.
V době před rozpoznáním pozdních nežádoucích účinků bisfosfonátů nebyla jasná pravidla pro délku podávání. Pacientů v kompletní remisi bylo před 10 lety méně než je dnes, a tak většina nemocných s mnohočetným myelomem užívala dříve tyto léky dlouhodobě. Mimoto všechny klinické studie srovnávající bisfosfonáty s placebem byly časově omezené.
Po rozpoznání pozdních komplikací bisfosfonátů typu osteonekrózy čelisti a atypických fraktur se začala délka podávání bisfosfonátů omezovat s cílem snížit počty těchto pozdních komplikací. Proto mezinárodně platná léčebná doporučení pro léčbu mnohočetného myelomu preferují podávání bisfosfonátů ukončit u těch pacientů, kteří po protimyelomové léčbě dosáhnou dlouhodobé kompletní remise (CR) či velmi dobré parciální remise nemoci (VGPR). Mezinárodní doporučení se shodují v tom, že bisfosfonáty by měly být podávány u pacientů v CR či ve VGPR nejméně ještě jeden rok od dosažení takto definované léčebné odpovědi, ale ne déle než dva roky [46–51].
Doporučení podávat bisfosfonáty ještě rok po dosažení kompletní remise (ukončení léčby) se odvíjí od faktu, že u části nemocných myelom do jednoho roku recidivuje.
Doporučení nepodávat bisfosfonáty pacientům v CR či parciální remisi déle než dva roky od dosažení CR či VGPR (od ukončení léčby) se odvíjí od zjištěné skutečnosti, že incidence osteonekróz čelisti začíná výrazněji narůstat po dvou letech podávání bisfosfonátů [46].
V současnosti jsou tato pravidla respektována většinou lékařů, protože léčba v souladu s platnými doporučeními je nejlepší ochranou v případě stížnosti pacienta při vzniku osteonekrózy.
Dlouhodobé podávání bisfosfonátů se doporučuje jen těm pacientům s mnohočetným myelomem a s osteolytickými projevy, kteří nedosáhnou ani VGPR, u kterých je dlouhodobě přítomná aktivita nemoci [46–51].
Nicméně i zde je variabilita v postupech, při dlouhodobém podávání se objevují názory, že je možné opustit měsíční interval aplikace a prodloužit jej až na 3 měsíční [52].
V případě biochemického relapsu, který ale zatím nevyžaduje léčbu, se má obnovit léčba bisfosfonáty. Obnovení podávání bisfosfonátů při známkách laboratorního relapsu vedlo k oddálení vzniku dalších kostních komplikací, ne však k prodloužení intervalu do vzniku jiných signálů aktivity nemoci [52]
Názory jednotlivých odborných společností a jejich doporučení uvádíme v přehledu v tabulce 3 [52]. Z ní je patrná snaha definovat ty indikace, kde to jednoznačně přinese nemocnému užitek a nepodávat to v situacích, kdy by potenciální přínos byl převážen riziky.
Tab. 3. Přehled doporučení uznávaných odborných společností pro podávání bisfosfonátů ASCO 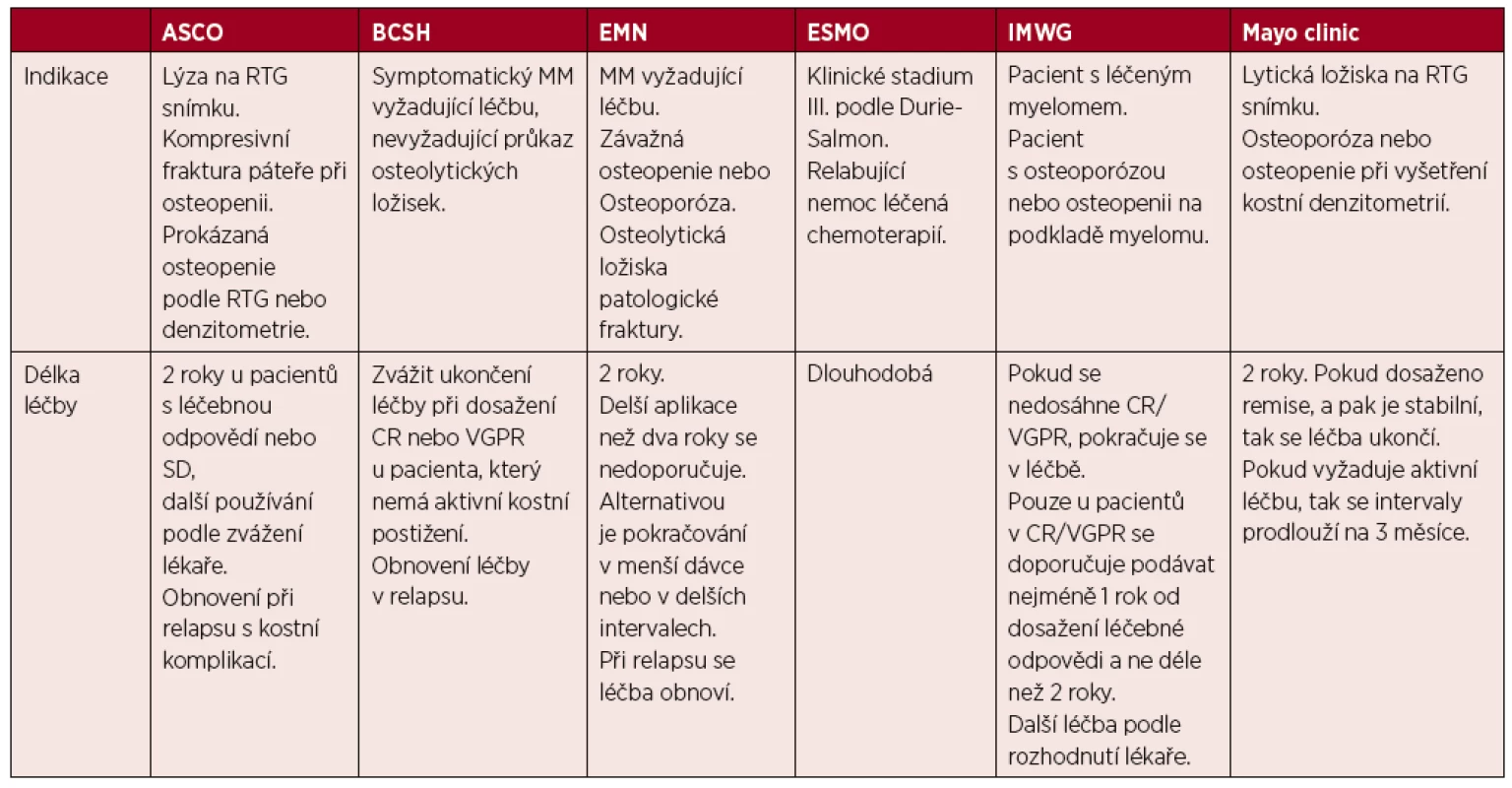
ASCO – American Society of Clinical Oncology, BCSH – British Committee for Standards in Haematology, CR – kompletní remise, VGPR – velmi dobrá parciální remise, EMN – European Myeloma Network, ESMO European Society for Medical Oncology, IMWG – International Myeloma Working Group, NCCN – National Comprehensive Cancer Network S tímto cílem byly definovány rizikové kategorie pro vznik další nové kostní příhody, které uvádí tabulka 4. K těmto novým rizikovým faktorům však přihlíží jen doporučení australské odborné společnosti [52], pro informaci uvádíme ve schématu 1.
Tab. 4. Riziko vzniku nové kostní příhody, komplikace (skeletal releated event)* 
(podle [52])
*Pro zařazení do kategorie musí být splněna všechna kritéria.
CR – kompletní remise, VGPR – velmi dobrá parciální remise, SD – stabilní nemocSchéma 1. Doporučení „Australské společnosti pro léčbu mnohočetného myelomu“ upravující léčbu bisfosfonáty u mnohočetného myelomu 
2. 6 Ne u každého pacienta jsou tato doporučení realizovatelná
Uvedená doporučení se zakládají na výsledcích četných klinických studií. Výsledky studií nám pouze mohou napomoci v rozhodování o léčbě, ale určitě nemohou být v léčbě stoprocentně závazná. Navíc, ať chceme, nebo nechceme, každý výsledek klinické studie je svým způsobem výsledkem léčby jasně definované skupiny pacientů, a proto se nedá zcela paušalizovat pro všechny. Do žádné recentní studie s bisfosfonáty by jistě nešel zařadit pacient s kariézním chrupem s několika váčky, vypadlými implantáty, nebo nespolupracující pacient. Ale my musíme léčit i tyto nemocné, ty, kteří o svůj chrup nebudou pečovat z důvodu jejich životního stylu, z důvodu ekonomické situace či z důvodu zhoršené hybnosti vlivem maligní nemoci, která jim znemožňuje navštěvovat zubní lékaře. Ošetřující hematolog si musí uvědomit, že současná extrakce více zubů v případě, kdy není zajištěna navazující protetická práce, povede k potížím s příjmem stravy a může vést k malnutrici. Náklady na protetické úkony nemusí být akceptovatelné pro nemocného, jehož jediným příjmem je starobní důchod od státu.
Dvě publikace, jejichž autoři se zaměřili na frekvenci podávání bisfosfonátů u pacientů v USA popsali, že v rámci iniciální léčby mnohočetného myelomu jsou bisfosfonáty použity u 65 % nemocných. Při hodnocení starších pacientů se udává, že 45 % z nich nedostalo bisfosfonáty nikdy [54, 55].
Takže je sice pravda, že bisfosfonáty zmenšují počet kostních komplikací, ale proti tomuto benefitu je třeba postavit možné komplikaci. Vždy je nutné zvážit riziko případné osteonekrózy. Zejména u pacientů s vyšším rizikem osteonekrózy čelisti, u kterých nelze očekávat fyzickou i ekonomickou dostupnost komplexní stomatologické péče, raději léčbu bisfosfonáty oddálit, či vůbec nezahajovat. Tuto situaci je nutno vždy s pacientem individuálně prodiskutovat, protože i zde platí, že „v životě nic není zadarmo, za vše se něčím platí“. A osteoprotektivní účinek bisfosfonátů a pacientů s maligní osteolýzou je vykoupen rizikem osteonekrózy, jejíž riziko se zvyšuje s délkou léčby bisfosfonáty.
Pokud se již ošetřující hematolog rozhodne poslat pacienta na extrakci zubu, což stomatochirurg obratem udělá, měl by se napřed zeptat pacienta, zda vůbec má zubaře, který mu udělá odpovídající protetické práce, zda na to má finance a zda je schopen se k zubaři v dohledné době dostavit. Pokud je pacient omezeně pohyblivý, tak pro něj může být ordinace stomatologa, k němuž musí zdolat jedno či dvě poschodí, téměř nedostupná. Prostě jako u každého rozhodnutí v životě, i před odesláním pacienta na extrakci zubů je nutno zvážit pozitiva i negativa tohoto rozhodnutí.
2. 7 Podávat bisfosfonáty u asymptomatického myelomu?
Otázku, zda podávat bisfosfonáty pacientům s mnohočetným myelomem, kteří splňují diagnózu asymptomatického myelomu, řešilo mnoho studií. Závěry všech těchto studií byly podobné. Podávání bisfosfonátů pacientům s asymptomatickým myelomem, tedy myelomem bez prokazatelných osteolytických ložisek, kteří ještě nevyžadují zahájení cytostatické léčby, vedlo k tomu, že v době přechodu do symptomatické formy mnohočetného myelomu měli tito nemocní skelet podstatně méně poškozený nemocí než ti, kteří bisfosfonáty nedostávali. Vlivem podávání bisfosfonátů však nedošlo k prodloužení asymptomatické fáze myelomu [55–57]. Tyto výsledky byly dříve interpretovány jako jednoznačná indikace pro zahájení podávání bisfosfonátů pacientům s asymptomatickým a tedy neléčeným myelomem. Za posledních deset let se však hodně zlepšily možnosti detekce počátků osteolytické aktivity mnohočetného myelomu (celotělové „low-dose“ CT, FDG-PET/CT). To znamená, že mnozí pacienti, kteří by dříve byli podle rentgenových snímků ponecháni ve skupině asymptomatického myelomu, jsou dnes však přeřazováni do symptomatické formy a léčeni díky průkazu časných forem osteolýzy metodou celotělového „low-dose“ CT nebo FDG-PET/CT vyšetření.
Podání bisfosfonátů u pacientů s asymptomatickým myelomem, nevyžadujícím cytostatikou léčbu, v roce 2019 odvisí od rozhodnutí ošetřujícího lékaře, který individuálně vyhodnotí potenciální přínos oproti riziku pozdních komplikací při dlouhodobém podávání bisfosfonátů.
Pokud má pacient osteoporózu, tak ta je považována za jeden z argumentů pro podávání bisfosfonátů, protože mnohočetný myelom nezpůsobuje pouze jasná osteolytické ložiska, ale při difuzní infiltraci kostní dřeně způsobuje i osteoporózu. Takže průkaz osteoporózy u pacienta jinak řazeného do kategorie asymptomatický myelom je jedním z argumentů pro podání bisfosfonátů.
2. 8 Dávkování v závislosti na funkci ledvin
Klodronát je k dispozici ve dvou preparátech (Bonefos a Lodronat). Pro Bonefos je v příbalovém letáku doporučení pro úpravu dávek při renální insuficienci, takže ani závažné renální selhání není kontraindikací jeho podání, pouze k úpravě dávky. Při závažném renálním selhání se snižuje nitrožilní dávka na 50 %, v případě perorální dávky je důraz na redukci méně striktní, je však nutno pečlivěji monitorovat případné nežádoucí účinky (sledování hladiny kalcia a další vývoj hodnot urey, kreatininu, případně clearence) a případně se prodlužuje doba aplikace. Podle naší zkušenosti lze podat při hyperkalcemii Bonefos v dávce 1 500 mg v pomalé infuzi injektomatem či infuzní pumpou v průběhu 12 hodin, aniž bychom pozorovali jakékoliv nežádoucí účinky. Bisfosfonáty mají krátký plazmatický poločas, krev je po průchodu kostní tkání zbavena bisfosfonátů, a tak velmi pomalé podávání nevede k vyšší plazmatické hladině.
Pamidronat je možné podávat i při závažném renálním selhání, a to dokonce bez redukce dávky, ale s prodloužením intervalu nitrožilní infuze s maximální rychlostí 20 mg/hodinu. Pro potencionální nefrotoxicitu se doporučuje sledovat hladinu urey a kreatininu při každé aplikaci.
Zoledronat je omezen pouze pro nemocné s dobrou funkcí ledvin. Výrobce doporučuje nepodávat jej dlouhodobě nemocným s hodnotou kreatininu nad 265 μmol/l. Pro jednorázovou aplikaci v případě hyperkalcemie je povolená hladina vyšší, 400 μmol/l.
V roce 2005 bylo nově zveřejněno doporučení pro úpravy dávek zoledronatu podle clearance kreatininu, což platí pro nemocné s kreatininem v rozsahu od normálních hodnot až do 256 μmol/l. Pro potencionální nefrotoxicitu se doporučuje sledovat hodnoty urey a kreatininu při každé aplikaci zoledronatu a při zjištěném vzestupu léčbu přerušit. Zhoršování renálních funkcí se v klinických studiích objevilo po mediánu 4 měsíců a dále pokračovalo zhruba po další dva měsíce i po ukončení podávání zoledronatu.
Ibandronat má velmi příznivý bezpečnostní profil a ledvinné funkce nezhoršuje [58, 59]. Podává se v dávce 6 mg i. v. a při snížení clearance pod 0,5 ml/s je doporučena redukce nitrožilní dávky z 6 na 2 mg a prodloužení trvání infuze nejméně na 1 hodinu.
U pacientů s těžkou poruchou renálních funkcí (CLcr < 30 ml/min) se doporučuje snížení perorální dávky na jednu 50 mg tabletu jednou týdně.
U ibandronatu se v dokumentaci objevuje doporučení redukovat dávku při chronické renální insuficienci. Pokud je kreatininová clearance nad 30 ml/minutu (0,5 ml/sec), podává se plná dávka. Při clearance pod 30 ml/min (0,5 ml/s) se doporučuje podávat 2 mg v intervalu 3–4 týdnů a infuze by měla trvat nejméně 1 hodinu.
Nicméně, v literatuře lze najít více publikací malých sérií pacientů s hyperkalcemií, léčenou neredukovanou dávkou ibandronatu i při renální insuficienci, u nichž nebylo popsáno žádné poškození ledvin. Autoři těchto sdělení doporučují neredukovat dávku ibandronatu u pacientů s akutní hyperkalcemií a zhoršenou funkcí ledvin [58–63].
Závěry pro praxi
- Dlouhodobé léčebné podávání bisfosfonátů je doporučováno všem pacientům s nepochybnou diagnózou symptomatický mnohočetný myelom [64].
- Podávání bisfosfonátů nemocným s mnohočetným myelomem v asymptomatické fázi nemoci bez známek osteolýzy, kteří zatím nevyžadují léčbu, odvisí od rozhodnutí ošetřujícího lékaře, který pro konkrétní situaci vyhodnotí potenciální přínos a míru rizika. Obecně dnes není považováno za obligátní [64].
- Výběr preparátu závisí na preferenci pacienta a lékaře a stavu organismu před léčbou, zvláště s ohledem na poškození ledvin a možnost vzniku osteonekrózy [64].
- V případě dosažení kompletní remise či velmi dobré parciální remise mnohočetného myelomu je vhodné léčbu časově omezit, aby léčby probíhala alespoň jeden rok od dosažení této léčebné odpovědi, ale ne dále než dva roky.
- V případně biochemicky zjevné recidivy myelomu je vhodné obnovit podávání bisfosfonátů [64].
- Opatrnost a úprava dávek těchto preparátů je nutná při středním a závažném selhání ledvin.
- Před podáním bisfosfonátů je nutné stomatologické vyšetření včetně panoramatického snímku čelisti a vhodné jsou i pravidelné kontroly stomatologem, který je informován o riziku osteonekrózy [64].
- V případě problematického chrupu s nutností četných extrakcí je na zvážení, co je pro pacienta závažnější, zda:
- a) provedení četných extrakcí i s očekáváními obtížemi při zajištění protetického řešení a podání bisfosfonátu,
- b) nebo ponechání problematického chrupu bez extrakcí a nepodání bisfosfonátů [64].
- V případně vzniku jedné ze dvou vzácných komplikací, osteonekrózy čelisti či atypické fraktury vlivem zvýšení křehkosti kostí je na lékaři, aby zvážil další potenciální přínos pokračování podávání bisfosfonátů oproti riziku progrese nežádoucích účinků a podle toho se rozhodl, zda v léčbě pokračovat či léčbu bisfosfonáty raději ukončit [64].
- Denosumab by byl pro pacienty s mnohočetným myelomem výhodnou alternativou bisfosfonátů. Má výhodu v podkožní formě podání, v absenci nefrotoxicity a nutnosti redukovat dávky při snížené hodnotě kreatininové clearance. V praxi je v ČR denosumab používám běžně v onkologických indikacích, ale z regulačních důvodů zatím ne tak běžně u mnohočetného myelomu. Na stránkách SÚKLu se lze dne 31. 5. 2019 dočíst: „Denosumab je předepisován k prevenci kostních příhod u dospělých pacientů s nádorovým onemocněním s osteolytickými, osteoblastickými nebo smíšenými kostními metastázami solidních tumorů.“ Mnohočetný myelom není na těchto stránkách SÚKLu zatím vyjmenován, ani není použito obecnější formulace osteolytická ložiska způsobená maligním krevním onemocněním, i když je dostupná již delší dobu randomizovaná klinická studie prokazující srovnatelný účinek se zoledronatem u mnohočetného myelomu.
Podíl autorů na přípravě rukopisu
Na sepsání článku se podíleli všichni autoři přibližně stejnou měrou.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 8. 3. 2019.
Přijato po recenzi dne 25. 6. 2019.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno-Bohunice
e-mail: adam.zdenek@fnbrno.cz
Zdroje
1. Russell RG. Bisphosphonates: the first 40 years. Bone 2011;49(1):2–19.
2. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003;61(9):1115–1117.
3. Ruggiero SL, Mehrota B. Osteonecrosis of the jaws associated with the use of bisphophonates; a review of 63 cases. J Oral Maxillofac Surg 2004;62 : 527–534.
4. Marx RE, Sawatari Y, Fortin M, Broumand V. Bisphosphonates--induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention and treatment. J Oral Maxillofac Surg 2005;63 : 1567–1575.
5. Ferlito S, Liardo C, Puzzo S. Bisphosponates and dental implants: a case report and a brief review of literature. Minerva Stomatol 2011;60(1–2):75–81.
6. Montoya-Carralero JM, Parra-Mino P, Ramírez-Fernández P, et al. Dental implants in patients treated with oral bisphosphonates: a bibliographic review. Med Oral Patol Oral Cir Bucal 2010;15(1):e65–e69.
7. Favia G, Piattelli A, Sportelli P, Capodiferro S, Iezzi G. Osteonecrosis of the posterior mandible after implant insertion: a clinical and histological case report. Clin Implant Dent Relat Res 2011;13(1):58–63.
8. Treglerová J, Zelinka J, Adam Z, et al. Osteonekróza čelisti, atypické fraktury kostí a další méně časté nežádoucí účinky bisfosfonátů. Transfuze Hematol dnes; v tisku.
9. Lenart BA, Lorich DG, Lane JM. Atypical fractures of the femoral diaphysis in postmenopausal women taking alendronate. N Engl J Med 2008;358(12):1304–1306.
10. Puhaindran ME, Farooki A, Steensma MR, et al. Atypical subtrochanteric femoral fractures in patients with skeletal malignant involvement treated with intravenous bisphosphonates. J Bone Joint Surg Am 2011;93(13):1235–1242.
11. Delmas PD, Charhon S, Chapuy E, et al. Long term effects of dichloromethylene diphosphate (C12MDP) on skeletal lesions in multiple myeloma. Metabol Bone Dis Rel Res 1982;4 : 163–168.
12. Lahtinen R, Laakso M, Palva I, et al. Randomised, placebo controlled multicentre trial of clodronate in multiple myeloma. Finnish Leukemia Group. Lancer 1992;340 : 1049–1052.
13. Closkey EV, MacLennan IC, Drayson MT, et al. A randomized trial of the effect of clodronate on skeletal morbitidy in multiple myeloma. MRC Working Party on Leukemia in Aduls. Brit J Haematol 1998;100 : 317–325.
14. Berenson JR, Lichtenstein A, Porter L, et al. Efficacy of pamidronate in reducing skeletal events in patientes with advanced multiple myeloma. N Engl J Med 1996;334 : 488–493.
15. Berenson JR, Lichtenstein A, Porter L, et al. Long-term pamidronate treatment of advanced multiple myeloma patients reduces skeletal events. Myeloma Aredia Study Group. J Clin Oncol 1998;16(2):593–602.
16. Rosen LS, Gordon D, Tchekmedyian NS, et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a phase III, double-blind, randomized trial – the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol 2003;15 : 31500–3157.
17. Adam Z, Ševčík P, Vorlíček J, et al. Kostní nádorová choroba. Praha, Grada 2005, 296s.
18. Menssen HD, Sakalová A, Fontana A, et al. Effects of long-term intravenous ibandronate therapy on skeletal-related events, survival, and bone resorption markers in patients with advanced multiple myeloma. J Clin Oncol 2002;20(9):2353–2359.
19. Body JJ, Diel IJ, Lichinitser MR, et al. Intravenous ibandronate reduces the incidence of skeletal complications in patients with breast cancer and bone metastases. Ann Oncol 2003; 14 : 1399–1405.
20. Barrett-Lee P, Casbard A, Abraham J, et al. Oral ibandronic acid versus intravenous zoledronic acid in treatment of bone metastases from breast cancer: a randomised, open label, non-inferiority phase 3 trial. Lancet Oncol 2014;15(1):114–122.
21. Body JJ, Lichinitser M, Tjulandin S, et al. Oral ibandronate is as active as intravenous zoledronic acid for reducing bone turnover markers in women with breast cancer and bone metastases. Ann Oncol 2017;18(7):1165–1171.
22. Pecherstorfer M, Rivkin S, Body J, et al. Long-term safety of intravenous ibandronic acid for up to 4 years in metastatic breast cancer: an open-label trial. Clin Drug Investig 2006; 26(6):315–322.
23. Knauf W, Berger R, Kropff M, et al. Compare – result of a randomised study to assess the renal safety nad efficacy of ibandronate and zoledronate in multiple myeloma patients. Onkologie 2010;33(Suppl 6):246 (abstr. 824).
24. Geng CJ, Liang Q, Zhong JH, et al. Ibandronate to treat skeletal-related events and bone pain in metastatic bone disease or multiple myeloma: a meta-analysis of randomised clinical trials. BMJ Open 2015;5(6):e007258.
25. Chen F, Pu F. Safety of denosumab versus zoledronic acid in patients with bone metastases: a meta-analysis of randomized controlled trials. Oncol Res Treat 2016;39(7–8): 453–459.
26. Raje N, Terpos E, Willenbacher W, Krejčí M, et al. An international randomised trial comparing denosumab with zoledronic acid for the treatment of bone disease in patients with newly diagnosed multiple myelom. 16th International Myeloma Workshop March 1–4. 2017 New Delhi, abstrakt OP-046 e39.
27. Raje N, Terpos E, Willenbacher W, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomised, controlled, phase 3 study. Lancet Oncol 2018;19(3):370–381.
28. Raje N, Vadhan-Raj S, Willenbacher W, et al. Evaluating results from the multiple myeloma patient subset treated with denosumab or zoledronic acid in a randomized phase 3 trial. Blood Cancer J 2016;6:e378. doi: 10.1038/bcj.2015.96.
29. Goldstein DA. Denosumab for bone lesions in multiple myeloma – what is its value? Haematologica 2018;103(5):753–754.
30. Raje N, Roodman GD, Willenbacher W, et al. A cost-effectiveness analysis of denosumab for the prevention of skeletal-related events in patients with multiple myeloma in the United States of America. J Med Econ 2018;21(5):525–536.
31. Yee AJ, Raje NS. Denosumab for the treatment of bone disease in solid tumors and multiple myeloma. Future Oncol 2018;14(3):195–203.
32. Gavriatopoulou M, Dimopoulos MA, Kastritis E, et al. Emerging treatment approaches for myeloma-related bone disease. Expert Rev Hematol 2017; 10(3): 217–228.
33. Vallet S, Filzmoser JM, Pecherstorfer M, et al. Update on pathogenesis and novel treatment strategies. Pharmaceutics 2018;10(4) pii:E202. doi: 10.3390/pharmaceutics10040202.
34. Dimopoulos MA, Kastritis E. Denosumab for myeloma bone disease: ready for prime time? Lancet Oncol 2018;19(3):277–278.
35. Marlow CF, Sharma S, Babar F, et al. Severe hypocalcemia and hypomagnesemia with denosumab in advanced chronic kidney disease: case report and literature review. Case Rep Oncol Med 2018;2018 : 2059364. doi: 10.1155/2018/2059364.
36. Terpos E, Christoulas D, Gavriatopoulou M. Biology and treatment of myeloma related bone disease. Metabolism 2018;80 : 80–90.
37. Ross JR, Saunders Y, Edmonds PM, et al. A systematic review of the role of bisphosphonates in metastatic disease. Health Technol Assess 2004;8(4):1–176.
38. Ross JR, Saunders Y, Edmonds PM, et al. Systematic review of role of bisphosphonates on skeletal morbidity in metastatic cancer. BMJ 2003;327(7413):469.
39. Rosen LS, Gordon D, Kaminski M, et al. Zolendronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma. A phase III double blind comparative trial. Cancer J 2001;7 : 377–387.
40. Gimsing P, Carlson K, Turesson I, et al. Effect of pamidronate 30 mg versus 90 mg on physical function in patients with newly diagnosed multiple myeloma (Nordic Myeloma Study Group): a double-blind, randomised controlled trial. Lancet Oncol 2010;11(10):973–982.
41. Morgan GJ, Davies FE, Gregory WM, et al. First-line treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX): a randomised controlled trial. Lancet 2010;376(9757):1989–1999.
42. Morgan GJ, Child JA, Gregory WM, et al. Effects of zoledronic acid versus clodronic acid on skeletal morbidity in patients with newly diagnosed multiple myeloma (MRC Myeloma IX): secondary outcomes from a randomised controlled trial. Lancet Oncol 2011; 12(8): 743–752.
43. Morgan GJ, Davies FE, Gregory WM, et al. Effects of induction and maintenance plus long-term bisphosphonates on bone disease in patients with multiple myeloma: the Medical Research Council Myeloma IX Trial. Blood 2012;119(23):5374–5383.
44. Mhaskar R, Redzepovic J, Wheatley K, et al. Bisphosphonates in multiple myeloma: a network meta-analysis. Cochrane Database Syst Rev 2012;(5):CD003188. doi: 10.1002/14651858.CD003188.
45. Mhaskar R, Kumar A, Miladinovic B, et al. Bisphosphonates in multiple myeloma: an updated network meta-analysis. Cochrane Database Syst Rev 2017;12:CD003188. doi: 10.1002/14651858.CD003188.
46. Fung P, Bedogni G, Bedogni A, et al. Time to onset of bisphosphonate-related osteonecrosis of the jaws: a multicentre retrospective cohort study. Oral Dis 2016. doi: 10.1111/odi.12632.
47. Terpos E, Morgan G, Dimopoulos MA, et al. International Myeloma Working Group recommendations for the treatment of multiple myeloma-related bone disease. J Clin Oncol 2013;31(18):2347–2357.
48. Snowden JA, Ahmedzai SH, Ashcroft J, et al. Guidelines for supportive care in multiple myeloma 2011. Br J Haematol 2011;154(1):76–103.
49. Terpos E, Sezer O, Croucher PI, et al. The use of bisphosphonates in multiple myeloma: recommendations of an expert panel on behalf of the European Myeloma Network. Ann Oncol 2009;20(8):1303–1317.
50. Kyle RA, Yee GC, Somerfield MR, et al. American Society of Clinical Oncology 2007 clinical practice guideline update on the role of bisphosphonates in multiple myeloma. J Clin Oncol 2007;25(17):2464–2472.
51. García-Sanz R, Oriol A, Moreno MJ, et al for Spanish Myeloma Group (GEM/PETHEMA). Zoledronic acid as compared with observation in multiple myeloma patients at biochemical relapse: results of the randomized AZABACHE Spanish trial. Haematologica 2015;100(9):1207–1213.
52. Lee OL, Horvath N, Lee C, et al. Bisphosphonate guidelines for treatment and prevention of myeloma bone disease. Internal Medicine J 2017;47 : 938–951.
53. McGrath LJ, Hernandez RK, Overman R, et al. Initiation and interruption in intravenous bisphosphonate therapy among patients with multiple myeloma in the United States. Cancer Med 2019;8(1):374–382.
54. Leng S, Chen Y, Tsai WY, et al. Use of bisphosphonates in elderly patients with newly diagnosed multiple myeloma. J Natl Compr Canc Netw 2019;17(1):22–28.
55. Witzig TE, Laumann KM, Lacy MQ, et al. A phase III randomized trial of thalidomide plus zoledronic acid versus zoledronic acid alone in patients with asymptomatic multiple myeloma. Leukemia 2013;27(1):220–225.
56. D‘Arena G, Gobbi PG, Broglia C, et al. Pamidronate versus observation in asymptomatic myeloma: final results with long-term follow-up of a randomized study. Leuk Lymphoma 2011;52(5):771–775.
57. Musto P, Petrucci MT, Bringhen S, et al. A multicenter, randomized clinical trial comparing zoledronic acid versus observation in patients with asymptomatic myeloma. Cancer 2008;113(7):1588–1595.
58. Henrich DM, Hoffmann M, Uppenkamp M, et al. Tolerability of dose escalation of ibandronate in patients with multiple myeloma and end-stage renal disease: a case series. Onkologie 2009;32(8–9):482–486.
59. Bergner R, Henrich DM, Hoffmann M, et al. Renal safety and pharmacokinetics of ibandronate in multiple myeloma patients with or with-out impaired renal function. J Clin Pharmacol 2007;47(8):942–950.
60. Bergner R, Henrich DM, Hoffmann M, etl al. Therapy of hypercalcemia with ibandronate in case of acute renal failure. Internist (Berl) 2006;47(3):293–296.
61. Diel IJ, Weide R, Köppler H, et al. Risk of renal impairment after treatment with ibandronate versus zoledronic acid: a retrospective medical records review. Support Care Cancer 2009;17(6):719–725.
62. Henrich D, Hoffmann M, Uppenkamp M, et al. Ibandronate for the treatment of hypercalcemia or nephrocalcinosis in patients with multiple myeloma and acute renal failure: Case reports. Acta Haematol 2006;116(3):165–172.
63. Jackson GH. Renal safety of ibandronate. Oncologist 2005;10(Suppl 1):14–18.
64. Maisnar V, Pour L, Krejčí M, et al. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelomovou Spoločností pro diagnostiku a léčbu mnohočetného myelomuu mnohočetného myelomu. Transfuze Hematol dnes 2018;24(Supl 1):1–157.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Úloha signální dráhy transformačního růstového faktoru β v hemopoéze a studie nových inhibitorů této dráhy pro léčbu nízkorizikového myelodysplastického syndromu
- Denosumab a bisfosfonáty u mnohočetného myelomu v roce 2019
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Odběry kostní dřeně pro alogenní transplantaci – zhodnocení desetileté zkušenosti se zaměřením na využití autotransfuzí u dárců
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Genová editace systémem CRISPR/Cas9 a její využití v hematologii
- Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML
- Komplexní mechanismy účinku inhibitorů „BCR signalizace“ a vzniku rezistence na tuto cílenou léčbu u chronické lymfocytární leukemie
- Mutace genů rodiny RAS u pacientů s akutní myeloidní leukemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



