-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
Development of chronic myeloid leukaemia treatment over the past 25 years
Introduction of tyrosine kinase inhibitors into the treatment of chronic myeloid leukaemia (CML) over the past 25 years has resulted in a revolutionary change and has had a crucial impact on global treatment strategies in oncology. CML has been transformed from a deadly malignancy into a chronic disorder with patients today dying more frequently from other illnesses and patient overall survival equalling that of the general population. As treatment efficacy rises, prevention and management of side effects is of growing importance. The logical next step is an attempt to stop treatment in optimally responding patients with the aim of maintaining treatment-free remission. On the other hand, a small fraction of high-risk patients can still profit from bone marrow transplantation and these patients may profit prospectively from the introduction of new classes of inhibitors acting outside the ABL kinase domain. Cure of CML with targeted conservative treatment has become the long-term aim. This review discusses the developments in CML treatment over the past 25 years with emphasis on the Czech contribution.
Keywords:
chronic myeloid leukaemia – Tyrosine kinase inhibitors – interferon alpha
Autoři: E. Faber; K. Indrák
Působiště autorů: Hemato-onkologická klinika FN a LF UP v Olomouci
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 1, p. 118-124.
Kategorie: Souhrnné/edukační práce
Souhrn
Léčba chronické myeloidní leukemie (CML) během posledního čtvrtstoletí prodělala díky zavedení inhibitorů tyrosinové kinázy revoluční přeměnu, jejíž úspěch zásadně ovlivnil globální strategie terapie v onkologii. Ze smrtící malignity se z CML stalo chronické onemocnění, u něhož je dnes častější příčinou úmrtí jiná choroba a délka přežití nemocných se srovnává s délkou přežití běžné populace. S účinností léčby roste důležitost prevence a zvládání nežádoucích účinků léčby, pro které se jako logická varianta u optimálně reagujících pacientů zkouší přerušení terapie za současného udržení molekulární remise bez pokračování léčby. Na druhé straně malá frakce vysoce rizikových nemocných stále profituje z provedení transplantace a výhledově pro ně bude přínosem také zavedení nových inhibitorů působících na leukemický protein mimo ABL kinázovou doménu. Dlouhodobým cílem se stává vyléčení CML pomocí cílené konzervativní terapie. V článku je diskutován vývoj léčby CML za posledních 25 let s důrazem na český přínos.
Klíčová slova:
chronická myeloidní leukemie – inhibitory tyrosinové kinázy – interferon alfa
Před 25 lety bylo v praxi možné pacienta s chronickou myeloidní leukemií (CML) buď transplantovat (v případě, že byl mladší – ideálně pod 40 let – a měl k dispozici HLA kompatibilního dárce krvetvorných buněk), nebo léčit konzervativně interferonem alfa, který začal být u nás dostupný po roce 1990. U většiny nemocných muselo být podávání vysokých dávek interferonu (5 MU/m2/den) ukončeno pro neúčinnost, nesnášenlivost nebo toxicitu. Pouze asi třetina nemocných dosáhla kompletní cytogenetické odpovědi a pouze necelá třetina z těchto pacientů dosáhla odpovědi molekulární, v tu dobu ověřitelnou pouze pomocí klasické kvalitativní RT-PCR (o vývoji kvantitativní PCR se dočtete v článku kolegyně Machové Polákové na s. 34–42 tohoto čísla). Klinické studie druhé poloviny 90. let se převážně zaměřovaly na ověřování účinku kombinace interferonu a cytostatik (hydroxyurey anebo cytarabinu). Velkou pozornost vzbudila publikace Angela Carelly, který potvrdil možnost mobilizace Ph negativních krvetvorných buněk po stimulaci chemoterapií mini-ICE v kombinaci s G-CSF časně po stanovení diagnózy [1]. Úvahy, že provedení autologní transplantace takto sklizeného štěpu po myeloablativní přípravě by mohlo výrazně zlepšit výsledky následné terapie interferonem alfa, vedla například k organizaci prospektivní studie v rámci Evropské společnosti pro transplantaci krve a kostní dřeně (European Society for Blood and Marrow Transplantation; EBMT). Některé farmaceutické firmy doufaly ve zlepšení účinnosti a zmírnění toxicity interferonu pomocí jeho pegylace a s takto upravenou molekulou připravovaly rozsáhlé klinické studie.
Většina zmíněných aktivit však byla koncem 90. let ukončena díky revolučnímu výzkumu Briana Drukera a jeho spolupracovníků, kteří (opírajíc se o experimenty dokládající klíčovou roli fúzního genu a proteinu Bcr-Abl a objevy o mechanismech fungování tyrosinových kináz, provedené koncem 80. a počátkem 90. let minulého století) po rozsáhlém testování řady látek ze skupiny 2-fenylaminopyrimidinů a tyrfostinů identifikovali látku CGP57148B (později přejmenovanou na STI571 a nakonec známou jako imatinib). Tato látka byla schopná nejen blokovat aktivitu proteinu Bcr-Abl, ale navíc ve tkáňové kultuře úměrně dávce inhibovat růst BCR-ABL pozitivních leukemických buněk, přičemž se její účinek na normální progenitory jevil jako nevýznamný [2]. Prezentace výsledků in vitro studií a prvních experimentů na zvířatech nevzbudila na výročním sjezdu Americké hematologické společnosti (ASH) v roce 1995 příliš velkou pozornost [3]. Druker ještě nějakou dobu musel bojovat se skeptiky, kteří nevěřili, že takto cílený lék bude mít dostatečný antileukemický účinek a obávali se závažných nežádoucích účinků malé molekuly, která mohla teoreticky interagovat s dalšími buněčnými strukturami. Bylo nezbytné přesvědčit i vedení firmy Novartis (která se stala vlastníkem práv na molekulu po fúzi firem Sandoz a Ciba-Geigy), které pochybovalo, že klinické testování imatinibu u poměrně vzácného onemocnění, jakým je CML, se finančně vyplatí [3]. Klinická studie fáze I s imatinibem byla zahájena v červnu 1998 a prezentace jejích výsledků, které předčily všechna očekávání, byla na konferenci ASH v roce 1999 zařazena na plenární zasedání [3]. Imatinib podávaný od 25 do 1000 mg nevyvolal u zařazených pacientů toxicitu, která by omezovala dávkování (maximálně tolerovatelnou dávku se nepodařilo stanovit), 98 % pacientů s CML v chronické fázi rezistentních na interferon dosáhlo kompletní hematologické odpovědi a pouze jeden z 53 nemocných relaboval po roce léčby [4]. Podobně impresivních výsledků bylo dosaženo také u pacientů v blastickém zvratu. Imatinib tak zahájil revoluční cestu inhibitorů tyrosinových kináz napříč celou onkologií a kromě jiného se dostal v roce 2001 na titulní stránku časopisu Time, jako „munice“ pro léčbu rakoviny v příštím století.
Dalším významným milníkem byla randomizovaná klinická studie fáze III IRIS, jejíž výsledky přesvědčily i poslední skeptiky [5]. Úřad pro potraviny a léky (Food and Drug Administration – FDA), která nejdříve v USA schválila imatinib v roce 1999 pro léčbu nemocných s CML rezistentních na interferon, schválila v roce 2001, na základě časných výsledků studie IRIS, jeho použití v první linii léčby (tab. 1). Mezitím v laboratořích zavládla horečná snaha identifikovat další vhodné inhibitory, které by byly schopné překonat rezistenci k imatinibu, jejíž mechanismy se dařilo postupně alespoň částečně identifikovat [6, 7]. Výsledkem byly inhibitory druhé generace, z nichž byl na jedné straně design nilotinibu veden snahou zlepšit vazebné kapacity k vazebnému místu pro ATP ve srovnání s imatinibem, na druhé straně inhibiční vlastnosti dasatinibu byly zjištěny při vývoji léku původně určeného k jinému účelu. Oba inhibitory naplnily očekávání plynoucí z jejich několikanásobně vyšší in vitro účinnosti ve srovnání s imatinibem a vedly si velmi dobře v klinických studiích zahájených během prvního desetiletí 21. století (ENESTnd, ENESTst, série START a DASISION) [8–14]. S malým opožděním je následoval poslední inhibitor druhé generace bosutinib (studie BELA) [15]. Závažný problém poslední mutace v ABL kinázové doméně, T315I, rezistentní ke všem do té doby vyvinutým inhibitorům, vyřešil ponatinib (studie EPIC a PACE) [16,17]. FDA a Evropská agentura pro léky (European Medicines Agency – EMA) postupně akceptovaly všechna tato léčiva pro léčbu CML, byť v případě ponatinibu svá rozhodnutí částečně revokovaly pro významný výskyt kardiovaskulárních nežádoucích účinků (viz také níže a tabulka 1).
Tab. 1. Data schválení inhibitorů tyrosinové kinázy k léčbě CML* 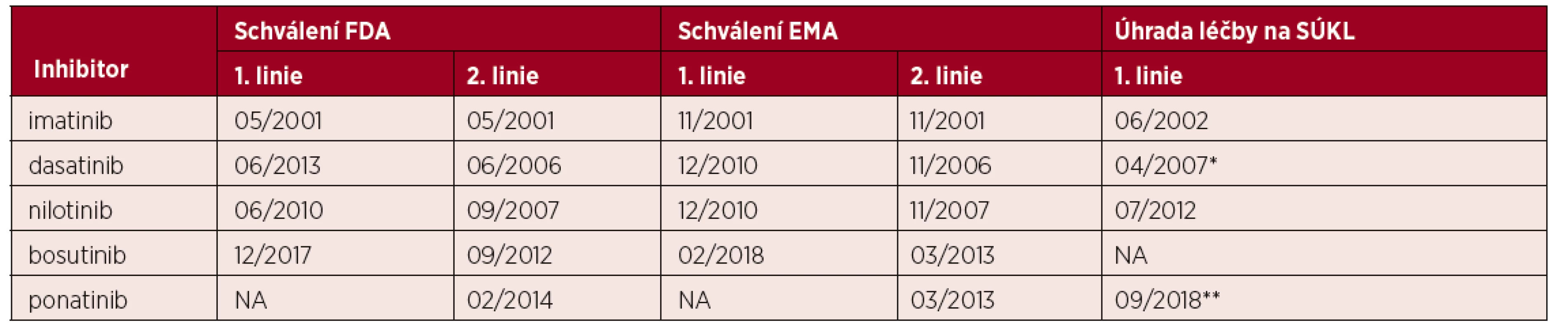
*v první linii v USA (Food and Drug Administration; FDA), v Evropě (European Medical Agency; EMA) a data schválení jejich úhrady v České republice ve Státním ústavu pro kontrolu léčiv (SÚKL). **úhrada dasatinibu schválena pouze pro 2. linii léčby, ponatinibu ve 3. linii nebo v případě přítomnosti mutace T315I. Výsledky dlouhodobé úspěšné léčby imatinibem, ale i dalšími inhibitory tyrosinové kinázy se postupně projevily ve výsledcích nezávislých klinických studií (obr. 1), v poklesu transplantační aktivity u CML dokumentované opakovaně v EBMT, ale i v USA a ve zlepšení celkového přežití pacientů v národních registrech (obr. 2) [18–20]. Díky vynikajícím léčebným výsledkům a dlouhodobému přežívání nemocných logicky vyvstala potřeba řešení dvou významných oblastí problémů – nežádoucích účinků inhibitorů a komorbidity. S nimi úzce souvisí možnost udržení remise bez potřeby pokračování léčby (treatment-free remission), která je ověřována řadou prospektivních klinických studií [21–24]. Po vypršení patentu na imatinib mohou sice lékaři předepisovat generické přípravky, které jsou významně levnější, nicméně kromě otázek srovnatelnosti účinnosti a bezpečnosti léčby těmito preparáty se v některých státech jeví jako důležitý problém také časté střídání těchto přípravků v léčbě jednotlivých nemocných v důsledku „pružné“ reakce nemocnic na aktuální změny v nabídce na trhu. Tento ale i další aspekty zajišťování moderní léčby v hematoonkologii (edukace nemocných s cílem zlepšit spolupráci na léčbě, jednání poskytovatelů péče, plátců a dalších orgánů, ochrana práv nemocných) zvýrazňují roli pacientských sdružení. Je důležité, že v České republice mají pacienti možnost podílet se na činnosti velmi aktivního zájmového spolku Diagnóza leukemie (v letech 2006–2014 občanského sdružení Diagnóza CML), které má díky své předsedkyni také mezinárodní aktivity.
Obr. 1. Přežití nemocných léčených v rámci různých studií Německé kooperativní skupiny pro léčbu CML
Upraveno podle [18].![Přežití nemocných léčených v rámci různých studií Německé kooperativní skupiny pro
léčbu CML<br>
Upraveno podle [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7d94b9ce6d3c357d135d6acce955ff0b.png)
Obr. 2. Efekt dostupnosti imatinibu a dalších inhibitorů tyrosinové kinázy na zlepšení pravděpodobnosti přežití nemocných různých věkových skupin ve švédském národním registru
Upraveno podle [20].![Efekt dostupnosti imatinibu a dalších inhibitorů tyrosinové kinázy na zlepšení
pravděpodobnosti přežití nemocných různých věkových skupin ve švédském národním
registru<br>
Upraveno podle [20].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/966fa8ccd617553de1c3fa7d6896011c.png)
Problematika CML se stala jedním ze základních kamenů nové celoevropské spolupráce na poli hematoonkologie – organizaci Evropské leukemické sítě (European LeukemiaNet, ELN), projektu profesora Hehlmanna podpořeného od ledna 2004 grantem Europské unie. Projekt vedl v oblasti výzkumu CML k řadě významných úspěchů včetně publikace široce akceptovaných doporučení, harmonizaci molekulárního monitorování léčby CML a projektům EUTOS for CML ve spolupráci s firmou Novartis [9, 22, 23, 25–29]. Na všech aktivitách ELN se významně podílela jako centra excelence také všechna univerzitní a výzkumná česká hematologická pracoviště, nicméně český příspěvek v oblasti experimentálního a klinického výzkumu přesáhl mantinely ELN. Kromě účasti na naprosté většině firemních klinických studií včetně studií rozšířené dostupnosti (kromě IRIS) to bylo především založení registrů pacientů s CML CAMELIA (Chronic MyEloid LeukaemIA, založen v roce 2004) ČHS ČLS JEP a INFINITY (Imatinib In First Line CML Treatment ) skupiny CELL (Česká leukemická skupina – pro život, The CzEch Leukemia Study Group – for Life; založena v roce 2006), které se při svém vzniku mohly opřít o experty a vybavení Institutu biostatistiky a analýz Masarykovy univerzity. Centralizace péče o nemocné s CML v ČR a analýza výsledků všech nemocných s CML ve zmíněných registrech umožnily získat populační data, která nám záviděla celá Evropa včetně Německa a byla i důležitým argumentem pro jednání s plátci zdravotní péče. Ze spolupráce center na registrech vzešla řada publikací věnovaných zejména problematice léčby CML v reálné praxi, ale i dalším problémům [30–42]. Pojem přežití bez potřeby změny inhibitoru (alternative treatment-free survival) byl zaveden právě skupinou CELL, zatímco možnost intermitentního podávání imatinibu byla poprvé zkoumána v Olomouci, stejně jako první popis případu účinnosti dasatinibu u mutace F317L nebo možnosti redukce dávky imatinibu ke zmírnění nežádoucích účinků za současného udržení hluboké hematologické odpovědi, zatímco důležitý výzkum metabolických nežádoucích účinků nilotinibu iniciovalo brněnské centrum [30, 32, 33, 37, 39]. Další oblasti výzkumu zahrnovaly popis výskytu sekundárních malignit během léčby inhibitory tyrosinové kinázy, výzkum významu stanovení hladin imatinibu v běžné praxi pro praktické vedení léčby, účast na registru gravidních pacientek s CML, účast na doposud největší prospektivní studii EURO-SKI ověřující možnost bezpečného přerušení léčby v hluboké molekulární remisi, participaci na přípravě sdíleného stanoviska expertů a pacientských advokátů k přerušení léčby TKI nebo farmakogenetický výzkum, který snad přinese možnost identifikace pacientů vhodných k léčbě imatinibem ještě před zahájením terapie [35, 39–44]. Výsledky dalších retrospektivních analýz a jiných studií nebo přehledné články zaměřené na problematiku CML byly publikovány i na stránkách Transfuze a hematologie dnes. Šlo například o výsledky studie rozšířené dostupnosti u pacientů v akcelerované fázi CML, srovnání ekonomické náročnosti léčby imatinibem a transplantací kostní dřeně, zkušenosti s léčbou imatinibem ve druhé linii po selhání interferonu nebo významu molekulárního monitorování [43–56]. Úplný výčet příspěvků českých autorů na poli CML přesahuje rozsah a cíle této publikace.
ZÁVĚR
Vývoj léčby CML svědčí o významu akumulace poznatků o patofyziologii onemocnění, započatých identifikací chromozomu Philadelphia v roce 1960, pro design cílené léčby. Po úspěchu u CML byly inhibitory tyrosinových kináz úspěšně použity u řady dalších maligních onemocnění. Z malignity, která při cytostatické léčbě vedla k úmrtí téměř všech pacientů do pěti let od stanovení diagnózy, se po zavedení inhibitorů tyrosinových kináz stalo z CML chronické onemocnění, u něhož se v současné době staly častější příčinou úmrtí další choroby nemocných, a jejich celkové přežití se srovnává s běžnou populací. Úspěšnost léčby u CML vedla ke zvýšení prevalence nemoci, což mělo za následek růst celkových nákladů na terapii a sledování nemocných. U nejlépe odpovídajících nemocných se otevírá možnost přerušení terapie při dosažení remise bez potřeby obnovení léčby, zatímco vysoce rizikoví nemocní mohou stále profitovat z alogenní transplantace krvetvorných buněk a výhledově z možnosti podání nových inhibitorů působících mimo ABL kinázovou doménu. Pokud další výzkum objeví způsob, jak účinněji působit přímo na leukemické kmenové buňky, budeme schopni CML vyléčit konzervativní terapií.
Podíl autorů na přípravě rukopisu
EF – příprava první verze rukopisu, finalizace rukopisu
KI – připomínkování, korektura první verze rukopisu, schválení finální verze
Čestné prohlášení
Autoři práce prohlašují, že vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Autoři deklarují tento možný střet zájmů
EF – Angelini, Bristol-Squibb Meyer, Novartis – podpora klinických studií, účasti na konferencích, honoráře za přednášky
KI – bez střetu zájmů
Poděkování
Tato práce byla podpořena grantovým projektem IGA_LF_2018_004. Autoři děkují MUDr. Kláře Vrablíkové a Mgr. Vendule Hájkové z firmy Novartis, Ing. Petře Jasné z firmy Bristol-Myers Squibb a Mgr. Heleně Hedejové z firmy Angelini za zprostředkování údajů uvedených v tabulce 1.
Doručeno do redakce dne 23. 10. 2018.
Přijato po recenzi 17. 12. 2018.
prof. MUDr. Edgar Faber, CSc.
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
Lékařská fakulta Univerzity Palackého v Olomouci
I. P. Pavlova 6
775 20 Olomouc
e-mail: edgar.faber@fnol.cz
Zdroje
1. Carella AM, Lerma E, Celesti L, et al. Effective mobilization of Philadelphia-chromosome-negative cells in chronic myelogenous leukaemia patients using a less intensive regimen. Br J Haematol 1998;100 : 445–448.
2. Druker BJ, Tamura S, Buchdunger E, et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nat Med 1996;2 : 561–566.
3. Druker BJ. Translation of the Philadelphia chromosome into therapy for CML. Blood 2008;112(13):309–318.
4. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001;344 : 1031–1037.
5. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003;348 : 994–1004.
6. Gorre ME, Mohammed M, Ellwood K, et al. Clinical resistance to STI-571 cancer therapy caused by BCRABL gene mutation or amplification. Science 2001;293 : 876–880.
7. Naušová J, Priwitzerová M, Jarošová M, et al. Chronická myeloidní leukémie - rezistence na imatinib mesylát (Glivecâ) (Přehled literatury a vlastní zkušenosti). Čas Lék Čes 2006;145 : 377–382.
8. Saglio G, Kim DW, Issaragrisil S, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010;362 : 2251–2259.
9. Hochhaus A, Mahon FX, le Coutre P et al. Nilotinib first-line therapy in patients with Philadelphia chromosome-negative/BCR-ABL-positive chronic myeloid leukemia in chronic phase: ENEST1st sub-analysis. J Cancer Res Clin Oncol 2017;143 : 1225–1233.
10. Guilhot F, Apperley J, Kim DW, et al. Dasatinib induces significant hematologic and cytogenetic responses in patients with imatinib-resistant or intolerant chronic myeloid leukemia in accelerated phase. Blood 2007;109 : 4143–4150.
11. Cortes J, Rousselot P, Kim DW, et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or intolerant chronic myeloid leukemia in blast crisis. Blood 2007;109 : 3207–3213.
12. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic phase chronic myeloid leukemia after failure of imatinib therapy. Blood 2007;109(6):2303–2309.
13. Kantarjian H, Pasquini R, Hamerschlak N, et al. Dasatinib or high-dose imatinib for chronic phase chronic myeloid leukemia after failure of first-line imatinib: a randomized phase-II trial. Blood 2007;109 : 5143–5150.
14. Kantarjian H, Shah NP, Hochhaus A, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2010;362 : 2260–2270.
15. Cortes J, Kim DW, Kantarjian HM, et al. Bosutinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: results from the BELA trial. J Clin Oncol 2012;30(28):3486–3492.
16. Cortes JE, Kim D-W, Pinilla-Ibarz J, et al. A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias. N Engl J Med 2013;369 : 1783–1796.
17. Lipton JH, Chuah C, Guerci-Bresler A, et al. Ponatinib versus imatinib for newly diagnosed chronic myeloid leukaemia: an international, randomised, open-label, phase 3 trial. Lancet Oncol 2016;17 : 612–621.
18. Hehlmann R. Ann Hematol 2015;94(Suppl 2):S103–S105.
19. Gratwohl A, Baldomero H, Horisberger B, et al. Current trends in hematopoietic stem cell transplantation in Europe. Blood 2002;100 : 2374–2386.
20. Björkholm M, Ohm L, Eloranta S, et al. Success story of targeted therapy in chronic myeloid leukemia: a population-based study of patients diagnosed in Sweden from 1973 to 2008. J Clin Oncol. 2011; 29 : 2514–2520.
21. Saussele S, Krauss MP, Hehlmann R et al. Impact of comorbidities on overall survival in patients with chronic myeloid leukemia: results of the randomized CML study IV. Blood. 2015 Jul 2;126(1):42–49.
22. Steegmann JL, Baccarani M, BrecciaM et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia 2016;30 : 1648–1671.
23. Saussele S, Richter J, Guilhot J, et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukemia (EURO-SKI): a prespecified interim analysis of a prospective, multicentre, non-randomised, trial. Lancet Oncol 2018;19 : 747–757.
24. Šrámek J, Karas M, Lysák D, Jindra P. Možnost ukončení terapie tyrosin kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“. Transfuze Hematol dnes 2017;23(4):192–198.
25. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia. Recommendations from an expert panel on behalf of The European LeukemiaNet. Blood 2006;108 : 1809–1820.
26. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013;122 : 872–884.
27. Hoffmann VS, Baccarani M, Hasford J, et al. Treatment and outcome of 2904 CML patients from the EUTOS population-based registry. Leukemia 2017;31 : 593–601.
28. Soverini S, Hochhaus A, Nicolini FE et al. BCR-ABL kinase domain mutation analysis in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: recommendations from an expert panel on behalf of European LeukemiaNet. Blood 2011;118 : 1208–1215.
29. Cross NC, White HE, Ernst T, et al. Development and evaluation of a secondary reference panel for BCR-ABL1 quantification on the International Scale. Leukemia 2016;30(9):1844–1852.
30. Faber E, Naušová J, Jarošová M, et al. Intermittent dosage of imatinib mesylate in CML patients with history of significant hematologic toxicity after standard dosing. Leuk Lymphoma 2006;47 : 1082–1090.
31. Klamova H, Faber E, Zackova D, et al. Dasatinib in imatinib-resistant or -intolerant CML patients: data from the clinical practice of 6 hematological centers in the Czech Republic. Neoplasma 2010;57 : 355–359.
32. Faber E, Mojzikova R, Plachy R, et al. Major molecular response achieved with dasatinib in a CML patient with F317L BCR-ABL1 kinase domain mutation. Leuk Res 2010;34 : 91–93.
33. Zackova D, Klamova H, Dusek L, et al. Imatinib as the first-line treatment of patients with chronic myeloid leukemia diagnosed in the chronic phase: Can we compare real life data to the results from clinical trials? Amer J Hematol. 2011;86 : 318–321.
34. Faber E, Mužík J, Koza V, et al. Treatment of consecutive patients with chronic myeloid leukaemia in the cooperative centres from the Czech Republic and the whole of Slovakia after 2000 - a report from the population-based CAMELIA Registry. Eur J Haematol 2011;87 : 157–168.
35. Voglová J, Mužík J, Faber E, et al. Incidence of second malignancies during treatment of chronic myeloid leukemia with tyrosine kinase inhibitors in the Czech Republic and Slovakia. Neoplasma 2011;58 : 256–262.
36. Zackova D, Klamova H, Muzik J, et al. Efficacy and tolerance of dasatinib after imatinib failure or intolerance for patients with chronic myeloid leukemia treated in three different hospitals compare well with results achievable in formal clinical trials. Leuk Lymphoma 2013;54(10):2310–2313.
37. Racil Z, Razga F, Drapalova J, et al. Mechanism of impaired glucose metabolism during nilotinib therapy in patients with chronic myelogenous leukemia. Haematologica 2013;98(10):e124–126.
38. Pavlik T, Janousova E, Mayer J, et al. Current survival measures reliably reflect modern sequential treatment in CML: correlation with prognostic stratifications. Am J Hematol 2013;88(9):790–797.
39. Faber E, Divoká M, Skoumalová I, et al. Lower dosage of imatinib is sufficient to maintain undetectable disease in patients with chronic myeloid leukemia with long-term low-grade toxicity of the treatment. Leuk Lymphoma 2016;57(2):370–375.
40. Faber E, Friedecký D, Mičová K, et al. Imatinib trough plasma
levels do not correlate with the response to therapy in patients with chronic myeloid leukemia in routine clinical setting. Ann Hematol 2012;91 : 923–929.41. Racil Z, Razga , Klamova H, et al. No clinical evidence for performing trough plasma and intracellular imatinib concentrations monitoring in patients with chronic myelogenous leukaemia. Hematol Oncol 2013;32(2):331–334.
42. Jaruskova M, Curik N, Hercog R, et al. Genotypes of SLC22A4 and SLC22A5 regulatory loci are predictive of the response of chronic myeloid leukemia patients to imatinib treatment. J Exp Clin Cancer Res 2017;36(1):55.
43. Saussele S, Richter J, Guilhot J, et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO-SKI): a prespecified interim analysis of a prospective, multicentre, non-randomised, trial. Lancet Oncol 2018;19(6):747-757.
44. Saglio G, Sharf G, Almeida A, et al. Considerations for treatment-free remission in patients with chronic myeloid leukemia: a joint patient-physician perspective. Clin Lymphoma Myeloma Leuk 2018;18(6):375-379.
45. Faber E, Hluší A, Indrák K, et al. Imatinib (Glivec®) v léčbě nemocných s akcelerovanou fází chronické myeloidní leukémie a Ph pozitivní akutní lymfoblastické leukémie. Transfuze Hematol dnes 2003;9 : 159–165.
46. Voglová J, Poznarová A, Chrobák L, et al. Imatinib mesylát (Glivec®) v léčbě chronické fáze chronické myeloidní leukémie. Vnitř Lék 2004;50 : 21–29.
47. Klamova H, Voglova J. Chronická myeloidní leukemie. Transfuze Hematol dnes 2010;16 : 17–20.
48. Mayer J, Brychtová Y, Doubek M, Krejčí M, Vorlíček J. Srovnání reálné ceny léčby chronické myeloidní leukemie nemyeloablativní transplantací krvetvorných buněk s hypotetickou terapií imatinibem (Glivec). Zamyšlení nad velmi drahými medicínskými postupy. Transfuze Hematol dnes 2006;12(1):6–13.
49. Mayer J, Klamová H, Žáčková D, et al. Rezistence na imatinib a možnosti využití vyššího dávkování léku u pacientů s chronickou myeloidní leukemií. Transfuze a Hematol dnes 2007;13(3):133–141.
50. Rohoň P, Faber E, Naušová J, et al. Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu príčiny rezistencie k imatinibu – kazuistika. Transfuze Hematol dnes 2007;13(1):27–31.
51. Mayer J, Klamová H, Žáčková D, et al. Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi. Transfuze Hematol dnes 2008;14(4):150–158.
52. Rohoň P, Rožmanová Š, Zapletalová J, et al. Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií. Transfuze a hematol dnes 2010;16(4):202–209.
53. Šťastný M, Machová Poláková K, Klamová H, et al. Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“. Transfuze Hematol dnes 2010;16(1):47–54.
54. Rožmanová Š, Rohoň P, Divoká M, et al. Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra. Transfuze Hematol dnes 2012;18(2):66–71.
55. Martišová M, Sninská Z, Hatalová A, Demečková E, Mistrík M. Dasatinib v 2. línii liečby chronickej myelocytovej leukémie u pacientov s rezistenciou alebo intoleranciou imatinibu na Klinike hematológie a transfuziológie Bratislava v rokoch 2007-2011. Transfuze Hematol dnes 2012;18(3):105–111.
56. Zemanová K, Žižková H, Jurček T, et al. Chronická myeloidní leukémie – standardizace molekulárního monitorování hladiny transkriptů BCR-ABL1 v České republice. Transfuze Hematol dnes 2016; 22(1):56–64.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Posledních 25 let v diagnostice a léčbě myelodysplastického syndromu
- Vývoj transfuzní služby v České republice po roce 1990
- Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
- 25 let nepříbuzenského darování krvetvorných buněk
- Vývoj transplantací hematopoetických buněk v posledních 25 letech
- 25 rokov podpornej antiinfekčnej liečby v hematoonkológii
- 25 let vývoje metod molekulární biologie a jejich uplatnění v hemato(onko)logii
- 25 let vývoje dětské hematologie
- 25 rokov v komplexnej starostlivosti a liečbe hemofílie
- Ohlédnutí za vývojem antitrombotické profylaxe s akcentem na posledních 25 let
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
- Úvodník
- Transfuze a hematologie dnes – průřez historií
- Ohlédnutí za čtvrtstoletím léčby chronické lymfocytární leukemie
- Non-Hodgkinův lymfom v České republice
- Hodgkinův lymfom – nekončící příběh
- Vývoj diagnostiky a léčby mnohočetného myelomu v průběhu posledních 25 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hodgkinův lymfom – nekončící příběh
- Non-Hodgkinův lymfom v České republice
- Vývoj transfuzní služby v České republice po roce 1990
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



