-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Non-Hodgkinův lymfom v České republice
Non-Hodgkin lymphomas in the Czech Republic
This article presents a review of the developments in the diagnosis and treatment of non-Hodgkin lymphomas (NHL) in the Czech Republic over the past 30 years. The incidence of lymphomas is on the increase and currently corresponds to 14.4 new cases per 100 000 inhabitants. Mortality has been on the decrease since 2001 and is currently 5.4 per 100 000 inhabitants. The past 15 years have seen the introduction of immunochemotherapy and the subsequent decrease of risk of mortality by 40% in B-NHL. The reasons for this include improved diagnostics; the introduction of targeted immune therapy or immunochemotherapy; transplantation; improving organisation of care as well as national and international collaboration represented by the Czech Cooperative Lymphoma Group. However, the basic drawback remains insufficient funding.
Keywords:
Czech Republic – non-Hodgkin lymphoma
Autoři: M. Trněný
Působiště autorů: I. interní klinika, Všeobecná fakultní nemocnice a LF UK v Praze
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 1, p. 81-86.
Kategorie: Souhrnné/edukační práce
V článku je podán přehled vývoje v oblasti non-Hodgkinových lymfomů (NHL) v České republice (ČR) v uplynulých 30 letech. Incidence lymfomů má stoupající tendenci a dosahuje nyní 14,4 nových případů na 100.000 obyvatel. Mortalita začala od roku 2001 klesat a v současné době je 5,4 na 100.000 obyvatel. Za posledních 15 let došlo zavedením imunochemoterapie ke snížení rizika úmrtí zhruba o 40 % u B NHL. Mezi důvody jsou zlepšená diagnostika, zavedení cílené imunoterapie, resp. imunochemoterapie, transplantační léčba, zlepšující se organizace péče, národní i mezinárodní spolupráce reprezentovaná Kooperativní lymfomovou skupinou. Základním nedostatkem je stále podfinancování této péče.
Souhrn
V článku je podán přehled vývoje v oblasti non-Hodgkinových lymfomů (NHL) v České republice (ČR) v uplynulých 30 letech. Incidence lymfomů má stoupající tendenci a dosahuje nyní 14,4 nových případů na 100.000 obyvatel. Mortalita začala od roku 2001 klesat a v současné době je 5,4 na 100.000 obyvatel. Za posledních 15 let došlo zavedením imunochemoterapie ke snížení rizika úmrtí zhruba o 40 % u B NHL. Mezi důvody jsou zlepšená diagnostika, zavedení cílené imunoterapie, resp. imunochemoterapie, transplantační léčba, zlepšující se organizace péče, národní i mezinárodní spolupráce reprezentovaná Kooperativní lymfomovou skupinou. Základním nedostatkem je stále podfinancování této péče.
Klíčová slova:
non-Hodgkinův lymfom – Česká republika
Non-Hodgkinův lymfom (NHL) je vysoce heterogenní onemocnění. Máme-li se ohlédnout zpět za posledními 25 lety, je nutné připomenout několik základních změn, které se v oblasti lymfomů udály obecně. Rozvoj monoklonálních protilátek, jejich přínos k definici jednotlivých podskupin lymfoproliferativních malignit vedl k návrhu revidované evropsko-americké klasifikace lymfomů (REAL) [1]. Tento návrh se stal základem WHO klasifikace publikované v roce 2001 a v dalších upravených vydáních v letech 2008 a 2017 [2, 3].
Další zásadní změnou v oblasti NHL bylo zavedení monoklonálních protilátek do terapie, jednalo se zejména o zavedení rituximabu, chimerické antiCD20 IgG1 protilátky typu I, která byla poprvé použita v roce 1994, na základě studie z roku 1998 byla schválena k použití u folikulárního lymfomu (FL) a v tomtéž roce jsme měli možnost ji použít u prvního pacienta v ČR [4,5]. Následovalo schválení pro použití v kombinaci s chemoterapií (R-CHOP) pro nejčastější podtyp lymfomu – difuzní velkobuněčný lymfom z B buněk (DLBCL) po studii prezentované v roce 2000 a publikované v roce 2002 [6, 7]. Další změnou, která výrazně ovlivnila způsob hodnocení léčebné odpovědi, bylo zavedení celotělové pozitronové emisní tomografie (PET) s radionuklidem značenou glukózou 18FDG. Zavedení této metody změnilo mezinárodní pravidla pro hodnocení odpovědi z roku 1999 založená pouze na počítačové tomografii (CT) již dvakrát, a to v roce 2007 a 2014, kdy byla přijata tzv. Luganská klasifikace pro úvodní stážování a hodnocení klinické odpovědi u maligních lymfomů [8–11]. V neposlední řadě je nutné zmínit rozvoj transplantační terapie, ať již vysokodávkované terapie s autologní transplantací (ASCT) nebo alogenní transplantaci krvetvorných buněk (aloSCT), který nastal od první poloviny 90. let. V roce 2000 byla publikována první práce charakterizující DLBCL na základě genové exprese, postupně bylo zavedeno sekvenování nové generace a další molekulárně biologické metody, které vedou ke stále lepšímu pochopení mechanismů důležitých pro lymfomovou buňku či její mikroprostředí a interakci s imunitním systémem [12]. Tyto poznatky umožňují zavádění nové cílené terapie, která je testována (a zaváděna) s cílem dále zlepšit osud nemocných.
Zmapování vývoje znalostí a způsobu péče u nemocných s maligními lymfomy v ČR je nutné provést v rámci vymezeném výše velmi zjednodušeně uvedenými hlavními změnami v oblasti lymfomů. V ČR sehrály roli i organizační faktory, jakými bylo například v první polovině 90. let ustanovení center intenzivní hematologické péče v univerzitních (fakultních) nemocnicích, kde byl rozvíjen transplantační program. Založení Kooperativní lymfomové skupiny (Czech Lymphoma Study Group – CLSG, www.lymphoma.cz) v roce 1999 sehrálo velmi důležitou roli v rozvoji spolupráce a také v získávání dat, která mohla být použita při jednání s organizátory, regulátory a plátci zdravotní péče.
V roce 2016 bylo v Česku diagnostikováno 1510 nových případů NHL, což představuje incidenci 14,4 na 100 000 obyvatel [13]. Pokud bychom přičetli nové případy s Hodgkinovým lymfomem, chronickou lymfocytární leukemií (společná jednotka s lymfomem z malých lymfocytů) a akutní lymfoblastovou leukemií (společná jednotka s lymfoblastovým lymfomem), bylo v Česku v roce 2016 diagnostikováno celkem 2 465 nových případů, což představuje situaci, kdy každé 3,5 hodiny je diagnostikován jeden nový pacient. Incidence a mortalita NHL v čase narůstá, jak ukazuje obrázek 1. Jestliže v roce 1981 byla incidence 6,1, v roce 2001 10,8 a v roce 2016 to je 14,4. Zároveň do roku 2001 narůstala mortalita z 3,6 (v roce 1981) na 6,0 (v roce 2001). Od té doby začala mortalita klesat a s malými výkyvy se v posledních 4 letech pohybuje kolem 5 (2013 – 4,8; 2014 – 5,1; 2015 – 4,8; 2016 – 5,4).
Obr. 1. Vývoj incidence a mortality nemocných s non-Hodgkinovým lymfomem v ČR v čase 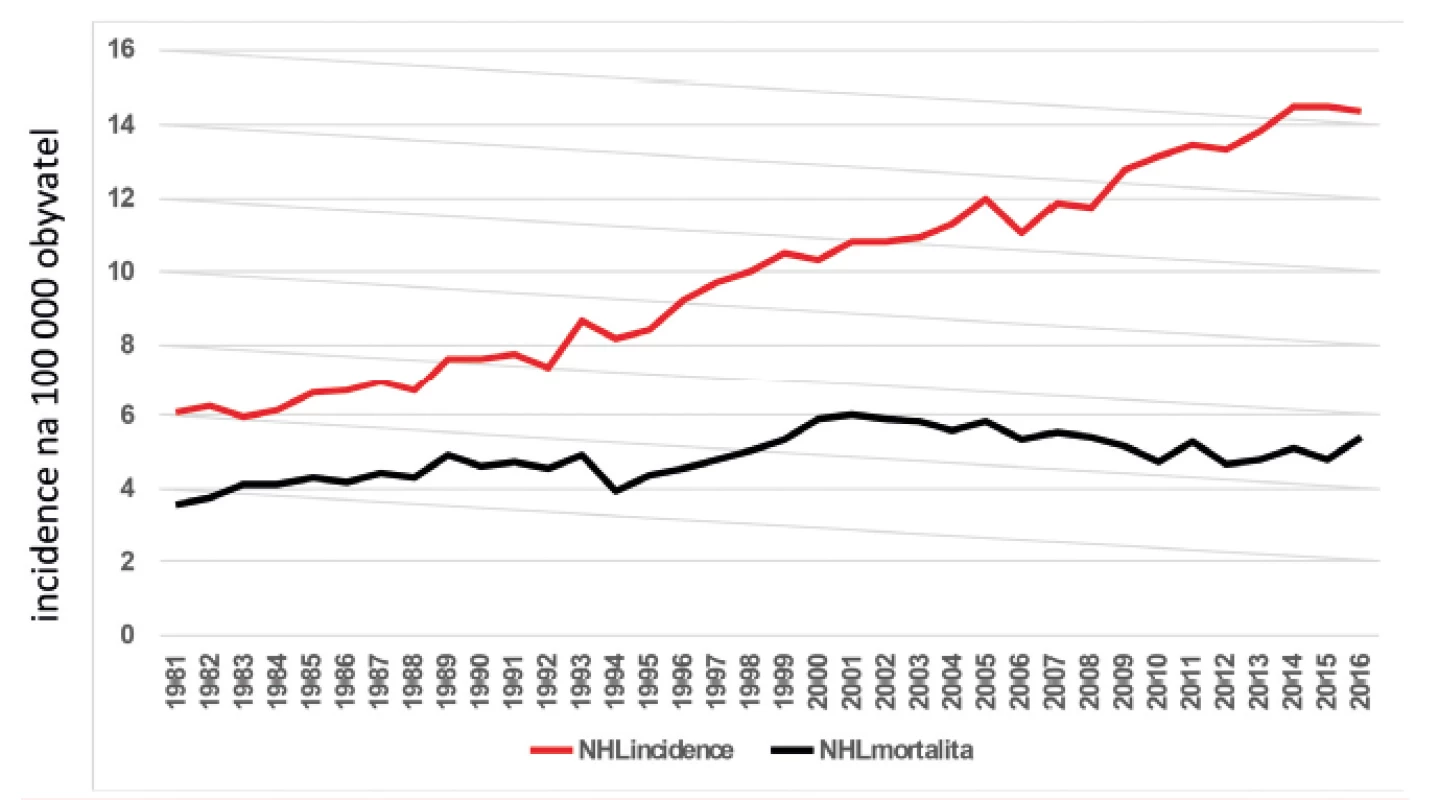
Vysvětlení tohoto vývoje může být celá řada. Zdá se, že se na něm podílí zavedení rituximabu, který po 30 letech od zahájení léčby pomocí kombinované chemoterapie CHOP (první polovina 70. let) zlepšil celkové přežití nemocných. Více než 95 % nemocných má totiž lymfoproliferativní nádor vycházející z B lymfocytů a tudíž senzitivní k léčbě rituximabem. V průběhu let se výrazně zlepšilo pětileté relativní přežití nemocných, jak ukázala recentní analýza, když u nemocných léčených v letech 1990–1994 bylo pětileté relativní přežití 45 %, zatímco v letech 2010–2015 to bylo již 68 % (obr. 2) [14]. Při analýze jednotlivých podtypů B NHL bylo ukázáno, že zavedením rituximabu výrazně kleslo riziko úmrtí, resp. úmrtí či progrese jak u celé skupiny B NHL (-40 %), tak u největších podskupin B NHL, jako jsou DLBCL (-34 %, resp. -35 %), FL (-24%, resp. -40 %), SLL (-40 %, resp. -47%) nebo MCL (-33% resp. -66%) – tabulka 1 [15]. Výsledky jsou také částečně demonstrovány na obrázku 3, který ukazuje srovnání křivek celkového přežití nemocných s B NHL a DLBCL. Je zajímavé, že došlo také k trendu ve zlepšení celkového přežití u nemocných s T buněčnými lymfomy (o 18 %), přestože nebylo statisticky významné. To ukazuje, že i další faktory, jako je celková kvalita péče, její organizace, spolupráce mezi regionálními a univerzitními pracovišti, mají dopad na léčebné výsledky u pacientů.
Obr. 2. Vývoj pětiletého relativního přežití (%) nemocných s non-Hodgkinovým lymfomem v ČR 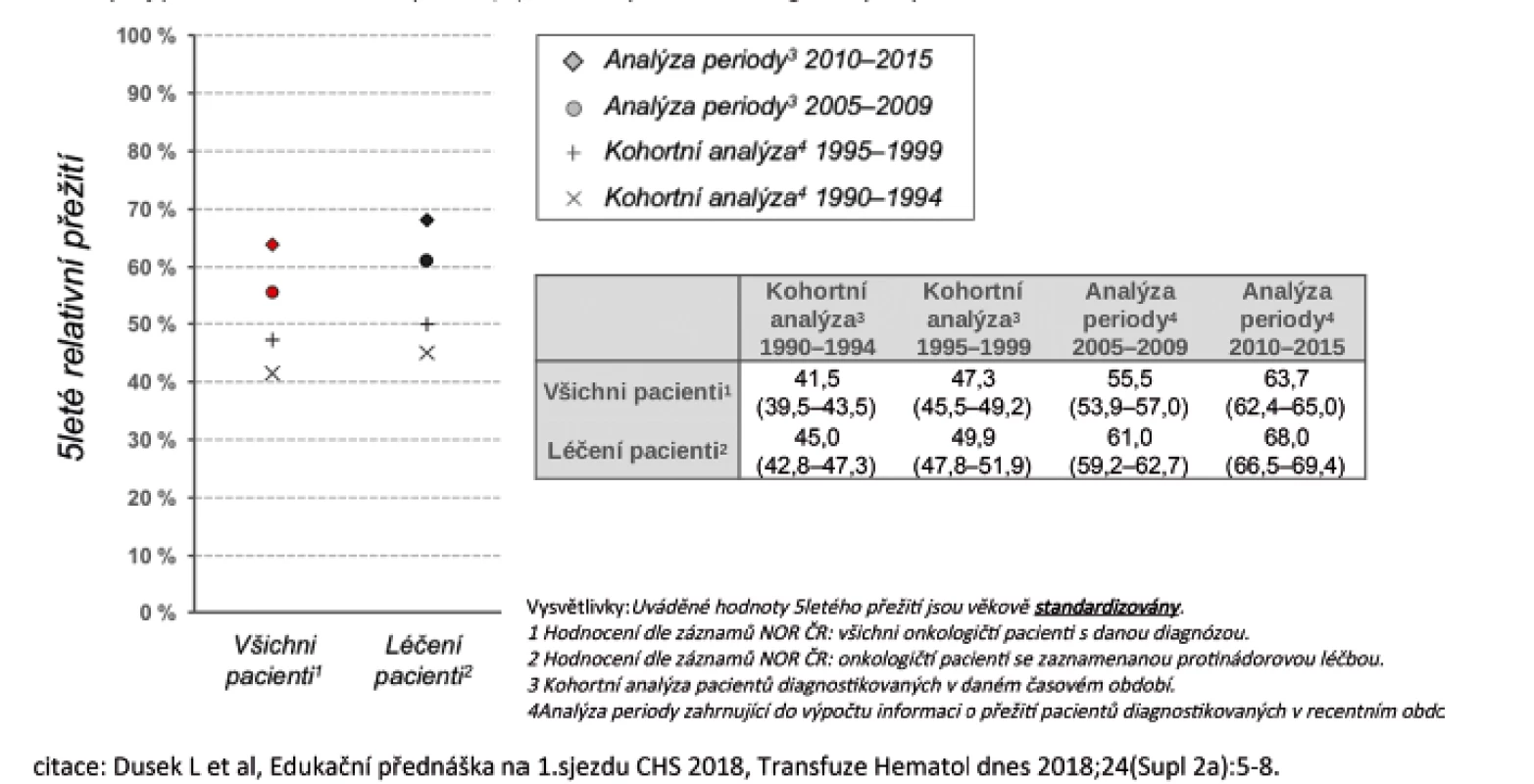
Obr. 3. Pravděpodobnost přežití u nemocných léčených imunoterapií (rituximab + chemoterapie) proti nemocným léčeným pouze chemoterapií
A: B-buněčný non-Hodgkinův lymfom (n = 543)
B: difuzní velkobuněčný lymfom (n = 4 187)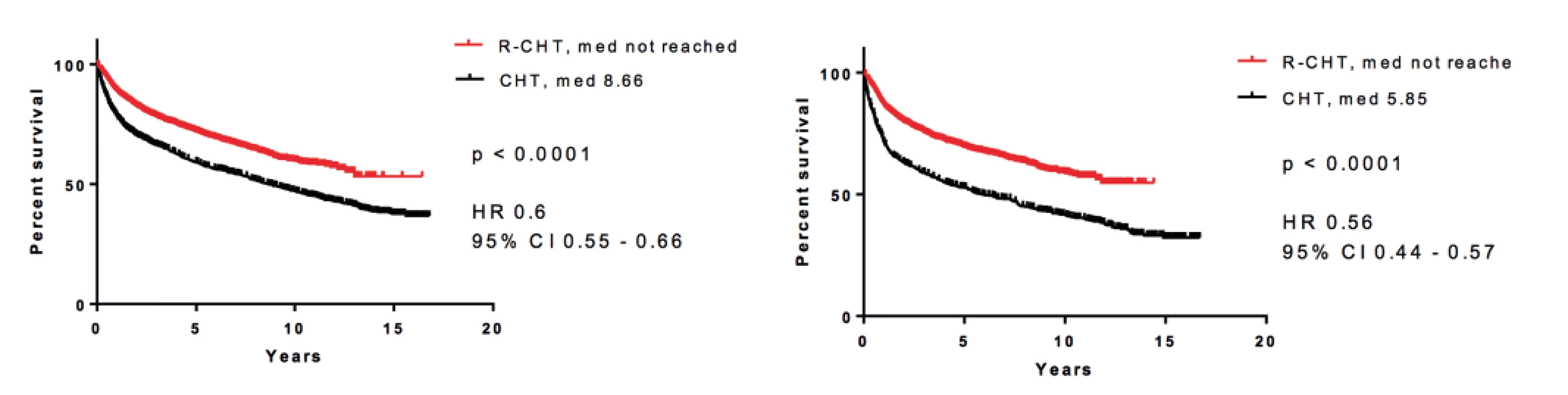
Tab. 1. Relativní snížení rizika úmrtí (OS) či progrese nebo úmrtí (PFS) pacientů léčených kombinací rituximabu s chemoterapií proti samotné chemoterapii 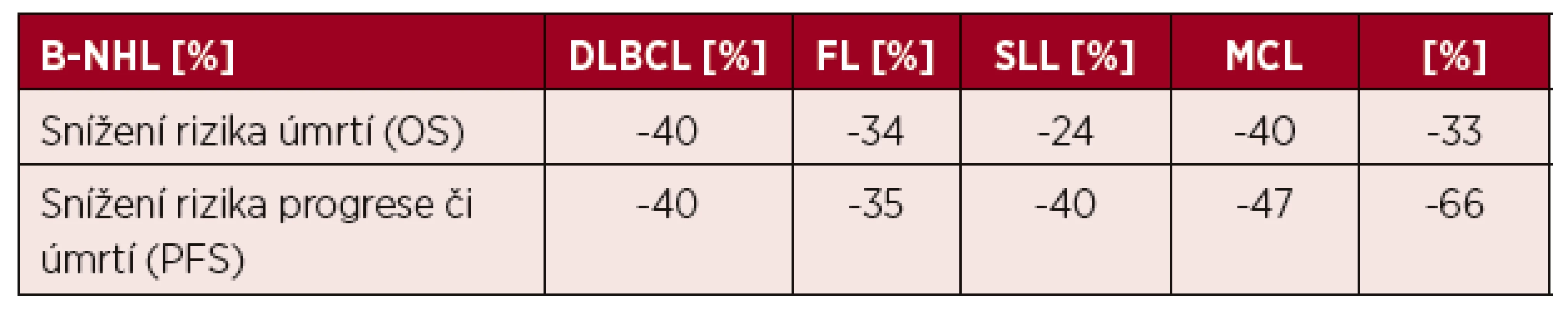
Poznámky: B-NHL – B-buněčný non-Hodkinův lymfom, DLBCL – difuzní velkobuněčný lymfom z B-lymfocytů, FL – folikulární lymfom, SLL – lymfom z malých lymfocytů, MCL – lymfom z plášťových buněk Systematický transplantační program v ČR byl založen v roce 1986 v Ústavu hematologie a krevní transfuze a od počátku 90. let se rozvíjel i na dalších pracovištích. Data sbíraná centrálně v národním registru provedených transplantací krvetvorných buněk na I. interní klinice VFN a 1. LF UK Praha od roku 1993 (součást EBMT registru) ukazují postupný nárůst počtu transplantací jak ASCT, tak aloSCT, kdy zhruba od roku 1999 se počet provedených ASCT pro lymfomy pohybuje kolem 120 za rok a od roku 2002 kolísá počet provedených aloSCT mezi 15–20 za rok (obr. 4) [16]. Postupem doby se měnily indikace pro ASCT, kdy poklesl počet nemocných s Hodgkinovým lymfomem a DLBCL, naopak postupně vzrůstá počet nemocných s periferními T lymfomy (PTCL) a MCL. Výsledky aloSCT se významně liší pro jednotlivé podtypy lymfomů, kdy nejlepší jsou dosahovány u T lymfomů a FL, neuspokojivé jsou stále u DLBCL a HL (obr. 5). Postupně se výrazně zvýšil věkový medián transplantovaných nemocných ze 41 let v 90. letech na 55 let v době od roku 2010 u ASCT a ze 42 na 47 let u aloSCT.
Obr. 4. Vývoj počtu transplantací pro lymfomy v ČR od roku 1993 do roku 2016 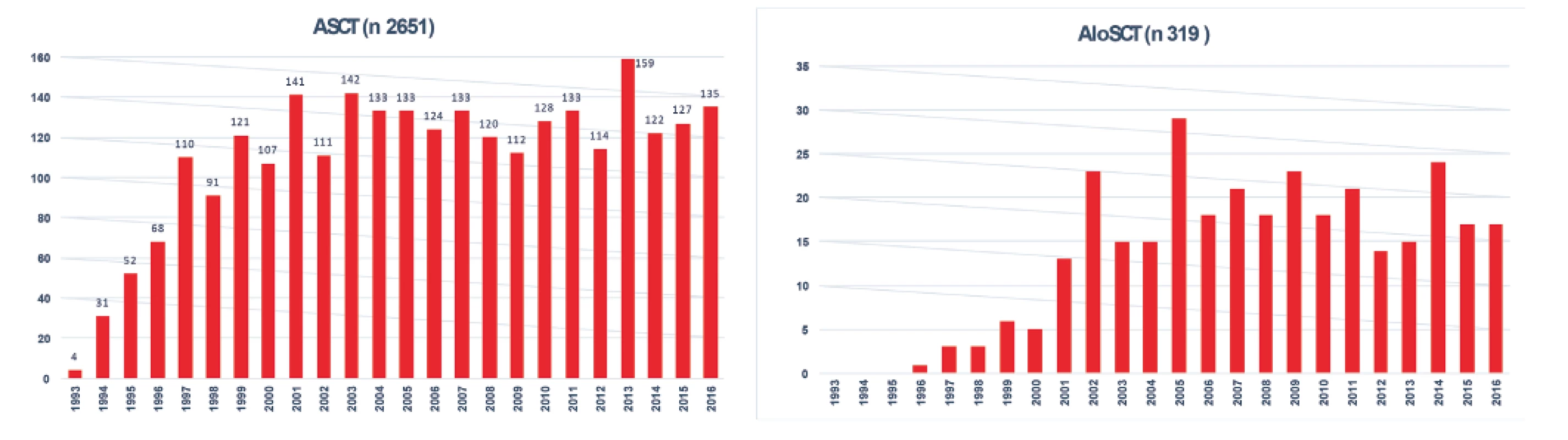
ASCT - autologní transplantace krvetvorných buněk
AloSCT - alogenní transplantace krvetvorných buněkObr. 5. Výsledky aloSCT pro jednotlivé typy lymfomů
A: doba do progrese či úmrtí (PFS)
B: celkové přežití (OS)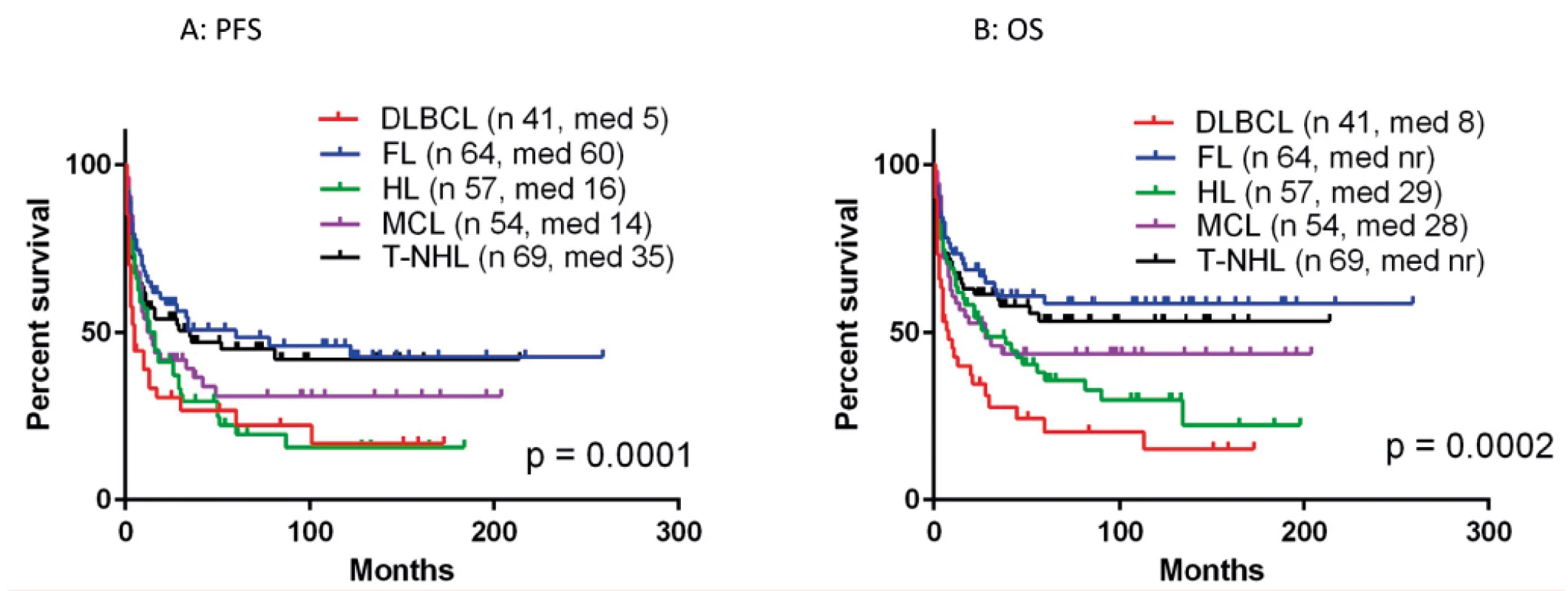
V posledních deseti letech jsme svědky nástupu celé řady nových léků cílených na nitrobuněčné pochody (ibrutinib, idelalisib, copanlisib, venetoclax, inhibitory histondeacetyláz – HDAC inhibitory, epigenetická terapie – tazemetostat a další), cílené radioterapie (radioimunoterapie ibrutimomab tiuxetan), cílené chemoterapie (konjugáty cytostatika s protilátkou (brentuximab vedotin, polatuzumab vedotin)). Využívají se léky cílené jak na nádorovou buňku, tak na imunitní systém (lenalidomid a další), léky ovlivňující imunitní systém, jako jsou nové modifikované protilátky (obinutuzumab, ublituximab, MOR208 a další), bispecifické protilátky (blinatumomab a další), inhibitory kontrolních imunitních bodů (nivolumab, pembrolizumab), terapie pomocí geneticky modifikovaných T lymfocytů exprimujících tzv. CAR – chimerické antigenní receptory [17–19]. Dopad těchto nových léků nebude tak výrazný na celou populaci lymfomů, bude spíše cílený na jednotlivé podtypy lymfomů, kterých je celkem více než sedmdesát, a tam může sehrát významnou roli. Jejich dostupnost je však v ČR limitovaná a úhradu získávají velmi pomalu a je nutné tuto situaci řešit. V řadě center však s těmito léky probíhají klinické studie.
Jak již bylo uvedeno výše, výraznou měrou se na postupném zlepšování výsledků na poli lymfomů jak léčebných, tak vědeckých podílí Kooperativní lymfomová skupina (CLSG, obr. 6). Prakticky od počátku svého založení vydává léčebná doporučení pro diagnostiku a léčbu lymfomů, v roce 2018 to byla již 10. aktualizovaná verze [20]. Podporuje vzdělávání v oblasti lymfomů, výměnu informací. Velmi důležitou součástí je práce na poli prospektivního sběru dat, která se postupně transformovala do projektu NiHiL (GovTrial: NCT03199066), v jehož rámci jsou analyzována prospektivně sbíraná data pro jednotlivé typy lymfomů, a výstupem je celá řada prezentovaných a publikovaných výsledků. Kromě již zmíněných jmenujme alespoň za poslední rok jen výběrem analýzu incidence transformace u nemocných s FL a jejich osud [21], význam udržovací terapie rituximabem u starších nemocných s folikulárním lymfomem [22], význam udržovací terapie rituximabem u nemocných s lymfomem z plášťových buněk [23], osud mladších nemocných s lymfomem z plášťových buněk léčených vysoce intenzivní terapií s ASCT a udržovacím podáváním rituximabu [24]. Z prospektivních studií byly publikovány výsledky ukazující možnost léčby alternujícím režimem R-CHOP a R-„high dose“ Ara-C u starších nemocných s MCL [25] a také měnící se význam minimální reziduální choroby v kontextu udržovací terapie [26].
Obr. 6. Fotografie z posledního setkání Kooperativní lymfomové skupiny v roce 2018 
V oblasti péče o pacienty je nutné zmínit velmi úspěšně se rozvíjející spolupráci s pacientským sdružením LymfomHelp (www.lymfomhelp.cz). Účast lékařů na akcích této pacientské organizace, vzájemná spolupráce v oblasti dostupnosti nových léků a v dalších oblastech je velmi dobře kvitována.
Existuje však také výrazný rozvoj práce v oblasti experimentální, ať již na úrovni molekulárně biologické zabývající se např. významem mir150 a FOXP1 v transformaci folikulárních lymfomů [27], významem mutace TP53 a komplexního karyotypu u MCL [28], či preklinických myších modelů derivovaných xenotransplantací z pacientů (PDX; „patient-derived xenograft”) z pro testování nových léčebných postupů [29, 30].
Kromě spolupráce na úrovni národní bylo v posledních 25 letech dosaženo i významného pokroku na úrovni mezinárodní spolupráce, ať již v rámci European Mantle Cell Lymphoma Network, rozvíjející se spolupráce na úrovni Lymphoma Scientific Study Group EHA, bilaterální spolupráce s dalšími lymfomovými skupinami – francouzská LYSA, italská FIL, německá GLA a další.
Celkově lze shrnout, že v posledních 25 letech došlo k výraznému zlepšení jak v oblasti péče o nemocné s lymfomy, tak v oblasti klinického i preklinického výzkumu a vzájemné spolupráce. Dík za to patří všem spolupracujícím centrům, lékařům, vysokoškolákům, ošetřovatelským týmům, vědeckým pracovníkům a v neposlední řadě pacientům a jejich rodinám.
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 26. 11. 2018.
Přijato po recenzi dne 29. 1. 2019.
prof. MUDr. Marek Trněný, CSc.
I. interní klinika
Všeobecná fakultní nemocnice
U Nemocnice 2
128 08 Praha 2
e-mail: trneny@cesnet.cz
Zdroje
1. Harris NL, Jaffe ES, Stein H, et al. A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994;84 : 1361–1392.
2. Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon, IARC 2008.
3. Swerdlow AJ, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues, Revised 4th Edition. Lyon, IARC 2017.
4. Maloney DG, Liles TM, Czerwinski DK, et al. Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B-cell lymphoma. Blood 1994;84 : 2457–2466.
5. McLaughlin P, Grillo L, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four - dose treatment program. J Clin Oncol 1998;16 : 2825–2833.
6. Coiffier B, Lepage E, Herbrecht R, et al. MabThera (rituximab) plus CHOP is superior to CHOP alone in elderly patients with diffuse large B-cell lymphoma (DLCL): Interim results of a randomized GELA trial. Blood 2000;96(Suppl 1):950.
7. Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma. N Engl J Med 2002;346 : 235–242.
8. Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas. NCI Sponsored International Working Group. J Clin Oncol 1999;17(4):1244.
9. Juweid ME, Stroobants S, Hoekstra OS, et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the imaging subcommittee ofinternational harmonization project inlymphoma. J Clin Oncol 2007;25(5):571–578.
10. Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007;25 : 579–586.
11. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32 : 3059–3067.
12. Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000;403 : 503–511.
13. UZIS: Novotvary 2016 v ČR. Dostupné na: https://www.uzis.cz/katalog/zdravotnicka-statistika/novotvary.
14. Dušek L, Krejčí D, Mužík J, Jarkovský J, Pavlík T, Brabec P. Hematologické malignity v české populaci: aktuální epidemiologické trendy, predikce vývoje a jejich dopad do úhrad zdravotní péče. Transfuze Hematol dnes 2018;24(Supl 2a):5–8.
15. Trneny M, Campr V, Janikova A, et al. The improving outcome of non-Hodgkin lymphoma (NHL) within 15 years period – real world data of national-wide lymphoma project. Haematologica 2016;101 : 479–480.
16. Konirova E, Vitek A, Krejci M, et al. Vývoj transplantací pro lymfomy v České republice. Transfuze Hematol dnes 2018;24(Supl 2b):30.
17. Younes A, Ansell S, Fowler N, et al. The landscape of new drugs in lymphoma. Nat Rev Clin Oncol 2017;14 : 335–346.
18. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2019;380 : 45–56.
19. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017;377 : 2531–2544.
20. Belada D, Trněný M, et al. Kooperativní lymfomové skupiny. Diagnostické a léčebné postupy u nemocných s maligními lymfomy X. vydání, dostupné na: https://www.lymphoma.cz/assets/pdf/KLS_guidelines_10_2018.pdf.
21. Janikova A, Bortlicek Z, Campr V, et al. The incidence of biopsy-proven transformation in follicular lymphoma in the rituximab era. A retrospective analysis from the Czech Lymphoma Study Group (CLSG) database. Ann Hematol 2018;97 : 669–678.
22. Belada D, Prochazka V, Janikova A, et al. The influence of maintenance therapy of rituximab on the survival of elderly patients with follicular lymphoma. A retrospective analysis from the database of the Czech Lymphoma Study Group. Leuk Res 2018;73 : 29–38.
23. Obr A, Prochazka V, Papajik T, et al. Maintenance rituximab in newly diagnosed mantle cell lymphoma patients: a real world analysis from the Czech Lymphoma Study Group registry. Leuk Lymphoma 2018; publikováno elektronicky 6. září 2018. DOI: 10.1080/10428194.2018.1508672.
24. Klener PJ, Salek D, Pytlik R, et al. Rituximab maintenance significantly prolongs progression-free survival of patients with newly diagnosed mantle cell lymphoma treated with the Nordic MCL2 protocol and autologous stem cell transplantation. Am J Hematol; publikováno elektronicky 13. prosince 2018. DOI: 10.1002/ajh.25362.
25. Klener P, Fronkova E, Belada D, et al. Alternating R-CHOP and R-cytarabine is a safe and effective regimen for transplant-ineligible patients with a newly diagnosed mantle cell lymphoma. Hematol Oncol 2018;36 : 110–115.
26. Klener P, Fronkova E, Kalinova M, et al. Potential loss of prognostic significance of minimal residual disease assessment after R-CHOP based induction in elderly patients with mantle cell lymphoma in the era of rituximab maintenance. Hematol Oncol 2018;36(1):110–115.
27. Musilova K, Devan J, Cerna K, et al. miR-150 downregulation contributes to the high-grade transformation of follicular lymphoma by upregulating FOXP1 levels. Blood 2018;132 : 2389–2400.
28. Obr A, Prochazka V, Jirkuvova A, et al. TP53 mutation and complex karyotype portends a dismal prognosis in patients with mantle cell lymphoma. Clin Lymphoma Myeloma Leuk 2018;18 : 762–768.
29. Klener PJ, Trneny M, Andera L, et al. Co-targeting of BCL2 with venetoclax and MCL1 with S63845 is synthetically lethal in vivo in relapsed refractory mantle cell lymphoma with complex karyotype changes. Blood 2018;132 : 42.
30. Etrych T, Daumova L, Pokorna E, et al. Effective doxorubicin-based nano-therapeutics for simultaneous malignant lymphoma treatment and lymphoma growth imaging. J Control Release 2018;289 : 44–55.
Štítky
Dětská onkologie Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Posledních 25 let v diagnostice a léčbě myelodysplastického syndromu
- Vývoj transfuzní služby v České republice po roce 1990
- Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
- 25 let nepříbuzenského darování krvetvorných buněk
- Vývoj transplantací hematopoetických buněk v posledních 25 letech
- 25 rokov podpornej antiinfekčnej liečby v hematoonkológii
- 25 let vývoje metod molekulární biologie a jejich uplatnění v hemato(onko)logii
- 25 let vývoje dětské hematologie
- 25 rokov v komplexnej starostlivosti a liečbe hemofílie
- Ohlédnutí za vývojem antitrombotické profylaxe s akcentem na posledních 25 let
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
- Úvodník
- Transfuze a hematologie dnes – průřez historií
- Ohlédnutí za čtvrtstoletím léčby chronické lymfocytární leukemie
- Non-Hodgkinův lymfom v České republice
- Hodgkinův lymfom – nekončící příběh
- Vývoj diagnostiky a léčby mnohočetného myelomu v průběhu posledních 25 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hodgkinův lymfom – nekončící příběh
- Non-Hodgkinův lymfom v České republice
- Vývoj transfuzní služby v České republice po roce 1990
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



