-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodgkinův lymfom – nekončící příběh
Hodgkin lymphoma – endless story
Hodgkin lymphoma (HL) is a relatively rare malignant disease of lymphatic tissue. It accounts for only 0.5% of all cancer cases with an incidence of 2.9 cases per 100 000 of men and women per year. The typical curve of incidence has 2 peaks in developed industrial countries: young people are most frequently affected (age at diagnosis is 20–35 years in 70% of patients); the second peak of the disease is at the age over 60 years, more frequently in men (3 : 2). Medical history frequently includes infectious mononucleosis, autoimmune diseases and immunosuppression. Genetic factors (familiar occurrence) have probably additional impact on the disease. Currently, HL is a malignant disease with the highest rate of curability. This success was achieved by is due to immeasurable and financially demanding efforts of haemato-oncological centres worldwide. Long-lasting remissions are achieved (according to the clinical stage and risk factors) in 85–95% of patients and their life expectancy is currently more than 40 years. Late effects of treatment are coming to the fore, especially cardiotoxicity and secondary malignancies. Current research is focused on two goals: reduction of late effects in cured patients (by reducing chemotherapy intensity and by reducing radiotherapy dose and extent) while maintaining excellent efficacy of first-line treatment: positron emission tomography (PET) plays a central role in this effort. The second goal is to rescue the otherwise tragic fate of patients with relapsed/refractory HL (RR HL). New drugs based on immunotherapy such as brentuximab vedotin - an antibody-drug conjugate and anti-PD1 check-point inhibitors (nivolumab and pembrolizumab) are increasing in importance alongside conventional chemotherapy and radiotherapy.
Keywords:
radiotherapy – Hodgkin lymphoma – refractory/relapsed Hodgkin lymphoma – brentuximab vedotin – check-point inhibitors – anti-PD1
Autoři: J. Marková
Působiště autorů: Interní hematologická klinika FN Královské Vinohrady a 3. LF UK, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,25, 2019, No. 1, p. 87-95.
Kategorie: Souhrnné/edukační práce
Hodgkinův lymfom (HL) je relativně vzácné nádorové onemocnění lymfatické tkáně. Tvoří pouze 0,5 % všech malignit, incidence je 2,9 osob/100 000 obyvatel. V průmyslově vyspělých zemích má výskyt typickou dvouvrcholovou křivku: nejvíce postihuje mladé lidi (věk 70 % pacientů je v době diagnózy 20–35 let), druhý vzestup počtu onemocnění je ve věku nad šedesát let, častěji onemocní muži (3 : 2). V anamnéze mají pacienti často infekční mononukleózu, autoimunitní onemocnění nebo imunosupresi. Význam mají pravděpodobně i genetické faktory (rodinný výskyt). V současné době je HL jedno z nejlépe léčitelných hemato-onkologických onemocnění. Za úspěchy stojí nezměrné a finančně náročné úsilí světových hemato-onkologických center. Dlouhodobé remise dosahuje (podle stadia a rizikových faktorů) 85–95 % pacientů, jejich životní naděje je v současné době více než 40 let. Do popředí však začaly vystupovat pozdní následky léčby, především kardiotoxicita a sekundární malignity.
Souhrn
Hodgkinův lymfom (HL) je relativně vzácné nádorové onemocnění lymfatické tkáně. Tvoří pouze 0,5 % všech malignit, incidence je 2,9 osob/100 000 obyvatel. V průmyslově vyspělých zemích má výskyt typickou dvouvrcholovou křivku: nejvíce postihuje mladé lidi (věk 70 % pacientů je v době diagnózy 20–35 let), druhý vzestup počtu onemocnění je ve věku nad šedesát let, častěji onemocní muži (3 : 2). V anamnéze mají pacienti často infekční mononukleózu, autoimunitní onemocnění nebo imunosupresi. Význam mají pravděpodobně i genetické faktory (rodinný výskyt). V současné době je HL jedno z nejlépe léčitelných hemato-onkologických onemocnění. Za úspěchy stojí nezměrné a finančně náročné úsilí světových hemato-onkologických center. Dlouhodobé remise dosahuje (podle stadia a rizikových faktorů) 85–95 % pacientů, jejich životní naděje je v současné době více než 40 let. Do popředí však začaly vystupovat pozdní následky léčby, především kardiotoxicita a sekundární malignity. Současné cíle výzkumu HL se koncentrují do dvou směrů: snížit výskyt pozdních následků u vyléčených pacientů (snížit intenzitu chemoterapie, dávku a rozsah radioterapie) při zachovaní výborné účinnosti primární léčby. Zdůrazněn je význam pozitronové emisní tomografie (PET). Druhým cílem je zvrátit tragický osud pacientů s relabujícím a refrakterním HL (RR HL). Mimo radioterapie a chemoterapie nabývají významu nové léky na bázi imunoterapie, brentuximab vedotin (BV; „anti-drug-conjugate“) a tzv. „check-point“ inhibitory (CPI; anti PD1 – nivolumab a pembrolizumb).
Klíčová slova:
Hodgkinův lymfom – radioterapie – refrakterní/relabující Hodgkinův lymfom – brentuximab vedotin – „check-point“ inhibitory – anti PD1
ÚVOD
V roce 1832 publikoval v Londýně v časopisu Medico-Chirurgical Transactions patolog Thomas Hodgkin práci s názvem „On Some Morbid Appearances of the Absorbent Glands and Spleen“. Popsal sekční nález u sedmi pacientů se zvětšenými uzlinami a obrovskou slezinou [1]. V roce 1865 Samuel Wilks učinil podobná pozorování a nazval toto onemocnění Hodgkinovou chorobou [2].
Až v roce 1994 se podařilo rozluštit 160 let starou otázku – je Hodgkinova choroba infekce, zánět nebo maligní nádor? Ralf Küppers prokázal, že patognomonické Hodgkinovy/Reedové–Sterbergovy buňky (HRS buňky) jsou původem monoklonální B-lymfocyty germinálních center a označil Hodgkinovu chorobu za Hodgkinův lymfom (HL) [3].
HL je charakterizovaný výjimečnou histologií s minimem nádorových buněk (0,5–1 %). HRS buňky jsou těsně obklopené nenádorovými buňkami lymfatické uzliny. Mikroprostředí je tvořeno reaktivními zánětlivými/imunogenními buňkami s možností vzájemné interakce (cytokiny, signální síť) [4].
HRS buňky se in vitro obtížně kultivují. Poznatky o biologii HRS buněk byly získány díky první buněčné linii (German Hodgkin Study Group – GHSG) [5]. S detekcí CD30 antigenu HRS buněk se otevřely nové možnosti cílené léčby. V USA byl vyvinut brentuximab vedotin (BV), což je konjugát monoklonální protilátky anti CD30 s toxickou látkou monomethyl auristatin E (ADC – „antibody drug conjugate“) [6]. Dalším nadějným lékem na bázi imunoterapie jsou PD-1 inhibitory („check - point“ inhibitory, CPI) [7].
Výzkum velkých světových center je zaměřen na snížení pozdních následků léčby (především kardiotoxicitu a sekundární malignity), které zvyšují morbiditu a mortalitu vyléčených pacientů [8, 9] – graf 1. Zdůrazňována je snaha o maximálně účinnou přísně cílenou léčbu s minimálními vedlejšími toxicitami (akutními i dlouhodobými). Budoucnost ukáže, jaký bude výskyt pozdních následků u pacientů léčených současnou moderní léčbou.
Graf 1. Příčiny úmrtí pacientů s HL [8, 9]
Upraveno podle [8].
CVD – kardiovaskulární onemocnění, SM – sekundární malignity, HL – Hodgkinův lymfom. Na HL umírají pacienti prvních 10 let, později na kardiovaskulární onemocnění a sekundární malignity.![Příčiny úmrtí pacientů s HL [8, 9]<br>
Upraveno podle [8].<br>
CVD – kardiovaskulární onemocnění, SM – sekundární malignity, HL – Hodgkinův lymfom.
Na HL umírají pacienti prvních 10 let, později na kardiovaskulární onemocnění a sekundární
malignity.](https://pl-master.mdcdn.cz/media/image_pdf/fc7d3cf37e45da18c7e899efc88554f8.png?version=1560428245)
Dalším cílem výzkumů je zlepšení tragického osudu opakovaně relabujících a k léčbě rezistentních pacientů (R/R HL) [10].
Od poloviny 90. let minulého století strategii léčby HL v České republice nejvíce ovlivnila GHSG, vedená univerzitou v Kolíně nad Rýnem, v čele s profesorem Volkerem Diehlem, později profesorem Andreasem Engertem. Od roku 1995 naše centra zařazovala pacienty do aktuálních studií (Interní hematologická klinika FN Královské Vinohrady Praha, Interní hematologická a onkologická klinika FN Brno). Aktivně jsme se účastnili studií pro pokročilá stadia: HD9, HD12, HD15 , HD18; pro intermediární stadia: HD8, HD11, HD14; pro počáteční stadia: HD7, HD10, HD13; studie PVAG pro starší pacienty a studie recidiv HD-R2. Díky tomu jsme spoluautory mnoha publikací v prestižních časopisech [11–17].
Poznámka: Článek se zabývá převážně klasickým Hodgkinovým lymfomem (cHL), NLPHL (nodulární lymfocytárně predominantní HL), kterého je přibližně jen 5 %, krátce zmiňujeme.
Tabulka 1 zachycuje úspěchy první linie léčby GHSG, [12–14]
Tab. 1. GHSG - úspěchy první linie léčby, Borchmann, [12, 13, 14] ![GHSG - úspěchy první linie léčby, Borchmann, [12, 13, 14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/72e4d6797823ae256a3b662f2c1a401f.png)
Kontraverze v léčbě HL
Přes úspěchy v léčbě HL není zcela shoda, jak nejlépe léčit pacienty s různě pokročilým onemocněním. Mají se pacienti s počátečními stadii HL léčit chemoterapií a radioterapií, anebo je dostatečná jen chemoterapie? Jaká je správná léčba první linie u pokročilých stadií HL? Vzhledem k naší 25 let trvající spolupráci s GHSG budeme především zmiňovat strategie evropských skupin; GHSG a EORTC (European Organisation for Research and Treatment of Cancer).
VÝZNAM PET
HL silně akumuluje radiofarmakum fluorodeoxyglukózu (FDG), je výrazně FDG avidní (v metabolicky aktivní tkáni se glukóza s navázaným izotopem rychle spotřebovává). Pomocí PET je možno u HL na rozdíl od ostatních zobrazovacích metod (např. CT) prokázat aktivní nádorovou tkáň. Při iniciálním vyšetření (stanovení rozsahu nemoci, „staging“) není již potřeba provádět trepanobiopsie (histologické vyšetření kostní dřeně). PET spolehlivěji prokáže ložiskovité léze nádoru v kostní dřeni [18]. Léčba HL je přísně adaptovaná na rozsah tumoru, stanovený stadiem a rizikovými faktory, které jsou jasně definované [19]. Metoda stanovení celkového metabolického volumu nádorové masy TMTV („total metabolic tumor volume“) pomocí PET je přesnější, zejména při stanovení intermediárního stadia, ale není zatím v praxi zcela běžná [20, 21].
GHSG a EORTC rozlišuje tři terapeutické skupiny: GHSG časná, intermediální a pokročilá stadia, EORTC časná stadia příznivá („early favorable“) a časná stadia nepříznivá („early unfavorable“) a pokročilá stadia [22].
PET je významný nejen pro stanovení strategie chemoterapie, ale i pro přesnou navigaci radioterapie (RT). Důležitý je při plánování co nejmenších objemů ozařovacího pole: IS RT („involved side“), IN RT („involved node“). V souvislosti s RT HL se hovoří o výhodách protonové radioterapie, zvláště při nutnosti ozařování mediastina u mladých pacientů. Protonová RT je stejně tumoricidní jako klasická RT (fotonová). Při protonové RT je svazek protonů koncentrovaný do úzkého svazku („pencil beam scanning“), který přesně vykreslí ozařované pole. Vzhledem k přesnosti se minimalizuje ozáření plic, myokardu a míchy [23–26].
„PET response“ studie
Výsledek časně provedeného PET (průběžný, „interim“), většinou po dvou cyklech chemoterapie, určuje další intenzitu léčby. „Interim PET“ dokumentuje odpověď nádoru na terapii [24–26]. Semikvantitativní hodnocení efektu léčby pomocí PET používá termín DS (Deauville skóre, 5stupňová škála aktivity fluorodeoxyglukózy – FDG*). *Poznámka: aktivita FDG: DS1, menší než mediastinální pool. DS2, stejná jako mediastinální pool. DS3, větší než mediastinální pool a menší nebo stejná jako jaterní pool. DS4, větší než jaterní pool – pozitivní. DS5, ještě silnější než 4, značí progresi [26]. Jako PET negativní byl iniciálně označován DS1 a 2. DS3 byl považován za pozitivní (u studií plánovaných více než před 10 lety). Bylo zjištěno, že pacienti s DS3 mají stejně dobrou prognózu jako DS1,2. Nyní je proto DS1–3 považováno za negativní a pozitivní je až DS4 (viz závěry 11. International Symposium on Hodgkin Lymphoma (ISHL) v Kolíně nad Rýnem v říjnu 2018). Podle nově definované pozitivity „interim“ PET (až DS4) byly aktualizovány výsledky studie GHSG HD18 pro pokročilá stadia a provedeno první hodnocení studie GHSG HD16 pro počáteční stadia [27].
Obecně: PET negativní interim PET má vysokou prediktivní hodnotu na rozdíl od pozitivního interim PET, který má prediktivní hodnotu nižší.
Mezi recentně vyhodnocené „PET response“ studie patří EORTC H10, RAPID a RATHL (Velká Británie) a jmenované GHSG HD16 a HD18 [14, 22, 27–30]. V krátké době má být vyhodnocena studie HD17 GHSG (intermediární stadia). Studie HD17 a HD18 (pokročilá stadia) zahajují terapii dvěma cykly eBEA (časná internzifikace). Studie skupiny EORTC začínají chemoterapii většinou dvěma cykly ABVD (adriamycin, bleomycin, vinblastin, dacarbazin) a dále postupují podle výsledku „interim“ PET2. Je-li pozitivní, intenzifikují (eskalují) léčbu podáním dalších cyklů chemoterapie eBEA (bleomycin, etoposid, adriamycin, cyklofosfamid, oncovin-vincristin, procarbazin, prednison).
AKTUÁLNÍ STRATEGIE LÉČBY HL
Počáteční stadia
Standardem léčby GHSG je podle výsledků studie HD10 terapie 2 x ABVD + RT 20 Gy IS, [12]. Na 11. ISHL (Kolín 2018) prezentoval profesor A. Engert konečné hodnocení studie HD16, která řešila otázku: Je možné u PET negativních pacientů po chemoterapii 2 x ABVD vynechat radioterapii? NE! PFS („progression-free survival“) při vynechání RT je signifikantně horší (93,4 % vs. 86,1 %), OS („overal survival“) se při mediánu sledování 47 měsíců neliší (vzhledem k účinné léčbě druhé linie). Studie neprokázala zvýšení toxicity v rameni s RT. Zároveň byla řešena další otázka: je u PET pozitivních pacientů po 2 x ABVD zvýšené riziko zhoršení PFS? ANO! Pozitivní PET (DS4) po 2 x ABVD ukazuje signifikantně horší PFS: 93,1 % vs. 80,9 %. Standardem léčby pro počáteční stadia zůstává chemoterapie následovaná RT, PFS bez RT je horší. Stejný závěr potvrdily i další studie pro počáteční stadia (H10 a Rapid studie) [22, 29].
Intermediární stadia
Standardem GHSG je chemoterapie 2 x eBEA + 2 x ABVD + RT 30 Gy IF (výsledky HD14 studie). Relaps u pacienta s intermediárním stadiem může mít stejně špatnou prognózu jako relaps u pacienta s pokročilým stadiem. Předností studie HD14 je jistější kontrola tumoru. [13]. Čeká se na závěr HD17 studie GHSG, která podle výsledků PET2 redukuje radioterapii.
Studie EORTC/LYSA/FIL H10 pro časná stadia („early favorable“ a „unfavorable“ – v naší nomenklatuře počáteční a intermediární stadia). Intenzita léčby je upravená podle interim PET2. Přesto po iniciálních dvou cyklech ABVD s negativním PET2 a následném vynechání RT IN v obou ramenech studie došlo častěji k relapsům HL (obě ramena bez radioterapie byla uzavřena) [29]. U PET2 pozitivních pacientů byla léčba dále intenzifikovaná dvěma cykly eBEA. Tuto intenzifikaci potřebovala ale jen necelá čtvrtina pacientů. Chemoterapie byla posléze u všech pacientů konsolidována RT IN 30 Gy [30].
Pokročilá stadia
Léčba pokročilých stadií klasickou terapií ABVD selhává u 30–40 % pacientů. V 90. letech minulého století došlo k výrazným pokrokům v oblasti podpůrné léčby, především díky dostupnosti růstových faktorů leukocytů (G-CSF). Umožnilo to léčit pacienty účinnějšími terapeutickými schématy s vyššími dávkami cytostatik. GHSG intenzifikovala dávku i čas standardní terapie COPP+ ABVD. Vzniklo nové schéma polychemoterapie BEACOPP eskalovaný (eBEA), který prokázal velmi dobrou účinnost právě u pokročilých stadií HL. Bohužel, léčba 8 cykly eBEA měla vyšší toxicitu, především vyšší počet sekundárních MDS/AML (myelodysplastických syndromů s přechodem do akutních leukemií). Základní strategií GHSG se stal tzv. Kairos efekt* (Volker Diehl). HRS buňky jsou cytogeneticky velmi nestabilní, náchylné k vývoji časné sekundární rezistence. Mají být eliminovány tak brzy, jak jen je možné při prvním terapeutickém zásahu. Jsou velmi citlivé na léčbu, která však musí být zpočátku intenzivní, jinak hrozí nebezpečí vzniku rezistence [15]. (*Poznánka: Kairos je v řecké mytologii bůh příhodného času.) Intenzivní terapie na počátku léčby zlepšuje přežití. Rozdíl pětiletého OS je 10 % při časné intenzifikaci chemoterapií eBEA (oproti ABVD). Studie pokročilých stadií HL jsou v rámci GHSG během posledních let výrazně zaměřené na deeskalaci dávky chemoterapie a rozsahu radioterapie za podmínky zachování výborných výsledků léčby. Cílem je redukovat akutní a hlavně pozdní toxicitu léčby [10, 14].
Studie GHSG HD18. 2 x eBEA, při negativním interim PET2, jen další dva cykly, celkem jen 4 cykly eBEA. Při pozitivitě PET2 pokračuje léčba dalšími čtyřmi eBEA (celkem 6 cyklů) + RT reziduálního tumoru 30 Gy zaměřená jen na PET pozitivní reziduum [14]. Asi 70 % pacientů nepotřebuje intenzivní léčbu a bylo by vyléčeno ABVD. Internacionální prognostické skóre pro pokročilá stadia HL (IPS Hasenclever) hodnotí jen klinické rizikové faktory a nedokáže tyto pacienty identifikovat [31–35].
Co nás naučila studie HD18 ? [27]. Spolehlivou identifikací pacientů, kteří po dvou cyklech eBEA potřebují intenzifikovat léčbu dalšími čtyřmi cykly eBEA je pozitivní „interim“ PET2 (DS4,5). Tito pacienti jsou léčeni celkem 6 cykly eBEA. Přežití (PFS a OS) je díky této strategii velmi dobré. PET2 (DS1-3) má vysokou negativní prediktivní hodnotu a dovoluje 76 % pacientů léčit jen čtyřmi cykly eBEA. Toxicita při léčbě jen čtyřmi cykly eBEA (76 % pacientů] je únosná [14]. OS po čtyřech cyklech eBEA je 98 %. Díky výrazně snížené toxicitě je signifikantně lepší ve srovnání s 6/8 cykly.
Britská studie RATHL pro pokročilá stadia HL. Při pozitivním „interim“ PET po dvou cyklech ABVD je terapie intenzifikovaná eBEA. Má vyšší selhání léčby u PET2 negativních pacientů (negativní význam pozdní intenzifikace). U PET2 negativních pacientů byl od třetího cyklu vynechán bleomycin (méně plicní toxicity) bez signifikantního zhoršení výsledků [36].
LYSA AHL 2011 (studie fáze III) u pokročilých stadií cHL: u PET2 negativních pacientů po dvou cyklech eBEA je možné pokračovat čtyřmi cykly ABVD. Pacienti po 4 cyklech eBEA, je-li PET 4 pozitivní, tvoří vysoce rizikovou skupina se špatnou prognózou [27].
Srovnání studie HD18 (GHSG) s ostatními strategiemi léčby pokročilých stadií [36–40] viz tabulka 2.
Tab. 2. Srovnání studie HD18 (GHSG) s ostatními strategiemi léčby pokročilých stadií [36–40] ![Srovnání studie HD18 (GHSG) s ostatními strategiemi léčby pokročilých stadií [36–40]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/052b5c684ad4edbd4e8eb093b1e6e18c.png)
TRM: treatment related mortality Pacienti nad 60 let věku mají horší prognózu. eBEA se nedoporučuje, obvykle se používá terapie ABVD. Nebezpečnou komplikaci představuje hematotoxicita spolu s akutní a chronickou plicní toxicitou. Je-li PET2 negativní, možno v dalších cyklech bleomycin vynechat a pokračovat jen terapií AVD. Radioterapie IF/IS 30 Gy doplňuje terapii. Starší pacienti hůře tolerují i RT. Pravděpodobně bude výhodnější použití nových léků na bázi imunoterapie [10, 11, 22, 30].
Rezistentní a relabující HL. U 10–20 % pacientů dochází k progresi nebo relapsu onemocnění (RRHL). Standardem 2. linie léčby je záchranná („salvage“) terapie. U nás se nejčastěji používá chemoterapie 2 x DHAP (dexamethazon, vysoká dávka cytosin-arabinosidu a cisplatina) s následnou vysokodávkovanou terapii (HDT) s podporou autologní transplantací periferních kmenových buněk (ASCT) – studie HDR2 [41]. Tato strategie je účinná asi u 50 % pacientů. Osud zbylé poloviny pacientů byl do nedávna velmi špatný i přes možnost alogenní transplantace (aloSCT), většina pacientů zemřela do dvou až tří let [42, 43]. AloSCT ztrácí postupně na významu vzhledem k možnosti použití nových léků na bázi imunoterapie. Je to ADC (antibody-drug conjugate) brentuximab vedotin – BV). Na monoklonální protilátku anti CD30 je bílkovinnými můstky navázána silně toxická látka – momometyl auristatin E (MMAE) – obrázek 1.
Obr. 1. ADC – brentuximab bedotin, ADC – „antibody-drug conjugate“, mechanismus cytotoxického účinku
Na protilátku anti-CD30 je pomocí proteinového můstku (v plazmě stabilního] připojen cytotoxický antitubulinový monomethyl auristatin E (MMAE). Konjugát se váže na receptory CD 30, které jsou exprimované na povrchu H/RS buněk, pomocí lysozomů se noří do nitra buňky. Lysozomální proteázy degradují proteinovou vazbu na anti CD30 protilátku. MMAE je uvolněn, rozruší mikrotubulární síť, buněčný cyklus se zastaví, dochází k apoptóze buňky.
(Upraveno podle Younes A, Bartelett NL, Leonard JP, et al. Brentuximab vedotin (SGN 35) for relapsed CD30-positive lymfomas. N Engl J Med 2010;363:1812–1821.)![ADC – brentuximab bedotin, ADC – „antibody-drug conjugate“, mechanismus cytotoxického
účinku<br>
Na protilátku anti-CD30 je pomocí proteinového můstku (v plazmě stabilního] připojen cytotoxický
antitubulinový monomethyl auristatin E (MMAE). Konjugát se váže na receptory CD 30, které jsou
exprimované na povrchu H/RS buněk, pomocí lysozomů se noří do nitra buňky. Lysozomální proteázy
degradují proteinovou vazbu na anti CD30 protilátku. MMAE je uvolněn, rozruší mikrotubulární síť,
buněčný cyklus se zastaví, dochází k apoptóze buňky.<br>
(Upraveno podle Younes A, Bartelett NL, Leonard JP, et al. Brentuximab vedotin (SGN 35) for relapsed
CD30-positive lymfomas. N Engl J Med 2010;363:1812–1821.)](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/07cb20eb7eef7e8ab8a4089059065ab6.png)
Younes prezenentoval v roce 2012 studii, které se účastnilo 102 pacientů s RRHL, léčených BV. Celková odpověď („overall response rate“, ORR) byla 75 %, z toho kompletní remisi dosáhlo 34 pacientů (33 %) [6]. Povzbudivé je konečné hodnocení studie, která dokumentuje pětileté trvání kompletní remise u části pacientů s RR HL, léčených jen monoterapií BV. U 13 ze zmíněných 34 pacientů (38 %) trvala kompletní remise v době posledního hodnocení více než 5 let. Devět z těchto 13 pacientů (9 % všech zařazených pacientů) bylo léčeno jen BV, bez další konsolidační léčby alogenní transplantací. Celkové 5leté OS celého souboru (102 pacientů) je 41 % a 5leté PFS je 22 %. Pacienti, kteří dosáhli CR po léčbě BV mají OS 64 % a PFS 52 %. Konečné hodnocení prokázalo, že část pacientů s RR HL je léčitelná jen monoterapií BV [44].
Profil toxicity BV je relativně příznivý. Z vedlejších účinků je nejvýznamnější neurotoxicita (kumulativní dávka BV). Způsobuje jí antitubulární toxicita MM Auristatinu E v distálních neuronech. Periferní senzorickou neuropatii má více než 50 % pacientů (< 10 % stupně 3). Periferní motorická neuropatie se vyskytuje asi u 10 % pacientů (< 5 % stupně 3). Přibližně u poloviny pacientů neuropatie vymizí, u jedné třetiny přetrvává v mírné formě. Závažnými, i když vzácnými vedlejšími účinky jsou: akutní pankreatitida, těžké kožní reakce a progredující multifokální leukoencefalopatie. Pravděpodobným vysvětlením je skutečnost, že pankreas exprimuje u některých pacientů malé množství CD30 receptorů. Ostatní vedlejší účinky jsou mírné [44]. Prezentovali jsme pacientku s relapsem po ASCT, která je v CR 5 let po monoterapii šestnácti cykly BV. Konsolidaci aloSCT odmítla [45].
Další novou substancí, jejíž účinek je na imunologické bázi jsou monoklonální protilátky anti PD-1 nivolumab a pembrolizumab – obrázek 2.
Obr. 2. Immune checkpoint 2 Nivolumab, „check-point“ inhibitor PD-1,mechanismus působení CPI Nivolumab je humánní monoklonální protilátka IgG4 fungující jako inhibitor „check point“ PD-1 („programmed death“). Aktivuje protinádorovou imunitní odpověď T lymfocytů. Zabraňuje vazbě PD-1 na jeho ligandy PD-L1 a PD-L2 a tím blokuje přenos inhibičního signálu do T-lymfocytu. IgG4 – imunoglobulin G4.
(Upraveno podle Postow MA, Callahan MK, Wolchok JD, Blockade in cancer therapy. J Clin Oncol 2015;33(17):1974–1982).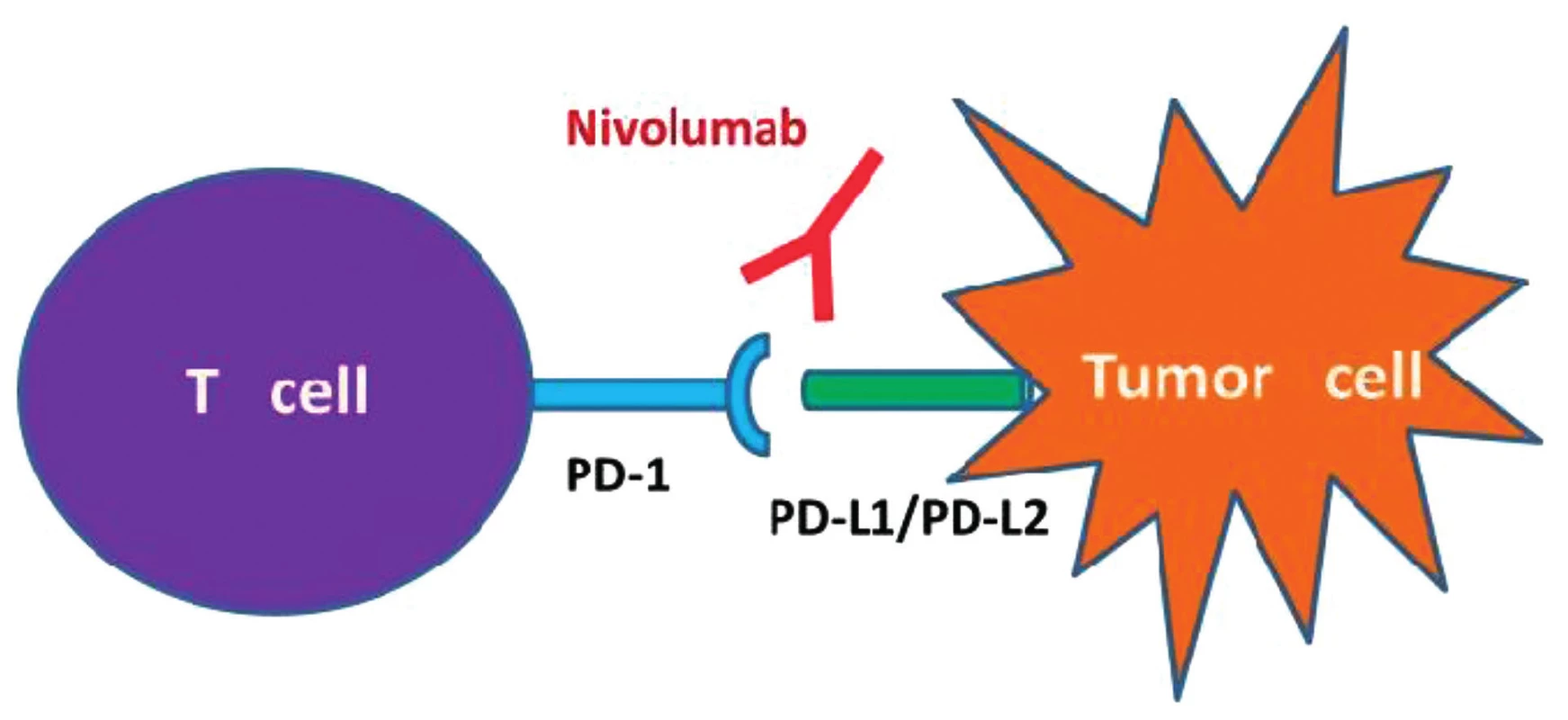
Málokterý pacient by byl v roce 2019 indikován k aloSCT, aniž by prodělal léčbu některým tímto novým lékem, působícím na imunologické bázi [46, 47]. Přesto se doporučuje kontaktovat centrum, které aloSCT provádí. Při druhém relapsu není nutno spěchat s indikací aloSCT a zahajovat drahé vyhledávání v našich i zahraničních registrech dárců kostní dřeně. Umožňují to i pokroky v oblasti aloSCT – možnost transplantovat periferními kmenovými buňkami haploidentického dárce s redukovanou dávkou přípravného režimu (RIC aloSCT). Následné podání cyklofosfamidu tlumí GvHD (reakci štěpu proti hostiteli), ale GvHL (reakce štěpu proti lymfomu) je zachovaná [48]. (Poznámka redakce: viz také příspěvek Cetkovského). Pacienti po aloSCT mají obvykle horší kvalitu života, četné komplikace: relapsy, GvHD, oportunní infekce.
Nové léky (BV a anti-PD1 inhibitory, „check-point“ inhibitory – CPI) jsou nadějí pro pacienty s druhým a dalším relapsem HL po ASCT nebo po dvou liniích „salvage“ terapie u pacientů, kteří nejsou únosní pro transplantaci [44, 49, 50].
Další vývoj vědeckých poznatků v oblasti biologie HL, nových léků, technických pokroků radioterapie jistě ještě dále zlepší prognózu pacientů s HL.
Experimentálně jsou nové léky zařazovány již do první linie léčby pokročilých stadií HL. Cílem je snížit intenzitu léčby a tím i výskyt pozdních následků. Například prospektivní globální randomizovaná studie ECHELON-1. Srovnává léčbu 6 cykly ABVD s 6 cykly A-AVD (A = Adcetris, firemní název brentuximab vedotinu). Vzhledem k pneumotoxicitě se vynechává bleomycin. Podává se v dávce 1,2 mg/kg v intervalu dvou týdnů. Dvouletý PFS 76,6 % vs. 83,2 %, dvouletý OS 94,2 % vs. 96,6 %. Ve srovnání s ABVD má A-AVD o 30 % nižší riziko relapsu a/nebo úmrtí na HL. Oproti klasickému ABVD má A-AVD vyšší toxicitu a především vyšší finanční náklady. Medián sledování 24,6 měsíců. Poslední hodnocení (OS 2 roky) se zdá slibné, i když se ozývají kritické hlasy [27, 38–40]. „Echelon 1 update“ přednesl na 11. ISHL J. Radford [27].
HRS buňky exprimují PD-1-L (ligand) a T lymfocyty exprimují PD-1 receptory. PD-1 inhibitory (nivolumab a pembrolizumab) jsou humání monoklonální protilátky, které zabrání interakci PD1-L a PD-1. Kombinace s chemoterapií může působit synergicky a být nadějí pro RR/HL [7] (viz obr. 2).
Výhodu konsolidace BV po ASCT u pacientů s rizikovým prvním relapsem potvrdila studie AETHERA. Za rizikový relaps je považován: lymfom refrakterní na první linii léčby, časný relaps < 12 měsíců, relaps s extranodálním postižením, B symptomy a ≥ 2 „salvage“ léčbami před ASCT [46]. Pro indikaci stačí již dva z těchto nepříznivých faktorů. V současné době je konsolidace BV po ASCT u pacientů s rizikovými prvními relapsy HL považovaná za standard. BV konsolidace po ASCT. Moskowitz CH uvedl v přednášce AETHERA update aktualizované výsledky pětiletého sledování PFS: 59 % vs 41 % v rameni s placebem [27].
JAK DÁL V LÉČBĚ HL?
11. zasedání ISHL v Kolíně nad Rýnem v říjnu 2018, organizované GHSG, nastínilo rychlý vývoj především v oblasti imunoterapie. Aktuální hodnocení některých studií přispělo k vyřešení závažných otázek, ale ne všechny jsou vyřešené [27].
Margaret Schipp (Stanford) ve své přednášce na téma T-buňky a PD-1 inhibice u HL uvedla mnohá zajímavá fakta. Analýza HRS buněk a imunogenního mikroprostředí, které je těsně obklopuje, byla provedena v rámci studie Checkmate 205. HRS buňky exprimují PD-L1 a imunogenní T lymfocyty receptor PD-1. Pomocí vazby PD1-L a PD-1 dochází k tlumení imunitní činnosti T lymfocytů, které ztrácejí schopnost působení proti růstu a množení nádorových buněk. PD-1 inhibitory (nivolumab a pembrolizumab) tuto vazbu blokují, dochází k restituci imunitní protinádotové funkce T lymfocytů. Téměř všichni pacienti s klasickým HL (cHL) mají genetický základ pro senzitivitu na PD-1 blokádu. 97 % pacientů s cHL má chromozomální alteraci v 9p24.1 lokusu a zvýšeně exprimují PD-L1 nádoru. Pacienti RR/HL s nízkou hladinou 9p24.1 alterace a nízkou hladinou PD-L1 exprese mají horší PFS po léčbě nivolumabem. M. Schipp uvádí, že HRS buňky jsou obklopeny CD4 pozit lymfocyty, exprimujícími CD-1 receptor. Exprese CD4 na T buňkách je ovlivněna expresí MHC II („major histocompatibility complex“) na HRS buňkách. HRS buňky jsou chráněny hradbou tumor-asociovaných makrofágů (TAM), které exprimují PD-L1. Přesná znalost mechanismů těchto interakcí v budoucnu může zlepšit protinádorovou terapii.
David Rossi (Švýcarsko) se ve své přednášce „Genotypizace cHL cestou solubilní biopsie“ zabýval stanovením cirkulující „cell free DNA“ HRS buněk (cf DNA). Provádí se experimentálně v rámci studií. Hladina koreluje s velikostí tumoru a efektem terapie. V budoucnu jí bude možno použít ke stanovení minimální reziduální nemoci.
Nové léky v první linii
André M. Studie BREACH (Lysa, EORTC, FIL). Intermediární stadia „early unfavorable HL“. Studie byla zahájena v roce 2015 [27]. Pacienty randomizovala do standardní větve 4 x ABVD + 30 Gy a experimentální větve 4x AVD + A + (1,2 mg/kg v intervalu dvou týdnů) + 30 Gy RT. Studie je přísně standardizovaná. PET po 2 cyklech byl centrálně hodnocen, v určených intervalech byla odebírána periferní krev za účelem stanovení solubilní cf DNA HRS buněk, organizován byl digitalizovaný panel patologů. Studie prokázala signifikantně vyšší PET2 negativitu u experimentálního ramene (A-AVD), ale s výrazně vyšší toxicitou (výskyt závažných nežádoucích účinků byl 18 % vs. 2 %). Medián sledování v době hodnocení byl 25 měsíců. PFS 97,2 % vs. 91,3 %. Je třeba výsledků s delší dobou sledování.
Relabující/refrakterní Hodgkinův lymfom byl zajímavým tématem 11. ISHL v Kolíně. ASCT má být provedena co nejdříve u pacientů se zvýšeným rizikem (význam PET po první linii léčby). Třetí linie (po ASCT): BV konsolidace nebo terapie CPI. BV a CPI, mají dobré výsledky u netransplantovatelných pacientů starších než 60 let [27]. Účinnost kombinace nových léků s různými záchrannými režimy při prvním relapsu – přehled přednesli Moskowitz CH a Advani Ranjana, která se této problematice věnovala podrobněji. BV+ bendamustin, BV-DHAP, BV+ ESHAP, BV+ nivolumab, nivolumab + ipilimumab. Tyto kombinace dosahují před ASCT odpovědi přibližně v 62 % až 79 %. Po ASCT je dvouletý PFS nejvyšší s kombinací nivolumab s BV (= 97 %).
Postavení a význam nových cílených preparátů v léčbě HL (BV a CPI). Výsledkem monoterapie v primární léčbě je nízké procento remisí krátkého trvání. Naopak v oblasti relapsů, i opakovaných, mají tyto léky dobrý efekt, relativně nízkou toxicitu a kvalita života pacientů je dobrá.
Léčba CPI
Studie Keynote 087 (RR/HL), monoterapie pembrolizumabem, CR dosáhlo 20–25 % pacientů, medián PFS byl 13,4 měsíce pro všechny pacienty (3 skupiny, kohorty). BV+ nivolumab: ORR 83 %, CR 62 %. CPI v první linii léčby: Studie Checkmate 205, kohorta D: Nivo +AVD, ORR 84 %, CR 64 %. V USA probíhá randomizovaná studie u pokročilých stadií BV +AVD vs. Nivo + AVD (North American Intergroup Trial). Připravují se studie fáze 3 pro pacienty s R/R HL (BV vs. pembrolizumab, BV vs BV + nivolumab). Další studie testují synergické působení imunoterapie a radioterapie v rámci mikroprostředí HL, využívají tzv. abskopálního efektu. Abskopální efekt vychází z hypotézy, že RT stimuluje aktivitu T buněk působících proti tumoru. Při progresi nádoru ale dochází ke zvýšení PD-L1. Např. fáze 2 studie s pembrolizumabem a IS RT u pacientů s lokalizovaným relapsem. (C. Moskowitz), AERN studie GHSG využívá abskopálního efektu RT a nivolumabu při relapsu po PD-1 terapii [27].
ZÁVĚR
Nobelova cena za fyziologii a lékařství byla v roce 2018 udělena J. P. Allisonovi z USA a T. Hondžó z Japonska za objev protinádorové imunity. Indikace nových účinných léků na bázi imunoterapie (brentuximab vedotin a PD1 inhibitory nivolumab a pembrolizumab) je v našich podmínkách vzhledem k vysokým finančním nákladům přísně kontrolovaná. Pro naše pacienty je přesto dostupná. Udržovací léčba brentuximab vedotinem po ASCT u rizikového prvního relapsu je považovaná již za standard (viz AETHERA). BV je indikován u relapsu HL po ASCT a nebo u pacientů se selháním dvou linií terapie, nejsou-li schopni ASCT. Cílem léčby BV nemá být jen „přemostění“ k aloSCT, ale kompletní remise. PD-1 inhibitor je možno podat po selhání léčby BV a recentně lze i při relapsu po ASCT u pacienta, který neprodělal ještě léčbu BV. Významná je účast našich center v prospektivních mezinárodních studiích, které tyto léky nebo jejich kombinace testují. Zařazeným pacientům je věnovaná zvýšená péče, účinné léky jsou dodávány testující firmou. Mimo finančních úspor nemocnic a benefitu pro pacienty, získají lékaři zkušenost s novými léky, mnohdy ještě před jejich registrací v Evropě.
Čestné prohlášení
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací toho článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena grantem AZV 16-29857A a výzkumným projektem Univerzity Karlovy v Praze, 3. lékařské fakulty v Praze Q28 Progres a Q40/08 Progres.
Doručeno do redakce dne 7. 10. 2018.
Přijato po recenzi dne 14. 12. 2018.
MUDr. Jana Marková
Interní hematologická klinika
FN Královské Vinohrady a 3. LF UK
Šrobárova 50
100 34 Praha 10
e-mail: jana.markova@fnkv.cz
Zdroje
1. Hodgkin T. On some morbid appearances of the absorbent glands and spleen. Med Chir Trans1832;17(1):68–114.
2. Wilks S. Cases of enlargement of the lymphatic glands and spleen (or Hodgkin´s disease), with remarks. Guy´s Hosp Rep 1865;11 : 56–67.
3. Küppers R, Rajewsky K, Zhao M, et al. Hodgkin disease: Hodgkin and Reed-Sternberg cells picked from histological sections show clonal imunoglobulin gene rearraangements and appear to be derived from B cells at variol stages of development. Proc Natl Acad Sci USA 1994;91(23):10962–10966.
4. Mociková H. Epidemiologie a rizikové faktory spojené s Hodgkinovým lymfomem. Transfuze Hematol dnes 2014;20(3):81–86.
5. Stein H, Diehl V. First Hodgkin cell line L428 and the CD30 antigen: their role for diagnostic and treatment of CD30-positive neoplasms. Hematol Oncol Clin North Am 2014;28(1):1–11.
6. Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refracory Hodgkin´s lymphoma. J Clin Oncol 2012;30 : 2183–2189.
7. Armand P, Engert A, Younes A, et al. Nivolumab for relapsed/refraktory classic Hodgkin Lymphoma after failure autologous hematopoietic cell transplantation: Extended follow – up of the multicohort single – arm phase II Checkmate 205 trial. J Clin Oncol 2018;36 : 1–12.
8. Aleman BM, van den Belt-Dusebout AW, Klokman WJ, et al. Long-term cause-specific mortality of patients treated for Hodgkin‘s disease. J Clin Oncol 2003;21(18):3431–3439.
9. Schaapveld M, Aleman BMP, van Eggermond AM, et al. Second cancer risk up to 40 years after treatment for Hodgkin’s Lymphoma. N Engl J Med 2015;373(26):2499–2511.
10. Eichenauer DA, Aleman BMP, Andre M, et al. Hodgkin lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up on behalf of the ESMO Guidelines Committee. Ann Oncol 2018;29 (Sup 4):iv19–iv29.
11. Sýkorová A, Móciková H. Hodgkinův lymfom u starších nemocných. Acta Medicinae 2018;11 : 97–103.
12. Engert A, Plütschow A, Eich HT, et al. Reduced treatment intensity in patients with early stage Hodgkin Lymphoma. New Engl J Med 2010;363 : 640–652.
13. Von Tresckow B, Plütschow A, Fuchs M, et al. Dose-intensification in early unfavorable Hodgkin lymphoma: Final analysis of the GHSG HD14 trial. J Clin Oncol 2012;30(9):907–913.
14. Borchmann P, Goergen H, Kobe C, et al. PET-guided treatment in patiens with advanced-stage Hodgkin´s lymphoma (HD18):final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet 2018;390 : 2790–2802.
15. Diehl V, Franklin J, Pfreundschuh M, et al. German Hodgkin‘s Lymphoma Study Group. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin‘s disease. N Engl J Med 2003;348(24):2386–2395.
16. Behringer K, Goergen H, Hitz F, et al. German Hodgkin Study Group; Swiss Group for Clinical Cancer Research; Arbeitsgemeinschaft Medikamentöse Tumortherapie. Omission of dacarbazine or bleomycin, or both, from the ABVD regimen in treatment of early-stage favourable Hodgkin‘s lymphoma (GHSG HD13): an open-label, randomised, non-inferiority trial. Lancet 2015;385(9976):1418–1427.
17. Eich HT, Diehl V, Görgen H, et al. Intensified chemotherapy and dose-reduced involved field radiotherapy in patients with early unfavorable Hodgkin lymphoma: final analysis of the German Hodgkin Study Group (GHSG) HD11 trial. J Clin Oncol 2010;28 : 4199–4206.
18. Voltin CA, Goergen H, Baues C, et al. Value of bone marrow biopsy in Hodgkin lymphoma patients staged by FDG PET: results from the German Hodgkin Study Group trials HD16, HD17, and HD18. Ann Oncol 2018;29(9):1926–1931.
19. Sýkorová A, Pytlík R, Móciková H, et al. Hodnocení klinického stadia a léčebné odpovědi u maligních lymfomů – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace). Klin Onkol 2016;29(4):295–302.
20. Cottereau AS, Versari A, Loft A, et al. Prognostic value of baseline metabolic tumor volume in early-stage Hodgkin lymphoma in the standard arm of the H10 trial. Blood 2018;131(13):1456–1463.
21. Procházka V, Lukášová M, Henzlová L, et al. Můžeme upravit intenzitu úvodní léčby u Hodgkinova lymfomu podle výsledku průběžného PET? Acta Medicinae 2018;11 : 104–107.
22. Radford J, Illidge T, Counsell N, et al. Results of a trial of PET-directed therapy for early stage Hodgkin´s lymphoma. N Engl J Med 2015;372(17):1598–1607.
23. Dědečková K, Móciková H, Belada D, et al. Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny. Klin Onkol 2013;26(2):99–109.
24. Mociková H. Vyšetření pozitronovou emisní tomografií u nemocných s Hodgkinovým lymfomem. Transfuze Hematol dnes 2011;17(1):20–24.
25. Marková J, Kobe C, Skopalova M, et al. FDG-PET for assessment of early treatment response after 4 cycles of chemotherapy in patients with advanced-stage Hodgkin lymphoma has a high negative predictive value. Ann Oncol 2009;20(7):1270–1274.
26. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32(27):3059–3068.
27. HemaSphere 2(S3): 11. ISHL, 27, October 2018, Cologne, Germany.
28. Bröclekmann PJ, Sasse S, Engert A. Balancing risk and bendit in early stage classical Hodgkin lymphoma. Blood 2018;131(15):1666–1678.
29. Raemakers JM, André MP, Federico M, et. Al. Omitting radiotherapy in early positronemission tomography-negative stage I/II Hodgkin lymphoma is associated with an increased riskof early relapse: clinical results of the preplanned interim analysis of the randomised EORTC/LYSA/FIL H10 trial. J Clin Oncol 2014;32(12):1188–1194.
30. André MPE, Girinsky T, Federico M, et al. Early positron emission tomography response-adapted treatment in stage I and II Hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol 2017;35(16):1786–1794.
31. Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin‘s disease. International Prognostic Factors Project on Advanced Hodgkin‘s Disease. N Engl J Med 1998;339(21):1506–1514.
32. Engert A, Diehl V, Franklin J, et al. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkins Lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol 2009;27 : 4548–4554.
33. Borchmann P, Haverkamp H, Diehl V, et al. Eight cycles of of escalated-dose BEACOPP compared with four cycles of escalated-dose BEACOPP with or without radiotherapy in patients with advanced-stage Hodgkin’s lymphoma: Final analysis of the HD12 trial of the German Hodgkin Study Group (GHSG). J Clin Oncol 2011;29(32):4234–4242.
34. Belada D, Štěpánková P, Sýkorová A, et al. Ten years‘ experience with four cycles of bleomycin, etoposide, doxorubicin, cyclophosphamide, vincristine, prednisone, procarbazine (BEACOPP)-escalated followed by four cycles of baseline-dose BEACOPP in patients with advanced stage Hodgkin lymphoma: a single-center, retrospective study. Leuk Lymphoma 2015;56(7):2013–2018.
35. Engert A, Haverkamp H, Kobe C, et al. German Hodgkin Study Group; Swiss Group for Clinical Cancer Research; Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin‘s lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet 2012;379(9828):1791–1799.
36. Johnson P, Federico M, Kirkwood A, et al. Adapted treatment guided by interim PET-CT scan in advanced Hodgkin‘s lymphoma. N Engl J Med 2016;374(25):2419–2429.
37. Lim SH, Johnson PWM. Optimizing therapy in advanced-stage Hodgkin lymphoma. Blood 2018;131 : 1679–1688.
38. Connors JM, Jurczak W, Straus DJ, et al. Brentuximab Vedotin with chemotherapy for Stage III or IV Hodgkin‘s Lymphoma. ECHELON-1 Study Group. N Engl J Med 2018;378(9):878.
39. Borchmann P, Fosså A, Dlugosz-Danecka M, et al. The phase 3 study ECHELON-1 evaluating brentuximab vedotin in patients with newly diagnosed Hodgkin lymphoma leaves important questions unanswered. HemaSphere 2018;2(3):e52.
40. Adams HJA, Kwee TC. Benefit of brentuximab over bleomycin in first line treatment of advanced-stage Hodgkin lymfom has not been proven. Blood 2018;132 : 339–340.
41. Josting A, Müller H, Borchmann P, et al. Dose intensity of chemotherapy in patients with relapsed Hodgkin‘s lymphoma. J Clin Oncol 2010;28(34):5074–5080.
42. Mociková H. Léčba relabovaného a refrakterního Hodgkinova lymfomu. Transfuze Hematol dnes 2010;16(2):82–88.
43. Krejčí M, Sedláček P, Jindra P, et al. Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP. Transfuze Hematol dnes 2016;22(2):127–149.
44. Chen R, Gopal AK, Smith SE, et al. Five-year survival and durability results of brentuximab vedotin in patiens with relapsed or refraktory Hodgkin lymphoma. Blood 2016;128 : 1562–1566.
45. Marková J, Mociková H. Brentuximab vedotin – zkušenosti z klinické praxe. Remedia 2018;28 : 382–386.
46. Shah NM, Bartlett NL. Management of relapsed/refraktory classical Hodgkin lymphoma in transplant-ineligible patients. Blood 2018;131 : 1698–1703.
47. Shah GL, Moskowitz CH. Transplant strategies in relapsed/refractory Hodgkin lymphoma. Blood 2018;131 : 1689–1696.
48. Martinez C, Gayoso J, Sureda A, et al. On behalf of the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Post – transplantation cyclophosphamide – based haploidentical transplantation as alternative to matchet sibling or unrelated donor transplantation for Hodgkin lymphoma. J Clin Oncol 2017;35 : 3425–3432.
49. Bartlett NL, Chen R, Fanale MA. Retreatment with brentuximab vedotin in patiens with CD30-positive hematologic malignancies. J Hematol Oncol 2014;7(24):1–8.
50. Moskowitz CH, Nademanee A, Masszi T, et al. Brentuximab vedotin as consolidation therapy after autologous stem cell transplantation in patientss with Hodgkin´s lymphoma et risk of relace or progression (AETHERA): a randomised, double blind, placebo-controlled, phase 3 trial. Lancet 2015;385 : 1853–1862.
Štítky
Dětská onkologie Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Úvodník
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2019 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Posledních 25 let v diagnostice a léčbě myelodysplastického syndromu
- Vývoj transfuzní služby v České republice po roce 1990
- Vývoj léčby chronické myeloidní leukemie v posledních 25 letech
- 25 let nepříbuzenského darování krvetvorných buněk
- Vývoj transplantací hematopoetických buněk v posledních 25 letech
- 25 rokov podpornej antiinfekčnej liečby v hematoonkológii
- 25 let vývoje metod molekulární biologie a jejich uplatnění v hemato(onko)logii
- 25 let vývoje dětské hematologie
- 25 rokov v komplexnej starostlivosti a liečbe hemofílie
- Ohlédnutí za vývojem antitrombotické profylaxe s akcentem na posledních 25 let
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
- Úvodník
- Transfuze a hematologie dnes – průřez historií
- Ohlédnutí za čtvrtstoletím léčby chronické lymfocytární leukemie
- Non-Hodgkinův lymfom v České republice
- Hodgkinův lymfom – nekončící příběh
- Vývoj diagnostiky a léčby mnohočetného myelomu v průběhu posledních 25 let
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hodgkinův lymfom – nekončící příběh
- Non-Hodgkinův lymfom v České republice
- Vývoj transfuzní služby v České republice po roce 1990
- Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



