-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
Indications for allogeneic and autologous haematopoietic cell transplantations in the Czech Republic in 2016: Recommendations of the Transplant Section of the Czech Society of Haematology and the Czech Society of Oncology of the J. E. Purkyně Medical Association
Haematopoietic cell transplantation (HCT) remains at present (2016) a very important and irreplaceable treatment option. The main indications for HCT are haematological malignancies (90% of all indications), non-malignant disorders (6%) and solid tumours (4%). The last recommendations for HCT indications were published by the Czech Society of Haematology and the Czech Society of Oncology in 2006. An up-to-dated version of the previous report has been prepared by the authors on behalf of both professional societies in 2016. Recommendations presented in this article are mainly based on the current practise of European transplant centres and on recommendations published by the European Group for Blood and Marrow Transplantation (EBMT) in 2015. The aim of this report is to provide an up to date guide to hospitals not directly involved in haematopoietic cell transplantations regarding the correct and well-timed indication of HCT. This article also aims to provide other specialist information relating to HCT.
Key words:
haematopoietic cells – transplantation – indications
Autoři: M. Krejčí 1; P. Sedláček 2; P. Jindra 3,12; M. Šťastná-Marková 4
; E. Faber 5; P. Žák 6; M. Trněný 7; T. Kozák 8; J. Štěrba 9; R. Hájek 10; T. Büchler 11; M. Kuříková 13; J. Mayer 1; J. Starý 2; M. Karas 3; A. Vítek 4; L. Raida 5; D. Pohlreich 7; Z. Kořístek 10; P. Cetkovský 4
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Klinika dětské hematologie a onkologie UK 2. LF a FN Praha-Motol 2; Hematologicko-onkologické oddělení FN Plzeň 3; Ústav hematologie a krevní transfuze Praha 4; Hemato-onkologická klinika FN Olomouc 5; IV. interní hematologická klinika, FN a LF Hradec Králové 6; I. interní klinika VFN a 1. LF UK Praha 7; Interní hematologická klinika 3. LF UK a FN Královské Vinohrady, Praha 8; Klinika dětské onkologie FN Brno 9; Hematoonkologická klinika FN Ostrava 10; Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha 11; Český národní registr dárců dřeně Plzeň 12; Český registr dárců krvetvorných buněk Praha 13
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. 2, p. 127-150.
Kategorie: Doporučené postupy
Souhrn
Transplantace krvetvorných buněk zůstávají i v současné době (rok 2016) důležitou a nenahraditelnou terapeutickou modalitou především u některých hematologických malignit (90 % všech indikací), ale i řady jiných onemocnění (10 % všech indikací, z toho představují 6 % nenádorová onemocnění krvetvorby a 4 % solidní tumory). Poslední indikační doporučení k transplantacím krvetvorných buněk byla vydána Českou hematologickou a Českou onkologickou společností ČLS JEP v roce 2006. V roce 2016 byla v zastoupení obou odborných společností autory připravena aktualizovaná verze původního sdělení. V článku uvedená doporučení vychází především ze současné praxe evropských transplantačních center a z publikovaných doporučení Evropské skupiny pro transplantace krve a kostní dřeně (EBMT) z roku 2015. Cílem práce je poskytnout pracovištím, která tyto transplantace standardně neprovádějí, aktuální návod k jejich správné a včasné indikaci, ale také řadu dalších odborných informací vztahující se k problematice transplantací krvetvorných buněk.
KLÍČOVÁ SLOVA :
krvetvorné buňky – transplantace – indikace1 ÚVOD
Transplantace krvetvorných buněk (haematopoietic cell transplantation, HCT) je efektivní léčebná procedura pro mnoho získaných i vrozených onemocnění krvetvorby včetně některých vzácných poruch imunitního systému a enzymatických metabolických onemocnění, která je prováděna také u některých solidních tumorů [1–4]. Vlastní transplantace krvetvorných buněk je intravenózní podání štěpu krvetvorných buněk, kterému předchází podání přípravného předtransplantačního režimu (nejčastěji jde o kombinaci cytostatik, případně i celotělového ozáření). Přípravný režim má za cíl zničit stávající neefektivní krvetvorbu či maligní buňky (myeloblativní příprava), případně pouze potlačit imunitní systém příjemce, a tak umožnit přihojení krvetvorby dárce (nemyeloablativní příprava, příprava redukovanou intenzitou). Aplikace myeloablativního přípravného režimu je značně toxická, tato toxicita je hematologická a nehematologická. Podání cytostatik ve vysokých dávkách by bez podání štěpu vedlo mimo jiné k dlouhodobé až ireverzibilní aplazii kostní dřeně pacienta. Hematologickou toxicitu pozitivně ovlivňuje právě podání štěpu krvetvorných buněk. K uchycení štěpu krvetvorných buněk a postupné obnově krvetvorby dochází zpravidla do 2–3 týdnů po transplantaci periferních krvetvorných buněk, u krvetvorných buněk z kostní dřeně je tento interval o něco delší.
Rozlišujeme dva základní typy transplantací (HCT):
- Autologní transplantace znamená, že pro transplantaci jsou použity vlastní krvetvorné buňky nemocného odebrané zpravidla ve stadiu remise nebo minimální aktivity základní nemoci.
- Alogenní transplantace znamená, že pro transplantaci jsou použity krvetvorné buňky jiného člověka, nejčastěji je to vhodný sourozenec nebo vhodný nepříbuzný dárce.
Výjimečně se provede tzv. syngenní transplantace, je-li dárcem jednovaječné dvojče.
Terapeutické využití HCT je dlouhodobé a trvalé, léčba pomocí HCT je standardně v České republice (ČR) prováděna od devadesátých let 20. století. I v současné době (rok 2016) zůstává provedení HCT u celé řady onemocnění, především některých hematologických malignit (90 % všech HCT indikací), nenahraditelnou a nezastupitelnou terapeutickou modalitou, která může vést k vyléčení jinak smrtelného onemocnění. Na druhé straně je třeba si uvědomit, že tento terapeutický výkon je značně složitý, nese s sebou řadu možných závažných zdravotních komplikací, které mohou vést v některých případech i k úmrtí pacienta. U některých hematologických malignit se po zavedení nových cílených léčivých přípravků do klinické praxe zcela změnila indikační kritéria pro provedení HCT (např. u chronické fáze chronické myeloidní leukemie u dospělých pacientů, která byla dříve standardní HCT indikací, je nyní jednoznačně preferovaná léčba tyrozinkinázovými inhibitory), naopak u řady dalších diagnóz zůstává provedení HCT důležitou terapeutickou možností s kurativním potenciálem (akutní leukemie, myelodysplastický syndrom, myelofibróza a další).
Provedení HCT v ČR jednoznačně spadá do kompetence center vysoce specializované hematoonkologické péče (HOC), respektive transplantačních hematoonkologických center, kterých je v současné době (rok 2016) v ČR deset. Jedná se o specializovaná pracoviště v těchto fakultních nemocnicích (FN) a specializovaných ústavech v ČR: FN Plzeň (dospělí), VFN Praha (dospělí), ÚHKT Praha (dospělí), FN Brno (dospělí), FN Motol Praha (děti), FN Královské Vinohrady Praha (dospělí), FN Hradec Králové (dospělí), FN Olomouc (dospělí), FN Ostrava (dospělí), FN Brno (děti). Některá z těchto center provádějí pouze autologní nebo alogenní transplantace krvetvorných buněk, jiná centra provádějí oba typy transplantací.
Hlavní současné HCT indikace podle zprávy Evropské skupiny pro transplantace kostní dřeně z roku 2013 (European Society for Blood and Marrow Transplantation, EBMT) představují leukemie (32 % všech indikací, z toho 96 % alogenních a 4 % autologních), lymfoidní malignity a mnohočetný myelom (57 % všech indikací, z toho 11 % alogenních a 89 % autologních), solidní tumory (4 % všech indikací, z toho 4 % alogenních a 96 % autologních) a nemaligní onemocnění (6 % všech indikací, z toho 91 % alogenních a 9 % autologních) [5].
Počty transplantací krvetvorných buněk v Evropě a v ČR postupně stále narůstají, např. v roce 2013 bylo v Evropě provedeno 39 209 HCT, z toho bylo 43 % alogenních (14 950 případů) a 57 % autologních (19 859 případů). Současné trendy jsou takové, že je pozorován rychlejší nárůst v počtu alogenních než autologních HCT, dále narůstá počet příbuzných i nepříbuzných dárců. V roce 2013 bylo v Evropě provedeno také 1571 haploidentických transplantací a 666 transplantací pupečníkové krve.
V ČR je v posledních letech prováděno kolem 600 HCT ročně, např. v roce 2014 bylo v ČR provedeno 696 transplantací krvetvorných buněk, z toho bylo 257 alogenních (37 %) a 439 autologních (63 %).
Počet provedených HCT ve vyspělých zemích Evropy se v současné době pohybuje nad 200–300 alogenních HCT na 10 miliónů obyvatel a nad 300–400 autologních HCT na 10 miliónů obyvatel [5]. Česká republika patří v tomto ohledu mezi evropskou špičku a řadí se mezi 15 evropských zemí s nejvyššími počty HCT [5].
Indikace k alogenním a autologním transplantacím krvetvorných buněk (alo-HCT, auto-HCT) byly opakovaně publikovány Transplantační sekcí České hematologické společnosti a České onkologické společnosti ČLS JEP, naposledy v roce 2006 [6]. Tato doporučení vždy vycházela především ze závěrů a doporučení EBMT. Současným cílem autorů je přinést aktualizovaný pohled na transplantační indikace, vycházející z běžné praxe transplantačních center v Evropě v roce 2015 [7] a také z již opakovaně zveřejněných indikačních doporučení EBMT [8–12].
U každého nemocného vstupuje do hry celá řada faktorů (celkový klinický stav, přítomnost přidružených onemocnění, věk, dostupnost dárce, stav základní nemoci, prognostické faktory a další skutečnosti), které ovlivňují závěrečné indikační rozhodnutí. Individuální posouzení indikace transplantace krvetvorných buněk je komplexní a složitý proces, spadající do kompetence jednotlivých transplantačních komisí, které jsou součástí každého transplantačního hematoonkologického centra v rámci ČR. Některé složitější případy indikací nepříbuzenských alogenních transplantací v ČR jsou ještě posuzovány Meziústavní indikační komisí, kterou tvoří odborníci z center provádějících alogenní transplantace.
Autoři věří, že aktualizované shrnutí standardní evropské klinické praxe v roce 2015 může pomoci především hematologickým a onkologickým pracovištím, která transplantace standardně neprovádějí, pomýšlet na možnou indikaci transplantační léčby správně a včas, což je základním předpokladem pro optimální léčebný výsledek u každého konkrétního nemocného.
2 DEFINICE TRANSPLANTACE, KATEGORIE DÁRCŮ, ZDROJE KRVETVORNÝCH BUNĚK
2.1 Transplantace krvetvorných buněk (HCT)
Definice: Provedení HCT se rozumí jakýkoliv léčebný postup, umožňující podání krvetvorných buněk z jakéhokoliv zdroje a od jakéhokoliv dárce příjemci s cílem obnovit nebo nahradit plně nebo částečně jeho krvetvorný systém [7]. Krvetvorné buňky mohou být získány z kostní dřeně, periferní krve nebo pupečníkové krve. U alogenní HCT může být obnovení/náhrada krvetvorných buněk měřeno vyšetřením tzv. chimerismu, tedy poměru zastoupení krvetvorby dárce a příjemce po provedení alo-HCT. Kompletní chimerismus po provedení alogenní HCT znamená přítomnost 100 % dárcovské krvetvorby a jeho navození po alo-HCT je optimálním stavem. Cíl provedení HCT by měl být stanoven předem a před zahájením léčby a provedením HCT by měl být získán informovaný souhlas nemocného (a rovněž také dárce).
2.2 Klasifikace a kategorie dárců, typy transplantací
Základní typy dárců jsou následující: autologní, syngenní, alogenní.
Kategorie alogenní dárce zahrnuje tyto typy dárců: HLA-identický sourozenecký dárce, jiný rodinný, respektive jiný příbuzný dárce a dále vhodný nepříbuzný dárce.
Optimální alogenní dárce má s pacientem shodné všechny důležité povrchové antigeny na leukocytech (tzv. HLA identický sourozenecký dárce nebo dobře shodný nepříbuzný dárce), v současné době se preferuje shoda 10 z 10 antigenů I. a II. HLA třídy (lokusy A, B, C, DR, DQ).
Jako dobře shodný nepříbuzný dárce (MUD, well-matched unrelated donor) je tedy definován dárce se shodou s příjemcem v 10/10 nebo 8/8 HLA antigenech při použití molekulárně-biologického vyšetření (PCR vyšetření, metoda high-resolution).
Jako nepříbuzný dárce s neshodou (MMUD, mismatched unrelated donor) je definován dárce, který má alespoň jednu neshodu v antigenu či alele HLA-A, -B, -C či -DR (13).
Jako haploidentický dárce je definován člen rodiny pacienta, který má alespoň jeden HLA haplotyp geneticky shodný s pacientem.
Podle typu použitého dárce krvetvorných buněk tedy rozeznáváme tyto čtyři základní typy transplantací [7]:
- A. Sourozenecká alogenní transplantace: dárcem je HLA identický sourozenec (bratr nebo sestra). Tento dárce je definován jako genotypově identický dárce.
- B. Alogenní transplantace od dobře shodného nepříbuzného dárce (MUD) – shoda 10/10, shoda 8/8 nebo shoda 9/10, pokud je přítomna neshoda v DQ.
- C. Alogenní HCT od alternativního dárce – tato kategorie zahrnuje nepříbuzného dárce, který má alespoň jednu neshodu v antigenu či alele HLA-A, -B, -C či -DR, dále do této skupiny patří haploidentická transplantace a transplantace pupečníkové krve.
- D. Autologní HCT – dárce a pacient jsou jedna a tatáž osoba. U autologní HCT je protinádorový účinek zajištěn předtransplantační vysokodávkovanou chemoterapií. Vlastní transplantace (převod autologního štěpu krvetvorných buněk) neléčí, ale umožňuje podání této vysokodávkované léčby tím, že dojde k obnově fatálně poškozené krvetvorby.
U alogenní HCT není transplantát kontaminován nádorovými buňkami. Navíc obsahuje T-lymfocyty dárce, schopné rozpoznat přežívající nádorové buňky příjemce, které pak jsou imunitními mechanismy likvidovány. Jde o tzv. reakci štěpu proti nádoru, tato je však často spjata i s reakcí štěpu proti hostiteli (graft-versus-host disease, GvHD), která naopak poškozuje tkáně a orgány hostitele (nejčastěji bývá postižení kůže, jater, sliznice gastrointestinálního traktu, dále dutiny ústní a očí). Alogenní HCT také umožňuje podání vysokodávkované terapie tím, že dojde k obnovení krvetvorby podobně jako u autologní HCT, avšak rovněž sama o sobě má výrazný léčebný účinek.
Je-li potřeba provést alogenní HCT, je nutné na prvním místě hledat potenciálního dárce v rodině a začít u sourozenců. Zde je 25% pravděpodobnost zdědění stejných holotypů, a tudíž nalezení úplné HLA shody. Jen menšina nemocných má sourozence a ještě navíc HLA identického. Výjimečně je možné najít vhodného dárce v širším příbuzenstvu.
Pokud pacient nemá HLA identického sourozence, pak je potřeba se obrátit na registry dobrovolných dárců krvetvorných buněk. V ČR existují 2 národní registry, Český národní registr dárců dřeně v Plzni a Český registr dárců krvetvorných buněk v Praze. Dále existuje celá řada zahraničních registrů, s nimiž zabezpečují komunikaci oba národní registry. Většině pacientů je nalezen vhodný alogenní nepříbuzný dárce v horizontu několika měsíců. Samotné darování krvetvorných buněk je bezplatné, veškeré náklady spjaté s vyhledáním vhodného dárce a získáním štěpu krvetvorných buněk jsou v ČR hrazeny zdravotní pojišťovnou pacienta. Vlastní provedení HCT (autologní i alogenní) u konkrétního nemocného je rovněž standardně v ČR hrazeno zdravotními pojišťovnami.
Haploidentická transplantace: použití haploidentického dárce pro alo-HCT je i v současnosti indikováno pouze v situaci, kdy nemůže být nalezen jiný vhodný dárce a současně neexistuje žádný jiný kurativní léčebný postup. Výhodou je možnost nalezení haploidentického dárce v rodině pacienta pro většinu nemocných, hlavní nevýhody haploidentické alo-HCT byly dříve: vysoká incidence závažných forem GvHD a vysoký počet rejekcí štěpu [14]. Variant přípravy štěpu od haploidentického dárce je více. V 80. letech 20. století bylo principem významné snížení počtu T-lymfocytů (CD3+ buněk) při vyšším počtu kmenových krvetvorných buněk (CD34+ buněk) ve štěpu. Riziko GvHD pak bylo relativně nízké, významně však narůstalo riziko pomalé imunologické rekonstituce. Vysoká byla i incidence virových infekcí a snížený byl efekt štěpu proti nádoru [6]. Haploidentický štěp by měl obsahovat více než 5 x 106 CD34 pozitivních buněk/kg hmotnosti příjemce [6]. V posledních letech zájem o haploidentické transplantace opět narůstá při využití potransplantačního cyklofosfamidu jako prevence rejekce štěpu a GvHD [15, 16], haploidentické alo-HCT představují v současné době cca 10 % všech alogenních transplantací [5].
2.3 Darování od nezletilého dárce
Dárcovství nezletilých (do 18 let věku) je ve světě regulováno. V roce 2002 bylo právně upraveno i v České republice podle zákona č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů. K darování je nezbytný souhlas rodičů či právních zástupců dítěte a kladné vyjádření podle tohoto zákona ustavené speciální etické komise. Přihlíží se i k vyjádření nezletilého dárce. Podle tohoto zákona lze použít nezletilého dárce výhradně k transplantaci pro vlastního sourozence.
U nezletilých dárců jsou stále převládající odběry kostní dřeně, i když zastoupení štěpů PBSC se postupně zvyšuje, např. v roce 2013 bylo v Evropě uskutečněno 1181 transplantací krvetvorných buněk u dětí od HLA identických sourozenců, z toho představovaly PBSC 20 % všech štěpů a kostní dřeň 74 % všech štěpů [5].
Dárcovství při významném negativním váhovém nepoměru mezi dárcem a příjemcem je možno řešit opakovaným odběrem se zamražením části štěpu. U starších dělí je již možno použít mobilizaci pomocí G-CSF s následným odběrem PBSC, ale tento výkon pro většinu z nich znamená nutnost zavedení centrálního žilního katétru, což zvyšuje riziko komplikací. Další alternativou je krátkodobá stimulace dárce růstovými faktory v nižší dávce než před aferézou s následným odběrem kostní dřeně. Takto stimulovaná kostní dřeň obsahuje více progenitorových krvetvorných buněk (CD34+ buněk). U malých dětí, kde jsou plánovány odběry významného objemu kostní dřeně, může být krátce podáván erytropoetin ve snaze minimalizovat nutnost podání transfuze cizí krve po odběru.
2.4 Infuze dárcovských T-lymfocytů (DLI)
DLI je definována jako infuze T-lymfocytů (nebo jejich subpopulace) získaných od předchozího dárce alogenních krvetvorných buněk odběrem z primárního štěpu, plné krve nebo následnou lymfocytaferézou. Jejím účelem je posílit přihojení štěpu, posunout poměr mezi krvetvorbou dárce a příjemce ve prospěch dárce (tedy u nemocných s nestabilním smíšeným chimerismem snaha o navození kompletního chimerismu), předcházet odmítnutí štěpu a za účelem léčby či předcházení relapsu základní nemoci. Cíl postupu by měl být stanoven předem a před zahájením postupu by měl být získán písemný souhlas nemocného a dárce.
2.5 Zdroje krvetvorných buněk
Standardními zdroji krvetvorných buněk jsou kostní dřeň (bone marrow, BM) a periferní krvetvorné buňky (peripheral blood stem cells, PBSC). U auto-HCT se PBSC staly upřednostňovaným zdrojem s ohledem na dosažení rychlejší obnovy krvetvorby, v současné době se používají u 99 % všech autologních transplantací právě PBSC (5). Vlastní odběr periferních krvetvorných buněk se provádí pomocí separátorů krevních buněk. Pro periferní krvetvorné buňky je typické, že na svém povrchu nesou antigen CD34. Optimální načasování odběru PBSC se děje zpravidla sledováním koncentrace CD34+ buněk (CD34+ frakce leukocytů) v periferní krvi pomocí vyšetření průtokovou cytometrii. Pro mobilizaci PBSC do periferní krve se využívá většinou růstový faktor pro granulocyty filgrastim (G-CSF), ať již samotný, nebo v kombinaci s chemoterapií. Dávky G-CSF jsou variabilní v závislosti na typu dárce a složení mobilizačního režimu a pohybují se v intervalu 5–16 µg/kg/den. U některých pacientů, kteří nedosáhnou adekvátního množství CD34+ buněk po této standardní mobilizaci PBSC, lze využít podání plerixaforu [17–19]. Plerixafor v kombinaci s G-CSF je určen ke zlepšení mobilizace hematopoetických kmenových buněk do periferní krve pro odběr a následnou autologní transplantaci u dospělých pacientů s lymfomem a mnohočetným myelomem, jejichž PBSC nebyly dostatečně mobilizovány při předchozí standardní mobilizaci za použití G-CSF. Bezpečný autologní transplantát obsahuje alespoň 2,0 x 106 CD34+ buněk na kg hmotnosti příjemce [6].
Pokud jde o alo-HCT, oba tyto zdroje krvetvorných buněk mají své výhody i nevýhody. PBSC dosahují výrazně rychlejšího obnovení krvetvorby u příjemce, což je velmi důležitý faktor [7]. Na druhé straně po podání PBSC dochází ke zvýšenému výskytu chronické reakce štěpu proti hostiteli po jejich podání ve srovnání s kostní dření [20]. Třebaže některými studiemi bylo doloženo, že podáním alogenních PBSC dochází ke snížení transplantační mortality a zlepšení doby přežití bez nemoci u pacientů s pokročilejším stadiem choroby, nebyly podobné výsledky dosaženy u nemocných transplantovaných v časné fázi choroby [6]. Existuje randomizovaná studie fáze III, která neprokázala zásadní rozdíl v celkovém přežití pacientů transplantovaných kostní dření nebo periferními krvetvornými buňkami od nepříbuzných dárců, nicméně použití PBSC může redukovat riziko rejekce štěpu, použití BM může redukovat riziko chronické GvHD [21].
Za určitých situací, jako např. při potřebě získání bohatě buněčného štěpu u haploidentických transplantací, mohou být PBSC zřetelnou výhodou. Předběžné výsledky nedokládají také žádnou výhodu PBSC ve srovnání s kostní dření u nemocných s těžkou aplastickou anémií, kde vyšší riziko chronické reakce štěpu proti hostiteli může dokonce ústit ve zhoršení celkového přežití. V každém případě při volbě zdroje krvetvorných buněk musí být jednoznačně respektováno přání a rozhodnutí dárce [6, 7].
Dalším zdrojem krvetvorných buněk je pupečníková krev (cord blood, CB). Tento zdroj je však využíván spíše v situacích, kdy není dostupný vhodný alogenní dárce kostní dřeně či PBSC nebo když situace nemocného vyžaduje rychlé provedení transplantace nedovolující prodlení nezbytné k vyhledání dárce. CB transplantace je považována za efektivní transplantační způsob zvláště u dětí, neboť pro transplantaci je doporučováno podání dávky alespoň 2 x 107 jaderných buněk/kg hmotnosti příjemce [6, 7]. Nicméně CB transplantace mohou být prováděny i u dospělých pacientů, zvláště pokud dávka buněk dosahuje požadovaných parametrů, případně je možné použít pro transplantaci dvě jednotky CB [22]. HLA shoda je samozřejmě upřednostňována, ovšem HLA neshoda nepřesahující 2 HLA antigeny bývá běžně akceptována. Výběr CB štěpu má být v první řadě prováděn s ohledem na dávku buněk podaných na kilogram hmotnosti příjemce, teprve v druhé řadě s ohledem na úroveň HLA shody [6]. Využití pupečníkové krve (CB) pro provedení HCT oproti ostatním zdrojům krvetvorných buněk je nízké a má význam pouze u alogenních HCT. Podle mezinárodní evropské analýzy bylo v roce 2013 provedeno celkem 39 209 HCT, z tohoto množství byla CB jako alogenní zdroj krvetvorných buněk použita od 64 HLA identických dárců a od 666 nepříbuzných dárců (2 % všech HCT) [5]. V případě autologních HCT byla pouze ve 2 případech uvedena jako zdroj krvetvorných buněk CB.
Kritérium rychlosti přihojení štěpu je zásadní faktor, podle analýzy EBMT z roku 2015 u sourozeneckých alogenních transplantací tvoří periferní krvetvorné buňky 71 % a kostní dřeň 21 % všech štěpů. U nepříbuzných alogenních transplantací pak představují PBSC 76 % a kostní dřeň 16 % všech štěpů [5].
2.6 Přípravné předtransplantační režimy – myeloablativní a s redukovanou intenzitou
Transplantační přípravné režimy tvoří většinou různé kombinace cytostatik, někdy spolu s celotělovým ozářením (TBI). Liší se svojí intenzitou, podle které mohou být klasifikovány do dvou základních kategorií:
- a) standardní transplantační přípravný režim, neboli myeloablativní režim (myeloablative conditioning, MAC režim);
- b) režim s redukovanou intenzitou (reduced intensity conditioning, RIC režim) [7]. Podání myeloablativního režimu vede ke zničení stávající krvetvorby a navození těžké dřeňové aplazie s dlouhodobou periferní pancytopenií, bez podání štěpu krvetvorných buněk by došlo k úmrtí na infekční, krvácivé a další komplikace. Myeloablativní režim má významnou toxicitu hematologickou i nehematologickou, na druhé straně má silný protinádorový účinek a zničením stávající krvetvorby je vytvořeno místo pro krvetvorbu novou. U alogenní transplantace má přípravný režim i významný imunosupresivní účinek, jelikož intenzivní imunosuprese je předpokladem přihojení transplantátu a zamezení jeho rejekce. Důležitou součástí některých přípravných režimů před alo-HCT je proto podání anti-thymocytárního globulinu (ATG). Dříve byly používány pouze myeloablativní předtransplantační režimy.
Hypotéza, že reakce štěpu proti nádoru je schopna eradikovat nádorové buňky, vedla k postupnému rozvoji režimů s redukovanou intenzitou, tedy RIC režimů [7]. Transplantačních příprav s redukovanou intenzitou bylo publikováno a je používáno široké spektrum a zatím neexistuje obecně přijímaná shoda, od jakého okamžiku lze přípravu označit za redukovanou. Recentní EBMT definice doporučuje jako RIC režim označit takový, který představuje redukci dávek cytostatik nebo TBI nejméně na 50 % ve srovnání se standardním myeloablativním režimem [7]. RIC redukovaná příprava může u alo-HCT měnit poměr mezi rizikem transplantační mortality a rizikem relapsu. RIC transplantace jsou ve stále vyšší míře využívány v léčbě jak maligních, tak nemaligních onemocnění. V posledních letech je zhruba 40 % všech alo-HCT prováděno s redukovanou přípravou [5], u některých onemocnění představují až 70 % všech indikací [7]. Dosavadní výsledky prokazují, že RIC transplantace významně snižují riziko časné transplantační mortality, a umožňují tak transplantaci u nemocných ve vyšším věku a s řadou přidružených chorob, které byly dříve považovány za transplantační kontraindikaci. U mnoha nemocných je tento typ transplantace jedinou dostupnou kurativní léčbou [6, 7]. Retrospektivní studie z EBMT registru ukazují, že RIC režimy mají nižší úmrtnost, tedy peritransplantační mortalitu, ve srovnání s myeloablativními režimy, u myeloablativních režimů je zase nižší počet relapsů [23–25]. Myeloablativní režimy i RIC režimy tak mají obdobné doby do progrese nemoci (PFS) i podobné celkové přežití (OS). Transplantace se standardní myeloablativní přípravou tak zůstávají možností volby u mladších nemocných bez jiných přidružených chorob. U nemocných staršího věku nebo s přítomností komorbidit je spíše vhodné volit RIC režim.
2.7 Faktory rizikové pro výsledek transplantace
Ještě před vlastním provedením HCT u konkrétního nemocného jsou hodnocena rizika a faktory, ovlivňující peritransplantační mortalitu (non-relapse mortality, NRM), tedy úmrtnost v souvislosti s provedením HCT, a tím i celý výsledek transplantace.
Hlavní faktory důležité pro výsledek alogenní HCT po myeloablativní přípravě podle Gratwohla et al. jsou následující: stav nemoci před transplantací (remise versus aktivní onemocnění), věk pacienta (pod 20 let, 20–40 let, nad 40 let), doba od stanovení diagnózy do provedení HCT (doba do 1 roku versus nad 1 rok), míra histokompatibility mezi dárcem a příjemcem (sourozenecký dárce versus nepříbuzný dárce), rozdílné pohlaví dárce a příjemce (jako možný nepříznivý faktor je označována situace, kdy je dárce žena a příjemce muž) [26]. Jedná se o tzv. EBMT skóre. Čím vyšší je toto EBMT skóre, tím větší je pravděpodobnost potransplantačních komplikací a možného úmrtí v souvislosti s provedením HCT.
Věk nemocného je jedním z důležitých prognostických faktorů u HCT, podstatný je však spíše biologický než kalendářní věk, obecně však čím vyšší věk, tím větší riziko. Velmi zjednodušeně lze doporučit pro provádění autologních i alogenních transplantací krvetvorných buněk jako věkovou hranici 65 let, je ovšem nutný individuální přístup a v případě dobrého klinického stavu pacienta s nepřítomností zásadních komorbidit lze provádět transplantační léčbu až do věku 70 let, a to především u autologních HCT [6]. Je třeba zdůraznit, že uvedené věkové limity pro provedení HCT jsou orientační a nelze je považovat za zcela striktní. U řady nemocných je tak plně oprávněné doporučené věkové hranice překročit a u jiných je naopak provedení HCT odmítnuto i přes mladší věk, jelikož jejich celkový klinický stav a přítomnost dalších komplikujících onemocnění neumožňuje bezpečné provedení HCT. Nemocní ve věku do 18 let jsou v tomto sdělení klasifikováni jako děti.
Se zavedením režimů s redukovanou intenzitou do klinické praxe a zlepšením podpůrné péče v potransplantačním období rostou počty HCT i u pacientů staršího věku a s přítomností komorbidit. Ke zhodnocení potransplantačního rizika byl vytvořen HCT-specifický index přítomnosti přidružených chronických onemocnění, která mají význam pro predikci peritransplantační mortality, a tedy pro celkové přežití po transplantaci, tzv. index komorbidit (HCT-specific co-morbidity index, HCT-CI skóre) (27). Například pacienti, kteří mají hodnotu HCT-CI skóre 0, mají pravděpodobnost úmrtí ve 2 letech po alogenní HCT 9%. Pacienti, kteří mají hodnotu HCT-CI skóre 4 a více, mají pravděpodobnost úmrtí ve 2 letech po alogenní HCT 43% [27]. Dalším důležitým faktorem je celkový klinický stav pacienta, tzv. Karnofského skóre. Jeho hodnota se vyjadřuje v procentech, v tomto případě platí čím vyšší hodnota, tím lépe, optimální hodnota je 80 % a více [28].
Před vlastním provedením HCT je tedy nutno posoudit kromě správné indikace také celou řadu dalších faktorů u konkrétního nemocného a rozhodnout, zda transplantační léčba bude pro pacienta skutečným přínosem. Toto je úkolem transplantačních komisí, které pracují v rámci jednotlivých hematoonkologických transplantačních center v ČR.
2.8 Nejčastější léčivé přípravky používané v souvislosti s transplantacemi krvetvorných buněk
S vlastním provedením HCT je spjato podávání celé řady léčivých přípravků, které jsou aplikovány jak v rámci předtransplantační přípravy, tak v potransplantačním období. Naprostá většina těchto přípravků je registrována v ČR a standardně hrazena ze zdravotního pojištění. Jedná se především o cytostatika, která tvoří nezbytnou a důležitou součást přípravného předtransplantačního režimu, jde nejčastěji o tyto léčivé přípravky: busulfan, cyklofosfamid, melfalan, fludarabin, cytosinarabinosid, etoposid, BCNU a další. Tato cytostatika mají významnou hematologickou i nehematologickou toxicitu, kterou je třeba řešit.
Neméně důležitá je též podpůrná terapie, která zahrnuje mimo jiné podávání antimikrobiální terapie (antibiotika, antivirotika, antimykotika), dále aplikaci granulocytárních růstových faktorů, antiemetik, analgetik, parenterální výživu a podání řady dalších léčivých přípravků.
Důležitou součástí terapie u alogenních HCT je také podávání imunosupresivních léčivých přípravků, které jsou užívány v profylaxi reakce štěpu proti hostiteli (cyklosporin A, metotrexát, mykofenolát-mofetil, anti-thymocytární globulin a další).
V některých speciálních případech je nutno použít i léčivé přípravky neregistrované v ČR, v takových případech je nutno požádat o úhradu revizního lékaře příslušné zdravotní pojišťovny. Jedná se například o tyto specifické situace: profylaxe pneumocystové pneumonie po HCT u pacientů alergických na trimetoprim+sulfametaxazol (Biseptol) – inhalační profylaxe pentamidinem (Pentacarinate); dále terapie venookluzivní nemoci defibrotidem a další.
2.9 Kategorie transplantačních indikací
Indikace k transplantační léčbě jsou rozděleny do čtyř základních kategorií. Jejich definice jsou následující [6, 7]:
1. Standardní indikace (standard of care; S) jde o indikace, u nichž je provedení transplantace krvetvorných buněk (HCT) standardním léčebným přístupem. Výsledky transplantační léčby jsou u těchto indikací obecně dobře doloženy (na základě klinických studií, obvykle randomizovaných) a jsou prokazatelně lepší ve srovnání s jinými léčebnými postupy. Kategorie standardní indikace však přesto neznamená, že HCT je pro konkrétního pacienta nezbytně optimální léčbou za všech okolností. Jiný léčebný postup je obvykle oprávněn v těchto případech:
- není nalezen vhodný dárce;
- existuje srovnatelná alternativní léčba;
- nemocný významně překračuje doporučený věkový limit (65–70 let);
- nemocný má jiné závažné onemocnění, které je kontraindikací provedení transplantační léčby;
- celkový klinický stav pacienta je natolik závažný, že neumožňuje provedení HCT;
- nemocný provedení HCT vědomě odmítá.
2. Individuální indikace – klinická možnost (clinical option; CO): jde o indikace, kdy lze předpokládat, že transplantační léčba má obecně přinejmenším stejné výsledky jako jiný léčebný postup na základě publikovaných klinických studií. U některých vzácných onemocnění jsou však počty pacientů nízké, a nelze proto provádět randomizované klinické studie. Provedení HCT je v těchto případech indikováno individuálně po důkladném zvážení rizik, ale i benefitů u konkrétního pacienta. Podle doporučení EBMT se hodnotí provedení HCT v této indikaci jako cenná terapeutická možnost pro individuálního pacienta [7]. Správné stanovení individuální indikace vyžaduje pečlivé posouzení a zvážení řady prognostických faktorů, dostupnosti dárce, zdroje krvetvorných buněk, typu přípravného režimu, přítomnosti komorbidit apod.
3. Vývojové indikace, transplantace podle klinického protokolu (developmental; D): jde o indikace, kdy za současného stavu poznání není možné jednoznačně definovat přínos a význam transplantační léčby ve srovnání s jinými léčebnými možnostmi. Tyto indikace jsou proto označovány jako vývojové a je třeba dalšího klinického výzkumu k přesnějšímu definování role HCT u těchto indikací. Tyto transplantace by měly být prováděny pouze v rámci klinických protokolů, které musí být schváleny lokální etickou komisí a musí odpovídat současným národním, případně mezinárodním standardům.
4. Transplantace není indikována, transplantace není všeobecně doporučována (generally not recommended, GNR): tato kategorie zahrnuje onemocnění či jejich fáze, kdy provedení HCT není indikováno, či není všeobecně doporučováno. Tato kategorie zahrnuje také časná stadia nemoci, kdy výsledky netransplantační, konvenční léčby neopravňují vystavit nemocného riziku transplantační mortality. Nebo situace, kdy nemoc je naopak tak pokročilá, že naděje na úspěšnost transplantace je do té míry malá, že riziko odběru krvetvorných buněk u zdravého dárce je těžko ospravedlnitelné. Samozřejmě je nutné předpokládat určitou formu překrývání se mezi kategoriemi vývojové a neindikované transplantace, probíhající klinické studie dále budou upřesňovat tyto indikační kategorie. Uvedená definice neplatí pro situace, kdy je dostupný syngenní dárce.
Definitivní rozhodnutí o provedení či neprovedení HCT u konkrétního pacienta v ČR spadá plně do kompetence jednotlivých center vysoce specializované hematoonkologické péče (HOC), respektive transplantačních hematoonkologických center, kterých je v současné době (rok 2016) v ČR deset. Pouze v těchto specializovaných centrech jsou také transplantace krvetvorných buněk standardně prováděny.
3 VLASTNÍ INDIKACE K TRANSPLANTACÍM KRVETVORNÝCH BUNĚK – PŘEHLED
Nejčastější současné indikace k autologním a alogenním transplantacím krvetvorných buněk v ČR v roce 2016 pro nádorová i nenádorová hematologická onemocnění, solidní tumory a autoimunitní nemoci u dospělých i dětí jsou shrnuty v tabulkách 1-5. Tato doporučení vycházejí ze současné praxe evropských transplantačních center včetně ČR, založené na dosavadních výsledcích klinických studií týkajících se transplantací krvetvorných buněk [7].
Tab. 1. Indikace k transplantacím krvetvorných buněk u dospělých – leukemie, myeloproliferativní onemocnění a myelodysplastický syndrom 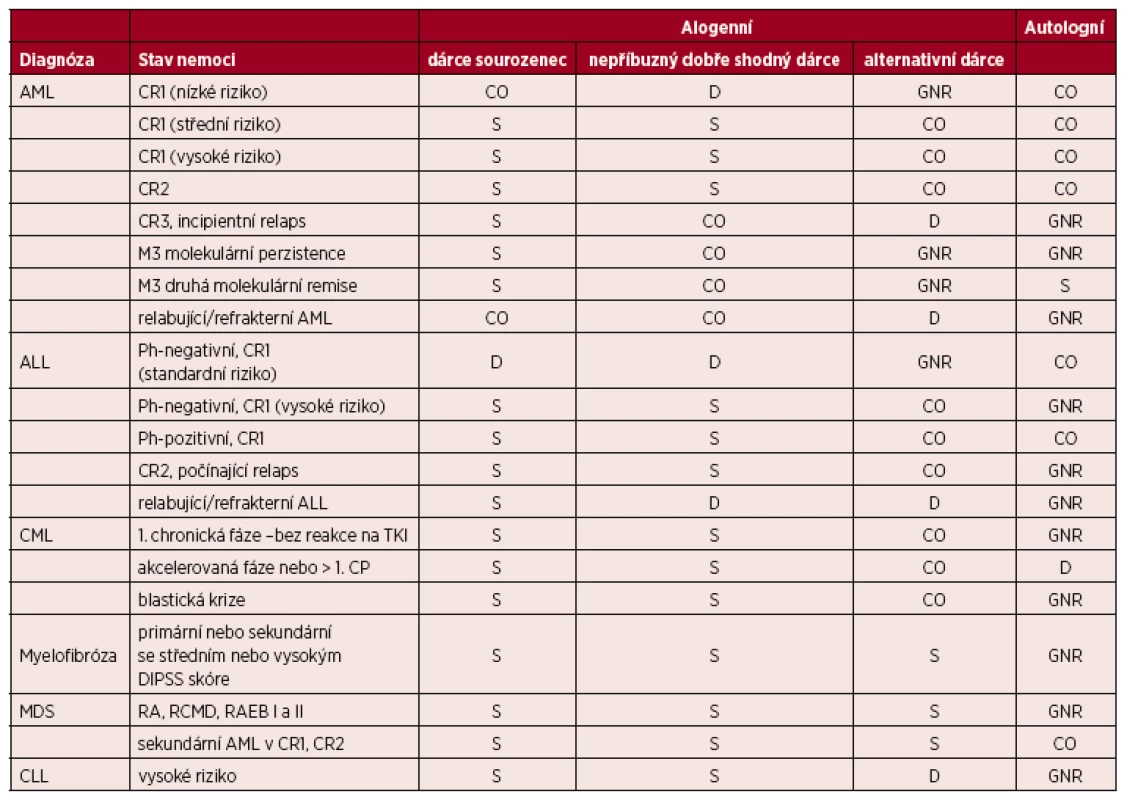
(Upraveno podle [7].) Vysvětlivky a zkratky: S – standardní indikace transplantace; CO– individuální indikace transplantace, klinická možnost; D – transplantace v rámci klinického protokolu, vývojové indikace; GNR – transplantace není indikována či není všeobecně doporučována; Nepříbuzný dobře shodný dárce – dárce 10/10, 8/8 nebo 9/10 (pokud je neshoda v DQB1); Alternativní dárce: nepříbuzný dárce s 1 a více neshodami, haploidentický dárce, dárce pupečníkové krve; AML – akutní myeloidní leukemie, ALL – akutní lymfoblastická leukemie, CML – chronická myeloidní leukemie, MDS – myelodysplastický syndrom, RA – refrakterní anémie, RCMD – refakterní cytopenie s multilineární dysplazií, RAEB – refrakterní anémie s excesem blastů, DIPSS – dynamický mezinárodní prognostický skórovací systém; CLL – chronická lymfocytární leukemie; Ph – chromosom Philadelphia: přítomnost translokace t(9;22); CR 1,2,3 – kompletní remise 1., 2., 3.; TKI – tyrozinkinázové inhibitory; Kategorie nízké, střední, vysoké riziko u akutních leukemií – založené především na počtu leukocytů, cytogenetice a molekulárních markerech přítomných při diagnóze nemoci, dále na době do dosažení remise a dále na vývoji minimální reziduální nemoci (MRN) Tab. 2. Indikace k transplantacím krvetvorných buněk u dospělých – lymfoidní malignity a mnohočetný myelom 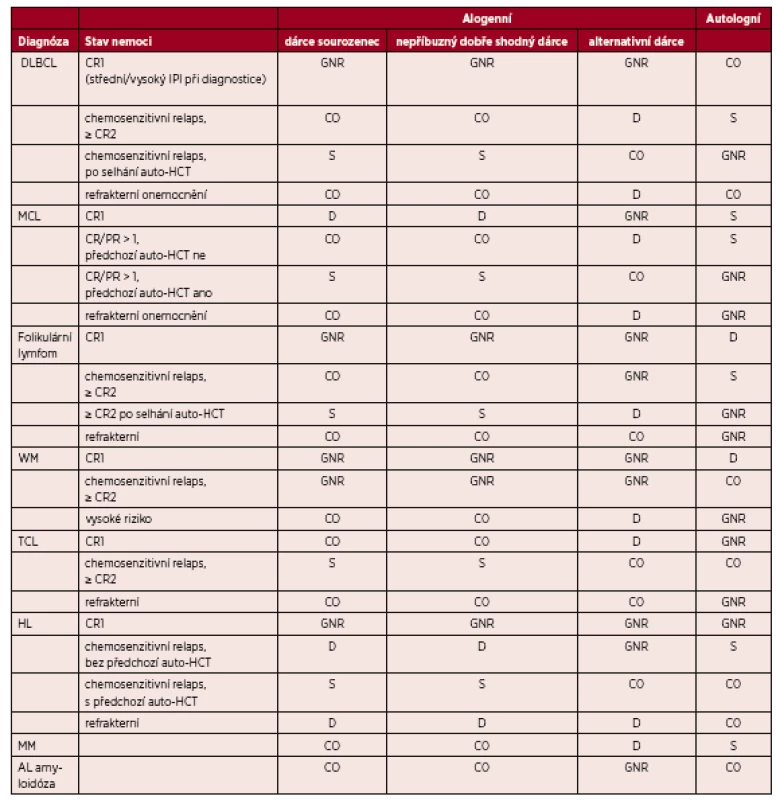
(Upraveno podle [7].) Vysvětlivky a zkratky: S – standardní indikace transplantace; CO – individuální indikace transplantace, klinická možnost; D – transplantace v rámci klinického protokolu, vývojové indikace; GNR – transplantace není indikována či není všeobecně doporučována; Nepříbuzný dobře shodný dárce – dárce 10/10, 8/8 nebo 9/10 (pokud je neshoda v DQB1); Alternativní dárce – nepříbuzný dárce s 1 a více neshodami, haploidentický dárce, dárce pupečníkové krve; DLBCL – difúzní velkobuněčný B-lymfom; MCL – lymfom z plášťových buněk; WM – Waldenströmova makroglobulinemie; TCL – T-buněčný lymfom; HL – Hodgkinův lymfom; MM – mnohočetný myelom,AL-amyloidóza – amyloidóza z lehkých řetězců; CR 1,2 – kompletní remise 1. nebo 2.; PR – parciální remise; IPI – mezinárodní prognostický index. Tab. 3. Indikace k transplantacím krvetvorných buněk u dospělých – ostatní onemocnění 
(Upraveno podle [7].) Vysvětlivky a zkratky: S – standardní indikace transplantace; CO – individuální indikace transplantace, klinická možnost; D – transplantace v rámci klinického protokolu, vývojové indikace; GNR – transplantace není indikována či není všeobecně doporučována; Nepříbuzný dobře shodný dárce – dárce 10/10, 8/8 nebo 9/10 (pokud je neshoda v DQB1); Alternativní dárce – nepříbuzný dárce s 1 a více neshodami, haploidentický dárce, dárce pupečníkové krve; SAA – těžká aplastická anémie, AA – aplastická anémie, PNH – paroxysmální noční hemoglobinurie Tab. 4. Indikace k transplantacím krvetvorných buněk u dětí – hematologické malignity 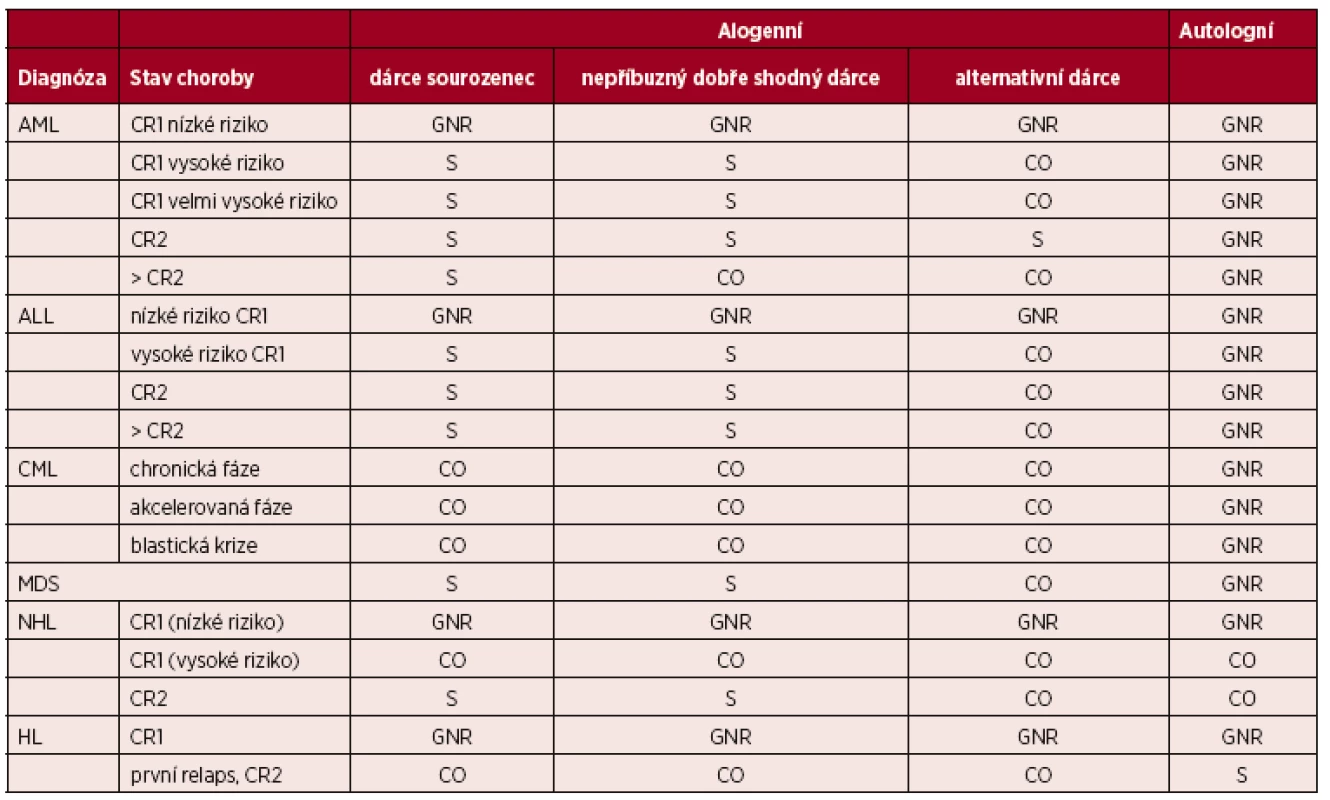
(Upraveno podle [7].) Vysvětlivky a zkratky: S – standardní indikace transplantace; CO – individuální indikace transplantace, klinická možnost; D – transplantace v rámci klinického protokolu, vývojové indikace; GNR – transplantace není indikována či není všeobecně doporučována; Nepříbuzný dobře shodný dárce – dárce 10/10, 8/8 nebo 9/10; Alternativní dárce – nepříbuzný dárce s 1 a více neshodami, haploidentický dárce, dárce pupečníkové krve; AML – akutní myeloidní leukemie, ALL – akutní lymfoblastická leukemie, CML – chronická myeloidní leukemie, NHL – nehodgkinské lymfomy, HL – Hodgkinův lymfom; CR – kompletní remise. Tab. 5. Indikace k transplantacím krvetvorných buněk u dětí – vybraná nemaligní onemocnění a solidní tumory 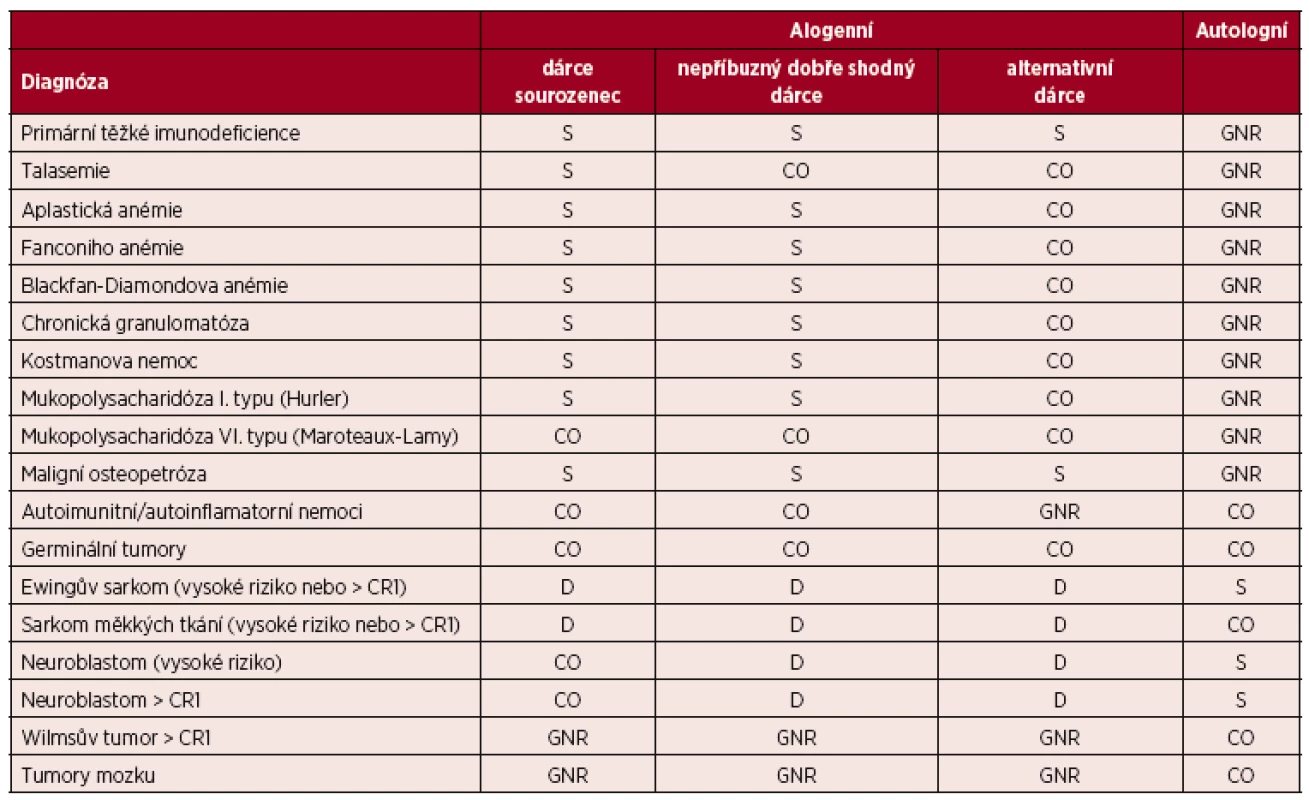
(Upraveno podle [7].) Vysvětlivky a zkratky: S– standardní indikace transplantace; CO – individuální indikace transplantace, klinická možnost; D – transplantace v rámci klinického protokolu, vývojové indikace; GNR – transplantace není indikována či není všeobecně doporučována; Nepříbuzný dobře shodný dárce – dárce 10/10, 8/8 nebo 9/10; Alternativní dárce – nepříbuzný dárce s 1 a více neshodami, haploidentický dárce, dárce pupečníkové krve 3.1 Akutní myeloidní leukemie (AML)
Transplantace nemocných s AML v první kompletní remisi (1. CR) i nadále zůstává u části pacientů poněkud kontroverzním a diskutabilním výkonem. Důvodem je to, že určité procento pacientů s AML může být vyléčitelné samotnou chemoterapií, jedná se obvykle o AML pacienty s nízkým rizikem AML, respektive příznivou prognózou na základě cytogenetických a molekulárně-biologických znaků [29]. U každého jednotlivého pacienta však nelze spolehlivě předpovědět, zda u něho dojde k relapsu choroby či nikoliv, proto jsme odkázáni na statistickou pravděpodobnost podle rizikovosti podtypu AML. Rozeznáváme AML s příznivou, střední a nepříznivou prognózou podle šance na vyléčení samotnou chemoterapií. Jednotlivé podtypy jsou definovány přítomností či absencí příznivé cytogenetické nebo molekulárně-genetické aberace, anebo naopak nepříznivé cytogenetické či molekulárně-genetické aberace. Důležitá pro stanovení prognózy je také odpověď na indukční léčbu a některé další parametry. Samostatnou jednotku tvoří AML-M3, u které je šance na vyléčení chemoterapií nejvyšší.
Mezi AML s příznivou prognózou řadíme nemocné s AML s translokací t(8;21) bez vstupní hyperleukocytózy, dále AML s přítomností inverze inv(16) nebo s translokací t(16;16), dále pacienty s mono - či bialelickou mutací CEBPA a pacienty s mutací NPM1 při negativitě FLT3-ITD. U všech těchto pacientů se dříve nedoporučovalo provedení transplantace v 1. CR pro relativně dobré výsledky léčby samotnou chemoterapií. V současné době, na základě několika randomizovaných studií, se ukazuje, že provedením konsolidace transplantací buď autologní, štěpem bez přítomnosti reziduální nemoci, či transplantací od HLA shodného sourozence lze docílit snížení rizika relapsu a i určité zlepšení celkového přežití pacientů transplantovaných ve srovnání s pacienty, kteří transplantováni nebyli (30, 31). Uspokojivého léčebného efektu lze však docílit i samotnou chemoterapií, proto je zatím indikace k transplantaci ponechána na individuálním posouzení, její provedení od HLA shodného dárce pravděpodobně není chybným výkonem. Většinou se však spíše transplantace odkládá až do doby po relapsu AML. Pacienty, kteří docílí hematologické, ale ne molekulárně-genetické remise, indikujeme k alogenní transplantaci, a to i od alternativního dárce. Při indikaci autologní transplantace je třeba vzít v úvahu, že v případě relapsu po autologní transplantaci nebude pravděpodobně možné před eventuální následnou alogenní transplantací použít myeloablativní přípravný režim z důvodu zvýšeného rizika toxicity, takže výkon je vhodné indikovat spíše u nemocných, u nichž alogenní HCT neplánujeme, např. z důvodu vyššího věku, komorbidit či z důvodu absence HLA shodného dárce.
AML s nepříznivou prognózou mají podle současných kritérií pacienti, kteří nedocílí kompletní remise po jedné indukční léčbě, či kteří ji docílí za více než 40 dní od diagnózy, dále AML s M5 či M6 FAB podtypem, pacienti s rizikovou cytogenetikou – nepříznivým karyotypem (sem patří například přítomnost komplexního karyotypu, monozomie 7, inverze inv(3), některé typy translokací (t(6;11), t(6;9), t(11;19)), a rovněž pacienti s genovou mutací FLT3-ITD či MLL přestavbou [7, 32]. Splňují-li věkové kritérium pro alogenní HCT a mají-li příznivý komorbiditní index, mají být standardně alogenně transplantováni po docílení 1. CR, a to i od alternativního dárce, nepodaří-li se vyhledat dárce plně shodného. Není-li pacient vhodný pro alogenní transplantaci, můžeme indikovat i transplantaci autologní.
K pacientům se středně rizikovou AML, kam řadíme pacienty nesplňující kritéria pro zařazení do výše uvedených dvou rizikových podtypů, přistupujeme podobně jako k pacientům s prognosticky nepříznivou AML. Jsou standardními kandidáty pro provedení transplantace v 1. CR od HLA shodného dárce (sourozence i nepříbuzného) i transplantace autologní. Autologní transplantaci preferujeme u nemocných, kteří z nějakého důvodu nemohou podstoupit transplantaci alogenní a u kterých je získatelný štěp bez pozitivity minimální reziduální nemoci (MRN) [33]. Transplantace od alternativních dárců může být indikována na základě individuálního rozhodnutí a vždy u pacientů s narůstající pozitivitou MRN či přetrváváním MRN.
Pacienti s akutní promyelocytární leukemií (APL) se v 1. CR netransplantují. Jsou kandidáty pro provedení alogenní transplantace v 1. CR jen v případě nedocílení molekulárně-genetické remise. Pacienti s APL po léčbě relapsu profitují z autologní transplantace v 2. remisi v případě, že se podaří chemoterapií navodit molekulárně-genetickou remisi, a získat tak štěp bez přítomnosti reziduálních leukemických buněk [7, 34]. Pacienti s APL ve 3. a další remisi, případně v relapsu po autologní HCT mohou profitovat z alogenní HCT.
K alogenní HCT jsou dále indikováni všichni nemocní v druhé nebo třetí remisi AML, jakož i v počínajícím relapsu AML, a to včetně transplantace od alternativních dárců. Transplantace po RIC přípravných režimech jsou indikované u starších nemocných nebo u nemocných, u kterých celkový stav či předchozí transplantace nedovoluje plnou transplantační přípravu.
3.2 Akutní lymfoblastická leukemie (ALL)
Názory na provedení transplantace u dospělých pacientů s ALL v 1. CR jsou provázeny stejnými pochybnostmi, jako je tomu u AML. Indikace se liší podle rizikovosti onemocnění, tedy podle vyléčitelnosti samotnou chemoterapií. Se zavedením intenzivnějších protokolů do léčby ALL se zlepšily výsledky léčby projevující se zvýšením proporce pacientů vyléčených chemoterapií, toto zlepšení je pozorovatelné zejména u mladších pacientů do věku cca 35 let. Věk zde představuje důležitý prognostický faktor a pacienti starší 35 let jsou automaticky řazeni do skupiny s vyšším rizikem relapsu po samotné chemoterapii [7]. Dalším z rizikových faktorů, predikujících riziko relapsu, je odpověď na indukční léčbu, kdy oddálené dosažení remise či nedocílení remise indukční léčbou je významný nepříznivý prognostický faktor. Na základě výsledků léčby z několika velkých randomizovaných studií byly definovány faktory pro vyléčitelnost ALL chemoterapií. Jako zásadní se ukázaly být: věk, dynamika odpovědi na indukční léčbu, imunofenotyp, počet leukocytů v době diagnózy a přítomnost některých cytogenetických aberací. Rozeznáváme tak ALL se standardní prognózou, která je relativně dobře vyléčitelná chemoterapií a ALL s nepříznivou prognózou, jejíž vyléčitelnost chemoterapií je nízká.
Za prognosticky nepříznivou podle současných kritérií pokládáme ALL s přítomností jednoho z následujících parametrů:
- věk nad 50–55 let,
- nepříznivá cytogenetika (přítomnost některých z těchto translokací: t(9;22) nebo t(4;11), dále přestavba MLL genu, monozomie 7 a další cytogenetické změny),
- leukocytóza nad 30 tisíc u B-prekurzorové ALL a nad 100 tisíc u T-prekurzorové ALL,
- docílení kompletní remise za déle než 6 týdnů.
Za rizikový fenotyp se pokládá pro-B ALL (B-lin, CD-10neg), dále časný pro-T či pre-T fenotyp ALL (T-lin, CD1aneg,sCD3neg) nebo T-ALL se zralým fenotypem (T-lin, CD1aneg, sCD3posit). Za nejrizikovější se pokládá Ph+ ALL (přítomnost chromozomu Philadelphia, tedy translokace t(9;22)), která je chemoterapií pravděpodobně nevyléčitelná, i když zlepšení prognózy je pozorováno po zavedení TKI do léčby této leukemie. Pacienti s rizikovým podtypem ALL jsou standardně indikováni k alogenní transplantaci již v 1. CR, a to i od alternativních dárců. Autologní transplantace se u nich nedoporučuje s výjimkou transplantací u pacientů s Ph+ ALL v 1. CR, u nichž lze autologní HCT docílit tříleté přežití bez relapsu u více než 50 % pacientů, pokud je transplantace udělána v době negativity MRN štěpem bez přítomnosti choroby, a pokud byl v léčbě použit některý tyrozinkinázový inhibitor [35]. Takovou transplantaci můžeme tedy standardně indikovat u nemocných, u nichž alogenní HCT neplánujeme, např. z důvodu vyššího věku či komorbidit, či z důvodu absence HLA shodného dárce.
ALL nesplňující kritéria pro prognosticky nepříznivý podtyp ALL je řazena do skupiny se standardní prognózou (SP). Zatímco podle dřívějších doporučení se u pacientů s ALL se standardní prognózou alogenní transplantace v 1. CR nedoporučovala, nyní jsou k dispozici data ukazující, že provedení alogenní transplantace i u pacientů mladších 35 let snižuje riziko relapsu a zlepšuje přežití ve srovnání s pacienty netransplantovanými cca o 10 % [36]. Jsou k dispozici i data ukazující, že autologní HCT u pacientů starších 55 let může vést k lepšímu celkovému přežití než u pacientů po RIC alo-HCT (7). Podle současných doporučení není tedy chybou u pacientů se standardně rizikovým podtypem ALL provedení alogenní HCT v 1. CR od HLA shodného dárce, není však ani chybou transplantaci odložit až na dobu po relapsu, a to zejména u pacientů mladších 35 let. Máme-li možnost sledovat MRN, je možné se řídit kinetikou tohoto ukazatele a transplantaci indikovat v případě přetrvávání či nárůstu MRN. Můžeme indikovat i autologní HCT jako součást konsolidační léčby, a zkrátit tak dobu intenzivní chemoterapie. Při indikaci autologní HCT je třeba vzít v úvahu, že v případě relapsu po autologní HCT nebude pravděpodobně možné před eventuální následnou alogenní HCT použít myeloablativní přípravný režim z důvodu zvýšeného rizika toxicity, takže výkon je vhodné indikovat spíše u nemocných, u nichž alogenní HCT neplánujeme, např. z důvodu vyššího věku, komorbidit či z důvodu absence HLA shodného dárce.
Nedocílení molekulárně-genetické remise nás opravňuje indikovat alogenní transplantaci i od dárců alternativních. Nemocní s ALL v druhé a další kompletní remisi naplňují standardní kritérium pro provedení alo-HCT, a to včetně transplantace od alternativního dárce. U nemocných v 2. CR můžeme individuálně indikovat i transplantaci autologní se všemi výše uvedenými omezeními. U pacientů, kteří nejsou v remisi, můžeme rovněž individuálně indikovat alogenní transplantaci, a to včetně HCT od alternativních dárců. U těchto nemocných není indikace pro transplantaci autologní.
3.3 Chronická myeloidní leukemie (CML)
I přes zavedení inhibitorů tyrozinové kinázy (TKI) do léčby CML, zůstává alo-HCT jedinou kurativní léčbou této nemoci. Přes zlepšující se výsledky alo-HCT u CML je však transplantační léčba indikována v chronické fázi CML až po selhání jedné nebo častěji dvou linií léčby TKI [37, 38]. Při rozhodování o léčebném postupu je nezbytné se řídit vstupním rizikem CML a EBMT rizikovým skóre (Gratwohlovým skóre), které identifikuje nemocné s vysokým rizikem transplantační mortality [26, 37, 39]. Nemocní s vysoce rizikovou CML a současně nízkým EBMT rizikovým skóre mohou profitovat z časné transplantace. V případě selhání imatinibu v první linii lze identifikovat pacienty s nízkou pravděpodobností odpovědi na druhou linii TKI pomocí Hammersmith skóre [40]. Tito pacienti mohou profitovat z časně provedené alo-HCT ve druhé linii léčby. U nemocných s přidruženými chorobami nedovolujícími standardní transplantační přípravu je indikována RIC transplantace. RIC transplantace by však neměla být indikována mimo chronickou fázi nemoci. Nemocní v akcelerované fázi a blastické krizi by měli podstoupit transplantaci se standardní přípravou, pokud možno po dosažení druhé chronické fáze pomocí TKI podaných samostatně (v případě akcelerace) nebo v kombinaci s chemoterapií (v případě blastického zvratu). V situaci, kdy nemocní v akcelerované fázi dosáhnou po TKI optimální léčebnou odpověď, nemusí být aloSCT indikována [37]. Použití TKI před alo-HCT podle dostupných studií neovlivňuje negativně výsledek transplantace [41]. Auto-HCT není v současnosti u nemocných s CML indikována.
3.4 Myeloproliferativní choroby jiné než CML
Alo-HCT je v současnosti jedinou kurativní léčbou myeloproliferativních chorob (MPN) a je indikována zejména u nemocných s primární myelofibrózou. I u této diagnózy se však indikace transplantace opírá o prognostické škály, zejména dynamický mezinárodní prognostický index (DIPSS), eventuálně rozšířený o parametry nepříznivého karyotypu, trombocytopenie a transfuzní závislosti (DIPSS plus) [42, 43]. Nemocní s vyšším středním (intermediate-2 risk) a vysokým rizikem (high risk) mají významně kratší přežití a alo-HCT u nich představuje standardní léčebný přístup [7]. Alo-HCT není indikována u esenciální trombocytémie nebo pravé polycytemie, pokud nedošlo k leukemické transformaci onemocnění nebo rozvoji sekundární myelofibrózy. Zkušenosti se vzácnějšími typy myeloproliferací a stavy stojícími na rozhraní myelodysplastického syndromu (MDS) a MPN neumožňují stanovit všeobecná doporučení a alo-HCT by měla být u těchto nemocných zvažována individuálně [44]. Auto-HCT nejsou v léčbě MPN indikovány.
3.5 Myelodysplastický syndrom (MDS)
Alogenní transplantace krvetvorných buněk (alo-HCT) je jediným postupem umožňujícím kompletní vyléčení nemocných s MDS, ale je spojena jednak s relativně vysokou morbiditou a mortalitou, která je mimo jiné ovlivněna i vysokou incidencí onemocnění ve vyšších věkových skupinách, jednak i relativně vysokou incidencí relapsu po HCT. Terapeutický postup u jednotlivých pacientů se odvíjí od charakteru onemocnění spolu s biologickým stavem pacienta. Zároveň však platí, že HCT provedená včasně po stanovení diagnózy má pozitivní vliv na celkovou délku přežití, na čemž se významně podílí nižší procento úmrtí mimo relaps choroby (non-relapse mortality, NRM). Aktuální indikace k HCT u MDS vychází z Mezinárodního prognostického systému (IPSS), respektive z jeho recentně revidované formy (IPSS-R) [45]. Přínos autologní HCT nebyl u MDS prokázán.
Nemocní s méně pokročilými formami MDS
Většina pacientů s nízkým či středním-1 rizikem podle IPPS, respektive velmi nízkým či nízkým rizikem podle IPSS-R profituje z konzervativního léčebného přístupu a odložení transplantace do doby iniciální progrese onemocnění, kdy je ovšem nutno indikovat HCT bezprostředně tak, aby nedošlo k leukemické transformaci choroby.
K neodkladné HCT jsou ve skupině nemocných s méně pokročilými formami choroby indikováni:
- nemocní s těžkou cytopenií vedoucí k významné závislosti na transfuzích erytrocytů či trombocytů, respektive s opakovanými závažnými infekčními a krvácivými komplikacemi;
- nemocní s hypoplastickou formou MDS či s přítomností významného stupně fibrózy ve dřeni;
- nemocní se středním-1 rizikem (podle IPSS) s > 5 % blastů ve dřeni či s prognosticky nepříznivými změnami karyotypu a zejména mladší nemocní se středním rizikem podle IPSS-R;
- nemocní se sekundárním (therapy-related) MDS.
Přítomnost dalších rizikových faktorů, zejména mutací některých genů, které mají zásadní význam pro reparaci poškození buňky a regulaci proliferace a diferenciace, ve vztahu k indikaci HCT u časných forem MDS, je v současné době předmětem rozsáhlých studií.
Nemocní s pokročilými formami MDS
Nemocní se středním-2 a vysokým rizikem podle IPSS, nemocní s vysokým a velmi vysokým rizikem podle IPSS-R jsou k alogenní transplantaci indikování všichni, kteří jsou schopni podstoupit tuto léčbu. Rozhodující je zejména klinický stav nemocného daný počtem, typem a závažností komorbidit. Jednoznačná věková hranice není určena [46–48].
Výběr štěpu
V obou skupinách je legitimní použití jak shodného příbuzného i nepříbuzného dárce, tak alternativních zdrojů štěpu. Při výběru štěpu se ukazuje výhodou použití periferních kmenových buněk oproti kostní dřeni, jež s sebou nese sice vyšší incidenci chronické GvHD, ale zároveň nižší frekvenci relapsů. U hypoplastické formy MDS bývá upřednostňováno použití štěpu kostní dřeně obdobně jako u aplastické anémie.
Volba přípravného režimu
Dosud publikované studie neprokázaly zásadní rozdíly mezi výsledky HCT při použití myeloablativních nebo redukovaných přípravných režimů. U myeloablativních režimů je přítomna vyšší mortalita spojená s výkonem (NRM), u režimů s redukovanou intenzitou je naopak vyšší incidence potransplantačních relapsů. Rozdíl mezi užitím jednotlivých myeloablativních režimů nebyl u MDS jednoznačně prokázán, u redukovaných režimů se ukazuje závislost na intenzitě redukce režimu. Aktuálně platí, že je výhodné použít myeloablativní režim v případě, že tomu nebrání vyšší věk nebo komorbidity. Možnost užití redukovaného přípravného režimu u nemocných s nízkým rizikem s těžkou cytopenií a s cytopenií bez nepříznivých cytogenetických změn zatím nebyla ověřena [23, 49].
Předtransplantační léčba
Přestože je zřejmé, že nemocní vstupující do transplantace s menší nádorovou náloží přežívají déle vzhledem k nižší incidenci relapsu, není dosud jednotný názor, kdy a jakou předtransplantační léčbu nemocným s MDS poskytnout. Dosažení remise choroby indukční chemoterapií před HCT má podle řady studií příznivý efekt na délku přežití, ale kombinovaná chemoterapie může významně zvýšit toxicitu léčby a díky vznikajícím komplikacím oddálit provedení HCT. Možností je zvolit sekvenční postup indukční chemoterapie a následné transplantace u nemocných s MDS > 10 % blastů. U nemocných s 5–10 % blastů ve dřeni je možno zvážit intenzifikaci přípravného režimu před HCT. Na indikaci konsolidační terapie a na počet cyklů konsolidační léčby před HCT není u MDS jednotný názor. Podání hypometylačních látek namísto kombinované chemoterapie před zahájením přípravného režimu může vést ke snížení tumorové nálože u respondentů, zabezpečení období vyhledávání dárce a přípravy transplantace a v neposlední řadě k imunomodulaci zvyšující „graft versus MDS“ efekt. Užití těchto látek v přípravných režimech, stejně tak jako jejich podávání v udržovací terapii po HCT je předmětem současných studií [50, 51].
3.6 Chronická lymfatická leukemie (CLL)
Alogenní transplantace krvetvorných buněk od HLA identického sourozence nebo HLA shodného nepříbuzného dárce je v současné době jediným doloženým kurativním postupem v případě CLL, a to zejména v případě rizikových CLL, kde standardní léčba dlouhodobě selhává a kde naopak alo-HCT může navodit díky reakci štěpu proti CLL dlouhodobou kontrolu nemoci [52–54].
Jako rizikovou CLL s indikací k alo-HCT lze označit následující situace:
- CLL refrakterní nebo časně relabující (< 12 měsíců) po léčbě purinovými analogy;
- časný relaps CLL < 24 měsíců po kombinované léčbě obsahující purinová analoga, CLL s průkazem del17p/mutace p53 vyžadující léčbu.
Uvedená fakta jsou doložena řadou publikovaných registrových dat a studií II. klinické fáze [55]. Vzhledem k literárně dokládané nižší léčebné mortalitě by měl být preferovaným přípravným předtransplantačním režimem některý z redukovaných přípravných režimů před režimy myeloablativními [52, 53, 56]. Na základě publikovaných dat a vzhledem k obecnému zlepšení transplantačních postupů lze v individuálních případech zvažovat i provedení alo-HCT od alternativního dárce [57].
Nadějná efektivita nově zavedených léků (BCR-
-inhibitory, do budoucna inhibitory bcl2 atd.), a to i v případě prognosticky rizikové CLL, jejíž prognóza je při standardní léčbě nepříznivá, přináší alternativu k provedení alo-HCT, a to především u pacientů s vyššími riziky transplantační mortality (HCT-CI, EBMT skóre atd.). Nicméně zhodnocení role nově zaváděných léků do léčby CLL vyžaduje delší dobu sledování výsledků dosud publikovaných souborů pacientů a další informace v podobě publikací aktuálně probíhajících klinických studií, a to i vzhledem k dosud popisované vysoce nepříznivé prognóze nemocných s CLL, u nichž léčba novými léky selhává [57–60].Autologní transplantace krvetvorných buněk nezlepšila v rámci randomizovaných klinických studií přežití pacientů s CLL a není v současné době obecně v léčbě CLL indikována [61–63]. Individuálně lze její indikaci zvažovat ve specifických případech (Richterův syndrom).
3.7 Hodgkinův lymfom (HL)
V první linii léčby HL nejsou transplantace indikovány. Standardem léčby relabujících nebo refrakterních HL je záchranná chemoterapie následovaná v případě chemosenzitivity auto-HCT [64]. U nemocných s kritickými rizikovými faktory a/nebo v případě přetrvávající PET pozitivity po záchranné chemoterapii je ke zvážení intenzifikace léčby použitím tandemové auto-HCT [65]. Samotná alo-HCT je standardní indikací pro chemosenzitivní relapsy HL po auto-HCT [66]. Nemocní s refrakterním onemocněním mohou podstoupit auto-HCT po individuální indikaci nebo mohou být zařazeni do alo-HCT protokolu.
3.8 Nehodgkinské lymfomy (NHL)
Difuzní velkobuněčný B lymfom (DLBCL): auto-HCT je standardní indikací u chemosenzitivního relapsu onemocnění [67, 68]. Použití auto-HCT v 1. linii léčby je indikováno při nedosažení kompletní remise léčbou 1. linie, neboť to je považováno za selhání léčby. Přestože auto-HCT není standardně doporučována v první linii, lze ji zvážit z individuální indikace v situaci vysoce rizikového onemocnění [69, 70]. V případě relapsu po auto-HCT, prokázané chemosenzitivitě onemocnění k záchranné terapii a únosnosti pacienta je indikována alo-HCT (71). U refrakterních nemocných je ke zvážení individuální indikace k auto - nebo alo-HCT.
Folikulární lymfom (FL): auto-HCT je standardní indikací u relapsu FL v závislosti na rozsahu relapsu, jeho časnosti, předchozí léčby a dalších faktorů [72]. Alo-HCT je nutné zvážit v případě relapsu po auto-HSCT v závislosti na rizikových faktorech, v individuálních případech (vysoce rizikové onemocnění) je možné alo-HCT indikovat bez předchozí auto-HCT [73].
Lymfom z plášťových buněk (MCL): vzhledem k nepříznivé prognóze tohoto lymfomu, je konsolidace 1. linie léčby pomocí auto-HCT standardní indikací a v individuálních indikacích lze zvážit alo-HCT [74]. U časného chemosenzitivního relapsu stejně jako v případě pozdního relapsu onemocnění po auto-HCT je indikována alo-HCT (75), v případě pozdního relapsu je k individuálnímu zvážení druhá auto-HCT.
Periferní T buněčné lymfomy (PTCL): s ohledem na neuspokojivé výsledky standardní léčby PTCL je vhodné zvážit auto-HCT již v první linii léčby, v závislosti na histologickém typu onemocnění, odpovědi na léčbu a dalších rizikových faktorech [76, 77]. Alo-HCT je standardně indikována v léčbě 1. linie v případě histologicky extrémně nepříznivých diagnóz (např. hepatosplenický gamma-delta T-lymfom). U nemocných s relapsem PTCL je standardně indikována auto-HCT nebo alo-HCT v závislosti na předchozí léčbě, rozsahu relapsu a odpovědi na záchrannou terapii [78].
Vzácnější typy lymfomů: nemocní s kožními T-lymfomy – mycosis fungoides a Sezaryho syndromem mohou být v případě pokročilé prognosticky nepříznivé nemoci (IIB až IV stadium) indikováni k alo-HCT [79]. Nemocní s Waldenströmovou makroglobulinemií mohou být indikováni individuálně k auto-HCT v případě chemosenzitivního relapsu, u mladších nemocných s prognosticky nepříznivou formou nemoci (časná progrese, nepříznivé cytogenetické změny) je indikováno zvážení alo-HCT [80, 81]. Nemocní s lymfoblastovým lymfomem (LL) a vysokým rizikem, nedostatečnou odpovědí na léčbu či přítomností minimální reziduální nemoci nebo v relapsu jsou kandidáti k alo-HCT. Auto-HCT má u LL omezenou roli a může být zvážena u nemocných v relapsu zejména s uzlinovým postižením [82].
3.9 Mnohočetný myelom (MM)
Autologní transplantace periferních kmenových buněk je nadále považována za dosud nejúčinnější léčebnou metodu u všech vhodných nemocných s nově diagnostikovaným MM, provedení auto-HCT u MM patří mezi standardní indikace [7]. Nejvíce účinným postupem v současnosti (z hlediska četnosti kompletních remisí, prodloužení doby do progrese a prodloužení celkového přežití) je kombinace zahrnující 1–2 nové léky (inhibitory proteasomu a imunomodulační léky) v indukční fázi a poté provedení 1–2 autologních transplantací krvetvorných buněk [83]. Vysokodávkovaná chemoterapie s auto-HCT by měla být součástí primární léčebné strategie u vhodných pacientů s nově diagnostikovaným MM do věku 70 let či vhodného biologického věku. Optimálním přípravným režimem je melfalan v dávce 200 mg/m2. Opakovaná (tandemová) autologní transplantace může být použita jako konsolidace u všech nemocných s MM, kteří nedosáhli maximální léčebné odpovědi po první auto-HCT [83]. Vysokodávkovaná chemoterapie u pacientů s těžkým poškozením ledvin (clearence pod 50 ml/min) vyžaduje vždy redukci dávky melfalanu, obvykle na 100–140 mg/m2. Auto-HCT lze efektivně využít také jako součást léčby relapsu/progrese MM [84].
Provedení alo-HCT u MM lze individuálně indikovat u nemocných s relabujícím onemocněním, u kterých je však účinné i opakování auto-HCT. Za možnou individuální indikaci k provedení alo-HCT lze považovat první chemosenzitivní relaps MM u vysoce rizikových nemocných s časnou progresí (do 12 měsíců) po vstupní léčbě.
Speciální přístup vyžaduje AL amyloidóza. Pro vybrané nemocné s AL amyloidózou s nevelkým poškozením organismu amyloidem a dobrou srdeční funkcí lze individuálně indikovat provedení auto-HCT. V řadě případů vyžaduje klinický stav redukci dávky přípravného režimu [85].
3.10 Získaná těžká aplastická anémie (SAA)
Nově diagnostikovaná SAA: alo-HCT s HLA identickým sourozencem je standardní indikací u nemocných s nově diagnostikovanou SAA ve věku do 50 let [86, 87]. Nicméně ve věkové kategorii 40–50 let je nutné pečlivě zhodnotit celkový stav pacienta se stanovením rizika transplantační morbidity a mortality a podle toho zvážit případný benefit netransplantační léčby, tedy imunosuprese v první linii, oproti alo-HCT. Transplantace se shodným nepříbuzným dárcem je standardní indikací u nemocných < 40 let, je-li tento rychle k dispozici [88]. U pacientů ve věku 40–50 let je transplantace se shodným nepříbuzným dárcem možná v rámci klinického protokolu. Totéž platí i o transplantaci s alternativním dárcem (haploidentický, pupečníková krev, neshodný nepříbuzný) [89, 90]. U pacientů > 50 let je standardní léčbou 1. linie kombinovaná imunosuprese (ATG +CSA) [86].
Relabující/refrakterní SAA: Transplantace s HLA-identickým sourozencem či shodným nepříbuzným dárcem je zde standardní indikací, a to podle zvyklých věkových omezení pro HCT. Transplantace s alternativním dárcem je individuální indikací při nedostupnosti HLA--identického či shodného nepříbuzného dárce [86, 91].
Preferovaným zdrojem krvetvorných buněk je u SAA vždy kostní dřeň a všichni pacienti by v rámci předtransplantační přípravy měli dostat ATG [92]. U pacientů < 30 let preferujeme jako přípravný režim cyklofosfamid v dávce 200 mg/kg, u pacientů > 30 let pak nižší dávky cyklosfosfamidu (120 mg/kg) s fludarabinem [88]. Před transplantací s alternativním dárcem je vhodné stanovit donor-specifické protilátky, a vyhnout se tak dárcům, proti nimž má příjemce protilátky.
3.11 Solidní nádory
Přínos transplantace v léčbě solidních nádorů zůstává obtížně zhodnotitelný. S přihlédnutím k dostupným datům lze pokládat za odůvodnitelnou individuální indikaci auto-HCT u určitých skupin nemocných s neuroblastomem, meduloblastomem, Ewingovým sarkomem a germinálními nádory. Řada rozsáhlých, randomizovaných studií sledujících význam auto-HCT u karcinomu prsu, a to jak ve smyslu adjuvantní léčby či vysokodávkované chemoterapie u metastazovaného nádoru, neprokázala žádný přínos. Do současnosti také neexistuje žádná prospektivní randomizovaná studie prokazující přínos transplantační léčby u nemocných s ovariálním karcinomem a malobuněčným plicním karcinomem. Auto-HCT u solidních nádorů tak mají většinou indikační opodstatnění pouze v rámci klinických protokolů a jejich indikace jsou vývojové [7].
Alogenní transplantace se u solidních nádorů dospělých v současnosti nevyužívají.
3.12 Autoimunitní choroby
Autologní transplantace hematopoetických kmenových buněk může být vysoce individuálně zvážena u některých autoimunitních onemocnění ve specifických fázích postižení, která neodpovídají na konvenční léčbu a u nichž jsou z naší nebo světové literatury dostupná data o účinnosti vysokodávkované terapie. Tak může být tato léčba nabídnuta pacientům zejména se systémovou sklerodermií, kde u většiny pacientů konvenční léčba dosud selhává, u specifických forem roztroušené sklerózy, systémového lupus erythematodes, Crohnovy choroby, revmatoidní artritidy, eventuálně u dalších vzácných onemocnění s autoimunitním podkladem, u nichž standardní imunosuprese není účinná nebo dokonce není známa. V případě život ohrožujících forem autoimunitně podmíněných cytopenií (ITP, AIHA, Evansův syndrom) lze kromě auto-HCT zvážit i alogenní transplantaci, pokud je k dispozici vhodný dárce.
4 KOMENTÁŘ K TRANSPLANTAČNÍM INDIKACÍM U JEDNOTLIVÝCH NEMOCÍ DĚTÍ
4.1 Transplantace u maligních onemocnění dětí
4.1.1 Akutní myeloidní leukemie (AML)
Děti s AML v první hematologické remisi nejsou indikovány k auto-HCT. K alogenní transplantaci od sourozeneckého i identického nepříbuzného dárce v první remisi jsou standardně indikováni nemocní, kteří nedosáhli kompletní remise po druhém bloku chemoterapie, pacienti s prognosticky nepříznivými změnami karyotypu (např. monozomie chromozomu 7) a pacienti se sekundární AML. K alo-HCT od jakéhokoliv vhodného dárce jsou indikováni rovněž nemocní v druhé nebo pozdější remisi. Alo-HCT není indikována u nemocných v rozvinutém relapsu choroby. Alogenní transplantace s použitím haploidentického dárce je indikována individuálně [93].
4.1.2 Akutní lymfoblastická leukemie (ALL)
Alo-HCT u dětí s ALL standardního rizika není v první remisi indikována. K alo-HCT od sourozeneckého i identického nepříbuzného dárce jsou v první remisi indikováni nemocní s pomalou odpovědí na léčbu (pozdní dosažení remise, přetrvávající minimální reziduální nemoc). Pacienti v druhé nebo pozdější kompletní remisi jsou ve většině případů indikováni k alo-HCT s HLA identickým příbuzným i nepříbuzným dárcem. Alo-HCT není indikována u nemocných dětí, které nejsou v době transplantace v hematologické remisi. Alogenní transplantace s použitím haploidentického dárce u pacientů v remisi ALL je indikována individuálně. Autologní HCT není u dětí s ALL indikována [93, 94].
4.1.3 Chronická myeloidní leukemie (CML)
Každý dětský pacient s nově diagnostikovanou CML v chronické fázi (CP) zahajuje léčbu inhibitorem tyrozinových kináz (TKI; imatinib aj.). Pro naprostou většinu pacientů se jedná o celoživotní léčbu. V pediatrii je dlouhodobé užívání TKI spojeno s výskytem řady vedlejších projevů a nežádoucích účinků, z nichž některé jsou závažné a ireverzibilní (porucha růstu, vaskulopatie aj.) Navzdory zavedení imatinibu a dalších preparátů do standardní léčby CML zůstává alo-HCT jedinou kurativní léčbou této nemoci. Děti mohou být indikovány k alo-HCT po dosažení klidové chronické fáze časně v průběhu nemoci, pokud mají vhodného identického dárce (9–10/10 rodinného či nepříbuzného). V takovém případě je využívána příprava s redukovanou toxicitou. Pokud s transplantací nesouhlasí a/nebo nemají vhodného identického dárce, pokračují v zavedené léčbě v závislosti na její toleranci (nežádoucí účinky) a efektivitě. Po dosažení dlouhotrvající negativity BCR-ABL1 je možno zvážit zařazení do studií s přerušením léčby a častým sledováním minimální zbytkové nemoci. Transplantace je indikována standardně při selhání (mutace T315I aj.) nebo netoleranci léčby nebo u pacientů s primárně pokročilou formou CML (akcelerace nebo blastický zvrat) zpravidla s použitím myeloablativního režimu. Auto-HCT není u dětí s CML indikována. Alogenní transplantace s použitím haploidentického dárce je indikována individuálně u pacientů mimo CP.
4.1.4 Myeloproliferativní choroby jiné než CML
Tato onemocnění jsou v pediatrii vzácná. Třebaže zkušenosti s transplantací u nemocných s pravou polycytemií, primární myelofibrózou a jinými myeloproliferativními chorobami jsou zatím pouze částečné, měla by být u nemocných s vysokým rizikem zvažována alo-HCT jako individuální indikace. Alo-HCT je dnes jedinou kurativní léčbou.
4.1.5 Myelodysplastický syndrom (MDS)
Alo-HCT včetně použití nepříbuzného dárce je u dětí standardně indikována jako léčebná možnost první volby u nemocných s MDS. Auto-HCT není v současnosti u nemocných dětí s MDS indikována. Alogenní transplantace s použitím haploidentického dárce je indikována individuálně [93, 95, 96].
4.1.6 Hodgkinův lymfom (HL)
Auto-HCT je standardní indikací pro nemocné s chemosenzitivním relapsem HL. Transplantaci zatím nelze považovat za indikovanou u nemocných v první kompletní remisi, ani v případech s rizikovými prognostickými faktory v době stanovení diagnózy. Za standardní indikaci k auto-HCT lze považovat rovněž HL refrakterní k první linii léčby a zároveň senzitivní k záchranné chemoterapii. Alo-HCT s použitím HLA shodného sourozence je individuálně indikována při chemosenzitivním relapsu nemocných se špatnými prognostickými faktory a při opakovaném relapsu včetně nemocných, kteří relabovali po auto-HCT. Alo-
-HCT s použitím nepříbuzného dárce je považována za vývojovou.4.1.7 Nehodgkinské lymfomy (NHL)
Dětští pacienti s NHL mají velmi dobrou prognózu při léčbě chemoterapií a radioterapií. Při částečné odpovědi na primární chemoterapii či v případě chemosenzitivního relapsu je indikována auto-HCT (Burkittův lymfom, DLBCL, anaplastický velkobuněčný lymfom – ALCL). Nemocné relabující po chemoterapii či po auto-HCT lze indikovat k alo-HCT (např. ALCL, T/preB LL), je-li dostupný HLA shodný příbuzný či nepříbuzný dárce.
4.1.8 Solidní nádory
Přínos transplantace v léčbě solidních nádorů u dětí zůstává obtížně zhodnotitelný. S přihlédnutím k dostupným datům lze pokládat za standardní indikaci auto-HCT u neuroblastomu vysokého rizika a Ewingova sarkomu, individuální indikaci u germinálních tumorů, některých typů tumorů mozku (meduloblastom, gliom), chemosenzitivního relapsu sarkomu měkkých tkání či Wilmsova tumoru. Alo-HCT u dětských solidních nádorů mají indikační opodstatnění pouze v rámci klinických protokolů, respektive jako vývojová indikace, případně jejich provádění není doporučováno.
4.2 Transplantace u nemaligních onemocnění dětí
4.2.1 Získaná těžká aplastická anémie (SAA)
Alo-HCT s HLA identickým sourozencem je standardní indikací u nemocných dětí s SAA. Transplantace je indikována co nejdříve po potvrzení diagnózy. Pacienti, u kterých není dostupný HLA identický sourozenec, jsou léčeni kombinací anti-thymocytárního globulinu (ATG) a cyklosporinu A (CSA). Medián doby odpovědi po této léčbě je 2–3 měsíce. Definitivní zhodnocení odpovědi na uvedenou imunosupresivní léčbu by proto mělo být provedeno až zhruba po 4 měsících od jejího zahájení, zvláště je-li zvažována následná alo-HCT s nepříbuzným dárcem. Aplastická anémie vzniklá na podkladě Fanconiho anémie je pak indikací k alogenní transplantaci s redukovanou intenzitou předtransplantační přípravy od shodného rodinného i od jiného nepříbuzného dárce, a to bez předchozí imunosupresivní léčby.
4.2.2 Poruchy imunity
K alo-HCT jsou standardně neprodleně indikovány děti s těžkou formou vrozené imunodeficience. V některých případech je možno takové pacienty transplantovat i bez použití myeloablativního režimu s použitím RIC, či dokonce bez jakékoliv přípravy. Předpokladem úspěchu je mj. především včasné provedení transplantace, proto je klíčová rychlá identifikace možného dárce včetně jakéhokoliv nepříbuzného dárce. Závazná kritéria a indikace k transplantacím aktualizují evropské společnosti (EBMT, ESID) [97].
4.2.3 Vrozené poruchy metabolismu
K alo-HCT jsou standardně neprodleně indikovány děti v dosud dobrém klinickém stavu s mukopolysacharidózou 1. typu (Hurler), adrenoleukodystrofií (COALD) a maligní osteopetrózou. Těžké poškození pacienta nepříznivým průběhem onemocnění či při pozdním stanovení diagnózy je kontraindikací transplantace, neboť jejím očekávaným efektem u metabolických poruch je zástava degenerativních většinou ireverzibilních změn. Také v těchto případech je proto předpokladem úspěchu především včasné provedení HCT, klíčová je tedy rychlá identifikace možného dárce včetně jakéhokoliv nepříbuzného dárce. Indikace k alo-HCT u ostatních onemocnění v této skupině je individuální až vývojová v rámci klinických protokolů [98].
4.2.4 Vrozené poruchy krvetvorby
K alo-HCT jsou indikovány děti s nepříznivým průběhem (dlouhodobá závislost na častých transfuzích krve) vrozené poruchy krvetvorby, např. Diamondovy-
-Blackfanovy anémie, vrozené hemoglobinopatie, srpkovité anémie, těžké formy talasemie, amegakaryocytární trombocytopenie. Indikace k alogenní transplantaci od HLA vhodného dárce (sourozenec, nepříbuzný dárce) je individuální. Hlavním kritériem je posouzení rizik a výhod transplantace proti podpůrné léčbě [98–100].4.2.5 Autoimunitní choroby
Auto-HCT po vhodně zvolené transplantační přípravě s cílem dosáhnout co největší imunosuprese může být zvažována pro vybrané nemocné, u kterých selhala veškerá v současné době dostupná kombinovaná imunosupresivní léčba (těžká roztroušená skleróza, revmatoidní artritida, systémový lupus erythematodes apod.). Transplantační indikace se pohybuje na rozmezí individuální a vývojové indikace podle případu. Pro ostatní autoimunitní choroby lze auto-HCT považovat v současnosti za indikaci vývojovou. Stejně tak alo-HCT nutno v současnosti považovat u některých nemocných s velice nepříznivou prognózou za indikaci individuální až vývojovou v situaci, kdy selhala jiná dostupná léčba (biologická) [98].
4.2.6 Autoinflamatorní onemocnění
Jedná se o velmi heterogenní skupinu geneticky podmíněných vzácných onemocnění s projevy autoimunity (diabetes mellitus, thyreoiditida, artritidy, enteritidy, pneumonitidy, nefritidy, imunní cytopenie, periodické horečky, makrofágový syndrom a další), někdy v kombinaci s imunodeficiencí (CVID, CID). Indikací k alogenní transplantaci není průkaz genové poruchy, protože řada z nich má různou penetranci, ale výskyt závažných poruch imunity (autoimunity, imunodefi-
cience), kde je předpoklad, že převodem buněk zdravého dárce (lymfocyty, makrofágy) dojde k plné či částečné korekci závažných projevů onemocnění. Indikace k alo-HCT u onemocnění v této skupině je individuální až vývojová v rámci klinických protokolů [101].5 ZÁVĚR
Transplantace krvetvorných buněk dlouhodobě představují významnou terapeutickou modalitu a i v současné době patří u celé řady hematologických nádorových i nenádorových onemocnění mezi důležité a nenahraditelné léčebné přístupy. Provedení HCT je zatíženo řadou možných závažných zdravotních komplikací, proto tyto výkony spadají do kompetence vysoce specializovaných hematoonkologických center. Provedení transplantace krvetvorných buněk nadále představuje u některých typů hematologických malignit, ale i u nenádorových hematologických onemocnění jedinou léčebnou metodu s kurativním potenciálem.
Podíl autorů na přípravě rukopisu
Krejčí M., Sedláček P., Jindra P., Šťastná-Marková M., Faber E., Trněný M., Kozák T., Büchler T., Karas M., Vítek A., Raida L.: vlastní příprava rukopisu, revize a kontrola rukopisu. Žák P., Štěrba J., Hájek R., Kuříková M., Mayer J., Starý J.,Pohlreich D., Kořístek Z.,Cetkovský P.: revize a kontrola rukopisu.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku neshledávají žádný střet zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 9. 2. 2016.
Přijato po recenzi dne 15. 3. 2016.
prof. MUDr. Marta Krejčí, Ph.D.
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20,
625 00 Brno
e-mail: mkrejci@fnbrno.cz
Zdroje
1. Copelan EA. Hematopoietic stem-cell transplantation. N Engl J Med 2006; 354 : 1813–1826.
2. Appelbaum FR. Hematopoietic-cell transplantation at 50. N Engl J Med 2007; 357 : 1472–1475.
3. Ljungman P, Bregni M, Brune M, et al. European Group for Blood and Marrow. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe 2009. Bone Marrow Transplant 2010; 45 : 219–234.
4. Gratwohl A, Baldomero H, Aljurf M, et al. Hematopoietic stem cell transplantation: a global perspective. JAMA 2010; 303 : 1617–1624.
5. Passweg JR, Baldomero H, Bader P, et al. Hematopoietic SCT in Europe 2013: recent trends in the use of alternative donors showing more haploidentical donors but fewer cord blood transplants. Bone Marrow Transplant 2015; 50 : 476–482.
6. Koza V, Cetkovský P, Faber E, et al. Indikace k alogenním a autologním transplantacím krvetvorných buněk. Doporučení České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP. Trans Hematol dnes 2006; 12 : 223–231.
7. Sureda A, Bader P, Cesaro S, et al. Indications for allo - and auto-SCT for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2015. Bone Marrow Transplant 2015; 50 : 1037–1056.
8. Schmitz N, Gratwohl A, Goldman JM. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe in 1996 and proposals for an operational classification. Bone Marrow Transplant 1996; 17 : 471–477.
9. Goldman J M, Schinitz N, Niethainmer D, Gratwohl A. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe in 1998. Bone Marrow Transplant 1998; 21 : 1–7.
10. Gratwohl A, Hermans J, Baldoinero H, et al. Indications for haemopoietic precursor cell transplants in Europe. Br J Haematol 1996; 92 : 35–43.
11. Urbano-Ispizua A, Schinitz N, de Witte T, et al. Allogeneic and autologous transplantation for haematological diseases. solid tumours and immune disorders; definitions and current practice in Europe. Bone Marrow Transplant 2002; 29 : 639–646.
12. Ljungman P, Urbano-Ispizua A, Cavazzana-Calvo M, et al. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: definitions and current practice in Europe. Bone Marrow Transplant 2006 : 37; 439–449.
13. Lee SJ, Klein J, Haagenson M, et al. High-resolution donor-recipient HLA matching contributes to the success of unrelated donor marrow transplantation. Blood 2007; 110 : 4576–4583.
14. Beatty PG, Clift RA, Mickelson EM, et al. Marrow transplantation from related donors other than HLA-identical siblings. N Engl J Med 1985; 313 : 765–771.
15. Luznik L, O‘Donnell PV, Symons HJ, et al. HLA-haploidentical bone marrow transplantation for hematologic malignancies using nonmyeloablative conditioning and high-dose, posttransplantation cyclophosphamide. Biol Blood Marrow Transplant 2008; 14 : 641–650.
16. Raiola AM, Dominietto A, Ghiso A, et al. Unmanipulated haploidentical bone marrow transplantation and posttransplantation cyclophosphamide for hematologic malignancies after myeloablative conditioning. Biol Blood Marrow Transplant 2013; 19 : 117–122.
17. DiPersio JF, Micallef IN, Stiff PJ, et al. Phase III prospective randomized double-blind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem-cell mobilization and transplantation for patients with non-Hodgkin‘s lymphoma. J Clin Oncol 2009; 27 : 4767–4773.
18. DiPersio JF, Stadtmauer EA, Nademanee A, et al. Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 2009; 113 : 5720–5726.
19. Duarte RF, Shaw BE, Marín P, et al. Plerixafor plus granulocyte CSF can mobilize hematopoietic stem cells from multiple myeloma and lymphoma patients failing previous mobilization attempts: EU compassionate use data. Bone Marrow Transplant 2011; 46 : 52–58.
20. Schmitz N, Eapen M, Horowitz MM, et al. Long-term outcome of patients given transplants of mobilized blood or bone marrow: A report from the International Bone Marrow Transplant Registry and the European Group for Blood and Marrow Transplantation. Blood 2006; 108 : 4288–4290.
21. Anasetti C, Logan BR, Lee SJ, et al. Peripheral-blood stem cells versus bone marrow from unrelated donors. N Engl J Med 2012; 367 : 1487–1496.
22. Sideri A, Neokleous N, Brunet de la Grande P. A overview of the progress on double umbilical cord blood transplantation. Haematologica 2011; 96 : 1213–1220.
23. Martino R, Iacobelli S, Brand R, et al. Retrospective comparison of reduced-intensity conditioning and conventional high-dose conditioning for allogeneic hematopoietic stem cell transplantation using HLA-identical sibling donors in myelodysplastic syndromes. Blood 2006; 108 : 836–846.
24. Sureda A, Robinson S, Canals C, et al. Reduced-intensity conditioning compared with conventional allogeneic stem cell transplantation in relapsed or refractory Hodgkin‘s lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26 : 455–462.
25. Martino R, de Wreede L, Fiocco M, et al. Comparison of conditioning regimens of various intensities for allogeneic hematopoietic SCT using HLA-identical sibling donors in AML and MDS with < 10% BM blasts: a report from EBMT. Bone Marrow Transplant 2013; 48 : 761–770.
26. Gratwohl A, Hermans J, Goldman JM, et al. Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation. Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. Lancet 1998; 352 : 1087–1092.
27. Sorror ML, Maris MB, Storb R, et al. Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT. Blood 2005; 106 : 2912–2919.
28. Sorror M, Storer B, Sandmaier BM, et al. Hematopoietic cell transplantation-comorbidity index and Karnofsky performance status are independent predictors of morbidity and mortality after allogeneic nonmyeloablative hematopoietic cell transplantation. Cancer 2008; 112 : 1992–2001.
29. Döhner H, Estey EH, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European Leukemia Net. Blood 2010; 115 : 453–474.
30. Gorin NC, Labopin M, Frassoni F, et al. Identical outcome after autologous or allogeneic genoidentical hematopoietic stem-cell transplantation in first remission of acute myelocytic leukemia carrying inversion 16 or t(8;21): a retrospective study from the European Cooperative Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26 : 3183–3188.
31. Schlenk RF, Taskesen E, van Norden Y, et al. The value of allogeneic and autologous hematopoietic stem cell transplantation in prognostically favorable acute myeloid leukemia with double mutant CEBPA. Blood 2013; 122 : 1576–1582.
32. Byrd JC, Mrozek K, Dodge RK, et al. Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461). Blood 2002; 100 : 4325–4336.
33. Keating A, DaSilva G, Perez WS, et al. Autologous blood cell transplantation versus HLA-identical sibling transplantation for acute myeloid leukemia in first complete remission: a registry study from the Center for International Blood and Marrow Transplantation Research. Haematologica 2013; 98 : 185–192.
34. Holter Chakrabarty JL, Rubinger M, Le-Rademacher J, et al. Autologous is superior to allogeneic hematopoietic cell transplantation for acute promyelocytic leukemia in second complete remission. Biol Blood Marrow Transplant 2014; 20 : 1021–1025.
35. Giebel S, Labopin M, Gorin NC, et al. Improving results of autologous stem cell transplantation for Philadelphia-positive acute lymphoblastic leukaemia in the era of tyrosine kinase inhibitors: a report from the Acute Leukaemia Working Party of the European Group for Blood and Marrow Transplantation. Eur J Cancer 2014; 50 : 411–417.
36. Gupta V, Richards S, Rowe J. Allogeneic, but not autologous, hematopoietic cell transplantation improves survival only among younger adults with acute lymphoblastic leukemia in first remission: an individual patient data meta-analysis. Blood 2013; 121 : 339–350.
37. Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122 : 872–884.
38. Helhmann R, Berger U, Pfirrmann M. Drug treatment is superior to allografting as first-line therapy in chronic myeloid leukemia. Blood 2007; 109 : 4686–4692.
39. Gratwohl A, Pfirrmann M, Zander A, et al. Long-term outcome of patients with newly diagnosed chronic myeloid leukemia: a randomized comparison of stem cell transplantation with drug treatment. Leukemia 2015; publikováno elektronicky 14. října 2015, doi: 10.1038/leu.2015.281.
40. Milojkovic D, Nicholson E, Apperley JF, et al. Early prediction of success or failure of treatment with second-generation tyrosine kinase inhibitors in patients with chronic myeloid leukemia. Haematologica 2010; 95 : 224–231.
41. Lee SJ, Kukreja M, Wang T, et al. Impact of prior imatinib mesylate on the outcome of hematopoietic cell transplantation for chronic myeloid leukemia. Blood 2008; 112 : 3500–3507.
42. Passamonti F, Cervantes F, Vannucchi AM, et al: A dynamic prognostic model to predict survival in primary myelofibrosis: A study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood 2010; 115 : 1703–1708.
43. Gangat N, Caramazza D, Vaidya R, et al. DIPSS Plus: A refined dynamic international prognostic scoring system for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol 2010; 29 : 392–397.
44. Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of theWorld Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009; 114 : 937–951.
45. Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood 2012; 120 : 2454–2465.
46. Cutler CS, Lee SJ, Greenberg P, et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome. Blood 2004; 104 : 579–585.
47. Platzbecker U, Mufti G. Allogeneic stem cell transplantation in MDS: how? When? Best Pract Res Clin Haematol 2013; 26 : 421–429.
48. Litzow MR, Tarima S, Pérez WS, et al. Allogeneic transplantation for therapy-related myelodysplastic syndrome and acute myeloid leukemia. Blood 2010; 115 : 1850–1857.
49. Luger SM, Ringdén O, Zhang MJ, et al. Similar outcomes using myeloablative vs reduced-intensity allogeneic transplant preparative regimens for AML or MDS. Bone Marrow Transplant 2012; 47 : 203–211.
50. Scott BL, Storer B, Loken MR, et al. Pretransplantation induction chemotherapy and posttransplantation relapse in patients with advanced myelodysplastic syndrome. Biol Blood Marrow Transplant 2005; 11 : 65–73.
51. de Witte T, Hagemeijer A, Suciu S, et al. Value of allogeneic versus autologous stem cell transplantation and chemotherapy in patients with myelodysplastic syndromes and secondary acute myeloid leukemia. Final results of a prospective randomized European Intergroup Trial. Haematologica 2010; 95 : 1754–1761.
52. Dreger P, Döhner H, Ritgen M, et al. Allogeneic stem cell transplantation provides durable disease control in poor-risk chronic lymphocytic leukemia: long-term clinical and MRD results of the German CLL Sudy Group CLL3x trial. Blood 2010; 116 : 2438–2447.
53. Brown JR, Kim HT, Armand P, et al. Long-term follow-up of reduced-intensity allogeneic stem-cell transplantation for chronic lymphocytic leukemia: prognosis model to predict outcome. Leukemia 2013; 27 : 362–369.
54. Herth I, Dietrich S, Benner A, et al. The impact of allogeneic stem cell transplantation on the natural course of poor-risk chronic lymphocytic leukemia as defined by the EBMT consensus criteria: a retrospective donor versus no donor comparison. Ann Oncol 2014; 25 : 200–206.
55. Dreger P, Corradini P, Kimby E, et al. Indication for allogeneic stem cell transplantation in chronic lymphocytic leukemia. The EBMT consensus. Leukemia 2007; 21 : 12–17.
56. Schetelig J, Thiede C, Bornhauser M, et al. Evidence of a graft-versus-leukemia effect in chronic lymphocytic leukemia after reduced intensity conditioning and allogeneic stem-cell transplantation: the Cooperative German Transplant Study Group. J ClinOncol 2003; 21 : 2747–2753.
57. Dreger P, Schetelig J, Andersen N, et al. Managing high-risk CLL during transition to a new treatment era: stem cell transplantation or novel agents. Blood 2014; 124 : 3841–3849.
58. Byrd JC, Brown JR, O´Brien S, et al. Ibrutinib versus ofatumab in previosly terated chronic lymphocytic leukemia. N Engl J Med 2014; 371 : 213–223.
59. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370 : 997–1007.
60. Jain P, Keating M, Wierda W, et al. Outcomes of patients with chronic lymphocytic leukemia after discontinuing ibrutinib. Blood 2015; 125 : 2062–2067.
61. Michallet M, Dreger P, Sutton L, et al. Autologous hematopoietic stem cell transplantation in chronic lymphocytic leukemia: results of European intergroup randomized trial comparing autografting versus observation. Blood 2011; 117 : 1516–1521.
62 Sutton L, Chevret S, Tournilhac O, et al. Autologous stem cell transplantation as a first-line treatment strategy for chronic lymphocytic leukemia: a multicenter, randomized, controlled trial from the SFGM-TC and GFLLC. Blood 2011; 117 : 6109–6119.
63 Brion A, Mahe B, Kolb B, et al. Autologous transplantation in CLL patients with B and C Binet stages: final results of the prospective randomized GOELAMS LLC 98 trial. Bone Marrow Transplant 2012; 47 : 542–548.
64. Schmitz N, Pfistner B, Sextro M, et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin‘s disease: a randomised trial. Lancet 2002; 359 : 2065–2071.
65. Devillier R, Coso D, Castagna L, et al. Positron emission tomography response at the time of autologous stem cell transplantation predicts outcome of patients with relapsed and/or refractory Hodgkin‘s lymphoma responding to prior salvage therapy. Haematologica 2012; 97 : 1073–1079.
66. Sureda A, Canals C, Arranz R, et al. Allogeneic stem cell transplantation after reduced intensity conditioning in patients with relapsed or refractory Hodgkin‘s lymphoma. Results of the HDR-ALLO study – a prospective clinical trial by the Grupo Espanol de Linfomas/Trasplante de Medula Osea (GEL/TAMO) and the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Haematologica 2012; 97 : 310–317.
67. Philip T, Guglielmi C, Hagenbeek A, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin‘s lymphoma. N Engl J Med 1995; 333 : 1540–1545.
68. Gisselbrecht C, Glass B, Mounier N, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol 2010; 28 : 4184–4190.
69. Petrich AM, Gandhi M, Jovanovic B, et al. Impact of induction regimen and stem cell transplantation on outcomes in double-hit lymphoma: a multicenter retrospective analysis. Blood 2014; 124 : 2354–2361.
70. Pytlik R, Belada D, Kubackova K, et al. Treatment of high-risk aggressive B-cell non-Hodgkin lymphomas with rituximab, intensive induction and high-dose consolidation: long-term analysis of the R-MegaCHOP-ESHAP-BEAM Trial. Leuk Lymphoma 2015; 56 : 57–64.
71.van Kampen RJW, Canals C, Schouten HC, et al. Allogeneic stem-cell transplantation as salvage therapy for patients with diffuse large B-cell non-Hodgkin‘s lymphoma relapsing after an autologous stem-cell transplantation: an analysis of the European Group for Blood and Marrow Transplantation Registry. J Clin Oncol 2011; 29 : 1342–1348.
72. Al Khabori M, de Almeida JR, Guyatt GH, et al. Autologous stem cell transplantation in follicular lymphoma: a systematic review and meta-analysis. J Natl Cancer Inst 2012; 104 : 18–28.
73. Montoto S, Corradini P, Dreyling M, et al. Indications for hematopoietic stem cell transplantation in patients with follicular lymphoma: a consensus project of the EBMT-Lymphoma Working Party. Haematologica 2013; 98 : 1014–1021.
74. Robinson S, Dreger P, Caballero D, et al. The EBMT/EMCL consensus project on the role of autologous and allogeneic stem cell transplantation in mantle cell lymphoma. Leukemia 2015; 29 : 464–473.
75. Vaughn JE, Sorror ML, Storer BE, et al. Long-term sustained disease control in patients with mantle cell lymphoma with or without active disease after treatment with allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning. Cancer 2015; 121 : 3709–3716.
76. d‘Amore F, Relander T, Lauritzsen GF, et al. Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01. J Clin Oncol 2012; 30 : 3093–3099.
77. Reimer P, Rudiger T, Geissinger E, et al. Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas: results of a prospective multicenter study. J Clin Oncol 2009; 27 : 106–113.
78. Dodero A, Spina F, Narni F, et al. Allogeneic transplantation following a reduced-intensity conditioning regimen in relapsed/refractory peripheral T-cell lymphomas: long-term remissions and response to donor lymphocyte infusions support the role of a graft-versus-lymphoma effect. Leukemia 2012; 26 : 520–526.
79. Duarte RF, Boumendil A, Onida F, et al. Long-term outcome of allogeneic hematopoietic cell transplantation for patients with mycosis fungoides and Sezary syndrome: a European society for blood and marrow transplantation lymphoma working party extended analysis. J Clin Oncol 2014; 32 : 3347–3348.
80. Dimopoulos MA, Kastritis E, Owen RG, et al. Treatment recommendations for patients with Waldenstrom macroglobulinemia (WM) and related disorders: IWWM-7 consensus. Blood 2014; 124 : 1404–1411.
81. Kyriakou C, Canals C, Cornelissen JJ, et al. Allogeneic stem-cell transplantation in patients with Waldenstrom macroglobulinemia: report from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2010; 28 : 4926–4934.
82. Cortelazzo S, Ponzoni M, Ferreri AJ, et al. Lymphoblastic lymphoma. Crit Rev Oncol Hematol 2011; 79 : 330–343.
83. Hájek R, Adam Z, Ščudla V, et al. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí ČHS a Slovenskou myelomovou společností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2012; 18(Supplementum): 1–92.
84. Jimenez-Zepeda VH, Mikhael J, Winter A, et al. Second autologous stem cell transplantation as salvage therapy for multiple myeloma: impact on progression-free and overal survival. Biol Blood Marrow Transplant 2012; 18 : 773–779.
85. Ščudla V, Adam Z, Hájek R, et al. Diagnostika a léčba systémové AL amyloidosy. Doporučení vypracované Českou myelomovou skupinou a Myelomovou sekcí ČHS. Transfuze Hematol dnes 2013; 19(Supplementum): 1–60.
86. Marsh JC, Ball SE, Cavenagh J, et al. Guidelines for the diagnosis and management of aplastic anaemia. Br J Haematol 2009; 147 : 43–70.
87. Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood 2012; 120 : 1185–1196.
88. Bacigalupo A, Socié G, Schrezenmeier H, et al. Bone marrow versus peripheral blood matched sibling transplants, in acquired aplastic anemia: survival advantage for marrow in all age groups. Haematologica 2012; 97 : 1142–1148.
89. Ciceri F, Lupo-Stanghellini MT, Korthof ET. Haploidentical transplantation in patients with acquired aplastic anaemia. Bone Marrow Transplantation 2013; 48 : 183–185.
90. Clay J, Kulasekarara AG, Potter V, et al. Non-myeloablative peripheral blood haploidentical stem cell transplantation for refractory severe aplastic anemia. Biol Blood Marrow Transplant 2014; 20 : 1711–1716.
91. Bacigalupo A, Marsh JC. Unrelated donor search and unrelated donor transplantation in the adult aplastic anaemia patient aged 18-40 years without an HLA-identical sibling and failing immunosuppression. Bone Marrow Transplant 2013; 48 : 198–200.
92. Marsh JC, Gupta V, Lim Z, et al. Alemtuzumab with fludarabine and cyclophosphamide reduces chronic graft-versus-host disease after allogeneic stem cell transplantation for acquired aplastic anaemia. Blood 2011; 118 : 2351–2357.
93. Boztug H, Sykora KW, Slatter M, et al. European Society for Blood and Marrow Transplantation analysis of treosulfan conditioning before hematopoietic stem cell transplantation in children and adolescents with hematological malignancies. Ann Hematol 2015; 94 : 297–306.
94. Peters C, Schrappe M, von Stackelberg A, et al. Stem-cell transplantation in children with acute lymphoblastic leukemia: A prospective international multicenter trial comparing sibling donors with matched unrelated donors-The ALL-SCT-BFM-2003 trial. J Clin Oncol 2015; 33 : 1265–1274.
95. Hussein AA, Halkes CM, Socié G, et al. Outcome of allogeneic stem cell transplantation for patients transformed to myelodysplastic syndrome or leukemia from severe aplastic anemia: a report from the MDS Subcommittee of the Chronic Malignancies Working Party and the Severe Aplastic Anemia Working Party of the European Group for Blood and Marrow Transplantation. Biol Blood Marrow Transplant 2014; 20 : 1448–1450.
96. Locatelli F, Crotta A, Ruggeri A, et al. Analysis of risk factors influencing outcomes after cord blood transplantation in children with juvenile myelomonocytic leukemia: a EUROCORD, EBMT, EWOG-MDS, CIBMTR study. Blood 2013; 122 : 2135–2141.
97. Kang E, Gennery A. Hematopoietic stem cell transplantation for primary immunodeficiencies. Hematol Oncol Clin North Am 2014; 28 : 1157–1170.
98. Slatter MA, Boztug H, Pötschger U, et al. Treosulfan-based conditioning regimens for allogeneic hematopoietic stem cell transplantation in children with non-malignant diseases. Bone Marrow Transplant 2015; 50 : 1536–1541.
99. Angelucci E, Matthes-Martin S, Baronciani D, et al. Hematopoietic stem cell transplantation in thalassemia major and sickle cell disease: indications and management recommendations from an international expert panel. Haematologica 2014, 99 : 811–820.
100. Peffault de Latour R, Porcher R, Dalle JH, et al. Allogeneic hematopoietic stem cell transplantation in Fanconi anemia: the European Group for Blood and Marrow Transplantation experience. FA Committee of the Severe Aplastic Anemia Working Party; Pediatric Working Party of the European Group for Blood and Marrow Transplantation. Blood 2013; 122 : 4279–4286.
101. Wehr C, Gennery AR, Lindemans C, et al. Multicenter experience in hematopoietic stem cell transplantation for serious complications of common variable immunodeficiency. J Allergy Clin Immunol 2015, 135 : 988–997.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Cena České hematologické společnosti za nejlepší původní vědeckou práci v oboru hematologie v roce 2015
- Výběr z tisku a zprávy o knihách
- Analýza vztahu výsledků cytogenetického vyšetření k poměru volných lehkých řetězců κ/λ (FLC-r, FreeliteTM), páru těžkých/lehkých řetězců imunoglobulinu (HLC-r, HevyliteTM ) a vybraných prognostických faktorů vyšetřených při diagnóze mnohočetného myelomu
- Využití interfázní fluorescenční in situ hybridizace pro analýzu CD34+ buněk v periferní krvi u nemocných s myelodysplastickými syndromy
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Indikace k alogenním a autologním transplantacím krvetvorných buněk v ČR v roce 2016: doporučení Transplantační sekce České hematologické společnosti ČLS JEP a České onkologické společnosti ČLS JEP
- Liečba starších pacientov s myelodysplastickým syndrómom, nevhodných na intenzívnu terapiu a jej finančné dôsledky – skúsenosti jedného centra
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) České skupiny pro chronickou lymfocytární leukemii, sekce České hematologické společnosti ČLS JEP
- Profylaxe versus léčba „on demand“ u dospělých pacientů s těžkou hemofilií A – zkušenosti z FN Brno
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



