-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení
The Relapsed AML 2001/01, 02 Study for children with relapsed acute myeloid leukaemia or initially resistant disease has improved outcome
Relapse of acute myeloid leukaemia (AML) or AML initially resistant to treatment is extremely prognostically unfavourable. Between VIII/2001 and III/2009 in the Czech Republic, twenty patients aged 0-18 years with this diagnosis were treated as part of the international Relapsed AML 2001/01study. The protocol consisted of two blocks of chemotherapy based on a high-dose cytosine-arabinoside in combination with fludarabine. In the first block, patients were randomized to receive liposomal daunorubicin (DaunoXome). If there was > 20% blasts in the bone marrow after the first block or if a complete remission was not achieved after the second block, patients were considered non-responders and were excluded from the study. They were however eligible for the therapeutic study Relapsed AML 2001/02 with gemtuzumab ozogamicin (Mylotarg; GO) in monotherapy. After achieving a 2nd remission, children were indicated to undergo hematopoietic stem cell transplantation (HSCT). Two patients were treated for an initially resistant disease, 18 children for the 1st relapse of AML. In 61%, the relapse occurred early, less than 12 months from diagnosis. Six children did not respond to treatment, two died of an early death, twelve (60%) patients achieved a 2nd remission and 11 of these underwent allogeneic HSCT. In total, 6 (30%) of the children are alive with a median follow up of 5.8 years, all having undergone allogeneic transplantation (2 children after the 2nd HSCT). For the whole group, the event free survival probability (EFS) at 5 years is 18 ± 9%, the overall survival (OS) probability is 34 ± 11%. Treatment in the Relapsed AML 2001 study improved the prognosis of children with relapsed AML in the Czech Republic compared to the previous period 1993-2001 (n=22 children, OS 14%).
Key words:
acute myeloid leukemia, relapse, resistance, Relapsed AML 2001, children
Autoři: Zdráhalová K.ihash2ihash4ihash6ihash8ihash10ihash12ihash14ihash16ihash18ihash20ihash22ihash24ihash26ihash28ihash30ihash32ihash34ihash36ihash38ihash40ihash42ihash44ihash46ihash48ihash50ihash52 1 1 1 1 2 3 4 5 6 7 8 9 10 11 12,14 13 14 1 1 1 15 15 16 16 1 1 1
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha, Klinika dětské onkologie, FN Brno, I. dětská interní klinika LF MU a FN Brno, Klinika dětského lékařství FN Ostrava, Dětská klinika LF UP a FN Olomouc, #IHA 1
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 3, p. 113-121.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Relaps akutní myeloidní leukemie (AML) nebo AML primárně rezistentní na léčbu je prognosticky velmi nepříznivým onemocněním. V období VIII/2001 – III/2009 bylo v ČR s touto diagnózou léčeno 20 pacientů ve věku 0–18 let v mezinárodní studii Relapsed AML 2001/01. Protokol se skládal ze dvou bloků chemoterapie založené na vysokodávkovaném cytosin-arabinosidu v kombinaci s fludarabinem, v prvním bloku byli pacienti randomizováni pro podání lipozomálního daunorubicinu (DaunoXome). Pokud po prvním bloku bylo v kostní dřeni > 20 % blastů nebo po druhém bloku nebylo dosaženo kompletní remise, byli pacienti jako non-respondeři vyřazeni ze studie. Alternativou pro ně byla léčba ve studii Relapsed AML 2001/02 monoterapií gemtuzumab ozogamicinem (Mylotarg; GO). Po dosažení 2. remise byly děti indikovány k alogenní transplantaci kmenových buněk krvetvorby (HSCT). Dva pacienti byli léčeni pro primárně rezistentní onemocnění, 18 dětí pro první relaps AML. V 61 % byl relaps časný do 12 měsíců od diagnózy. Šest dětí neodpovědělo na léčbu, dvě zemřely časnou smrtí, dvanáct (60 %) pacientů dosáhlo 2. remise a 11 z nich podstoupilo alogenní HSCT. Celkem žije s mediánem sledování 5,8 roku 6 (30 %) dětí, všechny po alogenní transplantaci (2 děti po 2. HSCT). Pravděpodobnost 5letého přežití do selhání (EFS) je pro celou skupinu 18 ± 9 %, pravděpodobnost celkového přežití (OS) 34 ± 11 %. Léčba ve studii Relapsed AML 2001 zlepšila prognózu dětí s relapsem AML v České republice ve srovnání s předchozím obdobím 1993–2001 (n = 22 dětí, OS 14 %).
Klíčová slova:
akutní myeloidní leukemie, relaps, rezistence, Relapsed AML 2001, dětiÚvod
Akutní myeloidní leukemie (AML) představuje 15 % leukemií dětského věku. Chemoterapie s indukční léčbou založenou na antracyklinech a vysokodávkovaném cytosinarabinosidu (HD-AraC) spolu se zlepšující se podpůrnou léčbou přinesla od osmdesátých let 20. století výrazné zlepšení výsledků. Dlouhodobé přežití do selhání (EFS) dosahuje nyní 40–60 %, celkové přežití 60–70 %, 30 až 35 % dětských pacientů prodělá relaps a u 5–10 % je AML primárně rezistentní na chemoterapii (1–8). Prognóza pacientů s relapsem nebo rezistentní AML je velmi nepříznivá. Šance na dlouhodobé přežití se v 90. letech pohybovala mezi 20 a 30 %. Na přelomu 80. a 90. let neexistoval doporučený léčebný postup, často se používaly léčebné prvky z iniciální léčby, část pacientů byla léčena při relapsu pouze paliativně. Postupně byly vypracovány terapeutické protokoly přímo určené pro relaps dětské AML. Jejich léčba byla založena především na vysokodávkovaném cytosinarabinosidu, obvykle v kombinaci s antracykliny, fludarabinem a/nebo etoposidem ve 2–3 blocích. Po dosažení remise byla většinou doporučována transplantace kostní dřeně, která byla provedena u 2/3 dětí v remisi. Dárcem byl HLA shodný sourozenec, eventuálně shodný nepříbuzný dárce nebo byla provedena autologní HSCT. Transplantace, zejména alogenní nepříbuzenská, byla zatížena velkým rizikem komplikací, přesto výsledky dlouhodobého přežití dosahovaly obvykle lepších výsledků než pouhá chemoterapie (OS po transplantaci 36–62 %). Výsledky těchto studií (9–14) na celkovém počtu skoro tisíce dětí s relapsem AML prokázaly dále výrazný prognostický význam délky 1. kompletní remise (CR1). Časný relaps do jednoho roku od diagnózy představoval kolem 50–60 % všech relapsů a vedl k nižší úspěšnosti v dosažení 2. kompletní remise (CR2) a velmi nepříznivým výsledkům dlouhodobého přežití (10–20 %).
V letech 1993–2001 bylo v ČR pro relaps AML léčeno 22 dětí. Osmnáct z nich mělo relaps dřeňový. S kurativním cílem (protokoly AML-BFM-REZ 93, -97) jich bylo léčeno 17, z nich 12 (70,5 %) dosáhlo celkové remise a bylo transplantováno. Z těchto pacientů 2 zemřeli na komplikace transplantace, 7 prodělalo relaps a zemřelo, 3 (14 %) žijí v kompletní remisi, z toho 2 po 2 transplantacích a 1 pacient s extenzivní chronickou reakcí štěpu proti hostiteli (GVHD). Všichni 4 pacienti po autologní transplantaci zemřeli, z 8 pacientů transplantovaných alogenně žijí tři.
Pracovní skupina pro dětskou hematologii ČR se v letech 2001–2009 účastnila mezinárodní studie Relapsed AML 2001/01, 02. Cílem této léčby bylo dosáhnout chemoterapií remise a následně provést alogenní transplantaci kostní dřeně. Chemoterapie byla založena na kombinaci HD-AraC, fludarabinu, G-CSF a dle randomizace ev. lipozomálního daunorubicinu. Ara-C je účinné cytostatikum pro léčbu AML, fludarabin kromě vlastního cytostatického efektu zvyšuje i vychytávání Ara-C buňkami. G-CSF zvyšuje citlivost blastů na Ara-C i účinek fludarabinu, kombinace těchto léků se tedy vzájemně potencuje. Antracykliny mají nezastupitelnou roli v léčbě AML a jejich dávková intenzita a kumulativní dávka zásadně ovlivňují přežití (15). V léčbě relapsu byla přidáním idarubicinu k bloku FLAG (fludarabin, Ara-C, G-CSF) prokázána větší úspěšnost v dosažení remise (16). Vzhledem ke kardiotoxicitě antracyklinů existuje jejich maximální přípustná kumulativní dávka. Antracykliny jsou ale součástí iniciální léčby AML, při které se kumulativní podaná dávka už blíží bezpečné hranici, což omezuje jejich podání při relapsu. Lipozomální daunorubicin je daunorubicin kombinovaný s unilamelárním lipozomálním transportním systémem. Díky tomu je tento komplex v plazmě stabilnější, jen malé množství daunorubicinu se v plazmě nachází volné a většina se uvolňuje intracelulárně. To zvyšuje protinádorovou aktivitu a zároveň snižuje celkovou toxicitu včetně kardiotoxicity a celkově tedy umožňuje zachovat plnou dávku daunorubicinu (17). U pacientů, kteří takto nedosáhli remise, byla zahájena monoterapie gemtuzumab ozogamycinem (GO) vyráběným pod názvem Mylotarg v rámci studie Relapsed AML 2001/02. Jedná se o rekombinantní humanizovanou IgG4 protilátku proti CD33 konjugovanou s calicheamicinem, cytostatickým antibiotikem. Myeloidní blasty, které jsou CD33 pozitivní až u 90 % dětských AML, jsou tak selektivněji ničeny na protilátku navázaným cytostatikem (18). V případě takto dosažené remise byli pacienti také transplantováni.
Pacienti a metody
Do souboru byli zařazeni všichni pacienti s de novo AML ve věku 0–18 let, u kterých byl v České republice v období srpen 2001 – březen 2009 diagnostikován relaps AML nebo jejich AML byla primárně refrakterní na chemoterapeutickou léčbu (nedosažení remise po dvou indukčních blocích chemoterapie). Vyřazen byl jediný pacient s relapsem promyelocytární AML léčený oxidem arzenitým, stejně tak jako pacienti se sekundární AML.
Diagnóza primární AML i relapsu a odpověď na léčbu byly konfirmovány v referenční laboratoři Oddělení klinické hematologie FN Motol. Diagnóza AML i zařazení do podtypů byla provedena podle FAB klasifikace a centrálně konfirmována imunofenotypem ve FN Motol. Karyotyp byl vyšetřen při diagnóze a opět při relapsu v cytogenetických laboratořích spolupracujících s jednotlivými centry dětské hematologie. Screening přestavby MLL genu byl prováděn metodou split-FISH (19). Molekulární screening tří nejčastějších fúzních genů (PML-RARα, AML1-ETO, CBFβ-MYH11) byl proveden v Ústavu hematologie a krevní transfuze v Praze nebo na Interní hematoonkologické klinice FN Brno jednokrokovou RT-PCR. U pacientů po transplantaci se v rámci standardního potransplantačního sledování vyšetřovala minimální reziduální nemoc (MRD) pomocí kvantifikace fúzního genu, průtokové cytometrie a dále chimerismus pomocí VNTR polymorfismu.
Hodnocení léčby
Výsledky léčby byly hodnoceny v souladu s použitým protokolem Relapsed AML 2001/01. Relaps byl definován jako ≥10 % blastů v reprezentativní kostní dřeni nebo leukemická infiltrace v jakékoliv jiné lokalizaci poté, co byla v předchozích vyšetřeních dokumentována kompletní remise. Časný relaps byl stanoven jako relaps zjištěný do 12 měsíců od diagnózy, pozdní relaps jako relaps 1 rok a více od diagnózy. Za kompletní remisi byl považován pokles ≤ 5 % blastů v kostní dřeni se známkami normální hematopoézy a s regenerující periferní krvetvorbou, za parciální remisi nález > 5 % a ≤ 20 % blastů v kostní dřeni a/nebo neregenerující krvetvorba. Jako non-response neboli rezistence na léčbu relapsu byl označován nález > 20 % blastů v kostní dřeni nebo leukemická infiltrace v libovolné jiné lokalizaci po 1 nebo 2 blocích chemoterapie. Jako časná smrt je nazýváno úmrtí v průběhu prvních 2 měsíců léčby, tj. dříve, než mohla být dokumentována remise.
Léčebný protokol
Pacienti s relapsem AML zahájili léčbu podle protokolu Relapsed AML 2001/01. Pacienti s AML, kteří nedosáhli CR po 2. indukčním bloku iniciální chemoterapie, byli hodnoceni jako rezistentní na léčbu a byli přeřazeni do relapsového protokolu.
Léčba byla založena na vysokodávkovaném cytosin-arabinosidu (HD-AraC) v kombinaci s fludarabinem. Chemoterapie sestávala ze dvou bloků FLAG (fludarabin, HD-AraC, G-CSF), v prvním bloku se na základě randomizace přidával lipozomální daunorubicin (schéma léčby viz obr. 1, dávky cytostatik viz tab. 1). Po dosažení remise byli pacienti indikováni k alogenní HSCT. Pokud nemohla být transplantace provedena z jakéhokoliv důvodu co nejdříve po dosažení remise, dostávali v mezidobí konsolidační terapii, jejíž intenzita se řídila stavem pacienta. Konsolidační blok vysoké intenzity se skládal z 4denní kontinuální infuze AraC v dávce 500 mg/m2/den, 5 dávek etoposidu 100 mg/m2/dávku a jedné intrathékální (IT) aplikace AraC. Konsolidační blok nízké intenzity byl tvořen 6-thioguaninem per os 100 mg/m2/den v jedné denní dávce, maximální délka podání 4 týdny, dvou 4denních bloků AraC 75 mg/m2/den s.c. a IT-AraC. Cílem protokolu bylo zhodnotit, zda přidáním lipozomálního daunorubicinu se zvýší procento dosažených remisí a zlepší celkové výsledky přežití, dále také zhodnotit toxicitu lipozomálního antracyklinu.
Obr. 1. Schéma protokolu Relapsed AML 2001/01. 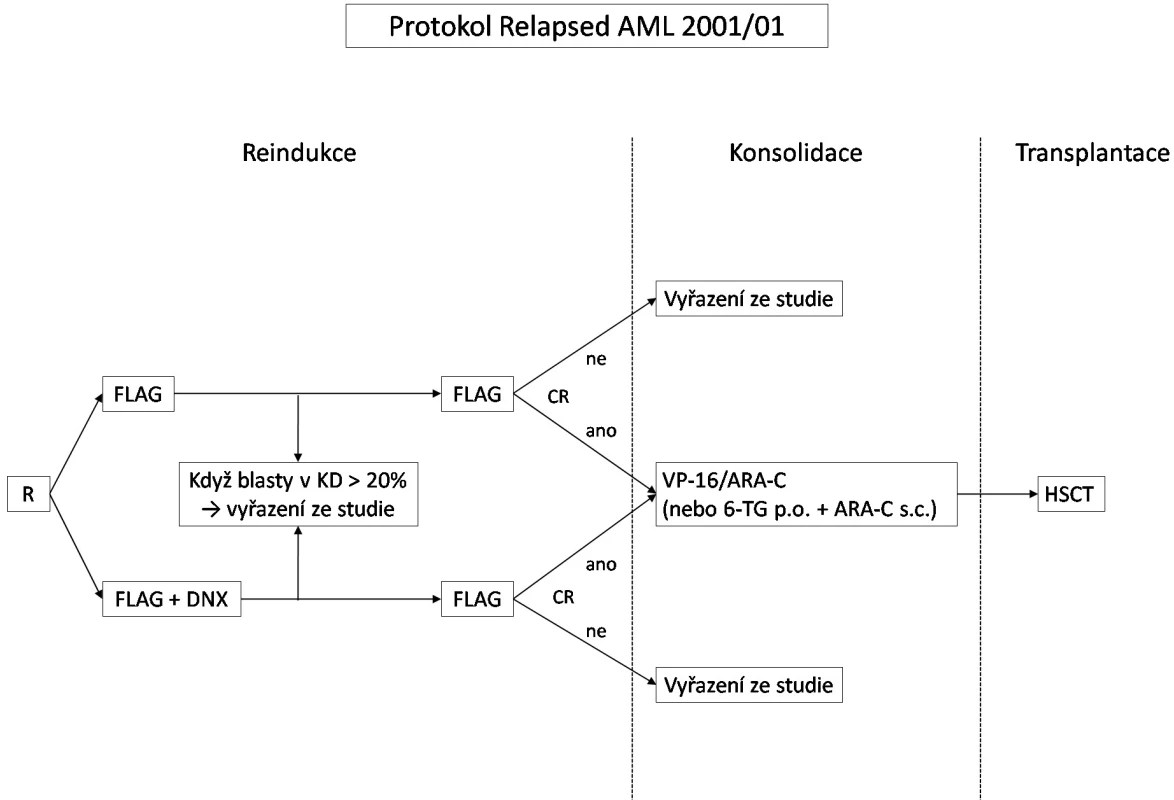
Vysvětlivky: FLAG – fludarabin + ARA-C + G-CSF, DNX – DaunoXome, HSCT – transplantace kmenových buněk krvetvorby, R – randomizace, CR – kompletní remise, KD – kostní dřeň, VP-16 – etoposid, ARA-C – cytosinarabinosid, 6-TG – 6-thioguanin, p.o. – per os, s.c. - subkutánně Tab. 1. Blok FLAG – dávky léků a schéma podání. 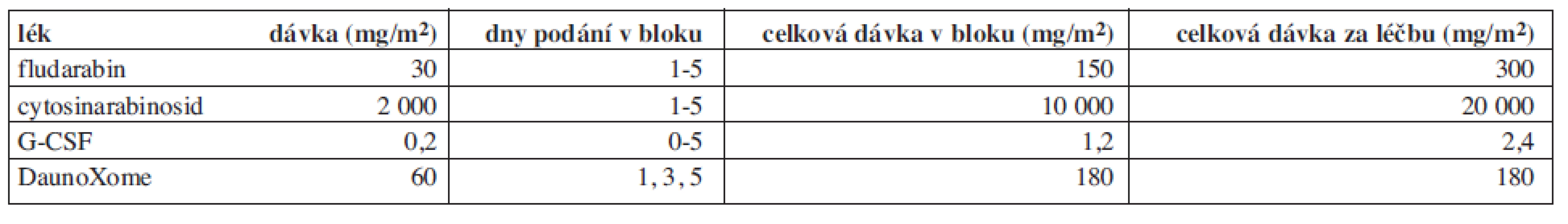
Pokud po 1. bloku chemoterapie nedošlo alespoň k částečné odpovědi s poklesem blastů v kostní dřeni pod 20 %, nebo po 2. bloku nebylo dosaženo kompletní remise, byli pacienti ze studie vyřazeni. Mohli být ale následně ještě léčeni v rámci jiných studií, zejména studie ve fázi II Relapsed AML 2001/02 s monoterapií GO. GO byl podáván ve dvou dávkách 7,5 mg/m2 s odstupem 14 dní, pokud po 1. dávce nedošlo k progresi onemocnění. V případě kompletní odpovědi na tuto léčbu (pod 5 % blastů v reprezentativní kostní dřeni s obnovenou periferní hematopoézou) byli pacienti opět indikováni k transplantaci kostní dřeně.
Statistická analýza
Křivky přežití byly konstruovány podle metody Kaplana-Meiera a rozdíly byly počítány podle log-rank testu (20, 21). Doba přežití byla počítána od diagnózy relapsu nebo v případě non-response od stanovení diagnózy AML. Za selhání pro hodnocení celkového přežití (OS) byl považován exitus. Pro hodnocení přežití do selhání (EFS) byla za selhání považována časná smrt, smrt v remisi, relaps nebo non-response (selhání v čase nula). Pro srovnání zastoupení nominálních proměnných mezi skupinami pacientů byl použit χ2 test.
Výsledky
V průběhu sledovaného období bylo do studie Relapsed AML 2001/01 zařazeno 20 pacientů ve věku 0–18 let (charakteristika souboru – viz tab. 2). Důvodem zařazení do studie byl u 18 z nich relaps onemocnění (medián 11 měsíců od diagnózy), u 2 pacientů non-response na iniciální chemoterapii. Primární léčba AML probíhala podle protokolů AML BFM 93, -98 a -2004, z toho 5 pacientů bylo standardního a 15 vysokého rizika. V 11 případech (55 %) se jednalo o relaps časný, u 4 pacientů dokonce velmi časný do 6 měsíců od diagnózy. Převahu tvořily relapsy dřeňové (88 %), nejčastěji izolované, extramedulárně byly postiženy CNS a kůže. Oba primární non-respondeři měli i extramedulární postižení. Podle FAB klasifikace nejvíce pacientů patřilo do M2 a M5 subtypu. Fúzní gen byl identifikován u 13 pacientů (65 %) (5x AML1-ETO, 2x CBFβ-MYH11, 6x MLL přestavby (MLL-AF6 : 2, MLL-AF10 : 2, MLL-AF9 : 1, MLL-CASC5 : 1).
Tab. 2. Charakteristika souboru pacientů. 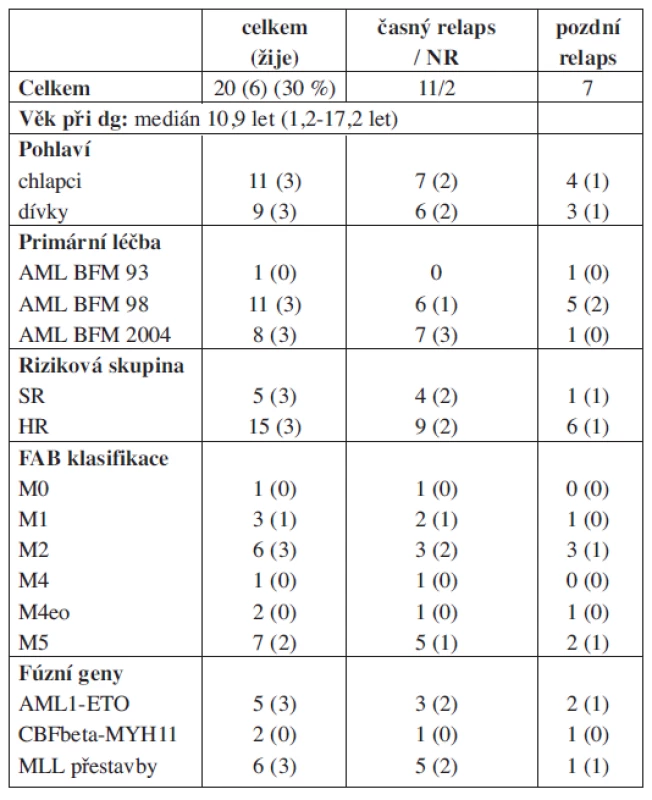
NR – non responder, SR – standardní riziko, HR – vysoké riziko Podrobnosti o léčbě relapsu zobrazuje tabulka 3 a obrázek 2. Dva pacienti zemřeli časnou smrtí před dokumentovanou remisí (multiorgánové selhání při progresi nemoci; pseudomonádová sepse). Šest pacientů bylo po 1. bloku vyřazeno ze studie pro non-response s více než 20 % blasty v kostní dřeni. Tři z nich následně nedosáhli remise ani monoterapií GO v rámci studie Relapsed AML 2001/02. Jeden z nich byl transplantován ve floridním relapsu od HLA identického sourozence a zrelaboval současně s regenerací krvetvorby. Všichni non-respondeři zemřeli.
Obr. 2. Schematické znázornění léčebných výsledků celého souboru pacientů 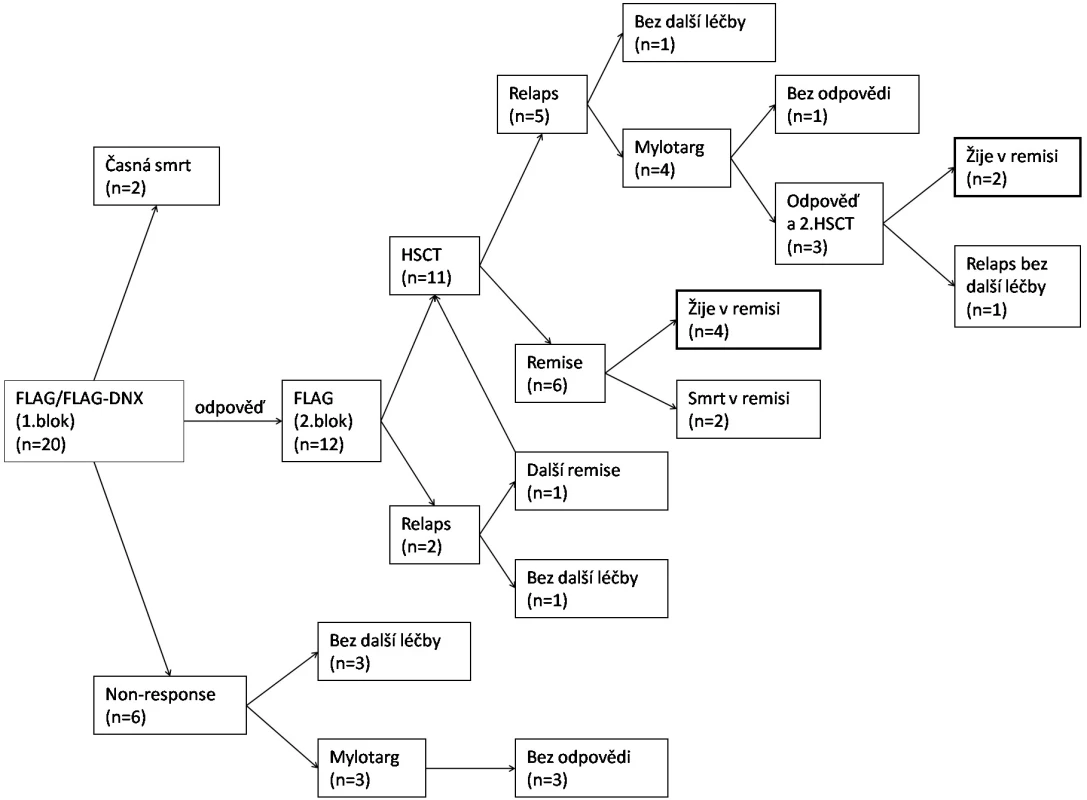
DNX – DaunoXome, HSCT – transplantace kmenových buněk krvetvorby. Tab. 3. Léčba relapsu. 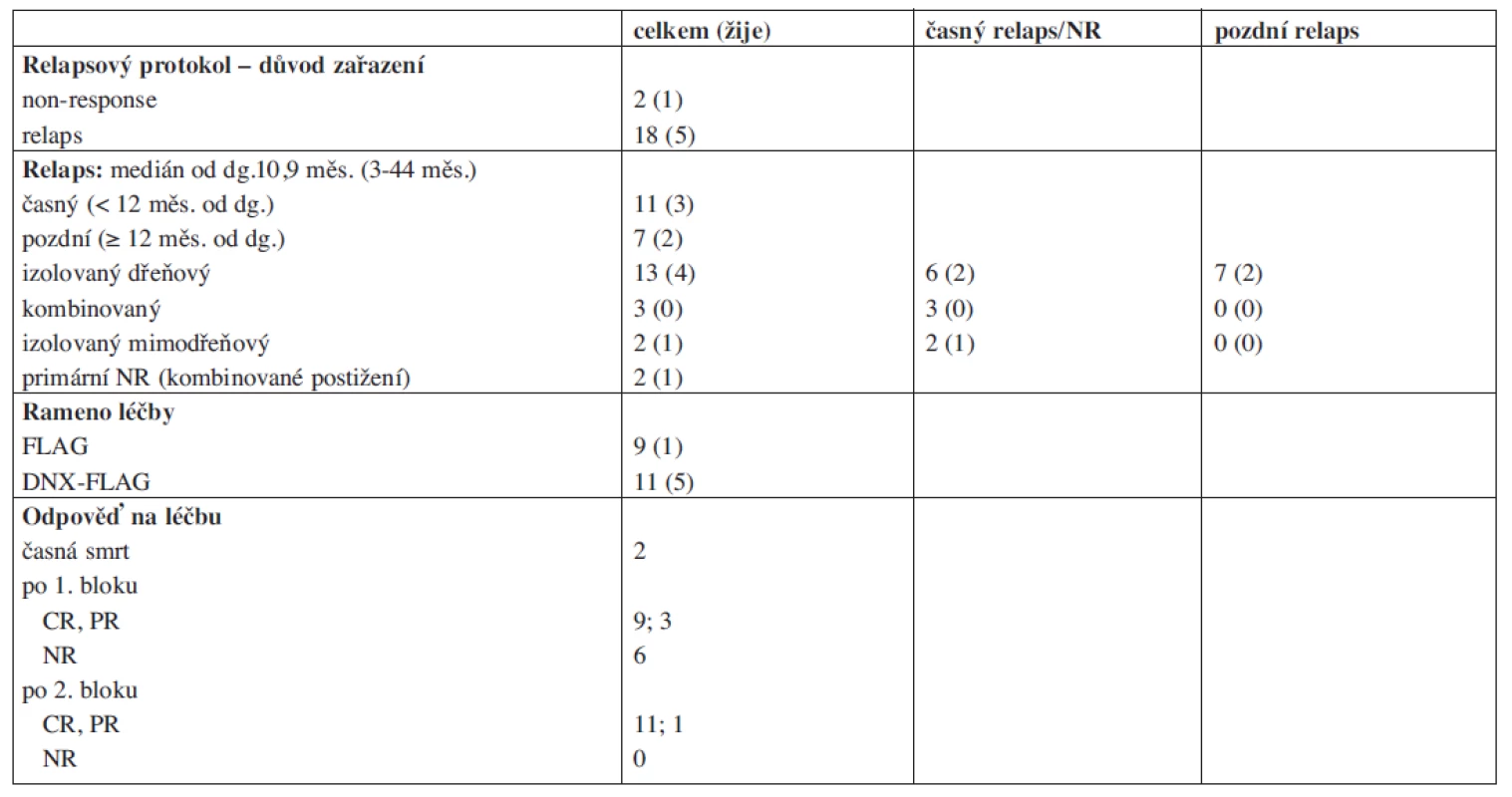
NR – non responder, CR – kompletní remise, PR – parciální remise Z 12 pacientů, kteří odpověděli na léčbu, jich 9 dosáhlo kompletní remise po 1. bloku a další 2 až po 2. bloku chemoterapie. Jeden pacient v aplázii kostní dřeně byl hodnocen nadále jako remise parciální. Dva pacienti prodělali relaps ještě před plánovanou transplantací. V případě izolovaného testikulárního relapsu bylo orchidektomií a radioterapií dosaženo 3. kompletní remise, ve které byl pacient transplantován.
Alogenní transplantaci kmenových buněk krvetvorby podstoupilo v remisi 11 pacientů s mediánem 4 měsíce od stanovení relapsu, všichni od nepříbuzného dárce z registrů (detailnější informace viz tab. 4). Přípravný předtransplantační režim obsahoval ve všech případech kombinaci busulfanu 16 mg/kg, cyklofosfamidu 120 mg/kg a melfalanu 140 mg/m2. V prevenci GVH reakce se uplatnil cyklosporin A a metotrexát v kombinaci s antitymocytárním globulinem. Dva pacienti zemřeli na potransplantační komplikace související s chronickou reakcí proti hostiteli (cGVHD) 1,2 a 5,8 roku po transplantaci, 4 děti žijí v kompletní remisi. Pět pacientů prodělalo další relaps s mediánem 14 měsíců (5–22 měsíce) od transplantace, z toho ve dvou případech relaps pouze molekulárně genetický. Tři ze 4 pacientů dosáhli další kompletní remise monoterapií GO (2 dávky) a podstoupili druhou transplantaci, 2 z nich žijí v kompletní remisi 3,5 a 6 let od 2. transplantace.
Tab. 4. Transplantace kmenových buněk krvetvorby. 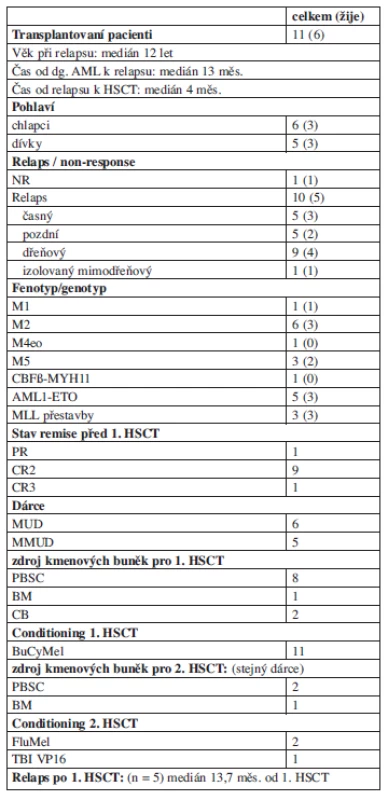
NR – non-responder, HSCT – transplantace kmenových buněk krvetvorby, PR – parciální remise, CR2 – 2. kompletní remise, CR3 – 3. kompletní remise, MUD – shodný nepříbuzenský dárce (shoda 9-10/10), MMUD – neshodný nepříbuzenský dárce (shoda 8/10 a méně), PBSC – periferní kmenové buňky, BM – kostní dřeň, CB – pupečníková krev, BuCyMel – Busulfan + Cyklofosfamid + Melfalan, FluMel – Fludarabin + Melfalan, TBI VP16 – celotělové ozáření + Etoposid Pravděpodobnost přežití do selhání (EFS) 5 let od stanovení relapsu nebo primární non-response byla pro celou skupinu 18 ± 9 %, pravděpodobnost celkového přežití (OS) byla 34 ± 11 % (graf 1). Celkem žije 6 (30 %) dětí, čtyři ve druhé remisi a dvě v remisi třetí. Ze 13 pacientů s primárně rezistentní AML/časným relapsem žijí 4 (31 %), ze 7 pacientů s pozdním relapsem déle než 12 měsíců od diagnózy žijí 2 (29 %).
Graf 1. Pravděpodobnost přežití do selhání (EFS) a celkového přežití (OS) celé skupiny pacientů (n=20). 
Diskuse
Relaps nebo refrakterní AML byly dosud prognosticky velmi nepříznivou diagnózou. Původní nejednotná léčba nedosahující uspokojivých výsledků a malý počet pacientů vedly k vytvoření mezinárodních multicentrických relapsových studií. Posledním ukončeným z těchto protokolů je studie Relapsed AML 2001/01, které se účastnilo přes 200 center z více než 20 zemí. Cílem studie bylo ověřit, zvýší-li přidání lipozomálního daunorubicinu k indukci FLAG úspěšnost dosažení remise bez zvýšení toxicity, a alogenní transplantací v remisi zvýšit pravděpodobnost dlouhodobého přežití.
Podle předběžných výsledků celé studie, ve které bylo zahrnuto 495 hodnotitelných pacientů, bylo 56 % relapsů časných (G. Kaspers, ústní sdělení, I-BFM-SG konference, Bergamo, Itálie, 2009). Kompletní remise z celého souboru dosáhlo 62 % dětí, naopak non-responderů na relapsovou léčbu bylo 32 %. Pravděpodobnost celkového přežití (OS) 4 roky od diagnózy byla 33 %, výrazně horší prognózu měly relapsy časné. Statisticky lepších výsledků OS dále dosahovali pacienti s příznivým cytogenetickým nálezem t(8;21) nebo inv(16). Signifikantním prognostickým faktorem bylo dosažení kompletní remise (OS 48 % oproti 8 % u těch, kteří remise nedosáhli). Blok DaunoXome-FLAG dosáhl účinnější redukce blastů a vyššího procenta remisí než FLAG bez zvýšené toxicity. Celkové přežití ale neovlivnil.
V našem souboru dosažení kompletní remise u 60 %, 5letý EFS 18 % i OS 34 % odpovídá publikovaným výsledkům současné léčby relapsu AML u dětí, podle kterých se úspěšnost dosažení remise pohybovala mezi 60 a 70 % a OS mezi 23 a 34 % (10–14). Srovnání randomizačních výsledků s a bez lipozomálního daunorubicinu není při malém počtu našich pacientů možné. Medián doby od diagnózy AML k relapsu byl 11 měsíců. Časné relapsy tvořily 61 % všech relapsů. Při malých číslech našeho souboru nemůžeme dokumentovat jejich horší pravděpodobnost přežití. Nicméně zemřeli všichni 4 pacienti s velmi časným relapsem (do 6 měsíců od diagnózy) a mezi 6 pacienty, kteří neodpověděli na relapsovou léčbu, byli 4 s časným relapsem a 1 non-responder na iniciální AML terapii. Převahu tvořily relapsy dřeňové, zejména izolované. Všechny extramedulární nebo kombinované relapsy byly časné. Oba primární non-respondeři na iniciální léčbu AML měli postižení kombinované.
Nejčastějšími FAB podtypy byly M2 (30 %) a M4/5 (40 %), fúzní geny byly detekovány u 2/3 pacientů. Pět ze 6 pacientů M2 podtypu mělo fúzní gen AML1/ETO, který je považován za prognosticky příznivý. Častější relapsy u této skupiny dokumentované vyšším zastoupením AML1/ETO pozitivity mezi relapsy (25 % v našem souboru) oproti diagnóze (12–14 %) (7, 22) mohou souviset s iniciální léčbou těchto pacientů. Ti pro svůj příznivý cytogenetický nález byli řazeni do standardního rizika léčby a v protokolu AML BFM 2004 proto byli léčeni pouze jedním blokem obsahujícím HD-AraC. Ve srovnání s předchozími protokoly, kde byly děti léčeny dvěma bloky s HD-AraC, došlo v této skupině pacientů k nárůstu relapsů, což mělo za následek návrat k dvěma blokům (23).
Právě pro přítomnost příznivých cytogenetických translokací (AML1/ETO, CBFß/MYH11) bylo při iniciální léčbě celkem 5 pacientů léčeno podle standardního ramene. Při srovnání prognózy při následném relapsu, EFS v 5 letech je u standardního rizika 60 % oproti 0 % rizika vysokého (p = 0,007). To svědčí o tom, že pacienti s příznivým cytogenetickým nálezem mají větší pravděpodobnost při relapsu dosáhnout kvalitní remise (24).
Podtyp M5 je v BFM studiích iniciálně léčen jako vysoké riziko a jako takový je spojen s vyšším rizikem relapsu (22). To je dokumentováno i vyšším zastoupením M5 typu u relapsů než u iniciální diagnózy (9), tomu odpovídá i naše zastoupení M4/5 (40 % při relapsu v našem souboru vs. 27 % při diagnóze (7). Podle výsledků léčby relapsů amerického St. Jude je při relapsu u M5 typu obtížnější dosažení remise a velmi špatné výsledky dlouhodobého přežití (pouze 11 %) (14), ostatní publikace ale jasný prognostický vliv FAB podtypu u relapsu nenalézají. V našem souboru žijí 2 ze 7 pacientů s M5. Za pozornost stojí, že většina relapsů byla časných (n = 5) a s mimodřeňovým postižením (n = 5), dva dokonce měli relaps pouze izolovaný mimodřeňový, 4 pacienti měli MLL přestavbu, 3 nedosáhli remise.
MLL přestavby v rámci dětské AML představují 15–20 % a jsou velmi heterogenní skupinou s velkým množstvím translokačních partnerů. Ve většině případů jsou spojeny s M4 nebo M5 podtypem a nižším věkem při diagnóze (medián 2,2 roku). Výsledky bývají hodnoceny souhrnně a přestavba MLL genu v oblasti 11q23 bývá považována za prognosticky nepříznivou nebo intermediární. Při přesnější analýze jednotlivých podskupin ale existuje škála s velmi odlišnou prognózou (25). Přibližně polovinu představuje t(9;11), někdy považovaná za prognosticky příznivou (26). Nečetná translokace t(1;11) dosahuje excelentních výsledků, naopak t(6;11), představující 5 % MLL translokací a asociovaná s vyšším věkem při diagnóze, má EFS pouze 11 %. V našem souboru byla prokázána MLL přestavba u 30 % pacientů (n = 6). Časté u nich byly časné relapsy (n = 3), non-response na iniciální léčbu AML (n = 2) a extramedulární postižení. Všichni byli FAB typu M4 nebo M5 s jedinou výjimkou pacienta s t(6;11) a M1 typem, který byl non-responder už na iniciální léčbu. Ten pak sice dosáhl parciální remise relapsovým protokolem a byl alogenně transplantován, rok po transplantaci ale prodělal molekulární relaps. Monoterapií GO se podařilo dosáhnout další remise a pacienta s touto extrémně nepříznivou prognózou poté retransplantovat, žije 6 let od druhé transplantace v kompletní remisi.
Na protilátku navázané cytostatikum GO představuje léčbu cílenější na nádorové buňky než běžná systémová léčba. Dle dosavadních výsledků odpoví na léčbu kolem třetiny dětských pacientů (27, 28). Nebyl pozorován rozdíl v odpovědi na GO mezi relapsy a iniciální rezistencí na léčbu. Mezi nejčastější nežádoucí účinky patří myelotoxicita, mukositida, febrilie a třesavka při podání, infekční komplikace a hepatotoxicita. Hepatotoxicita se obvykle omezuje jen na elevaci transamináz a bilirubinu, velmi obávanou komplikací ale je venookluzivní nemoc (VOD). Tento život ohrožující stav je způsoben jaterní mikroangiopatií s následnou hyperbilirubinemií, trombocytopenií, ascitem a vzestupem hmotnosti. Riziko rozvoje VOD se u dětských pacientů odhaduje na 1 %. Pokud byl ale pacient v předchozí léčbě transplantován, nebo je transplantován po léčbě GO, hrozí VOD až v 17 %. Proto se při transplantaci prováděné po podání GO nyní doporučuje preventivní podávání defibrotidu (28).
V našem souboru jsme dokumentovali odpověď na léčbu GO u 3 ze 7 pacientů (43 %). Odpověď nebyla zaznamenána u žádného z pacientů rezistentních na chemoterapii relapsového protokolu. Tři ze 4 pacientů s relapsem po transplantaci ale dosáhli léčbou GO další remise, která jim umožnila podstoupit druhou transplantaci a znamenala významný přínos v jejich léčbě. Žádný z pacientů nerozvinul VOD přímo při léčbě GO. Ze 3 pacientů retransplantovaných v remisi dosažené po podání GO se rozvinula VOD jen v případě pacientky, která jediná nedostávala defibrotide preventivně, na jeho následné léčebné podání pak ale odpověděla ústupem VOD.
GO se jeví jako nadějný lék v terapii rezistentní AML, a to jak v monoterapii, tak v redukované dávce i v kombinaci s chemoterapií (29). V nové studii relapsu AML u dětí se proto počítá s GO jako součástí standardní léčby (přes nejistoty o jeho další výrobě).
Většina pacientů s relapsem AML po dosažení remise podstoupí transplantaci kmenových buněk krvetvorby, s 36–62 % pravděpodobností dlouhodobého přežití po transplantaci (10–14, 24, 30). Výrazným přínosem alogenní transplantace u AML je efekt štěpu proti leukemii. Pacienti bez shodného rodinného dárce byli v minulosti často transplantováni pouze autologně. Použití dárců z registrů nebylo příliš využíváno vzhledem k vyššímu riziku úmrtí na transplantační komplikace. Pokroky v HLA typizaci a zlepšování potransplantační imunosuprese i podpůrné terapie snížily potransplantační komplikace včetně mortality. To vedlo k ústupu od autologní transplantace a častější indikaci transplantace nepříbuzenské. Nebylo dosud prokázáno randomizovanou studií (která není při malých počtech pacientů reálná), že alogenní transplantace má lepší výsledky než samotná chemoterapie (31), eventuálně zda se přínos transplantace liší u jednotlivých skupin pacientů. Přesto alogenní transplantace po dosažení CR2 je v současnosti doporučována jako nejvhodnější postup. Pacienti našeho souboru byli transplantováni od HLA shodného (shoda 9–10/10, n = 6) nebo neshodného (shoda 7–8/10, n = 5) nepříbuzného dárce, žádný neměl HLA identického sourozence. Pro malý počet pacientů v obou skupinách nelze vliv HLA (ne)shody v našem souboru hodnotit.
Z našich transplantovaných pacientů prodělala relaps téměř polovina. To dokumentuje nedostatečnou kvalitu jejich remise, ve které HSCT podstoupili. Cílem nové studie pro léčbu relapsů bude nejen zvýšení úspěšnosti v dosažení remise, ale právě i zlepšení její kvality. U všech našich pacientů byla v řádu týdnů až měsíců před relapsem detekována stoupající hladina minimální reziduální nemoci (MRD) (stoupající kvantitativní PCR fúzního genu, narůstající smíšený chimerismus, pozitivní MRD metodou průtokové cytometrie). Tento postup včasné diagnostiky blížícího se relapsu umožňuje zasáhnout ve stadiu, kdy ještě není nálož nádorových buněk příliš veliká, což zvyšuje naději na terapeutický úspěch. Na nález stoupající MRD bylo reagováno imunoterapií – snížením imunosuprese, podáním infuze dárcovských lymfocytů (DLI) a/nebo GO. Dva pacienti s molekulárním relapsem dosáhli remise monoterapií GO, u ostatních uvedené postupy nevedly k udržení trvalé remise, pravděpodobně ale oddálily manifestaci floridního hematologického relapsu. Umožnily tak plánovat eventuální retransplantaci v dostatečném odstupu od první transplantace a tím snížit riziko toxických komplikací. Za pozornost stojí, že ani potransplantační relaps není fatální situací, a 2 z 5 těchto pacientů žijí v další remisi, po 2. alogenní transplantaci.
Důležitou otázkou do budoucna zůstává, zda je možné při iniciální léčbě AML určit podle výše minimální reziduální nemoci pacienty, u kterých je vysoké riziko následného relapsu, a zda jejich intenzivnější iniciální chemoterapie dokáže toto riziko snížit (32, 33). Potenciálně přínosná je také možnost zachytit návrat nemoci už na úrovni molekulárního relapsu, zejména u relapsů velmi časných, které mají jinak extrémně nepříznivou prognózu a u kterých ani plánovaná nová studie nedává předpoklad významnějšího zlepšení. Základním předpokladem úspěšné léčby relapsu AML je v současnosti velmi úzká spolupráce mezi leukemickým a transplantačním centrem. Ihned po stanovení diagnózy relapsu je nutné zahájit hledání dárce štěpu a plánovat optimální termín transplantace.
Závěr
V souhrnu, z našich pacientů žije celkem 6 z 20 dětí s mediánem sledování 5,8 let (4x v CR2 a 2x v CR3). To představuje 30 % pacientů celého souboru a 50 % z těch, kteří dosáhli remise. EFS a OS 5 let od relapsu je 18 %, resp. 34 %. Přestože náš soubor není velký, naše výsledky jsou srovnatelné s výsledky mezinárodních studií a ukazují zlepšení oproti naší historické skupině léčené v letech 1993–2001. Na podkladě mezinárodních výsledků studie Relapsed AML 2001, kde byl prokázán pozitivní efekt přidaného lipozomálního daunorubicinu, bude v následujícím protokolu Relapsed AML 2010/01 podáván lipozomální daunorubicin v prvním bloku všem pacientům a léčba bude formou randomizované studie posílena o GO s cílem zlepšit kvalitu remise před následující HSCT.
Poděkování
Děkujeme lékařům a sestrám jednotlivých center za péči o dětské pacienty a spolupráci při získávání klinických a laboratorních dat. Studie byla částečně podpořena výzkumnými záměry MSM0021620813, MSM 619 895 9205, MSM 0021622430 a MZ0FNM2005.
Doručeno do redakce: 1. 6. 2011
Přijato po recenzi: 9. 6. 2011
MUDr. Kateřina Zdráhalová
Klinika dětské hematologie a onkologie
Fakultní nemocnice Motol
V úvalu 84150 06, Praha 5
email: katerina.zdrahalova@fnmotol.cz
Zdroje
1. Creutzig U, Zimmermann M, Ritter J, et al. Treatment strategies and long-term results in paediatric patients treated in four consecutive AML-BFM trials. Leukemia 2005; 19 : 2030-42.
2. Kaspers GJ, Creutzig U. Pediatric acute myeloid leukemia: international progress and future directions. Leukemia 2005; 19 : 2025-9.
3. Lie SO, Abrahamsson J, Clausen N, et al. Long-term results in children with AML: NOPHO-AML Study Group—report of three consecutive trials. Leukemia 2005; 19 : 2090-100.
4. Entz-Werle N, Suciu S, van der Werff ten Bosch J, et al. Results of 58872 and 58921 trials in acute myeloblastic leukemia and relative value of chemotherapy vs allogeneic bone marrow transplantation in first complete remission: the EORTC Children Leukemia Group report. Leukemia 2005; 19 : 2072-81.
5. Ravindranath Y, Chang M, Steuber CP, et al. Pediatric Oncology Group (POG) studies of acute myeloid leukemia (AML): a review of four consecutive childhood AML trials conducted between 1981 and 2000. Leukemia 2005; 19 : 2101-16.
6. Smith FO, Alonzo TA, Gerbing RB, Woods WG, Arceci RJ; Children’s Cancer Group. Long-term results of children with acute myeloid leukemia: a report of three consecutive Phase III trials by the Children’s Cancer Group: CCG 251, CCG 213 and CCG 2891. Leukemia 2005; 19 : 2054-62.
7. Starý J, Vávra V, Gajdoš P, et al. Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice. Transfuz Hemat dnes 2008; 14 : 166-74.
8. Starý J, Gajdoš P, Blažek B, et al. Sjednocení léčby dětí s akutní myeloidní leukemií v České republice podle protokolu AML-BFM 93. Čas Lek čes 2004; 143 : 257-63.
9. Stahnke K, Boos J, Bender-Götze C, Ritter J, Zimmermann M, Creutzig U. Duration of first remission predicts remission rates and long-term survival in children with relapsed acute myelogenous leukemia. Leukemia 1998; 12 : 1534-8.
10. Sander A, Zimmermann M, Dworzak M, et al. Consequent and intensified relapse therapy improved survival in pediatric AML: results of relapse treatment in 379 patients of three consecutive AML-BFM trials. Leukemia 2010; 24 : 1422-8.
11. Aladjidi N, Auvrignon A, Leblanc T, et al. Outcome in children with relapsed acute myeloid leukemia after initial treatment with the French Leucemie Aique Myeloide Enfant (LAME) 89/91 protocol of the French Society of Pediatric Hematology and Immunology. J Clin Oncol 2003; 21 : 4377-85.
12. Abrahamsson J, Clausen N, Gustafsson G, et al. Improved outcome after relapse in children with acute myeloid leukaemia. Br J Haematol 2007; 136 : 229-36.
13. Webb DK, Wheatley K, Harrison G, Stevens RF, Hann IM. Outcome for children with relapsed acute myeloid leukaemia following initial therapy in the Medical Research Council (MRC) AML 10 trial. MRC Childhood Leukaemia Working Party. Leukemia 1999; 13 : 25-31.
14. Rubnitz JE, Razzouk BI, Lensing S, Pounds S, Pui CH, Ribeiro RC. Prognostic factors and outcome of recurrence in childhood acute myeloid leukemia. Cancer 2007; 109 : 157-63.
15. Fernandez HF, Sun Z, Yao X, et al. Anthracycline dose intensification in acute myeloid leukemia. New Engl J Med 2009; 361 : 1249-59.
16. Fleischhack G, Hasan C, Graf N, Mann G, Bode U. IDA-FLAG (idarubicin, fludarabine, cytarabine, G-CSF), an effective remission-induction therapy for poor-prognosis AML of childhood prior to allogeneic or autologous bone marrow transplantation: experiences of a phase II trial. Br J Haematol 1998; 102 : 647-55.
17. Gill PS, Espina BM, Muggia F, et al. Phase I/II clinical and pharmacokinetic evaluation of liposomal daunorubicin. J Clin Oncol 1995; 13 : 996-1003.
18. Van der Velden VHJ, te Marvelde JG, Hoogeveen PG, et al. Targeting of the CD33-calicheamicin immunoconjugate GO in acute myeloid leukemia: in vivo and in vitro saturation and internalization by leukemic and normal cells. Blood 2001; 97 : 3197-204.
19. van der Burg M, Beverloo HB, Langera AW, et al. Rapid and sensitive detection of all types of MLL gene translocations with single FISH probe set. Leukemia 1999; 13 : 2107-13.
20. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457-81.
21. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163-70.
22. Creutzig U, Zimmermann M, Lehrnbecher T, et al. Less toxicity by optimizing chemotherapy, but not by addition of granulocyte colony-stimulating factor in children and adolescents with acute myeloid leukemia: results of AML-BFM 98. J Clin Oncol 2006; 24 : 4499-506.
23. Creutzig U, Zimmermann M, Bourquin J-P, et al. t(8;21) in childhood AML: Improved outcome by an intensified induction with HAM – Results from studies AML-BFM 98 and -2004. J Clin Oncol 2011 – přijato do tisku
24. Gassas A, Ishaqi MK, Afzal S, et al. A comparison of the outcomes of children with acute myelogenous leukemia in either first or second complete remission (CR1 vs CR2) following allogeneic hematopoietic stem cell transplantation at a single transplant center. Bone Marrow Transplant 2008; 41 : 941-5.
25. Balgobind BV, Raimondi SC, Harbott J, et al. Novel prognostic subgroups in childhood 11q23/MLL-rearranged acute myeloid leukemia: results of an international retrospective study. Blood 2009; 114 : 2489-96.
26. Grimwade D, Walker H, Oliver F, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. The Medical Research Council Adult and Children’s Leukaemia Working Parties. Blood 1998; 92 : 2322-33.
27. Zwaan CM, Reinhardt D, Zimmerman M, et al. Salvage treatment for children with refractory first or second relapse of acute myeloid leukaemia with gemtuzumab ozogamicin: results of a phase II study. Br J Haematol 2010; 148 : 768-76.
28. Arceci RJ, Sande J, Lange B, et al. Safety and efficacy of gemtuzumab ozogamicin in pediatric patients with advanced CD33+ acute myeloid leukemia. Blood 2005; 106 : 1183-8.
29. Brethon B, Yakouben K, Oudot C, et al. Efficacy of fractionated gemtuzumab ozogamicin combined with cytarabine in advanced childhood myeloid leukaemia. Br J Haematol 2008; 143 : 541-7.
30. Fagioli F, Zecca M, Locatelli F, et al. Allogeneic stem cell transplantation for children with acute myeloid leukemia in second complete remission. J Pediatr Hematol Oncol 2008; 30 : 575-83.
31. Goemans BF, Tamminga RY, Corbijn CM, Hählen K, Kaspers GJ. Outcome for children with relapsed acute myeloid leukemia in the Netherlands following initial treatment between 1980 and 1998: survival after chemotherapy only? Haematologica 2008; 93 : 1418-20.
32. Coustan-Smith E, Ribeiro RC, Rubnitz JE, et al. Clinical significance of residual disease during treatment in childhood acute myeloid leukaemia. Br J Haematol 2003; 123 : 243-52.
33. Sievers EL, Lange BJ, Alonzo TA, et al. Immunophenotypic evidence of leukemia after induction therapy predicts relapse: results from a prospective Children’s Cancer Group study of 252 patients with acute myeloid leukemia. Blood 2003; 101 : 3398-406.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledkyČlánek Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistikaČlánek Oznámení o nové knize
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení
- Who is fit for allogeneic transplantation? (PERSPECTIVES)
- Úloha alogenní transplantace buněk krvetvorby v léčbě získané aplastické anémie u dětí – zkušenost v České republice v letech 1991–2007
- A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation
- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistika
- Hematopoietic cell transplantation comorbidity index predicts transplantation outcomes in pediatric patients
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Oznámení o nové knize
- Incidence of factor VIII inhibitors throughout life in severe hemophilia A in the United Kingdom
- Long-term clinical outcomes of patients with primary chronic immune thrombocytopenia: a Danish population-based cohort study
- Monosomal karyotype in primary myelofibrosis is detrimental to both overall and leukemia-free survival
- New insights into childhood autoimmune hemolytic anemia: a French national observational study of 265 children
- A randomized, double-blind study of romiplostim to determine its safety and efficacy in children with immune thrombocytopenia
- Významná data z historie československé a české hematologie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Významná data z historie československé a české hematologie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



