-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
Detection of the JAK2V617F mutation in myeloproliferative disorders - an overview and own experiences
The lack of reliable molecular markers is responsible for difficult detection and monitoring of Ph-negative myeloproliferative diseases, such as polycythemia vera, essential thrombocythemia or idiopathic myelofibrosis. In recent years, the V617F point mutation in the JAK2 gene (JAK2V617F) come to be a feasible marker for confirmation and evaluation of such hematology disorders. In this paper we report a review of diagnostic methods developed for investigation of JAK2 gene mutations and we present our experience with detection of JAK2V617F. Two methods (allelic discrimination analysis and real-time polymerase chain reaction for quantitative determination of mutant allele burden) are compared and discussed. We conclude that this detection of JAK2V617F mutant allele burden may be used for establishing possible correlation between clinical symptoms and hematologic abnormalities for patients suffering from myeloproliferative disorders.
Key words:
JAK2V617F, myeloproliferative disorders, real-time polymerase chain reaction, allelic discrimination, allele burden
Autoři: Z. Křístková; D. Dvořáková; F. Rázga; J. Pospíšilová; J. Kujíčková; M. Doubek; J. Mayer
Působiště autorů: Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika (IHOK), FN Brno a LF MU, kooperující pracoviště České leukemické skupiny – pro život (CELL , The CzEch Leukemia Study Group – for Life)
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 3, p. 143-148.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
K Ph-negativním chronickým myeloproliferativním onemocněním (CMPO) řadíme pravou polycytemii (PV), esenciální trombocytemii (ET) a primární idiopatickou myelofibrózu (IMF). Diagnostika CMPO je obtížná vzhledem k absenci jednoznačných diagnostických ukazatelů. Objev bodové mutace V617F v genu JAK2 (JAK2V617F) u velké části pacientů s CMPO znamenal velký pokrok v poznání vzniku onemocnění a uvedená somatická mutace je využívána v současnosti jako významný diagnostický prostředek k vyloučení sekundárních trombocytemií nebo erytrocytóz. V této práci je podán přehled a srovnání některých metod molekulární biologie, které nalezly uplatnění při vyšetření JAK2 genu. Jsou uvedeny rovněž vlastní zkušenosti se stanovením mutace JAK2V617F metodou alelické diskriminace a se stanovením alelické zátěže pomocí kvantitativní real-time polymerázové řetězové reakce. Stanovení alelické zátěže se může jevit jako přínosné jak pro sledování úspěšnosti chemoterapeutické léčby, tak i pro zkoumání možných korelací s klinickými symptomy či dalšími hematologickými abnormalitami vyskytujícími se u uvedené skupiny pacientů.
Klíčová slova:
JAK2V617F, myeloproliferativní onemocnění, real-time polymerázová řetězová reakce, alelická diskriminace, alelická zátěžÚvod
Chronická myeloproliferativní onemocnění (CMPO) představují skupinu hematologických chorob, které jsou charakteristické proliferací jednoho či více klonů myeloidní linie v kostní dřeni a nálezem zvýšeného počtu zralých a nezralých buněk v periferní krvi. Nejčastější molekulární příčinou CMPO jsou mutace genů kódujících tyrozinkinázy, např. fúzní gen BCR-ABL u nejfrekventovanějšího CMPO chronické myeloidní leukemie, charakterizované přítomností tzv. Filadelfského chromozomu (Ph). K Ph-negativním klasickým CMPO řadíme pravou polycytemii (PV), esenciální trombocytemii (ET) a primární idiopatickou myelofibrózu (IMF).
Gen JAK2
U pacientů s Ph-negativním CMPO objevilo nezávisle na sobě v roce 2005 několik výzkumných týmů somatickou mutaci V617F v genu JAK2 kódujícím Janusovu kinázu (1, 2, 3). JAK2 patří do rodiny cytoplazmatických JAK tyrozinkináz, které jsou součástí důležitých buněčných signálních kaskád. Janusovy kinázy byly pojmenovány podle římského boha Januse, boha dvou tváří, neboť obsahují ve své struktuře dvě symetrické, homologní kinázové domény: katalyticky aktivní JH1 doménu a téměř identickou JH2 doménu, která je enzymaticky inertní (4). Všechny čtyři JAK kinázy (JAK1, JAK2, JAK3, TYK2) obsahují sedm JH domén, které jsou rozděleny do čtyř oblastí: kinázové (JH1), pseudokinázové (JH2), FERM (N-koncová JH7, JH6, JH5 a část JH4) a SH2 (JH3 a část JH4). Úkolem pseudokinázové domény je negativně regulovat aktivitu JH1. Funkce FERM oblasti spočívá v interakci s receptorem (5). Gen JAK2 je lokalizován na chromozomu 9p24. Bodová mutace JAK2V617Fje substitučním nahrazením G ’T na pozici 1849 v exonu 14 genu JAK2, což má za následek záměnu valinu za fenylalanin v kodónu 617. JAK2V617F postihuje doménu JH2, která tímto ztrácí svou regulační funkci vůči kináze JH1 a důsledkem je konstitutivní aktivace JAK2 kinázy a aktivace JAK-STAT dráhy, která ovlivňuje proliferaci a přežití buňky (6).
Mutace JAK2V617F detekovatelná téměř u všech případů PV (90–95 %) umožnila charakterizovat PV na molekulární úrovni a usnadnila diagnostiku PV, i když patogeneze choroby zůstává stále ne zcela objasněná. Mutace JAK2V617F je však identifikována i u významné části pacientů s ET a PMF (40 – 50 %). Zde je významným přínosem k pochopení patologického procesu, ale samotná přítomnost mutace pro potvrzení diagnózy nestačí (7). Současná diagnostická kritéria pro stanovení PV, ET a PMF jsou uvedena v WHO klasifikaci malignit hematopoetického a lymfoidního systému z roku 2008 (8). Klinický význam a role JAK2V617F ve vzniku a progresi onemocnění se dále intenzivně zkoumá a ukazuje se, že úloha mutace v patogenezi CMPO je komplexnější a nemusí být primárně kauzativní (9, 10, 11). Hledají se např. souvislosti mezi alelickou zátěží JAK2V617F, prognostickými faktory a fenotypovým projevem onemocnění (stupeň myelofibrózy kostní dřeně, náchylnost k trombotickým stavům) (12). Byla publikována celá řada technik pro genotypizaci JAK2V617F s velmi odlišnou citlivostí stanovení.
Metody molekulární diagnostiky JAK2V617F
Jednou z prvních metod detekce JAK2V617F bylo stanovení polymorfismu délky restrikčních fragmentů u PCR produktů (PCR-RFLP) (2, 13), které je založeno na štěpení normální (wild type, wt) JAK2 alely pomocí restrikční endonukleázy BsaXI. Mutace JAK2V617F mění specifickou sekvenci restrikčního místa pro BsaXI, restrikční místo není rozeznáno a v tom případě PCR produkt není štěpen. Udávaná citlivost metody je 20 %, v hraničních případech je nutno potvrdit pozitivní nález jinou detekční technikou (14).
Přímé sekvenační techniky využívají PCR produktů amplifikované genomové DNA nebo komplementární DNA, které jsou templátem sekvenační PCR reakce. Různé pracovní skupiny dosahovaly citlivostí v rozmezí 10–30 % mutované alely, u nižších zastoupení mutované alely ve vzorku interferuje pozadí vyvolané normální JAK2 alelou (1, 3, 15). Pyrosekvenace je senzitivní metoda založená na uvolnění a detekci pyrofosfátu v okamžiku zařazení správného nukleotidu v průběhu sekvenační reakce (16, 17). Výhodou metody je prezentace dat v reálném čase a možnost semikvantitativního vyhodnocení. Citlivost metody je 5–10 % mutované alely. Nevýhodou je poměrně vysoká vstupní investice (automatizovaný systém PSQ HS 96, Biotage, Uppsala, Švédsko) i finanční nákladnost vlastní analýzy z hlediska klinické praxe. Jiný přístup k detekci JAK2V617F využívá denaturační vysokoúčinnou kapalinovou chromatografii (dHPLC) s citlivostí záchytu 1–2 % (18).
Základem mnoha publikovaných prací je alelově specifická polymerázová řetězová reakce (AS-PCR) (2), která používá společný reverzní primer a dvojici forward primerů, jeden specifický pro mutantní alelu a druhý pro normální alelu. Citlivost metody dosahuje kolem 5 %. Variantou AS-PCR je amplifikační refrakční mutační systém (ARMS). Citlivost stanovení touto technikou se udává od 3 do 0,01 % (19, 20). A právě vysoká citlivost dosažená těmito přístupy vedla k přehodnocení četnosti výskytu JAK2V617F u pacientů s PV. Původní výsledky získané přímou sekvenací uváděly frekvenci JAK2V617F u PV kolem 70 %, po rozšíření ARMS se tento údaj zvýšil na dnes udávané hodnoty kolem 90–95 %.
Kvantitativní real-time PCR (RQ-PCR) umožňuje amplifikovat cílový úsek DNA a současně detekovat vzniklý PCR produkt pomocí emitovaného fluorescenčního signálu, takže získáváme informaci o vstupním množství specifického templátu v analyzovaném vzorku. Detekční fluorescenční přístupy dělíme na specifické a nespecifické. K nespecifickým patří interkalační barviva (např. SYBR Green I dye), specifické systémy jsou představovány fluorescenčně značenými oligonukleotidovými sondami (např. hydrolyzační nebo hybridizační). TaqMan systém je založen na 5ę’ 3ę exonukleázové aktivitě Taq DNA polymerázy a její schopnosti uvolnit a hydrolyzovat sondu, která při PCR hybridizuje k cílovému úseku DNA. TaqMan sonda je krátký oligonukleotid, který má na jednom konci navázaný R-fluorofor (reporter), jenž excituje záření a na druhém konci Q-fluorofor (quencher – zhášeč), který díky vzájemné krátké vzdálenosti pohlcuje excitovanou energii (tzv. zháší R-fluorofor). Při hydrolýze sondy unikne R-fluorofor z vlivu Q-fluoroforu a následně dochází k emisi záření, které můžeme při vhodné vlnové délce měřit.
Druhý metodický přístup využívá hybridizační sondy ve spojení s termocyklerem LightCycler (LightCycler, Roche Applied Sciences, Indianapolis, USA). Dvě hybridizační sondy, z nichž je jedna značená pouze donorovým fluoroforem a druhá pouze akceptorovým fluoroforem, nasedají v těsné blízkosti vedle sebe (1 bp) a v důsledku této těsné pozice dochází k přenosu fluorescenční energie a k emisi záření, které je detekováno. Publikované citlivosti RQ-PCR metod se pohybují v rozmezí 2,5 až 0,01 % (21, 22, 23, 24, 25).
Vlastní zkušenosti s molekulární diagnostikou JAK2V617F
Na našem pracovišti používáme pro kvalitativní záchyt metodu alelické diskriminace pomocí real-time PCR založenou na použití dvou sond lišících se v místě bodové mutace V617F (11, 26, 27). Tuto metodu jsme dále modifikovali pro účely kvantitativního stanovení JAK2V617F.
Materiál a metodika
Separace granulocytů, izolace DNA
Výchozím materiálem bylo 5 ml nesrážlivé periferní krve (EDTA). Krev byla získána po informovaném souhlasu od 1036 pacientů suspektních pro CMPO. V pozici negativních kontrol byly použity odběry od 60 zdravých dobrovolníků. Separací pomocí hustotní gradientové centrifugace (Histopaque 1077/1119, Sigma, GmbH, Německo) byly získány granulocyty, ze kterých byla izolována DNA pomocí komerčního kitu (QIAamp Blood Mini kit, Qiagen, Hilden, Německo) podle výrobcem doporučeného postupu. Koncentrace DNA byla měřena spektrofotometrem ND-1000 (NanoDrop Technologies, Wilmington, DE, USA).
Kvalitativní stanovení JAK2V617F metodou alelické diskriminace
Metoda alelické diskriminace je založena na PCR amplifikaci s jedním párem primerů a se dvěma alelově specifickými sondami. Primery přiléhají k oblasti JAK2 genu, ve které je lokalizována potencionální mutace V617F a rozlišení mutované a nemutované alely je prováděno na základě oligonukleotidových sond, lišících se v místě mutace V617F: jedna je komplementární k normální JAK2 alele (R-fluorofor: FAM) a druhá k mutované JAK2V617F alele (R-fluorofor: HEX). Obě sondy mají na 3ękonci A2 zhášeč (Q-fluorofor) (Exiqon, Vedbaek, Dánsko). Ke zvýšení specifity a citlivosti byly do sond vmezeřeny uzamčené nukleové kyseliny. Jedná se o nukleotidy, jejichž ribózový kruh je ,,uzamčen” methylenovým můstkem mezi atomy 2ę-O a 4ę-C (Locked Nucleic Acid, LNA).
Vstupní množství genomové DNA do PCR analýzy bylo 100 ng. Celkový objem reakční směsi byl 20 μl: obsahoval 2 μl 10 x PCR Buffer (Abgene Limited, Epsom, Velká Británie), 3,2 μl MgCl2 (25 mM), 0,4 μl dNTPs (každý 10 mM), 1 μl forward a reverse primerů (každý 25 μM), 0,4 μl FAM-sondy a 0,4 μl HEX-sondy (každá 10 μM) a 0,2 μl ThermoStart DNA polymerázy 5 U/μl (Abgene Limited, Epsom, Velká Británie).
Sekvence použitých primerů a sond:
JAK2-RQ-F: (5ę - gaagcagcaagtatgatgagcaa - 3ę),
JAK2-RQ-R: (5ę - actgacacctagctgtgatcc - 3ę),
sonda JAK2wt: (5ę - FAM - tcCacAgaCaCatAc - A2 - 3ę),
sonda JAK2V617F: (5ę - HEX - ctcCacAgaAacAtaCtc - A2 - 3ę).
Kapitálky označují LNA nukleotidy.
Teplotní profil
Analýza byla provedena na cykleru RotorGene 3000 (Corbett Research, Mortlake, Austrálie). Signál z JAK2wt sondy byl snímán na kanále pro fluorofor FAM, signál z JAK2V617F sondy na kanále pro fluorofor HEX/JOE. Teplotní profil a časy: 8 min. při 95 °C, následně 55 cyklů denaturace 20 s při 95 °C a annealing/extenze 1 min. při 63 °C. Vyhodnocení bylo provedeno softwarem pro analýzu alelické diskriminace, který je součástí daného cykleru. Před každým měřením byla provedena autokalibrace při 63 °C.
Kvantitativní stanovení JAK2V617Fmetodou real-time PCR
Pro kvantitativní stanovení alelické zátěže JAK2V617F byla použita metoda absolutní kvantifikace pomocí dvou standardních křivek u souboru 60 pacientů nesoucích mutaci JAK2V617F. Standardní křivky byly vytvořeny amplifikací desítkového ředění dvou plazmidových DNA obsahujících sekvenci mutované alely JAK2V617F a normální alely JAK2wto známém počtu kopií v rozsahu 6 log (106 až 10 kopií na reakci). Vstupní množství genomové DNA do PCR analýzy je stejné, jako v případě analýzy alelickou diskriminací (100 ng), stejná je i sekvence a výsledná koncentrace oligonukleotidových primerů a obou LNA sond v reakci. DNA je amplifikována ve výsledném reakčním objemu 25 μl ve směsi ABsolute™ QPCR Mix (Abgene Limited, Epsom, Velká Británie). Teplotní profil reakce se opakuje v 50 cyklech: 95 ľC/15 s, 63 ľC/90 s a následuje po úvodní prodloužené denaturaci 95 ľC/15 min.
Počet kopií mutované a normální alely ve vyšetřovaném materiálu je odečítán ze standardních křivek, výsledek je vyjádřen jako procentuální zastoupení mutované alely JAK2V617F v celkovém počtu JAK2 alel podle vzorce JAK2V617F (%) = (počet kopií JAK2V617F/ počet kopií JAK2V617F + počet kopií JAK2wt)*100.
Výsledky
Výsledky genotypizace JAK2 pomocí alelické diskriminace měly tři možné výstupy. Pacient s normálním JAK2 genem vykazoval pouze signál z FAM – sondy (JAK2wt), ve druhém případě byl zaznamenán signál z obou sond anebo byl ve třetím případě detekován pouze signál z HEX – sondy (JAK2V617F) (obr. 1 A, B, C). Proměřením 60 kontrolních vzorků DNA JAK2V617F negativních zdravých osob byl stanoven diskriminační threshold na hodnotu 0,05 pro eliminaci velmi nízkého fluorescenčního signálu, který se může objevit jako důsledek nespecifické vazby sondy JAK2V617Fk normální alele. Citlivost metody byla testována na plazmidech obsahujících JAK2 normální a JAK2V617F alelu, které byly vzájemně naředěny v poměrech 5 %, 2 %, 1 %, 0,5 % zastoupení mutované alely. Mez detekce byla 1 % JAK2V617F alely, za mez stanovitelnosti byla zvolena detekce 2 % JAK2V617F alely. Sekvence obou plazmidů byla potvrzena kontrolní sekvenační analýzou. Reprodukovatelnost uvnitř stanovení (intra-assay) byla určena otestováním skupiny vzorků s různou hladinou mutace ve čtyřech paralelních reakcích (koeficient variability 1,9 %). Reprodukovatelnost mezi stanoveními (inter-assay) byla zjištěna otestováním 3 vzorků s různou alelickou zátěží JAK2V617F z 10 různých běhů (koeficient variability 2 %).
Obr. 1. Alelická diskriminace s použitím dvojice hybridizačních LNA -modifikovaných sond. FAM - sonda hybridizuje s normální sekvencí JAK2 genu (plná čára), HEX - sonda hybridizuje s mutovanou sekvencí JAK2<sup>V617F</sup> (tečkovaná čára). Vzorek DNA V617F negativního pacienta obsahující pouze normální sekvenci JAK2 vykazuje signál jen FAM - sondy (A). U pacienta B je zachycen signál obou sond a u DNA pacienta C je detekován signál jen s HEX - sondou. 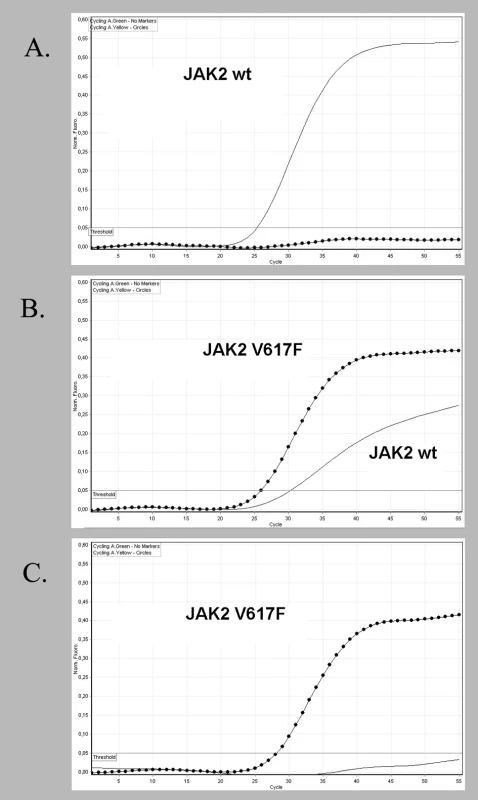
Pro přesnou kvantitativní analýzu alelické zátěže byla použita absolutní kvantifikace se dvěma standardními křivkami. Reprodukovatelná senzitivita metody je 10 kopií JAK2V617F a 10 kopií JAK2wtna reakci a tato byla potvrzena i titračním ředěním JAK2V617F pozitivní DNA do JAK2V617F negativní DNA. Amplifikační účinnost (E) pro alelu JAK2V617F i JAK2wt je prakticky shodná a dosahuje hodnoty 0,99.
U dvaceti vzorků DNA od pacientů s různou alelickou zátěží (0,1–96,7 %; medián 8,1 %) a u dvaceti negativních kontrolních DNA (0 %) byl proveden srovnávací test s využitím komerčního kitu JAK2 MutaQuant Kit (Ipsogen, Marseille, Francie). Výsledky byly plně srovnatelné u obou analýz.
Diskuse
I když průkaz mutace JAK2V617Fnemůže v současné chvíli sloužit ke vzájemnému odlišení uvedených CMPO, je bezesporu velkým diagnostickým přínosem, neboť přítomnost tohoto klonálního markeru umožňuje vyloučení reaktivní trombocytózy nebo myelofibrózy (7). Na našem pracovišti používáme kvalitativní stanovení JAK2V617F metodou alelické diskriminace v kombinaci s kvantitativním měřením alelické zátěže JAK2V617F.Dosažená citlivost kvalitativní analýzy (2 % mutované alely) a uspokojivé údaje o variabilitě (koeficient variability 2 %) potvrzují robustnost metody a její uplatnění v pozici rychlé diagnostické techniky. Musíme vyzdvihnout také jednoduchost a rychlost celé analýzy, důležité aspekty každého rutinního vyšetření. Častým problémem alelově specifických PCR analýz bývá nestejná amplifikační účinnost při amplifikaci mutované a nemutované alely. Proto jsme pro přesnou kvantifikaci alelické zátěže JAK2V617Fzavedli real-time PCR se dvěma standardními křivkami s reprodukovatelnou citlivostí 10 kopií JAK2V617Fa 10 kopií JAK2wt na reakci. Tato metoda byla optimalizována tak, aby amplifikační účinnost pro mutovanou i nemutovanou alelu dosahovala stejných hodnot (E = 0,99). Důležitým faktorem ovlivňujícím citlivost stanovení je výběr biologického materiálu. CMPO jsou charakterizovány klonální proliferací jedné nebo několika myeloidních linií, ale mutace JAK2V617F byla detekována nejenom v purifikovaných hematopoetických kmenových buňkách a ve všech myeloidních liniích periferní krve (28), ale také s rozdílným zastoupením v lymfoidních buňkách. V periferní krvi je však nejvyšší zastoupení v granulocytech (76–100 %), krevních destičkách (51–75 %) a monocytech (26–50 %), zatímco zastoupení v lymfoidních řadách bylo detekováno pouze v jednotkách procent (29, 30). Pokud budeme testovat celkové periferní leukocyty, získáme DNA i z B a T lymfocytů, ve kterých byla mutace prokázána jen v nepatrném zastoupení a změny v zastoupení krevních buněk mohou ovlivnit relativní množství JAK2V617F ve vzorku testované DNA. Z tohoto důvodu se obecně doporučuje izolovat DNA ze separovaných granulocytů z periferní krve. Je třeba si také uvědomit, že termín „heterozygotní pro JAK2V617F“ není zcela přesný, protože zvláště u pacientů s PV bylo zjištěno, že na úrovni progenitorových buněk mohou mít tito pacienti proměnlivý podíl buněk heterozygotních, homozygotních a buněk nesoucích normální JAK2 gen (31). Někteří autoři udávají, že alelický poměr vyšší než 50 % mutované alely indikuje přítomnost granulocytární populace homozygotní pro JAK2V617F (32). Pro vysvětlení role JAK2V617F v klonálním vývoji myeloproliferativní choroby byl navržen dvoustupňový model (3). První krok představuje vznik somatické mutace G’T v jedné alele JAK2 genu ve stadiu hematopoetické progenitorové buňky nebo kmenové buňky. Takto zmutovaná buňka je základem heterozygotního klonu, který svou expanzí vytlačuje hematopoetické buňky bez mutace v JAK2. Druhý krok představuje mitotickou rekombinaci v jedné progenitorové nebo kmenové buňce heterozygotní pro JAK2V617F, která navodí prostřednictvím uniparentální dizomie homozygozitu pro mutaci u jedné ze dvou dceřiných buněk. Tato dceřiná buňka je pak základem klonu homozygotního pro JAK2V617F. Homozygotní JAK2 mutace bývá častěji zachycena u diagnóz PV a IMF než u ET a je spjata s delší historií onemocnění než heterozygotní mutace. Homozygotní genotyp koreluje s agresivnějším průběhem choroby a mohl by nepřímo indikovat suboptimální výsledek léčby (33).
Námi zavedená kvantitativní metoda je dostatečně specifická a citlivá pro sledování úspěšnosti terapie u pacientů s CMPO a pro zkoumání možných korelací mezi alelickou zátěží JAK2V617F a četností klinických symptomů charakterizujících uvedené diagnózy. Metoda stanovení alelické zátěže rozšiřuje možnosti aplikace metod molekulární diagnostiky v oblasti hematologie.
Práce byla podpořena grantem MSM0021622430.
Ing. Dana Dvořáková, CSc.
Centrum molekulární biologie a genové terapie
Interní hematoonkologická klinikaFN Brno
Černopolní 9
625 00 BRNO
Doručeno do redakce: 1. 12. 2008
Přijato: 19. 5. 2009
Zdroje
1. James C, Ugo V, Le Couedic J-P, et al. A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature 2005; 434 : 1144-1148.
2. Baxter EJ, Scott LM, et al. Acquired mutation of tyrosine kinase JAK2 in human myeloproliferative disorders. Lancet 2005; 365 : 1054-1061.
3. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Eng J Med 2005; 352 : 1779-1790.
4. Saharinen P, Silvennoinen O. The pseudokinase domain is required for suppression of basal activity of JAK2 and JAK3 tyrosine kinases and for cytokine-inducible activation of signal transduction. J Biol Chem 2002; 277 : 47954-47963.
5. Schindler C, Levy DE, Decker T. JAK-STAT signaling: from interferons to cytokines. J Biol Chem 2007; 282 : 20059-20063.
6. Delhommeau F, Pisani DF, James C, Casadevall N, Vainchenker W, et al. Oncogenic mechanisms in myeloproliferative disorders. Cell Mol Life Sci 2006; 63 : 2939-2953.
7. Tefferi A, Vardiman JW. Classification and diagnosis of myeloproliferative neoplasms: the 2008 World Health Organization criteria and point-of-care diagnostic algorithms. Leukemia 2008; 22 : 14-22.
8. Swerdlow SH, Campo E, Harris NL, Jaffe ES, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC Press: Lyon, France, 2008, 1-439.
9. Kralovics R, Teo S, Li S, Theocharides A, Buser AS Tichelli A, Skoda RC. Acquisition of V617F mutation of JAK2 is a late genetic event in a subset of patients with myeloproliferative disorders. Blood 2006; 108 : 1377-1380.
10. Nussenzveig RH, Swierczek SI, Jelinek J, Gaikwad A, et al. Polycythemia vera is not initiated by JAK2V617F mutation. Experimental Hematology 2007; 35 : 32-38.
11. Veselovska J, Pospisilova D, Pekova S, et al. Most pediatric patients with essential trombocythemia show hypersensitivity to erythropoietin in vitro, with rare JAK2 V617F-positive erythroid colonies. Leukemia Research 2008; 32 : 369-377.
12. Tefferi A, Lasho TL, Schwager SM, et al. The clinical phenotype of wild-type, heterozygous and homozygous JAK2 V17F in polycythemia vera. Cancer 2006; 106(3): 631-635.
13. Vannucchi AM, Antoniolo E, Guglielmeli P, et al. Prospective identification of high-risk polycythemia vera patients based on JAK2V617F allele burden. Leukemia 2007; 21 : 1952-1959.
14. Poodt J, Fijnheer R, Walsh IBB, Hermans MHA. A sensitive and reliable semi-quantitative real-time PCR assay to detect JAK2 V617F in blood. Hem Oncology 2006; 24 : 227-233.
15. Steensma DP, Dewald GW, Lasho TL, et al. The JAK2 V617F activating tyrosine kinase mutation is an infrequent event in both “atypical” myeloproliferative disorders and myelodysplastic syndromes. Blood 2005; 106 : 1207–1209.
16. Jelinek J, Oki Y, Gharibyan V, et al. JAK2 mutation 1849G>T is rare in acute leukemias but can be found in CMML, Philadelphia chromosome-negative CML, and megakaryocytic leukemia. Blood 2005; 106 : 3370–3373.
17. Jones AV, Kreil S, Zoi K, et al. Widespread occurrence of the JAK2 V617F mutation in chronic myeloproliferative disorders. Blood 2005; 106 : 2162–2168.
18. Sattler M, Walz C, Crowley BJ, et al. A sensitive high-throughput method to detect activating mutations of JAK2 in peripheral-blood samples. Blood 2006; 107 : 1237-1238.
19. McClure R, Mai M, Lasho T. Validation of two clinically useful assays for evalution of JAK2 V617F mutation in chronic myeloproliferative disorders. Leukemia 2006; 20 : 168-171.
20. Chen Q, Lu P, Jones AV. Amplification refractory mutation system, a highly sensitive and simple polymerase chain reaction assay, for the detection of JAK2 V617F mutation in chronic myeloproliferative disorders. J Mol Diagn 2007; 9(2): 272–276.
21. Antonioli E, Guglielmeli P, Poli G, et al. Influence of JAK2V617F allele burden on phenotype in essential trombocythemia. Haematologica 2008; 93(1): 41-48.
22. Wolstencroft EC, Hanlon K, Harries LW, et al. Development of a quantitative real-time polymerase chain reaction assay for the detection of the JAK2 V617F mutation. J Mol Diag 2007; 9(1): 42-46.
23. Kröger N, Badbaran A, Holler E, et al. Monitoring of the JAK2-V617F mutation by highly sensitive quantitative real-time PCR after allogeneic stem cell transplantation in patients with myelofibrosis. Blood 2007; 109(3): 1316-1321.
24. Hammond E, Shaw K, Carnley B, Png S, James I, Herrmann R. Quantitative determination of JAK2 V617F by TaqMan: An absolute measure of averaged copies per cell that may be associated with the different types of myeloproliferative disorders. J Mol Diagn 2007; 9(2): 242-8.
25. Murugesan G, Aboudola S, Szpurka H, et al. Identification of JAK2 V617F mutation in chronic myeloproliferative disorders using FRET probes and melting curve analysis. Am J Clin Pathol 2006; 125 : 625-633.
26. Pekova S, Hoffmann R, Jindra P, Novakova L, et al. Mutation JAK2 V617F in patients with myeloproliferative disorders and technical aspects of its detection. Blood 2006; 108 : 313B.
27. Marková J, Průková D, Volková Z, Schwarz J. A new allelic discrimination assay using locked nucleic acid-modified nucleotides (LNA) probes for detection of JAK2 V617F mutation. Leuk Lymphoma 2007; 48(3): 636-639.
28. Lasho TL, Mesa R, Gilliland DG, et al. Mutation studies in CD3+, CD19+ and CD34+ cell fractions in myeloproliferative disorders with homozygous JAK2(V617F) in granulocytes. Br J Haematol 2005; 130 : 797-799.
29. Delhommeau F, Dupont S, Tonetti C, Massé A, et al. Evidence that JAK2 G1849T (V617F) mutation occurs in a lymphomyeloid progenitor in polycythemia vera and idiopathic myelofibrosis. Blood 2007; 109 : 71-77.
30. Li S, Kralovics R, De Libero G, Theocharides A, et al. Clonal heterogeneity in polycythemia vera patients with JAK2 exon 12 and Jak2-V617F mutations. Blood 2008; 111 : 3863-3866.
31. Scott LM, Scott MA, Campbell PJ, Green AR. Progenitors homozygous for the V617F mutation occur in most patients with polycythemia vera, but not essential thrombocythemia. Blood 2006; 108 : 2435-2437.
32. Lippert E, Boissinot M, Kralovics R, Girodon F, et al. The JAK2-V617F mutation is frequently present at diagnosis in patients with essential thrombocythemia and polycythemia vera. Blood 2006; 108 : 1865-1867.
33. Schnittger S, Bacher U, Kern W, Haferlach C. JAK2V617F as progression marker in CMPD and as cooperative mutation in AML with trisomy 8 and t(8;21): a comparative study on 1130 CMPD and 269 AML cases. Leukemia 2007; 21 : 1843-1845.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Vzdělávací akce IPVZČlánek Bude syntetická lidská krev?
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Cievny endotelový rastový faktor u osôb s diabetom 2. typu
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
- Vzdělávací akce IPVZ
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Činnost nemocniční transfuzní služby v České republice v roce 2008
- XXIII. Olomoucké hematologické dny s mezinárodní účastí
- Bude syntetická lidská krev?
- Paroxysmal nocturnal hemoglobinuria: natural history of disease subcategories
- Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera
- Sirolimus is associated with veno-occlusive disease of the liver after myeloablative allogeneic stem cell transplantation
- Thalidomide and rituximab in Waldenstrom macroglobulinemia
- Aktuální informace k nomenklatuře HLA systému
- Autotransfuze v České republice v roce 2008
- MUDr. Libuše Novosadová čestnou členkou České hematologické společnosti ČLS JEP
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



