-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
Successful treatment of early molecular relapse of variant form of secondary acute promyelocytic leukemia with arsenic trioxide
We describe the case of young woman with variant form of acute promyelocytic leukemia, who achieved complete molecular remission after the primotherapy according to GIMEMA/EORTC 06952 protocol. Molecular relapse was revealed early (3 months) after maintenance therapy initiation. The induction treatment with arsenic trioxide was administered, followed by two cycles of consolidation treatment combining arsenic trioxide and all-trans retinoic acid. The patient achieved the second molecular remission of leukemia and allogeneic transplantation of hematopoietic stem cells was performed subsequently.
Key words:
acute promyelocytic leukemia, variant form, molecular relapse, arsenic trioxide
Autoři: T. Szotkowski; J. Hubáček; K. Indrák
Působiště autorů: Hemato-onkologická klinika FN a LF UP Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 3, p. 148-150.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Popsán kazuistický případ mladé nemocné s variantní formou akutní promyelocytární leukemie, která po primoterapii podle GIMEMA/EORTC 06952 protokolu dosáhla kompletní molekulární remisi. Časně, 3 měsíce po zahájení udržovací terapie, byl zjištěn molekulární relaps onemocnění. Nemocná byla léčena indukční terapií s oxidem arsenitým a poté dvěma cykly konsolidační léčby kombinující oxid arsenitý a all-trans-retinovou kyselinu. Dosáhla druhé molekulární remise onemocnění a následně podstoupila alogenní transplantaci krvetvorných buněk, po které přetrvává molekulární remise choroby.
Klíčová slova:
akutní promyelocytární leukemie, variantní forma, molekulární relaps, oxid arsenitýÚvod
Akutní promyelocytární leukemie (APL) představuje v naší geografické oblasti 7–10 % z celkového počtu akutních myeloidních leukemií (AML) dospělých. Jde o prognosticky nejpříznivější variantu AML, která je v éře all-trans-retinové kyseliny (ATRA) u většiny nemocných vyléčitelná. Relapsy APL po této léčbě nejsou časté a doporučení pro jejich léčbu nejsou, vzhledem k malému počtu těchto nemocných, zatím jednotná. Jednou z účinných modalit léčby relabujícího onemocnění je oxid arsenitý (ATO = arsenic trioxide). V monoterapii tímto lékem přesahuje pravděpodobnost dosažení remise 80 % (1).
Popis případu
32letá žena byla v červenci 2007 přijata na Hemato--onkologickou kliniku Fakultní nemocnice Olomouc s týdenní anamnézou krvácivých projevů (kožních, slizničních). V krevním obraze byla přítomna lehká normocytární anémie (Hb 117 g/l, MCV 85 fl), leukocytóza (15,9 x 109/l) a trombocytopenie (16 x 109/l), s nálezem atypických blastů a promyelocytů v nátěrech periferní krve (obr. 1, 2). Na základě morfologického, klinického a laboratorního nálezu (koagulačně zjištěna i hypofibrinogenemie 0,83 g/l) bylo vysloveno podezření na variantní formu APL. Tato diagnóza byla potvrzena metodami cytogenetiky a molekulární genetiky (metodou FISH i PCR), pomocí nichž byla detekována reciproká translokace t(15;17)(q22;q21) se vznikem fúzního genu PML/RARα. Jednalo se o sekundární akutní leukemii, nemocná byla v 5 předchozích letech opakovaně léčena aplikací radiojódu pro relabující papilární karcinom štítné žlázy.
Obr. 1. Blast, atypický promyelocyt a monocyt. 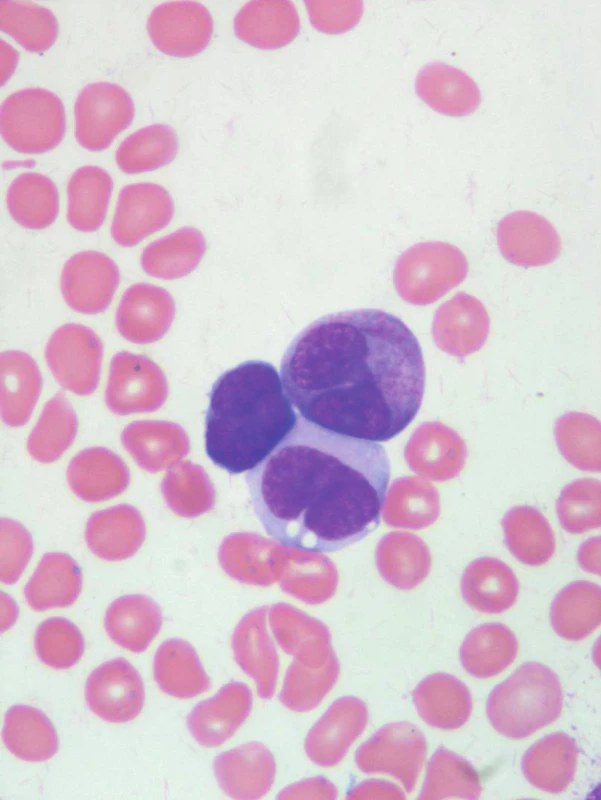
Obr. 2. Atypické promyelocyty, schistocyty. 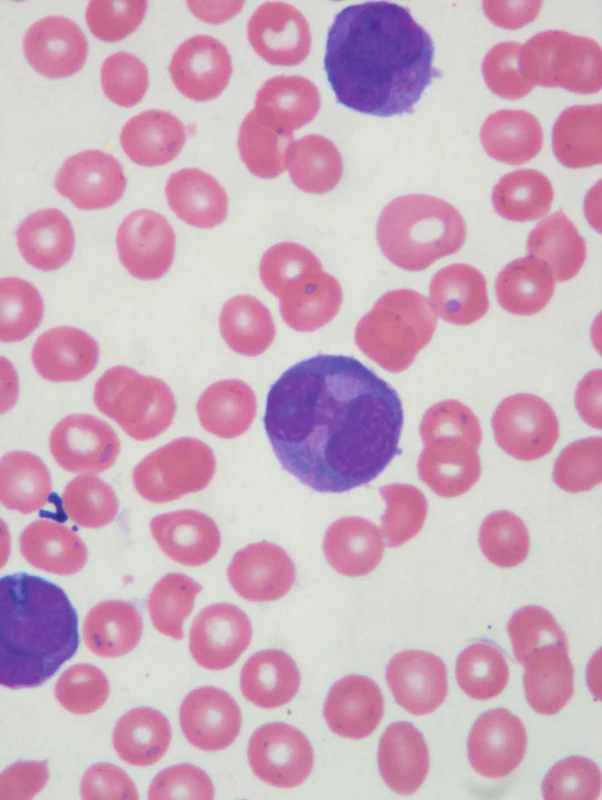
Nemocná byla na HOK léčena kombinací all-trans-retinové kyseliny a chemoterapie podle protokolu GIMEMA/EORTC 06952 (tab. 1). Již po indukční léčbě dosáhla kompletní molekulárně-genetické remise. Podle protokolu byly podány tři cykly konsolidační chemoterapie. Trvání molekulárně-genetické remise v kostní dřeni bylo verifikováno i po ukončení konsolidační léčby a v březnu 2008 proto byla zahájena udržovací terapie (ATRA 45 mg/m2/d 15 dnů á 3 měsíce).
Tab. 1. Protokol léčby APL podle protokolu GIMEMA/EORTC 06952. 
Před podáním druhého cyklu udržovací léčby v červnu 2008 byl proveden rutinní odběr periferní krve na detekci reziduální nemoci. Překvapivě byla zjištěna pozitivita kvalitativní nested RT-PCR na detekci PML/RARa v obou kolech reakce. Pozitivita byla následně konfirmována vyšetřením kostní dřeně se stejným výsledkem. Hematologický relaps nebyl vyšetřením kostní dřeně zjištěn – šlo o molekulární relaps onemocnění. Nemocná byla indikována k léčbě oxidem arsenitým – ATO (Trisenox®), která byla podána podle doporučení Evropské APL skupiny expertů z prosince 2007 (1). Indukční terapie byla podávána 5 týdnů, vždy 5 dnů v týdnu (dny 1–5, 8–12, 15–19, 22–26, 29–33), ve formě dvouhodinové nitrožilní infuze v dávce 0,15 mg/kg/den. Léčba proběhla bez závažných komplikací, bez projevů toxicity oxidu arsenitého, bez významné cytopenie. Jedinou komplikací byla kanylová sepse během indukční léčby. Po indukci bylo provedeno kontrolní vyšetření kostní dřeně na reziduální nemoc pomocí nested RT-PCR, pomocí které byla detekována slabá pozitivita reakce ve druhém kole. Poté byla podána konsolidační terapie kombinující oxid arsenitý (ve stejném časování a dávkách jako v indukci) a ATRA (45 mg/m2/d dny 1–33). Po této léčbě již bylo dosaženo kompletní molekulární remise APL. Následně byla nemocná vzhledem k faktu, že šlo o časný relaps sekundární malignity indikována k provedení alogenní transplantace krvetvorných buněk. Z důvodu vnějšími okolnostmi způsobené časové prodlevy mezi konsolidační léčbou a transplantací (cca 3 měsíce) byl podán ještě 1 cyklus konsolidační léčby, opět podle doporučení Evropské APL skupiny pro postkonsolidační léčbu – ATO 0,15 mg/kg/d, dny 1–5, 8–12 + ATRA 45 mg/m2/d dny 1–14.
V době odeslání kazuistiky k publikaci je nemocná 50 dnů po transplantaci, která proběhla bez závažných komplikací, je v ambulantní péči a molekulárně geneticky bylo verifikováno dosažení kompletního 100% chimerismu.
Diskuse
K relapsu APL dochází podle literárních údajů nejčastěji (cca u 20–30 %) u nemocných s vysokým rizikem podle Sanze, tj. s leukocytózou při stanovení diagnózy (2). Léčba byla před érou ATO založena na podání ATRA a chemoterapie, s případným následným provedením transplantace krvetvorných buněk. Objev výrazných účinků ATO na leukemické buňky APL změnil léčebný přístup k relabujícím nemocným. Léčba relapsu užitím ATO navodí kompletní remisi v 80–90 % případů (3, 4, 5). Aktuálně platná doporučení pro léčbu těchto nemocných obsahují podání ATO samostatně v indukci a v kombinaci s ATRA v konsolidaci. Otázka následné terapie nebyla zatím z důvodu nedostatečně početných souborů nemocných v této situaci uspokojivě vyřešena. Vždy je doporučeno zvážit provedení transplantace krvetvorných buněk, případně pokračování v konsolidační terapii ATO příp. s ATRA (2, 6). Mezi faktory, které je nutno brát v úvahu při rozhodování o postupu následné léčby jsou přetrvávající přítomnost minimální reziduální nemoci, interval mezi vznikem relapsu a ukončením předchozí léčby, dostupnost dárce, věk a přidružené choroby.
Zahájení léčby je v každém případě indikováno již v době molekulárního relapsu, protože bez terapie by nevyhnutelně došlo ke vzniku floridního onemocnění se všemi riziky a komplikacemi.
Sekundární APL tvoří 5–22 % všech APL (6), vznikají nejčastěji po léčbě karcinomu prsu a nehodgkinských lymfomů. Nejčastější skupinou leukemogenních léků spojovaných s následným vznikem APL jsou zmiňovány inhibitory topoizomerázy II. Incidence sekundárních APL v poslední době mírně narůstá, což je dáváno do souvislosti s častějším používáním právě této lékové skupiny. Na rozdíl od všech ostatních akutních myeloidních leukemií nejsou výsledky léčby sekundárních forem APL horší než u primárních onemocnění (7).
V našem souboru 45 nemocných léčených kombinací ATRA + chemoterapie jsme od roku 1993 zaznamenali 5 relapsů (11,1 %), z nichž 3 byly molekulární a 2 hematologické. Na vzniku 1 z nich se navíc podílela i modifikace a redukce primární léčby způsobená špatnou spoluprací mentálně postiženého pacienta. Kromě tohoto a výše popisovaného případu došlo k relapsu u 2 nemocných s nízkým rizikem a u 1 nemocného se středním rizikem podle Sanze, což není v souladu s literárními údaji, ale může to být ovlivněno chybou malých čísel. Kromě poslední nemocné šlo vždy o pozdní relapsy – po více než rok trvající kompletní remisi.
K relapsu došlo jen u 1 nemocné ze 4 se sekundární formou APL.
Doposud všechny relapsy (kromě zmíněného mentálně postiženého a nespolupracujícího pacienta) jsme úspěšně vyřešili podáním identické léčby, jaká byla použita v primoléčbě – tedy kombinací ATRA a chemoterapie podle GIMEMA/EORTC protokolu, u 1 nemocné navíc s následnou autologní transplantací krvetvorných buněk. Všichni nemocní žijí v dlouhotrvající 2. KR (15, 6 a 5 let).
Popisovaná kazuistika relapsu se od předchozích odlišuje – relaps vznikl časně po dokončení konsolidační léčby, na udržovací léčbě ATRA, což svědčilo pro pravděpodobný rozvoj rezistence k tomuto léku. Podle aktuálně platných doporučení (2) byla tedy nemocná indikována k podání léčby ATO, která bez významných komplikací a nežádoucích účinků vedla k dosažení 2. molekulární remise. Vzhledem k věku, dostupnosti dárce (dobrovolný HLA-identický dárce z registru), s přihlédnutím k názoru nemocné a sekundaritě leukemie (byť podle literárních údajů (7) i našich zkušeností tento fakt zřejmě neovlivňuje prognózu nemocných s APL) byla indikována alogenní transplantace.
V souvislosti s popisovaným případem je potřeba zdůraznit význam monitorování nemocných s APL na přítomnost reziduální choroby pomocí RT-PCR. Díky pravidelnému vyšetřování našich nemocných po ukončení konsolidační terapie (co 3 měsíce) byli zachyceni již 3 nemocní s molekulárním relapsem, jejichž léčba proběhla podle předpokladů s minimem komplikací a nežádoucích účinků ve srovnání s léčbou floridního hematologického relapsu, ke kterému by bez včasné léčby nevyhnutelně došlo. Doporučováno je monitorovat přítomnost reziduální choroby v kostní dřeni co 3 měsíce po dobu 3 let od dokončení konsolidační terapie, kdy je výskyt relapsů nejvyšší. Na našem pracovišti provádíme toto pravidelné monitorování v obdobném časovém harmonogramu, ale vyšetřením periferní krve, což se podle našich zkušeností zdá být dostatečně senzitivní – u všech takto monitorovaných nemocných byl relaps zachycen ve formě relapsu molekulárního. K hematologickému relapsu došlo pouze u již zmíněného nemocného, jehož léčba i sledování byly výrazně negativně poznamenány nespoluprácí a pak u nemocné 5 let po dosažení 1. kompletní remise, která již nebyla takto intenzivně monitorována. Vyšetření kostní dřeně pak vždy provádíme ke konfirmaci pozitivního nálezu v periferní krvi.
Vypracováno s podporou grantu IGA MZ ČR NR/9481-3 a výzkumného záměru MŠMT ČR 6198959205.
MUDr. Tomáš Szotkowski
Hemato-onkologická klinika FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
tszotkowski@seznam.cz
Doručeno do redakce: 3. 4. 2009
Přijato: 16. 7. 2009
Zdroje
1. Amadori S, Buechner T, Burnett A, Cimino G, Doehner H, Fenaux P, Lengfelder E, Lo-Coco F, Lowenberg B, Sanz M. European recommendation for salvage therapy of relapsed acute promyelocytic leukemia (APL) including arsenic trioxide (ATO). 12.12.2007 http://www.scribd.com/doc/5442262/European-recommendation-for-salvage-therapy-of-relapsed-acute-promyelocytic-leukemia-APL-including-arsenic-trioxide-ATO.
2. Tallman MS. What is the role of arsenic in newly diagnosed APL? Best Prac Res Clin Haematol 2008; 21 (4): 659–666.
3. Lazo G, Kantarjian H, Estey E, Thomas D, O’Brien S, Cortes J. Use of arsenic trioxide (As2O3) in the treatment of patients with acute promyelocytic leukemia: the M. D. Anderson experience. Cancer 2003; 97(9): 2218–24.
4. Raffoux E, Rousselot P, Poupon J, Daniel MT, Cassinat B, Delarue R, Taksin AL, Réa D, Buzyn A, Tibi A, Lebbé G, Cimerman P, Chomienne C, Fermand JP, de Thé H, Degos L, Hermine O, Dombret H. Combined treatment with arsenic trioxide and all-trans-retinoic acid in patients with relapsed acute promyelocytic leukemia. J Clin Oncol 2003 Jun 15; 21(12): 2326–34.
5. Tallman MS. Treatment of relapsed or refractory acute promyelocytic leukemia. Best Pract Res Clin Haematol 2007; 20 : 57–65.
6. Sanz MA, Grimwade D, Tallman MS, Lowenberg B, Fenaux P, Estey EH, Naoe T, Lengfelder E, Büchner T, Döhner H, Burnett AK, Lo-Coco F. Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2009; 113 (9): 1875–1891.
7. Beaumont M, Sanz M, Carli PM. Therapy-Related Acute Promyelocytic Leukemia. J Clin Oncol 2003; 21 : 2123–2137.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Vzdělávací akce IPVZČlánek Bude syntetická lidská krev?
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Cievny endotelový rastový faktor u osôb s diabetom 2. typu
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
- Vzdělávací akce IPVZ
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Činnost nemocniční transfuzní služby v České republice v roce 2008
- XXIII. Olomoucké hematologické dny s mezinárodní účastí
- Bude syntetická lidská krev?
- Paroxysmal nocturnal hemoglobinuria: natural history of disease subcategories
- Pegylated interferon-alfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera
- Sirolimus is associated with veno-occlusive disease of the liver after myeloablative allogeneic stem cell transplantation
- Thalidomide and rituximab in Waldenstrom macroglobulinemia
- Aktuální informace k nomenklatuře HLA systému
- Autotransfuze v České republice v roce 2008
- MUDr. Libuše Novosadová čestnou členkou České hematologické společnosti ČLS JEP
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



