-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Robotická distální pankreatektomie − první zkušenosti
Robotic distal pancreatectomy – the first experience
Introduction: Minimally invasive distal pancreatectomy (MIDP) includes both laparoscopic and robotic distal pancreatectomy (RDP). MIDP is often adopted first due to the absence of the requirement of a complex reconstruction. In recent years, an increase in the use of robotic surgery has been noted.
Methods: The authors present initial experience with RDP and retrospective analysis of data from prospectively collected database.
Results: Between September 2021 and October 2022 five patients undergoing RDP with splenectomy performed in the 3rd Department of Surgery, 1st Faculty of Medicine, Charles University and Motol University Hospital were included from a prospectively maintained database. The age was from 20 to 70 years. No conversion was required. One patient underwent reoperation due to staple-line hemorrhage. Postoperative hospital stay was from 4 to 14 days. The follow-up period was from 2 to 14 months.
Conclusion: Our first experience demonstrates RDP is a safe and efficacious approach for tumors of pancreatic body and tail in selected patients. A larger number of patients is needed to obtain more accurate results.
Keywords:
minimally invasive distal pancreatectomy – MIDP – robotic distal pancreatectomy – RDP
Autoři: S. Jaroščiaková; J. Tvrdoň; P. Hladík; T. Haruštiak; M. Podhráský; R. Lischke
Působiště autorů: III. chirurgická klinika, 1. lékařská fakulta Univerzity Karlovy, Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Rozhl. Chir., 2023, roč. 102, č. 3, s. 125-129.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2023.102.3.125–129Souhrn
Úvod: Minimálně invazivní distální pankreatektomie (MIDP) zahrnuje laparoskopickou a robotickou distální pankreatektomii (RDP). MIDP je často první adaptovanou minimálně invazivní operací pankreatu z důvodu absence rekonstrukční fáze. V posledních letech se dostává do popředí robotická chirurgie.
Metody: Autoři prezentují první zkušenosti s RDP a výsledky pilotního souboru pacientů retrospektivně zhodnocené z prospektivně vedené databáze.
Výsledky: Od září 2021 do října 2022 byla na III. chirurgické klinice 1. LF UK a FN v Motole provedena RDP u 5 pacientů. Pacienti byli ve věku 20 až 70 let. Všem byla provedena splenektomie. Konverzi nevyžadovala žádná z operací. Jeden pacient byl reoperován pro krvácení ze staplerové linie. Doba hospitalizace byla 4−14 dnů a celková doba sledování byla 2−14 měsíců.
Závěr: Podle našich prvotních zkušeností RDP je bezpečným a účinným chirurgickým přístupem pro léčbu tumorů těla a kaudy pankreatu u selektované skupiny pacientů. Exaktní zhodnocení vlastních výsledků bude možné až na větším souboru pacientů.
Klíčová slova:
minimálně invazivní distální pankreatektomie – MIDP – robotická distální pankreatektomie – RDP
ÚVOD
Od prvního provedení distální pankreatektomie na konci 19. století došlo k technologickému pokroku a rozvoji minimálně invazivní chirurgie [1]. Adaptace minimálně invazivního přístupu v chirurgii pankreatu nebyla tak progresivní jako u jiných typů gastrointestinální chirurgie [2]. Jedním z důvodů je anatomická lokalizace pankreatu v retroperitoneu, blízký vztah k velkým cévním strukturám a složitost operativy. V roce 2020 byly publikovány první mezinárodní guidelines pro minimálně invazivní resekce pankreatu (The Miami international evidence-based guidelines on minimally invasive pancreas resection) pojednávající o výběru pacientů, tréninku a tzv. learning curve, minimálním ročním počtu výkonů v centrech s cílem zajistit optimální výsledky a bezpečnost pacientů [3]. Minimálně invazivní distální pankreatektomie (MIDP) zahrnuje laparoskopickou (LDP) a robotickou distální pankreatektomii (RDP). MIDP je považována za bezpečnou a účinnou metodu pro léčbu ložiskových procesů těla a kaudy pankreatu [3]. V posledních letech se dostává do popředí robotická chirurgie. První RDP byla provedena Melvinem v roce 2003 [4]. Proti laparoskopii robotická chirurgie využívá trojdimenzionální vidění a sofistikovanější nástroje, které umožňují precizní pohyb s filtrací tremoru [2]. Cílem práce je prezentovat naše první zkušenosti s RDP a krátký přehled literatury.
METODY
Pacienti
Od září 2021 do října 2022 jsme na III. chirurgické klinice 1. LF UK a FN v Motole provedli RDP se splenektomií celkem u 5 pacientů pro benigní a maligní tumory. V rámci stagingu všichni pacienti podstoupili výpočetní tomografii (CT) nebo pozitronovou emisní tomografii (PET/CT). Doplňujícím vyšetřením byla magnetická rezonance (3 pacienti) a endosonografické vyšetření (EUS) pankreatu (4 pacienti). Dva pacienti měli diagnózu stanovenou před operací pomocí jehlové biopsie pod EUS kontrolou. Všem pacientům byla doporučena primární operace multidisciplinárním týmem. U pacientů jsme hodnotili kondici podle ASA (The American Society of Anesthesiologists) klasifikace [5], délku operačního času, krevní ztráty, perioperační a pooperační komplikace podle Clavien-Dindo klasifikace [6] a výskyt pooperačních komplikací specifických pro chirurgii pankreatu – pooperační pankreatická píštěl (postoperative pancreatic fistula – POPF) po 3. pooperačním dnu [7] a postpankreatektomická hemoragie (PPH) [8] podle doporučení mezinárodní skupiny pro pankreatickou chirurgii (ISGPS – The International Study Group of Pancreatic Surgery).
Operační technika
Pro RDP používáme robotický system Da Vinci Xi (Intuitive Surgical Inc.). Pacient je v supinační poloze s náklonem o 20 stupňů na pravý bok. Používáme 4 robotické porty (Obr. 1). První port (8 mm), který zavádíme supraumbilikálně, využíváme pro optiku. Po provedení diagnostické laparoskopie a vyloučení generalizace umísťujeme další 3 porty (vpravo 8 mm, vlevo 12 mm a 8 mm) v semicirkulární linii kolem portu s kamerou. Jeden asistentský port (12 mm) zavádíme v levém mezogastriu pod úroveň pupku. Samotný výkon začínáme otevřením omentální burzy po přerušení gastrokolického a gastrosplenického ligamenta, přerušujeme splenokolické ligamentum a mobilizujeme lienální flexuru. Preparujeme dolní okraj pankreatu. Identifikujeme v. mesenterica superior (VMS), v. mesenterica inferior (VMI) a její soutok s v. lienalis (VL) (Obr. 2B). Mobilizujeme horní okraj pankreatu a identifikujeme a. lienalis (AL) (Obr. 2A). Obcházíme pankreas v oblasti isthmu v dostatečné vzdálenosti od tumoru (Obr. 2C). Pomocí endoskopických klipů (Hem-o-loc, Teleflex) přerušujeme VL, AL a VMI. Pomocí endostapleru (SureFormTM 60 reload) přerušujeme pankreas v isthmu (Obr. 2D). Po provedení standardní lymfadenektomie mobilizujeme levou část pankreatu a slezinu od Gerotovy fascie a resekát vkládáme do endobagu. K pahýlu pankreatu zavádíme easy-flow drén a preparát odstraňujeme z Pfannestielova řezu. Po operaci pacienty monitorujeme na jednotce intenzivní péče. Od 1. pooperačního dne podáváme pacientům tekutou stravu, v dalších dnech kašovitou pankreatickou dietu. Třetí pooperační den kontrolujeme hladinu amyláz v odpadu z drénu. Drén odstraňujeme podle charakteru, množství odpadu a hladiny amyláz.
Obr. 1. Umístění portů pro robotickou distální pankreatektomii. Vytvořeno BioRender.com (Č. IV252GCUKL)
Fig. 1: Trocar placement for robotic distal pancreatectomy. Created with BioRender.com (No. IV252GCUKL)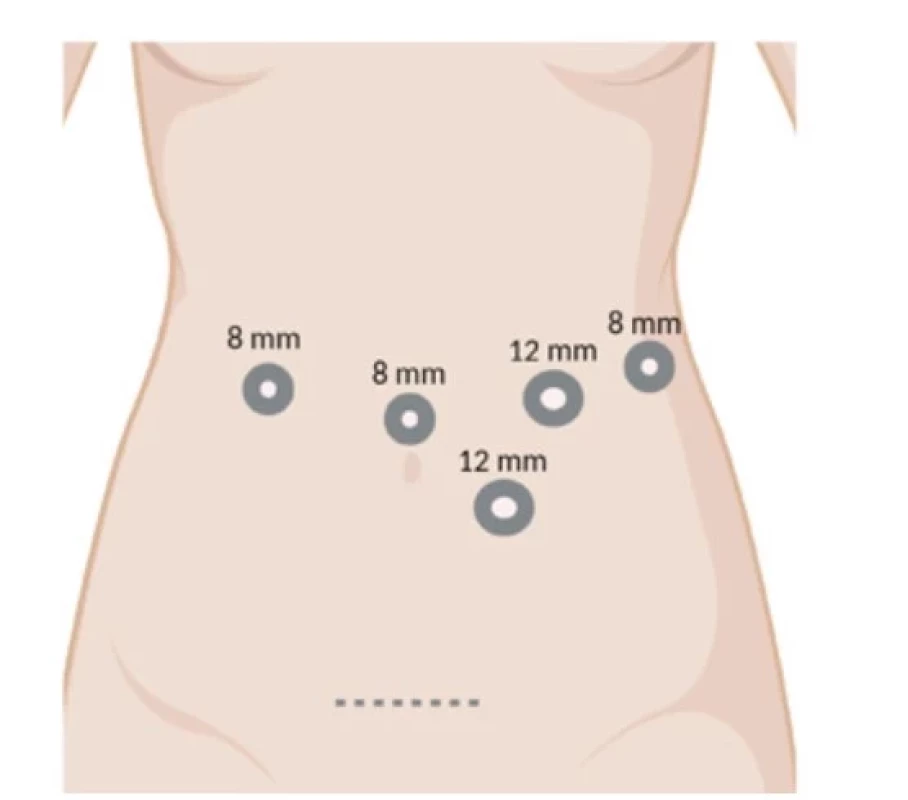
Obr. 2. Peroperační pohled
A − identifikace a. lienalis (AL), B − mobilizace pankreatu, identifikace v. lienalis (VL), přerušení v. mesenterica inferior (VMI), C – isthmus pankreatu, přerušení VL; D − přerušení pankreatu endostaplerem.
Fig. 2: Intraoperative view
A − exposure of the splenic artery (AL), B − mobilization of the pancreas, identification of the splenic vein (VL), transection of the inferior mesenteric vein (VMI), C − pancreatic isthmus, transection of the VL, D − transection of the pancreas using an endostapler.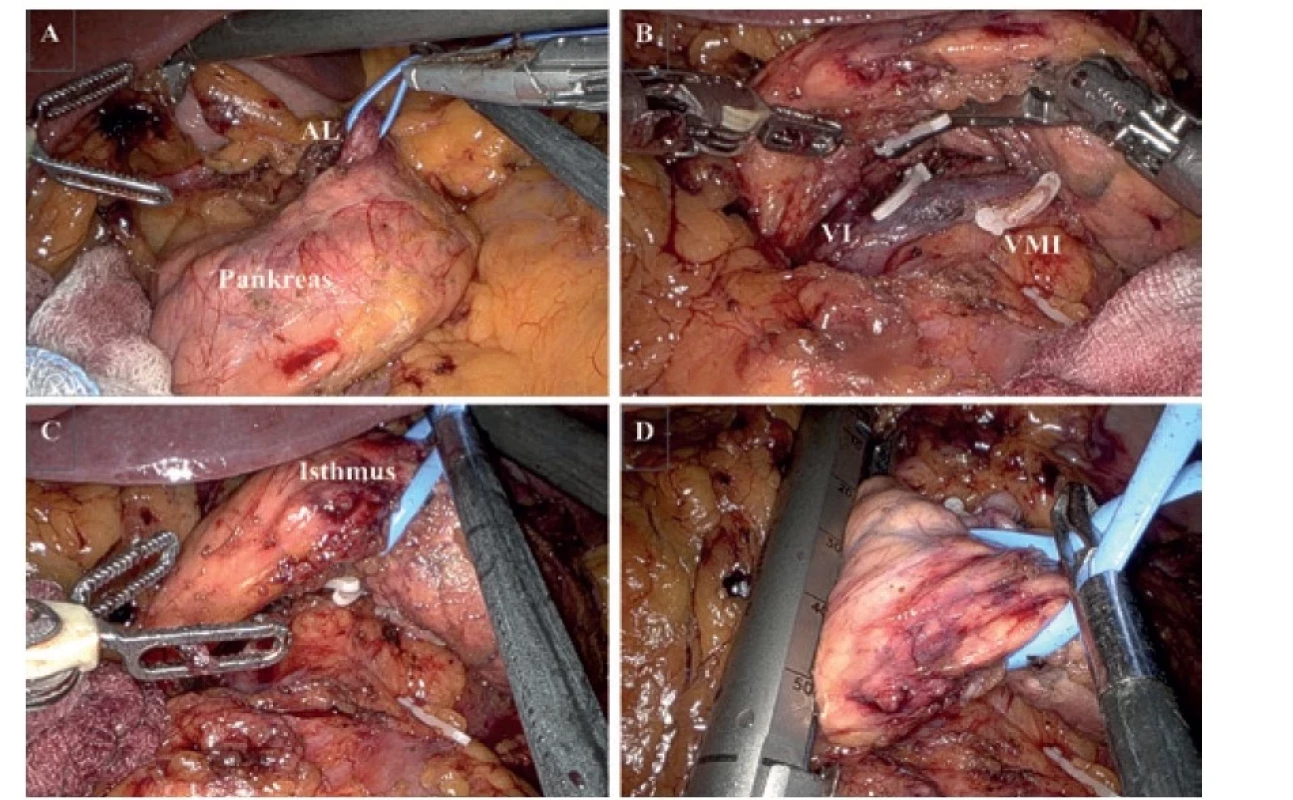
VÝSLEDKY
RDP podstoupilo 5 pacientů. Všem byla provedena splenektomie. Klinicko-patologická data, peroperační a pooperační výsledky znázorňuje Tab. 1. Všichni pacienti byli ženského pohlaví s průměrným věkem 51,2 roku. Průměrný operační čas (definován dobou od kožní incize po suturu kůže, včetně dokování systému) byl 238 minut, rozmezí 150−310 minut. Průměrné krevní ztráty byly 118 ml, rozmezí 20−300 ml. U dvou pacientů byly delší doba operace (300 a 310 minut) a vyšší krevní ztráty (200 a 300 ml) zapříčiněné velikostí tumoru (99×81×24 mm) a parenchymovým krvácením po přerušení isthmu pankreatu endostaplerem. Konverzi nevyžadovala žádná z operací.
Tab. 1. Klinicko-patologické charakteristiky, peroperační a pooperační výsledky
Tab. 1: Clinical-pathological characteristics, intraoperative and postoperative outcomes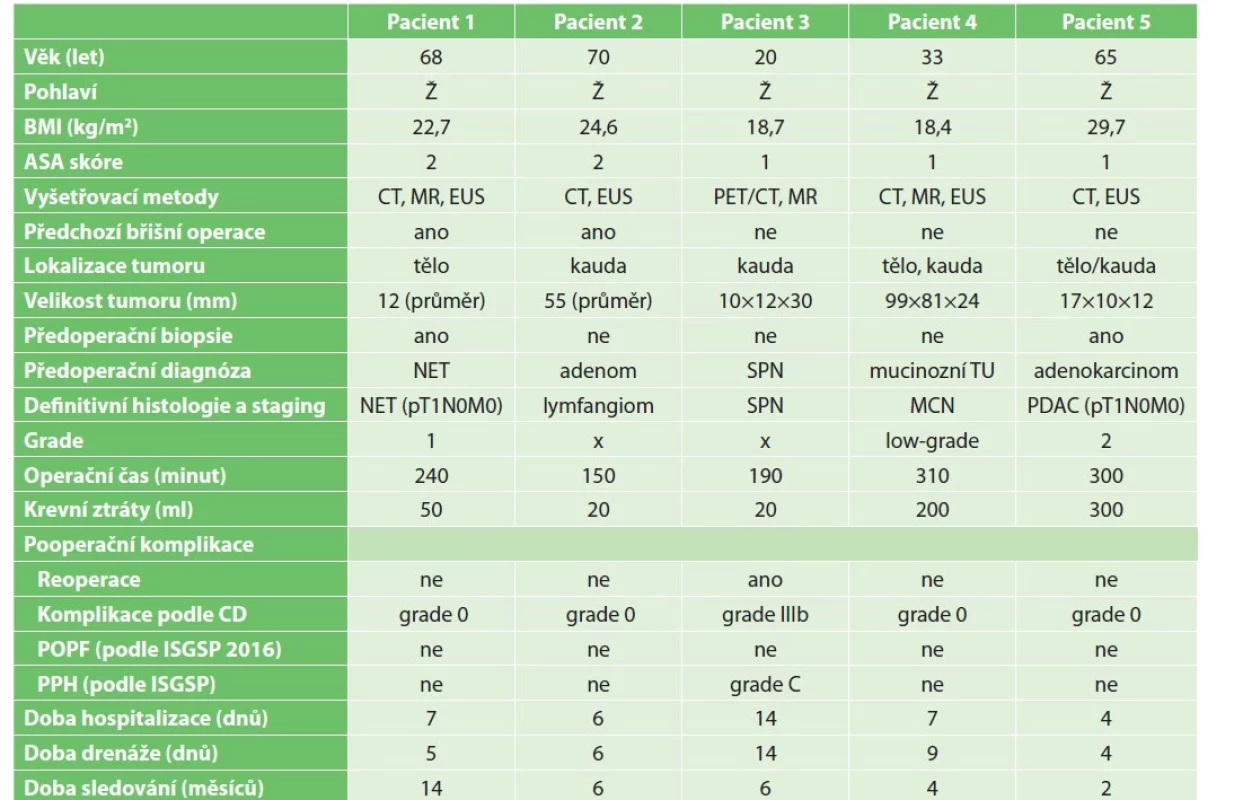
Vysvětlivky: ASA − The American Society of Anesthesiologists, CT − výpočetní tomografie, MR − magnetická rezonance, EUS − endosonografické vyšetření, NET − neuroendokrinní tumor, SPN − solitární pseudopapilární neoplázie, MCN – mucinózní cystická neoplazie, PDAC − duktální adenokarcinom pankreatu, TU − tumor, CD − Clavien-Dindo klasifikace, POPF − pooperační pankreatická píštěl, ISGPS − mezinárodní skupina pro pankreatickou chirurgii (The International Study Group of Pancreatic Surgery), PPH − postpankreatektomická hemoragie.
Legend: ASA − The American Society of Anesthesiologists; CT – computed tomography; MR − magnetic resonance imaging; EUS – endosonography; NET − neuroendocrine tumor; SPN – solitary pseudopapillary neoplasm; MCN – mucinous cystic neoplasm; PDAC − pancreatic ductal adenocarcinoma; TU – tumor; CD − Clavien-Dindo classification; POPF – postoperative pancreatic fistula; ISGPS − The International Study Group of Pancreatic Surgery; PPH – postpancreatectomy hemorrhage.Jednoho pacienta jsme reoperovali 2. pooperační den pro náhle vzniklé krvácení ze staplerové linie na pahýlu pankreatu, které jsme ošetřili přešitím. Celková krevní ztráta byla 700 ml s nutnosti substituce krevními deriváty (4 jednotky krevní transfuze), bez potřeby katecholaminové podpory. Další průběh byl nekomplikovaný. Drén jsme extrahovali průměrně 7. pooperační den. Doba hospitalizace byla 4−14 dnů, medián 7. U jednoho pacienta byla delší doba hospitalizace 14 dnů v důsledku provedení expozičního testu k ověření alergie na penicilinové antibiotikum na doporučení imunologa. Žádný z pacientů nevyžadoval rehospitalizaci. Všichni jsou sledování v pravidelných intervalech. Celková doba sledováni je 2−14 měsíců bez prokázání recidivy onemocnění.
DISKUZE
V poslední dekádě je minimálně invazivní chirurgie stále využívanější operační technikou. Mezi hlavní výhody patří menší pooperační bolestivost, kratší doba rekonvalescence a menší výskyt ranných komplikací [2,9]. MIDP je často první adaptovanou minimálně invazivní operací pankreatu z důvodu absence rekonstrukční fáze. Podle guidelines z roku 2020 je MIDP doporučovanou metodou pro léčbu benigních a low-grade maligních tumorů těla a kaudy pankreatu [3]. Dvě randomizované kontrolované studie LEOPARD a LAPOP hodnotily výsledky MIDP a otevřené distální pankreatektomie (ODP). Obě studie prokázaly menší krevní ztráty a nižší výskyt opožděného vyprazdňování žaludku, kratší dobu do funkčního zotavení a kratší dobu hospitalizace u MIDP. Míra komplikací byla stejná jako u ODP [10,11]. Výsledky potvrdila i další metaanalýza a systematická review [12]. Většina studií byla zaměřena na krátkodobé výsledky. V literatuře chybějí prospektivní komparativní studie zaměřené na dlouhodobé onkologické výsledky MIDP u karcinomu pankreatu. V roce 2019 van Hilst a kol. publikovali první mezinárodní retrospektivní kohortovou studii (n = 1212) porovnávající výsledky pacientů, kteří podstoupili MIDP nebo ODP pro duktální adenokarcinom pankreatu (Pancreatic ductal adenocarcinoma – PDAC). Obě skupiny pacientů byly párované pomocí propensity skóre. Ve srovnání s ODP byla u MIDP vyšší míra radikální resekce (67 % vs. 58 %, p=0,02), nižší medián počtu odebraných lymfatických uzlin (14 vs. 22 uzlin, p<0,001) a nižší míra perineurální a lymfovaskulární nádorové invaze (p<0,001). Medián přežití byl podobný (MIDP vs. ODP, 28 vs. 31 měsíců) [13]. Navzdory párování výsledky ukázaly možné zkreslení způsobené alokací léčby při selekci méně agresivních tumorů u MIDP [13,14]. Podle guidelines je MIDP bezpečnou, proveditelnou a z onkologického hlediska srovnatelnou technikou s ODP v rukou zkušeného chirurga, ale přesnější informace může přinést probíhající mezinárodní randomizovaná studie DIPLOMA, která posuzuje non-inferioritu mikroskopické resekční radikality MIDP proti ODP u pacientů s PDAC [3,15].
Studií, které srovnávaly laparoskopický a robotický přístup, je menší počet. Lof a kol. v mezinárodní multicentrické studii v roce 2021 zaznamenali u RDP menší počet konverzí na otevřený výkon (6,7 % vs. 15,2 %, p<0,001), vyšší počet slezinu zachovávajících operací (81,4 % vs. 62,9 %, p=0,001) a nižší počet rehospitalizací [16]. Proti laparoskopii u RDP byla delší doba hospitalizace (medián 8,5 vs. 7 dnů, p<0,001) a delší doba operace (medián 285 vs. 240 minut, p<0,001). Morbidita a 90denní mortalita nebyly signifikantně rozdílné [16] a výsledky autorů byly v souladu s předchozími studiemi [15,17]. Podle Raoofa a kol. byly onkologické výsledky v incidenci radikálního chirurgického okraje, přežívání, mortalitě a počtu odebraných lymfatických uzlin srovnatelné u obou minimálně invazivních metod [18].
Zlepšení perioperačních výsledků bylo zaznamenáno v souvislosti s tzv. learning curve. Holandská studie LAELAPS prokázala snížení počtu konverzí, krevních ztrát, délky hospitalizace a zvýšení počtu provedených resekcí pro PDAC v souvislosti s tréninkovým programem pro MIDP [19]. Názor na doporučovaný počet RDP pro dosažení optimálních výsledků není jednotný, ve studiích je udáván počet 7 až 40 výkonů [21, 20].
I přes technologické pokroky a tréninkový program nebyl výskyt POPF signifikantně odlišný [19]. V současnosti neexistují jasná doporučení pro techniku uzávěru pahýlu pankreatu a POPF zůstavá nejzávažnější komplikací distální pankreatektomie. Tři randomizované studie porovnávaly výskyt POPF grade B/C u MIDP a ODP. Studie LAPOP neprokázala signifikantní rozdíl (31 % vs. 38 %, p=0,581) [10], ve studii LEOPARD byl vyšší výskyt POPF u MIDP (39 % vs. 23 %, p=0,07) [11] a post hoc analýza holandské randomizované studie prokázala signifikantně vyšší výskyt POPF u MIDP (28,7 % vs. 16, 9 %, p=0,029), i když s menším klinickým dopadem na pacienta [22].
Na III. chirurgické klinice FN v Motole byl Program robotické chirurgie zahájen v červnu 2018 a celkem bylo provedeno více než 300 operací. RDP provádějí dva chirurgové, kteří mají zkušenosti i s LDP a 3letou zkušenost s robotickou chirurgií. Oba chirurgové absolvovali komplexní školení podporované firmou Intuitive Surgical a získali certifikát pro práci s robotickým systémem DaVinci Xi (Intuitive Surgical Inc.).
Podle našich prvotních zkušeností pacienti z RDP profitovali. Příznivé výsledky ukazují, že robotický přístup je vhodný pro léčbu tumorů těla a kaudy pankreatu. Oproti konvenční laparoskopii umožňuje lepší vizualizaci operačního pole, preciznější a bezpečnější preparaci pankreatu a velkých cév. Vlastní výsledky u prvních 5 pacientů jsou ovlivněny selekční bias při implementaci nového operačního přístupu do praxe a exaktní zhodnocení výsledků bude vyžadovat větší soubor pacientů. Nevýhodou robotického systému je vysoká cena a dostupnost. Četnost výkonu za dané časové období ukazuje na vytíženost robotického systému na našem pracovišti jinými chirurgickými programy, což zatím limituje rozšíření na rutinní přístup. Pokládáme za důležité vést prospektivní databázi pacientů, sdílet data a participovat v mezinárodním registru pro minimálně invazivní resekce pankreatu.
ZÁVĚR
Závěrem lze konstatovat, že mnohé publikované studie prezentují výsledky z individuálních center a mají retrospektivní design. Další randomizované studie jsou nutné pro zhodnocení pooperačních výsledků a onkologické bezpečnosti robotické distální pankreatektomie, ale díky všem výhodám má velký potenciál do budoucna.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Silvia Jaroščiaková
III. chirurgická klinika, 1. LF UK a FN v Motole, Praha
V Úvalu 84
150 06 Praha
e-mail: silvia.jarosciakova@fnmotol.cz
Zdroje
1. Finney JM. VII. Resection of the pancreas: Report of a case. Ann Surg. 1910;51(6): 818−829. doi:10.1097/00000658-191006000-00007.
2. Maeso S, Reza M, Mayol JA, et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis. Ann Surg. 2010;252(2):254−262. doi:10.1097/SLA.0b013e3181e6239e.
3. Asbun HJ, Moekotte AL, Vissers FL, et al. The Miami international evidence-based guidelines on minimally invasive pancreas resection. Ann Surg. 2020;271(1):1−14. doi:10.1097/SLA.0000000000003590.
4. Melvin WS, Needleman BJ, Krause KR, et al. Robotic resection of pancreatic neuroendocrine tumor. J Laparoendosc Adv Surg Tech A. 2003 Feb;13(1):33−36. doi: 10.1089/109264203321235449.
5. Doyle DJ, Hendrix JM, Garmon EH. American Society of Anesthesiologists classification. In: StatPearls. Treasure Island (FL). StatPearls Publishing 2022.
6. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004 Aug;240(2):205−213. doi: 10.1097/01.sla.0000133083.54934. ae.
7. Bassi C, Marchegiani G, Dervenis C, et al. International Study Group on Pancreatic Surgery (ISGPS). The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after. Surgery 2017 Mar;161(3):584−591. doi: 10.1016/j. surg.2016.11.014.
8. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH): an International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery 2007 Jul;142(1):20−25. doi: 10.1016/j. surg.2007.02.001.
9. Stauffer JA, Coppola A, Mody K, et al. Laparoscopic versus open distal pancreatectomy for pancreatic adenocarcinoma. World J Surg. 2016;40(6):1477−1484. doi:10.1007/s00268-016-3412-6.
10. de Rooij T, van Hilst J, van Santvoort H, et al. Dutch Pancreatic Cancer Group. Minimally invasive versus open distal pancreatectomy (LEOPARD): A multicenter patient-blinded randomized controlled trial. Ann Surg. 2019 Jan;269(1):2−9. doi: 10.1097/SLA.0000000000002979.
11. Björnsson B, Larsson AL, Hjalmarsson C, et al. Comparison of the duration of hospital stay after laparoscopic or open distal pancreatectomy: randomized controlled trial. Br J Surg. 2020 Sep;107(10):1281−1288. doi:10.1002/bjs.11554.
12. Mehrabi A, Hafezi M, Arvin J, et al. A systematic review and meta-analysis of laparoscopic versus open distal pancreatectomy for benign and malignant lesions of the pancreas: it’s time to randomize. Surgery 2015;157(1):45−55. doi:10.1016/j. surg.2014.06.081.
13. van Hilst J, de Rooij T, Klompmaker S, et al. Minimally invasive versus open distal pancreatectomy for ductal adenocarcinoma (DIPLOMA): A Pan-European propensity score matched study. Ann Surg. 2019;269(1):10−17. doi:10.1097/ SLA.0000000000002561.
14. van Hilst J, Korrel M, de Rooij T, et al. Oncologic outcomes of minimally invasive versus open distal pancreatectomy for pancreatic ductal adenocarcinoma: A systematic review and meta-analysis. Eur J Surg Oncol. 2019;45(5):719−727. doi:10.1016/j.ejso.2018.12.003.
15. van Hilst J, Korrel M, Lof S, et al. Minimally invasive versus open distal pancreatectomy for pancreatic ductal adenocarcinoma (DIPLOMA): study protocol for a randomized controlled trial. Trials 2021;22(1):608. doi:10.1186/s13063-021 - 05506-z.
16. Lof S, van der Heijde N, Abuawwad M, et al. Robotic versus laparoscopic distal pancreatectomy: multicentre analysis. Br J Surg. 2021;108(2):188−195. doi:10.1093/ bjs/znaa039.
17. Hong S, Song KB, Madkhali AA, et al. Robotic versus laparoscopic distal pancreatectomy for left-sided pancreatic tumors: a single surgeon’s experience of 228 consecutive cases. Surg Endosc. 2020;34(6):2465−2473. doi:10.1007/ s00464-019-07047-8.
18. Raoof M, Nota CLMA, Melstrom LG, et al. Oncologic outcomes after robot - assisted versus laparoscopic distal pancreatectomy: Analysis of the National Cancer Database. J Surg Oncol. 2018;118(4):651−656. doi:10.1002/jso. 25170.
19. de Rooij T, van Hilst J, Boerma D, et al. Impact of a nationwide training program in minimally invasive distal pancreatectomy (LAELAPS). Ann Surg. 2016;264(5):754−762. doi:10.1097/SLA. 0000000000001888.
20. Shakir M, Boone BA, Polanco PM, et al. The learning curve for robotic distal pancreatectomy: an analysis of outcomes of the first 100 consecutive cases at a high-volume pancreatic centre. HPB (Oxford) 2015;17(7):580−586. doi:10.1111/hpb.12412.
21. Benizri EI, Germain A, Ayav A, et al. Short-term perioperative outcomes after robot-assisted and laparoscopic distal pancreatectomy. J Robot Surg. 2014;8(2):125−132. doi:10.1007/s11701 - 013-0438-8.
22. van der Heijde N, Lof S, Busch OR, et al. Incidence and impact of postoperative pancreatic fistula after minimally invasive and open distal pancreatectomy. Surgery 2022;171(6):1658−1664. doi:10.1016/j. surg.2021.11.009.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2023 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Kam kráčí hepatopankreatobiliární chirurgie v České republice?
- Příprava experimentálního modelu defektní anastomózy tlustého střeva prasete − souhrnné sdělení
- Pravostranná pankreatoduodenektomie u nemocných s neobvyklým průběhem hepatické tepny
- Rizikové faktory predikující nález fraktury na CT krční páteře u kraniocervikálních traumat – retrospektivní studie
- Robotická distální pankreatektomie − první zkušenosti
- Pneumoperitoneum, pneumomediastinum a podkožní emfyzém po ošetření angiektázií kolon argon plazma koagulací
- Naše skúsenosti so solitárnymi fibróznymi tumormi v oblasti hrudníka
- Volvulus 8 let po bariatrické operaci
- Pankreatologický klub a profesor Dítě
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Robotická distální pankreatektomie − první zkušenosti
- Pneumoperitoneum, pneumomediastinum a podkožní emfyzém po ošetření angiektázií kolon argon plazma koagulací
- Naše skúsenosti so solitárnymi fibróznymi tumormi v oblasti hrudníka
- Pravostranná pankreatoduodenektomie u nemocných s neobvyklým průběhem hepatické tepny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



