-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Naše skúsenosti so solitárnymi fibróznymi tumormi v oblasti hrudníka
Our experience with solitary fibrous tumors in the chest area
The article reports on three patients with a solitary fibrous tumor of the chest. The first patient had a tumor in the area of the dome of the right pleural cavity which was radically resected together with the chest wall around its origin. In the second case, the tumor was attached by a vascular pedicle to the lower lobe of the right lung. This tumor was resected atypically, via thoracotomy, along with a margin of healthy lung tissue at the base of its pedicle. The last patient had a tumor of the lower lobe of the right lung, surrounding the lower pulmonary vein, which did not have a clear margin of healthy lung tissue. This finding required right lower lobectomy via posterolateral thoracotomy.
The presented cases describe rare types of tumors in the chest area which at the time of detection often reach large dimensions, necessitating extensive surgical procedures. Due to the biological nature of these tumors, long-term patient follow-up is advisable.
Keywords:
Thoracotomy – solitary fibrous tumor – lung lobectomy
Autoři: J. Muri 1; B. Durcová 2; M. Ledecký 3; V. Kamarád 1; M. Makovická 1; A. Vrbenská 4
Působiště autorů: Ústav histologie a embryologie Lékařská fakulta Ostravská univerzita, Ostrava 1; 2. Oddelenie pneumológie a ftizeológie NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry 2; Oddelenie srdcovej a cievnej chirurgie KCE AGEL Košice 3; Oddelenie patológie NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry 4
Vyšlo v časopise: Rozhl. Chir., 2023, roč. 102, č. 3, s. 134-138.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2023.102.3.134–138Souhrn
Článok referuje troch pacientov so solitárnym fibróznym tumorom hrudníka. Prvý pacient mal nádor v oblasti kupoly pravej pohrudnicovej dutiny, ktorý bol radikálne resekovaný spolu s hrudníkovou stenou v okolí jeho origa. V druhom prípade išlo o nádor fixovaný cievnou stopkou k dolnému laloku pravých pľúc. Tento nádor bol resekovaný atypicky, cestou torakotómie, spolu s bezpečnostným lemom zdravého pľúcneho tkaniva v oblasti bázy jeho stopky. Posledný pacient mal nádor dolného laloka pravých pľúc, ktorý obklopoval dolnú pľúcnu žilu a miestami nemal zreteľnú hranicu so zdravým pľúcnym tkanivom. Nález si vyžiadal dolnú lobektómiu pravých pľúc cestou posterolaterálnej torakotómie.
Kazuistiky poukazujú na zriedkavý typ nádorov v oblasti hrudníka, ktoré v čase zistenia dosahujú často veľké rozmery, nútiace k rozsiahlym operačným výkonom. Vzhľadom k biologickej povahe týchto nádorov, je vhodné daných pacientov dlhodobo dispenzarizovať.
Klíčová slova:
solitárny fibrózny tumor – torakotómia – lobektómia pľúc
ÚVOD
Solitárne fibrózne tumory sú zriedkavé mäkkotkanivové nádory mezenchýmového pôvodu. Prvý krát boli opísané ako nádorové masy v oblasti pleurálnych priestorov [1]. Vo všeobecnosti sa môžu vyskytovať v akejkoľvek anatomickej lokalizácii, najčastejšie však v hrudníkovej dutine. Extratorakálne boli diagnostikované v bruchu, v oblasti krku aj hlavy [2]. V bruchu prevažujú extraperitoneálne nádory lokalizované v malej panve [3,4]. Intrakraniálne môžu solitárne fibrózne tumory vyrastať z mozgových obalov, najčastejšie z dura mater tvoriacej tentorium cerebelli. Nie sú známe žiadne environmentálne rizikové faktory ich vzniku a sú približne rovnako časté u mužov aj žien. Zväčša sa diagnostikujú u pacientov v 5. až 6. decéniu života [5]. Až v 80 % sú zistené náhodne a často veľkostne pokročilé. Symptomatické lézie sa prejavujú nešpecificky, predovšetkým útlakom okolitých štruktúr [4,5,6]. Zriedkavejšie boli pozorované paraneoplastické syndrómy, ako napríklad hypertrofická osteoartropatia či hypoglykémia, spôsobená nádorovou produkciou inzulínu podobného rastového faktora IGF-II [7]. Paraneoplastické syndrómy postihujú menej ako 10 % postihnutých, no môžu byť znakom agresívnejšieho správania nádoru a jeho horšej prognózy. Vzhľadom k neurčitosti biologického správania solitárnych fibróznych tumorov, klasifikácia WHO z roku 2020 vypúšťa pojmy «typický» a «malígny» a odporúča komplexnejšie modely stratifikácie rizika recidívy a metastatického šírenia. Štúdie vychádzajúce z dlhodobejšieho sledovania uceleného súboru pacientov dokumentujú riziko metastatického šírenia až v 45 %. Cieľom článku je upozorniť na solitárne fibrózne tumory a zdokumentovať niekoľko prípadov z praxe.
KAZUISTIKA 1
52-ročný pacient bez závažnejšej osobnej anamnézy, vyšetrovaný pre dušnosť, ktorej kardiálna príčina bola vylúčená. RTG a CT hrudníka ukázali objemnú expanzívnu léziu hrudníka v apikálnej časti pravej pleurálnej dutiny, naliehajúcu na hrudníkovú stenu a mediastinum. Tumor mal najväčší priemer 18,5 cm.
Transparietálnou biopsiou navigovanou ultrazvukom bol zistený solitárny fibrózny tumor neistého biologického správania. Cestou posterolaterálnej torakotómie vpravo bol nádor v decembri 2018 resekovaný aj s časťou hrudníkovej steny v mieste jeho fixácie. Išlo o R0 resekciu s odstránením bloku hrudníkovej steny 6×8 cm, ktorý tvorili časti 3. a 4. rebra spolu s mäkkými tkanivami príľahlých medzirebrových priestorov. Histologicky boli overené negatívne resekčné okraje. Nádor v celom svojom rozsahu len naliehal na horný lalok pravých pľúc. Defekt hrudníkovej steny bol prekrytý svalmi a nevyžiadal si aloplastiku. Histologickým vyšetrením resekátu bol diagnostikovaný solitárny fibrózny tumor CD34+, STAT6+, s malígnymi črtami ako fokálna pleomorfia, hypercelularita a nekrózy. Nádor vykazoval hemangiopericytoma-like vaskulárny rast. Proliferačná aktivita Ki-67 bola od 20–50% a mitotická aktivita 3/10HPF. Pooperačný priebeh bol nekomplikovaný. Pacient bol prepustený v dobrom klinickom stave po piatich dňoch hospitalizácie v Centre hrudníkovej chirurgie NÚTPCHaHCH vo Vyšných Hágoch do ambulantnej starostlivosti s odporúčaním dispenzarizácie u onkológa. Dispenzarizácia trvala bez známok recidívy ochorenia do septembra 2020, kedy pacient podľahol komplikáciam pri ochorení covid 19.
Obr. 1. Solitárny fibrózny tumor v apikálnej časti pravej pleurálnej dutiny (CT pracovisko NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry)
Fig. 1: Solitary fibrous tumor in the apical part of the right pleural cavity (CT department of NUTPCHaHCH Vysne Hagy, Vysoke Tatry)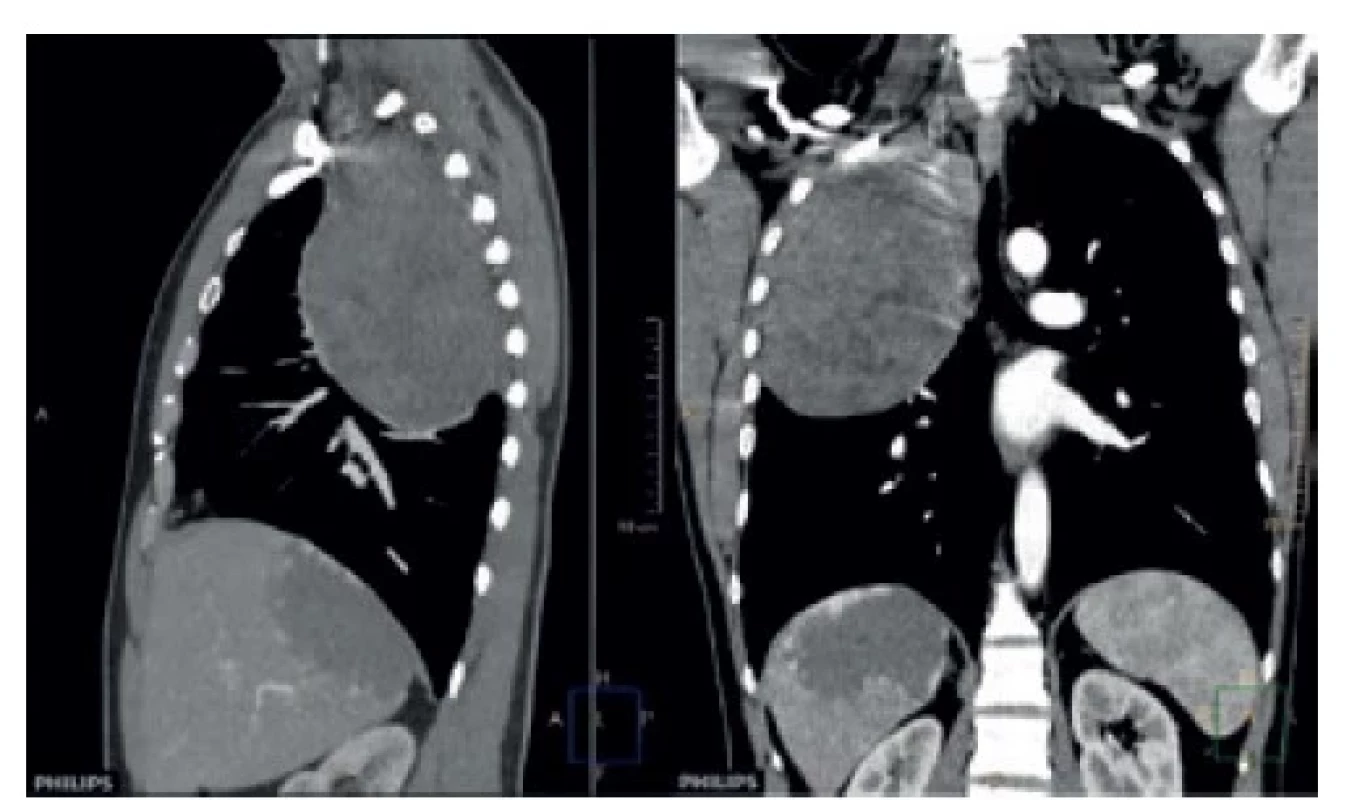
KAZUISTIKA 2
38-ročná pacientka bez závažnejšieho predchorobia, s náhodným RTG nálezom tumoru hrudníka vpravo. CT hrudníka odhalilo nádor v pravej pleurálnej dutine, široko naliehajúci na bránicu a stenu hrudníka v laterálnej a zadnej časti kostodiafragmatického recesu, s najväčším priemerom cca 18 cm.
Transparietálnou punkciou tumoru pod ultrazvukovou kontrolou bol histologicky verifikovaný solitárny fibrózny tumor CD34+, STAT6+. Nádor bol resekovaný cestou laterálnej, svaly šetriacej torakotómie vpravo v novembri 2019. Peroperačne ho k dolnému laloku pľúc fixovala široká vaskularizovaná stopka, ktorej báza bola atypicky resekovaná s lemom zdravého pľúcneho tkaniva. Na všetky ostatné štruktúry nádor len naliehal, ale nebol k nim žiadnym spôsobom fixovaný. Resekcia nálezu bola radikálna, R0. Na základe definitívnej histológie a vzhľadom k veľkosti nádoru patológ upozornil na jeho potenciálne malígny charakter a odporúčal zváženie PET CT a ďalšiu dispenzarizáciu pacientky u onkológa. Nepriaznivými prognostickými faktormi spojenými so zvýšeným rizikom možného malígneho správania boli v danom prípade predovšetkým prítomnosť hypercelulárnych ložísk a veľkosť nádoru. Proliferačná aktivita Ki-67 bola do 2 %. Pacientka mala nekomplikovaný pooperačný priebeh a bola prepustená s uvedeným odporúčaním v siedmy pooperačný deň. Je dispenzarizovaná ambulantne. So zreteľom na možné pooperačné zmeny bolo prvé kontrolné CT vyšetrenie hrudníka a brucha po 3 mesiacoch od operácie. Vyšetrenie bolo s negatívnym nálezom a pacientka je do súčasnosti bez známok recidívy ochorenia.
Obr. 2. Solitárny fibrózny tumor v bazálnej časti pravej pleurálnej dutiny (CT pracovisko NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry)
Fig. 2: Solitary fibrous tumor in the basal part of the right pleural cavity (CT department NUTPCHaHCH Vysne Hagy, Vysoké Tatry)
KAZUISTIKA 3
69-ročný pacient, 5 rokov liečený na glaukóm, bol vyšetrovaný u reumatológa pre bolesti kĺbov dolných končatín a opuchy prstov rúk. RTG a CT hrudníka ukázali nehomogénnu tumoróznu masu dolného laloka pravých pľúc, široko nasadajúcu na stenu hrudníka v zadnej časti kostodiafragmatického recesu, s najväčším priemerom 12 cm. Súvislosť jeho symptómov s nádorom nebola vylúčená.
Transparietálna punkcia nádoru neprispela k diagnóze. Následne bola v máji 2018 indikovaná chirurgická cesta biopsie a adekvátny resekčný výkon. Lokálny nález si, pre nepresné ohraničenie tumoru voči pľúcnemu parechýmu a zavzatie dolnej pľúcnej žily do jeho masy, vynútil dolnú lobektómiu pravých pľúc cestou posterolaterálnej torakotómie. Histologicky bol diagnostikovaný solitárny fibrózny tumor, CD34+, STAT6+. Aj v tomto prípade išlo o R0 resekciu. Negatívnym prognostickým faktorom bola hlavne veľkosť tumoru. Významnejšie známky fokálnej pleomorfie, hypercelulárne areály, nekrózy či mitotické figúry však neboli markantné. Ki-67 varíroval od 0 do 10 %. Pacient mal nekomplikovaný pooperačný priebeh a bol prepustený do ambulantnej starostlivosti po desiatich dňoch hospitalizácie. Rovnako, ako v predchádzajúcich dvoch prípadoch, bola odporúčaná dispenzarizácia v spádovej onkologickej ambulancii. V súčasnosti je pacient bez známok recidívy ochorenia už takmer 5 rokov.
Obr. 3. Solitárny fibrózny tumor dolného laloka pravých pľúc v bazálnej časti pleurálnej dutiny (CT pracovisko NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry)
Fig. 3: Solitary fibrous tumor of the lower lobe of the right lung in the basal part of the pleural cavity (CT department NUTPCHaHCH Vysne Hagy, Vysoke Tatry)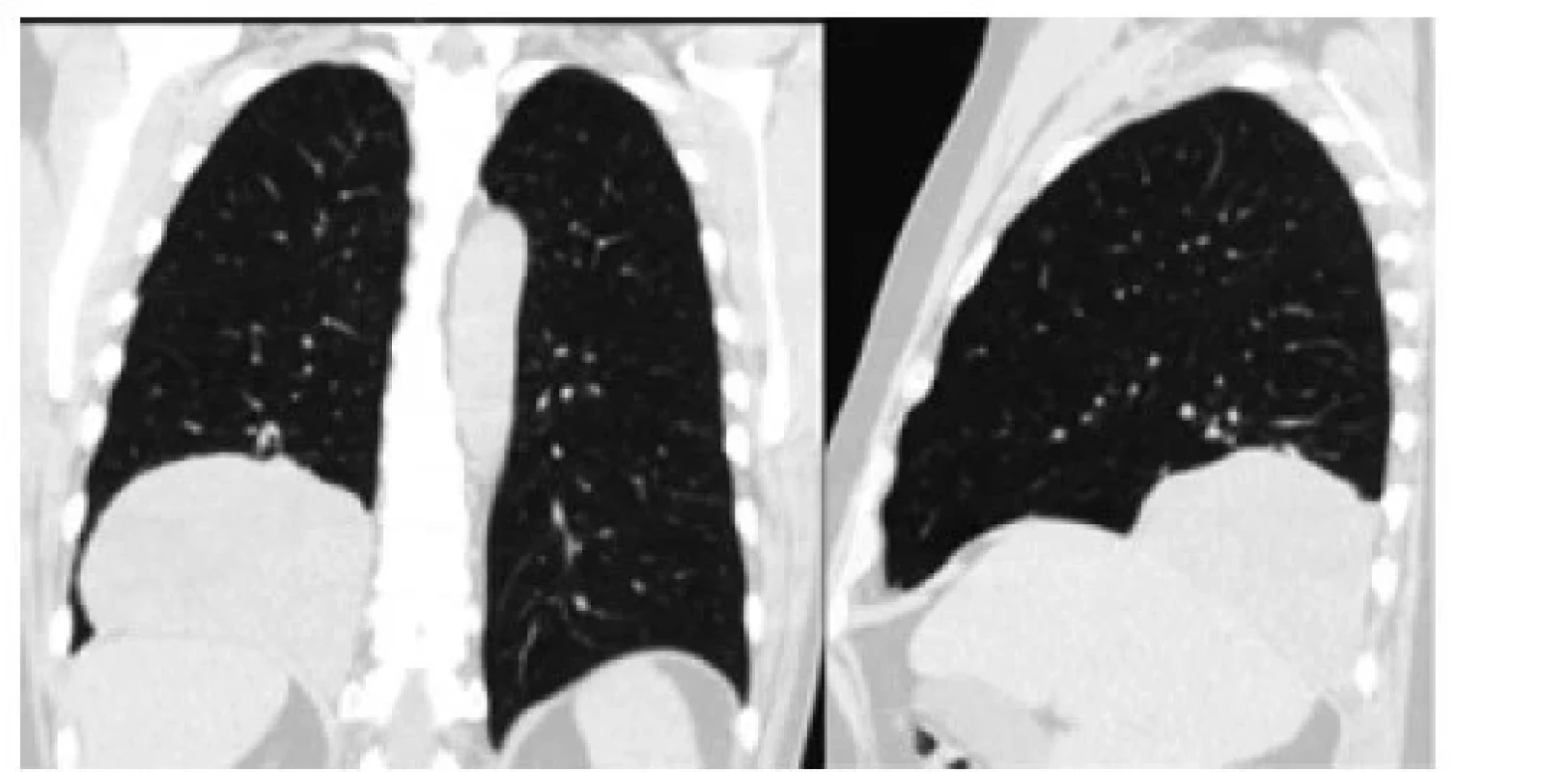
Obr. 4. Histologické nálezy tumorov jednotlivých pacientov
Fig. 4: Histological findings of tumors of individual patients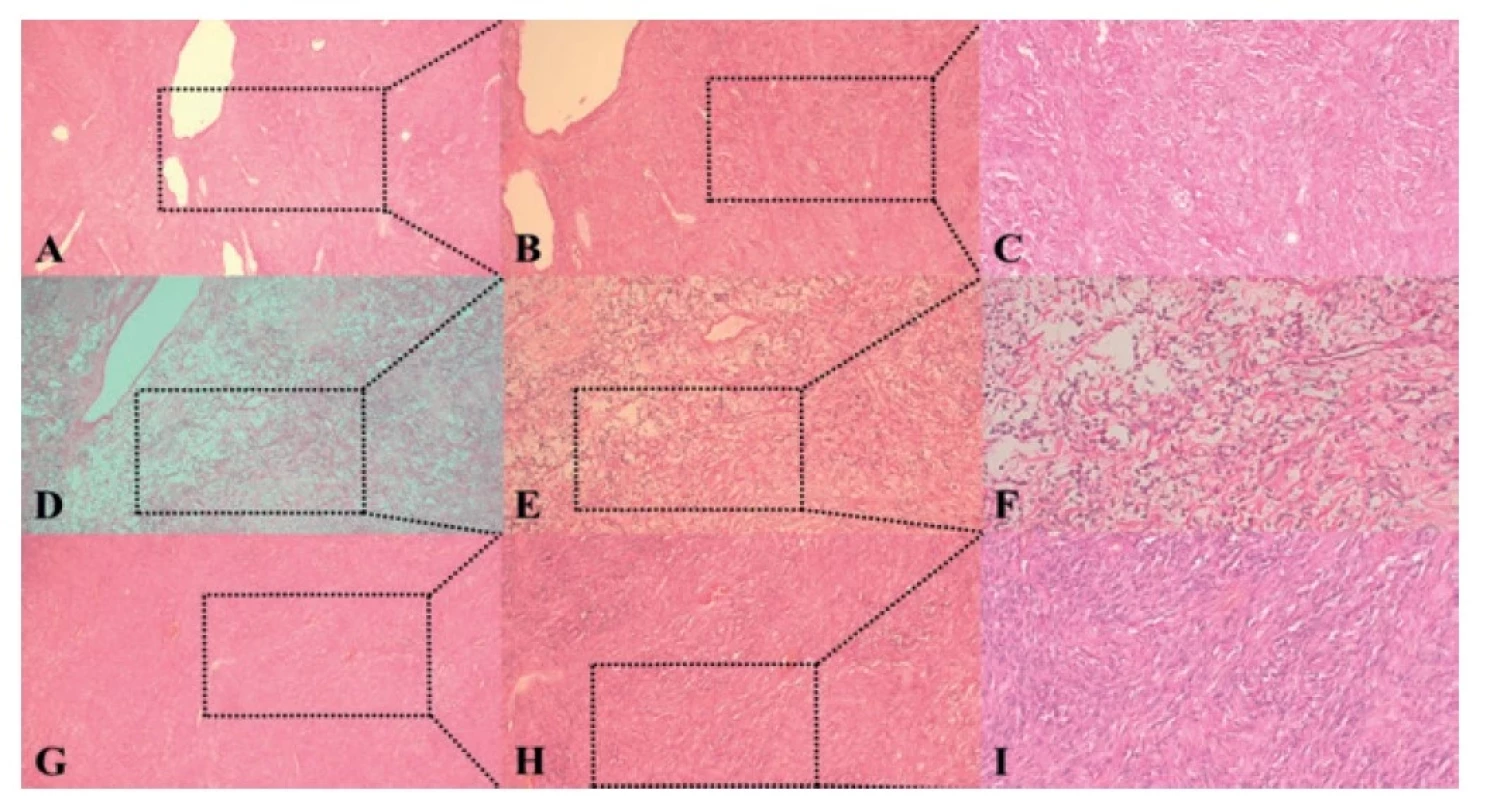
Legenda k histologickým nálezom/ Legend to histological findings:
Kazuistika 1: A (50×), B (100×), C (200×) solitárny fibrózny tumor, ktorý je usporiadaný fascikulárne s početnými pozdĺžne i priečne zachytenými navzájom sa preplietajúcimi septami tumoróznych buniek aj s produkciou vláknitej zložky a zrelého kolagénu.
Case 1: A (50×), B (100×), C (200×) solitary fibrous tumor, which is arranged fascicularly with numerous longitudinally and transversely intertwining septa of tumorous cells, also with the production of a fibrous component and mature collagen.
Kazuistika 2: D (50×), E (100×), F (200×) solitárny fibrózny tumor zložený zo striedajúcich sa úsekov fascikulárne a vaskulárne usporiadaných vretenovitých mierne atypických nádorových buniek aj s priľahlým zrejúcim väzivom.
Case 2: D (5), E (100×), F (200×) solitary fibrous tumor composed of alternating sections of fascicularly and vascularly arranged spindle-shaped slightly atypical tumor cells with adjacent maturing fibrous tissue.
Kazuistika 3: G (50×), H (100×), I (200×) solitárny fibrózny tumor s obrazom fascikulárne usporiadaných navzájom sa preplietajúcich v jednotlivých úsekoch pozdĺžne, inde priečne zachytených sept s obsahom vretenovitých až špirálovitých tumoróznych buniek aj s produkciou vláknitej zložky a zrelého kolagénu.
Case 3: G (50×), H (100×), I (200×) solitary fibrous tumor with an image of fascicularly arranged intertwining in individual sections longitudinally, elsewhere transversely captured septa containing spindle-shaped to spiral tumorous cells and with the production of a fibrous component and mature collagen.DISKUSIA
Solitárne fibrózne tumory sú zriedkavé nádory s neistým biologickým správaním. Obmedzený počet štúdií s dlhodobým sledovaním pacientov viedol k optimistickejším predstavám o ich dignite. Riziko recidív a metastatického šírenia sa v dlhodobom časovom horizonte ukazuje vyššie ako sa v minulosti predpokladalo. Jedna zo štúdií dokumentuje 5-ročné prežívanie bez recidívy u 74 % pacientov, ale pri 10-ročnom sledovaní sa riziko recidívy zvyšuje na 45 %. Po 20 rokoch ostáva bez recidívy okolo 18 % pacientov [8]. Z toho vyplýva niekoľko skutočností o agresivite solitárnych fibróznych tumorov a ich tumorigenéze. Časť nádorov, aj po radikálnom chirurgickom výkone, recidivuje. Tento proces by mohol byť vo vzťahu s ich histologickým vzhľadom. Horšie diferencované typy s jadrovým pleomorfizmom, mitotickými figúrami, nekrózami a vysokou hustotou vaskularizácie, prejavujú agresívnejšie správanie a vyššie riziko recidívy. Rekurencia ochorenia môže vychádzať jednak zo zostatkového okrajového a kontaktného tkaniva, ktoré sa po čase opäť zvrhne, ale môže mať aj genetický základ, podmienený mutáciami v génoch. Solitárne fibrózne tumory sú makroskopicky zväčša dobre ohraničené laločnaté nádory s hladkým povrchom. Mikroskopicky sú tvorené populáciami vretenovitých buniek so striedaním hypercelulárnych a hypocelulárnych areálov, ktoré sú bohaté na kolagén. Podobný obraz sme popísali aj v našich troch prípadoch. Pre solitárne fibrózne tumory sa ukázal veľmi charakteristický dôkaz fúzneho génu NAB2-STAT6, resp. jeho génového produktu [9,10]. V prípadoch STAT6 pozitívnych mäkkotkanivových nádorov je potrebné, v rámci diferenciálnej diagnostiky, odlíšiť sarkómy, ktoré môžu mať v prehľadnom farbení podobný vzhľad [11]. Expresia STAT6 v solitárnych fibróznych tumoroch klesá v prípade malígnych nádorových fenotypov. Jedným z najkonzistentnejších markerov solitárnych fibróznych tumorov ostáva CD34 [12]. Expresia CD34 je silná a difúzna vo viac ako 80 % týchto nádorov. V prípade najagresívnejších fenotypov sa však môže aj vytratiť. Na druhej strane je potrebné konštatovať, že CD34 nie je pre solitárne fibrózne tumory špecifickým markerom, pretože sa exprimuje aj pri iných fibroblastických a myofibroblastických tumoroch benígnej aj malígnej povahy.
Predoperačné bioptické vyšetrenie môže prispieť k správnej diagnóze. Jeho opodstatnenosť stúpa s rastúcimi diferenciálne diagnostickými pochybnosťami. Význam má napríklad pri odlíšení od tumoriformných lézií, ktorých liečba a priori nie je chirurgická a tiež pri už vstupne inoperabilných léziach. Vždy treba zvážiť dostupnosť danej konkrétnej lézie k biopsii, dosiahnuteľnosť výťažnej bioptickej vzorky a vplyv získaného výsledku biopsie na ďalší postup. U dobre komponovaných pacientov s dostatočnými funkčnými rezervami, bez významnejších diagnostických pochybností, u ktorých sa uvažuje o chirurgickom odstránení lézie, je vhodné neoddiaľovať toto definitívne riešenie, ktoré naviac povedie k získaniu dostatočného materiálu na širokú histopatologickú diferenciálnu diagnostiku. Aj v nami referovanej skupine pacientov viedla predoperačná transparietálna biopsia tumoru dva krát k správnej diagnóze, ale raz k správnej diagnóze neprispela. Vzhľadom k charakteru nálezu a predpokladu jeho definitívneho chirurgického riešenia však rebiopsia zvažovaná nebola. U lokalizovaných a oligometastatických solitárnych fibróznych tumorov a funkčne dobre komponovaných pacientov, je liečba chirurgická. Cieľom je vždy radikálna resekcia s histologicky verifikovanými negatívnymi resekčnými okrajmi [13,14]. V prípade vaskularizovaných lézií prichádza do úvahy embolizácia nádorového cievneho riečiska s cieľom redukcie krvných strát počas operácie. Miniinvazívna operačná technika má uplatnenie predovšetkým pri menších a vhodne lokalizovaných nádoroch [15]. Neexistujú unifikované odporúčania pre sledovanie pacientov s týmto ochorením. Ako vhodnú schému dispenzarizácie možno považovať klinickú kontrolu pacienta každé 3 mesiace a CT/MRI kontrolu každých 6 mesiacov v prvých dvoch rokoch po radikálnej resekcii. V ďalšom období prichádza do úvahy v treťom roku klinická a CT kontrola po 6 mesiacoch a v štvrtom až šiestom roku klinická a CT/MRI kontrola raz za 12 mesiacov. Pri agresívnejších histologických typoch možno aplikovať prísnejšiu schému dispenzarizácie s klinickou kontrolou každé 3 mesiace a CT/MRI kontrolou každých 6 mesiacov počas prvých troch rokov, s postupným znižovaním frekvencie kontrol v štvrtom a piatom roku na raz za pol roka a od šiesteho roka raz ročne. Rádioterapia môže byť neoadjuvantná aj adjuvantná a predstavuje potenciálny prínos hlavne pri neistote resekčných okrajov a v prípadoch hraničnej resekability. Neoadjuvantná rádioterapia môže viesť k zmenšeniu lézie, čo umožní šetrnejší operačný výkon. V rámci systémovej liečby prichádzajú do úvahy inhibítory angiogenézy. Sľubnú účinnosť má bevacizumab, pazopanib aj sunitinib [16]. Vo vhodných prípadoch môže byť benefitom kombinácia týchto liekov s chemoterapiou. U dediferencovaných fenotypov vystupuje do popredia chemoterapia. Údajov o imunoterapii solitárnych fibróznych tumorov je málo, ale jedna kazuistika dokumentuje pozoruhodné výsledky u pacienta liečeného inhibítorom kontrolného bodu anti-PD-1 [17].
ZÁVER
Článok referuje troch pacientov so solitárnym fibróznym tumorom v oblasti hrudníka, ktorých liečba si vyžiadala extenzívny chirurgický výkon. Poukazujeme na úskalia spojené s ojedinelým výskytom týchto nádorov, ako aj na absenciu unifikovaných odporúčaní pre onkologickú dispenzarizáciu pacientov s týmto ochorením. Práve dlhodobejšie sledovanie pacientov odhaľuje skutočnú biologickú povahu solitárnych fibróznych tumorov, umožňuje lepšie identifikovať prediktory prognózy v histologickom obraze a lepšie stratifikovať riziko recidívy a metastatického šírenia. Tieto poznatky umožnia efektívnejšie riadiť dispenzarizáciu a liečbu. Článok poukazuje na skutočnosť, že radikálna chirurgická liečba lokalizovaných solitárnych fibróznych tumorov je u funkčne dobre komponovaných jedincov jediná potenciálne kuratívna modalita a v prípade oligometastatických slitárnych fibróznych tumorov je u vhodne selektovaných pacientov modalitou prinášajúcou najlepšiu prognózu. Ostatné liečebné modality majú v súčasnosti podporný a paliatívny charakter.
Za odborné pripomienky a usmernenie autori ďakujú MUDr. Jurajovi Beniakovi, primárovi oddelenia klinickej onkológie, Poprad.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Jozef Muri
Ružová 15
054 01 Levoča
e-mail: muri.jozef@gmail.com
Zdroje
1. Klemperer P, Coleman BR. Primary neoplasms of the pleura. A report of five cases. Am J Ind Med. 1992;22(1):1−31. doi: 10.1002/ajim.4700220103.
2. Davanzo B, Emerson RE, Lisy M, et al. Solitary fibrous tumor. Transl Gastroenterol Hepatol. 2018;3 : 94. doi: 10.21037/ tgh.2018.11.02.
3. Gold JS, Antonescu CR, Hajdu C, et al. Clinicopathologic correlates of solitary fibrous tumors. Cancer 2002; 94(4):1057−1068.
4. Toporcer T, Belák J, Böör A, et al. Obrovský solitárny fibrózny tumor pleury – kazuistika. Rozhl Chir. 2009;88(3):97−102.
5. Demicco EG, Park MS, Araujo DM, et al. Solitary fibrous tumor: a clinicopathological study of 110 cases and proposed risk assessment model. Mod Pathol. 2012;25(9):1298−1306. doi: 10.1038/ modpathol.2012.83. Epub 2012 May 11.
6. Martin-Broto J, Mondaza-Hernandez JL, Moura DS, et al. A comprehensive review on solitary fibrous tumor: New insights for new horizons. Cancers (Basel) 2021;13(12):2913. doi: 10.3390/cancers13122913. PMID: 34200924; PMCID: PMC8230482.
7. Pavlíková P, Sochorová L, Snížková O, et al. Solitary fibrous tumor of the pleura as a rare cause of severe hypoglycemia: Doege-Potter syndrome. Rozhl Chir. 2020;99(2):95−98. doi: 10.33699/ PIS.2020.99.2.95-98.
8. Yokoi T, Tsuzuki T, Yatabe Y, et al. Solitary fibrous tumour: significance of p53 and CD34 immunoreactivity in its malignant transformation. Histopathology 1998 May;32(5):423−432. doi: 10.1046/j.1365 - 2559.1998.00412.x.
9. Robinson DR, Wu YM, Kalyana-Sundaram S, et al. Identification of recurrent NAB2 - STAT6 gene fusions in solitary fibrous tumor by integrative sequencing. Nat Genet. 2013 Feb;45(2):180−185. doi: 10.1038/ ng.2509. Epub 2013 Jan 13.
10. Krsková L, Odintsov I, Fabián O, et al. Determination of biological behavior of solitary fibrous tumors: correlation of expression of Ki-67, TPX2 and TERT mRNA subunit level and NAB2-STAT6 fusion compared to morphological aspects of SFTs. Neoplasma 2022 Jan;69(1):28−35. doi: 10.4149/neo_2021_210511N642. Epub 2021 Nov 25.
11. Thway K, Flora R, Shah C, et al. Diagnostic utility of p16, CDK4, and MDM2 as an immunohistochemical panel in distinguishing well-differentiated and dedifferentiated liposarcomas from other adipocytic tumors. Am J Surg Pathol. 2012 Mar;36(3):462−469. doi: 10.1097/ PAS.0b013e3182417330.
12. Geramizadeh B, Marzban M, Churg A. Role of immunohistochemistry in the diagnosis of solitary fibrous tumor, a review. Iran J Pathol. 2016;11(3):195−203.
13. Vejvodova S, Spidlen V, Mukensnabl P, et al. Solitary fibrous tumor − less common neoplasms of the pleural cavity. Ann Thorac Cardiovasc Surg. 2017 Feb 20;23(1):12−18. doi: 10.5761/atcs.oa.16 - 00108. Epub 2016 Dec 28.
14. Szkorupa M, Klein J, Bohanes T, et al. Solitární fibrózní tumor pleurální dutiny. Rozhl Chir. 2010 Dec;89(12):750−753.
15. Hatooka S, Shigematsu Y, Nakanishi M, et l. Subxiphoid approach for extracting a giant solitary fibrous tumour of the pleura. Interact Cardiovasc Thorac Surg. 2017 Nov 1;25(5):834−835. doi: 10.1093/ icvts/ivx134.
16. Ozaniak A, Hladik P, Lischke R, et al. Diagnostic challenges and treatment options in patients with solitary fibrous tumor: A single-center observational study. Front Surg. 2022;9 : 952463. Published 2022 Aug 31. doi:10.3389/ fsurg.2022.952463
17. Boothe JT, Budd GT, Smolkin MB, et al. Durable near-complete response to anti - PD-1 checkpoint immunotherapy in a refractory malignant solitary fibrous tumor of the pleura. Case Rep Oncol. 2017 Nov 13;10(3):998−1005. doi: 10.1159/000484041.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2023 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Kam kráčí hepatopankreatobiliární chirurgie v České republice?
- Příprava experimentálního modelu defektní anastomózy tlustého střeva prasete − souhrnné sdělení
- Pravostranná pankreatoduodenektomie u nemocných s neobvyklým průběhem hepatické tepny
- Rizikové faktory predikující nález fraktury na CT krční páteře u kraniocervikálních traumat – retrospektivní studie
- Robotická distální pankreatektomie − první zkušenosti
- Pneumoperitoneum, pneumomediastinum a podkožní emfyzém po ošetření angiektázií kolon argon plazma koagulací
- Naše skúsenosti so solitárnymi fibróznymi tumormi v oblasti hrudníka
- Volvulus 8 let po bariatrické operaci
- Pankreatologický klub a profesor Dítě
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Robotická distální pankreatektomie − první zkušenosti
- Pneumoperitoneum, pneumomediastinum a podkožní emfyzém po ošetření angiektázií kolon argon plazma koagulací
- Naše skúsenosti so solitárnymi fibróznymi tumormi v oblasti hrudníka
- Pravostranná pankreatoduodenektomie u nemocných s neobvyklým průběhem hepatické tepny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



